
图1 酵母单菌落图
Fig.1 Single colonies of yeasts
王晓丹 1,2,3,陈美竹 1,2,班世栋 1,3,邱树毅 1,3,*
(1.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州大学生命科学学院,贵州 贵阳 550025;3.贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
摘 要:采用可培养方法对酱香型白酒大曲中的酵母菌进行计数和筛选,通过形态学特征、生理生化实验及酵母26S rDNA分子生物学方法鉴定酵母,并分析酵母的发酵能力和风味成分。结果表明,酱香型大曲中酵母数量为10 3CFU/g;共分离鉴定6 种酵母,各酵母产香能力不同,编号FBKL2.0071扣囊复膜酵母(Saccharomycopsis fibuligera)固态发酵物具有浓郁的果香味,其中以乙酸乙酯、乙酸异戊酯、苯乙醇、乙酸苯乙酯、棕榈酸乙酯含量较高。编号FBKL2.0082多株伯顿丝孢毕赤酵母(Hyphopichia burtonii)固态发酵物呈浓郁的花香味,其中以乙酸乙酯、乙酸异戊酯和苯乙醇含量较高。这两株酵母固态发酵时都能产生大量的酯类和醇类等挥发性香味物质,还有少量醛、酮、酚和烷类等物质。分离得到的酵母产酒能力不同,总体产酒能力不高。
关键词:酱香型大曲;酵母;风味成分;产酒性能
酵母从酱香型白酒制曲、堆积和窖池发酵整个酿造过程中均能检出,是酱香型白酒酿造微生物家族的重要成员之一 [1]。高温制曲工艺是酱香型白酒生产的一大特色,曲砖发酵时间长,发酵中后期品温高达60 ℃以上。早前研究认为发酵制曲的前期酵母菌大量繁殖,但是中后期高温环境不适宜酵母生长,随着制曲发酵过程中品温逐渐升高,酵母菌生长被抑制,在发酵中后期仅能少量或不能检出酵母 [2]。虽然利用传统分离方法可从高温成品曲中检出酵母,但数量较低为10 3~10 5CFU/g,低于细菌数量2~3 个数量级,而免培养的手段能检测出酵母数量占酱香型大曲真菌数量的2.6% [3-5],因而在酱香型白酒高温成品大曲中仍然存在一定数量的酵母。从酱香型大曲中检测出的酵母包括假丝酵母属(Candida)、酵母属(Saccharomyces)、丝孢酵母属(Trichosporon)、伊萨酵母属(Issatchenkia)、地霉属(Geotrichum)、毕赤酵母属(Pichia)、接合酵母属(Zygosaccharomyces)、红酵母属(Rhodotorula)、汉逊酵母属(H a n s e n u l a)、复膜孢酵母属(Saccharomycopsis)、隐球酵母属(Cryptococcus)、德巴利酵母酵母属(Debaryomyces)、丝孢毕赤酵母属(Hyphochia)等属的酵母 [1]。
目前,对酱香型白酒中酵母功能的研究主要包括对产酒酵母和产香酵母的筛选。产酒酵母主要影响酱香型白酒的产量,而产香酵母对醇和酸具有较强的酯化能力,产生的物质对酒体风格形成具有重要作用 [6]。从酱香型白酒生产中分离到的卡斯特假丝酵母(Candida casterllani)、栗酒裂殖酵母(Schizosaccharomyces pombe)MT-14、酿酒酵母(Saccharomyces cerevisiae)、Kazachstania exigua、白地霉(Geotrichum candidum)、东方伊萨酵母(Issatchenkia orientalis)、克柔念珠菌(Candida krusei)等酵母变现出较好的发酵能力 [7-9]。而分离到的平常假丝酵母(Candida inconspicua)和库德毕赤酵母(Pichia kudriavzevii)、东方伊萨酵母(Issatchenkia orientalis)、意大利酵母(Saccharomyces italicus)、地生酵母(Saccharomyces telluris)、Saccharomyces cerevisiae、间型假丝酵母(Candida intermedia)、膜璞毕赤酵母(Pichia membranifaciens)、Candida krusei、拜耳结合酵母(Zygosaccharomyces bailii)、栗酒裂殖酵母(Schizosaccharomyce spombe)、Kazachstania exigua、白地霉(Galactomyces geotrichum)、丝孢酵母属(Trichosporon)、汉逊酵母属(Hansenula)等酵母在一定条件下表现出较好的产香能力 [3,6,8,10]。
本研究对酱香型白酒高温大曲中酵母数量、种类和功能特性进行了分析,旨在为改善酱香型白酒生产挖掘优质功能酵母资源,为酱香型大曲的科学生产和管理提供一定理论依据。
1.1 材料、试剂与培养基
酱香型白酒高温大曲为贵州茅台酒股份有限公司酿酒车间粉碎后的生产用曲,取样时间为2015年10月。
酵母DNA提取试剂盒 美国Biomiga公司;美蓝染液北京诺博莱德科技有限公司;其他试剂均为分析纯。
固态产香培养基 [3,6]:小麦全粉碎,高粱整粒-碎粒质量比3∶1,高粱-小麦质量比1∶1,称量混匀,加入95 ℃润粮5 h(水为50%~60%),121 ℃灭菌20 min,无菌条件下按200 U/g淀粉加入糖化酶,60 ℃处理2 h,装瓶115 ℃灭菌20 min备用。2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)上层培养基(培养基冷却至60 ℃左右,在无菌条件下加入0.05%的TTC染色剂溶解混匀倒平板)、麦氏培养基、缺维生素培养基、氮源基础培养基、碳源基础培养基配制参照文献[11-13]。葡萄糖发酵培养基:葡萄糖20%,酵母膏1%,(NH 4) 2SO 40.1%,KH 2PO 40.1%,MgSO 4·7H 2O 0.1%,115 ℃灭菌 20 min [14]。麦芽汁培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、玉米粉琼脂培养基和孟加拉红培养基均购于上海博微生物科技有限公司。
1.2 仪器与设备
HP6890/5975C气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪 美国安捷伦公司;GT10-1型高速离心机 北京时代北利离心机有限公司;PTC-100型聚合酶链式反应(polymerase chain reaction,PCR)仪 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 酵母计数
称取大曲样品10 g至装有玻璃珠的90 mL无菌生理盐水的三角瓶中,混匀备用。无菌条件下取上清液进行梯度稀释,取10 -1、10 -2、10 -3、10 -4、10 -5浓度梯度的菌液1 mL于孟加拉红培养基,倾注法培养计数。培养条件为30 ℃培养2 d,计数范围为30~300 个,做3 个平行 [15]。
1.3.2 酵母分离筛选
根据计数结果,按1.3.1节进行菌液稀释,取1 mL 10 -3梯度菌液于孟加拉红培养基上,用涂布棒涂布均匀,于30 ℃培养2 d,挑选不同且具有典型酵母菌落形态特征的菌株在平板上划线纯化,酵母菌落质地均匀,正面与反面以及边缘与中央部位的颜色较一致,菌落一般较大,黏稠,隆起,表面和边缘光滑或粗糙,多数为乳白色,少数为红色、黑色等 [16],再挑取单菌落进行斜面保存并编号,重复实验3 次。
1.3.3 形态特征观察
将菌株接种于PDA培养基,30 ℃倒置培养3 d,观察并记录菌落形状、颜色、透明度、边缘、质地、湿润程度等菌落特征;在载玻片上滴加一滴美兰染液,用接种环涂布少许菌体并盖上盖玻片,100 倍油镜下观察细胞形态特征;将酵母接种于玉米粉琼脂培养基和麦氏培养基上,30 ℃培养数天,分别观察假菌丝和子囊孢子 [12]。
1.3.4 生理生化实验
对酵母菌进行碳源同化实验、氮源同化实验、产类淀粉实验、脲酶实验、产类淀粉实验 [12],并参照《酵母菌的特征与鉴定手册》加以对比鉴定判断 [13]。
1.3.5 分子鉴定
酵母菌DNA提取以及26SrDNA D1/D2区域的PCR扩增 [17];引物:NL1(5’-GCATATCAATAAGCGGAGGAAA AG-3’)/NL4(5’-GGTCCGTGTTTCAAGACGG-3’),引物对合成及PCR产物测序由上海立菲生物技术有限公司完成;将测序数据在GenBank数据库中进行同源序列搜索(BLAST search,http://blast.ncb-i.nlm.nih.gov/Blast. cgi),选取同源性较高的相关菌株的26SrDNA D1/D2区域序列作为参比对象 [18-19];用MEGA5.05软件进行多序列比对,采用Kimura2模型计算进化距离,并用邻接法(Neighbor-Joining)法构建系统发育树。进化树拓扑分析为1 000 个重复取样的结果 [18]。
1.3.6 酵母产香特性分析
酵母产香初级评定:将酵母菌株接种在50 mL麦芽汁液体培养基,30 ℃、160 r/min培养48 h,对发酵液的酯、酸、酒味进行感官评价,气味强度按照数字1~10逐渐升高,数值越高接受性越强,筛选总体可接受性最好的酵母进行固态产香实验。
产香酵母固态发酵:将筛选出的酵母接入20 mL麦芽汁液体培养基,30 ℃、160 r/min扩培24 h,按4%的接种量接入固态产香培养基中,发酵5 d,筛选出产香最好的酵母利用GC-MS进行挥发性成分分析 [3]。
1.3.7 酵母产酒特性分析
酵母菌30 ℃培养48 h后在酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)上长出单菌落,倾入融化45 ℃左右的TTC上层培养基,覆盖菌落,避光保存3 h,随时观察菌落的颜色变化。由菌落呈色的深浅来判定酵母产酒精能力的大小,选取颜色较深的菌株进行产酒实验 [20]。将筛选的酵母接入20 mL麦芽汁发酵培养基中,30 ℃摇床160 r/min扩培24 h,再按4%比例接种至葡萄糖发酵培养基中,密封发酵5 d,记录CO 2总质量损失量,并测定酒精度以及残糖量。酒精度测定详见文献[12];利用直接滴定法来测定发酵液中残糖量,具体做法参见GB/T 5009.7—2008《食品中还原糖的测定》 [21]。
2.1 计数与筛菌
酱香型大曲中酵母数量为10 3CFU/g,共分离筛选出12株酵母。观察酵母的单菌落形态,形状均为圆形,记录结果如图1和表1。可看出,分离出的12 株酵母多为圆形,直径大小在5~9 mm,边缘多为完整,菌落易挑起,不透明。

图1 酵母单菌落图
Fig.1 Single colonies of yeasts
表1 茅台大曲酵母单菌落形态描述
Table1 Description of single colony morphology of yeasts in Moutai-f l avor Daqu
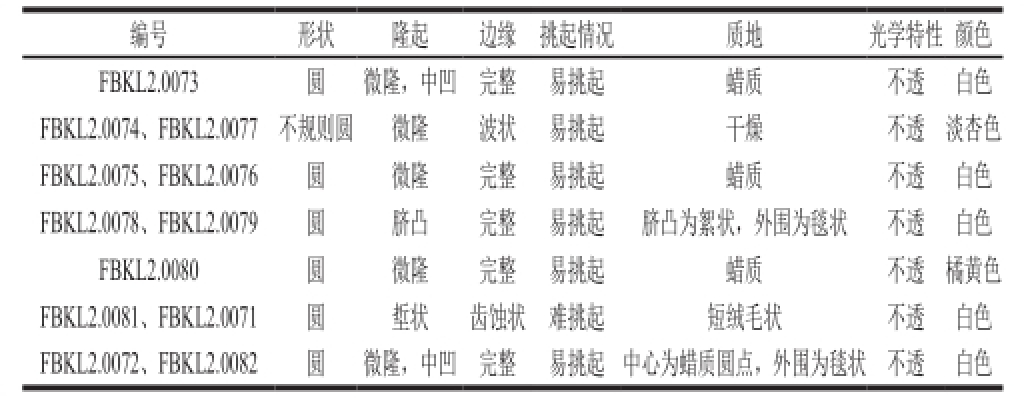
?
由表2和图2可看出,分离到的12株酵母在荧光显微镜下除FBKL2.0075、FBKL2.0076、FBKL2.0080外其余菌株均能产子囊孢子和假菌丝,均以芽殖方式繁殖,在扫描电子显微镜下细胞形态均为圆形或卵圆形。
表2 酱香型大曲中酵母显微形态描述
Table2 Description of microscopic morphological features of yeasts in Moutai-f l avor Daqu
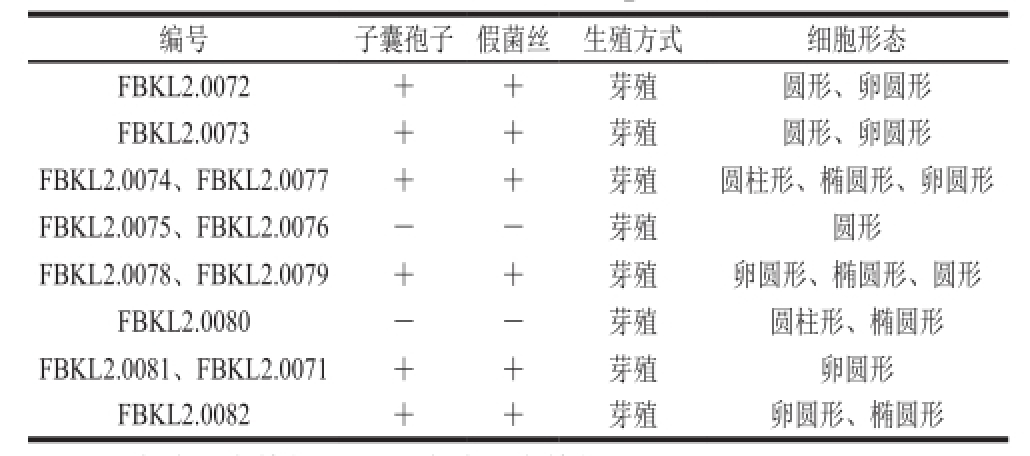
注:+.有该形态特征;-.没有该形态特征。
?
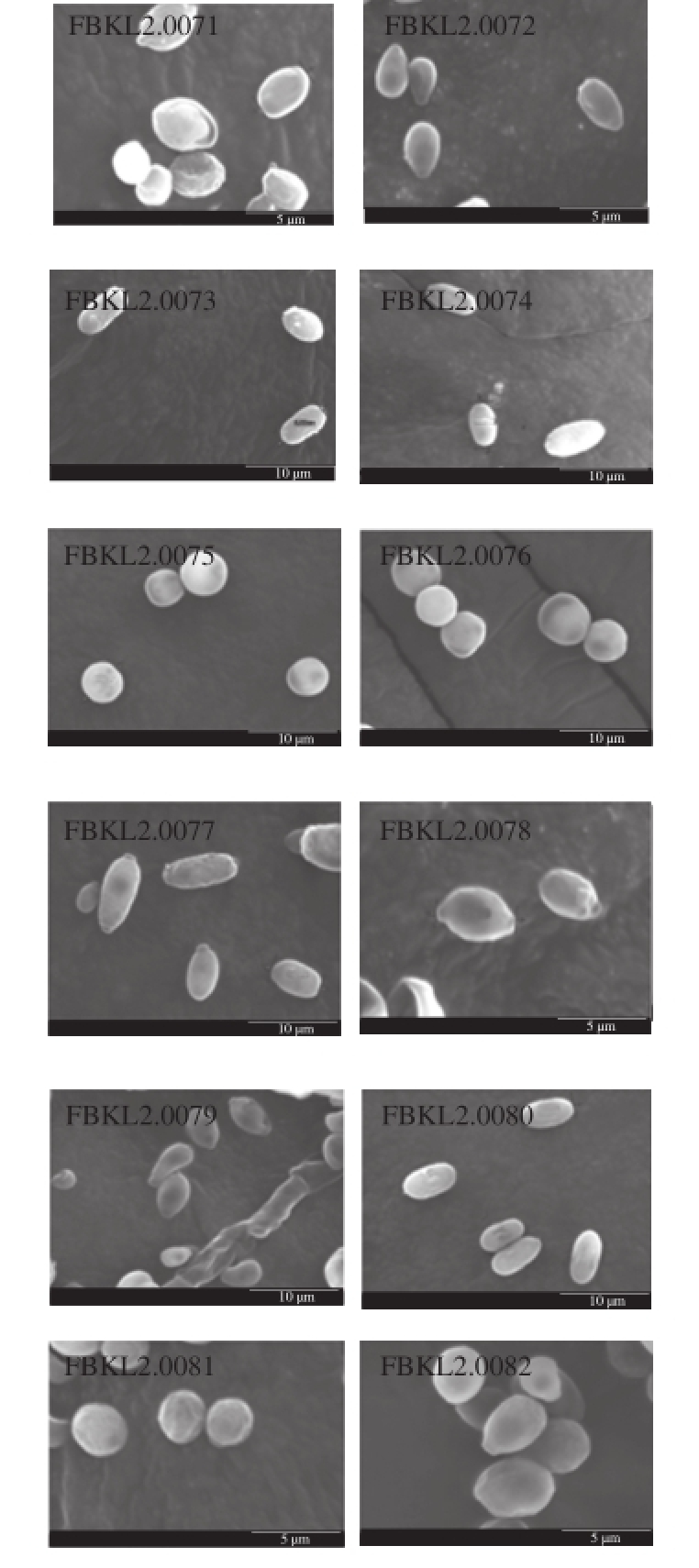
图2 酱香型大曲中酵母扫描电镜图
Fig.2 SEM observation of the morphological characteristics of yeasts in Moutai-f l avor Daqu
2.2 生理生化实验结果
表3 酱香型大曲中酵母生理生化实验
Table3 Physiological and biochemical properties of yeasts in Moutai-f l avor Daqu
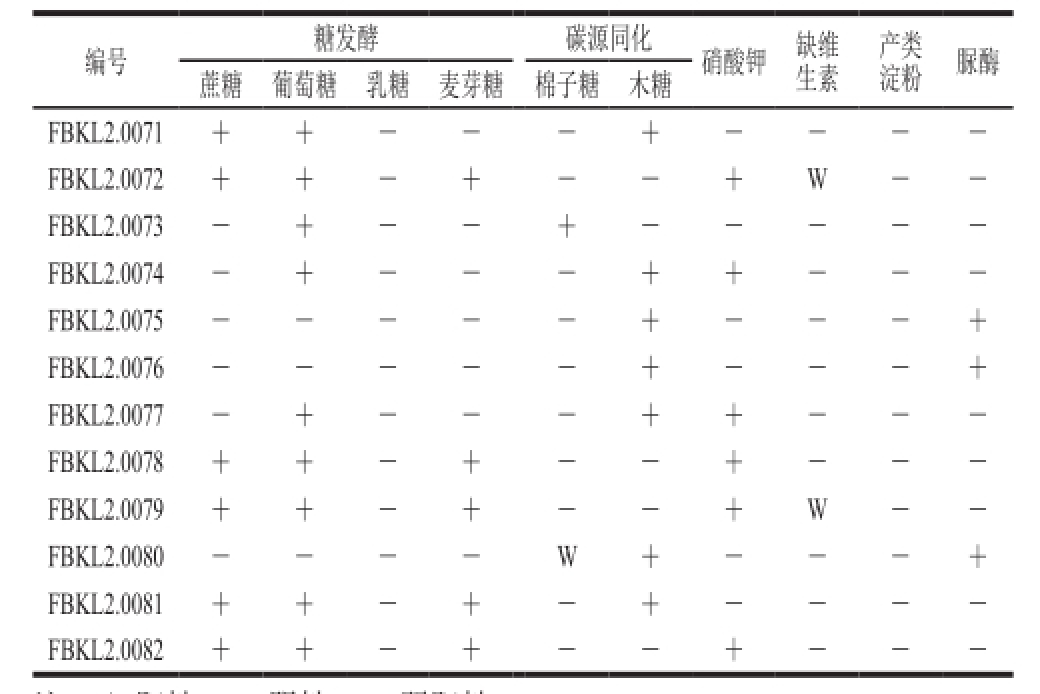
注:+.阳性,-.阴性,W.弱阳性。
?
由表3可知,FBKL2.0071和FBKL2.0081与Saccharomycopsis fibuligera相似;FBKL2.0073与长孢洛德酵母(Lodderomyces elongisporus)相似;FBKL2.0072、FBKL2.0078、FBKL2.0079和FBKL2.0082与Hyphopichia burtonii相似;FBKL2.0074和FBKL2.0077与Issatchenkia orientalis相似;FBKL2.0075和FBKL2.0076与Cryptococcus相似;FBKL2.0080与红冬孢酵母属(Rhodosporidium)相似。
2.3 26S rDNA测序和系统发育分析
将各酵母测序数据在GenBank数据库中进行同源序列搜索(BLAST search),实验菌株与已知菌株序列之间的最高同源性均不小于99%,系统发育树见图3。结合生理生化实验和细胞形态特征,对上述酵母进行鉴定。
结合以上实验,将FBKL2.0071和FBKL2.0081鉴定为Saccharomycopsis fibuligera,该菌与扣囊拟内孢霉(Endomycopsis fibuligera)同物异名 [22];FBKL2.0074和FBKL2.0077鉴定为Issatchenkia orientalis;FBKL2.0073鉴定为Lodderomyces elongisporus;FBKL2.0072、FBKL2.0078、FBKL2.0079和FBKL2.0082鉴定为Hyphopichia burtonii;FBKL2.0080鉴定为红冬孢酵母(Rhodosporidium fl uviale);FBKL2.0075和FBKL2.0076鉴定为新型隐球酵母(Cryptococcus neoformans)。
此次所分离到的酵母与以往研究相比,Saccharomycopsis fibuligera、Issatchenkia orientalis和Hyphopichia burtonii在酱香型白酒高温大曲中均有报道。在筛菌过程中,以类似Saccharomycopsis fibuligera表型出现的酵母最多;通过对多种大曲变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)图谱进行分析,表明高温大曲中依然存在多种酵母,其中Saccharomycopsis fibuligera和异常毕赤酵母(Pichia anomala)在酱香大曲中处于优势地位,与本研究结果具有相似性 [22];此外从烧酒曲、清香型小曲酒醅中曾分离鉴定出Saccharomycopsis fi buligera [23-24]。从酱香型高温大曲、酱香型白酒酒醅及酱香型白酒酿造过程均检测分离到东方伊萨酵母,其代谢产物对酱香型白酒风味物质贡影响很大 [1-17]。利用Biolog微生物自动鉴定系统对浓香型大曲分离到的一株酵母菌进行鉴定为伯顿丝孢毕赤酵母 [25]。
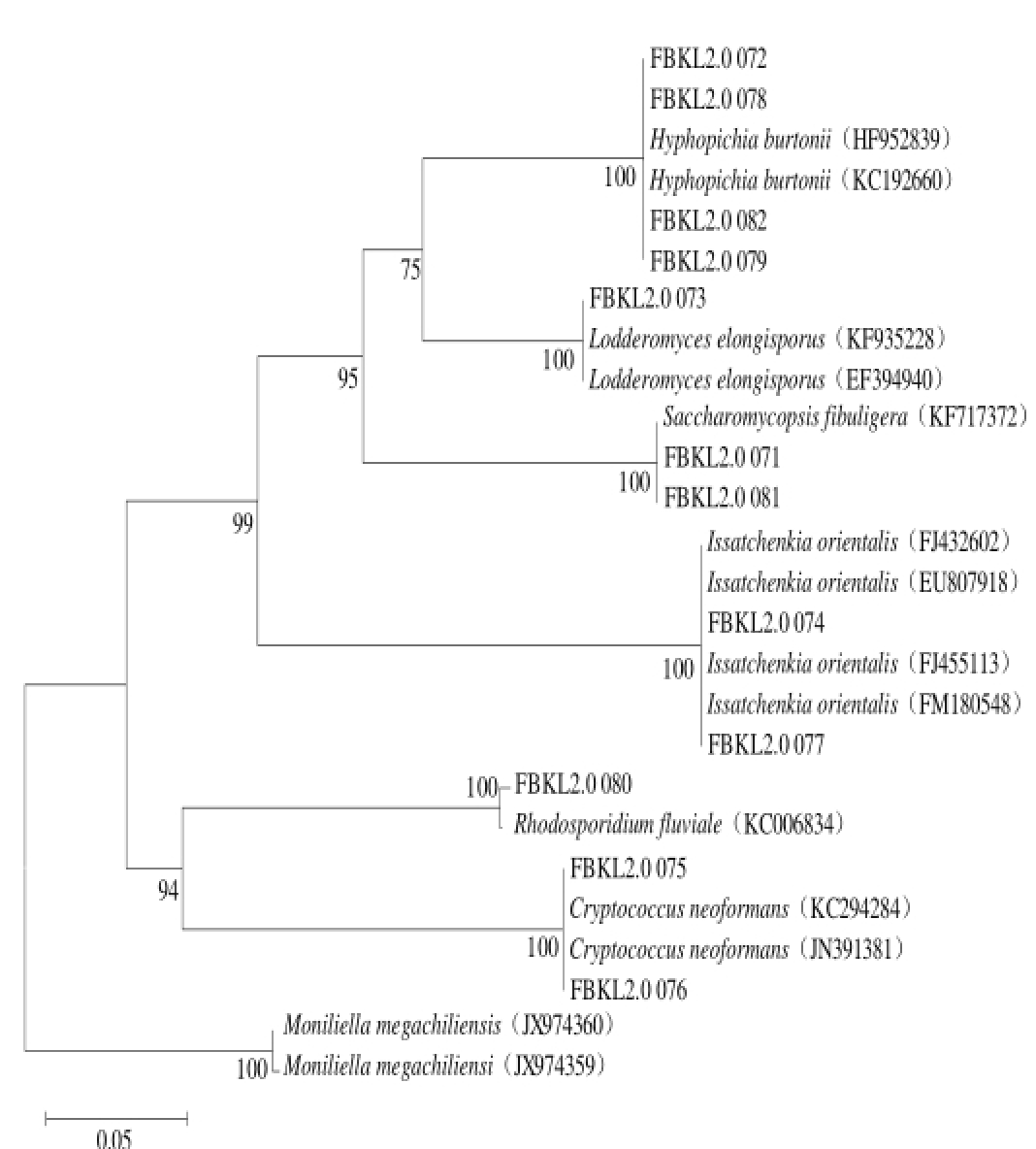
图3 酱香型大曲酵母系统发育树
Fig.3 Phylogenetic tree of yeasts in Moutai-f l avor Daqu
Lodderomyces elongisporus、Rhodosporidium fluviale、Cryptococcus neoformans属首次从酱香型白酒高温大曲中分离到 [1]。Lodderomyces elongisporus从葡萄酒发酵过程曾筛选到,对葡萄酒酿造有较好的增香作用 [26-27];该酵母是益生菌,能调节肠道微生态的变化,提高动物机体的免疫力 [28-29]。Rhodosporidium fl uviale最先是从亚热带盐渍环境中分离到 [30],后来在烟台干红葡萄酒发酵过程也有发现 [31]。Cryptococcus neoformans是临床上常见病原真菌 [32-33],是否为大曲中的酵母种类,在大曲中其作用未知,还有待进一步验证。
2.4 酵母产香特性
对分离鉴定出的酵母进行液态发酵产香实验,感官评价见表4。由表4可知,大曲中酵母的产香能力有明显差异,同种之间产香感官特征较为接近。分离出的酵母产香均良好,产香综合能力大于15的酵母的有6 株。选取这6株酵母进行固态产香实验,实验表明,FBKL2.0071固态发酵产物呈浓郁的果香味,FBKL2.0082固态发酵产物呈浓郁的花香味,两株酵母固态物香味均浓郁且柔和。
表4 酱香型大曲酵母产香感官评价
Table4 Sensory evaluation of aroma-producing yeasts in Moutai-f l avor Daqu

?
2.5 FBKL2.0071和FBKL2.0082固态发酵产物挥发性物质分析
表5 FBKL2.0071固态发酵物挥发性产物气味分析
Table5 Smell analysis of volatile compounds produced by FBKL2.0071 in solid-state fermentation

?
表6 FBKL2.0082固态发酵物挥发性产物气味分析
Table6 Smell analysis of volatile compounds produced by FBKL2.0082 in solid-state fermentation
?
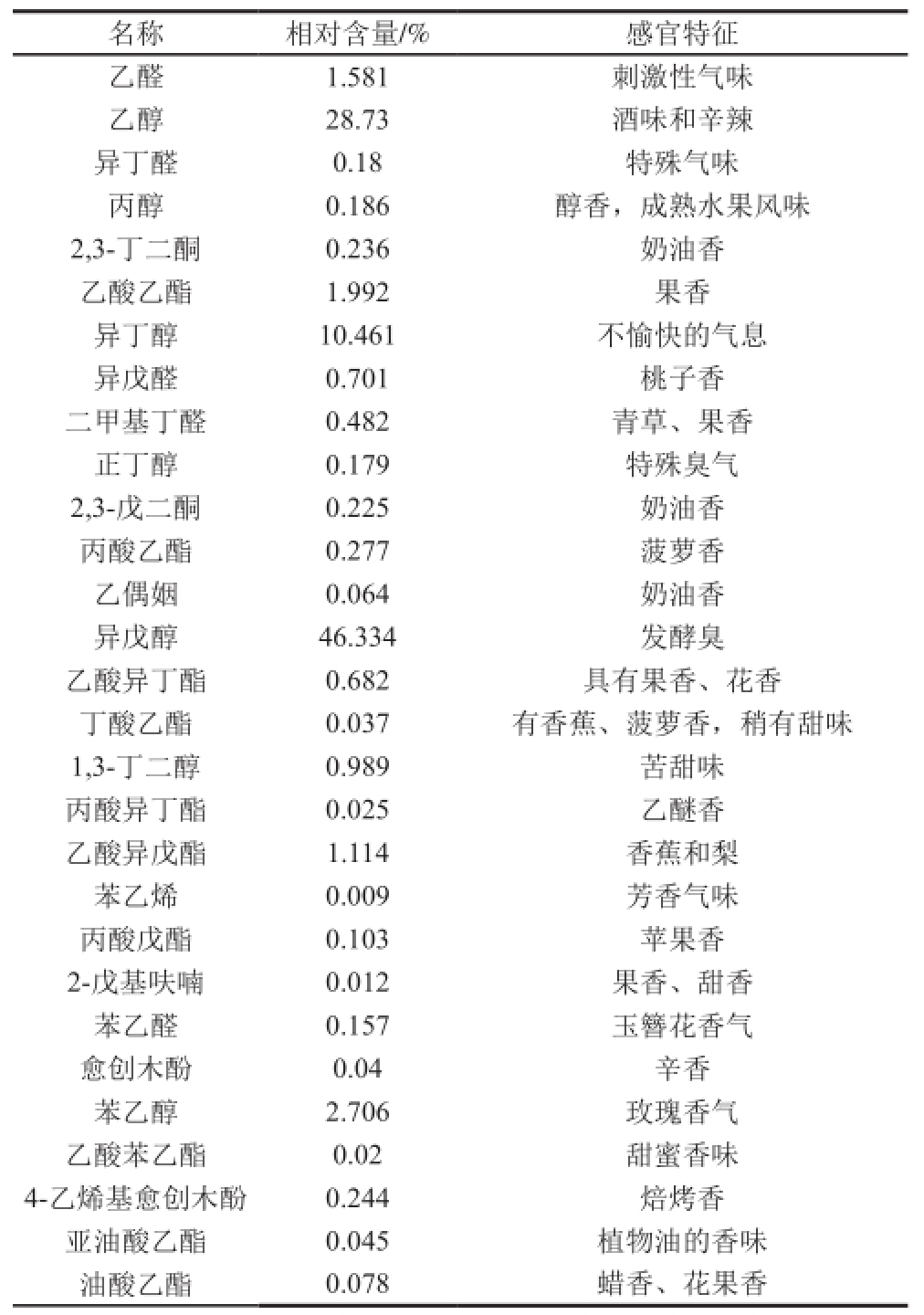
将两株酵母固态发酵物经固相微萃取后进行GC-MS分析检测,用峰面积归一化法测定了各化学成分的相对质量分数,对比分析,得到酵母固态发酵物中的挥发性组分名称及相对百分含量,见表5和表6。
结合表5和表6可以看出:1)两株酵母固态发酵时都能产生大量的挥发性香味物质,这些挥发性香味物质主要是酯类和醇类物质,还有少量醛、酮、酚和烷类等物质。2)FBKL2.0071固态发酵物挥发性香味成分中,多种产物也在不同程度上呈现出果香和花香等气味,其中以带有果香味的乙酸乙酯、有香蕉和梨的气味的乙酸异戊酯、具有玫瑰香气的苯乙醇、具有甜蜜香味的乙酸苯乙酯、具有果爵和奶油香气的棕榈酸乙酯含量较高;其固态发酵物感官评定呈现浓郁的果香味,是这些挥发性香味物质的共同作用结果。3)FBKL2.0082固态发酵物挥发性香味成分中,以有果香味的乙酸乙酯、有香蕉和梨的气味的乙酸异戊酯和具有玫瑰香气的苯乙醇含量较高,而其他产物也在不同程度上呈现出花香。
2.6 酵母发酵能力筛选
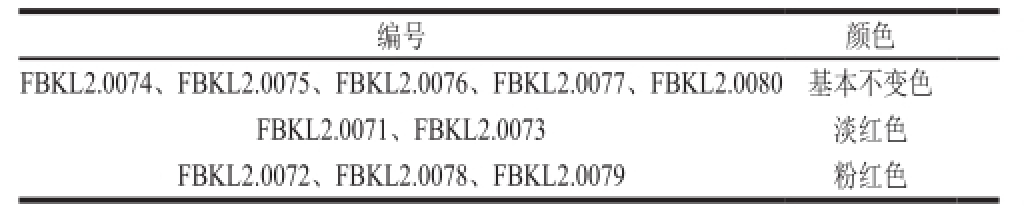
TTC是一种是脂溶性光敏复合显色指示剂,原本无色,但是在脱氢酶的作用下被还原为红色的甲臢化合物TPF(1,3,5-triphenylformazan),因而可以通过酵母菌落在TTC下的变色程度来判定酵母呼吸酶活性和产酒性能的高低 [19]。酵母TTC筛选结果如表7所示。
表7 茅台大曲酵母发酵特性初步评判
Table7 Fermentation characteristics of yeasts in Moutai-f l avor Daqu
?
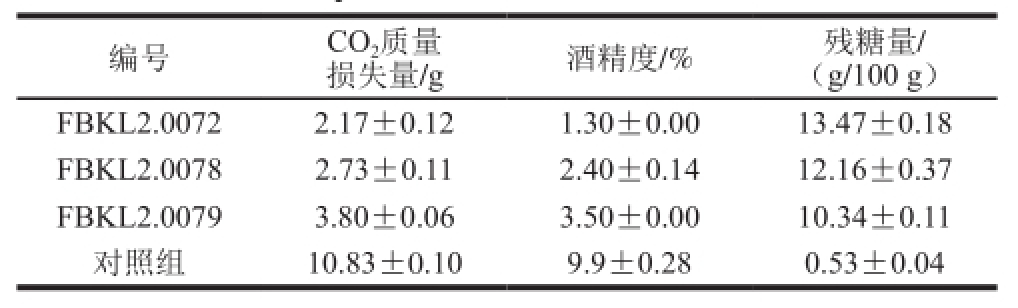
由表7可以看出,在相同条件和培养时间内,各酵母在TTC下呈色深浅不一(表中逐行颜色加深),这说明酱香型白酒大曲中酵母的产酒能力强弱不一。相比之下,显色较深的FBKL2.0072、FBKL2.0078、FBKL2.0079可能具有更好的产酒能力,因而进行进一步发酵实验来进行分析。发酵结束时,通过考察CO 2质量损失量、酒精度以及残糖量等指标,以安琪酵母为参比对象,来对这些酵母的发酵性能做进一步评判,结果见表9。
表8 酵母发酵液中CO
2总质量损失量、酒精度、残糖量分析
Table8 Total CO
2loss, alcohol concentration and residual sugar in yeast fermentation broths
?
由表8可以看出,在相同培养条件和发酵条件下,从酱香型白酒高温成品大曲中筛出的酵母总体发酵力弱,糖利用率低。同产酒初筛实验比较分析,TTC培养基中反应呈粉红色的酵母产酒能力明显较低,从而也反映了TTC培养基在初步分析酵母产酒能力时具有较好的效果。
酱香型大曲中酵母数量为10 3CFU/g,共分离筛选出12 株酵母。经过形态观察、生理生化实验及分子鉴定,最终鉴定为6 种酵母,即Saccharomycopsis fi buligera、Issatchenkia orientalis、Hyphopichia burtonii、Cryptococcus neoformans、Lodderomyces elongisporus和Rhodosporidium fluviale。 Cryptococcus neoformans、Lodderomyces elongisporus和Rhodosporidium fluviale为首次在白酒大曲中发现的酵母种类。
产香实验表明,大曲中分离的酵母有6株具有较好的产香能力。其中,FBKL2.0071固态发酵物呈浓郁的果香味,FBKL2.0082固态发酵物呈浓郁的花香味,两株酵母固态物香味均浓郁且柔和。GC-MS挥发性成分分析表明,两株酵母固态发酵物中含有大量的酯类和醇类物质,也能产生少量的醛、酮、酚和烷类物质。产酒实验表明,分离的酵母总体发酵能力较弱,糖利用率低。
Saccharomycopsis fibuligera是大曲上霉的主要微生物,广泛存在于成品曲中。该菌能够表达生淀粉液化酶和糖化酶,被认为是产生淀粉分解酶类的最好的子囊酵母菌之一,同时具有产酯能力 [21-23]。本实验中分离到的Saccharomycopsis fi buligera既能产酒又能产香。
参考文献:
[1] 陈美竹, 邱树毅, 胡宝东, 等. 酱香型白酒酿造体系中酵母菌研究进展[J].中国酿造, 2015, 34(6): 5-10. DOI:10.11882/j.issn.0254-5071.2015.06.002.
[2] 蒋红军. 茅台酒制曲发酵过程中微生物演替及作用规律[J]. 酿酒科技, 2004(3): 39-40. DOI:10.3969/j.issn.1001-9286.2004.03.009.
[3] 庞博. 酱香型大曲酒酿造过程酵母微生态及功能菌株筛选[D].贵阳: 贵州大学, 2014.
[4] 吴徐建. 酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D]. 无锡: 江南大学, 2013.
[5] 王彩虹. 基于克隆文库法研究不同香型大曲微生物群落结构[D].自贡: 四川理工学院, 2014.
[6] 沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 2013.
[7] 赵爽, 杨春霞, 窦屾, 等. 白酒生产中酿酒微生物研究进展[J]. 中国酿造, 2012, 31(4): 5-10. DOI:10.3969/j.issn.0254-5071.2012.04.002.
[8] 黄永光, 谌永前, 吴广黔, 等. 酱香白酒堆积发酵过程酒醅中酵母菌的分析研究[J]. 酿酒科技, 2013(6): 8-13.
[9] 陈良强, 吴群, 徐岩. 酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J]. 工业微生物, 2013(3): 1-6. DOI:10.3969/ j.issn.1001-6678.2013.03.001.
[10] 姚翠萍, 王和玉, 林琳, 等. 一株膜璞毕赤酵母的生理特性及其代谢产物研究[J]. 酿酒科技, 2011(7): 57-59.
[11] 毛志群. 高产酒精酵母的筛选及鉴定[J]. 食品与发酵工业, 2003(3): 50-53. DOI:10.3321/j.issn:0253-990X.2003.03.012.
[12] 郜希璐. 白酒窖泥中酵母菌的分离鉴定及发酵特性研究[D]. 天津:天津大学, 2009. DOI:10.7666/d.y1677210.
[13] 巴尼特, 佩恩·亚罗. 胡瑞卿译. 酵母菌的特征与鉴定手册[M]. 青岛:青岛海洋大学出版社, 1991.
[14] 刘庆军. 新疆野生酵母的耐受性、发酵特性及生产适用性研究[D].济南: 山东轻工业学院, 2009. DOI:10.7666/d.y1544792.
[15] 沈萍, 陈向东, 方呈祥, 等. 微生物学实验[M]. 北京: 高等教育出版社, 2007: 28-24.
[16] 周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 2010: 47-52.
[17] 孔维兵, 王晓丹, 班世栋. 酱香型大曲中酵母分离鉴定[J]. 酿酒, 2015(1): 57-62.
[18] WU Q, XU Y, CHEN L. Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J]. Letters of Applied Microbiology, 2012, 55(4): 301-307. DOI:10.1016/ j.ijfoodmicro.2013.07.003.
[19] TAMANG J P, FLEET G H. Yeasts diversity in fermented foods and beverages[J]. Yeast Biotechnology Diversity and Applications, 2009: 169-198. DOI:10.1007/978-1-4020-8292-4_9.
[20] 陈卫平, 涂谨, 熊建华. 红四氮唑在酒精酵母选育中的应用效果研究[J]. 酿酒科技, 2003(6): 35-37. DOI:10.3969/ j.issn.1001-9286.2003.06.007.
[21] 中国国家标准化管理委员会. 食品中还原糖的测定: GB/T 5009.7—2008[S]. 北京: 中国标准出版社, 2006: 5-8.
[22] WANG H Y, GAO Y B, FAN Q W, et al. Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J]. Letters in Applied Microbiology, 2011, 53: 134-140.
[23] 应玲云, 伍时华, 赵东玲, 等. 烧酒曲中扣囊复膜酵母的分离及鉴定[J].食品与发酵工业, 2013(1): 146-150.
[24] 颜华. 扣囊复膜酵母(Saccharomycopsis fi buligera)代谢工程的研究[D].北京: 中国科学院微生物研究所, 2007.
[25] 孙莹, 季方, 周维军, 等. Biolog微生物自动鉴定系统对2 株大曲菌种的鉴定[J]. 酿酒, 2013, 40(3): 69-71. DOI:10.3969/ j.issn.1002-8110.2013.03.022.
[26] 牟含. 川南白酒酿造环境中葡萄酒增香酿造酵母菌株的筛选[D].杨凌: 西北农林科技大学, 2015.
[27] 王会会. 烟台干红葡萄酒发酵过程酵母菌群的研究[D]. 济南: 山东轻工业学院, 2011. DOI:10.7666/d.d146560.
[28] 张霞. 肉鸭消化道酵母益生菌的分离和鉴定[D]. 武汉: 武汉轻工大学, 2015.
[29] 刘振兴, 周结珊, 马艳平, 等. 益生菌和有机硒对日本鳗鲡生长性能、抗氧化水平及溶菌酶活力的影响[J]. 安徽农业科学, 2015, 43(18): 156-158. DOI:10.3969/j.issn.0517-6611.2015.18.056.
[30] FELL J W, BUCK J D. Rhodosporidium fluviale sp. nov. a homokaryotic red yeast from a subtropical brackish environment[J]. Mycologia, 1988, 80(4): 560-564.
[31] BOVO B, ANDRIGHETTO C, CARLOT M, et al. Yeast population dynamics during pilot-scale storage of grape marcs for the production of Grappa, a traditional Italian alcoholic beverage[J]. International Journal of Food Microbiology, 2009, 129(3): 221-228. DOI:10.1016/ j.ijfoodmicro.2008.11.025.
[32] 姜楠, 张德法, 严冰, 等. 条件致病真菌新型隐球酵母(Cryptococcus neoformans)致病性研究进展[J]. 微生物学报, 2009, 49(4): 423-428. DOI:10.3321/j.issn:0001-6209.2009.04.003.
[33] KHAN A A, JABEEN M, ALANAZI A, et al. Antifungal efficacy of amphotericin B encapsulated fibrin microsphere for treating Cryptococcus neoformans infection in Swiss albino mice[J]. Brazilian Journal of Infectious Diseases An Off i cial Publication of the Brazilian Society of Infectious Diseases, 2016, 20(4): 342-348. DOI:10.1016/ j.bjid.2016.04.006.
Separation, Identif i cation and Functional Characterization of Yeast Strains from Moutai-Flavor Daqu, a Traditional Chinese Liquor Fermentation Starter
WANG Xiaodan
1,2,3, CHEN Meizhu
1,2, BAN Shidong
1,3, QIU Shuyi
1,3,*
(1. Guizhou Provincial Key Laboratory of Fermentation Engineering and Biological Pharmacy, Guizhou University, Guiyang 550025, China; 2. College of Life Sciences, Guizhou University, Guizhou 550025, China; 3. School of Liquor and Food Engineering, Guizhou University, Guizhou 550025, China)
Abstract:The yeasts in Moutai-flavor Daqu were counted and screened. Through morphological characteristics, physiological and biochemical tests, yeast 26S rDNA and molecular biology, we identified and classified the isolated yeasts. In addition, the fl avor compounds produced by the yeast strains in solid-state fermentation and their fermentation performance were also analyzed. The results showed that the number of yeasts in Moutai-f l avor Daqu was 10 3CFU/g. The yeasts isolated were classif i ed into 6 species. All the yeast strains showed different aroma-producing abilities. Among them, the solid-state fermented products of FBKL2.0071 (Saccharomycopsis fi buligera) smelled like full-bodied fruity fragrance, and the main volatile fl avor compounds included ethyl acetate, isoamyl acetate, phenylethyl alcohol, phenyl ethyl acetate and ethyl palmitate. Moreover, the solid-state fermented products of FBKL2.0082 (Hyphopichia burtonii) smelled like fullbodied fl owery fragrance, and the major volatile fl avor components, included ethyl acetate, isoamyl acetate and phenylethyl alcohol. These two strains not only could produce a large amount of alcohols and esters, but also produce small amounts of aldehydes and ketones. Besides, all the yeast strains showed different and poor ethyl alcohol-producing abilities.
Key words:Moutai-f l avor Daqu; yeast; fl avor composition; alcohol-producing ability
DOI:10.7506/spkx1002-6630-201704009
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2017)04-0051-07
引文格式:
王晓丹, 陈美竹, 班世栋, 等. 茅台大曲中酵母的分离、鉴定及其功能初探[J]. 食品科学, 2017, 38(4): 51-57.
DOI:10.7506/spkx1002-6630-201704009. http://www.spkx.net.cn
WANG Xiaodan, CHEN Meizhu, BAN Shidong, et al. Separation, identif i cation and functional characterization of yeast strains from Moutai-f l avor Daqu, a traditional Chinese liquor fermentation starter[J]. Food Science, 2017, 38(4): 51-57. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201704009. http://www.spkx.net.cn
收稿日期:2016-04-16
基金项目:“十二五”国家科技支撑计划项目(2011BAC06B12);贵州省科技支撑计划项目(黔科合支撑[2016]2340);贵州省科技厅重大专项(黔科合重大专项字[2013]6009号);贵州省省校合作计划项目(黔科合LH字[2014]7672)
作者简介:王晓丹(1980—),女,实验师,博士研究生,研究方向为应用生物技术。E-mail:wangxiaodan0516@126.com
*通信作者:邱树毅(1963—),男,教授,博士,研究方向为发酵工程。E-mail:syqiu@gzu.edu.cn