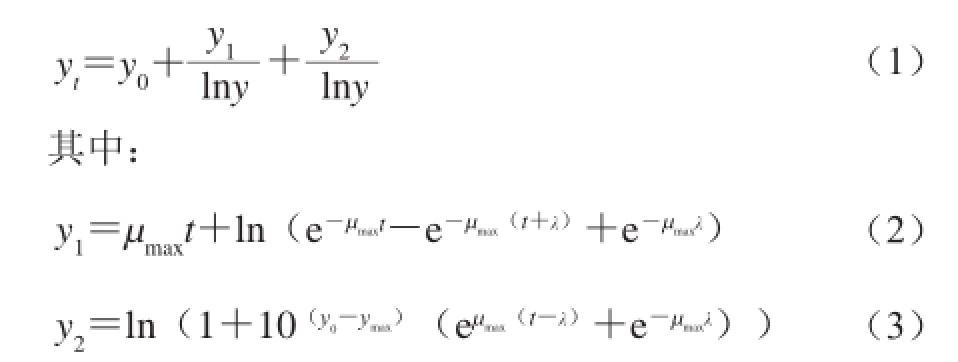
石育娇 1,董庆利 1,*,刘 弘 2,*,曹翊婉 1,刘 箐 1
(1.上海理工大学医疗器械与食品学院,上海 200093;2.上海市疾病预防控制中心,上海 200336)
摘 要:为探讨酸化和渗透压对浮游态、分离态的肠炎沙门氏菌生长的影响,运用Baranyi模型、修正的平方根模型分别建立了浮游态、分离态的肠炎沙门氏菌生长的一级、二级模型;同时研究了吸附态的肠炎沙门氏菌在随后不同环境下培养7 d后的生长情况。结果表明:在25 ℃条件下预培养72 h后,浮游态、分离态的肠炎沙门氏菌在随后不同酸化和渗透压环境中,于大多数条件下表现出了相似的生长情况(P≥0.05);但是在pH 5.0+ 0.0 g/100 mL NaCl、pH 7.0+4.0 g/100 mL NaCl、pH 6.0+4.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl 4 组环境中,2 种状态的肠炎沙门氏菌生长曲线、生长动力学参数均表现出显著性的差异(P<0.05)。同时在pH 5.0~7.0和NaCl含量0.0~4.0 g/100 mL的范围内,建立的浮游态、分离态肠炎沙门氏菌一级、二级模型的决定系数R 2较高,均方根误差较小;模型参数A w min、pH min和模型评价指标准确因子、偏差因子均在可接受范围内。且在25 ℃条件下预培养72 h后,吸附态的肠炎沙门氏菌的初始吸附量为(5.604±0.117)(lg(CFU/cm 2));在随后不同的酸化和渗透压环境下培养7 d后,随着pH值的降低或NaCl含量的增加,吸附态的肠炎沙门氏菌吸附量逐渐减小。本研究可为理解并控制食品加工过程中不同生理状态的肠炎沙门氏菌的生长提供理论依据。
关键词:酸化;渗透压;肠炎沙门氏菌;生理状态
在食品生产加工过程中,当生产线被致病菌污染后,致病菌可吸附于设备表面,尤其是一些难以清洗或消毒的地方,从而形成吸附态的细菌 [1]。致病菌在设备表面上吸附较长时间后会形成菌膜,且很难从设备表面清除;同时形成的菌膜对杀菌剂等具有一定的耐受性,对食品安全存在潜在威胁 [2-3]。由于食品与生产设备的表面会有直接或者间接的接触,吸附于设备表面的致病菌还可进入食品,形成分离态的细菌,进而污染食品 [4]。同时,以浮游态形式存在于食品中的致病菌(浮游态的细菌)也是食品污染的重要来源之一 [5]。其中分离态和浮游态的细菌与吸附态的细菌相比,生长特性更快,对食品安全的威胁更大 [6]。
关于酸化和渗透压对沙门菌生长影响的研究较多,并建立了大量的一级、二级模型 [7-9]。但已有研究中的菌株大多是以浮游态形式预培养的 [9-10],而以吸附态形式预培养的研究较少。且有研究表明,致病菌不同的预培养状态会影响其应对随后不同环境条件的行为 [11]。Belessi等 [6]建立了浮游态、分离态的单增李斯特菌在不同环境中的生长/不生长界面模型,发现浮游态、分离态的单增李斯特菌有不同生长界面。而浮游态、分离态的肠炎沙门氏菌在随后不同环境中的生长情况缺少比较性的动力学研究。同时对食品加工设备表面上(如不锈钢表面)的沙门氏菌主要集中于研究其在不同环境中菌膜形成情况 [12-13],而缺少对形成菌膜后的沙门菌在随后不同环境中生长的研究。酸化和渗透压是食品加工过程中常用到的技术,前期研究了酸化和渗透压的不同处理顺序对肠炎沙门氏菌失活的影响 [14];而酸化(不同pH值)和渗透压(不同NaCl含量)对不同状态的肠炎沙门氏菌生长的影响需要加强开展。
本研究旨在建立酸化和渗透压对浮游态、分离态的肠炎沙门氏菌生长影响的预测模型;同时研究吸附态的肠炎沙门氏菌在随后不同环境中培养7 d后的生长情况,从而模拟食品加工过程中不同生理状态的肠炎沙门氏菌的生长过程,减少肠炎沙门氏菌污染食品事件的发生,为微生物风险评估工作提供参考,完善风险评估体系 [15]。
1.1 材料与试剂
肠炎沙门氏菌(Salmonella enteritis ATCC 13076)购于美国模式菌种保藏中心,于-80 ℃瓷珠菌种保藏管中保藏。
沙门菌选择性(hektoen enteric agar,HE琼脂)培养基、大豆酪蛋白琼脂(tryptose soya agar,TSA)培养基、胰蛋白胨大豆肉汤(tryptose soya broth,TSB)培养基 青岛海博生物技术有限公司;乳酸、氢氧化钠、NaCl、丙酮、盐酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
JJ500型电子天平 江苏常熟市双杰测试仪器厂;SW-CJ-1FD型无菌操作台 江苏苏州安泰空气技术有限公司;YXQ-LS-75S11型高压灭菌锅 上海博讯实业有限公司医疗设备厂;HWS-150型恒温恒湿培养箱 上海比朗仪器有限公司恒温恒湿培养箱;THZ-103B型恒温培养摇床 上海一恒科学仪器有限公司;Avanti J-20XP型离心机 上海恪敏生物科技有限公司;XW-80A旋涡混合仪 上海精科实业有限公司。
1.3 方法
1.3.1 菌株与菌悬液制备
将保藏于-80 ℃瓷珠菌种保藏管中的肠炎沙门氏菌(ATCC 13076)划线接种至TSA培养基上,置于(4.0± 0.5)℃冰箱中临时保存。临用前从TSA培养基上取一环菌苔,接种于100 mL的TSB培养基中,于37 ℃、110 r/min的摇床上培养至菌体达到稳定期(16~18 h)备用 [15]。
1.3.2 肠炎沙门氏菌菌膜的形成
选用不锈钢片(3 0 4奥氏体不锈钢,50 mm×20 mm×0.8 mm,2B面)为肠炎沙门氏菌菌膜形成的介质。临用前将不锈钢片置于丙酮中浸泡一夜,以除去其表面上的食物碎片和油脂。然后将不锈钢片置于5 mol/L盐酸中浸泡15 min,再依次用洗涤剂、自来水、蒸馏水清洗,再于空气中干燥1 h,最后在121 ℃条件下灭菌20 min。将无菌不锈钢片置于装有30 mL TSB培养基(pH 7.2,0.5 g/100 mL NaCl)的无菌离心管中,接种0.5 mL已制备的肠炎沙门氏菌菌悬液,于25 ℃条件下培养72 h。
1.3.3 3 种不同生理状态的肠炎沙门氏菌的制备
在25 ℃条件下培养72 h后,用无菌镊子取出不锈钢片,分别用10 mL的0.85%无菌生理盐水清洗其两面,此时依然吸附于不锈钢片上的细菌为吸附态的细菌。将清洗后的不锈钢片置于另一无菌离心管中,加入30 mL无菌生理盐水及20 颗无菌玻璃珠,于旋涡仪上涡旋3 min,再用10 mL无菌生理盐水分别涡旋清洗2 次,从而得到分离态的细菌。从离心管中吸取10 mL菌悬液,于4 ℃、6 000 r/min条件下离心10 min,再用无菌生理盐水清洗2 次,最后加入10 mL无菌生理盐水制得浮游态的细菌。
1.3.4 实验设计
采用二因素三水平的全析因设计,参考相关文献 [7,9,16],pH值分别选取5.0、6.0、7.0,NaCl含量分别选取0.0、2.0、4.0 g/100 mL,同时选取pH 7.2+ 0.5 g/100 mL NaCl为对照组。通过添加乳酸、氢氧化钠和NaCl得到不同水平的pH值和NaCl含量。
将浮游态和分离态的肠炎沙门氏菌分别用无菌生理盐水进行稀释,制成10 5CFU/mL的接种液。然后接种于不同pH值和渗透压的TSB培养基中,于25 ℃条件下培养,定时取样,按GB 4789.2—2010《食品微生物学检验 菌落总数测定》 [17]测定肠炎沙门氏菌菌落数。每种环境条件重复2 次。
将吸附态的细胞置于装有30 mL不同pH值和渗透压的TSB培养基中,于25 ℃条件下培养7 d。然后用涡流珠法 [18]将不锈钢片上的细菌分离下来,测定菌落总数。每种环境条件重复3 次以减小随机误差。
1.3.5 一级模型的建立
应用DMFit软件拟合浮游态和分离态的肠炎沙门氏菌分别在不同环境条件下的生长曲线,选用的Baranyi模型 [19]如下:
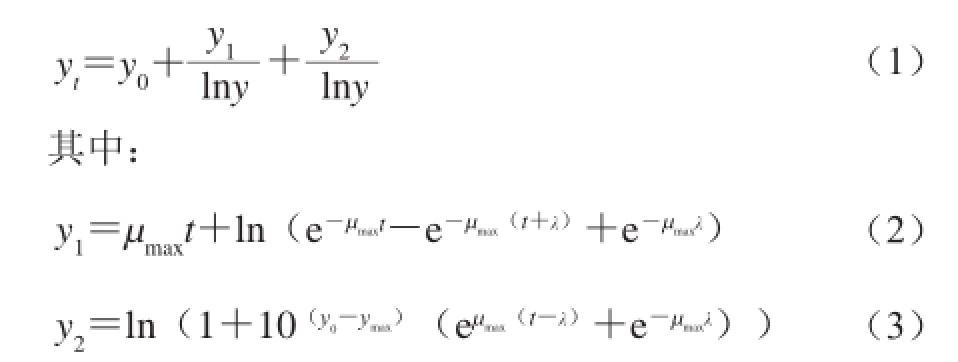
式中:t为肠炎沙门氏菌的生长时间/h;y t、y 0分别为肠炎沙门氏菌分别在t、0时刻菌体浓度(lg(CFU/mL));y max为最大菌体浓度(lg(CFU/mL));µ max为最大比生长速率/h -1;λ为迟滞期/h。
1.3.6 二级模型的建立
应用Matlab R2014a软件建立pH值、水分活度A w与浮游态或分离态的肠炎沙门氏菌最大比生长率µ max之间的二级模型,A w与NaCl含量的关系见文献[20]。选用的平方根模型修正式 [21]按式(4)计算。
式中:b为常数;A w min为肠炎沙门氏菌生长的理论最小水分活度;pH min为肠炎沙门氏菌生长的理论最小pH值。
1.3.7 模型的评价
一级模型的评价选用决定系数R 2,二级模型的评定选用均方根误差(root mean square error,RMSE)、准确因子(accuracy factor,A f)、偏差因子(bias factor,B f) [22],各评价参数分别按以下公式计算。
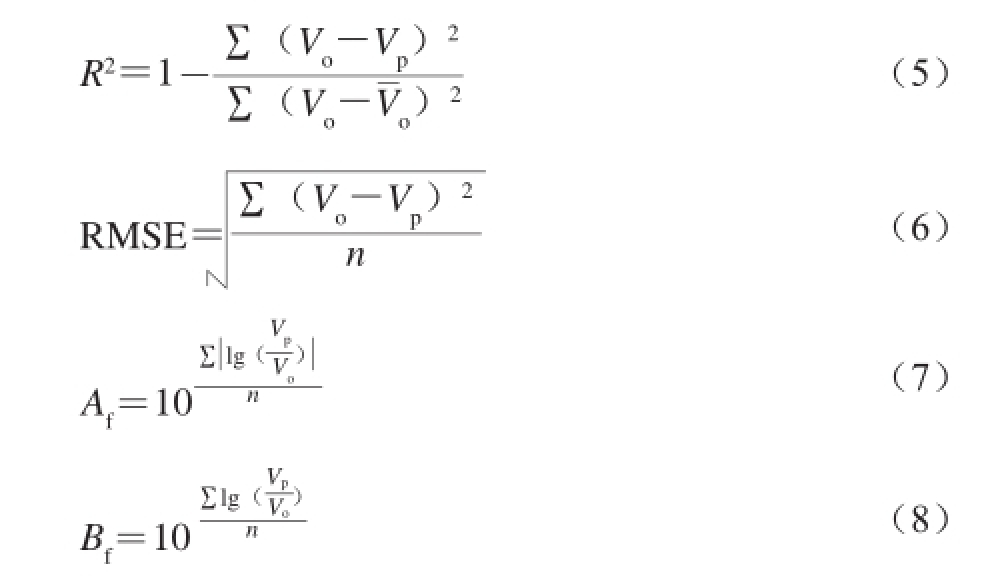
式中:V o、V p分别为观测值、预测值;n为观测值个数。
1.4 数据统计分析
应用DPS 7.05软件和SPSS 17.0软件,分别分析不同环境条件对3 种生理状态的肠炎沙门氏菌生长影响的显著性和生长动力学参数 [23]的显著性。
2.1 吸附态的肠炎沙门氏菌在不同环境条件下的生长情况
表1 吸附态的肠炎沙门氏菌在不同pH值和渗透压环境下培养7 d后的数目
Table1 The numbers of attached cells of Salmonella enteritisunder different pH and osmotic pressures after being cultivated for 7 days
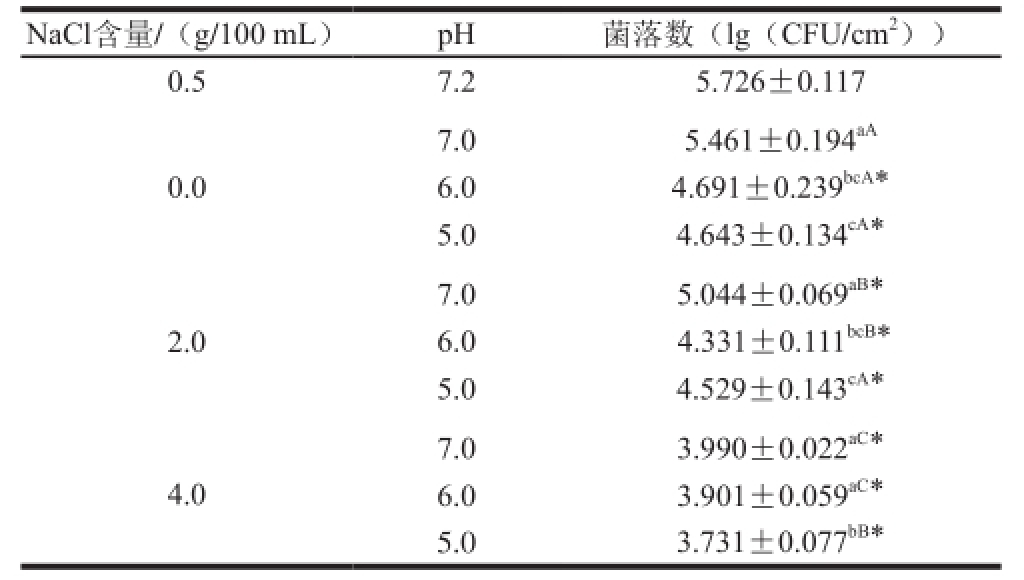
注:不同小写字母表示同一NaCl含量各菌落数差异显著(P<0.05);不同大写字母表示同一pH值各菌落数差异显著(P<0.05);*.与初始接菌量相比差异显著(P<0.05)。
?
吸附态的肠炎沙门氏菌在pH 7.2+0.5 g/100 mL NaCl环境中预培养72 h后的初始吸附量为(5.604±0.117)(lg(CFU/cm 2))。由表1可知,在不同pH值和渗透压环境下培养7 d后,吸附态的肠炎沙门氏菌数目与初始吸附量相比,在大多数环境条件下有显著的降低(P<0.05);只有在pH 7.2+0.5 g/100 mL NaCl、pH 7.0+0.0 g/100 mL NaCl的环境下,吸附态的肠炎沙门氏菌的数目无显著性变化(P≥0.05)。同时随着pH值的降低或者NaCl含量的增加,吸附态的肠炎沙门氏菌细胞数目分别逐渐降低(P<0.05)。
2.2 浮游态和分离态的肠炎沙门氏菌在不同环境条件下的生长情况
2.2.1 浮游态和分离态的肠炎沙门氏菌的一级模型

图1 浮游态和分离态的肠炎沙门氏菌在不同酸化和渗透压环境下的生长情况
Fig.1 Growth rates of planktonic and detached cells of Salmonella enteritis under different acid and osmotic pressures
在大多数环境条件下,浮游态和分离态的肠炎沙门氏菌表现出相似的生长情况(P≥0.05,生长情况图未列出)。但是如图1所示,在pH 5.0+0.0 g/100 mL NaCl、pH 7.0+4.0 g/100 mL NaCl、pH 6.0+ 4.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl这4 组环境中,浮游态和分离态的肠炎沙门氏菌的生长曲线之间表现出显著性的差异(P<0.05)。
表2 浮游态和分离态的肠炎沙门氏菌在不同酸化和渗透压环境下拟合Baranyi模型的动力学参数
Table2 Kinetic parameters of the Baranyi model obtained for planktonic and detached cells of Salmonella enteritis under different acid and osmotic pressures
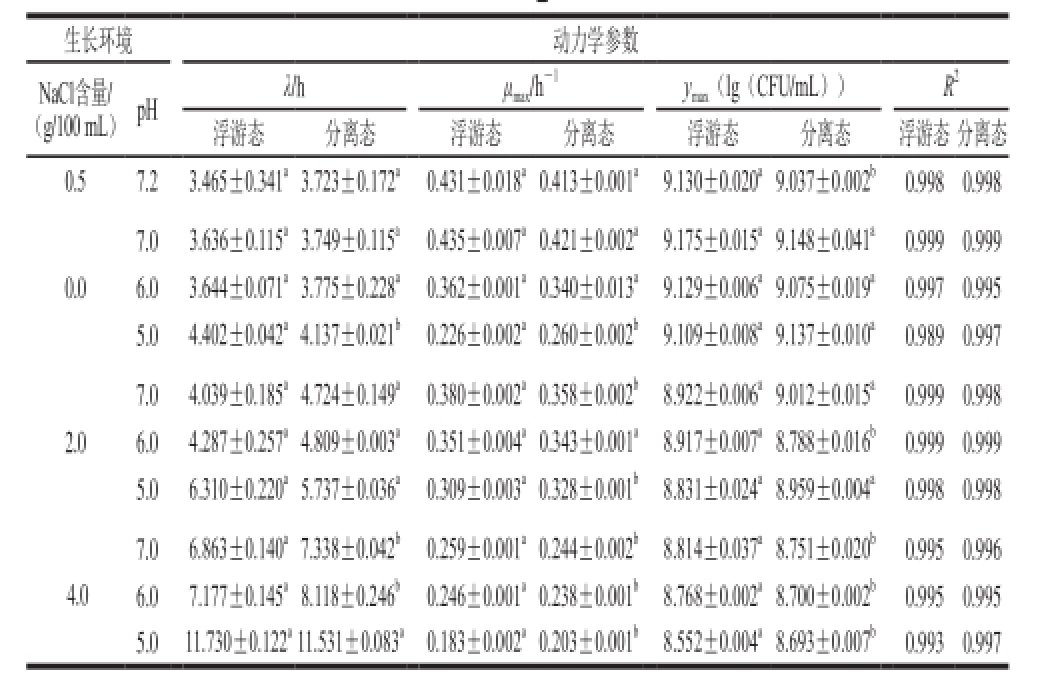
注:同一动力学参数同行肩标字母不同表示差异显著(P<0.05)。
?
由表2可知,在各种环境条件下,一级模型的决定系数R 2较高(R 2>0.9),表明Baranyi模型能很好地拟合浮游态和分离态的肠炎沙门氏菌生长情况。由单因素方差分析可知:在pH 5.0+0.0 g/100 mL NaCl、pH 7.0+ 4.0 g/100 mL NaCl、pH 6.0+4.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl这4 组环境中,浮游态与分离态的肠炎沙门氏菌的生长动力学参数之间也表现出了显著性差异(P<0.05)。在pH 7.0+4.0 g/100 mL NaCl、pH 6.0+4.0 g/100 mL NaCl这2 种环境中,浮游态的肠炎沙门氏菌与分离态肠炎沙门氏菌相比,最大比生长率显著较大(P<0.05),迟滞期显著较短(P<0.05)。然而在pH 5.0+0.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl这2 种环境中,浮游态的肠炎沙门氏菌生长率均显著小于分离态的肠炎沙门氏菌;同时在pH 5.0+0.0 g/100 mL NaCl环境中,浮游态的肠炎沙门氏菌的迟滞期显著大于分离态的肠炎沙门氏菌,但是在p H 5.0+ 4.0 g/100 mL NaCl环境中,2 种状态的肠炎沙门氏菌的迟滞期之间无显著性差异(P≥0.05)。且在pH 7.0+ 4.0 g/100 mL NaCl、pH 6.0+4.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl这3 种环境中,浮游态和分离态肠炎沙门氏菌的最大细菌数目之间分别有显著性差异(P<0.05)。在其他环境中,浮游态和分离态的肠炎沙门氏菌的生长曲线之间虽无显著性差异,但是在pH 7.0+ 2.0 g/100 mL NaCl、pH 5.0+2.0 g/100 mL NaCl这2 种环境中,浮游态和分离态的肠炎沙门氏菌的最大比生长率之间分别有显著性差异(P<0.05);在对照组pH 7.2+ 0.5 g/100 mL NaCl、pH 6.0+2.0 g/100 mL NaCl环境中,浮游态和分离态的肠炎沙门氏菌的最大细菌数目之间分别有显著性差异(P<0.05)。
在大多数环境中,随着pH值的降低或者NaCl含量的增加,浮游态或分离态的肠炎沙门氏菌的迟滞期逐渐增大,最大比生长率逐渐减小。然而当pH值为5.0时,随着NaCl含量的增加,浮游态和分离态的肠炎沙门氏菌最大比生长率均先增大后减小。
2.2.2 浮游态和分离态的肠炎沙门氏菌的二级模型
建立的浮游态或分离态的肠炎沙门氏菌的二级生长模型如下所示:
浮游态细菌:
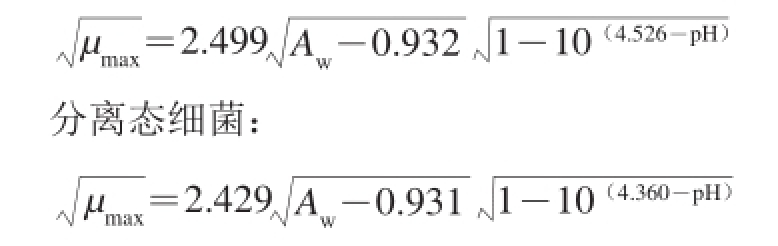
浮游态或分离态肠炎沙门氏菌的µ max与pH值和A w之间关系的平方根模型,具有较高的决定系数R 2。浮游态肠炎沙门氏菌的理论A w min、pH min值分别为0.932、4.526;分离态肠炎沙门氏菌的理论A w min、pH min值分别为0.931、4.360。沙门氏菌可生长的环境范围较广,pH值范围为4.0~9.0 [24],NaCl含量范围为0~12 g/100 mL(A w为0.919~1.000) [16]。模型参数A w min、pH min值均在可接受范围内,说明修正的平方根模型具有较好的拟合度。
2.2.3 浮游态和分离态的肠炎沙门氏菌二级模型的评价
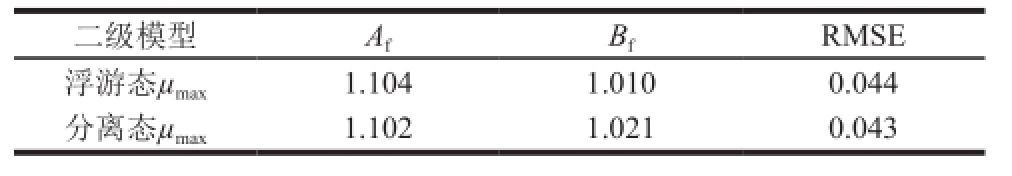
表3 浮游态和分离态的肠炎沙门氏菌二级模型的评价指标
Table3 Evaluation indexes of the second-order model for planktonic and detached cells of Salmonella enteritis
?
环境因素的个数影响着A f的可接受范围。当环境因素每增加一个变量时,准确因子A f将增加0.10~0.15个单位的可接受范围 [25];本研究有pH值和NaCl含量这2个环境因素,所以A f的可接受范围在1.0~1.3之间。有资料显示,B f的可接受范围为0.52~1.34,或者0.75~1.25 [26-27]。由表3可知,在pH 5.0~7.0和NaCl含量0.0~4.0 g/100 mL的范围内,二级模型的RMSE均较小,A f和B f均在可接受范围内,说明模型能很好地预测酸化和渗透压对浮游态或分离态的肠炎沙门氏菌最大比生长率的影响。
3.1 致病菌的吸附机理及参数的选择
本研究表明,肠炎沙门氏菌可吸附于不锈钢片表面并形成菌膜。当细菌受到来自外界环境的各种压力时,细菌通过合成水合多聚物黏附在一些介质的表面,以附着的方式生长并形成菌膜,从而对抗外界不利的环境条件 [28]。菌膜的形成是一个复杂的过程,与细菌表面的物理化学性质、吸附介质的表面、周围介质的组成等有关 [29]。不锈钢是一种非生物介质表面,广泛用于食品加工设备表面的制作 [30],且已有大量研究表明沙门氏菌可吸附于不锈钢表面并形成菌膜 [1,12-13]。有研究显示沙门氏菌在玻璃、聚乙烯等材质上也可形成菌膜 [31-32]。但是这些研究主要侧重于沙门氏菌在不同材质上菌膜逐步形成的情况。而不锈钢表面上菌膜的生长更符合实际加工环境,且研究已形成的菌膜在随后不同环境下的生长情况是本研究的创新点之一。研究吸附态的细胞在随后不同环境下生长7 d的情况,是因为7 d是食品腐败变质的一个节点时间 [33-34]。关于肠炎沙门氏菌在不锈钢表面上生长的研究可为控制加工过程中肠炎沙门氏菌的生长提供借鉴。
3.2 浮游态和分离态的肠炎沙门氏菌在不同环境条件下生长差异的分析
大多数条件下,浮游态和分离态的肠炎沙门氏菌的生长曲线之间无显著性差异,但是在pH 5.0+ 0.0 g/100 mL NaCl、pH 7.0+4.0 g/100 mL NaCl、pH 6.0+ 4.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl这4 组环境中,浮游态和分离态的肠炎沙门氏菌的生长曲线、生长动力学参数之间表现出显著性的差异。这种差异可能与微生物的生理历史或者代谢历史、细胞的变异性有关 [35-36]。虽然浮游态和分离态的细菌在预培养过程中存在于一个体系,但是浮游态细胞一直在液体环境中以浮游形式生长;分离态的细胞是吸附于不锈钢表面上以附着形式生长。有资料显示,长期吸附于固体表面的吸附态的细菌与浮游态的细菌相比,对恶劣的环境、抗生素或杀菌剂等具有更高的耐受性;当细菌从不锈钢表面分离下来后,细菌耐受性也会影响其在随后环境的生长情况 [6,11]。同时,细菌细胞本身的变异性也会影响微生物的生长情况。有研究表明:当生长环境越来越不利微生物生长时,细菌细胞的变异性也会逐渐变大 [36]。而pH 5.0+ 0.0 g/100 mL NaCl、pH 7.0+4.0 g/100 mL NaCl、pH 6.0+4.0 g/100 mL NaCl、pH 5.0+4.0 g/100 mL NaCl这4 组环境属于低酸或高盐的环境,不利于细菌的生长。所以在低酸或高盐环境下,浮游态和分离态肠炎沙门氏菌不同的生理历史以及细菌细胞本身的变异性使2 种状态的肠炎沙门氏菌表现出了不同的生长特性。
3.3 3 种生理状态的肠炎沙门氏菌随pH值或者NaCl含量变化的规律
在大多数环境下,随着pH值的降低或NaCl含量的增加,浮游态和分离态的肠炎沙门氏菌的迟滞期逐渐增大,生长率逐渐减小;吸附态的肠炎沙门氏菌在培养7 d后的吸附量也逐渐减小。这是因为随着pH值的降低,细胞膜的通透性、膜结构的稳定性、物质的溶解性或电离性逐渐降低,从而微生物对营养物质的吸收逐渐变弱 [37]。同时随着NaCl含量的增加,微生物生长环境的渗透压逐渐变高;当细胞处于高渗透环境中,胞浆和胞膜分离会出现质壁分离的现象 [38]。所以随着pH值的降低或者NaCl含量的增加,微生物生长环境逐渐变得不利,从而引起了微生物的缓慢生长,浮游态或分离态的肠炎沙门氏菌的迟滞期均逐渐增大,生长率均逐渐减小;吸附态的沙门菌的数量也逐渐降低。然而当pH值为5.0时,随着NaCl含量的增加,浮游态和分离态的肠炎沙门氏菌最大比生长率均先增大后减小。在pH 5.0的低酸环境中,随着NaCl含量的增加,细菌生长环境越来越恶劣,细菌细胞本身的变异性越来越大 [36],所以可能出现最大生长率先略微增大后减小的情况。
3.4 二级模型的选择与评价
本研究未对建立的模型进行验证,是因为在pH 5.0~7.0及NaCl含量0.0~4.0 g/100 mL的实验范围内,建立的一级、二级模型的决定系数R 2较高,RMSE较小,模型参数pH min、A w min及A f和B f均在可接受范围内,说明选取的Baranyi模型和修正的平方根模型具有较好的拟合度。
平方根模型广泛用于研究最大比生长率与环境因子之间的关系,且有资料显示Presser等 [21]提出的修正的平方根模型能更好地用于建立微生物生长的二级模型 [38],所以本研究采用了修正的平方根模型。前期采用了传统的平方根模型,拟合出的理论pH min、A w min(结果未列出)与肠炎沙门氏菌可生长的pH最小值、A w最小值略有偏差 [16-17];而采用的响应面模型得到的各个评价指标虽然在可接受范围内,但是没有pH值和NaCl含量的交互项,不能很好地预测肠炎沙门氏菌的生长(结果未列出)。
研究了吸附态的肠炎沙门氏菌在随后不同酸化和渗透压环境下培养7 d后的生长情况。结果表明:大多数环境下培养7 d后,吸附态的肠炎沙门氏菌的菌体数目与初始吸附量相比,有显著性降低(P<0.05)。同时随着pH值的降低或NaCl含量的增加,吸附态的肠炎沙门氏菌的菌体数目逐渐降低。
在大多数环境条件下,浮游态和分离态的肠炎沙门氏菌表现出相似的生长情况(P≥0.05)。但是在pH 5.0+ 0.0 g/100 mL NaCl、pH 7.0+4.0 g/100 mL NaCl、pH 6.0+4.0 g/100 mL NaCl、pH5.0+4.0 g/100 mL NaCl这4 组环境中,浮游态和分离态的肠炎沙门氏菌生长曲线之间、生长动力学参数之间均表现出显著性的差异(P<0.05)。
建立了浮游态和分离态的肠炎沙门氏菌在不同酸化和渗透压环境下的一级、二级模型。在pH 5.0~7.0及NaCl含量0.0~4.0 g/100 mL的实验范围内,各个模型的决定系数R 2较高,且二级模型的RMSE较小,A f和B f都在可接受范围内,表明模型具有良好的拟合度,能较好地预测浮游态和分离态肠炎沙门氏菌的生长情况。本研究建立的预测模型可为研究食品加工过程中(如饮料、牛奶等液态食品加工过程)不同状态沙门菌的生长提供借鉴,从而为灭活和控制加工过程中的肠炎沙门氏菌提供理论依据。
参考文献:
[1] BAE Y M, BAEK S Y, LEE S Y. Resistance of pathogenic bacteria on the surface of stainless steel depending on attachment form and efficacy of chemical sanitizers[J]. International Journal of Food Microbiology, 2012, 153(3): 465-473. DOI:10.1016/ j.ijfoodmicro.2011.12.017.
[2] BROOKSL J D, FLINT S H. Biof i lms in the food industry: problems and potential solutions[J]. International Journal of Food Science and Technology, 2008, 43(12): 2163-2176. DOI:10.1111/j.1365-2621.2008.01839.x.
[3] CHAVANT P, MARTINIE B G, HEBRAUD M. Antimicrobial effects of sanitizers against planktonic and sessile Listeria monocytogenes cells according to the growth phase[J]. FEMS Microbiology Letters, 2004, 236(2): 241-248. DOI:10.1016/j.femsle.2004.05.040.
[4] KUSUMANINGRUM H D, RIBOLDI G, HAZELEGER W C, et al. Survival of foodborne pathogens on stainless steel surfaces and crosscontamination to foods[J]. International Journal of Food Microbiology, 2003, 85(3): 227-236. DOI:10.1016/S0168-1605(02)00540-8.
[5] SMET C, NORIEGA E, MIERLO J, et al. Influence of the growth morphology on the behavior of Salmonella typhimurium and Listeria monocytogenes under osmotic stress[J]. Food Research International, 2015, 77: 515-526. DOI:10.1016/j.foodres.2015.08.008.
[6] BELESSI C E A, GOUNADAKI A S, SCHVARTZMAN S, et al. Evaluation of growth/no growth interface of Listeria monocytogenes growing on stainless steel surfaces, detached from biof i lms or in suspension, in response to pH and NaCl[J]. International Journal of Food Microbiology, 2011, 145: S53-S60. DOI:10.1016/j.ijfoodmicro.2010.10.031.
[7] PARK S Y, SEO K Y, HA S D. A response surface model based on absorbance data for the growth rates of Salmonella enterica serovar typhimurium as a function of temperature, NaCl, and pH[J]. Journal of Microbiology & Biotechnology, 2007, 17(4): 644-649.
[8] PIN C, AVENDAÑO-PEREZ G, COSCIANI-CUNICO E, et al. Modelling Salmonella concentration throughout the pork supply chain by considering growth and survival in fl uctuating conditions of temperature, pH and a w[J]. International Journal of Food Microbiology, 2011, 145: S96-S102. DOI:10.1016/j.ijfoodmicro.2010.09.025.
[9] LIANOU A, KOUTSOUMANIS K P. Effect of the growth environment on the strain variability of Salmonella enterica kinetic behavior[J]. Food Microbiology, 2011, 28(4): 828-837. DOI:10.1016/ j.fm.2010.04.006.
[10] THONGBAI B, GASALUCK P, WAITES W M. Morphological changes of temperature- and pH-stressed Salmonella following exposure to cetylpyridinium chloride and nisin[J]. LWT-Food Science and Technology, 2006, 39(10): 1180-1188. DOI:10.1016/ j.lwt.2005.07.020.
[11] POIMENIDOU S, BELESSI C A, GIAOURIS E D, et al. Listeria monocytogenes attachment to and detachment from stainless steel surfaces in a simulated dairy processing environment[J]. Applied and Environmental Microbiology, 2009, 75(22): 7182-7188. DOI:10.1128/ AEM.01359-09.
[12] LIANOU A, KOUTSOUMANIS K P. Strain variability of the biof i lmforming ability of Salmonella enterica under various environmental conditions[J]. International Journal of Food Microbiology, 2012, 160(2): 171-178. DOI:10.1016/j.ijfoodmicro.2012.10.002.
[13] NGUYEN H D N, YANG Y S, YUK H G. Biofilm formation of Salmonella typhimurium on stainless steel and acrylic surfaces as affected by temperature and pH level[J]. LWT-Food Science and Technology, 2014, 55(1): 383-388. DOI:10.1016/j.Lwt.2013.09.022.
[14] 董庆利, 石育娇, 刘箐, 等. 酸化和NaCl的处理顺序对肠炎沙门菌失活的影响[J]. 农业机械学报, 2016, 47(4): 201-208. DOI:10.6041/ j.Issn.1000-1298.2016.04.027.
[15] 彭国樑, 姚俭. 不确定性供应链风险的模糊综合评判[J]. 上海理工大学学报, 2010, 32(4): 373-377.
[16] JAKOCIUNE D, BISGAARDA M, HERVE G, et al. Effects of environmental conditions on growth and survival of Salmonella in pasteurized whole egg[J]. International Journal of Food Microbiology, 2014, 184: 27-30. DOI:10.1016/j.ijfoodmicro.2014.03.015.
[17] 卫生部. 食品微生物学检验 菌落总数测定: GB 4789.2—2010[S]. 北京: 中国标准出版社, 2010: 1-5.
[18] LINDSAY D, von HOLY A. Evaluation of dislodging methods for laboratory-grown bacterial biofilms[J]. Food Microbiology, 1997, 14(4): 383-390. DOI:10.1006/fmic.1997.0102.
[19] BARANYI J, ROBERTS T A. A dynamic approach to predicting bacterial growth in food[J]. International Journal of Food Microbiology, 1994, 23(3/4): 277-294. DOI:10.1016/0168-1605(94)90157-0.
[20] CHIRIFE J, RESNIK S L. Unsaturated solutions of sodium chloride as reference sources of water activity at various temperatures[J]. Journal of Food Science, 1984, 49(6): 1486-1488. DOI:10.1111/j.1365-2621.1984.tb12827.X.
[21] PRESSER K A, RATKOWSKY D A, ROSS T. Modelling the growth rate of Escherichia coli as a function of pH and lactic acid concentration[J]. Applied and Environmental Microbiology, 1997, 63(6): 2355-2360.
[22] 王军, 董庆利, 丁甜. 预测微生物模型的评价方法[J]. 食品科学, 2011, 32(21): 268-272.
[23] PELEG M, CORRADINI M G. Microbial growth curves: what the models tell us and what they cannot[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(10): 917-945. DOI:10.1080/10408398. 2011.570463.
[24] OLAIMAT A N, HOLLEY R A. Effects of changes in pH and temperature on the inhibition of Salmonella and Listeria monocytogenes by allyl isothiocyanate[J]. Food Control, 2013, 34(2): 414-419. DOI:10.1016/j.foodcont.2013.05.014.
[25] ROSS T, TIENUNGOON S, DALGAARD P. Predictive modelling of the growth and survival of Listeria in fi shery products[J]. International Journal of Food Microbiology, 2000, 62(3): 231-245. DOI:10.1016/ S0168-1605(00)00340-8.
[26] MARTINEZ L, DIENANE D, CILLA I, et al. Effect of different concentrations of carbon dioxide and low concentration of carbon monoxide on the shelf-life of fresh pork sausages packaged in modif i ed atmosphere[J]. Meat Science, 2005, 71(3): 563-570. DOI:10.1016/ j.meatsci.2005.04.041.
[27] 李敏, 李耘, 韩北忠. 金华火腿中杂色曲霉的生长预测模型[J]. 食品与发酵工业, 2005, 31(11): 56-59. DOI:10.13995/j.cnki.11-1802/ ts.2005.11.014.
[28] DONLAN R M, COSTERTON J W. Biof i lms: survival mechanisms of clinically relevant microorganisms[J]. Clinical Microbiology Reviews, 2002, 15(2): 167-193. DOI:10.1128/CMR.15.2.167-193.2002.
[29] FRANK J F. Microbial attachment to food and food contact surfaces[J]. Advances in Food and Nutrition Research, 2001, 43: 319-370. DOI:10.1016/S1043-4526(01)43008-7.
[30] BOULANÉ-PETERMANN L. Processes of bioadhesion on stainless steel surfaces and cleanability: a review with special reference to the food industry[J]. Biofouling, 1996, 10(4): 275-300. DOI:10.1080/08927019609386287.
[31] ABDALLAH F B, LAGHA R, SAID K, et al. Detection of cell surface hydrophobicity, biofilm and fimbirae genes in Salmonella isolated from Tunisian clinical and poultry meat[J]. Iranian Journal of Public Health, 2014, 43(4): 423-431.
[32] YOON H, LEE J Y, SUK H J, et al. Modeling to predict growth/no growth boundaries and kinetic behavior of Salmonella on cutting board surfaces[J]. Journal of Food Protection, 2012, 75(12): 2116-2121. DOI:10.4315/0362-028X.JFP-12-094.
[33] 厉曙光. 营养与食品卫生学[M]. 上海: 复旦大学出版社, 2012: 233-237.
[34] 邱静, 董庆利, 程飞. 气调包装冷却猪肉中假单胞菌生长概率模型的构建[J]. 农业工程学报, 2012, 28(13): 257-262. DOI:10.3969/ j.issn.1002-6819.2012.13.041.
[35] PAN Y, BREIDT F, KATHARIOUS S. Resistance of Listeria monocytogenes biofilms to sanitizing agents in a simulated food processing environment[J]. Applied and Environmental Microbiology, 2006, 72(12): 7711-7717. DOI:10.1016/j.ijfoodmicro.2011.12.017.
[36] KOUTSOUMANIS K. A study on the variability in the growth limits of individual cells and its effect on the behavior of microbial populations[J]. International Journal of Food Microbiology, 2008, 128(1): 116-121. DOI:10.1016/j.ijfoodmicro.2008.07.013.
[37] 周德庆. 微生物学教程[M]. 3版. 北京: 高等教育出版社, 2011: 164-165.
[38] THEYS T E, GEERAERD A H, VERHULST A, et al. Effect of pH, water activity and gel micro-structure, including oxygen prof i les and rheological characterization, on the growth kinetics of Salmonella typhimurium[J]. International Journal of Food Microbiology, 2008, 128(1): 67-77. DOI:10.1016/j.ijfoodmicro.2008.06.031.
Effect of Acid and Osmotic Pressure on the Growth of Salmonella enteritis in Different States
SHI Yujiao
1, DONG Qingli
1,*, LIU Hong
2,*, CAO Yiwan
1, LIU Qing
1
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China)
Abstract:To explore the effect of acid and osmotic pressure on the growth of planktonic and detached cells of Salmonella enteritis, the Baranyi model and modif i ed square root model were used to simulate the growth of S. enteritis in the two states, respectively. The growth of attached cells cultivated for 7 days under different environments was studied as well. The experimental results demonstrated that both the planktonic and detached cells pre-cultivated at 25 ℃ for 72 h showed similar growth rates under most subsequent environmental conditions (P ≥ 0.05). However, the growth curves and growth kinetic parameters of both cells were significantly different (P < 0.05) under four conditions including pH 5.0 + 0.0 g/100 mL NaCl, pH 7.0 + 4.0 g/100 mL NaCl, pH 6.0 + 4.0 g/100 mL NaCl, and pH 5.0 + 4.0 g/100 mL NaCl. Moreover, the fi rst- and second-order models showed high determination coeff i cient (R 2) and low root mean square error, and the model parameters A w min, pH min, as well as the evaluation indicators accuracy factor (A f) and deviation factor (B f) were within the acceptable range under the experimental conditions of pH 5.0–7.0 and NaCl concentration of 0.0–4.0 g/100 mL. The initial adsorbance quantity of attached cells cultivated at 25 ℃ for 72 h was (5.604 ± 0.117) (lg (CFU/cm 2)), and the value reduced gradually with the decrease in pH value or the increase in NaCl concentration after subsequent cultivation for 7 days under different acid and osmotic pressures. Consequently, this research could provide a reference for understanding and controlling the growth of S. enteritis in different states during food processing.
Key words:acid; osmotic pressure; Salmonella enteritis; physiological states
DOI:=59,ebook=66
DOI:10.7506/spkx1002-6630-201704010
中图分类号:TS251. 5
文献标志码:A
文章编号:1002-6630(2017)04-0058-07
收稿日期:2016-04-07
基金项目:“十二五”国家科技支撑计划项目(2015BAK36B04);国家自然科学基金面上项目(31271896;31371776);上海市科委长三角科技联合攻关领域项目(15395810900)
作者简介:石育娇(1992—),女,硕士研究生,研究方向为预测微生物学与风险评估。E-mail:1282360775@ qq.com
*通信作者:董庆利(1979—),男,教授,博士,研究方向为预测微生物学与风险评估。E-mail:dongqingli@126.com
刘弘(1965—),男,主任医师,硕士,研究方向为营养与食品卫生。E-mail:liuhong@scdc.sh.cn
引文格式:
石育娇, 董庆利, 刘弘, 等. 酸化和渗透压对不同状态肠炎沙门氏菌生长的影响[J]. 食品科学, 2017, 38(4): 58-64.
DOI:10.7506/spkx1002-6630-201704010. http://www.spkx.net.cn
SHI Yujiao, DONG Qingli, LIU Hong, et al. Effect of acid and osmotic pressure on the growth of Salmonella enteritis in different states[J]. Food Science, 2017, 38(4): 58-64. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201704010. http://www.spkx.net.cn