
图1 Shannon-Wiener曲线
Fig.1 Shannon-Wiener curve
张晓辉,杨靖鹏,王少军,王 静,樊明涛,魏新元 *
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:为研究自然发酵浆水中细菌的多样性并分离可以用于批量生产浆水的乳酸菌菌株,分析从3 个不同地方采集的浆水中的细菌多样性,分离和鉴定浆水中对常见食源性致病菌抑菌效果好的优势菌乳酸菌。提取浆水总DNA,采用MiSeq技术对细菌16S rRNA的V3~V4区进行测序分析,获得浆水中的细菌多样性。结果显示,乳杆菌在3 种浆水中为优势菌,3 种浆水中的细菌多样性存在差异,TS_taian和XA_changan 2 种浆水中的细菌多样性组成比较相近,而XA_yanta则与前面2 种浆水差异性比较大,在3 种浆水中检测到致腐菌和可能的致病菌(或条件致病菌)。利用改良的MRS培养基从3 种浆水中分离获得35 株产生溶钙圈的菌株,挑选其中10 株对4 种常见食源性致病菌抑制效果好的菌株进行16S rRNA测序鉴定,其中8 株为植物乳杆菌,2 株为鼠李糖乳杆菌,说明该2 种菌在浆水中为优势菌,为今后利用此两株菌进行单菌发酵或混合发酵生产浆水提供一定的理论和实践的依据。
关键词:浆水;细菌多样性;乳酸菌
浆水是一种传统发酵食品,其味酸醇、清香、爽口。在我国北方地区食用历史悠久,多被用于夏季制汤或下面,具有很强的保健功效。近年来,南方一些地区的人们也开始制作浆水菜,并用酸浆水点制豆腐,制成的豆腐微酸,鲜嫩,口感好,没有异味,深受人们的喜爱 [1]。
浆水的传统制作过程是将时令绿色蔬菜焯水后,加入制备好的面汤或米汤装入缸或罐中,再加入用老浆水做的引子,并在缸口或罐口加盖纱布,借助于蔬菜表面和原始浆水中的有益微生物,利用蔬菜原料初加工处理时流出的汁液,让其自然发酵,最终获得成品 [2]。其发酵过程一般经过3 个阶段,即初期、中期和后期。每个阶段的微生物群系都很复杂,但乳酸菌为其中主要的发酵菌群 [3]。近年来不少学者研究发现乳酸菌不仅可以调节机体胃肠道菌群稳定 [4]、保持胃肠道微生态平衡,提高食物消化率 [5],还可以降低人体肠道内胆固醇 [6-7],抑制肠道内致病菌生长繁殖 [5],制造营养物质,促进机体吸收利用,从而调节机体的营养状态和生理功能,作用于细胞感染、药物效应、毒性反应、免疫反应、肿瘤发生和应急反应等过程 [8-10],对人体有很强的益生作用。
浆水自然发酵周期长,发酵过程受很多因素影响,不同的蔬菜及老浆水中微生物菌群复杂,在浆水中极有可能存在腐败菌甚至致病菌污染的情况 [11-12]。因此,本研究拟对浆水中的细菌多样性进行分析,揭示浆水中的优势菌及可能存在的腐败菌或致病菌;然后对浆水中的乳酸菌进行分离鉴定,获得浆水中的优势菌种并鉴定,为今后浆水的纯种发酵以及工业化生产质量稳定、健康安全的浆水产品提供基本理论和实践依据。
1.1 材料与试剂
1.1.1 样品
所用的3 种浆水样品皆以芹菜为材料,分别采自3 个不同地方:样品1采自陕西省西安市雁塔区大寨路与丈八北路十字新乐城小区,编号为XA_yanta;样品2采自陕西省西安市长安区韦曲街道西韦村二组64号,编号为XA_ changan;样品3采自甘肃省天水市泰安县西川工业园区天水新世纪工贸有限公司,编号为TS_taian。
1.1.2 试剂
溶菌酶、蛋白酶K、酚-氯仿-异戊醇(25∶24∶1,V/V)溶液、氯仿-异戊醇(24∶1,V/V)溶液、Tris、乙二胺四乙酸二钠(eathylenediaminetetraacetic acid disodium salt,EDTA-2Na)、TE缓冲液、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、NaCl 北京索莱宝科技有限公司;琼脂糖 美国Invitrogen公司。
1.1.3 培养基
MRS(de Man Rogosa and Sharp)琼脂培养基:每1 000 mL培养基中含有蛋白胨12 g、牛肉膏10 g、酵母浸膏5 g、无水醋酸钠5 g、吐温-80 1 mL、磷酸氢二钾2 g、七水硫酸镁0.5 g、四水硫酸锰0.25 g、柠檬酸二铵2 g、葡萄糖20 g、琼脂14~18 g,pH 7.0~7.2 [13]。
改良MRS琼脂培养基:在MRS培养基中添加0.75% CaCO 3,pH 7.0~7.2 [13]。
LB培养基:每1 000 mL培养基中含有蛋白胨10 g、酵母浸粉5 g、氯化钠10 g,pH 7.0~7.2。
1.2 仪器与设备
移液器 Eppendorf(中国)股份公司;PHS-3C雷磁pH计 上海精科仪器仪表公司;立式压力蒸汽灭菌锅 上海博迅实业有限公司;HC3018型高速冷冻离心机 安徽中科中佳科学仪器有限公司;DYCP-31DN型琼脂糖水平电泳仪(槽) 北京六一仪器厂;GEL DOC XR型凝胶成像分析系统 美国Bio-Rad公司;MDF-3286S型-80 ℃超低温冰箱 三洋电机(中国)有限公司。
1.3 方法
1.3.1 样品采集
使用无菌密封袋采集浆水样品,置于低温保温容器中带回实验室,振荡后静置3 min,将上清液分装入50 mL无菌离心管中,每个样品留下1 管进行乳酸菌分离,其余样品于4 ℃条件下,5 000×g离心10 min,收集沉淀备用。
1.3.2 浆水中细菌多样性分析
1.3.2.1 浆水中微生物基因组DNA提取
浆水中微生物基因组DNA提取采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法 [14]:将1.3.1节中于贮存备用的浆水沉淀采用CTAB法进行基因组DNA的提取,提取的DNA经0.7%琼脂糖凝胶电泳检测后,利用紫外分光光度计测定OD 260 nm进行定量,并考察OD 260 nm/OD 280 nm。
1.3.2.2 浆水中细菌多样性分析
浆水中细菌多样性分析采用MiSeq技术,委托上海美吉生物医药科技有限公司完成 [15-18]。
1.3.3 浆水中乳酸菌的分离、纯化与初步筛选
1.3.3.1 浆水中乳酸菌的分离
乳酸菌的分离采用稀释平板法 [19]:取1 mL浆水菌悬液,置于9 mL灭菌生理盐水中,混匀后从中取1 mL加入另一只9 mL灭菌生理盐水中,以此类推,将浆水稀释至原液的10 -9。然后,取各稀释度菌悬液各1 mL分别注入无菌培养皿中,接着向培养皿中加入融化并50 ℃保温的改良MRS琼脂培养基,在培养皿中将培养基与菌悬液快速混匀,静置,待培养基凝固后,37 ℃培养箱中培养36~48 h。
1.3.3.2 浆水中乳酸菌的纯化与初步鉴定
乳酸菌的纯化采样划线分离法 [19]:选取在上述改良MRS琼脂培养基中生长并产溶钙圈的单菌落,在改良MRS固体培养基的平皿中进行划线分离,37 ℃条件下培养48 h后。从中选取产溶钙圈的单菌落。然后对疑似菌株进行革兰氏染色,选取革兰氏染色阳性,菌株形态单一的进行进一步鉴定。
1.3.4 疑似乳酸菌对肠道致病菌的抑制作用
疑似乳酸菌的抑菌作用采用牛津杯法 [20]。以金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌和痢疾志贺氏菌4 种食源性致病菌为指示菌,将培养好的致病菌菌悬液加入无菌培养皿中,随后向平皿中注入约20 mL溶化后50 ℃水浴保温的LB固体培养基,摇动混匀,静置凝固后将无菌牛津杯放于培养基表面,使其与培养基无缝接触,然后将乳酸菌发酵培养物滤液注入牛津杯中,平皿放入37 ℃培养箱中培养24~48 h,测量抑菌圈直径大小。每组实验做4 个重复1 个对照。
1.3.5 疑似乳酸菌的鉴定
1.3.5.1 乳酸菌的DNA提取
菌株DNA的提取采用CTAB法 [21]。将待鉴定菌株在液体MRS培养基中培养48 h后收集菌体,然后采用CTAB法对疑似乳酸菌基因组DNA进行抽提与纯化,提取的DNA通过0.7%的琼脂糖凝胶电泳检测,DNA溶液置于-20 ℃冰箱中保存备用。
1.3.5.2 乳酸菌的16S rDNA的PCR扩增与测序
以乳酸菌基因组DNA为模板,采用通用引物27f(5’-AGAGTTTGATCCTGGCTCAG-3’)和1495r(5’-CTACGGCTACCTTGTTACGA-3’)进行乳酸菌16S rDNA的PCR扩增 [21-22]。PCR扩增程序为:94 ℃预变性4 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1.5 min,35 个循环;72 ℃延伸10 min。PCR结束后,以1.0%的琼脂糖凝胶进行电泳检测。对于电泳结果显示条带大小与理论值相符者,用凝胶回收试剂盒进行回收,然后送至上海立菲生物技术有限公司(北京)测序。
1.3.5.3 乳酸菌的16S rDNA序列分析与菌株鉴定
16S rDNA序列分析采用在线BLASTN法,将双向测序并拼接得到的16S rDNA序列在NCBI数据库中采用BLASTN比对,进行同源性分析鉴定。
2.1 浆水中细菌多样性分析
2.1.1 浆水中DNA提取预定量
3 种不同来源浆水中总DNA的质量浓度分别为:XA_yanta 104.50 ng/μL、XA_changan 204.11 ng/μL、TS_taian 71.59 ng/μL。琼脂糖凝胶电泳显示RNA处理效果比较理想(数据未展示),且OD 260 nm/OD 280 nm均介于1.8~2.0之间,可进行下一步工作。
2.1.2 浆水中细菌多样性分析
2.1.2.1 Shannon-Wiener曲线

图1 Shannon-Wiener曲线
Fig.1 Shannon-Wiener curve
Shannon-Wiener是反映样本中微生物多样性的指数,利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线,反映各样本在不同测序数量时的微生物多样性 [23]。当曲线趋向平坦时,说明测序数据量足够大,可以反映样本中绝大多数的微生物信息。本次细菌多样性分析的测序深度曲线见图1,各样品的微生物多样性指数很快便达到一定数值,并不再随测序量增大而增大,曲线趋向平坦,故说明测序数据量足够大,可以反映样本中绝大多数的微生物信息。
2.1.2.2 操作分类单元(operational taxonomic units,OTU)聚类分析与不同样品间细菌多样性比较
Venn图可用于统计多个样本中所共有和独有的OTU数目,可以比较直观地表现样本的OTU数目组成相似性及重叠情况 [24]。通常情况下,分析时选用相似水平为97%的OTU样本表,按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,共得到OTU的代表序列43 个(数据未展示),并通过作Venn图来比较样品间细菌多样性的异同(图2)。由图2可知,3 个样品之间既有共存细菌,也有独自存在的细菌。
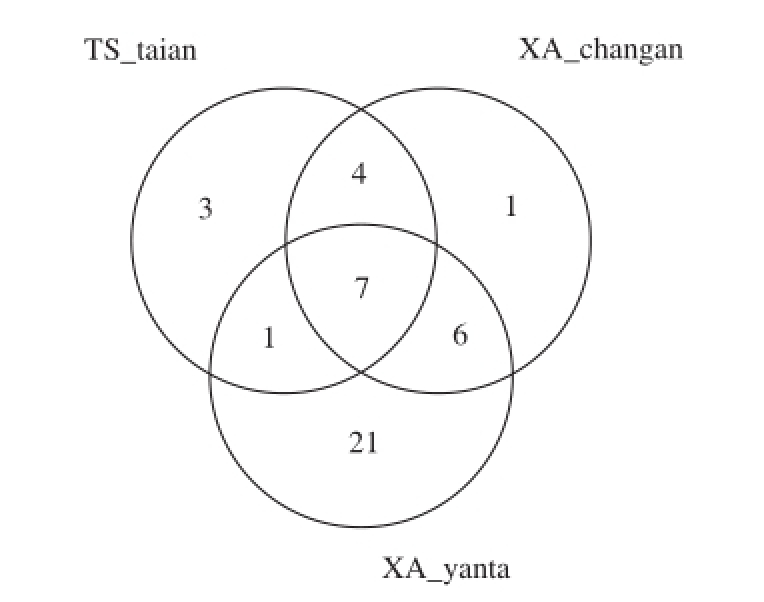
图2 OTU比较Venn图
Fig.2 Venn chart of OTU comparison among three samples
2.1.2.3 细菌群落结构分析

图3 各样品的菌种分布扇形图
Fig.3 Sector diagram for the distribution of bacterial species in three samples

图4 样品菌种分布柱状图
Fig.4 Bar graph showing the distribution of bacterial species in three samples
采用核糖体数据库工程分类贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在种属水平统计了每个样品的群落组成。由图3、4可知,3 种浆水中主要菌群为乳杆菌(Lactobacillus),尤其是浆水XA_ changan和浆水TS_taian中乳杆菌达到98%以上,两种浆水在细菌多样性组成上比较接近,浆水XA_yanta中乳杆菌也达到70%以上。此外,浆水XA_changan中还存在极少量的醋酸杆菌(Acetobacter,0.04%)和链球菌(Streptococcus,0.03%);浆水TS_taian中还存在少量醋酸杆菌(1.07%)和魏斯氏菌(Weissella,0.01%);而浆水XA_yanta还含有14.71%的魏斯氏菌、5.70%的链球菌、4.94%的乳球菌(Lactococcus)及4.43%的其他细菌。通过比较分析,来自西安长安区和来自天水泰安的浆水细菌多样性比较相似,而且多样性很简单,但是西安雁塔区的浆水与它们相比,多样性存在较大差异,而且西安雁塔区浆水中的细菌多样性比较复杂。
2.1.2.4 浆水样品中群落结构多样性分析
为检测不同浆水细菌多样性种类的异同,通过热图(Heatmap)分析了不同样品中的细菌多样性信息,如图5所示,不同颜色代表菌种OTU数目占总体OTU数目的百分比,纵轴显示菌种的种类,该图更清晰地展示了3 种浆水样品中的细菌组成。其中,TS_taian浆水中的有乳杆菌属、醋酸杆菌属、嗜热菌属及假单胞菌属等。XA_changan浆水中有乳杆菌属、链球菌属、克雷伯氏菌属、索氏菌属、假单胞菌及不动杆菌属等。而XA_yanta浆水细菌多样性最丰富,有乳杆菌属、魏斯氏菌属、链球菌属、乳球菌属、微小杆菌属、克雷伯氏菌属、不动杆菌属、气单胞菌属、梭状芽孢杆菌、明串珠菌属、固氮菌、月形单胞菌属、拟杆菌属、库特氏菌属及醋酸杆菌属等。

图5 常规群落结构Heatmap图
Fig.5 Heatmap for the structure of bacterial communities in three samples
2.2 乳酸菌的分离与纯化
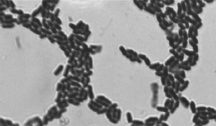
图6 菌株WZS_013的革兰氏染色(×1 000)
Fig.6 Microscopic observation of strain WZS_013 after Gram staining (× 1 000)
将梯度稀释的浆水菌悬液采用倾注法进行分离后,选取在改良MRS培养基产生溶钙圈的单菌落进一步在改良MRS进行划线分离,优先选择稀释度高和菌落形态有差异的。然后,将划线分离后依然产生溶钙圈的单菌落进行斜面划线培养后保藏,共得到35 株疑似乳酸菌。同时进行革兰氏染色,染色结果显示菌体均呈革兰氏染色阳性,且菌体形态单一,菌株之一WZS_013的显微图像见图6。
2.3 疑似乳酸菌对肠道致病菌的抑制作用
表1 疑似乳酸菌对食源性致病菌的抑菌圈
Table1 Inhibitory effects of possible lactic acid bacteria against foodborne pathogens

?
通过牛津杯法测定35 株疑似乳酸菌对4 种食源性致病菌的抑菌圈大小,如表1所示,对数据进行整理分析后发现菌株WZS_001、WZS_002、WZS_003、WZS_005、WZS_007、WZS_012、WZS_013、WZS_025、WZS_026、WZS_029对4 种致病菌抑制能力较强,因此,挑选出来对其进行菌种鉴定。
2.4 疑似乳酸菌16S rDNA的PCR扩增及菌种鉴定
2.4.1 疑似乳酸菌基因组DNA提取
由图7可知,8 株疑似乳酸菌的基因组DNA条带单一,大小比较理想,质量较好(另外2株菌DNA电泳效果和此8 株相似,未提供图谱),可以作为模板用于PCR扩增反应。

图7 疑似乳酸菌基因组DNA琼脂糖凝胶电泳
Fig.7 Agarose gel electrophoresis of genomic DNA of possible lactic acid bacteria
2.4.2 疑似乳酸菌16S rDNA的PCR扩增

图8 疑似乳酸菌16S rDNA基因PCR扩增产物的琼脂糖凝胶电泳
Fig.8 Agarose gel electrophoresis of 16S rDNA PCR products of possible lactic acid bacteria
以CTAB法提取的基因组DNA为模板,利用扩增细菌16S rDNA的通用引物27f和1495r进行16S rDNA的PCR扩增。由图8可知,PCR扩增片段大小约在1 500 bp位置,与理论值接近。
2.4.3 疑似乳酸菌的16S rDNA序列比较分析与鉴定
将疑似乳酸菌的16S rDNA测序所得序列(数据未展示)在NCBI网站进行在线BLASTN比对,比对结果显示菌株WZS_001、WZS_002、WZS_003、WZS_005、WZS_007、WZS_025、WZS_026、WZS_029这8 株菌与植物乳杆菌WCFS1相似度达100%,被鉴定为植物乳杆菌;菌株WZS_012和WZS_013与鼠李糖乳杆菌有大于94%的相似水平,被鉴定为鼠李糖乳杆菌。
当前对浆水的研究依然主要集中在发酵制作工艺 [25]与对其中益生菌乳酸菌分离、筛选及功能性研究方面 [26-29],乳酸菌新的功能及代谢活性被继续挖掘,如降胆固醇 [26]、γ-氨基丁酸 [28]、亚硝酸 [29]等。但是,对于浆水中微生物的复杂性的分析及安全性的评价尚少。
对于浆水中细菌多样性的测定,本研究通过测定细菌16S rDNA的可变区的核苷酸序列,比较分析结果显示,浆水中的细菌以乳杆菌为主,这与其他学者的研究结果相符 [27-29],但是不同的采集地的浆水中的细菌多样性并不一致。由图3~5可知,TS_taian浆水和XA_changan浆水中乳杆菌占绝大多数(98%以上),其他杂菌无论是种类还是所占比例均非常小;XA_yanta浆水相对前两种浆水,乳杆菌所占比例较低(70.22%)。而且除了乳杆菌,其他菌在种类上也存在较大差异,TS_taian浆水(含乳杆菌和醋酸杆菌)和XA_changan(含乳杆菌和魏斯氏菌)除了两类尚无有害报道的细菌外,都含有一种可能的致病菌(或者条件致病菌)或者其他暂时无法确定是否有害的菌;而XA_yanta浆水中除了含有的乳杆菌和魏斯氏菌,其他的可能致病菌较前两种浆水种类更多,在菌数上所占比例也较大,这可能因为其所处的发酵时期不一样,XA_yanta浆水的发酵时间较另外两种要短。尽管3 种浆水中具有益生功能的乳酸菌都占了绝大多数,但是其中依然有其他腐败菌及致病菌(或条件致病菌)的存在,如克雷伯氏菌属、不动杆菌属、气单胞菌属等。李雪萍等 [12,26-27]研究也发现浆水中还存在霉菌和肠道菌等有害菌的污染,不利于浆水的发酵和保存,对食品的安全性存在风险,因此很有必要对浆水进行标准化、规范化生产。
对乳酸菌的分离,本研究通过半选择性的改良MRS培养基进行初步筛选,这样,具有产酸能力并且酸性强于碳酸的菌株就会溶解培养基中的碳酸钙而形成溶钙圈,然后对其进行抑菌实验,筛选出抑菌能力强的菌株进行测序鉴定。由于乳酸菌分离采用梯度稀释法从高稀释度中选出,抑菌效果佳,而且测序比对结果显示,筛选出的菌均为植物乳杆菌和鼠李糖乳杆菌,为浆水优势菌,该2 种菌当前公认为安全,因此可以用于浆水及相关食品的发酵生产。
本研究中对浆水中细菌多样性的检测是针对16S rDNA的V3~V4区域进行扩增后测序得到,采用的是二代测序技术,因此,能对细菌多样性的分析尚未鉴定到种,随着测序技术的发展,测序精度和深度不断进步,对序列分析的软件也将不断地发展,这必将会大大地推动对不同样品中微生物多样性分析的深度和广度。
本研究从浆水中细菌的多样性方面揭示了浆水样品中存在着不同类群的细菌,尽管传统的自然发酵食品已经盛行很久,并且由于发酵过程中参与的微生物比较多,会增加一些特异性的风味,但是由于自然发酵食品不可避免的可能被污染,基于食品安全的考虑,自然发酵食品在食用前应尽量进行安全性的检测与评估,或者选用已知的益生乳酸菌纯种发酵或多种混合发酵进行浆水生产,将会大大减少食品安全风险,也必将成为一种发展趋势。因此,今后研究将分别考察不同的乳酸菌在浆水发酵中的风味的影响,筛选出合适的乳酸菌进行纯种发酵或混合菌发酵。
参考文献:
[1] 管有根. 酸浆水点浆工艺生产塘坞豆制品[J]. 中国酿造, 2007, 26(5): 69-70. DOI:10.3969/j.issn.0254-5071.2007.05.019.
[2] 侯智勇, 杨静, 贾洪锋, 等. 传统发酵食品: 浆水菜研究概况及研究前景[J]. 中国调味品, 2015, 40(2): 132-136. DOI:10.3969/ j.issn.1000-9973.2015.02.031.
[3] 孟宪刚, 张丽珂, 周鸽鸽, 等. 传统发酵食品: 浆水研究概况及发展前景展望[J]. 食品工业科技, 2010, 31(10): 402-404. DOI:10.13386/ j.issn1002-0306.2010.10.084.
[4] 张基亮, 何欣, 李元敬, 等. 细菌纤维素减肥功能测定及其酸奶的制作[J]. 食品科学, 2013, 34(12): 61-66. DOI:10.7506/spkx1002-6630-201312013.
[5] 赵树欣. 应重视对我国传统发酵食品的研究: 兼论发酵食品中的功能成分[J]. 中国食物与营养, 2004, 9(1): 27-29. DOI:10.3969/ j.issn.1006-9577.2004.01.010.
[6] JEUN J, KIM S, CHO S Y, et al. Hypocholesterolemic effects of Lactobacillus plantarum KCT3928 by increased bile acid excretion in C57BL/6 mice[J]. Nutrition, 2009, 26(3): 321-330. DOI:10.1016/ j.nut.2009.04.011.
[7] WANG Y, XU N, XI A, et al. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-vholesterol diet[J]. Applied Microbiology and Biotechnology, 2009, 84(2): 341-347. DOI:10.1007/s00253-009-2012-x.
[8] LEROY F, de VUYST L. Lactic acid bacteria as functional starter cultures for the food fermentation industry[J]. Food Science and Technology, 2004, 15(2): 67-78. DOI:10.1016/j.tifs.2003.09.004.
[9] MOLLET B. Genetically improved starter strains: opportunities for the dairy industry[J]. International Dairy Journal, 1999, 9(1): 11-15. DOI:10.1016/S0958-6946(99)00039-4.
[10] CHAMPAGEN P P, TOMPKINS T A, BUCKLEY N D, et al. Effect of fermentation by pure and mixed cultures of Streptococcus thermophilus and Lactobacillus helveticus on isof l avone and B-vitamin content of a fermented soy beverage[J]. Food Microbiology, 2010, 27(7): 962-972. DOI:10.1016/j.fm.2010.06.003.
[11] 张轶, 王玉丽, 陈晓前, 等. 传统发酵食品: 浆水中微生物的分离与初步鉴定[J]. 食品科学, 2007, 28(1): 219-222. DOI:10.3321/ j.issn:1002-6630.2007.01.052.
[12] 李雪萍, 李建宏, 孟宪刚. 西北浆水中兼性厌氧菌的分离与鉴定[J]. 食品工业科技, 2014, 35(12): 213-217. DOI:10.13386/ j.issn1002-0306.2014.12.038.
[13] ZHOU N, ZHANG J X, FAN M T, et al. Antibiotic resistance of lactic acid bacteria isolated from Chinese yogurts[J]. Journal of Dairy Science, 2012, 95: 4775-4783. DOI:10.3168/jds.2011-5271.
[14] 刘冬梅, 李理, 杨晓泉, 等. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发, 2006, 27(3): 110-111. DOI:10.3969/ j.issn.1005-6521.2006.03.044.
[15] FADROSH D W, MA B, GAJER P, et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J]. Microbiome, 2014, 2: 6-12. DOI:10.1186/2049-2618-2-6.
[16] SHAUFI M A M, SIEO C C, CHONG C W, et al. Deciphering chicken gut microbial dynamics based on high-throughput 16S rRNA metagenomics analyses[J]. Gut Pathogens, 2015, 7: 4-15. DOI:10.1186/s13099-015-0051-7.
[17] CAPORASO J G, LAUBER C L, WALTERS W A, et al. Ultra-highthroughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. The International Society for Microbial Ecology Journal, 2012, 6: 1621-1624. DOI:10.1038/ismej.2012.8.
[18] KOZICH J J, WESTCOTT S L, BAXTER N T, et al. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied and Environmental Microbiology, 2013, 79: 5112-5120. DOI:10.1128/AEM.01043-13.
[19] 张小美, 楼秀玉, 顾青. 1 株产细菌素乳酸菌的鉴定和细菌素的分离纯化[J]. 中国食品学报, 2013, 13(12): 181-186. DOI:10.16429/j.1009-7848.2013.12.039.
[20] 周延清. DNA分子标记技术在植物研究中的应用[M]. 北京: 化学工业出版社, 2005: 9-34. DOI:10.3969/j.issn.1004-3268.2008.06.004.
[21] 李睿, 沈汪洋, 翟平平, 等. 观音土曲乳酸菌的分离与分子鉴定[J]. 安徽农业科学, 2011, 39(4): 1891-1892. DOI:10.3969/ j.issn.0517-6611.2011.04.001.
[22] 曲丰发, 蔡畅, 郑献进, 等. 16S rDNA建立种特异性PCR快速检测鸭疫里默氏菌[J]. 微生物学报, 2006, 46(1): 13-17. DOI:10.3321/ j.issn:0001-6209.2006.01.004.
[23] WANG Y, SHENG H F, H Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of Illumina tags[J]. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271. DOI:10.1128/ AEM.01821-12.
[24] FOUTS D E, SZPAKOWSKI S, PURUSHE J, et al. Next generation sequencing to define prokaryotic and fungal diversity in the bovine rumen[J]. PLoS ONE, 2012, 7(11): 1-11. DOI:10.1371/journal. pone.0048289.
[25] 侯智勇, 黄文刚, 孙晋康, 等. 川北地区浆水菜传统发酵工艺的初步研究[J]. 中国调味品, 2015, 40(7): 100-103. DOI:10.3969/ j.issn.1000-9973.2015.07.022.
[26] 李雪萍, 李建宏, 李敏权, 等. 浆水中降胆固醇乳酸菌的筛选及其功能特性[J]. 微生物学报, 2015, 55(8): 1001-1009. DOI:10.13343/ j.cnki.wsxb.20140585.
[27] 李雪萍, 李建宏, 孟宪刚, 等. 浆水中微生物的分离与鉴定[J]. 食品科学, 2014, 35(23): 204-209. DOI:10.7506/spkx1002-6630-201423040.
[28] 刘佳荣, 梁金钟. 黄浆水中高产γ-氨基丁酸乳酸菌的筛选及鉴定[J]. 食品科学, 2014, 35(23): 221-225. DOI:10.7506/spkx1002-6630-201423043.
[29] 孟宪刚, 李雪萍, 李建宏, 等. 浆水中乳酸菌分离鉴定及其代谢特性的初步研究[J]. 食品工业科技, 2015, 36(1): 181-187. DOI:10.13386/ j.issn1002-0306.2015.01.029.
Bacterial Diversity Analysis and Isolation and Identi fi cation of Lactic Acid Bacteria from Jiangshui, a Traditional Chinese Fermented Vegetable Product
ZHANG Xiaohui, YANG Jingpeng, WANG Shaojun, WANG Jing, FAN Mingtao, WEI Xinyuan
*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Abstract:In this study, the bacterial diversities in three Jiangshui (a traditional Chinese fermented vegetable product) samples collected from three different locations were analyzed in order to isolate lactic acid bacteria for massive production of Jiangshui. The dominant lactic acid bacteria with a significant bacteriostatic effect against four common foodborne pathogens were isolated and identif i ed from the Jiangshui samples. Total bacterial DNA was extracted from Jiangshui for sequencing of the 16S rRNA V3–V4 region using the MiSeq sequencing technique to understand the bacterial diversity. The results showed that Lactobacillus was dominant in all three Jiangshui samples, showing differences in their bacterial diversity. The compositions of bacterial communities in Jiangshui samples from Chang’an district of Xi’an and Taian county of Tianshui were similar, but significantly different from that of the sample from Yanta district of Xi’an. Both spoilage bacteria and potential pathogens (or opportunistic pathogens) were detected in each sample. A total of 35 stains able to form calcium dissolution circle, were isolated using a modified MRS medium. Ten strains were selected for their outstanding inhibitory activity against Staphylococcus aureus, Escherichia coli, Salmonella enteritidis and Shigella dysenteriae, which were identified through 16S rDNA sequencing as 8 strains of Lactobacillus plantarum and 2 strains of Lactobacillus rhamnosus, indicating that Lactobacillus plantarum and Lactobacillus rhamnosus are the dominant bacteria in Jiangshui. This study can provide some theoretical and practical bases for the production of Jiangshui by applying both lactic acid bacteria or one of them in the future.
Key words:Jiangshui; bacterial diversity; lactic acid bacteria
DOI:10.7506/spkx1002-6630-201704012
中图分类号:Q935
文献标志码:A
文章编号:1002-6630(2017)04-0070-07
收稿日期:2016-04-10
基金项目:公益性行业(农业)科研专项(201503142-10);陕西省农业科技创新与攻关项目(2016NY-148);西北农林科技大学基本科研业务费专项(QN2011138);大学生创新创业训练计划项目(201410712078)
作者简介:张晓辉(1993—),本科生,研究方向为食品安全与食品高新技术。E-mail:zhangxiaohui9641@163.com
*通信作者:魏新元(1971—),副教授,博士,研究方向为食品安全与食品高新技术。E-mail:wheixinyuan@126.com
引文格式:
张晓辉, 杨靖鹏, 王少军, 等. 浆水中细菌多样性分析及乳酸菌的分离鉴定[J]. 食品科学, 2017, 38(4): 70-76.
DOI:10.7506/spkx1002-6630-201704012. http://www.spkx.net.cn
ZHANG Xiaohui, YANG Jingpeng, WANG Shaojun, et al. Bacterial diversity analysis and isolation and identif i cation of lactic acid bacteria from Jiangshui, a traditional Chinese fermented vegetable product[J]. Food Science, 2017, 38(4): 70-76. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201704012. http://www.spkx.net.cn