 。
。
顾 双,陈俊霖,王向阳 *
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
摘 要:为了解市场上霉菌发酵食品能否扩增霉菌DNA,除了红曲霉外其他曲霉是否具有pksCT基因,以及加热灭菌条件对红曲黄酒中pksCT基因降解的影响。从市售的11 种食品中提取DNA,选用ITS基因引物和pksCT基因引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并电泳分析。分别用麦曲、红曲发酵黄酒,对发酵前、发酵中、灭菌后、贮藏期样品扩增pksCT基因并测定橘霉素质量浓度;选择灭菌温度70、80、90、100 ℃,灭菌时间10、20、30 min,灭菌后样品扩增pksCT基因。结果表明有4 种食品能用ITS引物扩增出条带,但只有红曲霉发酵的红腐乳能扩增出pksCT基因。红曲黄酒在发酵中、灭菌后能够扩增出pksCT基因,并且在80 ℃灭菌20 min和90 ℃灭菌10 min条件下,仍然可以扩增出pksCT基因,但90 ℃灭菌20 min或100 ℃灭菌10 min,DNA受到破坏。红曲霉发酵食品能够扩增出pksCT基因,曲霉发酵的食品未能用pksCT基因引物扩增出条带。通过PCR方法扩增出部分霉菌发酵食品的霉菌DNA并测序,有助于了解其加工中使用的菌种,继而为发酵加工食品的终端监测提供一种新方法。
关键词:霉菌;发酵;pksCT基因;DNA;橘霉素
橘霉素亦称橘青霉素,抗菌素的一种,是真菌的一种次级代谢产物
[1],主要由青霉、曲霉及红曲霉等真菌产生
[2-3]。橘霉素对人体危害极大,具有肾毒性
[4],能导致肿瘤,甚至诱发突变
[5-6]。橘霉素广泛存在于人们日常生活的各类食品中
[7-9],如由红曲霉、曲霉发酵而成的腐乳、酱油、黄酒类等酿造食品中
[10],以红曲色素为食品添加剂的肉制品、鱼制品、蔬菜腌制品中及各类生鲜水果蔬菜中
[11]。而多数霉菌发酵的食品在加工后仍含有较高含量的橘霉素,且降解效果并不是十分理想,有研究表明橘霉素的某些降解产物也带有相当的毒性,如橘霉素H、
 。
。
1
研究者多从分子水平上着手,选育不产橘霉素的红曲霉菌种 [13-14]。Shimizu等 [15]于2005年从紫色红曲菌中首次克隆得到了一个与生物合成橘霉素相关的基因—pksCT基因。2008年付桂明等 [16]选取7 种共14 株产橘霉素的红曲菌,运用基因组聚合酶链式反应(polymerase chain reaction,PCR)分析方法,对pksCT基因进行保守性分析,认为其具有高度同源性,普遍存在于产橘霉素的红曲菌中。自从pksCT基因被报道以后,学者开始应用生物技术来筛选菌种,通过基因和代谢调控橘霉素的产生。丁月娣 [17]通过农杆菌介导法转化红色红曲霉,并对T-DNA进行扩增分析,研究产橘霉素的相关基因。Hajjan等 [18]认为橘霉素与红曲色素开始于同一个生物合成途径。目前对pksCT基因的报道仅限于红曲霉属霉菌,其他曲霉是否也有pksCT基因并不清楚。本研究利用霉菌的ITS序列扩增霉菌发酵食品的DNA,并用pksCT基因引物对曲霉发酵食品的DNA进行PCR扩增,以期了解除了红曲霉外,其他曲霉是否有pksCT基因,发酵加工食品中能否扩增出霉菌DNA。
1.1 材料与试剂
11 个不同品牌或同品牌不同类型发酵食品(酱油1、酱油2、黄酒1、黄酒2、黄酒3、米醋1、米醋2、米醋3、腐乳1、腐乳2、腐乳3)购自浙江杭州联华超市;黄酒曲1、黄酒曲2为网上购买。
Taq DNA聚合酶、DNA Marker、dNTPs Takara宝生物技术有限公司;缓冲液50×TAE、6×loading buffer杭州昊天生物技术有限公司;核酸染料 上海赛北盛生物技术有限公司;引物由上海英骏生物技术有限公司合成。
1.2 仪器与设备
TC-XP-G PCR扩增仪 杭州博日科技有限公司;DYY-2C电泳仪 北京市六一仪器厂;蛋白印迹检测系统 美国Bio-Rad公司;LC-20A高效液相色谱仪 日本Shimadzu公司;SHZ-82恒温振荡器 常州国华电器有限公司。
1.3 方法
1.3.1 市售霉菌发酵食品样品处理
分别取30 mL黄酒、酱油、米醋以及30 g腐乳在45 ℃条件下旋蒸浓缩后,提取DNA,选用ITS和pksCT基因引物,进行PCR扩增,电泳并凝胶成像分析。
1.3.2 黄酒加工各时期pksCT基因扩增处理
黄酒发酵分别使用黄酒曲1(含有熟麦曲、酵母、淀粉酶等,黄绿色)和黄酒曲2(含有红曲霉等,棕红色),曲-米质量比1∶20,发酵20 d。使用黄酒曲1的发酵酒为黄色,使用黄酒曲2的发酵酒为红色。分别取黄酒发酵前(未添加酒曲)、发酵中(发酵10 d的料液)、发酵结束(80 ℃条件下灭菌10 min)和贮藏期(灭菌后7 d)4 个阶段的黄酒10 mL,无菌水稀释至30 mL,4 ℃条件下8 000 r/min离心5 min,弃上清液,收集沉淀,冰浴条件下研磨,样品提取DNA,选用pksCT基因引物,PCR扩增后电泳凝胶成像,并测定各阶段对应的橘霉素质量浓度。
1.3.3 红曲黄酒灭菌温度和时间对PCR扩增的影响
由于黄酒曲1发酵的黄酒,未能得到清晰的pksCT基因条带,此处样品选择黄酒曲2发酵的黄酒。分别选用70、80、90、100 ℃灭菌10、20、30 min的黄酒样品,提取DNA,用pksCT基因引物进行PCR扩增,扩增后电泳凝胶成像。
1.3.4 DNA的提取
采用真菌提取DNA试剂盒提取。
1.3.5 ITS基因引物的PCR扩增
参考文献:[19],分别以黄酒、米醋、腐乳及酱油中提取的DNA为模板,以18S rRNA为靶基因进行PCR扩增。其引物序列为pITS1:5’-TCCGTAGGTGAACCTGCGG-3’和pITS4:5’-TCCTCCGCTTATTG ATATGC-3’。扩增条件为:95 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1 min,31 个循环;72 ℃延伸10 min。扩增体系(50 µL)为:5 µL 10×PCR buffer、5 µL dNTPs (2.0 mmol/L)、4 µL MgCl 2(25 mmol/L)、1.0 µL引物(10 μmol/L)、5 µL模板基因组DNA(50 ng/μL)、0.5 µL Taq酶(5.0 U/ μL)、28.5 µL无菌水。
1.3.6 pksCT基因引物的PCR扩增
参照GenBank中公布的紫色红曲菌中pksCT基因序列(No. AB167465)设计引物 [14],引物序列为K(5’-GGGGATCCCCGAAGGAGATAAACAGTGAG AG-3’)和L(5’-GCTCATGAAGGCGTTGATGAGATG TAG-3’)。扩增条件为:94 ℃预变性3 min;94 ℃变性1 min、56 ℃梯度温度退火1 min、72 ℃延伸1 min、30 个循环;72 ℃延伸10 min。扩增体系(20 µL)为:2 µL 10×PCR buffer、2 µL dNTPs(2.0 mmol/L)、1.6 µL MgCl 2(25 mmol/L)、1.0 µL引物(10 μmol/L)、2 µL模板基因组DNA(50 ng/μL)、Taq酶(5.0 U/μL)0.2 µL、无菌水10.2 µL。
1.3.7 PCR扩增片段电泳分析
PCR产物用2.0%的琼脂糖凝胶电泳分析,电泳电压为100 mV,时间30 min,电泳结束后,用Quanity One分析软件对上述电泳完成的琼脂糖凝胶进行成像处理。
1.3.8 黄酒酿制各阶段的橘霉素质量浓度测定
橘霉素检测参照Franco等 [20]的高效液相色谱法。色谱条件为:色谱柱Hypersil ODS 2(250 mm×4.6 mm,5 µm);流动相为乙腈(色谱纯)及体积分数60%三氟乙酸;RF-20A荧光检测器激发波长331 nm,发射波长500 nm;柱温25 ℃;流速1.0 mL/min;进样量10 μL。
1.4 数据统计分析
实验重复3 次,用Microsoft Off i ce 2007 Excel软件进行平均数和标准偏差的计算,结果表示为±s。
2.1 霉菌发酵食品中ITS基因引物扩增结果

图1 酱油、米醋、腐乳及黄酒ITS 基因引物的PCR产物电泳图
Fig.1 Agarose gel electrophoresis of PCR amplif i ed products with ITS gene primer of DNA extracts from soy sauce, rice vinegar, fermented bean curd and yellow rice wine
如果ITS基因引物能扩增出条带,说明存在真菌的DNA,并且该基因的DNA序列还是完好的。ITS序列可用于对真菌的不同生物型、菌株、种、属进行分类鉴定,其序列长度600~800 bp [21-22]。泳道1、5、8、11在750~1 000 bp之间相同位置都出现很亮的条带。酱油1、米醋3、腐乳3、黄酒3这4 个产品PCR扩增效果好,说明这些加工产品中霉菌的DNA还没有分解。未来可以利用PCR技术,进一步基因测序对加工中所用的霉菌进行鉴定(图1)。
2.2 pksCT基因引物的PCR扩增结果
对ITS能够扩增的米醋、腐乳、酱油、黄酒这4 种产品经pksCT基因引物进行PCR扩增后,发现只有泳道2在700 bp左右处出现了很亮的条带。这与资料中显示pksCT基因长度为684 bp相吻合 [14]。红色腐乳有红曲霉,能扩增出pksCT基因 [23-24]。而米醋、酱油、黄酒都没有红曲霉,只有曲霉等,曲霉合成橘霉素的基因也许与红曲的pksCT基因有差异,因此难以用该引物扩增出条带;也可能因为加热灭菌等处理致使DNA降解,导致PCR扩增失败。
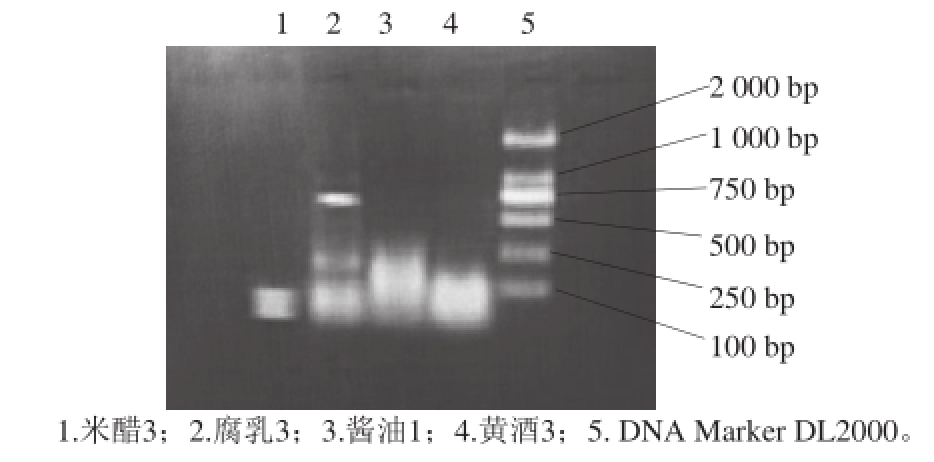
图2 酱油、米醋、腐乳及黄酒的pksCT 基因引物的PCR产物电泳图
Fig.2 Agarose gel electrophoresis of PCR amplif i ed products with pksCT gene primer of DNA extracts from soy sauce, rice vinegar, fermented bean curd and yellow rice wine
2.3 红曲黄酒酿制过程中的pksCT基因扩增和橘霉素质量浓度结果

图3 不同加工时期黄酒pksCT 基因的PCR产物电泳图
Fig.3 Agarose gel electropheresis of PCR amplif i ed products with pksCT gene primer of DNA extracts from yellow rice wine at different processing stages
表1 不同黄酒加工时期的橘霉素质量浓度
Table1 Citrinin contents of yellow rice wine at different processing stages

加工时期橘霉素质量浓度/(µg/mL)发酵前0.001 3±0.000 0发酵中1.169 0±0.014 3灭菌后1.487 0±0.016 1保藏期1.502 0±0.032 4
使用黄酒曲1(曲霉)发酵的麦曲黄酒没有扩增出清晰的pksCT基因,而使用黄酒曲2(红曲霉)发酵的红曲黄酒能够扩增出pksCT基因条带。由图3、表1可知,红曲黄酒在发酵前没有扩增出pksCT基因片段,而发酵过程中及灭菌后都出现了该片段。相应的发酵前橘霉素质量浓度极低,发酵过程及灭菌后橘霉素质量浓度大幅度上升。pksCT基因经过80 ℃灭菌后,还是能够保持稳定,橘霉素同样继续存在。在黄酒灭菌后第7天,未能扩增出pksCT基因,说明其已被降解,此时橘霉素质量浓度稍高于灭菌后,说明橘霉素比较稳定 [25]。
2.4 红曲黄酒灭菌温度和时间对pksCT基因的影响

图4 不同加热灭菌条件后黄酒pksCT基因PCR产物电泳图
Fig.4 Agarose gel electropheresis of PCR amplif i ed products with pksCT gene primer of DNA extracts from yellow rice wine under different thermal sterilization conditions
由图4可知,发酵后的红曲黄酒在70、80 ℃条件下处理10、20 min,90 ℃条件下处理10 min,能够扩增出pksCT基因;但90 ℃条件下处理20 min及100 ℃条件下处理10 min,均未能扩增出pksCT基因,说明强度较低的热杀菌可以保留霉菌DNA模板基因组。市售的一些产品能够保留霉菌DNA序列,而本实验室制备的红曲黄酒贮藏7 d后,霉菌DNA序列已经分解,可能与制备完成后没有严格密封有关。
市场上部分黄酒、米醋、腐乳、酱油样品能扩增出真菌ITS特征基因,但只有红腐乳扩增出pksCT基因序列。这与红腐乳使用红曲霉发酵,而黄酒、米醋、酱油使用曲霉发酵有关。用pksCT基因序列引物不能扩增出非红曲霉发酵食品的pksCT基因,说明曲霉没有pksCT基因,或者其核酸序列不同于红曲霉pksCT的核酸序列,导致无法扩增出pksCT基因。两种黄酒发酵的霉菌酒药,添加红曲米酒药的黄酒能够扩增出pksCT基因,而添加麦曲酒药的黄酒未能扩增出pksCT基因。红曲黄酒在发酵过程及80 ℃灭菌20 min或90 ℃灭菌10 min灭完菌后的样品中可以扩增出pksCT基因,但是更强的灭菌条件,90 ℃灭菌20 min,将破坏pksCT基因。橘霉素主要在发酵过程产生,低强度灭菌橘霉素未能降解,红曲黄酒经过7 d常温贮藏,红曲霉的pksCT基因降解,而橘霉素未能降解。
参考文献:
[1] POÓR M, MATISZ G, KUNSÁGI-MÁTÉ S, et al. Fluorescence spectroscopic investigation of the interaction of citrinin with native and chemically modif i ed cyclodextrins[J]. Journal of Luminescence, 2016, 172: 23-28. DOI:10.1016/j.jlumin.2015.11.011.
[2] OSTRY V, MALIR F, RUPRICH J. Producers and important dietary sources of ochratoxin A and citrinin[J]. Toxins, 2013, 5(9): 1574-1586. DOI:10.3390/toxins5091574.
[3] FLAJS D, PERAICA M. Toxicological properties of citrinin[J]. Archives of Industrial Hygiene and Toxicology, 2009, 60(4): 457-464. DOI:10.2478/10004-1254-60-2009-1992.
[4] ZHOU Y X, CHEN J B, DONG L H, et al. A study of fl uorescence properties of citrinin in β-cyclodextrin aqueous solution and different solvents[J]. Journal of Luminescence, 2012, 132(6): 1437-1445. DOI:10.1016/j.jlumin.2012.01.005.
[5] 赖卫华, 许杨. 红曲霉产桔霉素的研究动态[J]. 食品科学, 2002, 23(7): 139-141. DOI:10.3321/j.issn:1002-6630.2002.07.037.
[6] 潘荣华, 郑立忠, 姜嘉善, 等. 红曲中桔霉素的检测及控制[J]. 现代生物医学进展, 2013, 13(36): 7160-7164.
[7] LIA Y, ZHOU Y C, YANG H M, et al. Natural occurrence of citrinin in widely consumed traditional Chinese food red yeast rice, medicinal plants and their related products[J]. Food Chemistry, 2012, 132(2): 1040-1045. DOI:10.1016/j.foodchem.2011.11.051.
[8] KONONENKO G P, BURKIN A A. A survey on the occurrence of citrinin in feeds and their ingredients in Russia[J]. Mycotoxin Research, 2008, 24(1): 3-6. DOI:10.1007/BF02985263.
[9] 江一菲, 徐渊金, 王钱, 等. 高效液相法检测几种米醋中的桔霉素含量[J]. 中国调味品, 2012, 37(6): 85-88. DOI:10.3969/ j.issn.1000-9973.2012.06.022.
[10] 王向阳, 陈俊霖, 王芳, 等. 食品中桔霉素含量的测定[J]. 中国调味品, 2014, 39(11): 108-111. DOI:10.3969/j.issn.1000-9973.2014.11.027.
[11] MARLEY E, BROWN P, LEEMAN D, et al. Analysis of citrinin in cereals, red yeast rice dietary supplement, and animal feed by immunoaff i nity column cleanup and LC with fl uorescence detection[J]. Journal of AOAC International, 2016, 99(4): 1025-1031. DOI:10.5740/ jaoacint.16-0060.
[12] XU B J, JIA X Q, GU L J, et al. Review on the qualitative and quantitative analysis of the mycotoxin citrinin[J]. Food Control, 2006, 17(4): 271-285. DOI:10.1016/j.foodcont.2004.10.012.
[13] 郭晓旭, 袁朝琪, 李国莹, 等. 高产Monacolin K纯种红曲培养条件的研究[J]. 工业微生物, 2016, 46(1): 27-30. DOI:10.3969/ j.issn.1001-6678.2016.01.005.
[14] 高红, 彭月菊, 李贞景, 等. 八种稻米基质对红曲重要代谢产物的影响[J]. 中国食品添加剂, 2015(4): 137-142. DOI:10.3969/ j.issn.1006-2513.2015.04.019.
[15] SHIMIZU T, KINOSHITA H, SAKAI K, et al. Polyketide synthase gene responsible for citrinin biosynthesis in Monascus purpureus[J]. Applied and Environmental Microbiology, 2005, 71(7): 3453-3457. DOI:10.1128/AEM.71.7.3453-3457.2005.
[16] 付桂明, 许杨, 李燕萍, 等. 产毒红曲菌中生物合成桔霉素基因: pksCT基因的保守性分析[J]. 食品科学, 2008, 29(3): 359-363. DOI:10.3321/j.issn:1002-6630.2008.03.076.
[17] 丁月娣. 红曲霉产桔霉素相关基因的初步研究[D]. 武汉: 华中农业大学, 2006: 26-38. DOI:10.7666/d.y1004815.
[18] HAJJAN H, KLAEBE A, LOERT M O, et al. Biosynthetic pathway of citrinin in the filamentous fungus Monascus ruber as revealed by l3C nuclear magnetic resonance[J]. Applied and Environmental Microbiology, 1999, 65(1): 311-314.
[19] 李旺军, 方华, 曹钰, 等. 不同破壁方法提取绍兴黄酒麦曲中的微生物总DNA[J]. 中国酿造, 2007, 26(4): 17-20. DOI:10.3969/ j.issn.0254-5071.2007.04.005.
[20] FRANCO C M, FENTE C A, VAZQUEZ B, et al. Simple and sensitive high-performance liquid chromatography fl uorescence method for the determination of citrinin-application to the analysis of fungal cultures and cheese extracts[J]. Journal of Chromatography, 1996, 723(1/2): 69-75. DOI:10.1016/0021-9673(95)00818-7.
[21] PINTO F C J, de LIMA D B, AGUSTINI B C, et al. Morphological and molecular identification of filamentous fungi isolated from cosmetic powders[J]. Brazilian Archives of Biology and Technology, 2012, 55(6): 897-901. DOI:10.1590/S1516-89132012000600013.
[22] ANDERSON I C, PARKIN P I. Detection of active soil fungi by RT-PCR amplification of precursor rRNA molecules[J]. Journal of Microbiological Methods, 2007, 68(2): 248-253. DOI:10.1016/ j.mimet.2006.08.005.
[23] 曹丽凌. 红曲霉T-DNA突变体库的构建、生物学特性分析及吉霉素合成基因的克隆[D]. 杭州: 浙江师范大学, 2013: 53-58.
[24] 张淑云, 黄志兵, 许杨, 等. 橙色红曲菌及其pksCT基因缺失株液态发酵产橘霉素及色素的变化[J]. 食品科学, 2014, 35(19): 148-152. DOI:10.7506/spkx1002-6630-201319032.
[25] 喜军, 鲁晓翔, 刘勤生, 等. 桔霉素的定性及定量测定方法研究进展[J]. 环境与健康杂志, 2007, 24(11): 935-937. DOI:10.3969/ j.issn.1001-5914.2007.11.035.
Mold DNA Amplif i cation from Traditional Mold Fermented Foods
GU Shuang, CHEN Junlin, WANG Xiangyang
*
(School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China)
Abstract:This study aimed to fi nd out whether mold DNA can be amplif i ed from traditional mold fermented foods and whether Aspergillus besides Monascus carries pksCT gene. The effect of thermal sterilization conditions on the degradation of the pksCT gene in red kojic rice wine was examined as well. Eleven samples of soy sauce, rice vinegar, fermented bean curd and yellow rice wine collected from local market were used for DNA extraction. Polymerase chain reaction (PCR) amplif i cation was carried out with internal transcribed spacer (ITS) and pksCT gene primers. Rice wine was fermented by wheat koji and red koji, respectively, and then the pksCT gene was amplif i ed and citrinin contents were measured before and during fermentation, after sterilization, and during storage. Samples were sterilized at 70, 80, 90, 100 ℃ for 10, 20, and 30 min, respectively, and then were subjected to PCR amplification. The results showed that DNA fragments were successfully amplified with the ITS primer from 4 samples, including soy sauce, rice vinegar, fermented bean curd and yellow rice wine. However, the pksCT gene was successfully amplif i ed only from red bean curd fermented by Monascus. We failed to amplify the pksCT gene from yellow rice wine fermented by wheat koji. The pksCT gene was successfully amplif i ed from red kojic rice wine during fermentation and after sterilization. Meanwhile, citrinin content increased rapidly at these sampling points. When red kojic rice wine was sterilized at 80 ℃ for 20 min or 90 ℃ for 10 min, the pksCT gene remained amplif i able, while after sterilization at 90 ℃ for 20 min or 100 ℃ for 10 min, DNA structure was damaged. The pksCT gene was amplif i able in Monascus fermented foods, but not in Aspergillus fermented foods. It is implied that mold DNA in fermented foods can be amplif i ed by PCR and sequenced, which may be helpful for inspectors to fi nd out what kinds of strains are contained in mold fermented foods, and provides a new terminal monitoring method for mold fermented foods.
Key words:mold; fermentation; pksCT gene; DNA; citrinin
DOI:10.7506/spkx1002-6630-201704014
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)04-0083-04
引文格式:
顾双, 陈俊霖, 王向阳. 传统霉菌发酵食品中的霉菌DNA扩增[J]. 食品科学, 2017, 38(4): 83-86. DOI:10.7506/spkx1002-6630-201704014. http://www.spkx.net.cn
GU Shuang, CHEN Junlin, WANG Xiangyang. Mold DNA amplif i cation from traditional mold fermented foods[J]. Food Science, 2017, 38(4): 83-86. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704014. http://www.spkx.net.cn
收稿日期:2016-05-03
基金项目:浙江省自然科学基金项目(LY15C200005)
作者简介:顾双(1991—),女,硕士研究生,研究方向为农产品贮藏与加工。E-mail:gushuang025@163.com
*通信作者:王向阳(1966—),男,教授,博士,研究方向为果蔬贮藏保鲜与保健食品。E-mail:wxy200228@sina.com