李 雪,白新鹏 *,曹 君 *,赵 晔,武林贺,张宇翔,马若影
(海南大学食品学院,生物活性物质与功能食品开发重点实验室,海南 海口 570228)
摘 要:以仙人掌果汁为原料,添加SY型安琪酵母进行恒温发酵并对其发酵动力学和抗氧化性进行研究。每隔12 h测定仙人掌果酒的酵母菌数、酒精度、还原糖量,针对实验数据,应用Logistic模型、SGompertz模型和DoseResp模型对其进行非线性拟合。同时在果酒发酵的各个阶段测定了总酚和黄酮的含量及其抗氧化性,了解其变化规律。实验结果显示:3 种模型的模拟预测值和实测值的拟合度均大于0.99,模拟拟合度较好,综合反映了仙人掌果酒发酵过程的动力学特征。总酚和黄酮含量相对较高,清除1,1-二苯基-2-三硝基苯肼自由基、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基效果显著,Fe 3+还原能力良好。
关键词:仙人掌果;发酵动力学;抗氧化性
仙人掌果为热带植物仙人掌的果实,表皮为紫色、青绿色或者金黄色,果肉为紫色或红色,可以食用,口感微酸甜。仙人掌在我国海南、云南、广西等地均有分布,是一种资源丰富的野生植物。仙人掌果实富含糖、氨基酸、有机酸、矿物质、维生素等营养物质,还含有大量的黄酮类物质,另外它还含有果胶、色素和三萜化合物,以及珍贵的玉芙蓉、抱壁莲和角蒂仙等 [1]。经研究,仙人掌果有行气活血、祛湿退热、清热解毒、提高免疫力、抗肿瘤抗癌,降低血糖血脂血压、清除自由基等作用 [2]。马丹雅等 [3]用乙醇提取仙人掌果肉红色素,发现仙人掌果红色素色泽艳丽、稳定性强。Reddy等 [4]通过高效液相色谱法分析果酒中所含活性成分,发现果酒中活性成分明显高出水果。
发酵动力学可对实验过程进行定量分析,对实验指标进行较为准确的预测,对发酵过程放大及从分批发酵过渡到连续发酵有着重要指导作用 [5]。通过对仙人掌果酒进行发酵动力学分析,可以为日后工业标准化生产提供依据。仙人掌果酒发酵过程中,产物酒精的生成与基质糖的消耗及菌体的生长都有着直接的关系。本实验采用经验模型中的Logistic模型、SGompertz模型和DoseResp模型对实验数据进行非线性拟合,建立发酵动力学模型,为仙人掌果酒的发酵生产控制提供了理论支持。
自由基是机体氧化反应中产生的有害化合物,具有强氧化性,可损害机体的组织和细胞,进而引起机体慢性疾病及衰老效应 [6]。虽然测定物质抗氧化性的方法很多,但还没有一种方法可以综合地评价物质的抗氧化能力,应选取多个体系综合考察物质的抗氧化性。本实验采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)法测定物质抗氧化能力,普鲁士蓝法测定还原能力,通过比较仙人掌果原汁及果酒不同发酵阶段的抗氧化性,了解其变化规律。
目前市面上有仙人掌的加工利用,但是仙人掌果的加工鲜有报道。由于仙人掌果实的表皮覆盖着倒钩状刺,内部还有八角刺,果肉多籽,不利于经常食用。通过把仙人掌果酿成果酒,不仅能保持其保健价值,同时还可以丰富人们的日常饮食,具有经济价值 [4]。仙人掌果发酵成果酒,酒性温和,色泽艳丽,风味独特,具有清热解毒、美容养颜及抗氧化等功效。通过发酵动力学及抗氧化性研究,可以为日后更好地开发仙人掌果提供理论依据。
1.1 材料与试剂
仙人掌果为海南三亚市售。
酿酒酵母采用SY型葡萄酒、果酒专用酵母,购于安琪酵母股份有限公司。
果胶酶 法国莱蒙特集团;白砂糖 香港艺龙源食品有限公司;酒石酸钾钠、NaOH(均为分析纯)广州化学试剂厂;DPPH 西亚试剂;磷酸盐缓冲液(phosphate buffered saline,PBS) 北京中杉金桥生物技术有限公司。
1.2 仪器与设备
GL-20G-Ⅱ型高速冷冻离心机 上海安亭科学仪器厂;SW-CJ-1FD洁净工作台 苏净安泰空气技术有限公司;MLR-351恒温培养箱 日本三洋电机贸易株式会社(北京);DA-130N酒精计 日本京都电子工业株式会社;G154DW压力蒸汽灭菌锅 美国致微(厦门)仪器有限公司;PHS-3C型pH计 上海雷磁仪器厂;HB43-S快速水分测定仪 梅特勒-托利多仪器(上海)有限公司;723 PC可见分光光度计 上海奥普勒仪器有限公司。
1.3 方法
1.3.1 仙人掌果酒发酵工艺流程
仙人掌果→清洗→去皮去刺、取果肉→打浆→过滤去籽→酶解→调整糖度与pH值→接种发酵→恒温发酵培养→分析测定。
加白砂糖调整糖度至21 °Brix,加柠檬酸调整pH值至4.0,65 ℃条件下巴氏杀菌10 min,室温冷却至常温,接入质量分数10%的酵母,23 ℃条件下恒温发酵。
1.3.2 仙人掌果基本成分分析
采用索氏抽提法测定仙人掌果肉粗脂肪含量 [7];利用HB43-S快速水分测定仪测定仙人掌果肉水分;根据GB 5009.4—2010《食品中灰分的测定》测定仙人掌果肉的灰分含量 [8];根据GB 5009.5—2010《食品中蛋白质的测定》,采用凯氏定氮法测定仙人掌果肉的蛋白质含量 [9];根据GB/T 12456—2008《食品中总酸的测定》测定仙人掌果肉的总酸含量 [10];根据3,5-二硝基水杨酸比色法测定仙人掌果肉的可溶性糖含量。
1.3.3 发酵动力学模型的建立
采用血球计数板计算酵母菌浓度。还原糖质量浓度根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》,采用斐林试剂滴定法测定 [11];酒精度根据GB/T 15038—2006,采用酒精计法测定 [11]。
1.3.4 样液的制备
参考文献:[12],准确称取5.00 g样品于100 mL三角瓶中,加入25 mL 70%的乙醇溶液,超声水浴浸提30 min,提取液6 000 r/min离心10 min。滤液倒入100 mL容量瓶中。滤渣用20 mL 70%乙醇溶液洗进原三角瓶中,摇匀,超声水浴30 min,提取液6 000 r/min离心10 min,倒入上述100 mL容量瓶中。2 次离心液用70%乙醇溶液定容至100 mL即为样液。
1.3.5 总酚、黄酮的制备与测定
1.3.5.1 总酚的制备与测定
采用Folin-Ciocalteu法测定酚类物质含量 [13]。准确称取没食子酸0.01 g至100 mL容量瓶,纯水定容至刻度。分别移取0、1、2、3、4、5、6 mL标准溶液于10 mL容量瓶中,蒸馏水定容至刻度即为待测液。取0.5 mL样液于试管中,加入2.5 mL 0.2 mol/L福林酚试剂,摇匀后避光反应5 min,再加入7.5 g/100 mL的Na 2CO 3溶液2 mL摇匀避光反应90 min,于760 nm波长处测定吸光度,蒸馏水调零。以没食子酸质量浓度为横坐标,吸光度为纵坐标绘制没食子酸标准曲线。
分别取仙人掌果肉原汁及不同发酵阶段的果酒按照1.3.4节的方法制备样液。吸取样液1.25 mL,蒸馏水定容至25 mL,再取0.5 mL稀释后的样液于试管中,按照上述没食子酸测定方法测定吸光度。总酚含量按公式(1)计算。
式中:x为根据标准曲线计算得出的没食子酸质量浓度/(mg/mL);25为稀释倍数;m为样品质量/g。
1.3.5.2 黄酮的制备与测定
采用NaNO 2-Al(NO 3) 3分光光度法测定黄酮含量 [14]。准确称取0.02 g芦丁用95%乙醇溶液定容至100 mL容量瓶即为芦丁标准液。分别移取0、1、2、3、4、5、6 mL置于25 mL容量瓶中,加入4 g/100 mL的NaNO 2溶液 1 mL,摇匀后避光反应6 min。再加入8 g/100 mL的Al(NO 3) 3溶液1 mL,摇匀后避光反应6 min。再加入12 g/100 mL的NaOH溶液10 mL,纯水定容至25 mL。避光静置15 min,于510 nm波长处测吸光度。以芦丁质量浓度为横坐标,吸光度为纵坐标绘制芦丁标准曲线。
分别取仙人掌果肉原汁及不同发酵阶段的果酒按照1.3.4节的方法制备样液。吸取样液1 mL,按照上述方法测定吸光度。黄酮含量按公式(2)计算。
式中:x为根据标准曲线计算得出的没食子酸质量浓度/(μg/mL);m为样品质量/g;0.5为稀释倍数。
1.3.6 抗氧化性测定
1.3.6.1 清除DPPH自由基能力测定
分别取仙人掌果肉原汁及不同发酵阶段的果酒按照1.3.4节的方法制备样液。取1 mL样液,用70%乙醇溶液定容至10 mL即为待测液。取100 μL待测液,加入4.9 mL 6.5×10 -5mol/L DPPH无水乙醇溶液,摇匀后避光反应40 min,于510 nm波长处测吸光度,无水乙醇调零。DPPH自由基清除率按公式(3)计算。
式中:A 0为未加样品的DPPH无水乙醇溶液吸光度;A S为样品与DPPH无水乙醇溶液反应后的吸光度。
1.3.6.2 清除ABTS +·能力测定
参考文献[15],按照1.3.4节方法制备样液,取1 mL样液,用70%乙醇溶液定容至10 mL即为待测液。移取1 mL 10 mmol/L H 2O 2-ABTS-醋酸盐缓冲液,蒸馏水稀释至30 mL,再移取6 mL稀释后的ABTS反应液,加入40 μL待测液,迅速振荡,于734 nm波长处测吸光度,以30 mmol/L醋酸钠溶液调零。ABTS +·清除率按公式(4)计算。
式中:A 0为未加样品的ABTS溶液吸光度;A t为样品与ABTS溶液反应后的吸光度。
1.3.6.3 Fe 3+还原能力测定
参考文献[16]测定,配制质量浓度为0.010、0.015、0.020、0.025、0.030、0.035 mg/mL的VC溶液,测其吸光度,绘制VC标准曲线。
按照1.3.4节方法制备样液。取1 mL样液,用70%乙醇溶液定容至10 mL。取1 mL待测液,加入1 mL PBS(pH 6.6),再加入1 mL 1 g/100 mL铁氰化钾溶液,摇匀,50 ℃条件下反应20 min,取出冷却至室温。加入1 mL 10 g/100 mL的三氯乙酸溶液,再加入0.2 mL 0.1 g/100 mL的三氯化铁溶液,摇匀,避光静置10 min,于700 nm波长处测其吸光度,蒸馏水调零。结果以每克样品中含有相当VC的量表示,单位为g VC/g。
1.4 数据分析与处理
实验设3 组平行,结果取平均值。应用Origin 9.0软件对菌体生长、基质消耗、产物生成情况建立动力学模型 [17-18]。
根据实验数据分析,酵母的生长呈“S”型曲线,结合经验模型,选取典型的“S”曲线模型:Logistic模型、SGompertz模型、Botlezman模型进行非线性拟合,比较三者的拟合度,R 2越大,拟合度越高,故选取拟合相关系数最大的模型对其进行描述。酒精的生成与酵母的生长有直接关系,因此属于生长“偶联”型,选用上述3 种经典模型对其进行非线性拟合,选取拟合相关系数最大的模型对其进行描述 [19]。果酒发酵过程中主要利用可还原糖合成酒精 [18],因此选用经典模型中的DoseResp模型、Logistic模型与Botlzman模型进行非线性拟合,选取拟合相关系数最大的模型对其进行描述。
应用Origin 9.0软件对仙人掌果原汁及果酒不同发酵阶段的总酚、黄酮含量和抗氧化性进行分析比较。
2.1 仙人掌果的基本成分
经测定,仙人掌果中水分含量为86.3 g/100 g,灰分含量为0.33 g/100 g,粗蛋白含量为4.02 g/100 g,粗脂肪含量为0.039 g/100 g,可溶性糖含量为4.8 g/100 g,总酸含量为0.22 g/100 g,结果表明仙人掌果含有丰富的蛋白质。
2.2 仙人掌果酒发酵过程中酵母菌浓度、酒精度、还原糖质量浓度的变化规律
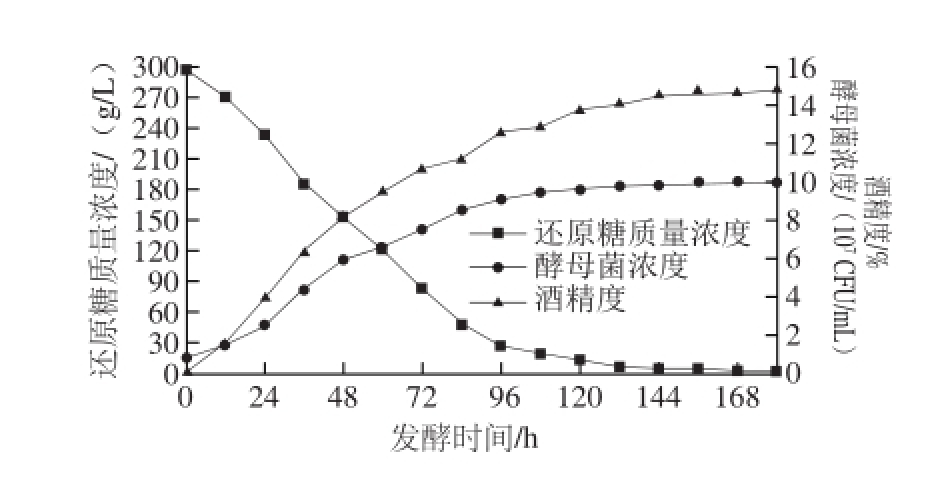
图1 仙人掌果酒发酵过程中酵母菌浓度、酒精度、还原糖质量浓度的变化规律
Fig.1 Evolution of yeast number, alcohol content, and reducing sugar concentration during the fermentation of cactus wine
由图1可知,酿酒酵母的生长规律比较典型,各个阶段比较分明。24 h后逐步进入对数生长期,96 h后趋于达到稳定期,菌体生物量最高值为1×10 8CFU/mL。还原糖在132 h前消耗比较快,之后糖消耗量缓慢降低。酒精度在12 h后增长较快,在132 h后趋于平缓,最大值为14.8%。
2.3 仙人掌果酒的发酵动力学模型
2.3.1 酵母菌数生长动力学模型
由表1可知,对比Logistic模型、SGompertz模型及Boltzmann模型的拟合相关系数,SGompertz模型拟合效果最好,相关系数R 2为0.997 28。故选用SGompertz模型对仙人掌果酒酵母菌数的生长情况进行拟合,此结论与李侠等 [19]关于红枣酒酵母菌数拟合模型一致,拟合曲线如图2。
表1 酵母菌数的拟合方程及其相关系数
Table1 Fitting equations with correlation coeff i cients for yeast count

?
由图2可知,酵母菌在仙人掌果酒发酵24 h后生长速率开始提高,24~96 h呈对数生长,在96 h后,菌体几乎不再生长,趋于平缓,进入稳定期。

图2 SGompertz模型下酵母菌生长拟合曲线
Fig.2 SGompertz model describing yeast growth
2.3.2 产物生成动力学模型
表2 产物生成拟合方程及其相关系数
Table2 Fitting equations with correlation coeff i cients for alcohol content

?

图3 Logistic模型下产物生成拟合曲线
Fig.3 Logistic model describing alcohol content
由表2可知,对比Logistic模型、SGompertz模型及Boltzmann模型的拟合相关系数,Logistic模型拟合效果最好,相关系数R 2为0.998 03,故选用Logistic模型拟合产物生成曲线,结论与张勇等 [20]关于蜂蜜酒产物拟合方程所选一致,曲线如图3。
由图3可知,酒精度在12 h后开始增加,在132 h后趋于平缓,最大值为14.8%。仙人掌果较一般水果易于发酵,且容易发酵成高度数果酒。普通水果正常发酵酒精度一般在8%~12% [21],但是仙人掌果酒酒精度相对来说较高,可能因为仙人掌果自带原始菌群利于仙人掌果发酵。
2.3.3 基质消耗动力学模型
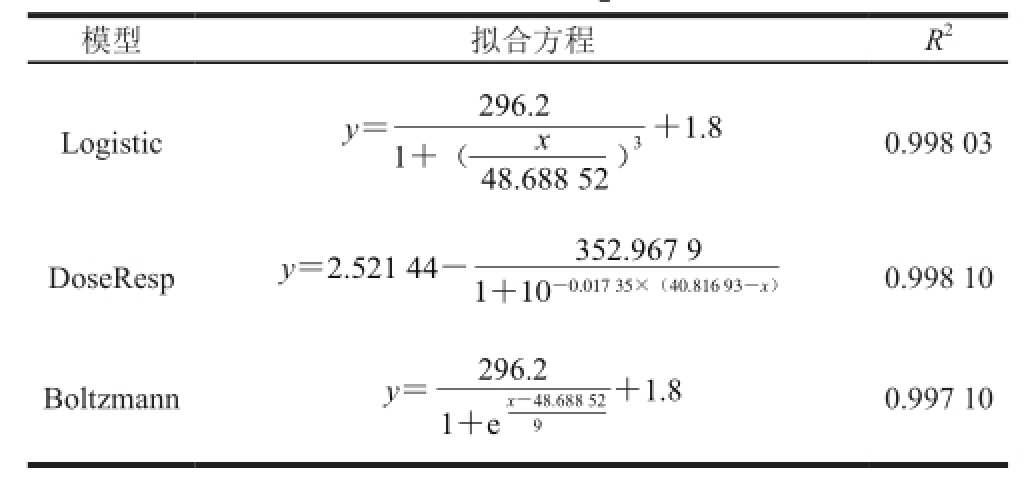
由表3可知,对比DoseResp模型、Logistic模型与Boltzmann模型3 种模型的拟合相关系数,DoseResp模型拟合效果最好,相关系数R 2为0.998 10。故选用DoseResp模型拟合基质消耗过程 [19]。
表3 基质消耗拟合方程及其相关系数
Table3 Fitting equations with correlation coeff i cients for substrate consumption
?

图4 DoseResp模型下基质消耗拟合曲线
Fig.4 DoseResp model describing substrate consumption
由图4可知,还原糖在132 h前消耗比较快,之后糖消耗量缓慢降低,与酒精度值几乎同步进行。果酒发酵过程中,糖被还原产生能量供酵母新陈代谢所需,生成酒精 [19]。
2.4 总酚、黄酮含量及其抗氧化性变化
2.4.1 仙人掌果发酵过程中总酚含量变化
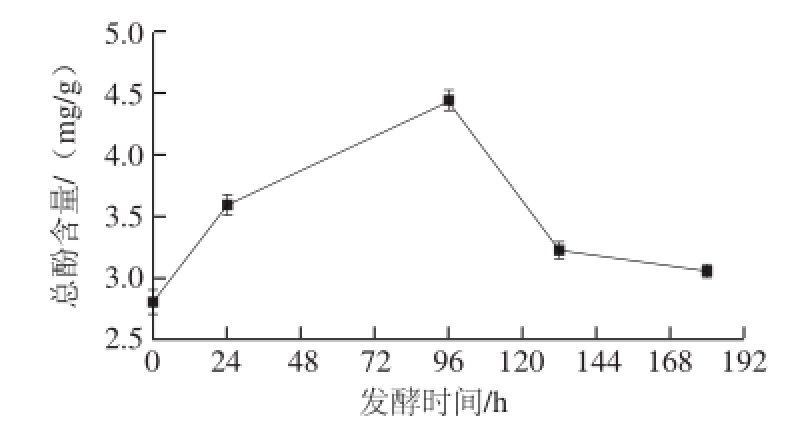
图5 总酚含量变化
Fig.5 Change in total phenol content with fermentation time
没食子酸标准曲线方程为y=11.928 75x+0.039 29(R 2=0.999 01)。根据上述方程及实验所测吸光度,换算为总酚含量。
由图5可知,仙人掌果总酚含量在发酵过程中呈现先上升后下降的趋势。主要上升阶段集中在发酵开始后24~96 h内,因为此阶段为仙人掌果酒主要发酵阶段,出汁量较多,使得果酒的总酚含量增加。在发酵后期,总酚含量开始降低,132 h后缓慢减少。随着酵母菌和仙人掌果原始菌群的生长繁殖,代谢过程中产生的酶,分解了多酚等大分子物质,使得酚含量降低。发酵结束后,果酒的总酚含量相对原汁有所增加,此结论与于立梅等 [22]关于山竹酒发酵过程中总酚变化趋势的结论一致。
2.4.2 仙人掌果发酵过程中黄酮含量变化
芦丁标准曲线方程为:y=0.016 15x+0.020 12(R 2=0.995 19)。由方程及实验所测数据,计算仙人掌果原汁及其发酵各个阶段黄酮含量。
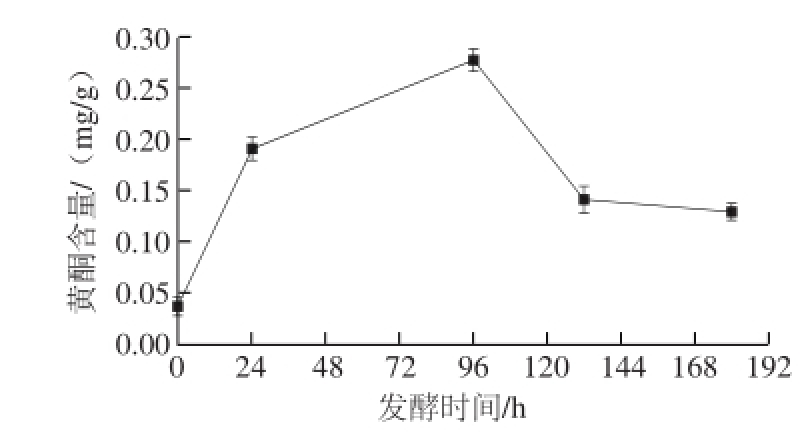
图6 黄酮含量变化
Fig.6 Change in total fl avonoids content with fermentation time
由图6可知,仙人掌果原汁所含黄酮相对较少,发酵过程中,黄酮含量呈现先上升后下降的趋势。开始发酵后,黄酮含量迅速增加,96 h后发酵趋近平缓,黄酮含量开始迅速下降。132 h后下降速率趋于平缓,但发酵后果酒总黄酮含量相对原汁高出很多。发酵前中期,由于仙人掌果大量出汁,酒精含量不断增加,黄酮的溶解量不断增加 [23]。发酵后期,由于发酵菌株对黄酮的分解及黄酮的不稳定性,使得黄酮含量下降。发酵趋于结束时,黄酮几乎全部溶于发酵液,含量基本不变。
2.5 果酒抗氧化性变化
2.5.1 发酵过程中DPPH自由基清除率变化

图7 仙人掌果原汁及发酵过程中DPPH自由基清除率变化
Fig.7 Change in DPPH radical scavenging capacity during the fermentation of cactus juice
由图7可知,DPPH自由基清除率总体呈现先微弱上升后微弱下降的趋势,与发酵过程中总酚和黄酮的含量变化趋势较符合,总体变化不明显。发酵前中期,DPPH自由基清除率缓慢上升,因为在此阶段,仙人掌果发酵速率较快,大量出汁,抗氧化性物质含量增加。发酵后期,DPPH自由基清除率缓慢下降,几乎与原汁DPPH自由基清除率持平,可能因为黄酮的不稳定性及发酵过程中产生的酶分解了酚类等大分子物质,导致抗氧化性降低 [24]。
2.5.2 发酵过程中ABTS +·清除率变化
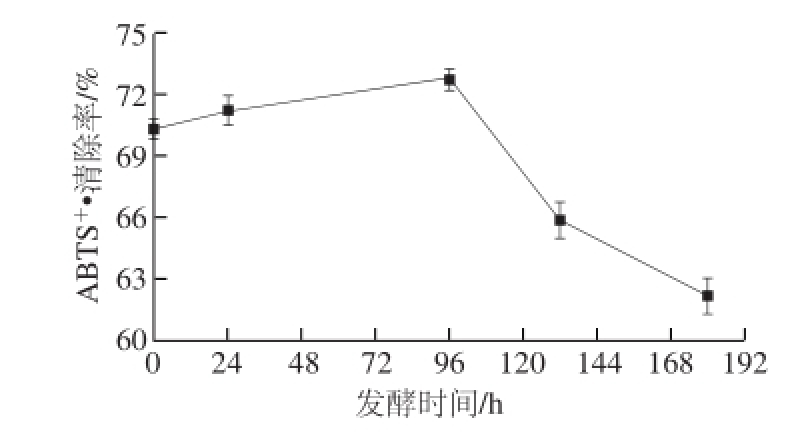
图8 仙人掌果原汁及发酵过程中ABTS
+·清除率变化
Fig.8 Change in ABTS radical scavenging capacity during the fermentation of cactus juice
由图8可知,ABTS +·清除率与DPPH自由基清除率趋势变化几近相同。总体呈现先上升后下降的趋势,发酵中酚类物质可形成解离和聚合的复杂反应,且这些反应与温度、时间、浸渍效果等多种因素有关,仙人掌果酒中总酚、黄酮含量与ABTS +·清除率呈正相关,此结论与焦扬等 [25]的研究结果一致。
2.5.3 发酵过程中Fe 3+还原能力变化

图9 仙人掌果原汁及发酵过程中Fe
3+还原能力变化
Fig.9 Changes in Fe
3+reducing power during the fermentation of cactus juice
由图9可知,发酵过程中Fe 3+还原能力为先下降后上升。发酵中期还原能力最弱。发酵结束后,虽然还原能力有所增强,但是总体还原能力弱于仙人掌果原汁,可能是因为发酵过程中,仙人掌果大量出汁,生成了某些物质,使Fe 3+转换Fe 2+,削弱了Fe 3+还原能力 [25]。
通过采用Origin 9.0软件对试验数据进行分析,并采用经典模型Logistic、DoseResp、SGompertz对其进行非线性拟合,得到相关拟合方程,相关系数均大于0.99,说明所选的方程能够很好地模拟仙人掌果酒发酵过程。本研究主要考察仙人掌果酒发酵过程中的酵母菌生长情况及特征物质的变化规律。结果表明,仙人掌果酒主要发酵阶段集中在24~96 h。
仙人掌果酒发酵前中期,酵母菌大量生长繁殖,酒精度迅速增大,总酚和黄酮含量也开始增加,抗氧化能力缓慢上升。96 h后由于酶等大分子物质的产生、发酵菌株的分解作用及和黄酮自身的不稳定性等因素,总酚和黄酮含量均相对降低。
仙人掌果及其发酵果酒的抗氧化能力都比较高,其DPPH自由基和ABTS +·清除率均大于60%。仙人掌果发酵果酒的抗氧化能力与原果没有显著差异,表明将仙人掌果发酵酿酒后仍较好地保留了其原有的抗氧化性能。
参考文献:
[1] 王红梅, 姚晶, 宋琳, 等. 仙人掌果中黄酮类物质提取工艺的优化[J].食品工业科技, 2013, 34(3): 259-261.
[2] 刘华钢, 梁秋云, 黄慧学, 等. 仙人掌果多糖的药效研究[J]. 中国实验方剂学杂志, 2011, 17(19): 170-173. DOI:10.3969/ j.issn.1005-9903.2011.19.048.
[3] 马丹雅, 赵晶, 姚晶. 仙人掌果红色素提取工艺及其稳定性研究[J].食品工业科技, 2012, 22(23): 214-217.
[4] REDDY L A, OBULAM O S R. Effect of fermentation conditions on yeast growth and volatile composition of wine produced from mango (Mangifera indica L.) fruit juice[J]. Food and Bioproducts Processing, 2011, 89: 487-491. DOI:10.1016/j.fbp.2010.11.007.
[5] SONG H, EOM M H, LEE S, et al. Modeling of batch experimental kinetics and application to fed-batch fermentation of Clostridium tyrobutyricum for enhanced butyric acid production[J]. Biochemical Engineering Journal, 2010, 53(1): 71-76. DOI:10.1016/ j.bej.2010.09.010.
[6] 汤晓, 焦泽武, 龚淑珍, 等. 黄酮混合物体外抗氧化活性的相互作用[J].食品科技, 2013, 38(2): 198-206.
[7] 卫生部. 食品中脂肪的测定: GB/T 5009.6—2003[S]. 北京: 中国标准出版社, 2003: 45-46.
[8] 卫生部. 食品中灰分的测定: GB 5009.4—2010[S]. 北京: 中国标准出版社, 2010: 1.
[9] 卫生部. 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2010: 1-3.
[10] 国家质量监督检验检疫总局. 食品中总酸的测定: GB/T 12456—2008[S]. 北京: 中国标准出版社, 2008: 1-2.
[11] 国家质量监督检验检疫总局. 葡萄酒、果酒通用分析方法: GB/T 15038—2006[S]. 北京: 中国标准出版社, 2006: 2-5.
[12] 许亮, 师俊玲, 任健, 等. 枸杞果酒发酵过程中黄酮含量的变化[J].食品科学, 2011, 32(5): 100-103.
[13] 李婧秋. 脱脂油棕果渣亚临界水降解动力学及产物活性研究[D]. 海口: 海南大学, 2015: 18-20.
[14] 丁明玉, 赵纪萍, 李擎阳, 等. 贯叶金丝桃提取物中总黄酮的测定方法[J]. 分析试验室, 2001, 20(6): 45-47. DOI:10.3969/ j.issn.1000-0720.2001.06.015.
[15] EREL O. A novel autonmated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation[J]. Clinical Biochemistry, 2004, 37(4): 277-285. DOI:10.1016/ j.clinbiochem.2003.11.015.
[16] SIDDHURAJU P. The antioxidant activity and free radicalscavenging capacity of phenolics raw and dry heated moth bean (Vigna aconitifolia) (Jacq.) Marechal seed extracts[J]. Food Chemistry, 2006, 99(1): 149-157. DOI:10.1016/j.foodchem.2005.07.029.
[17] 武新, 张永胜. Origin在曲线拟合中的应用[J]. 计算机工程与应用, 2005, 41(17): 206-208. DOI:10.3321/j.issn:1002-8331.2005.17.064.
[18] 程国斌, 张延红, 王康平, 等. 利用Origin软件实现化学实验数据的拟合分析[J]. 化学教学, 2005(9): 46-48. DOI:10.3969/ j.issn.1005-6629.2005.09.022.
[19] 李侠, 彭丹, 张春晖, 等. 红枣酒发酵动力学研究[J]. 中国酿造, 2012, 31(1): 190-193. DOI:10.3969/j.issn.0254-5071.2012.01.056.
[20] 张勇, 李从发, 艾遥琴, 等. 蜂蜜酒发酵动力学研究[J]. 食品工业科技, 2015, 36(5): 136-129. DOI:10.13386/j.issn1002-0306.2015.05.020.
[21] PAN Wei, JUSSIER D, TERRADE N, et al. Kinetics of sugars, organic acids and acetaldehyde during simultaneous yeast-bacterial fermentations of white wine at different pH values[J]. Food Research International, 2011, 44: 660-666. DOI:10.1016/j.foodres.2010.09.041.
[22] 于立梅, 刘俊梅, 冯卫华, 等. 山竹酒发酵过程中活性成分变化及成品香气分析[J]. 现代食品科技, 2014, 30(5): 287-296. DOI:10.13982/ j.mfst.1673-9078.2014.05.046.
[23] 吴竹青, 陈景, 黄群, 等. 响应面法优化雪莲果酒发酵工艺[J]. 食品科学, 2010, 31(23): 182-187.
[24] 刘方方. 发酵石榴汁抗氧化性和抗过敏性研究[D]. 扬州: 扬州大学, 2014: 55-66.
[25] 焦扬, 宋海, 张勇, 等. 3 种野生浆果果酒中活性物质及抗氧化活性比较[J]. 食品与发酵工业, 2015, 41(1): 60-65. DOI:10.13995/ j.cnki.11-1802/ts.201501012.
Fermentation Kinetics and Antioxidant Activity of Cactus Wine
LI Xue, BAI Xinpeng
*, CAO Jun
*, ZHAO Ye, WU Linhe, ZHANG Yuxiang, MA Ruoying
(Key Laboratory of Biological Active Substances and Functional Food Development, College of Food Science and Technology, Hainan University, Haikou 570228, China)
Abstract:The fermentation kinetics at a constant temperature and antioxidant activity of cactus wine produced from cactus juice using SY-type Angel-branded yeast were studied. Yeast count, alcohol content, and reducing sugar in cactus wine were determined after every 12 h, and the experimental data were nonlinearly fi tted to the Logistic, SGompertz and DoseResp models. Meanwhile, changes in the contents of total phenol and flavonoids and antioxidant activity of the wine were investigated as a function of fermentation time. The experimental results showed that the fi tness of all the three models was conf i rmed by a satisfactory value of determination coeff i cient, which was calculated to be greater than 0.99. In addition, it was also shown that the contents of total phenol and fl avonoids were relatively high in cactus wine. Cactus wine exhibited remarkable free radical scavenging activities against 1,1-diphenyl-2-picrylhydrazyl and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate and potent Fe 3+reduction power.
Key words:cactus wine; fermentation kinetics; antioxidant activities
DOI:10.7506/spkx1002-6630-201704015
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2017)04-0087-06
引文格式:
李雪, 白新鹏, 曹君, 等. 仙人掌果酒发酵动力学及其抗氧化性[J]. 食品科学, 2017, 38(4): 87-92. DOI:10.7506/spkx1002-6630-201704015. http://www.spkx.net.cn
LI Xue, BAI Xinpeng, CAO Jun, et al. Fermentation kinetics and antioxidant activity of cactus wine[J]. Food Science, 2017, 38(4): 87-92. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704015. http://www.spkx.net.cn
收稿日期:2016-05-16
基金项目:海南省自然科学基金项目(20153159);海南省高等学校科研项目(Hnky2016ZD-1);海南大学科研启动基金项目(kyqd1608)
作者简介:李雪(1991—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:lixuelala@163.com
*通信作者:白新鹏(1963—),男,教授,博士,研究方向为粮食、油脂和植物蛋白质工程。E-mail:xinpeng2001@126.com
曹君(1986—),女,讲师,博士,研究方向为营养、保健与功能食品。E-mail:juncaoyd2007@126.com