弧菌外膜蛋白OmpK单克隆抗体的制备及其特性
李 杰
1,丁承超
1,翟续昭
1,王广彬
2,刘武康
1,谢曼曼
1,曾海娟
1,王淑娟
1,孙静娟
1,董庆利
1,刘 箐
1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.徐州绿健乳品饮料有限公司,江苏 徐州 221006)
摘 要:制备弧菌外膜蛋白K(outer membrane protein K,OmpK)单克隆抗体并对其特性进行研究。以原核表达系统表达野生株Vibrio pa rahaemolyticus B的OmpK免疫Balb/c小鼠,取免疫小鼠脾细胞与肿瘤细胞SP2/0进行细胞融合,采用有限稀释法和间接酶联免疫吸附测定法筛选出能够稳定分泌单克隆抗体的杂交瘤细胞株,小鼠体内诱导制备腹水,用饱和硫酸铵沉淀法和亲和层析柱纯化抗体。最终获得能稳定分泌抗Omp K的两株单克隆抗体杂交瘤细胞株OmpK-Mab-4B7、OmpK-Mab-3C5,2 株杂交瘤细胞系所分泌的Mab亚类均为IgG1,效价达1∶128 000,抗体3C5、4B7的敏感度IC
50分别为2.5、5.0 μg/mL。Western blotting结果显示单克隆抗体可以与本实验室12 株副溶血性弧菌(V. parahaemolyticus A、B、C、D、E、F、G、H、I、J、ATCC17802、ATCC33847)的外膜蛋白有不同程度的结合反应,与4 株溶藻弧菌中的3 株(V. alginolyticus A、B、C)外膜蛋白能够较好的结合,与1 株鳗弧菌(V. anguillarum MVM)外膜蛋白也有轻微的结合反应,实验制备的单克隆抗体可用于弧菌OmpK的基础研究和快速检测。
关键词:弧菌;弧菌外膜蛋白K;单克隆抗体
海水水产病害问题是带来食品安全,影响我国水产养殖业发展的重要因素。水产病原微生物中,弧菌属引起的水产病害是主要原因。弧菌种类繁多,血清型复杂,目前发现的弧菌共有46 种,其中12 种与人类感染相关,超过27 种与鱼类和贝类感染有关
[1-3],能够感染几乎所有海洋养殖水生动物如甲壳类、软体动物、鱼等,其流行面积广、发病率高,给水产养殖业的发展造成了巨大危害
[4]。其中能够引起人类患病的致病菌如鳗弧菌、溶藻弧菌能够引起人类急性败血症、胃肠炎、严重的坏死性软组织感染等食源性疾病,致死率较高
[5-6],副溶血性弧菌和创伤弧菌是美国等世界范围内海鲜相关的感染和死亡的主要病原菌
[7]。弧菌的预防、早期诊断与治疗是水产领域长期以来的研究热点。针对弧菌病,常采用的控制方法是化学药物消毒预防和抗生素治疗,但是长期滥用抗菌素不仅造成严重的环境污染和药物残留问题
[8],还使得致病性弧菌的耐药性不断增强,产生了许多新的耐药菌株,使弧菌病的防治面临着新的挑战。
单克隆抗体具有高度特异性、均质性及来源稳定并可大量生产的优点,成为感染性疾病研究、诊断和治疗的一个有力手段。随着单克隆抗体技术应用的深入,其在水产病原细菌性疾病、病毒性疾病的诊断及预防中也发挥了重要的作用
[9]。外膜蛋白是革兰氏阴性细菌外膜的基本成分,呈β-桶状结构,其参与多个反应过程,如养分运输、耐药性和响应环境信号
[10],是弧菌的主要免疫原蛋白,不仅可激发机体细胞免疫和体液免疫,而且在不同弧菌及血清型菌株之间具有良好的免疫交叉保护作用,因而是国内外公认的一种潜在共同保护性抗原
[11-14]。弧菌外膜蛋白K(outer membrane protein K,OmpK)是弧菌外膜蛋白的主要成分之一,Inoue等
[6]发现天然的OmpK蛋白不仅是弧菌中共有的一种外膜蛋白,还具有免疫交叉反应性,伦镜盛等
[15]在22 种弧菌O m pK基因序列比对发现O m pK基因在弧菌中高度保守,并通过Western blotting分析证实了OmpK的免疫交叉反应具有种属特异性。杨智慧等
[16]从基因水平上证实了外膜蛋白OmpK广泛存在于海水鱼类致病性弧菌中,是一种免疫原性较好的共同抗原。通过将高保守性、高特异性的OmpK作为免疫抗原,制备可识别多种病原弧菌的单克隆抗体,能够为建立相应的多种弧菌检测方法提供参考依据
[18-19]。
本实验利用传统的杂交瘤技术,将纯化的弧菌OmpK用于免疫Balb/c小鼠,成功制得能稳定分泌弧菌外膜蛋白单克隆抗体的杂交瘤细胞株,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)对制得的单克隆抗体的纯度进行验证,利用Western blotting对其特异性进行检测,提取17 株弧菌的外膜蛋白,与单克隆抗体进行结合反应,检测其有效性,且制备的单克隆抗体与其他菌均无交叉反应,结果表明所制得的OmpK单克隆抗体敏感度高、特异性好,并且与弧菌OmpK能较好的结合,可用于弧菌OmpK的基础研究。
1 材料与方法
1.1 材料
1.1.1 实验菌株、细胞与动物
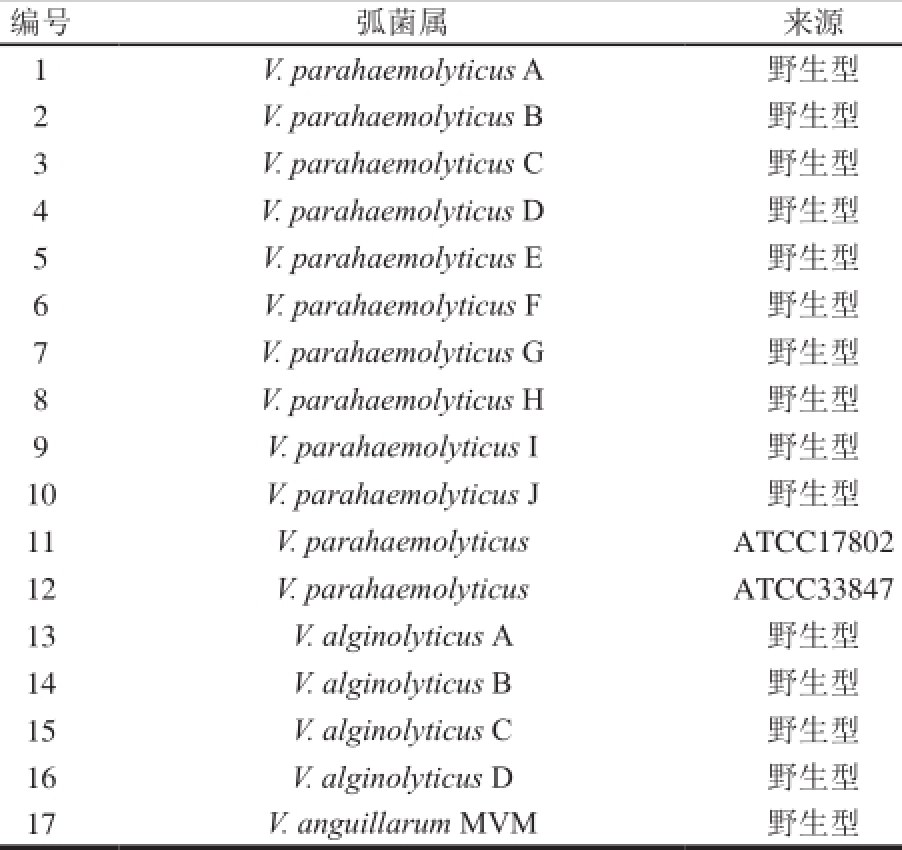
表1 实验弧菌
Table 1Vibrio tested in this study
编号弧菌属 来源1 V. parahaemolyticus A野生型2 V. parahaemolyticus B野生型3 V. parahaemolyticus C野生型4 V. parahaemolyticus D野生型5 V. parahaemolyticus E野生型6 V. parahaemolyticus F野生型7 V. parahaemolyticus G野生型8 V. parahaemolyticus H野生型9 V. parahaemolyticus I野生型10 V. parahaemolyticus J野生型11 V. parahaemolyticus ATCC17802 12 V. parahaemolyticus ATCC33847 13 V. alginolyticus A野生型14 V. alginolyticus B野生型15 V. alginolyticus C野生型16 V. alginolyticus D野生型17 V. anguillarum MVM野生型
水产品中分离出的17 株弧菌(表1)为本实验室保存;SP2/0小鼠骨髓瘤细胞由上海理工大学有害微生物危害与控制研究所保存;6~8 周龄SPF级Balb/c雌性小鼠上海市第二军医大学。
1.1.2 试剂
DMEM高糖细胞培养基 美国Gibco公司;8-氮鸟嘌呤(8-azaguanine,8-AG)、聚乙二醇(polyethylene glycol,PEG)、HAT(50×)培养基、HT(50×)培养基、二甲基亚砜、弗氏佐剂、辣根过氧化物酶(horse reddish peroxidase,HRP)标记的羊抗鼠Ig G抗体 美国Sigma公司;胎牛血清 上海Biosun公司;青链霉素混合液 上海生工生物工程有限公司。
1.1.3 仪器与设备
Milli-Q Academic A10纯水仪 美国Millipore公司;SpectraMax/n2酶标仪 美国Molecular Devices公司;protein G亲和层析柱 美国GE公司;Biologic LP蛋白纯化仪、JY1000C电泳仪、1658001电泳槽 美国Bio-Rad公司。
1.2 方法
1.2.1 抗原的制备
Omp K蛋白为丁承超等
[20]利用原核表达系统制备提供。
1.2.2 免疫Balb/c小鼠
取5 只8 周龄,体质量20 g左右,Balb/c雌鼠,分别做好标记,1~5号小鼠采用背部皮下3点注射抗原蛋白。共免疫5 次:基础免疫,将0.4 mg/mL的OmpK蛋白于弗氏完全佐剂1∶1混合,注射剂量为0.3 mL/只;2 周后每隔1 周加强免疫1 次,将0.4 mg/mL的OmpK蛋白于弗氏不完全佐剂1∶1混合,注射剂量为0.3 mL/只,共加强免疫3 次。
1.2.3 细胞融合与筛选
融合前30 d左右复苏SP2/0细胞,8-AG终质量浓度20 μg/mL的DMEM完全培养液选择培养3 代以上(以保持次黄嘌呤鸟嘌呤磷酸核糖转移酶缺陷型细胞),部分冻存,部分进行细胞融合实验。于融合前1 d取小鼠腹腔的巨噬细胞作为饲养层细胞。第3次加强免疫后第6天采用间接酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法测定小鼠血清效价,对血清抗体效价最高的小鼠进行冲击免疫,3 d后摘除眼球取血,分离得血清于-20 ℃贮存供检测抗体效价时作为阳性对照使用,将此小鼠脱臼拉颈处死取其脾细胞。
实验采用PEG化学融合法,具体过程参照文献[21]进行。调整骨髓瘤细胞与脾细胞的比例为1∶5,充分混合后离心去上清液,缓慢加入体积分数为50%的PEG进行融合,用含体积分数为10%胎牛血清的DMEM高糖培养基终止融合,离心重悬后按10
5个/孔铺于已铺饲养层细胞的96 孔板中。融合24 h后,开始HAT/HT选择性培养液筛选。采用ELISA法检测细胞上清液中的抗体,通过有限稀释法将阳性培养孔中的杂交瘤细胞进行亚克隆。经过3~4 次克隆化全为阳性后,选择效价高、生长状态良好的单细胞孔,进行转孔扩大培养并冻存。
1.2.4 小鼠腹水制备及抗体纯化
用筛选得到的两株针对弧菌OmpK蛋白的阳性杂交瘤细胞株制备腹水,选取8 周龄Balb/c雌性小鼠8 只,腹腔注射石蜡油0.3 mL/只,7~14 d后,1×磷酸盐缓冲溶液(phosphate buffer saline,PBS)重悬的杂交瘤细胞调整细胞浓度2×10
6细胞/mL,腹腔注射0.3 mL/只,10 d左右活体抽取腹水,4 ℃、5 000 r/min离心10 min,-20 ℃分装冻存,用于后续实验。单克隆抗体腹水经饱和硫酸铵沉淀初步纯化后,再经Protein-G柱亲和层析纯化。
1.2.5 单克隆抗体特性鉴定
1.2.5.1 抗体效价及亚型测定
单克隆抗体效价的测定采用间接ELISA法
[21]。以P/N(P为阳性对照的OD
450
nm值,N为阴性对照的OD
450
nm值)不小于2.1的抗体最大稀释倍数为该单克隆抗体的效价。同样,亚型鉴定采用间接ELISA法,按照小鼠单克隆抗体亚型分类试剂盒(IgA、IgM、IgG1、IgG3、Ig G2a、Ig G2b)说明书方法进行,2 mg/mL单克隆抗体均稀释1 000 倍,亚型鉴定羊抗鼠Ig G抗体稀释1 000 倍。
1.2.5.2 纯度的测定
SDS-PAGE测定纯化后抗体的纯度。分别将2 株抗体粗提后的腹水以及亲和层析处理的穿流液作为对照,将实验样品与样品电泳上样缓冲液按照4∶1体积混匀,于100 ℃条件下干浴5 min,粗提后腹水、穿流液加样量为20 μg,纯化抗体加样量为5 μg,考马斯亮蓝R250染色,以脱色液进行脱色。
1.2.5.3 抗体特异性分析
将2 株抗体分别稀释500、1 000、2 000、4 000 倍进行Western blotting,检测纯化后抗体的特异性。具体操作为,SDS-PAGE结束后,利用半干法将凝胶上的Omp K均匀的转移至硝酸纤维素(nitrocellulose filter membrane,NC)膜上,用TBS配制的10%脱脂乳粉摇床封闭2 h,TBST洗涤后加入到用BSA倍比稀释后的抗体溶液中,4 ℃过夜摇荡,洗涤后加入HRP标记的山羊抗鼠二抗(1∶10 000 稀释),37 ℃避光摇荡1 h,最后使用双色红外荧光成像系统扫描NC膜,通过条带确定特异性反应强度。
1.2.5.4 抗体检测能力分析
按改进的方法
[23]提取实验室现有的17 种弧菌的外膜蛋白,利用Western blotting检测所得抗体(选取3C5)与这些菌外膜蛋白的结合能力。将各种菌于37 ℃摇床过夜培养,6 000 r/min离心15 min,弃上清液;用PBS洗涤3 次后加入RIPA裂解液和苯甲基 磺酰氟,于水浴锅中45 ℃温浴30 min后超声处理10 min、15 000 r/min离心30 min,取上清液;向上清液中3 倍体积的丙酮,-20 ℃过夜保存;次日15 000 r/min离心30 min,弃上清液,所得沉淀即为菌外膜蛋白。热风风干沉淀除去丙酮,用PBS重悬调整浓度,最后进行Western blotting。
2 结果与分析
2.1 抗体纯度测定
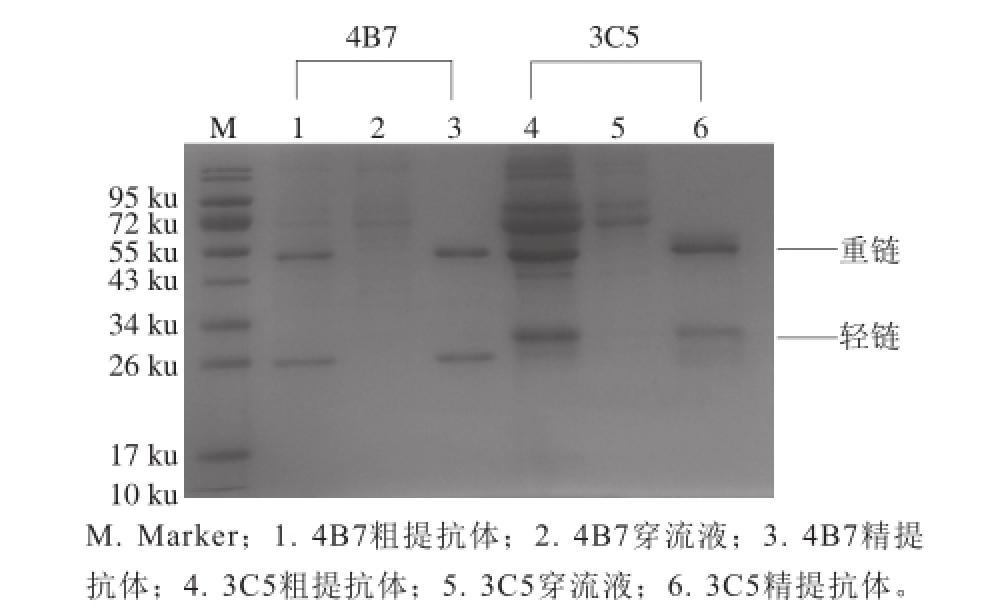
图1 纯化单克隆抗体的SDS-PAGE图
Fig. 1 SDS-PAGE analysis of purified monoclonal antibodies
4B7、3C5两株腹水经饱和硫酸铵粗提之后的抗体(图1条带1、4),经Protein-G柱亲和层析的穿流液(图2条带2、5),对应条带中不含目标蛋白,说明亲和层析过程中抗体基本没有损失。经Protein-G柱亲和层析后的纯化抗体(图1条带3、6),由对应条带可知,两株抗体分别都有一条55 ku左右的重链,一条26 ku左右的轻链,并且无多余条带,表明纯化后的抗体纯度较高。
2.2 免疫小鼠效价测定
用间接ELISA测定5 只免疫小鼠的效价。将5 只小鼠血清分别稀释1 000、2 000、4 000、8 000、16 000、32 000、64 000、128 000 倍,血清效价测定结果如图2所示。5号小鼠血清效价达到1∶128 000,效价最高,因此选择5号小鼠加强免疫后进行细胞融合。
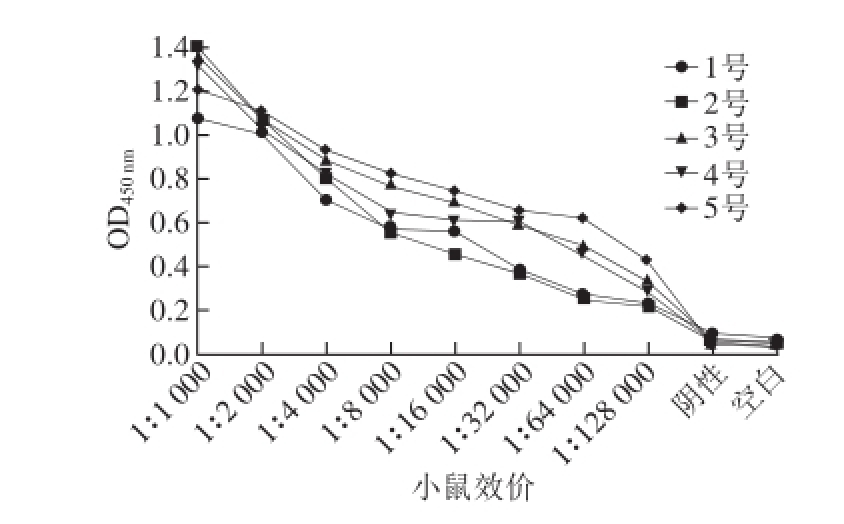
图2 小鼠血清效价图
Fig. 2 Titers of mouse serum samples
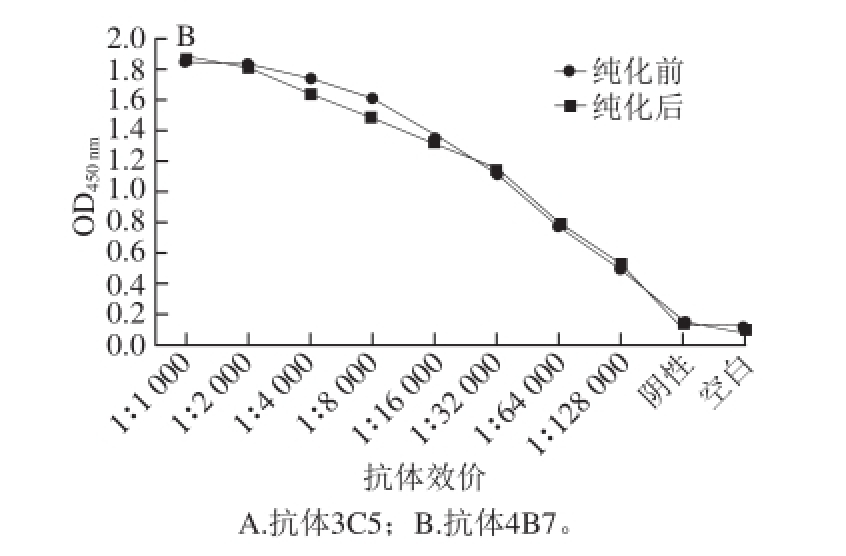
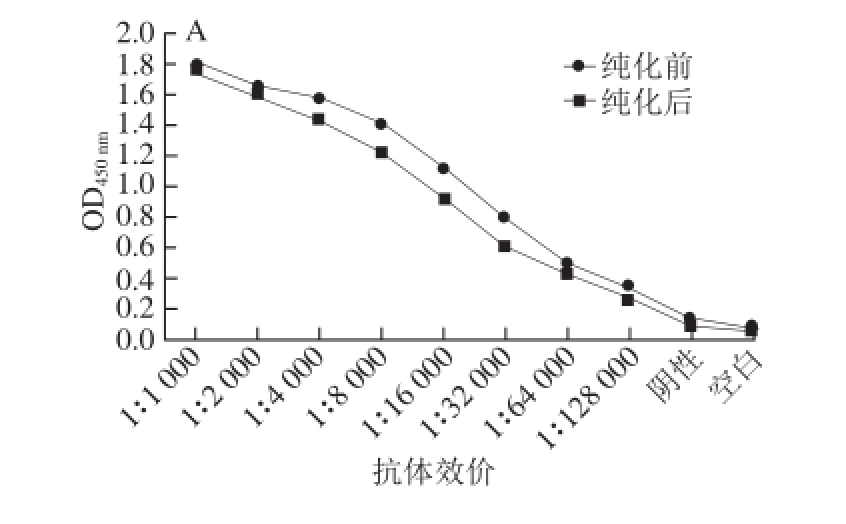
图3 腹水抗体及纯化后抗体的效价
Fig. 3 Titers of ascites and purified antibodies
2.3 抗体亚型及效价测定
ELISA法测定2 株杂交瘤细胞产生的腹水经粗提后以及最终纯化所得单克隆抗体的效价,如图3所示,纯化后2 株抗体3C5、4B7的效价均达到1∶128 000。从纯化前后对比可以看出,纯化过程对抗体效价略有影响,但并没出现明显的降低,说明纯化方案可行。用亚型试剂盒测定抗体亚型,结果如表2所示,两株抗体的亚型均为IgG1。
表2 2 种抗体亚型测定(OD
450
nm
)
Table 2 Subtypes of the two antibodies (OD
450
nm)
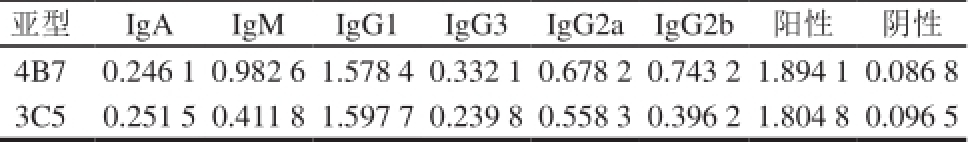
亚型IgA IgM IgG1 IgG3 IgG2a IgG2b阳性阴性4B7 0.246 1 0.982 6 1.578 4 0.332 1 0.678 2 0.743 2 1.894 1 0.086 8 3C5 0.251 5 0.411 8 1.597 7 0.239 8 0.558 3 0.396 2 1.804 8 0.096 5
2.4 单克隆抗体敏感性鉴定
采用间接竞争ELISA法测定抗体对Omp K的半数抑制浓度(half maximal inhibitory concentration,IC
50),即S/N(S为实验组OD
450
nm值,N为对照组OD
450
nm值)为0.5时所对应的质量浓度为IC
50。IC
50值越小抗体的敏感性越高。本实验对照组OD
450
nm为1.0,对应的抗体使用量为400 ng。从图4可知,单克隆抗体3C5、4B7的检测限分别为2.5、5.0 μg/mL并对2 株抗体与OmpK蛋白进行Western blotting分析,结果如图5所示,3C5、4B7两株抗体在稀释4 000 倍时仍有较明显的免疫反应条带,说明两株抗体对于OmpK蛋白均有较强的敏感性。

图4 单克隆抗体敏感性
Fig. 4 Sensitivity of monoclonal antibodies

图5 免疫印迹
Fig. 5 Western blotting
2.5 抗体与多种弧菌外膜蛋白OmpK的结合能力测定

图6 抗体3C5与17株弧菌外膜蛋白OmpK免疫结合
Fig. 6 Combination of the antibody 3C5 with the outer membrane protein OmpK of 17 strains of Vibrio
如图6所示,抗体与1 2 株副溶血性弧菌(V. P ara ha em olyticu s A、B、C、D、E、F、G、H、I、J、ATCC17802、ATCC33847)有不同程度的结合,4 株溶藻弧菌中有3 株(V. alginolyticus A、B、C)能够较好的结合,与实验中的一株鳗弧菌(V. anguillarum MVM)外膜蛋白也有轻微的结合反应。
3 结 论
Coll等
[24]研究单克隆抗体在鱼类免疫学和鱼类感染性疾病研究中的应用,并指出单克隆抗体具有高灵敏度和高特异性,在鱼类的被动免疫研究及用基因探针检测水产中病原菌方向会有较好的发展。自Kohler和Milstein于1975首次将B淋巴细胞与骨髓瘤细胞成功融合成杂交瘤细胞后,单克隆抗体技术也得到了快速的发展,对基础研究领域如免疫学、细胞生物学等产生了较大的影响。随着单克隆检测技术的不断发展,单克隆抗体制备技术也在不断发展,除了传统的用全菌免疫和特异性蛋白免疫
[25-26]之后,再利用杂交瘤细胞融合技术制备单克隆抗体外,还包括一些新型制备技术如蛋白嵌合单克隆抗体制备技术
[27]、噬菌体技术等新技术
[28]、通过转基因技术制备单克隆抗体
[29-30]等。由于本实验对单克隆抗体是鼠源或人源基本没有要求,并且之前的相关学者已经证实弧菌外膜蛋白OmpK是多种致病性弧菌的广谱性靶向抗原,所以本实验采用弧菌外膜蛋白OmpK免疫小鼠,这种方法成本较低且所制得的单克隆抗体特异性,敏感性均较高。
本实验利用弧菌外膜蛋白Omp K免疫小鼠,其中5号小鼠效价最高,取其脾细胞与骨髓瘤细胞进行细胞融合、利用单细胞克隆技术成功筛得两株能够稳定产生针对Omp K蛋白抗体的单细胞,经过小鼠体内培养,饱和硫酸铵沉淀及Protein-G亲和层析法纯化,得到两株效价高、特异性强的抗体3C5、4B7。对2 株抗体的亚型以及效价进行了测定,结果表明2 株抗体均为Ig G1型,且抗体效价均高达1∶128 000。分别将2 株纯化抗体与粗提腹水、亲和层析处理的穿流液进行SDS-PAGE,电泳图表明实验所得的2 株抗体分别有一条约55 ku的重链,一条约26 ku的轻链,纯化后抗体纯度较高,纯化效果较好。2 株抗体与其他菌并无交叉反应,特异性较强。最后用改进后的丙酮沉淀法提取实验室现有的17 株弧菌外膜蛋白,并利用Western blotting分析单克隆抗体3C5与所提外膜蛋白结合能力,发现此抗体与其中的16 株有不同程度的结合反应,说明本实验制得的是能够与目标抗原相结合的强特异性单克隆抗体,竞争ELISA法测定两株抗体3C5、4B7对OmpK的检测限分别为2.5、5.0 μg/mL,敏感度较高,可用于弧菌外膜蛋白OmpK的基础研究和快速检测等应用研究。
参考文献:
[1] 陆盼盼, 郭松林, 关瑞章, 等. 致病性弧菌外膜蛋白及其免疫原性研究进展[J]. 生物技术通报, 2014(4): 163-169. DOI:10.13560/j.cnki. biotech.bull.1985.2014.04.019.
[2] ALEJANDRO G M, ANTONIO L L, RAFAEL R S, et al. Presence of pathogenic Vibrio species in fresh mussels harvested in the southern Rias of Galicia (NW Spain)[J]. Food Control, 2016, 59(1): 759-765. doi:10.1016/j.foodcont.2015.06.054.
[3] LIU Y Y , ZHANG Z H, WANG Y L, et al. A highly sensitive and flexible magnetic nanoprobe labeled immunochromatographic assayplatform for pathogen Vibrio parahaemolyticus[J]. International Journal of Food Microbiology, 2015, 211(1): 109-116. DOI:10.1016/ j.ijfoodmicro.2015.07.005.
[4] ISNANSETYO A, ISTIQOMAH I, MUHTADI, et al. A potential bacterial biocontrol agent, strain S2V2 against pathogenic marine Vib rio in aquaculture[J]. World Journal of Microbiology and Biotechnology, 2009, 25(6): 1103-1113. DOI:10.1007/s11274-009-9992-7.
[5] STALIN N, SRINIVASAN P. Molecular characterization of antibiotic resistant Vibrio harveyi isolated from shrimp aquaculture environment in the south east coast of India[J]. Microbial Pathogenesis, 2016, 97: 110-118. DOI:10.1016/j.micpath.2016.05.021.
[6] FU K, LI J, WANG Y, et al. An innovative method for rapid identification and detection of Vibrio alginolyticus in different infection models[J]. Frontiers in Microbiology, 2016, 7: 651. DOI:10.3389/ fmicb.2016.00651.
[7] ELMAHDI S, DASILVA L V, PARVEEN S. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries: a review[J]. Food Microbiology, 2016, 57: 128-134: DOI:10.1016/ j.fm.2016.02.008.
[8] 任防振, 徐国勋. 兼氧/好氧膜生物反应器处理食品废水研究[J].上海理工大学学报, 2007(3): 285-288; 293. DOI:10.13255/j.cnki. jusst.2007.03.022.
[9] 李晓莉, 张以芳, 曾令兵,等. 单克隆抗体在水产养殖中的应用[J]. 动物医学进展, 2 00 9(9): 94-9 9. DOI:10.1 6 43 7/ j.cnki.1007-5038.2009.09.027.
[10] AUNG K M, SJÖSTRÖM A E, von PAWELRAMMINGEN U, et al. Naturally occurring IgG antibodies provide innate protection against Vib rio chole rae bacteremia by recognition of the outer membrane protein U[J]. Journal of Innate Immunity, 2016, 8(3): 269-283. DOI:10.1159/000443646.Epub2016Mar3.
[11] RAJAN J J S, SANTIAGO T C, SINGARAVEL R, et al. Outer membrane p ro tein C (Omp C) of E s c h e r ic h ia c o li indu ces neurodegeneration in mice by acting as an amyloid[J]. Biotechnology Letters, 2016, 38(4): 689-700. DOI:10.1007/s10529-015-2025-8.
[12] RANA A, AKHTER Y. A multi-subunit based, thermodynamically stable model vaccine using combined immunoinformatics and protein structure based approach[J]. Immunobiology, 2016, 221(4): 544-557. DOI:10.1016/j.imbio.2015.12.004.
[13] PEDERSEN P L, KO Y H. The outer mitochondrial membrane, a smooth ‘coat’ with many holes and many roles: preparation, protein components, interactions with other membranes, involvement in health, disease, and as a drug target[M]//Encyclopedia of Cell Biology, Waltham: Academic Press, 2016: 237-243. DOI:10.1016/B978-0-12-394447-4.10029-X.
[14] MCMORRAN L M, BROCKWELL D J, RADFORD S E. Mechanisticstudies of the biogenesis and folding of outer membrane proteins in vitro and in vivo: What have we learned to date?[J]. Archives of Biochemistry and Biophysics, 2014, 564: 265-280. DOI:10.1016/ j.abb.2014.02.011
[15] INOUE T, MATSUZAKI S, TANAKA S. A 26-k Da outer membrane protein, OmpK, common to Vibrio species is the receptor for a broadhost-range vibriophage, KVP40[J]. FEMS Microbiology Letters, 1995, 125(1): 101-105. DOI:10.1016/0378-1097(94)00480-F.
[16] 伦镜盛, 袁传飞, 夏常艳, 等. 弧菌外膜蛋白OmpK免疫交叉反应性的分析[J]. 汕头大学学报(自然科学版), 2013, 28(3): 52-63.
[17] 杨智慧, 李宁求, 白俊杰, 等. 19 株海水鱼致病性弧菌O mpK基因序列及其抗原性分析[J]. 中国水产科学, 2006, 13(5): 807-813.
[18] LI N Q, BAI J J, WU S Q, et al. An outer membrane protein, OmpK, is an effective vaccine candidate for Vibrio harveyi in orange-spotted grouper (E pinep helus coioides)[J]. Fish & Shellfish Immunology, 2008, 25(6): 829-833. DOI:10.1016/j.fsi.2008.09.007.
[19] MAO Z J, YU L, YOU Z Q, et al. Cloning, expression and immunogenicty analysis of five outer membrane proteins of Vibrio parahaem olyticus zj2003[J]. Fish & Shellfish Immunology, 2007, 23(3): 567-575. DOI:10.1016/j.fsi.2007.01.004.
[20] 丁承超, 谢曼曼, 曾海娟, 等. 弧菌外膜蛋白O m p k基因序列分析及其多克隆抗体的制备[J]. 食品科学, 2016, 37(23): 141-146. DOI:10.7506/spkx1002-6630-201623015.
[21] FASIHI R M, NEDJAD M A, ARABSALMANY F, et al. Production and characterization of monoclonal and polyclonal antibody against recombinant outer membrane protein[J]. American Journal of Immunology, 2014, 105662(10): 56-62. DOI:10.3844/ajisp.2014.56.62.
[22] 李明云, 丁文 , 陈炯, 等, 溶藻弧菌外膜蛋白OmpK基因表达和间接ELISA检测方法的初步建立[J]. 水产学报, 2010, 34(10): 1559-1565. DOI:10.3724/SP.J.1231.2010.07005.
[23] 张晓华. 副溶血弧菌的外膜蛋白及其抗原性研究[J]. 中国水产科学, 1997, 4(4): 49-53.
[24] COLL J M, DOMINGUEZ-JUNCAL J. Applications of monoclonal antibodies in aquaculture[J]. Biotechnology Advances, 1995, 13(1): 45-73. DOI:10.1016/0734-9750(94)00022-5.
[25] KAUSHAL N A, KAUSHAL D C. Production and characterization of monoclonal antibodies against substrate specific loop region of Plasmodium falciparum lactate dehydrogenase[J]. Immunological Investigations, 2014, 43(6): 1118-1123. DOI:10.3109/08820139.2014. 892962.
[26] LIU B H, CHU K, YU F Y. Nov el mo no clo n al a n tibo d ybased sensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for detecting aflatoxin M
1in milk[J]. Food Control, 2016, 66: 1-7. DOI:10.1016/j.foodcont.2016.01.036.
[27] MARCOSSILVA L, NARIMATS U Y, HALIM A, e t a l. Characterization of binding epitopes of CA125 monoclonal antibodies[J]. Journal of Proteome Research, 2014, 13(7): 3349-3359. DOI:10.1021/pr500215g.
[28] 张蕾, 张西萌, 张海予, 等. 副溶血性弧菌鞭毛蛋白单克隆抗体的制备及其活性分析[J]. 细胞与分子免疫学杂志, 2013, 29(7): 734-738. DOI:10.13423/j.cnki.cjcmi.006853.
[29] FUJIMOTO Y, OZAKI K, MAEDA M, et al. Resistance to infl uenza A virus infection in transformed cell lines expressing an anti-PB2 monoclonal antibody[J]. Veterinary Journal, 2013, 198(2): 487-493. DOI:10.1016/j.tvjl.2013.09.019.
[30] KIM S H, KIM Y N, TRUONG T T, et al. Development of a monoclonal antibody specific to envelope domain III with broadspectrum detection of all four dengue virus serotypes[J]. Biochemical and Biophysical Research Communications, 2016, 473(4): 894-898. DOI:10.1016/j.bbrc.2016.03.146.
Preparation and Characterization of Monoclonal Antibodies against Vibrio Outer Membrane Protein OmpK
LI Jie
1, DING Chengchao
1, ZHAI Xuzhao
1, WANG Guangbin
2, LIU Wukang
1, XIE Manman
1, ZENG Haijuan
1, WANG Shujuan
1, SUN Jingjuan
1, DONG Qingli
1, LIU Qing
1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Xuzhou Green and Healthy Dairy Drinks Co. Ltd., Xuzhou 221006, China)
Abstract:This study aimed to prepare and characterize monoclonal antibodies (Mab) against outer membrane protein K (Omp K) of Vibrio. We injected Balb/c mice with Omp K of the Vib rio parahaemolyticus wild-type strain B expressed by a prokaryotic expression system. Spleen cells from the immunized mice were fused with SP2/0 tumor cells. Then the hybrid cell lines which can stably secrete monoclonal antibody were screened out by using the limited dilution method and indirect enzyme linked immunosorbent assay (ELISA) method. Ascites was produced in the mice and then purified by saturated ammonium sulfate precipitation and Protein G affi nity chromatography. Finally, we obtained two hybridoma cell lines namely OmpK-Mab-4B7 and OmpK-Mab-3C5, which can stably secrete anti OmpK monoclonal antibody. The Mab subtypes secreted by both hybrid tumor cell lines were IgG1 and their titers reached 1:128 000. The sensitivity IC
50of 3C5 and 4B7 antibodies were 2.5 and 5.0 μg/mL, respectively. The results of Western blotting showed that the Mab could combine with the outer membrane proteins of 12 strains Vibrio parahaemolyticus (A, B, C, D, E, F, G, H, I, J, ATCC17802, and ATCC33847), 3 (A, B, and C) of 4 Vibrio alginolyticus strains and 1 Vibrio anguillarum strain (MVM). The monoclonal antibodies can be used for basic research and rapid detection of OmpK.
Key words:Vibrio; outer membrane protein K; monoclonal antibody
DOI:10.7506/spkx1002-6630-201706017
中图分类号:TS207.4
文献标志码:A
文章编号:1002-6630(2017)06-0111-06
引文格式:
李杰, 丁承超, 翟续昭, 等. 弧菌外膜蛋白OmpK单克隆抗体的制备及其特性[J]. 食品科学, 2017, 38(6): 111-116.
DOI:10.7506/spkx1002-6630-201706017. http://www.spkx.net.cn
LI Jie, DING Chengchao, ZHAI Xuzhao, et al. Preparation and characterization of monoclonal antibodies against Vibrio outer membrane protein OmpK[J]. Food Science, 2017, 38(6): 111-116. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201706017. http://www.spkx.net.cn
收稿日期:2016-07-22
基金项目:上海市科技创新行动计划项目(15395810900);上海理工大学研究生创新基金资助项目;
上海理工大学微创励志创新基金项目
作者简介:李杰(1990—),女,硕士研究生,研究方向为食源性致病菌致病机理及检测。E-mail:13569416654@163.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理及快速检测技术。E-mail:liuq@usst.edu.cn