
刘伟华,李 荣,姜子涛*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:在微波辅助的条件下,以环氧树脂为载体固定化胰蛋白酶。通过单因素试验和响应面分析法确定了微波辅助固定化胰蛋白酶的最佳条件:微波温度30 ℃、给酶量41 mg/g、pH 6.2、微波时间10 min。在此条件下制备的固定化胰蛋白酶活力为322.56 U/g树脂,高于传统振荡方法制备的固定化酶活力,将原来20 h的固定化时间缩短到几分钟,并且固定化酶具有良好的稳定性,由此可见微波辅助固定化酶是一种高效的固定化方法。
关键词:固定化酶;环氧树脂;微波;响应面;高效
胰蛋白酶是对底物选择性最高的蛋白酶之一,能高度特异地水解由赖氨酸或精氨酸所构成的肽键、酰胺键和酯键,在食品、制药、皮革、纺织、化妆品、畜牧、医疗及生物技术中都有着广泛的应用。但是游离的胰蛋白酶易自溶解折叠,限制了它的大规模应用。而固定化酶技术不仅使酶的稳定性提高,而且实现了酶的重复利用,产物易于从底物中分离,反应过程也更容易控制。
固定化酶的方法有很多,其中共价固定化是最为常用的方法 [1-9],然而共价固定化过程往往需要花费大量的时间。因此,一些国内外学者对采用微波辅助制备固定化酶开展了相关的研究。微波是一种电磁波,它直接作用于极性分子使之运动而发热,所以微波辐射能够使反应在温和的条件下进行,能够加速反应缩短反应时间,提高产率。蛋白质和多肽都是极性物质,所以在蛋白质和多肽参与的反应中引入微波,可以极大加速反应进程。Bezbradica等 [10]曾采用微波辐射技术将产自于假丝酵母的脂肪酶固定化在Eupergit载体上;另有研究 [1 1-1 4]在低温条件下采用微波辐射技术将醛缩酶、脂肪酶、木瓜蛋白酶和青霉素酰基转移酶固定化到功能化介孔泡沫硅(MCF S-NH 2)载体上;van Langen等 [15]采用微波辐射固定化青霉素酰化酶,Plagemann等 [16]采用微波辅助共价固定化漆酶,结果都表明微波辐射能显著地缩短固定化时间,使固定化时间由数小时降低到几分钟;得到的固定化酶活力高于游离酶,且稳定性增强。Chen Feifei等 [17]研究表明在微波辐射条件下盐溶制备的固定化嗜热菌蛋白酶催化活性提高,固定化过程仅需3 min。Sathvika等 [18]甚至采用微波辅助将酵母固定到纤维素生物聚合物上。目前,对于采用微波固定化胰蛋白酶鲜见报道。
ES-105环氧树脂是天津南开和成科技有限公司近年来研发专门用来固定化酶的树脂,本研究以ES-105环氧树脂为固定化载体,在微波辐射的条件下对胰蛋白酶进行固定化,采用响应面分析法优化了固定化胰蛋白酶的制备工艺,并对制备的固定化酶的性质做了研究。
1.1 材料与试剂
胰蛋白酶(2 50 U/mg) 美国Amresco公司;ES-105环氧树脂 天津南开和成科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
Multi SYNTH微波合成仪 意大利Milestone公司;Alpha-1500紫外-可见分光光度计 上海谱元仪器有限公司;FA1104N型电子天平 上海精密仪器有限公司;水浴恒温振荡器 天津市欧诺仪器仪表有限公司。
1.3 方法
1.3.1 微波辅助固定化胰蛋白酶
树脂的预处理:称取ES-105树脂5 g,用一定pH值的1 mol/L的K 2HPO 4-KH 2PO 4缓冲溶液冲洗3 次 [1 9-20],每次30 mL,滤干后备用。
固定化酶:称取上述树脂0.5 g,置于60 mL磨口圆底烧瓶中,加入用缓冲溶液配制的胰蛋白酶溶液10 mL,置于微波合成仪中,在一定的条件下反应一定时间,取出用蒸馏水洗净树脂上未固定的胰蛋白酶(洗至洗涤液在280 nm波长处无吸收),将树脂滤干,即得固定化胰蛋白酶。
1.3.2 酶活力的测定
采用福林-酚法 [21]。在40 ℃、pH 8.0的条件下,每克固定化酶水解酪蛋白1 min产生1 µg酪氨酸所需的酶量为一个酶活力单位,以U/g树脂表示。固定化酶活力测定基本同游离酶,但在酶反应过程中将其置于水浴恒温振荡器中,以使固定化酶与底物充分接触。固定化酶活力回收率计算如下式所示:

1.3.3 单因素试验
准确称取0.5 g经过预处理的树脂,参照1.3.1节方法,分别改变固定化的给酶量、微波温度、pH值、微波时间进行单因素试验。随后测定制备的固定化酶活力。
1.3.4 响应面试验设计
在单因素试验结果的基础上,选取给酶量、微波温度、p H值为主要影响因素,采用Box-Behnken法,设计三因素三水平试验方案,对数据进行响应面分析,中心试验重复5 次。响应面试验因素与水平设计见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels used in the response surface design
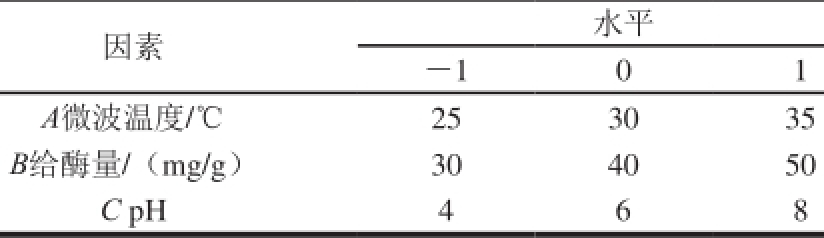
因素水平-1 0 1 A微波温度/℃25 30 35 B给酶量/(mg/g)30 40 50 C pH 4 6 8
1.3.5 传统方法固定化胰蛋白酶的对比
将本研究与传统方法进行比较 [20],传统方法固定化胰蛋白酶方法:称取预处理后的树脂0.5 g于100 mL具塞锥形瓶中,加入用缓冲溶液配制的胰蛋白酶溶液10 mL,置于水浴恒温振荡器中,于30 ℃条件下150 r/min振荡20 h,之后用蒸馏水洗净树脂上未固定的胰蛋白酶(洗至洗液A 280 nm为0),将树脂滤干,即为传统方法制备的固定化胰蛋白酶。
2.1 单因素试验结果
按照1.3.3节方法,分别测定不同微波温度、给酶量、pH值及微波时间条件下固载的固定化胰蛋白酶活力,以各条件下的最高酶活力值为100%,折算出相应条件下的固定化酶的比活力,得到相对酶活力,结果见图1。
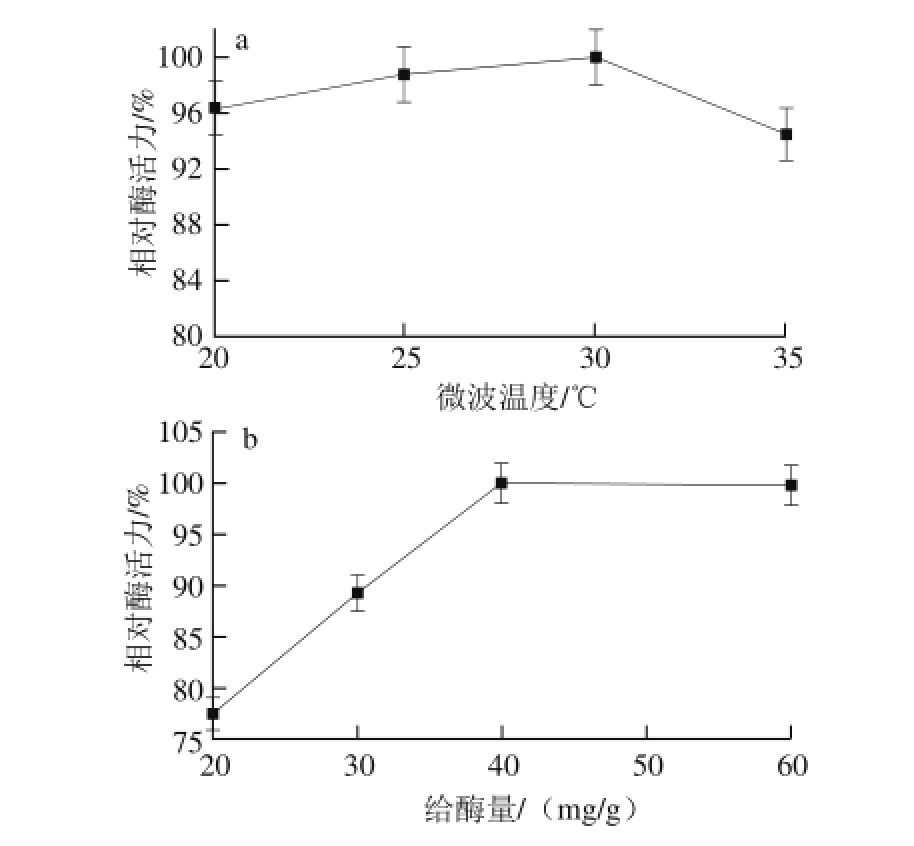
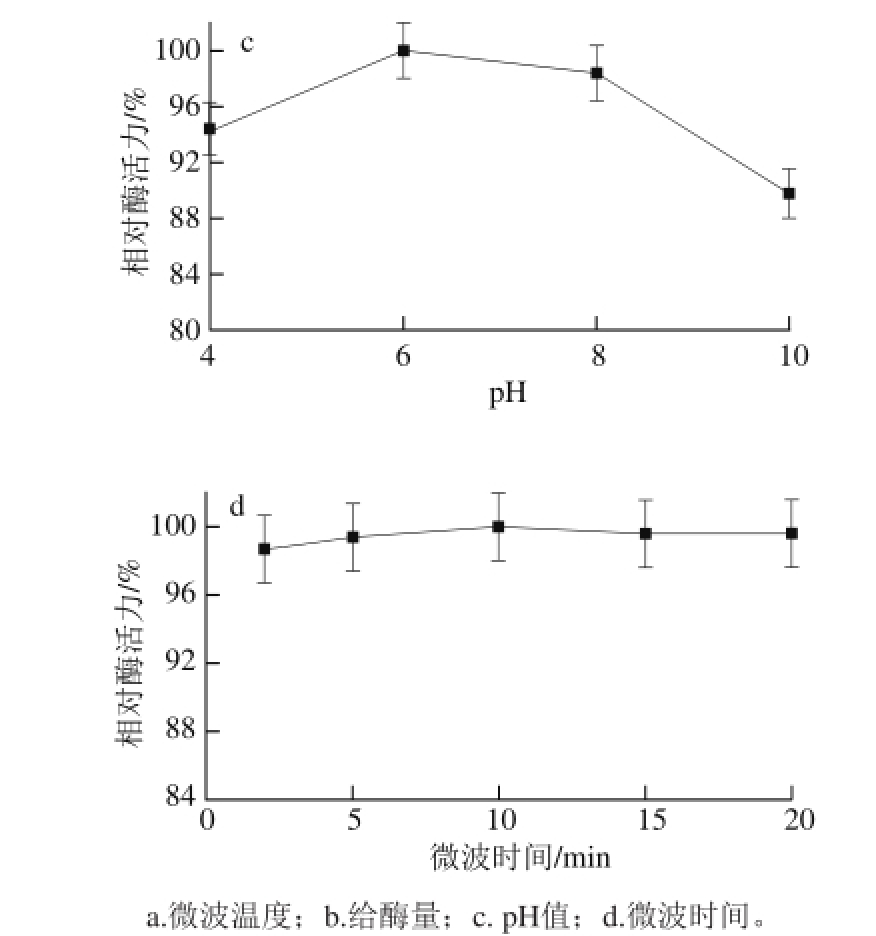
图1 各因素对相对酶活力影响的单因素试验结果
Fig. 1 Effects of microwave temperature, trypsin dosage, pH and
immobilization time on relative enzyme activity
本实验中使用的微波合成仪的工作机理为在设定的温度条件下,功率可以自由选择以达到设定的温度,并保持温度恒定不变,因此实验过程中的微波功率不是恒定的。如图1a所示,当微波温度恒定在30 ℃时,制备的固定化酶活力最高,此条件下微波的平均功率为20 W左右。Penafiel等 [22]研究表明微波辐射会对固定化酶的空间构象及活力产生不同的影响。由于学者们对于微波温度对酶的影响作用观点不一,而微波辐射的作用主要是由微波强度引起 [23],因此本研究认为当温度设定在30 ℃时的功率最适宜该环氧树脂固定化胰蛋白酶。随着给酶量的增加,固定化酶的相对酶活力增大(图1b)。当每克树脂添加40 mg胰蛋白酶时,制备得到的固定化酶相对酶活力最大,这是由于载体上的功能基团是有限的,当加入过量的酶,多余的酶无法共价固定到载体上,在冲洗的过程中会被洗下来,所以酶活力不会再增大。固定化酶的载体本身会改变酶活性位点周围的p H值,因为载体可以诱导溶液中分子与载体间的静电平衡和疏水相互作用,这些相互作用可以改变酶反应时的微环境 [24]。pH 6时固定化酶的相对酶活力最大(图1c)。酶液p H值会影响到酶蛋白侧链氨基的解离形式 [25-26],进而影响载体上的环氧基团与酶分子发生共价结合的基团类型。当pH值偏低时,环氧基团与酶分子上的羧基结合;当为中性或偏碱性时,与巯基结合;当pH值大于9时与氨基结合 [27-28]。在20 min内,微波时间的不同对酶活力影响不大,固定10 min左右时相对酶活力较高(图1d)。适当的微波辐射可以调节蛋白的分子结构使其活性增强 [22],但是过长时间的微波辐射会使得蛋白酶分子结构的破坏,使固定化酶的活力降低 [16]。
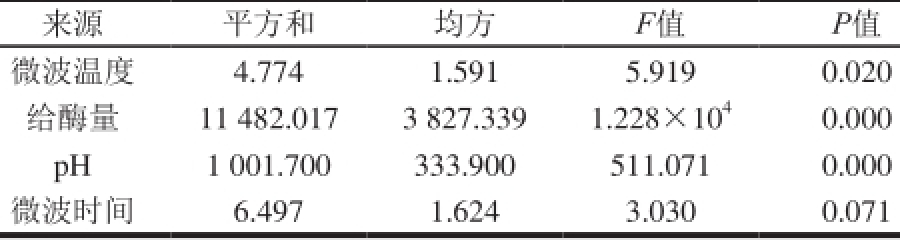
2.2 单因素试验方差分析
表2 单因素试验的方差分析
Table 2 Analysis of variance of one-factor-at-a-time experiments
来源平方和均方F值P值微波温度4.774 1.591 5.919 0.020给酶量11 482.017 3 827.339 1.228×10 40.000 pH 1 001.700 333.900 511.071 0.000微波时间6.497 1.624 3.030 0.071
通过SPSS处理单因素试验数据,确定影响固定化酶活力的各因素的大小关系为:给酶量>p H值>微波温度>微波时间,如表2所示。其中给酶量、p H值和微波温度3 个因素的P值分别为0.000、0.000及0.020,是影响固定化酶活力的显著因素,而微波时间的影响不显著。这是因为固定化胰蛋白酶使用的微波温度较低(3 0 ℃),维持此温度所需的微波功率也较低,在实验过程中时间延长没有对酶造成较大的影响,微波时间表现为不显著。在应用响应面分析法进行最优条件分析时,设定微波时间为10 min,以确定最优工艺条件。
2.3 响应面试验结果
响应面试验方案及结果见表3,回归方程的方差分析见表4。
表3 响应面试验方案及结果Table 3 Experimental design and results for response surface analysis

试验号A微波温度B给酶量C pH酶活力/(U/g树脂)1-1-1 0 281.0 2-1 1 0 290.1 3 1 -1 0 276.9 4 0 0 0 319.5 5 0 -1-1 265.8 6 0 0 0 322.0 7 0 1-1 280.2 8 0 0 0 321.6 9 0 1 1 285.2 10 1 0 1 289.5 11 1 1 0 283.4 12 0-1 1 278.7 13-1 0-1 281.8 14 0 0 0 321.8 15 1 0-1 281.3 16-1 0 1 290.8 17 0 0 0 322.2
利用Design-Expert软件对试验结果进行拟合,得到以酶活力Y为响应值,对自变量微波温度、给酶量和p H值三因素的回归方程为:Y=-847.152 5+36.601 5 A+ 20.206 75 B+68.142 5C-0.012 5 AB-0.02A C-0.1B C-0.604 9A 2-0.234 73B 2-5.111 87C 2。
由表4可知,模型P值小于0.000 1,说明该模型具有显著性;失拟项P值为0.117 5,大于0.05,不显著,说明回归拟合的情况良好,可以用其进行固定化酶活力的预测和分析。对回归方程各项的方差分析结果表明,方程的一次项B、C及二次项A 2、B 2和C 2的P值均小于0.01,极显著,一次项A及交互项B C是显著的,而交互项AB、AC不显著,说明此方程的拟合较充分。各因素对固定化酶活力的影响依次为:给酶量>pH值>微波温度,与SPSS分析结果一致。
表4 回归方程的方差分析
Table 4 Analysis variance of regression equation

注:P<0.05,差异显著;P<0.01,差异极显著。
来源平方和自由度方差F值P值模型5 968.08 9 663.12 253.65<0.000 1 A微波温度19.53 1 19.53 7.47 0.029 2 B给酶量164.71 1 164.71 63.00<0.000 1 C pH 154.88 1 154.88 59.24 0.000 1 AB 1.56 1 1.56 0.60 0.464 8 AC 0.16 1 0.16 0.061 0.811 7 BC 16.00 1 16.00 6.12 0.042 6 A 2962.91 1 962.91 368.31<0.000 1 B 22 319.82 1 2 319.82 887.34<0.000 1 C 21 760.42 1 1 760.42 673.37<0.000 1残差18.30 7 2.61失拟项13.49 3 4.50 3.74 0.117 5纯误差4.81 4 1.20总和5 986.38 16
对响应面数据(表3)进行二次多元回归拟合,去除不显著的交互项A B、A C,得到固定化酶活力对3 个因素的二次多项回归方程:y=-828.552 5+35.981 5A+
19.831 75B+67.542 5C-0.1BC-0.604 9A 2-0.234 72 B 2-
5.111 88 C
2。优化后,模型极显著,失拟项不显著,决定系数R
2为0.996 7,调整系数
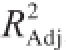 为0.994 1,预测系数
为0.994 1,预测系数
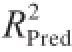 为0.985 0,说明测定值与模型预测值之间具有良好的相关度
[29]。调整系数和预测系数值高且接近(
为0.985 0,说明测定值与模型预测值之间具有良好的相关度
[29]。调整系数和预测系数值高且接近(
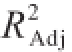 -
-
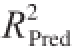 <0.2),则回归模型能充分说明工艺过程
[30]。
<0.2),则回归模型能充分说明工艺过程
[30]。
2.4 响应面分析

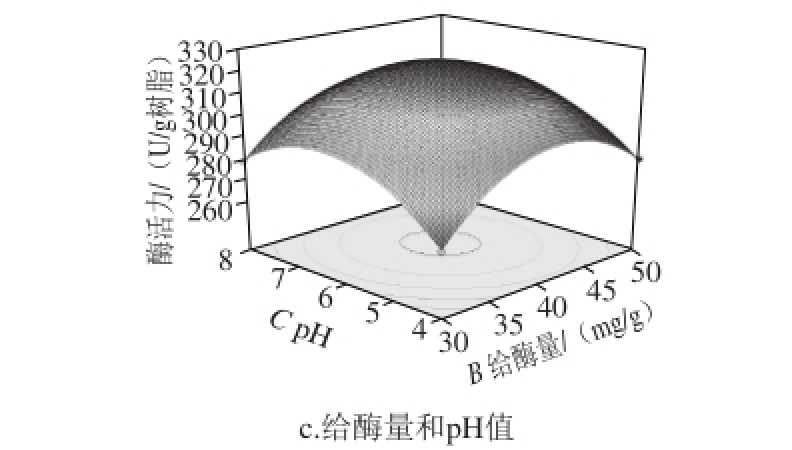
图2 各因素交互影响的响应面图
Fig. 2 Response surface plots showing the effects of various factors on the relative activity of immobilized trypsin
各因素交互作用影响的响应面见图2。通过回归模型预测,给出的固定化酶的最佳工艺条件为微波温度29.74 ℃、给酶量40.9 2 mg/g、p H 6.2 1、微波时间10 min,在此条件下酶活力的预测值为321.90 U/g树脂。考虑到实验的可操作性,修正最佳工艺条件为提取温度30 ℃、给酶量41 mg/g、p H 6.2、微波时间10 min。在此条件下进行3 次平行验证实验,固定化胰蛋白酶的活力为322.56 U/g树脂,相对误差为0.20%,与预测值接近,固定化酶活力回收率为16.2%。
2.5 固定化胰蛋白酶的特性
2.5.1 固定化胰蛋白酶的温度稳定性
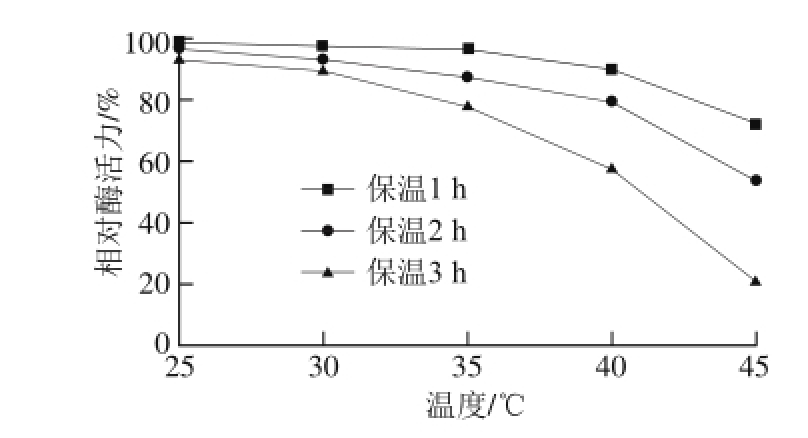
图3 固定化胰蛋白酶的温度稳定性
Fig. 3 Thermal stability of immobilized trypsin
将固定化胰蛋白酶放入缓冲液中分别在不同温度的水浴中放置1、2、3 h后测定其酶活力,以未处理的固定化酶的酶活力为100%,换算出不同时间及温度条件下固定化酶的相对酶活力。如图3所示,由于高温使载体不稳定,环氧树脂制备的固定化胰蛋白酶对温度的适应范围不大,随着温度的升高及连续保温时间的延长,固定化酶的活力下降较快。因此应将固定化胰蛋白酶保存在冰箱等低温环境,在使用固定化胰蛋白酶酶解时注意不要长时间将其置于高温环境中。
2.5.2 固定化胰蛋白酶的酸碱稳定性
将固定化胰蛋白酶置于不同p H值的缓冲液中,在4 ℃放置3 h,以最高酶活力为100%,换算出各pH值条件下的相对酶活力。p H值是影响酶活力的一个重要因素,在不同p H值条件下,共价结合后的酶分子构象发生变化,其活性也会发生相应改变。由图4可知,以环氧树脂为载体制备的固定化胰蛋白酶的酶活力在p H 8时活力最低,在酸性(pH值小于6)及碱性(pH值大于9)的条件下其活力较好。
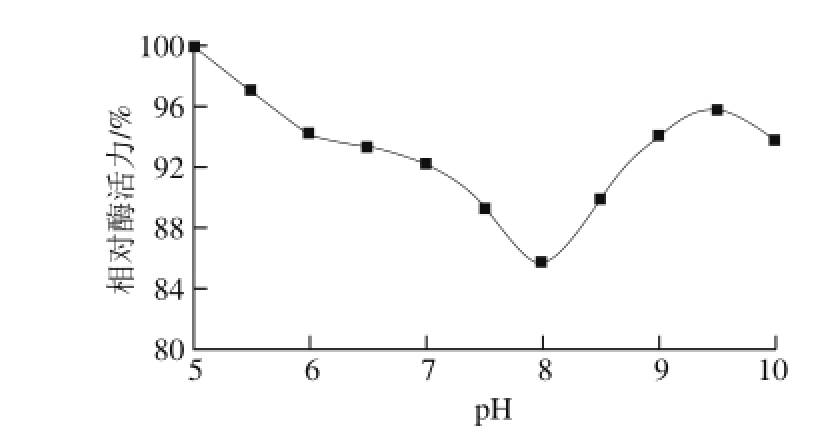
图4 固定化胰蛋白酶的酸碱稳定性
Fig. 4 pH stability of immobilized trypsin
2.5.3 固定化胰蛋白酶的操作稳定性

图5 固定化胰蛋白酶的操作稳定性
Fig. 5 Operational stability of immobilized trypsin
按照1.3.2节的方法,重复使用固定好的胰蛋白酶,每使用完一次将固定化酶用蒸馏水清洗干净并将其置于新的底物中继续反应。以第1次的酶活力为100%,换算出不同使用次数后固定化酶的相对酶活力,结果如图5所示。该固定化胰蛋白酶具有较好的操作稳定性,连续重复使用9 次后,其酶活力仍保存了原来的63.2%。
2.5.4 固定化胰蛋白酶的贮藏稳定性
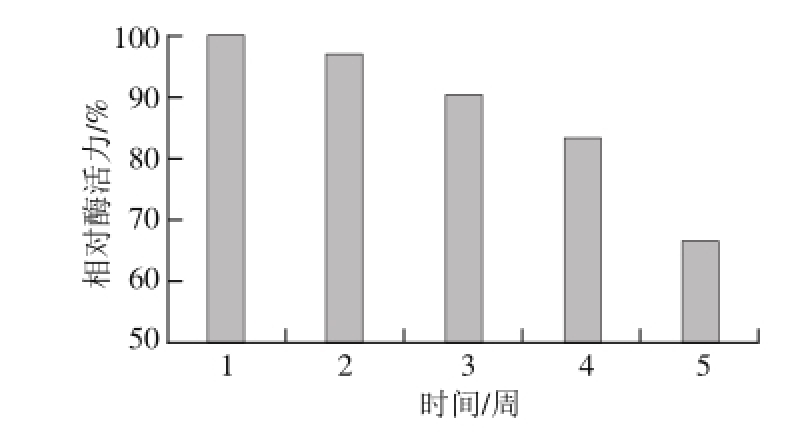
图6 固定化胰蛋白酶的贮藏稳定性
Fig. 6 Storage stability of immobilized trypsin
将固定化胰蛋白酶置于4 ℃冰箱密封保存,每隔1 周测定其活力,以最初酶活力为100%,换算出保存不同时间的相对酶活力,结果如图6所示。此固定化胰蛋白酶具有较好的贮藏稳定性,在冰箱放置4 周后其酶活力能保持原来的79.8%,5 周后仍能保持原来的64.6%。
2.6 传统方法固定化胰蛋白酶的对比
采用传统固定化方法制备的固定化胰蛋白酶活力平均值为310.83 U/g树脂,即微波辅助制备的固定化胰蛋白酶的酶活力是其1.04 倍;而微波辅助制备固定化酶的时间仅为传统固定化方法的1/120。可见,微波辅助固定化酶是一种高效的固定化方法。
以环氧树脂为固定化载体,采用微波辅助方法制备的固定化胰蛋白酶具有较好的稳定性。制备该固定化胰蛋白酶的最佳条件为:微波温度3 0 ℃、给酶量41 mg/g、pH 6.2、微波时间10 min。在此条件下制备的固定化胰蛋白酶活力高于传统振荡方法,且将原来20 h的固定化时间缩短到几分钟,是一种高效的固定化酶方法。
参考文献:
[1] 温小荣, 夏小乐, 杨海麟, 等. 氨基化大孔硅胶共价固定P an creas porcine脂肪酶的研究[J]. 现代食品科技, 2013, 29(10): 2487-2497. DOI:10.13982/j.mfst.1673-9078.2013.10.038.
[2] 华承伟, 于江傲, 谢凤珍, 等. 拟青霉β-1,3(4)-葡聚糖酶同源建模及共价固定化[J]. 食品科学, 2013, 34(1): 252-256.
[3] 于小雯, 盛凯旋, 陈骥, 等. 基于石墨烯修饰电极的电化学生物传感[J].化学学报, 2014, 72(3): 319-332. DOI:10.6023/A13080848.
[4] GARMROODI M, MOHAMMADI M, RAMAZANI A, et al. Covalent binding of hyper-activated Rhizomucor miehei lipase (RML) on hetero-functionalized siliceous supports[J]. International Journal of Biological Macromolecules, 2016, 86: 208-215. DOI:10.1016/ j.ijbiomac.2016.01.076.
[5] KUMARI S, CHAUHAN G S, AHN J H, et al. Bio-waste derived dialdehyde cellulose ethers as supports for alpha-chymotrypsin immobilization[J]. International Journal of Biological Macromolecules, 2016, 85: 227-237. DOI:10.1016/j.ijbiomac.2015.12.063.
[6] LAI E P, WANG Y X, WEI Y, et al. Covalent immobilization of trypsin onto thermo-sensitive poly (N-isopropylacrylamide-coacrylic acid) microspheres with high activity and stability[J]. Journal of Applied Polymer Science, 2016, 133(21): 43343. DOI:10.1002/ app.43343.
[7] IBRAHIM A S S, ALSALAMAH A A, ELTONI A M, et al. Enhancement of alkaline protease activity and stability via covalent immobilization onto hollow core-mesoporous shell silica nanospheres[J]. International Journal of Molecular Sciences, 2016, 17(2): 184. DOI:10.3390/ijms17020184.
[8] CAO Y, WEN L Y, SVEC F, et al. Magnetic AuNP@Fe 3O 4nanoparticles as reusable carriers for reversible enzyme immobilization[J]. Chemical Engineering Journal, 2016, 286: 272-281. DOI:10.1016/j.cej.2015.10.075.
[9] GUO H, TANG Y, YU Y, et al. Covalent immobilization of alphaamylase on magnetic particles as catalyst for hydrolysis of highamylose starch[J]. International Journal of Biological Macromolecules, 2016, 87: 537-544. DOI:10.1016/j.ijbiomac.2016.02.080.
[10] BEZBRADICA D, MIJIN D, MIHAILOVIC M, et al. Microwaveassisted immobilization of lipase from Candida rugosa on Eupergit (R) supports[J]. Journal of Chemical Technology and Biotechnology, 2009, 84: 1642-1648. DOI:10.1002/jctb.2222.
[11] WANG A M, WANG M Z, WANG Q Y, et al. Stable and effi cient immobilization technique of aldolase under consecutive microwave irradiation at low temperature[J]. Bioresource Technology, 2011, 102: 469-474. DOI:10.1016/j.biortech.2010.08.048.
[12] WANG A M, LIU M Q, WANG H, et al. Improving enzyme immobilization in mesocellular siliceous foams by microwave irradiation[J]. Journal of Bioscience and Bioengineering, 2008, 106: 286-291. DOI:10.1263/jbb.106.286.
[13] WANG A M, ZHOU C, DU Z Q, et al. Enhancement of microwaveassisted covalent immobiliz ation of penicillin acylase using macromolecular crowding and glycine quenching[J]. Journal of Bioscience and Bioengineering, 2009, 107: 219-224. DOI:10.1016/ j.jbiosc.2008.10.021.
[14] DU Z Q, WANG A M, ZHOU C, et al. Microwave-Assisted lipase covalent immobilization and improved its thermal stability using alcohols to quench excessive activated groups on support surface[J]. Journal of Chemical Engineering of Japan, 2009, 42: 441-446.
[15] van LANGEN L M, JANSSEN M H A, OOSTHOEK N H P, et al. Active site titration as a tool for the evaluation of immobilization procedures of penicillin acylase[J]. Biotechnology and Bioengineering, 2002, 79: 224-228. DOI:10.1002/bit.10280.
[16] PLAGEMANN R, von LANGERMANN J, KRAGL U. Microwaveassisted covalent immobilization of enzymes on inorganic surfaces[J]. Engineering in Life Science, 2014, 14(5): 493-499. DOI:10.1002/ elsc.201300115.
[17] CHEN F F, ZHANG F K, DU F C, et al. A novel and efficient method for the immobilization of thermolysin using sodium chloride saltingin and consecutive microwave irradiation[J]. Bioresource Technology, 2012, 115: 158-163. DOI:10.1016/j.biortech.2011.11.059.
[18] SATHVIKA T, MANASI, RAJESH V, et al. Microwave assisted immobilization of yeast in cellulose biopolymer as a green adsorbent for the sequestration of chromium[J]. Chemical Engineering Journal, 2015, 279: 38-46. DOI:10.1016/j.cej.2015.04.132.
[19] WHEATLEY J B, SCHMIDT D E. Salt-induced immobilization of affinity ligands onto epoxide-activated supports[J]. Journal of Chromatography A, 1999, 849(1): 1-12. DOI:10.1016/S0021-9673(99)00484-7.
[20] 高克亮, 颜淑玮, 许伟钦, 等. PGA在含环氧活性基的多孔高聚物载体上的固定化及修饰[J]. 华东理工大学学报, 2007, 33(6): 798-802. DOI:10.14135/j.cnki.1006-3080.2007.06.009.
[21] 王秀奇, 秦淑媛, 高天慧, 等. 基础生物化学实验[M]. 北京: 高等教育出版社, 1999.
[22] PENAFIEL L M, LITOVITZ T, KRAUSE D, et al. Role of modulation on the effect of microwaves on ornithine decarboxylase activity in L929 cells[J]. Bioelectromagnetics, 1997, 18: 132-141. DOI:10.1002/ (SICI)1521-186X(1997)18:2<132::AID-BEM6>3.0.CO;2-3.
[23] VUKOVA T, ATANASSOV A, IVANOV R, et al. Intensity-dependent effects of microwave electromagnetic fields on acetylcholinesterase activity and protein conformation in frog skeletal muscles[J]. Medical Science Monitor, 2005, 11: 50-56.
[24] TEMPORINI C, CALLERI E, CABRERA K, et al. On-line multienzymatic approach for improved sequence coverage in protein analysis[J]. Journal of Separation Science, 2009, 32: 1120-1128. DOI:10.1002/jssc.200800596.
[25] COSTANTINO H R, GRIEBENOW K, LANGER R, et al. On the pH memory of lyophilized compounds containing protein functional groups[J]. Biotechnolo gy Bioengine ering, 1997, 53(3): 345-348. DOI:10.1002/(SICI)1097-0290(19970205)53:3<345::AIDBIT14>3.0.CO;2-J.
[26] ZAKS A, KLIBANOV A M. Enzyme-catalyzed processes in organicsolvents[J]. Proceedings of the National Academy of Sciences of the United States of America, 1985, 82(10): 3192-3196.
[27] de SEGURA A G, ALCALDE M, YATES M, et al. Immobilization of dextransucrase from Leuconostoc mesenteroides NRRLB-512F on Eupergit C Supports[J]. Biotechnology Progress, 2004, 20(5): 1414-1420. DOI:10.1021/bp0400083.
[28] 崔培梧, 黎继烈, 肖作为, 等. 环氧基树脂固定化青霉菌柚苷酶的工艺条件[J]. 食品与发酵工业, 2014, 40(5): 87-92. DOI:10.13995/ j.cnki.11-1802/ts.2014.05.021.
[29] 刘自琴, 黄惠华. 响应面法优化脂肪酶的固定化条件及其水解橄榄油的特性研究[J]. 食品科学, 2012, 33(3): 184-189.
[30] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索, 2015, 34(8): 41-45.
Optimization of Microwave-Assisted Immobilization of Trypsin Using Response Surface Methodology
LIU Weihua, LI Rong, JIANG Zitao*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:Trypsin was immobilized onto epoxy resin under microwave irradiation. Using one-factor-at-a-time method and response surface methodology (RSM), the optimal conditions of immobilization were obtained as follows: trypsin dosage, 41 mg/g; microwave irradiation time, 10 min; pH, 6.2; and temperature, 30 ℃. Under these conditions, the activity of immobilized trypsin was 322.56 U/g resin, which was higher than that of traditional immobilized trypsin and the immobilization time was shortened from 20 h to a few minutes. Furthermore, immobilized trypsin had a good stability. Thus, microwave-assisted immobilization provides an effi cient way of immobilizing trypsin.
Key words:immobilized trypsin; epoxy resin; microwave; response surface methodology; high effi ciency
DOI:10.7506/spkx1002-6630-201706018
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)06-0117-06
引文格式:
刘伟华, 李荣, 姜子涛. 响应面试验优化微波辅助固定化胰蛋白酶工艺[J]. 食品科学, 2 017, 3 8(6): 117-1 2 2.
DOI:10.7506/spkx1002-6630-201706018. http://www.spkx.net.cn
LIU Weihua, LI Rong, JIANG Zitao. Optimization of microwave-assisted immobilization of trypsin using response surface methodology[J]. Food Science, 2017, 38(6): 117-122. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201706018. http://www.spkx.net.cn
收稿日期:2016-05-02
基金项目:天津市自然科学基金重点项目(12JCZDJC34100);天津市高等学校创新团队培养计划项目(TD12-5049)
作者简介:刘伟华(1990—),女,硕士研究生,研究方向为食品添加剂。E-mail:1059492293@qq.com
*通信作者:姜子涛(1956—),男,教授,博士,研究方向为食品添加剂。E-mail:ztjiang@tjcu.edu.cn