表1 酿酒葡萄基础数据
Table 1 Physicochemical properties of the wine grapes
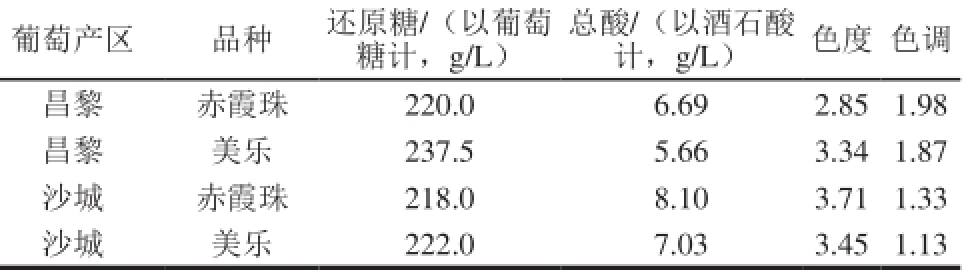
葡萄产区品种还原糖/(以葡萄总酸/(以酒石酸色度色调糖计,g/L)计,g/L)昌黎赤霞珠220.0 6.69 2.85 1.98昌黎美乐237.5 5.66 3.34 1.87沙城赤霞珠218.0 8.10 3.71 1.33沙城美乐222.0 7.03 3.45 1.13
周立华 1,李 艳 1,2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
摘 要:自选酿酒酵母KDLYS9-16高产β-D-葡萄糖苷酶,在葡萄酒酿造过程中,能够释放单萜烯类物质,增强葡萄酒的香气。以2015年份河北省昌黎和沙城葡萄酒产区赤霞珠和美乐葡萄为实验材料,以商品酿酒酵母F15和SC为对照菌,对KDLYS9-16酵母菌的降糖和酒精生成能力、以及葡萄酒香气进行测定与比较。结果表明自选菌比对照菌具有启动发酵快、降糖迅速、发酵周期短、酒精转化率高等优点。用该菌发酵的昌黎产区赤霞珠干红葡萄原酒中检测到32 种香气物质,占总挥发性物质的98.94%,比对照菌香气物质的质量分数和种类都明显增加,显示了很好的酿酒性能和产香潜质,具有良好的应用前景。
关键词:自选酿酒酵母;β-D-葡萄糖苷酶;酿酒性能;香气
风味和口感是衡量葡萄酒品质的重要指标,酵母菌对于发酵过程中风味物质的形成影响极大。酿酒过程中,酵母菌产生的β-D-葡萄糖苷酶能分解结合态芳香前体物质释放具有呈香作用的单萜烯类物质 [1-6],对葡萄酒香气的提升具有十分重要的作用。筛选和利用产β-D-葡萄糖苷酶的酿酒酵母酿造葡萄酒是近年来的重要课题。Wanapu等 [7]以普通酵母菌为对照,使用自选产β-D-葡萄糖苷酶的酵母菌进行发酵实验,发现葡萄酒中乙酸己酯、芳樟醇、苯乙醇、橙花醇、香叶醇等质量分数明显增加;González-Pombo等 [8]将固定化的β-D-葡萄糖苷酶加入到玫瑰香白葡萄酒中,经过20 d的水解后,游离态香气物质比对照组明显提高,其中香叶醇质量分数高于其感官阈值3~4 倍。此外,Otero [9]、Wang Yuxia [1 0]和Vernocchi [11]等均研究了β-D-葡萄糖苷酶增强葡萄酒香气的作用。
本研究以商品酿酒酵母F15和SC为对照菌,对自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16发酵葡萄酒的性能进行了研究,并检测分析以昌黎产区赤霞珠葡萄酿造的干红葡萄原酒香气物质组成,为评价自选菌的应用前景提供数据支持。
1.1 材料与试剂
1.1.1 酿酒葡萄
美乐和赤霞珠葡萄为2015年葡萄成熟季节,分别采摘于河北省昌黎和沙城葡萄酒产区,4 种酿酒葡萄的基础检测数据见表1。
表1 酿酒葡萄基础数据
Table 1 Physicochemical properties of the wine grapes

葡萄产区品种还原糖/(以葡萄总酸/(以酒石酸色度色调糖计,g/L)计,g/L)昌黎赤霞珠220.0 6.69 2.85 1.98昌黎美乐237.5 5.66 3.34 1.87沙城赤霞珠218.0 8.10 3.71 1.33沙城美乐222.0 7.03 3.45 1.13
1.1.2 酿酒酵母
自选酿酒酵母KDLYS9-1 6(Gen Ba n k登录号:KX1 1 9 94 3)选自沙城产区龙眼葡萄自然发酵后期,核糖体2 6 S D1/D2区域限制片长多态性(restriction fragment length polymorphism,RFLP)分析该菌株的基因序列见图1。
商品酿酒酵母F15 法国Laffort公司;商品酿酒酵母SC 意大利Esseco公司。

图1 KDLYS9-16基因序列
Fig. 1 Gene sequence of KDLYS9-16
1.1.3 试剂
氯化钠、氢氧化钠、硫酸铜(均为分析纯) 天津市永大化学试剂有限公司;偏重亚硫酸钾(分析纯)、HE果胶酶 法国Laffort公司。
1.2 仪器与设备
7820-5975C气相色谱-质谱(g as chromatographymass spectrography,GC-MS)联用仪 美国安捷伦公司;2 cm-50/30 μm DVB/Carboxen/PDMS萃取头及萃取手柄 美国Supelco公司;DF-101S集热式恒温加热磁力搅拌器 巩义市英峪华仪器厂;生物显微镜 日本奥林巴斯集团;电子天平 美国双杰兄弟(集团)有限公司;电子万用炉 天津永泰斯特仪器有限公司。
1.3 方法
1.3.1 干红葡萄酒酿造过程
干红葡萄酒酿造采用传统工艺于实验室酿造,基本工艺流程如下 [12]。
酿酒葡萄→分选→除梗→手工破碎→加入果胶酶和SO 2(果胶酶40 mg/L,SO 250 mg/L),浸渍过夜→接种酵母酒精发酵→压榨分离皮渣→葡萄原酒去沉淀→过滤→封存检测
1.3.2 CO 2生成曲线的测定
取150 mL葡萄浆加入到250 mL三角瓶中,接种后安装发酵栓,称重记录发酵0点,然后每隔24 h对发酵瓶进行称重,两点间质量差为CO 2产生量,3 瓶平行,以发酵时间为横坐标,CO 2产生量为纵坐标,绘制CO 2生成量曲线。
1.3.3 降糖曲线的测定
发酵液中还原糖的测定采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法 [13],利用斐林溶液与还原糖共沸,生成氧化亚铜沉淀的反应,每隔24 h测定一次发酵液中的残糖质量浓度,以发酵时间为横坐标,残糖质量浓度为纵坐标,绘制降糖曲线。
1.3.4 酒精度与酒精转化率计算
发酵结束后,测定葡萄酒的酒精度,测定方法参照GB/T 15038—2006中的酒精计法 [13];酒精转化率按以下公式计算。
1.3.5 香气物质萃取
采用顶空固相微萃取(h ea d sp a ce so lid p h ase microextraction,HS-SPME)来获得所要检测的香气物质。首先称取2 g氯化钠加到20 mL顶空瓶中,准确量取5 mL酒样于顶空瓶中。然后,加入磁力搅拌转子,加盖密封,将SPME针管穿透样品瓶隔垫,调整插入长度,45 ℃水浴搅拌平衡15 min,推手柄使纤维头伸出针管,45 ℃水浴条件下萃取吸附30 min,取出手柄,直接进样,250 ℃条件下质谱解吸3 min。
1.3.6 GC-MS检测条件
GC-MS检测条件参考文献[14]。GC条件:载气为氦气(99.999%)、流速1.0 mL/min;升温程序:40 ℃保持12 min,以3 ℃/min升至108 ℃保持2 min,再以5 ℃/min升至250 ℃保持5 min,进样口温度250 ℃。
MS条件:离子源温度230 ℃、四极杆温度150 ℃、电子电离源、电子能量70 eV、扫描质量范围45~550 u。
以上所有数据均为3 次平行实验结果的平均值。
1.4 数据处理
本实验所涉及的图表使用Origin 8.0、Excel 2003和SPSS 17进行汇总处理得到;香气物质采用NIST质谱数据库检索结合参考相关文献进行定性,采用总挥发性物质峰面积归一化法进行各种香气成分相对质量分数的计算。
2.1 CO 2生成曲线的测定


图2 干红葡萄酒发酵过程中CO
2生成量曲线
Fig. 2 CO
2production curves as a function of fermentation time
根据酵母菌发酵糖转化酒精的原理,CO 2也是发酵产物之一,从理论上说酒精和CO 2生成量之间具有量比关系。采用称质量法测定CO 2的生成量具有方法简单、快速、节省样品量、操作方便等优点。随着发酵的进程,可发酵的糖类物质逐渐转化为酒精和CO 2,采用称质量法通过发酵液中释出CO 2造成的质量损失计算出CO 2的生成量,可反映菌种的产物生成能力。2 株商品酵母菌F15和SC与自选酵母菌KDLYS9-16分别发酵2 个产区的赤霞珠和美乐葡萄过程中CO 2的生成量见图2。图2A为3 种酵母对昌黎产区赤霞珠葡萄的发酵,在24 h后酵母菌生长进入旺盛期,CO 2产生量迅速增加,自选酿酒酵母KDLYS9-16始终比商品菌的CO 2量高,2 株商品菌F15和SC相比,发酵100 h内F15的CO 2产生量高于SC,发酵100 h后,SC酵母好于F15。发酵结束后,自选菌的CO 2产生总量高于对照菌,说明KDLYS9-16发酵昌黎产区赤霞珠葡萄产酒精量高于商品菌;图2B是3 种酵母发酵昌黎美乐葡萄,50 h内3 种酵母的发酵趋势基本相同,比赤霞珠葡萄菌种的延迟期长,50~125 h,KDLYS9-16的CO 2产生量远高于对照菌,说明其生长速率快,125 h后发酵基本结束,而商品菌的发酵要延续到175 h,说明KDLYS9-16的发酵周期短,发酵快速;图2C、2D分别是3 种酵母发酵沙城产区赤霞珠和美乐葡萄,从菌种角度讲趋势和昌黎产区葡萄基本相同,KDLYS9-1 6启动发酵快和发酵周期短的优势明显。总之,自选酿酒酵母KDLYS9-16发酵2 个产区的赤霞珠和美乐葡萄时CO 2的生成量均比商品菌高。从两个产区的两种葡萄看,KDLYS9-16更适于发酵赤霞珠葡萄,启动发酵快,产CO 2量高。如果用于发酵美乐葡萄,则该菌发酵昌黎产区的美乐比商品菌发酵周期短。
2.2 降糖曲线的测定

图3 3 种酵母对不同葡萄品种的降糖曲线
Fig. 3 Glucose consumption curves of three yeast strains
结合酵母的降糖和CO 2生成量可反映发酵过程中酵母的理论产酒精能力,再通过发酵开始和结束时糖质量分数差可计算出酒精的理论生成量。因此,降糖速率和发酵结束的时间是评价酵母菌发酵产酒精能力的重要指标。检测发酵过程中残糖的变化绘制降糖曲线,结果见图3。KDLYS9-16与F15发酵昌黎产区赤霞珠葡萄的降糖速率相似,降糖能力优于SC酵母。KDLYS9-16发酵快速,144 h后发酵基本结束;同样KDLYS9-16对沙城产区赤霞珠葡萄也显示了较好的降糖效果,发酵初期降糖速率远高于对照菌,体现了较强启动发酵的能力;图3B、3D反映菌种发酵美乐葡萄时,初期降糖速率较慢,48 h为菌种的适应期,之后酵母菌生长和发酵快速,KDLYS9-16比商品菌的降糖速率快很多,且发酵周期短,发酵144 h时基本结束,而对照菌需168~192 h发酵才能结束。
2.3 葡萄酒酒精度及酒精转化率的测定结果

图4 葡萄酒的酒精度及酒精转化率
Fig. 4 Alcohol contents and alcohol conversion rates of the wines fermented by three different strains
由图4可知,自选菌KDLYS9-16的酒精生成量和酒精转化率除沙城产区美乐葡萄外,都比商品菌高,两株商品酵母菌的酒精生成量近乎相等,糖对酒精的转化率略有不同。对照图4A、4C和图4B、4D可知,产自不同产区的同品种酿酒葡萄,采用相同的酵母菌和工艺进行酿造,其酒精生成量和糖对酒精转化率不同。同样,对照图4A、4B和图4C、4D可知,采用相同酵母菌种和工艺酿造栽培在同一产区的不同品种酿酒葡萄,所得到的酒精生成量和糖对酒精转化率也有差异。就所研究的3 株酵母菌来说,选用KDLYS9-16自选酵母菌酿造赤霞珠葡萄酒有酒精产量高和酒精转化率也高的优点。对于昌黎产区的美乐葡萄可以采用自选酵母菌,而沙城产区的美乐葡萄自选菌的发酵效果不如商品菌。
2.4 赤霞珠干红葡萄酒香气物质分析
2.4.1 香气物质检测结果
表2 赤霞珠葡萄原酒中香气物质的测定
Table 2 Contents and aroma descriptions of aroma compounds in Cabernet Sauvignon grape juice and wines
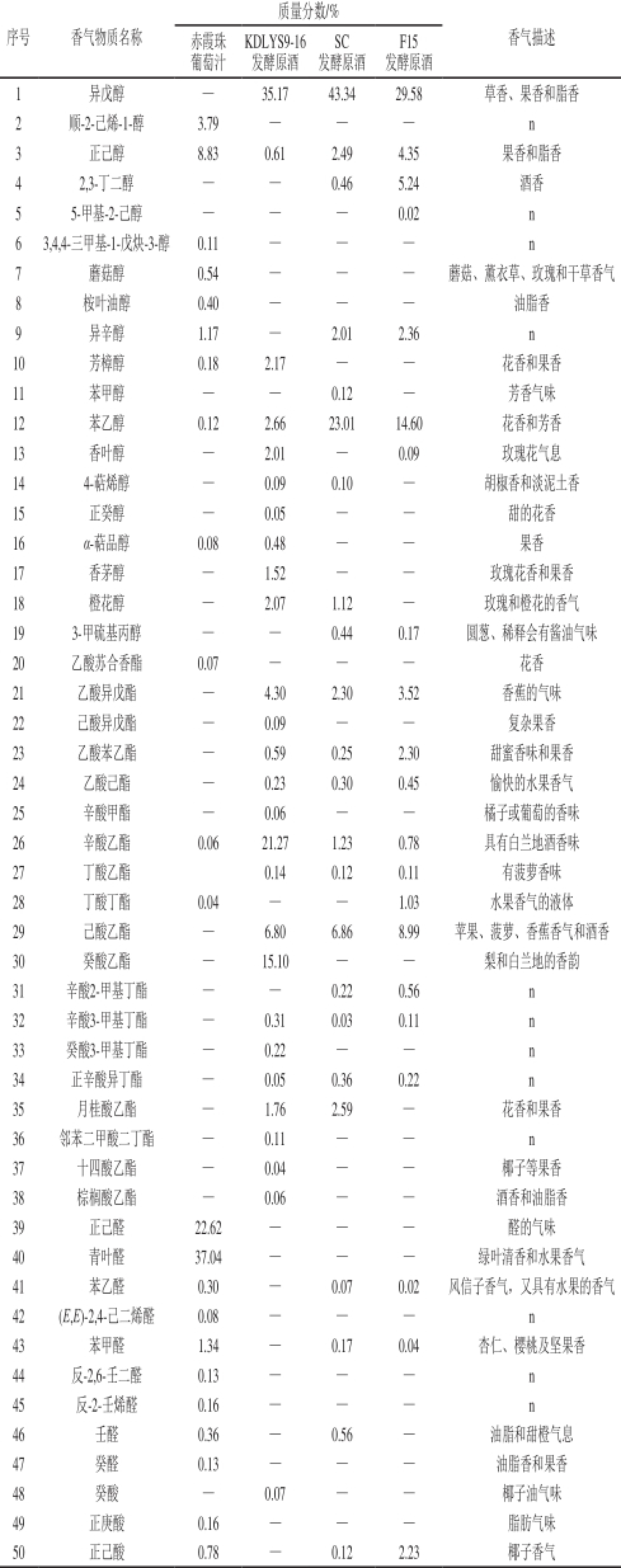
质量分数/%序号香气物质名称赤霞珠KDLYS9-16SCF15香气描述葡萄汁发酵原酒发酵原酒发酵原酒1异戊醇—35.17 43.34 29.58草香、果香和脂香2顺-2-己烯-1-醇3.79——n 3正己醇8.83 0.61 2.49 4.35果香和脂香4 2,3-丁二醇——0.46 5.24酒香5 5-甲基-2-己醇——0.02 n 6 3,4,4-三甲基-1-戊炔-3-醇0.11——n 7蘑菇醇0.54——蘑菇、薰衣草、玫瑰和干草香气8桉叶油醇0.40——油脂香9异辛醇1.17—2.01 2.36 n 10芳樟醇0.18 2.17——花香和果香11苯甲醇——0.12—芳香气味12苯乙醇0.12 2.66 23.01 14.60花香和芳香13香叶醇—2.01—0.09玫瑰花气息14 4-萜烯醇—0.09 0.10—胡椒香和淡泥土香15正癸醇—0.05——甜的花香16α-萜品醇0.08 0.48——果香17香茅醇—1.52——玫瑰花香和果香18橙花醇—2.07 1.12—玫瑰和橙花的香气19 3-甲硫基丙醇——0.44 0.17圆葱、稀释会有酱油气味20乙酸苏合香酯0.07——花香21乙酸异戊酯—4.30 2.30 3.52香蕉的气味22己酸异戊酯—0.09——复杂果香23乙酸苯乙酯—0.59 0.25 2.30甜蜜香味和果香24乙酸己酯—0.23 0.30 0.45愉快的水果香气25辛酸甲酯—0.06——橘子或葡萄的香味26辛酸乙酯0.06 21.27 1.23 0.78具有白兰地酒香味27丁酸乙酯0.14 0.12 0.11有菠萝香味28丁酸丁酯0.04——1.03水果香气的液体29己酸乙酯—6.80 6.86 8.99苹果、菠萝、香蕉香气和酒香30癸酸乙酯—15.10——梨和白兰地的香韵31辛酸2-甲基丁酯——0.22 0.56 n 32辛酸3-甲基丁酯—0.31 0.03 0.11 n 33癸酸3-甲基丁酯—0.22——n 34正辛酸异丁酯—0.05 0.36 0.22 n 35月桂酸乙酯—1.76 2.59—花香和果香36邻苯二甲酸二丁酯—0.11——n 37十四酸乙酯—0.04——椰子等果香38棕榈酸乙酯—0.06——酒香和油脂香39正己醛22.62——醛的气味40青叶醛37.04——绿叶清香和水果香气41苯乙醛0.30—0.07 0.02风信子香气,又具有水果的香气42(E,E)-2,4-己二烯醛0.08——n 43苯甲醛1.34—0.17 0.04杏仁、樱桃及坚果香44反-2,6-壬二醛0.13——n 45反-2-壬烯醛0.16——n 46壬醛0.36—0.56—油脂和甜橙气息47癸醛0.13——油脂香和果香48癸酸—0.07——椰子油气味49正庚酸0.16——脂肪气味50正己酸0.78—0.12 2.23椰子香气
续表2

注:—.未检出;n.香气较复杂,目前未见报道。下同。
质量分数/%序号香气物质名称赤霞珠KDLYS9-16SCF15香气描述葡萄汁发酵原酒发酵原酒发酵原酒51辛酸—0.31 0.37 7.07油脂香和果香52十三碳酸脂肪酸—0.04——油脂味53萘1.05 0.10—0.06樟脑丸气味54 2-甲基萘0.49——n 55大马士酮—0.05——青香、花香、木香和浆果香气56苯乙酮0.12——愉快的芳香气味57(1R)-(+)-诺蒎酮—0.31——n 58茴香脑0.20——茴香气息总质量分数/%80.35 98.84 88.64 83.90
以昌黎产区赤霞珠葡萄为原料,采用3 种酵母菌发酵的干红葡萄原酒,经过1 个月的贮存后,采用HSSPME结合GC-MS检测香气物质,统计结果见表2。4 组样品中共检测到5 8 种香气物质,葡萄汁中27 种,KDLYS9-16、SC和F15酵母菌酿造的3 种葡萄原酒中分别检出32、24 种和23 种香气物质,香气物质占总挥发性物质总量的百分比分别为98.84%、88.64%和83.90%,比发酵前葡萄汁中香气物质质量分数分别增加18.49%、8.29%和3.55%。葡萄汁中香气物质主要以醛类物质为主,青叶醛和正己醛分别达到37.04%和22.62%,两者占葡萄汁中香气物质的74.25%,青叶醛的存在使果汁具有很明显的青叶香和果香,正符合了新鲜酿酒葡萄的香气特点。经酵母菌的发酵之后,香气物质组成发生了显著变化,香气主体由果汁中的醛类香气转变为醇类和酯类香气。昌黎产区赤霞珠葡萄经过自选菌KDLYS9-16发酵后,总香气物质质量分数比对照菌SC和F15发酵的原酒香气总量分别提高10.20%和14.94%,体现出明显的增香特点,且香气物质种类也明显比对照菌株多。自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16对葡萄酒具有很显著的增香效果,有很好的应用开发潜质。
分析KDLYS9-16发酵的赤霞珠葡萄原酒香气物质可看出,醇类和酯类物质为主要香气物质,质量分数分别达到46.83%和51.13%,其他香气物质仅为0.88%。异戊醇、乙酸异戊酯、辛酸乙酯、己酸乙酯和癸酸乙酯为主体香气物质,质量分数分别为35.17%、4.30%、21.27%、6.80%和15.10%,尤其是异戊醇和辛酸乙酯,分别呈现草香、果香和酒香 [15],它们的大量存在使葡萄酒具有酒香的同时还保留了果香和草香,使酒体具有很好的典型性。而SC酵母菌发酵的葡萄酒中主要香气物质为醇类,质量分数高达73.09%,其他香气物质为15.55%,异戊醇、苯乙醇和己酸乙酯为主要呈香物质,质量分数分别为43.34%、23.01%和6.86%,香气物质种类较单一、不均衡;F15为发酵菌种的葡萄原酒中的醇类和酯类为主要香气物质,两者总质量分数达到74.48%,异戊醇、苯乙醇、己酸乙酯和辛酸4 种物质为其主体香,质量分数分别达到29.58%、14.60%、8.99%和7.07%,这些物质主要呈现花香和果香 [16-19]。总之,自选酵母KDLYS9-16在接种量相同的前提下,产生的香气物质总量和种类都高于F15和SC,且香气均衡。
2.4.2 自选酵母菌KDLYS9-16对单萜烯类物质的影响
表3 单萜烯物质质量分数
Table 3 Contents and aroma descriptions of monoterpenes in Cabernet Sauvignon grape juice and wines

序号单萜烯类单萜烯类物质质量分数/%香气描述物质名称葡萄汁KDLYS9-16 SC F15 1桉叶油醇0.40 n n n油脂香2芳樟醇0.18 2.17 n n花香和果香3香叶醇n 2.01 n 0.09玫瑰花气息4 4-萜烯醇n 0.09 0.10 n胡椒香和淡泥土香5α-萜品醇0.08 0.48 n n果香6香茅醇n 1.52 n n玫瑰花香和果香7橙花醇n 2.07 1.12 n玫瑰和橙花的香气总质量分数/%0.66 8.34 1.22 0.09
葡萄中的单萜烯类物质是葡萄酒香气成分的重要组成部分,而它们大多数是以与糖苷结合态形式存在于葡萄中,经过发酵进入葡萄酒中 [8],香气糖苷是葡萄酒活性香气成分的预备库,比它们对应的游离态配基多几倍,甚至几十倍 [3]。而β-D-葡萄糖苷酶具有水解结合态萜烯,释放游离态单萜烯的作用,本研究的自选酵母菌KDLYS9-16高产β-D-葡萄糖苷酶,通过检测和分析单萜烯类物质可以评价酵母菌的产香能力(表3)。由表3可知,葡萄汁中仅检测到3 种单萜烯物质,质量分数0.66%,而经过自选菌KDLYS9-16发酵后的葡萄酒中检测到6 种单萜烯物质,质量分数为8.34%,是葡萄果汁中该类物质的12.64 倍,香叶醇、4-萜烯醇、香茅醇和橙花醇由发酵产生,尤其芳樟醇、α-萜品醇和香茅醇在对照菌SC和F15的发酵葡萄酒中未检测到,而这几种物质都具有很低的香气感官阈值 [2 0-23],使酒体呈现玫瑰花等花香及果香 [2 4-25],对葡萄酒香气贡献较大;商品菌SC和F15发酵的葡萄酒中单萜烯类香气物质种类与质量分数都比较少,尤其F15发酵得到的葡萄酒中仅检测到香叶醇一种单萜烯物质,质量分数仅为0.09%,比葡萄果汁中还要低,说明F15酵母菌发酵昌黎产区赤霞珠葡萄,发酵过程中代谢掉了葡萄果实原有的桉叶油醇、芳樟醇和α-萜品醇,仅产生了香叶醇。SC酵母与F15类似,在发酵过程中保持葡萄果实原有单萜烯类物质的效果较差,仅产生1.22%的单萜烯物质。总之,自选高产β-D-葡萄糖苷酶酵母KDLYS9-16发酵昌黎产区赤霞珠葡萄酒,可以很好的保持葡萄果实中原有的单萜烯物质,且在发酵过程中促进产生多种单萜烯类物质,对葡萄酒具有很好的增香效果。
2.4.3 香气物质主成分及香气系列分析
用SPSS 17软件进行数据处理,以样品为自变量进行的主成分分析,对几种样品香气物质的相似度进行分析,旋转空间成分图见图5。4 种样品香气物质可以分为3 个类型,首先,葡萄汁香气为第1类香气类型,与3 种葡萄酒的香气物质存在较大差异;自选菌KDLYS9-16发酵的葡萄酒香气物质为第2大类香气类型,商品菌SC和F15发酵的葡萄酒香气物质为第3大类香气类型,在旋转空间内比较接近,说明2 种商品酵母菌发酵产生的香气物质主成分较为相近。自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16所产生的香气物质主体和商品菌发酵的葡萄酒存在较大的差距,这也就说明了KDLYS9-16具有自身独特的产香特点。
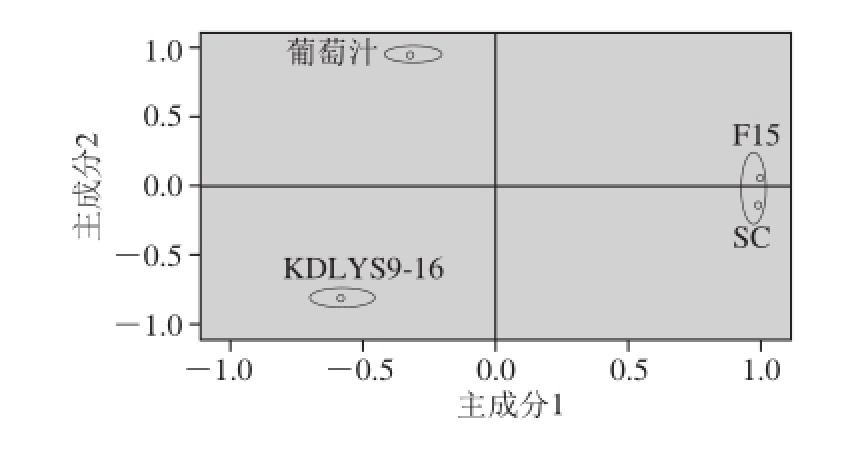
图5 样品的香气物质主成分相似度分析
Fig. 5 Similarity analysis of the principal components of aroma components in the samples
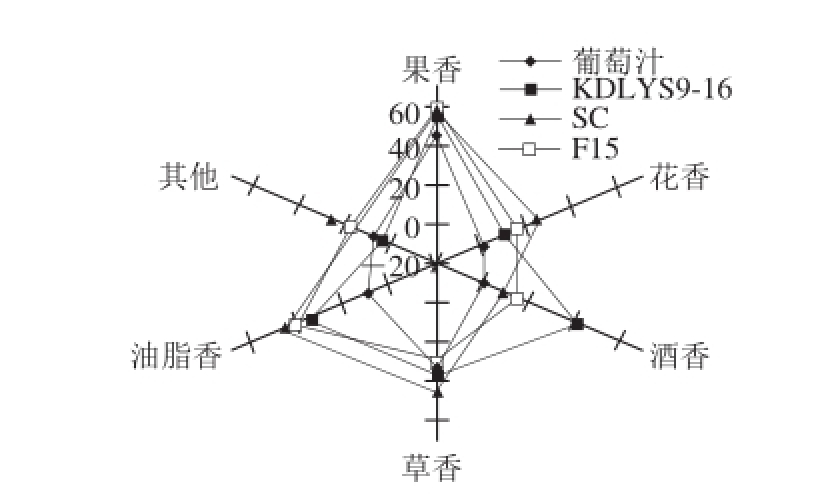
图6 香气系列网状图
Fig. 6 Mesh plots showing aroma types in grape juice and wines
分别将3 种葡萄酒及葡萄果实的香气物质进行香气系列分类,香气系列按花香、果香、酒香、草香、油脂香和其他类划分,做雷达网状图(图6)。由图6可知,昌黎产区赤霞珠葡萄香气物质主要呈现果香,质量分数接近50%,其次是草香,这符合果汁特点。经过发酵后其他香气系列有增加趋势,果香也有所增加,KDLYS9-1 6发酵产香较为均衡,果香、花香、酒香、草香和油脂香的质量分数分别为5 4.3 9%、1 0.5 3%、43.23%、35.31%和36.26%,除花香外,其他香气系列质量分数较相近,说明该菌发酵葡萄酒香气均衡,同时又有果香突出的特点。SC酵母发酵葡萄酒果香、草香和油脂香比较突出,而花香和酒香质量分数较低,尤其酒香仅为8.55%;F15酵母发酵葡萄酒以果香和油脂香为主,质量分数分别为59.69%和41.17%,而酒香和花香质量分数较低。总之,自选菌KDLYS9-16在产香方面具有产香均衡,酒香优于SC和F15,展现了很好的发酵产香潜质。
自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16具有启动发酵快、降糖迅速、发酵周期短、酒精转化率高的优点。发酵昌黎产区赤霞珠葡萄酿酒优于沙城产区赤霞珠葡萄,也优于美乐葡萄。发酵过程中产香能力显著,香气物质丰富、含量高,且平衡,具有很好的应用潜力和前景。
参考文献:
[1] 桑苇, 唐柯, 徐岩, 等. 黑曲霉β-葡萄糖苷酶对葡萄酒酶解增香调控及香气物质的影响[J]. 食品与发酵工业, 2015, 41(5): 8-13. DOI:10.13995/ j.cnki.11-1802 /ts.201505002.
[2] STYGER G, PRIOR B, BAUER F F. Wine flavor and aroma[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9): 1145-1159. DOI 10.1007/s10295-011-1018-4.
[3] 陶永胜, 牟含, 李国, 等. 野生胶红酵母糖苷酶水解媚丽新酒中香气糖苷研究[J]. 农业机械学报, 2014, 45(12): 249-254. DOI:10.6041/ j.issn.1000-1298.2014.12.037.
[4] GALLIFUOCO A, ALFANI F, CANTARELLA M, et al. Immobilized β-glucosidase for the winemaking industry: study of biocatalyst operational stability in laboratory-scale continuous reactors[J]. Process Biochemistry, 1999, 35(1): 179-185. DOI:10.1016/S0032-9592(99)00049-7.
[5] CAIRNS J R K, ESEN A. β-Glucosidases[J]. Cellular and Molecular Life Sciences, 2010, 67(20): 3389-3405. DOI:10.1007/s00018-010-0399-2.
[6] PARDO-GARCÍA A I, de la HOZ K S, ZALACAIN A, et al. Effect of vine foliar treatments on the varietal aroma of Monastrell wines[J]. Food Chemistry, 2014, 163: 258-266. DOI:10.1016/ j.foodchem.2014.04.100.
[7] WANAPU C, SRIPUNYA P, BOONKERD N. Selection of yeast strains containing β-glucosidase for improving wine aroma[J]. Journal of Agricultural Science and Technology B, 2012, 2(6): 691-702.
[8] GONZÁLEZ-POMBO P, FARIÑA L, CARRAU F, et al. Aroma enhancement in wines using co-immobilized A spe rg illu s nig e r glycosidases[J]. Food Chemistry, 2014, 143: 185-191. DOI:10.1016/ j.foodchem.2013.07.107.
[9] OTERO R R C, IRANZO J F U, BRIONES-PEREZ A I, et al. Characterization of the β-glucosidase activity produced by enological strains of non-Sac cha ro my ce s yeasts[J]. Journal of Food Science, 2003, 68(8): 2564-2569. DOI:10.1111/j.1365-2621.2003.tb07062.x.
[10] WANG Y X, ZHANG C, LI J M, et al. Different influences of β-glucosidases on volatile compounds and anthocyanins of Cabernet Gernischt and possible reason[J]. Food Chemistry, 2013, 140(1/2): 245-254. DOI:10.1016/j.foodchem.2013.02.044.
[11] VERNOCCHI P, NDAGIJIMANA M, SERRAZANETTI D I, et al. Use of Saccharomyces cerevisiae strains endowed with β-glucosidase activity for the production of Sangiovese wine[J]. World Journal of Microbiology and Biotechnology, 2011, 27(6): 1423-1433. DOI:10.1007/s11274-010-0594-1.
[12] 于英, 李记明, 姜文广, 等. 酿酒工艺对葡萄酒中生物胺的影响[J].食品与发酵工业, 2011, 37(11): 66-70. DOI:10.13995/j.cnki.11-1802/ ts.2011.11.028.
[13] 全国食品工业标准化技术委员会酿酒分技术委员会. 葡萄酒、果酒通用分析方法: GB/T 15038—2006[S]. 北京: 中国标准出版社, 2006.
[14] 周立华, 牟德华, 张哲琦, 等. GC-MS分析灯笼果果汁和果酒的香气成分[J]. 酿酒科技, 2015(8): 96-100. DOI:10.13746/j.njkj.2015045.
[15] 段雪荣, 陶永胜, 杨雪峰, 等. 不同成熟度赤霞珠葡萄所酿酒香气质量分析[J]. 中国食品学报, 2013, 12(11): 189-197. DOI:10.16429/ j.1009-7848.2012.11.021.
[16] 李景明, 于静, 吴继红, 等. 不同酵母发酵的赤霞珠干红葡萄酒香气成分研究[J]. 食品科学, 2009, 30(2): 185-189. DOI:10.3321/ j.issn:1002-6630.2009.02.040.
[17] CULLERÉ L, ESCUDERO A, CACHO J, et al. Gas chromatographyolfactometry and chemical quantitative study of the aroma of six premium quality Spanish aged red wines[J]. Journal of Agricultural and Foo d Chemistry, 2004, 52(6): 1653-1660. DOI:10.1021/ jf0350820.
[18] 王晓欣, 范文来, 徐岩. 应用GC-O和GC-MS分析酱香型习酒中挥发性香气成分[J]. 食品与发酵工业, 2013, 39(5): 154-160. DOI:10.13995/j.cnki.11-1802/ts.2013.05.042.
[19] 周立华, 牟德华, 张哲琦. HS-SPME结合GC-MS分析冷冻对欧李果香气的影响[J]. 酿酒科技, 2016(8): 113-118. DOI:10.13746/ j.njkj.2016058.
[20] 彭传涛, 刘浩, 牟含, 等. 媚丽葡萄酒品种香气成分的气味贡献研究[J].中国食品学报, 2015, 15(10): 230-239. DOI:10.16429/j.1009-7848.2015.10.032.
[21] 李纪涛, 蒋一鸣, 束俊霞, 等. 不同酿酒酵母发酵的紫薯糯米酒香气成分分析[J]. 食品科学, 2014, 35(16): 202-207. DOI:10.7506/ spkx1002-6630-201416039.
[22] 马腾臻, 李颍, 张莉, 等. 油橄榄酒的酿造及香气成分分析[J]. 食品科学, 2014, 35(18): 161-166. DOI:10.7506/spkx1002-6630-201418032.
[23] 蒋锡龙, 孙玉霞, 董兴全, 等. 不同酿酒酵母发酵桃果酒香气成分研究[J]. 食品工业科技, 2013, 34(21): 91-96. DOI:10.13386/ j.issn1002-0306.2013.21.049.
[24] 陶永胜, 彭传涛. 中国霞多丽干白葡萄酒香气特征与成分关联分析[J]. 农业机械学报, 2012, 43(3): 130-139. DOI:10.6041/ j.issn.1000-1298.2012.03.025.
[25] 陶永胜, 刘吉彬, 兰圆圆, 等. 人工贵腐葡萄酒香气的仪器分析与感官评价[J]. 农业机械学报, 2016, 47(2): 270-279. DOI:10.6041/ j.issn.1000-1298.2016.02.036.
Wine Fermentation Properties of Indigenous Saccharomyces cerevisiae KDLYS9-16 with High β-D-Glucosidase Activity
ZHOU Lihua
1, LI Yan
1,2,*
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China; 2. Hebei R&D Center for Fermentation Engineering, Shijiazhuang 050018, China)
Abstract:I ndigenous Saccharomyces cerevisiae KDLYS9-16, a high-yield β-D-glucosidase producing strain, can promote the release of monoterpenes to enhance the aroma of wine during the winemaking process. In this research, we fermented Cabernet sauvignon and Merlot grapes cultivated in Changli and Shacheng regions of Hebei province by the strain KDLYS9-16 to determine sugar consumption, alcohol production and wine aroma as a function of fermentation time in comparison with those achieved by using the commercial strains F15 and SC. The results showed KDLYS9-16 had the advantages of earlier initiation of fermentation, faster sugar consumption, shorter fermentation period, and higher sugar conversion rate compared with those of F15 and SC. In the wine from Cabernet Savignon grapes grown in Changli fermented by KDLYS9-16, 32 aroma substances were detected, accounting for 98.94% of the total volatile substances, demonstrating a signifi cant increase in both the types and amounts of aroma compounds as compared with its counterparts fermented by the control strains. Consequently, the strain KDLYS9-16 showed a good wine-making performance and had the potential for increasing wine aroma, thereby possessing promising applications.
Key words:i ndigenous Saccharomyces cerevisiae; β-D-glucosidase; wine fermentation properties; aroma
DOI:10.7506/spkx1002-6630-201706019
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2017)06-0123-07
引文格式:
周立华, 李艳. 自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16的酿酒性能[J]. 食品科学, 2017, 38(6): 123-129.
DOI:10.7506/spkx1002-6630-201706019. http://www.spkx.net.cn
ZHOU Lihua, LI Yan. Wine fermentation properties of indigenous Saccharomyces cerevisiae KDLYS9-16 with high β-D-glucosidase activity[J]. Food Science, 2017, 38(6): 123-129. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201706019. http://www.spkx.net.cn
收稿日期:2016-07-19
基金项目:河北省自然科学基金项目(C2011208028)
作者简介:周立华(1988—),男,硕士研究生,研究方向为传统发酵工程创新技术。E-mail:674692955@qq.com
*通信作者:李艳(1958—),女,教授,学士,研究方向为传统发酵工程创新技术、葡萄酒和果酒酿造。
E-mail:lymdh5885@163.com