香蕉MaWRKY31转录因子的特性及对MaACS1、MaACO1和MaSAG1的调控
范中奇,卓远芳,符亚莉,谭小丽,邝健飞,陆旺金,陈建业*
(华南农业大学园艺学院,亚热带农业生物资源保护与利用国家重点实验室,南方园艺产品保鲜教育部工程研究中心,广东省果蔬保鲜重点实验室,广东 广州 510642)
摘 要:从香蕉果实中克隆得到1 个WRKY转录因子,命名为MaWRKY31。氨基酸序列比对及进化树分析发现MaWRKY31具有一个典型的WRKY结构域,与拟南芥WRKY31和番茄SlWRKY6同源性较高,且同属于第Ⅱ类b亚族。实时荧光定量聚合酶链式反应表明外源乙烯处理诱导了MaWRKY31的表达,并且随着香蕉果实的成熟衰老,其表达明显增强。亚细胞定位和转录活性分析显示MaWRKY31定位于细胞核,是一种核蛋白,并且具有转录激活活性。双荧光素酶瞬时表达分析显示,MaWRKY31可以激活乙烯合成基因Ma ACS1和MaACO1,以及成熟衰老相关基因MaSAG1的启动子活性。这些结果表明MaWRKY31可能通过调控乙烯合成和成熟衰老相关基因的表达来参与香蕉果实成熟衰老过程,加深了对香蕉果实成熟衰老转录调控机制的认识。
关键词:香蕉;果实成熟;WRKY转录因子;转录调控
香蕉是世界主要热带、亚热带水果之一,经济价值很高,也是我国华南地区北运和出口的主要水果
[1-2]。但香蕉是典型的呼吸跃变型果实,常温贮藏下一周左右出现乙烯高峰和呼吸高峰,导致果实成熟衰老加快,货架期短,给香蕉保鲜物流带来不利影响
[3-5]。因此,香蕉果实成熟衰老的分子机制是香蕉采后生物学的重要研究方向,也可为生产上采取有效措施来延缓香蕉果实成熟衰老和延长货架期提供理论依据。
果实成熟衰老是一个复杂而高度有序的生物学过程,转录因子在其中发挥重要作用,目前报道的果实成熟衰老相关的转录因子有MADS-b ox、NAC和ERF(ethylene response factor)等
[6-8]。WRKY是一类植物所特有的转录因子,因其序列含有一个或两个WRKYGQK结构域而得名,同时还有一个由60 个氨基酸组成的锌指结构
[9]。第一个WRKY转录因子是从甘薯中克隆得到,随后在野燕麦、拟南芥、马铃薯、烟草和水稻等植物中也相继发现了WRKY转录因子
[9-10]。已有的报道表明,WRKY转录因子参与植物众多生长发育和生理进程,如种子和叶片形成、叶片衰老、激素信号转导以及逆境胁迫响应等
[10-11]。本课题组前期从香蕉果实中分离获得了3个响应低温和病菌胁迫的WRKY转录因子MaWRKY1、2和11
[12-14],但目前关于WRKY转录因子与香蕉果实成熟衰老的关系报道较少。
本研究利用香蕉成熟衰老差异基因表达谱,从中筛选获得了1 个成熟衰老相关的WRKY转录因子MaWRKY3 1,并分析了其亚细胞定位、转录激活和基因表达等特性;进一步采用双荧光素酶瞬时表达技术,分析了MaWRKY31对乙烯合成相关基因M aA C S1和M aA CO 1,以及衰老相关基因M a S A G 1启动子的转录调控,探讨了WRKY转录因子调控香蕉果实成熟衰老的可能机制,以期为进一步揭示香蕉果实成熟衰老的转录调控网络提供有用信息。
1 材料与方法
1.1 材料与试剂
香蕉品种为“巴西”(Musa acuminate),购于广州市番禺区香蕉种植园,采收成熟度为七至八成,果实落梳后立即运回实验室。将每梳香蕉分成单个蕉指后,挑选出果实大小及成熟度基本一致并且无病虫害,无机械损伤的果实进行处理。
施保功(咪鲜胺) 美国富美实公司;乙烯利 上海彭浦化工厂;1-甲基环丙烯(1-methy lcyclopropene,1-MCP) 美国SmartFresh公司;Prime Script
TMRT reagent Kit反转录试剂盒、SYBR
TMPremix Ex Taq
TMⅡ实时荧光定量聚合酶链式反应(quantitative real time polymerase chain reaction,qRT-PCR)试剂盒 大连宝生物工程公司;DNeasy Plant Mini Kit基因组DNA提取试剂盒 德国Qia g e n公司;双荧光素酶活性检测试剂盒 美国Promega公司;限制性内切酶 美国NEB公司;其他常规化学试剂均为国产分析纯。
1.2 仪器与设备
CF X 9 6 q RT-PC R仪 美国Bio-R a d公司;Lu mino skan Ascen t化学发光分析仪 美国Th ermo Scientific公司;Axioskep 2 Plus荧光显微镜 德国Zeiss公司。
1.3 方法
1.3.1 试材处理
挑选后的香蕉果实经500 mg/L施保功处理1 min,自然晾干。参考Shan Wei等
[4]的方法,分成3 组进行3 种不同成熟进程处理:第1组为自然成熟,放22 ℃冷库贮藏21 d,分别在0、1、3、5、7、12、15、18、21 d取样;第2组为乙烯催熟,用500 mg/L乙烯利浸泡3 min后放22 ℃冷库贮藏7 d,分别在0、1、3、5、7 d取样;第3组为1-MCP延缓成熟,采用0.5 μL/L 1-MCP处理18 h后,22 ℃贮藏36 d,分别在0、1、3、5、7、12、15、18、21、27、30、33、36 d取样。3 组香蕉果实均用聚乙烯薄膜袋包装(每袋10 个果)后贮藏,取样时取3 个香蕉果实的果肉,重复3 次,用液氮速冻后储存于-80 ℃条件下待分析用。
1.3.2 基因分离和序列分析
表1 引物序列
Table 1 Primer sequences used in this study

引物用途引物名称引物序列(5’→3’)全长扩增MaWRKY31 F:ATGGACAAAGGTGGTACTACC R:TCAGGCCGCCGGAAAATTGG MaACT1-RT F:GAGGCACCAGTCCGTAGATAGC R:CCGCCAGATGAAGGTACAACAT MaWRKY31-RT F:AATTCTCGAGTCTCCAGTCAGC R:CAGCCTGATGATTGCCACCGAT转录活性分析pBD-MaWRKY31 F:TCGCCGACCGGTAGGCCTATGGACAAAGGTGGTACTACC R:AACCAGAGTTAAAGGCCTTCAGGCCGCCGGAAAATTGG亚细胞定位MaWRKY31-GFP F:GGACTCTAGAGGATCCGATGGACAAAGGTGGTACTACC R:TGCTCACCATAAGCTTGGCCGCCGGAAAATTGG双荧光素酶瞬时表达qRT-PCR pEAQMaWRKY31 F:CGCGACCGGTGTCGACATGGACAAAGGTGGTACTACC R:AGTTAAAGGCCTCGAGTCAGGCCGCCGGAAAATTGG
采用热硼酸法
[15]提取香蕉果肉的总RNA。根据本课题组获得的香蕉果实成熟衰老差异基因表达谱,挑选了一个表达上调的WRKY转录因子,命名为MaWRKY31。设计引物进行全长扩增,所用引物(表1)全部由上海生工生物工程公司合成。经PCR扩增、连接、转化大肠杆菌(Escherich ia coli)DH5α后,将鉴定为阳性的克隆送广州英潍捷基生物技术有限公司测序。
利用Ex PASy在线工具(http://www.expasy.ch/tools/pi_tool.html)对M aWR K Y3 1基因编码的蛋白质进行氨基酸基本特性分析。在NCBI的BLAST(http://www.ncbi. nlm.nih.gov/blast)进行MaWR K Y31的同源性检索和相似性比对。利用Clustal X1.83和Genedoc以及DNAMAN软件进行不同物种间同源基因的氨基酸序列比对,并结合MEGA5.0软件构建系统进化树。
1.3.3 qRT-PCR分析
根据获得的Ma W RKY 31基因的全长序列,设计荧光引物(表1),选取Ma AC T1为内参基因
[16]。提取各样品的总RNA,合成cDNA第1链。按SYBR Premix Ex Ta q Ⅱ试剂盒说明配制PCR体系,运行程序为:9 4 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,4 0 个循环。测定其Ct值,用F=2
-ΔΔCt计算各样品的MaWRKY31基因的相对表达量。
1.3.4 亚细胞定位
所用载体为pUC骨架,带35S启动子驱动的绿色荧光蛋白(green fluorescent protein,GFP)。根据MaWRKY31的开放阅读框(open reading frame,ORF)和GFP载体图谱设计亚细胞定位引物,引物序列见表1。获得正确的阳性克隆后,经B am HⅠ/Hin dⅢ双酶切,用T4 DNA连接酶连接到pUC-GFP载体从而得到MaWRKY31-GFP融合表达载体,转入DH5α,PCR、酶切筛选阳性克隆,并对阳性克隆进行测序验证。
烟草BY2原生质体的分离:MaWRKY31-GFP质粒转化至原生质体进行瞬时表达,参考徐群刚等
[13]的方法进行,用荧光显微镜观察GFP信号并拍照记录。
1.3.5 启动子分离和元件分析
利用DNeasy Plant Mini Kit试剂盒提取香蕉果肉基因组DNA。根据香蕉基因组数据库序列(http://bananagenome-hub.southgreen.fr/),找到乙烯合成相关基因M aA CS 1和MaAC O1以及成熟衰老相关基因M aS AG 1的启动子序列并设计引物,以DNA为模板进行PCR扩增,目地片段经测序后获得确定的启动子序列。通过PLACE(http://www.dba.affrc.go.jp/PLACE/)软件进行启动子区域中的元件分析。
1.3.6 Dual-luciferase瞬时表达分析
载体构建:在新西兰Plant and Food Research开发的含双荧光素酶的pGreenⅡ 0800-LUC载体
[17]的基础上,对于Ma WRKY31的转录活性分析,将连续5 个GAL4序列和TATA序列插入到萤火虫荧光素酶报告基因(firefly lu ciferase,LUC)前面作为本实验要用的报告基因(reporter)载体,而在同一个载体上的由35S驱动的海肾荧光素酶报告基因(renilla luciferase,REN)作为内参。GAL4BD序列和Ma W R K Y3 1的ORF序列经PCR扩增分别重组到pEAQ载体上作为本实验要用的效应基因载体(effector)。对于MaWRKY31激活Ma AC S1、M aA CO1和M a S A G 1启动子的分析,将M a A C S 1、M a A C O 1和M a S A G 1启动子序列插入到LUC前面作为rep o rter载体,MaWRKY31的ORF序列重组到p EAQ载体上作为effector。载体构建引物序列见表1。
农杆菌法侵染烟草叶片及双荧光素酶活力测定:参考Sainsbury等
[18]的方法进行。CaCl
2法制备农杆菌GV3101感受态细胞,将effector和reporter质粒各加入到50 μL农杆菌感受态菌液中,电穿孔仪电转法进行转化;挑取农杆菌单菌落分别置于含相应抗生素的YEB液体培养基中,于摇床中28 ℃条件下200 r/min培养24~36 h,PCR鉴定阳性克隆。将阳性克隆农杆菌单菌液培养至OD
600
nm为0.8~1.0,10 000 r/min离心1 min,收集菌体,用侵染缓冲液(10 mmol/L 2-吗啉乙璜酸(2-(N-morpholino) ethanesulfonic acid,MES),10 mmol/L MgCl
2,0.1 mmol/L乙酰丁香酮重悬菌体至OD
600
nm为0.2~0.4,室温静置4 h后将含effector和reporter质粒的重悬菌液共注射到本式烟草(N ico tian a b enthamia na)叶片背面,培养室培养2 d后,取侵染过的约1 cm
2的叶片,应用双荧光素酶检测试剂盒在化学发光仪上测定LUC和REN荧光素酶活性,参考试剂盒说明书进行。Ma WRKY3 1的转录活性和MaWRKY31激活MaACS 1、MaA CO1和MaSAG1启动子的活性通过LUC和REN荧光素酶活性比值(LUC/REN)反映,每个effector和reporter组合重复6 次。
1.4 数据分析
使用Origin8.0软件绘图和DPS7.0对数据进行差异显著性分析。
2 结果与分析
2.1 香蕉MaWRKY31的克隆与序列分析
根据香蕉果实成熟衰老差异基因表达谱,从中挑选了1 个在成熟衰老过程中表达较明显上调的WRKY转录因子,命名为MaWRKY3 1。以香蕉果实cDNA为模板进行q RT-PCR扩增,获得与预期片段长度1 698 bp一致的目的条带,经测序获得其全长序列。在NCBI中进行BLAST同源性分析,结果显示Ma WRKY31与拟南芥的AtWRKY31的同源性最高,为44%,因此命名为MaWRKY31。MaWRKY31编码的氨基酸长度为565 aa,分子质量为42.29 kD,等电点为9.7。氨基酸序列比对表明,MaWRKY31含有1 个WRKYGQK保守结构域(图1)。
利用MEGA5.0对Ma WRKY31和其他物种WRKY构建系统进化树,发现植物WRKY可以分为Ⅰ、Ⅱ和Ⅲ类,其中第Ⅱ类又分为a~d等亚族;MaWRKY31与拟南芥的AtWRKY31、AtWRKY36和AtWRKY47,番茄的SlWRKY6和SlWRKY16组成1 个亚族,均含有1 个WRKYGQK保守结构域,同属于WRKY转录因子家族中的第Ⅱ类b亚族成员(图2)。

图1 香蕉MaWRKY31与其他植物WRKY蛋白氨基酸比对
Fig. 1 Alignment of the predicted WRKY proteins between banana and other plant species
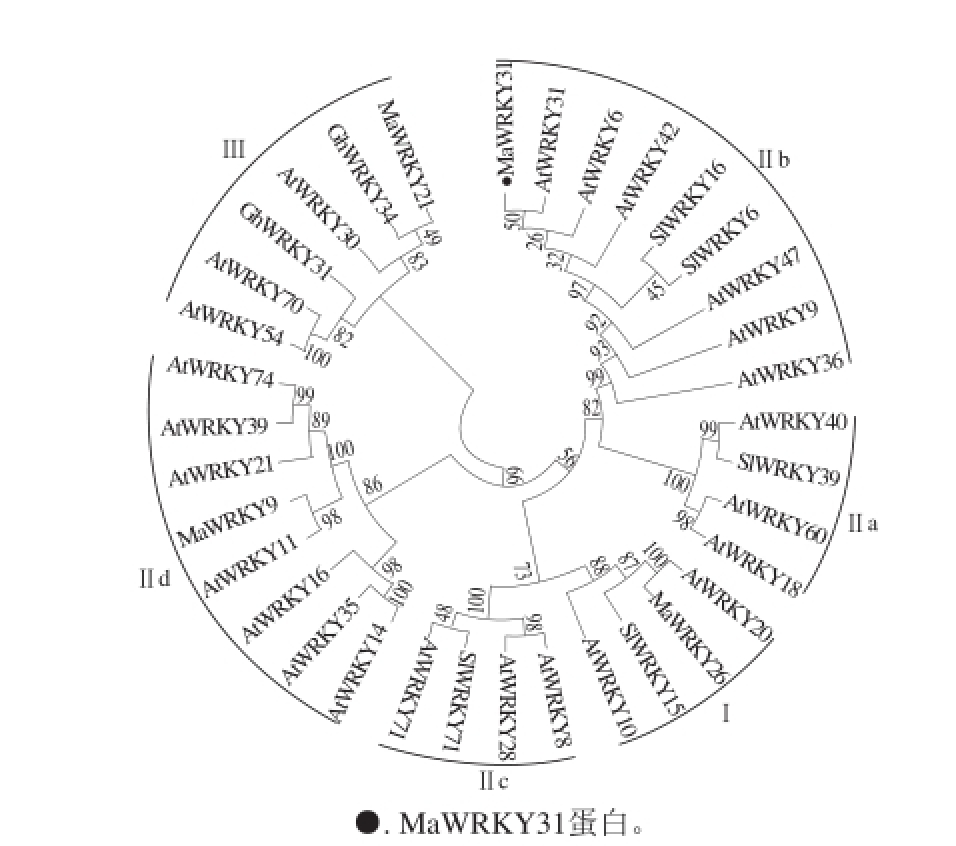
图2 香蕉MaWRKY31与其他植物WRKY蛋白家族的进化关系
Fig. 2 Phylogenetic tree of banana MaWRKY31 protein with WRKY proteins of other plants
2.2 香蕉果实成熟衰老过程中MaWRKY31的表达分析
前期的研究发现自然成熟的香蕉果实第15天开始产生乙烯,此时成熟启动,第18天出现乙烯高峰;外源乙烯处理香蕉,第1天开始释放乙烯,第3天出现乙烯释放高峰,加速了果实成熟;1-MCP处理的香蕉果实,第30天乙烯开始释放,高峰值出现在第33天,说明1-MCP推迟乙烯释放并延迟成熟
[4]。利用q RT-PCR技术分析了M aW RKY 3 1在3 种不同成熟进程(包括自然成熟、乙烯催熟和1-MCP延缓成熟)果实中的表达特征,结果显示M aWR K Y3 1都随着果实成熟衰老进程而表达增强,并且外源乙烯诱导了其表达。在自然成熟的第18天、乙烯催熟的第3天和1-MCP延缓成熟的第33天,MaW RKY 31的表达量分别为0 d时的530、325 倍和410 倍(图3),进一步表明MaWRKY31与香蕉果实成熟衰老有一定关系。

图3MaWRKY31在自然成熟(A)、乙烯催熟(B)、1-MCP延缓成熟(C)的香蕉果实中的表达
Fig. 3 Expression levels of MaWRKY31 in natural ripening (A), ethylene-induced (B) and 1-MCP delayed ripening (C) banana fruits
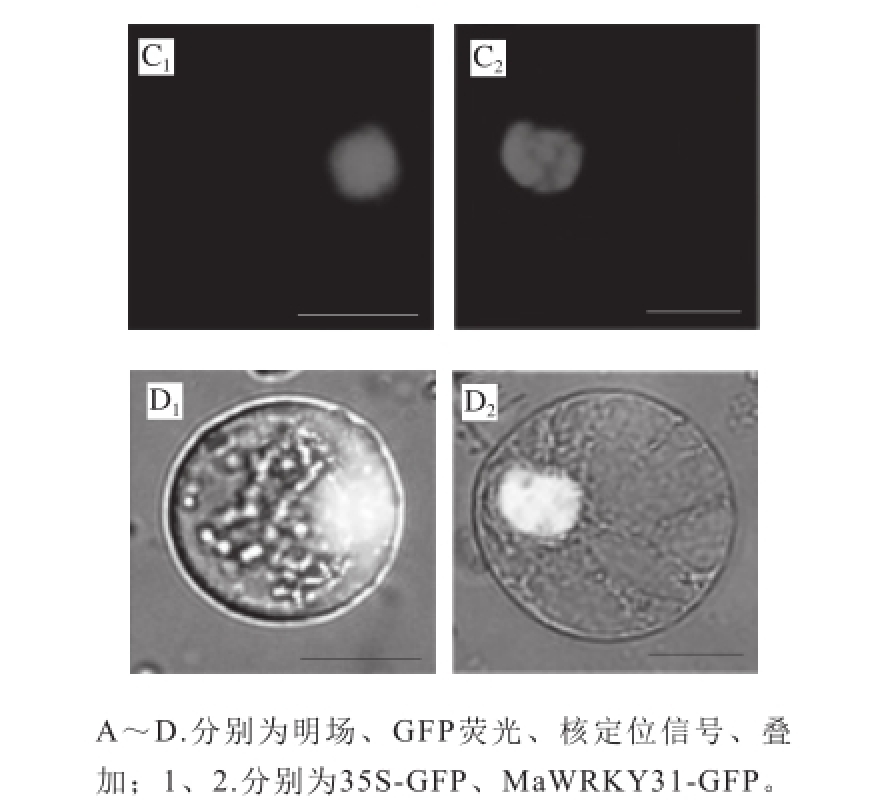
2.3 MaWRKY31的亚细胞定位
利用在烟草BY2原生质体瞬时表达体系,分析了MaWRKY31的亚细胞定位。如图4所示,与整个细胞都发光的阳性对照35S-GFP相比,MaWRKY31-GFP的融合蛋白在BY2原生质体内发出绿色荧光的位置与连有核定位信号(nuclear localization signal,NLS)的mCherry发出红色荧光的位置重合,表明MaWRKY31定位于细胞核,是核蛋白,这与转录因子是核定位的特征相一致。
2.4 MaWRKY31具有转录激活活性

图5 香蕉MaWRKY31转录活性分析
Fig. 5 Transcriptional activity of banana MaWRKY31
利用双荧光素酶报告基因分析系统,通过在烟草叶背面瞬时表达来确定MaWRKY31的转录活性。该分析系统包含双reporter和effector 2 个载体系统,其中reporter载体系统含有5 个串联的GAL4结合位点(5×GAL4)和TATA框一起驱动的LUC,以及位于同一个载体上的由CaMV35S驱动的REN作为内参来反映转化效率;effector载体系统包括CaMV35S驱动GAL4的DNA结合域,命名为GAL4BD(图5A)。将全长Ma WRKY 31构建到effector载体上(p BD-Ma WRKY3 1),以空GAL4BD为对照(p BD),reporter和effector 2 个载体系统共转到烟草叶背面瞬时表达后,测定2 个报告基因表达后发生的荧光量比值(LUC/REN)来反映MaWRKY31的转录活性。结果表明,与含MaWRKY31的effector载体共转后,LUC/REN的值明显高于对照,为对照的2.8 8 倍(图5B),这说明MaWRKY31具有转录激活活性,可能是一个转录激活子。
2.5 MaWRKY31激活MaACS1、MaACO1和MaSAG1的启动子活性
转录因子通过DNA结合功能域与下游目标基因启动子上的顺式元件结合来激活或抑制基因的表达。WRKY通过结合靶基因启动子区域的W-b o x元件((C/T)TGAC(C/T))调节靶基因的表达
[9]。香蕉乙烯合成相关基因MaACS1和MaACO1
[5]以及衰老相关基因MaSAG1
[19]与果实的成熟衰老密切相关。分析M a A C S 1、M a A C O 1和M aS AG1的启动子序列,发现它们分别含有9、3 个和1 个W-box元件,暗示MaWRKY31可能会激活MaAC S1、MaACO1和MaSAG1的启动子活性。

图6 香蕉MaWRKY31激活MaACS1、MaACO1和MaSAG1的启动子活性
Fig. 6 MaWRKY31 activated the promoter activities of MaACS1, MaACO1 and MaSAG1
为了确定Ma WRKY3 1是否可以激活M a A C S 1、M a A C O 1和M a S A G 1的启动子活性,继续采用双荧光素酶报告基因瞬时表达进行了相关分析。如图6所示,与Empty(对照)相比,当MaWRKY31分别与M a A CS 1、Ma A CO1和Ma S AG1的启动子共转时,LUC/REN的值分别上升了2.33、1.78 倍和3.25 倍,说明MaWRKY31可以激活Ma ACS1、M aA CO1和Ma SA G1的启动子活性,进而调控它们的表达。
3 讨 论
WRKY是植物所特有的转录因子,尽管已从多数植物中鉴定出WRKY转录因子,对它们的研究多集中于拟南芥、烟草、水稻和小麦等模式植物
[10-11],有关果实成熟衰老相关WRKY转录因子的分离及其作用机制的报道较少。在本研究中,从香蕉果实中克隆了一个WRKY转录因子MaWRKY31。序列分析表明,MaWRKY31具有WRKY转录因子第Ⅱ类b亚族的典型特点:具有1 个WRKYGQK结构域,系统进化树也显示,MaWRKY31与拟南芥Ⅱb亚族得AtWRKY 3 1、AtWRKY 4 2、AtWRKY9、AtWRKY36和AtWRKY47等组成一个分支,进一步证实MaWRKY31属于Ⅱb亚族。
WRKY转录因子主要参与植物生长发育、各种代谢过程以及生物或非生物胁迫的响应
[10-11]。拟南芥表达谱分析表明WRKY转录因子是叶片衰老转录组的第二大转录因子家族
[2
0]。拟南芥AtWRKY6、AtWRKY53、AtWRKY5 7、AtWRKY7 0和AtWRKY7 5以及水稻OsWRKY23和OsWRKY42等,其表达均在叶片衰老过程中显著上调
[21-22]。果实成熟方面,在对番茄果实发育过程的研究中发现,大部分WRKY转录因子在破色期后表达上升,但也有部分WRKY在破色期前表达下降,而后在果实成熟过程中又不断升高
[23]。在对葡萄的研究中发现,Vv WRKY受MeJA和乙烯的影响表达上调,进而推测WRKY与果实成熟可能相关,但具体的WRKY转录因子与其调控的成熟衰老网络均未见相关报道
[24-25]。本实验中,MaWRKY31的qRT-PCR分析表明,该基因受到外源乙烯诱导,并且在3 种不同成熟进程的香蕉果实中,均是随着乙烯释放和成熟衰老,其表达增强,推测MaWRKY31有可能参与调控果实的成熟衰老。这些结果也说明,WRKY转录因子不仅与叶片衰老有关,也与果实的成熟衰老有关,拓展了WRKY转录因子的生物学功能。
通常转录因子进入细胞核后才能发挥调控其他基因表达的作用。亚细胞定位分析表明,MaWRKY31定位在细胞核内,与转录因子的核定位特征相一致。WRKY转录因子主要通过结合下游靶基因启动子序列中的W-box元件来激活或者抑制靶基因的表达
[9]。研究发现拟南芥AtWRKY28
[26]、水稻OsWRKY4
[27]以及小麦TaWRKY2和TaWRKY19
[28]等在体内都具有转录激活活性,而拟南芥AtWRKY46
[29]和水稻OsWRKY76
[30]等则都具有转录抑制活性,说明WRKY转录因子既可以作为转录激活子,也可以作为转录抑制子。本研究表明,MaWRKY31具有转录激活活性,并且可以激活M a A CS 1、M a A C O 1和M a S A G 1的启动子活性,说明MaWRKY3 1可能通过调控乙烯合成和衰老相关基因的表达来参与香蕉果实成熟衰老过程。果实成熟衰老的调控是一个复杂的过程,涉及多层次、多种转录因子的协同作用
[31]。因此,MaWRKY31是否与其他香蕉果实成熟衰老相关的转录因子如ERFs
[5]、MADS-box
[32]和NACs
[4]等存在互作关系,并协同调控果实成熟衰老过程,有待于后续进行更深入的研究。
4 结 论
从香蕉果实中分离获得了1 个Ⅱb亚族的WRKY转录因子MaWRKY31。外源乙烯处理诱导了M aWRKY 31的表达,并且随着香蕉果实的成熟衰老,其表达明显增强。MaWRKY31定位于细胞核,是一种核蛋白,并且可以激活乙烯合成基因MaACS1和MaA CO 1,以及成熟衰老相关基因MaS AG1的启动子活性。以上结果表明MaWRKY31可能通过调控乙烯合成和成熟衰老相关基因的表达来参与对香蕉果实成熟衰老的调控,加深了对香蕉果实成熟衰老转录调控机制的认识。
参考文献:
[1] 谢建华, 庞杰. 香蕉采后生理与保鲜技术研究进展[J]. 保鲜与加工, 2010, 10(6): 37-42. DOI:10.3969/j.issn.1009-6221.2010.06.011.
[2] 贾彩红, 金志强, 刘菊华, 等. 香蕉采后生理学研究进展[J]. 热带作物学报, 2012, 33(1): 189-193. DOI:10.3969/j.issn.1000-2561.2012.01.038.
[3] BAPAT V A, TRIVEDI P K, GHOSH A, et al. Ripening of fl eshy fruit: molecular insight and the role of ethylene[J]. Biotechnology Advances, 2010, 28(1): 94-107. DOI:10.1016/j.biotechadv.2009.10.002.
[4] SHAN W, KUANG J F, CHEN L, et al. Molecular characterization of banana NAC transcription factors and their interactions with ethylene signalling component EIL during fruit ripening[J]. Journal of Experimental Botany, 2012, 63(14): 5171-5187. DOI:10.1093/jxb/ ers178.
[5] XIAO Y Y, CHEN J Y, KUANG J F, et al. Banana ethylene response factors are involved in fruit ripening through their interactions with ethylene biosynthesis genes[J]. Journal of Experimental Botany, 2013, 64(8): 2499-2510. DOI:10.1093/jxb/ert108.
[6] LIN Z, ZHONG S, GRIERSON D. Recent advances in ethylene research[J]. Journal of Experimental Botany, 2009, 60(12): 3311-3336. DOI:10.1093/jxb/erp204.
[7] GAPPER N E, MCQUINN R P, GIOVANNONI J J. Molecular and genetic regulation of fruit ripening[J]. Plant Molecular Biology, 2013, 82(6): 575-591. DOI:10.1007/s11103-013-0050-3.
[8] SEYMOUR G B, ØSTERGAARD L, CHAPMAN N H, et al. Fruit development and ripening[J]. Annual Review of Plant Biology, 2013, 64: 219-241. DOI:10.1146/annurev-arplant-050312-120057.
[9] RUSHTON P J, SOMSSICH I E, RINGLER P, et al. WRKY transcription factors[J]. Trends in Plant Science, 2010, 15(5): 247-258. DOI:10.1016/j.tplants.2010.02.006.
[10] BANERJEE A, ROYCHOUDHURY A. WRKY proteins: signaling and regulation of expression during abiotic stress responses[J]. Scientifi c World Journal, 2015: 807560. DOI:10.1155/2015/807560.
[11] BAKSHI M, OELMULLER R. WRKY transcription factors: Jack of many trades in plants[J]. Plant Signaling & Behavior, 2014, 9(2): e27700. DOI:10.4161/psb.27700
[12] 洪克前, 邝健飞, 陆旺金, 等. 香蕉果实转录因子MaWRKY1基因的原核表达和多克隆抗体制备[J]. 园艺学报, 2010, 37(12): 1929-1936. DOI:10.16420/j.issn.0513-353x.2010.12.020
[13] 徐群刚, 邝健飞, 单伟, 等. 香蕉果实冷胁迫相关MaWRKY11转录因子的特性、互作蛋白筛选与鉴定[J]. 热带亚热带植物学报, 2015,23(5): 543-552. DOI:10.11926/j.issn.1005-3395.2015.05.009.
[14] SHAN W, CHEN J Y, KUANG J F, et al. Banana fruit NAC transcription factor MaNAC5 cooperates with MaWRKYs to enhance the expression of pathogenesis-related genes against Colletotrichum m u sa e[J]. Molecular Plant Pathology, 2016, 17(3): 330-338. DOI:10.1111/mpp.12281.
[15] WAN C Y, WILKINS T A. A mini-scale hot borate method significantly enhances the yield of high-quality RNA from cotton (G o ssypium hirsutu m L.)[J]. Analytical Biochemistry, 1994, 223(1): 7-12. DOI:10.5897/AJB10.1425.
[16] CHEN L, ZHONG H Y, KUANG J F, et al. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta, 2011, 234(2): 377-3790. DOI:10.1007/s00425-011-1410-3.
[17] HELLENS R, ALLAN A, FRIEL E, et al. Transient expression vectors for functional genomics, quantifi cation of promoter activity and RNA silencing in plants[J]. Plant Methods, 2005, 1: 13. DOI:10.1186/1746-4811-1-13.
[18] SAINSBURY F, THUENEMANN E C, LOMONOSSOFF G P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants[J]. Plant Biotechnology Journal, 2009, 7(7): 682-693. DOI:10.1111/j.1467-7652.2009.00434.x. [19] YANG X T, PANG X Q, XU L Y, et al. Accumulation of soluble sugars in peel at high temperature leads to stay-green ripe banana fruit[J]. Journal of Experimental Botany, 2009, 60(14): 4051-4062. DOI:10.1093/jxb/erp238.
[20] GUO Y, CAI Z, GAN S. Transcriptome of Arabidopsis leaf senescence[J]. Plant Cell and Environment, 2004, 27(5): 521-549. DOI:10.1111/j.1365-3040.2003.01158.x.
[21] KOYAMA T. The roles of ethylene and transcription factors in the regulation of onset of leaf senescence[J]. Frontiers in Plant Science, 2014, 5: 650. DOI:10.3389/fpls.2014.00650.
[22] SCHIPPERS J H. Transcriptional networks in leaf senescence[J]. Current Opinion in Plant Biology, 2015, 27: 77-83. DOI:10.1016/ j.pbi.2015.06.018.
[23] ROHRMANN J, MCQUINN R, GIOVANNONI J J, et al. Tissue specificity and differential expression of transcription factors in tomato provide hints of unique regulatory networks during fruit ripening[J]. Plant Signaling & Behavior, 2012, 7(12): 1639-1647. DOI:10.4161/ psb.22264.
[24] GUO C L, GUO R R, XU X Z, et al. Evolution and expression analysis of the grape (Vitis vinifera L.) WRKY gene family[J]. Journal of Experimental Botany, 2014, 65(6): 1513-1528. DOI:10.1093/jxb/eru007.
[25] MORI K, LEMAIRE C M, ASAMIZU E, et al. Comparative analysis of common genes involved in early fruit development in tomato and grape[J]. Plant Biotechnology, 2013, 30: 295-300. DOI:10.5511/ plantbiotechnology.13.0321a.
[26] van VERK M C, BOL J F, LINTHORST H J. WRKY transcription factors involved in activation of SA biosynthesis genes[J]. BMC Plant Biology, 2011, 11: 89. DOI:10.1186/1471-2229-11-89.
[27] WANG H, MENG J, PENG X, et al. Rice WRKY4 acts as a transcriptional activator mediating defense responses toward Rhizoctonia solani, the causing agent of rice sheath blight[J]. Plant Molecular Biology, 2015, 89(1/2): 157-171. DOI:10.1007/s11103-015-0360-8.
[28] NIU C F, WEI W, ZHOU Q Y, et al. Wheat WRKY genes TaWRKY2 and TaW R K Y1 9 regulate abiotic stress tolerance in transgenic Arabidopsis plants[J]. Plant Cell and Environment, 2012, 35(6): 1156-1170. DOI:10.1111/j.1365-3040.2012.02480.x.
[29] DING Z J, YAN J Y, XU X Y, et al. WRKY46 functions as a transcriptional repressor of ALMT1, regulating aluminum-induced malate secretion in Arabidopsis[J]. Plant Journal, 2013, 76(5): 825-835. DOI:10.1111/tpj.12337.
[30] YOKOTANI N, SATO Y, TANABE S, et al. WRKY76 is a rice transcriptional repressor playing opposite roles in blast disease resistance and cold stress tolerance[J]. Journal of Experimental Botany, 2013, 64(16): 5085-5097. DOI:10.1093/jxb/ert298.
[31] 范中奇, 邝健飞, 陆旺金, 等. 转录因子调控果实成熟和衰老机制研究进展[J]. 园艺学报, 2015, 42(9): 1649-1663. DOI:10.16420/ j.issn.0513-353x.2015-0356.
[32] ELITZUR T, VREBALOV J, GIOVANNONI J J, et al. The regulation of MADS-box gene expression during ripening of banana and their regulatory interaction with ethylene[J]. Journal of Experimental Botany, 2010, 61(5): 1523-1535. DOI:10.1093/jxb/erq017.
Molecular Characterization of a Transcriptional Factor, MaWRKY31, and Its Regulation on MaACS1, MaACO1 and MaSAG1
FAN Zhongqi, ZHUO Yuanfang, FU Yali, TAN Xiaoli, KUANG Jianfei, LU Wangjin, CHEN Jianye*
(State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources, Engineering Research Center of Southern Horticultural Products Preservation, Ministry of Education, Guangdong Key Laboratory for Postharvest Science, College of Horticultural Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:WRKY proteins are a class of plant-specifi c transcriptional factors (TFs), which play important roles in plant growth and development, leaf senescence and hormonal signaling. However, their relationship with banana fruit ripening and senescence remains unknown. In the present work, a WRKY TF, termed MaWRKY31, was obtained from banana fruit. Analysis of deduced amino acid sequence and phylogenetic tree revealed that MaWRKY31 contained a typical WRKY domain showing high homology with Arabido psis thaliana WRKY31, and belonged to the Ⅱb sub-group. Realtime quantitative polymerase chain reaction displayed that MaWRKY31 was induced by ethylene, and up-regulated following banana fruit ripening and senescence. Sub-cellular localization and transcriptional activity analysis revealed that MaWRKY31 was a nuclear protein with transcriptional activation activity. In addition, dual-luciferase transient expression assay demonstrated that MaWRKY31 could activate the promoter activities of the ethylene biosynthetic genes MaACS1 and MaACO1 and the ripening-related gene MaSAG1. Taken together, these results suggest that MaWRKY31 may be involved in banana fruit ripening and senescence, possibly via the regulation of the expression of genes related to ethylene biosynthesis and ripening, which deepens the understanding of the transcriptional regulation mechanism of banana fruit ripening and senescence.
Key words:banana; fruit ripening and senescence; WRKY transcription factors; transcriptional regulation
DOI:10.7506/spkx1002-6630-201706003
中图分类号:TS225.1
文献标志码:A
文章编号:1002-6630(2017)06-0013-07
引文格式:
范中奇, 卓远芳, 符亚莉, 等. 香蕉MaWRKY31转录因子的特性及对MaAC S1、MaA CO1和MaSAG1的调控[J]. 食品科学, 2017, 38(6): 13-19. DOI:10.7506/spkx1002-6630-201706003. http://www.spkx.net.cn
FAN Zhongqi, ZHUO Yuanfang, FU Yali, et al. Molecular characterization of a transcriptional factor, MaWRKY31, and its regulation on MaACS1, MaACO1 and MaSAG1[J]. Food Science, 2017, 38(6): 13-19. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706003. http://www.spkx.net.cn
收稿日期:2016-04-26
基金项目:国家自然科学基金面上项目(31372111);国家香蕉现代农业产业技术体系项目(CARS-32-09)
作者简介:范中奇(1992—),女,硕士研究生,研究方向为园艺产品采后生物学。E-mail:ffanzqi@163.com
*通信作者:陈建业(1976—),男,教授,博士,研究方向为园艺产品采后生物学。E-mail:chenjianye@scau.edu.cn





 m
m
 )
)

