海南黎族鱼茶中微生物多样性分析
王小茹,徐传标,彭湘文,张家超*
(海南大学食品学院,海南 海口 570228)
摘 要:以采集自海南保亭与白沙两地区的黎族家庭的28 份样本为研究对象,采用传统分离培养方法,16S rRNA基因序列分析和实时定量聚合酶链式反应分析对样品中的微生物进行分离鉴定和多样性研究。结果表明,共鉴定出6 个属,22 个种,其中L acto ba cillus属占总数的68.56%,Bacillus属和Entero co ccus属则分别占18.04%和10.82%,又测得L a cto b a cillu s属基因拷贝数为2.24×10
7,B a cillu s属为1.72×10
5以及E n tero co ccus属为1.07×10
6。可知,Lacto ba cillus属是鱼茶中的主要优势菌属,Lactobacillus pla ntarum和Lactobacillus pentosus是鱼茶中的优势菌种。而不同地区鱼茶中微生物多样性也存在差异,以Lactobacillus属为例,保亭地区独有Lactobacillus rossiae,而白沙地区独有Lactobacillus coryniformis、Lactobacillus fermentum、Lactobacillus namurensis、Lactobacillus senioris。研究结果揭示了海南黎族鱼茶中微生物的丰富多样性,反映了微生物群落结构特点,为有益微生物资源的开发利用提供参考依据。
关键词:海南;黎族;鱼茶;微生物多样性;16S rRNA基因序列分析;实时定量聚合酶链式反应;分类进化
鱼茶,又名鱼酸,是海南黎族的一种传统发酵食品。制作方法主要是把生鱼或生肉拌入米饭,加入少许盐,在陶罐里腌制发酵而成,为了改善鱼茶风味,也加入辣椒、大蒜及其他调味品。鱼茶味酸而微咸,柔软且稍韧,味道独特,诱人食欲
[1-3]。
海南,位置独特、气候优越资源丰富,是我国发展热带生物产业和研究热带生物资源的重要区域
[4]。鱼茶制作工艺沿袭传统方法,保留了许多当地自然环境中的有益微生物,是研究海南微生物多样性的绝佳模型。近年来,国内外有许多传统发酵食品微生物多样性的研究,苗族酸汤中分离得到L a c to b a c illu s plantarum、Lactobacillus acidophilus、Lactobacillus lactis和S trepto coc cus th erm op h ilus菌种
[5],西藏传统发酵乳中Lactobacillus casei是优势菌群
[6],云南西双版纳州的景洪市和勐海县两地区豆豉的主要优势菌种分别为Leuconostoc mesenteroides和Stap hylococcus gallinarum
[7],东北传统豆酱发酵过程中优势细菌为B acillus和L a ctob a cillu s
[8],印度黑绿豆米饼中蕴含着丰富的L eucon ostos、Weissella和Pediococcus等菌属
[9],韩国八大种传统发酵食品中微生物多样性也十分丰富
[10],这些研究为当地环境中有益微生物的开发和利用提供了基础条件。
本研究结合传统分离培养方法,16S rRNA基因序列分析和实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)分析,对从海南保亭和白沙两地区的黎族人家收集到的鱼茶样品进行微生物多样性分析,旨在发掘海南地区微生物资源,保护有益微生物并为其开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
鱼茶样品采自海南保亭和白沙地区的黎族家庭。
MRS培养基 北京陆桥技术有限责任公司;M17培养基 英国Oxoid公司;6×DNA loading buffer(含二甲苯菁和溴酚蓝双染料);2×Es Taq Master Mix、D2000 DNA ladder、蛋白酶K 北京康为世纪生物科技有限公司;SYBR Green 2×Buffer 宝生物工程(大连)有限公司;Gold View™核酸染料 美国Amerco公司;Agarose LE 天根生化科技(北京)有限公司。
1.2 仪器与设备
DP72双目生物显微镜 日本Olympus公司;A300 Fast Th ermal Cycler PCR仪 杭州朗基科学仪器有限公司;ABI stepone plus qRT-PCR仪 美国Applied Biosystems公司;TD-6K迷你离心机 上海卢湘仪离心机仪器有限公司;冷冻离心机 赛默飞世尔科技;DYY-8C型电泳仪 北京市六一仪器厂;凝胶成像分析系统 美国Protein Simple公司。
1.3 方法
1.3.1 样品采集与处理
2 8 份样品采自保亭和白沙地区的黎族家庭,鱼茶装入无菌容器,全程4 ℃条件下低温保藏运送至实验室。称取1 0 g鱼茶样品放入9 0 m L无菌生理盐水(0.85 g/100 mL)中,混合均匀,按10 倍稀释法制备成10
-1~10
-5的鱼茶样品稀释液。
1.3.2 微生物分离与纯化
从各浓度的鱼茶样品稀释液中吸取100 μL,分别涂布于M17琼脂和MRS琼脂培养基上,每个稀释度涂布一个平板,37 ℃条件下培养48 h,其中MRS培养基需置于厌氧罐中。通过肉眼观察并记录菌落形态后,从最佳稀释梯度培养基中挑取可疑菌落,接种到对应肉汤培养基中37 ℃条件下培养48 h。用革兰氏染色法在光学显微镜下观察菌体形态,检验是否为纯菌种,并配合接触酶实验初步判断乳酸菌
[11]。检查为纯菌种的菌株传代培养后甘油法-70 ℃条件下低温冻存。
1.3.3 16S rRNA基因序列分析
采用液氮冻融法,参考文献[12-14]的十六烷基三甲基溴化铵(hexadecyltrimethy ammonium bromide,CTAB)法提取菌株总基因组DNA,提取出的DNA置于-20 ℃条件下保存。基因组DNA用1.0%琼脂糖凝胶电泳检测浓度和纯度,100 V电压下0.5×TBE电泳液中电泳20 min。
1 6 S r R N A扩增引物:正向引物为P r im e d(W27952):5’-AGAGTTTGATCATGGCTCAG-3’,反向引物为Primer2(W27 953):5’-TAGGGTTACC TTGTTACGACTT-3’
[15-16]。PCR扩增体系(50 μL):2×Es Ta q Master Mix 2 5 μL、引物(10 p mol/μL)各1.5 μL、基因组DNA模板(1 00 n g/μL)1.5 μL、ddH
2O 20.5 μL。反应参数:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,循环30 次;72 ℃末端延伸10 min,4 ℃条件下保温。
PCR产物用1.0%琼脂糖凝胶电泳检测,若可见到清晰的条带,并且无明显非特异性扩增,即可判断PCR成功。测序工作由上海美吉生物医药科技有限公司完成。使用SeqMan应用程序将测序结果进行校准后,利用NCBI数据库,进行BLAST分析,选择准确率在98%及以上的分析结果作为鉴定结果。然后选取鱼茶样品中的代表菌株及其相似菌种,使用MEGA6.0中Neighbor-Joining法构建系统发育树。
1.3.4 qRT-PCR分析
采用液氮冻融的方式获得鱼茶中微生物宏基因组DNA,结合分离鉴定结果并参照相应文献
[1
7-1
8]合成Lactobacillus、Bacillus和Enterococcus属特异性引物,qRT-PCR引物见表1,通过扩增上述菌属的参考菌株构建标准曲线,而后将构建的标品梯度稀释后与28 份鱼茶样品一起进行qRT-PCR并计算样品中目的菌属的基因拷贝数。
表1 qRT-PCR引物
Table 1 Primers for qRT-PCR

菌种引物序列(5’→3’)扩增最佳退火参考长度/bp温度/℃文献Lactobacillus Lac-FAGCAGTAGGGAATCTTCCA 192 58[17] Lac-RCACCGCTACACATGGAG Bacillus Bac-FATAGCCTTTCGAAAGRAAGAT 295 56[18] Bac-RCCAGTATCAACTGCAATTTTA Enterococcus Ent-FCCGTAGATATCTGGAGGAACATCAG 235 58[17] Ent-RACATCTAGCATCCATCGTTTACAGC
q RT-PCR体系(20 μL):SYBR Green 2×Buffer 1 0 μL、引物0.4 μL(1 0 μm o l/L)、总DNA模板2 μL,dd H
2O补至20 μL,设置3 个重复。反应参数:94 ℃ 30 s;94 ℃ 5 s,各自最佳退火温度(表1)40 s,72 ℃ 50 s,循环40 次;熔解曲线温度65~95 ℃。
2 结果与分析
2.1 微生物分离与纯化
经过分离纯化培养,从28 份样品中分离出19 4 株供试菌株,其中来自MRS培养基的有111 株,所占比例为57.22%,来自M17培养基的有83 株,所占比例为42.78%。革兰氏染色阳性、接触酶实验阴性的菌株有133 株,疑似乳酸菌的菌株占总数的68.56%。
2.2 16S rRNA序列同源分析鉴定
表2 16S rRNA序列同源分析鉴定结果
Table 2 Identifi cation of isolates based on 16S rRNA sequencing
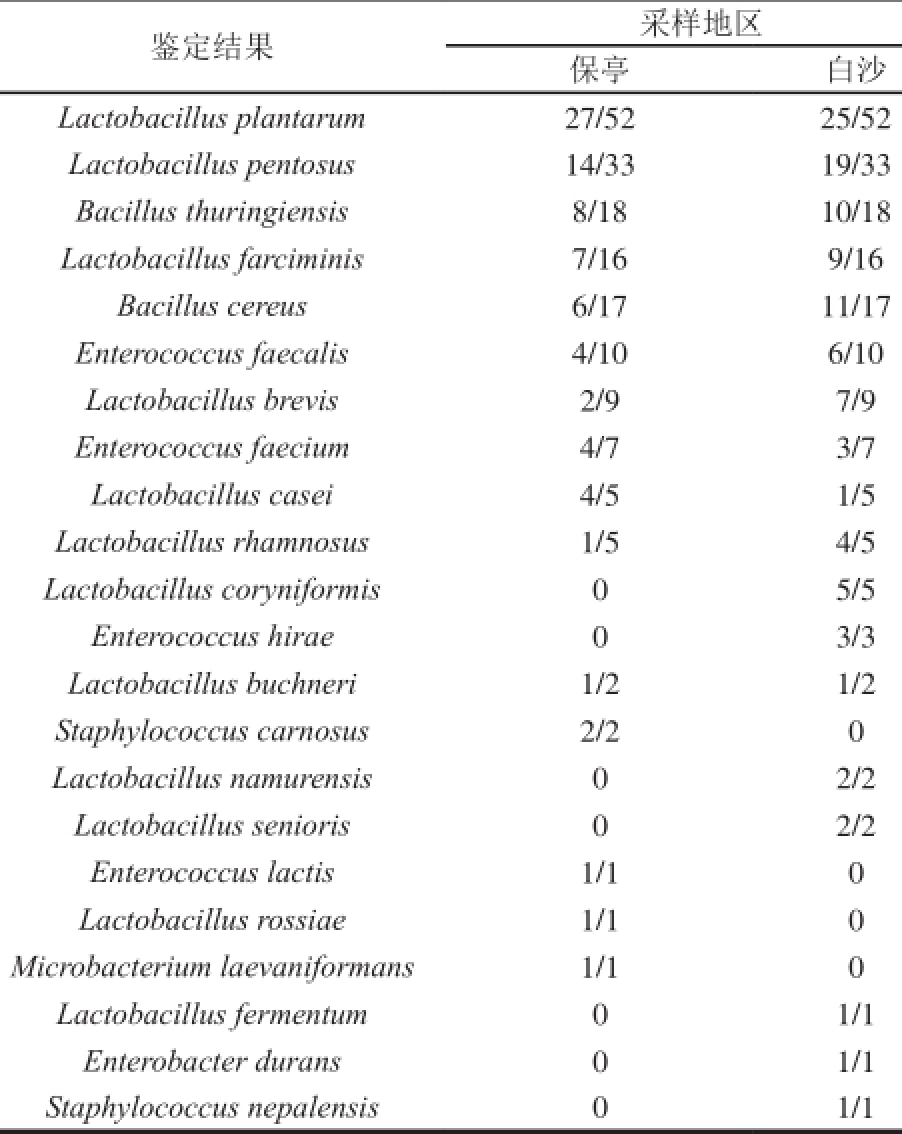
注:2 7/52表示分离得到的52 株菌种有2 7 株被鉴定为L a c to b a c illu s plantarum。
鉴定结果采样地区保亭白沙Lactobacillus plantarum 27/52 25/52 Lactobacillus pentosus 14/33 19/33 Bacillus thuringiensis 8/18 10/18 Lactobacillus farciminis 7/16 9/16 Bacillus cereus 6/17 11/17 Enterococcus faecalis 4/10 6/10 Lactobacillus brevis 2/9 7/9 Enterococcus faecium 4/7 3/7 Lactobacillus casei 4/5 1/5 Lactobacillus rhamnosus 1/5 4/5 Lactobacillus coryniformis 0 5/5 Enterococcus hirae 0 3/3 Lactobacillus buchneri 1/2 1/2 Staphylococcus carnosus 2/2 0 Lactobacillus namurensis 0 2/2 Lactobacillus senioris 0 2/2 Enterococcus lactis 1/1 0 Lactobacillus rossiae 1/1 0 Microbacterium laevaniformans 1/1 0 Lactobacillus fermentum 0 1/1 Enterobacter durans 0 1/1 Staphylococcus nepalensis 0 1/1
使用Seq Man应用程序将测序结果进行拼接,手动修正测序错误,获得准确的基因序列信息,序列长约1 500 bp。然后利用NCBI数据库,进行BLAST分析,选择准确率在9 8%及以上的分析结果作为鉴定结果。16S rRNA基因序列同源分析成功鉴定出194 株菌。共鉴定出L a c to b a c illu s(133 株)、B a c illu s(35 株)、E n tero c o c cu s(21 株)、S ta p h ylo co cc u s(3 株)、En terob a cter(1 株)、M icro b acterium(1 株)六大类菌属,可见L a c to b a c illu s属数量最多,占菌种总数的68.56%,此结果也与之前的形态学检查结果相呼应。在La cto ba cillu s菌株中,有87 株菌分离自MRS培养基,另外4 6 株菌分离自M17培养基。从表2可知,两个地区的鱼茶样品中均发现了大量L a cto b a cillu s p la n ta ru m(52 株)和L a cto b a cillu s p en to su s(33 株),可见这2 种菌是黎族鱼茶中的优势菌种,另外还鉴定出其他1 0 种乳杆菌L a cto b a cillu s fa rcim in is(16 株)、La cto b acillu s brevis(9 株)、La cto b acillu s rha m no su s(5 株)、L a ctob a cillu s ca sei(5 株)、L acto b acillu s coryn iformis(5 株)、Lactoba cillus senioris(2 株)、L a ctobacillus nam u ren sis(2 株)、Lactobacillus bu chneri(2 株)、La ctob acillus rossiae(1 株)、L acto bacillus ferm en tu m(1 株)。Ba cillu s属占总体的18.04%,鉴定出2 类菌种,Ba cillu s th u rin gien sis(18 株)和B acillu s c ereu s(1 7 株)。E n tero co ccu s属占总体的10.82%,主要有E n tero c o c c u s fa e c a lis(10 株)和E n te ro co c c u s fa eciu m(7 株)。研究还发现极少量的S ta p h yloco ccu s carnosus(2 株)、Stap hylococcu s nepalensis(1 株)、M icro ba cterium laeva n ifo rm a ns(1 株)和E nterob a cter durans(1 株)。
2.3 不同地区鱼茶微生物多样性对比
由表2可知,保亭和白沙两地区在菌种种类和数量上便存在一定差异,由图1可更直观看出,两地鱼茶微生物多样性差异。保亭地区分离鉴定出83 株菌,占总数的42.78%,共15 个种;而白沙地区分离鉴定出111 株菌,占总数的57.22%,共1 8 个种,白沙地区的微生物总数与种类均比保亭地区多。两地区共有且数量大致相等的6 个菌种分别为Lacto bacillus pla ntarum、B acillus th u ring ien sis、L actob a cillu s fa rcimin is、E ntero co ccu s faecalis、E n terococcus faecium和Lacto b acillus buchneri,保亭地区较多的菌种为L a cto b a cillu s ca sei,白沙地区较多的菌种为La cto ba cillu s p en tosus、Ba cillu s cereu s、L a cto b a cillu s brevis、L a cto b acillu s rh a m n o su s,保亭地区独有4 个菌种分别为S ta p h ylo co ccu s c a rn o su s、E n te r o c o c c u s la c tis、L a c to b a c illu s r o s s ia e、Micro bacteriu m la eva nifo rma ns,白沙地区独有7 个菌种分别为L actob acillus coryn ifo rm is、En tero coccu s hira e、L a c to b a cillu s fe rm e n tu m、L a c to b a cillu s n a m u re n sis、L a c to b a c illu s s e n io ris、E n te ro b a c te r d u ra n s和Staphylococcus nepalensis。

图1 不同地区鱼茶微生物多样性对比
Fig. 1 Comparison of microbial diversity in Yucha from different areas
2.4 系统发育分析
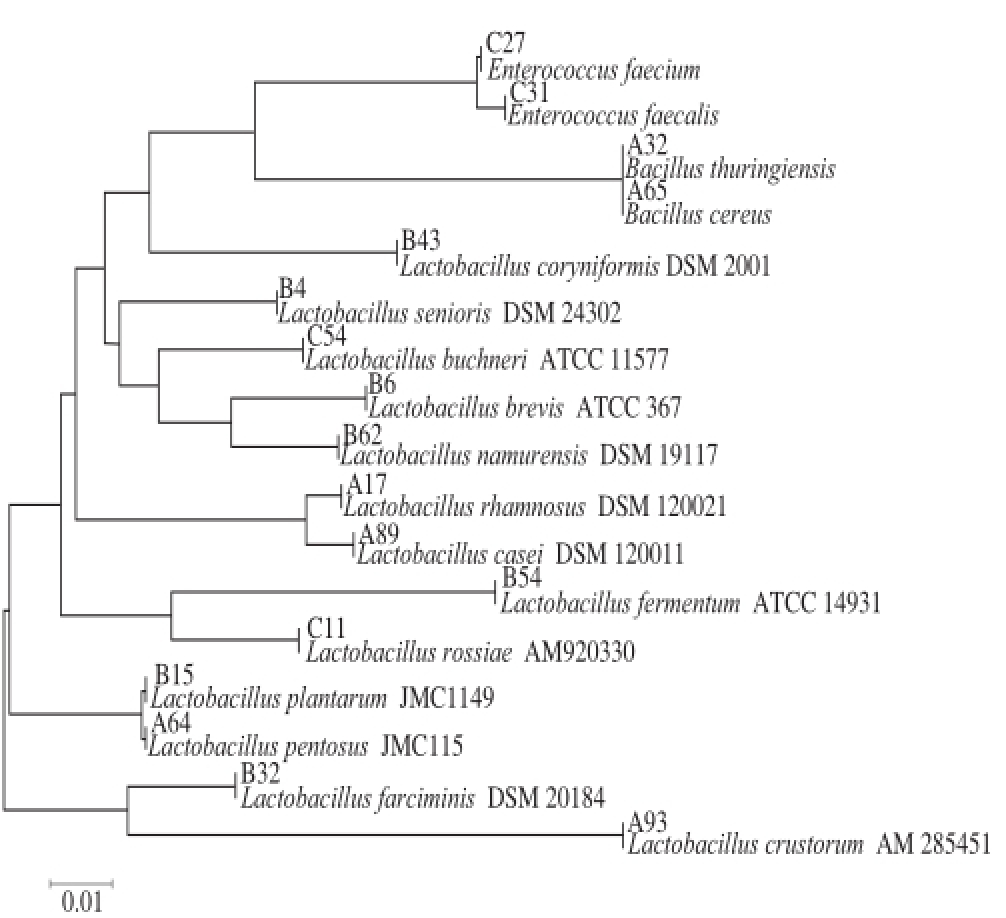
图2 鱼茶微生物16S rRNA基因序列建立的系统发育树
Fig. 2 Phylogenetic tree based on the 16S rRNA sequences of Yucha microorganisms
选取鱼茶样品中的代表菌株及其相似菌种,用MEGA6.0中Neighbor-Joining法构建系统发育树,显示各菌株的分类学地位和系统发育关系,结果如图2所示。全部菌株在系统发育树中基本分为12 个分支:C27和C31与Enterococcu s faeciu m和En terococcu s faecalis为一个分支;A32和A65与B ac illus thu ring ien sis和Ba cillu s ce reu s为一个分支;B43和Lacto bacillus coryniformis DSM 2001为一个分支;B4和La ctob acillus senio ris DSM 24302为一个分支;C54和La ctob acillu s b uch ne ri ATCC 11577为一个分支;B6和B62与La ctob acillus b revis ATCC 367和L actobacillu s namurensis DSM 19117为一个分支;A17和A89与Lactobacillus rhamnosus DSM 120021和Lactobacillus c a sei DSM 120 011为一个分支;B5 4和L a cto b a c illu s fermentum ATCC 14931为一个分支;C11和Lactob acillu s rossiae AM920330为一个分支;B15和A64与Lactobacillus plantarum JMC1149和Lactobacillus pentosus JMC115为一个分支;B32和Lactobacillus farciminis DSM 20184为一个分支;A93和Lactobacillus crustorum AM 285451为一个分支。上述结果已用Bootstrap检验500 次随机重复验证。
2.5 qRT-PCR定量结果

图3 优势菌属qRT-PCR结果
Fig. 3 Results of qRT-PCR for the predominant genera
结合分离鉴定结果,应用菌属特异性引物定量研究鱼茶样品中L ac to b a c illus、Ba c illu s和E n te ro c oc c u s属的含量。通过外标准品的制备,获得R
2为0.998的标准曲线,这表明通过该曲线定量对应菌属拷贝数,结果可信(图3A)。进而,定量结果显示(图3B),鱼茶中L a ctob acillus属含量最高,其基因拷贝数为2.24×10
7,Bacillus和Enterococcus属的含量为1.72×10
5和1.07×10
6,而该菌属的定量结果也与分离鉴定结果形成了良好的对应关系。
3 讨 论
本研究结合传统分离培养方法,16S rRNA基因序列同源性分析和实时定量PCR分析,从海南黎族传统发酵鱼茶食品中分离鉴定出194 株菌,其中Lactob acillus是主要优势菌属,Ba cillus和E nte ro co cc us也是鱼茶中重要的菌属。根据陈川平等
[19]的研究,其从海南鱼酸分离出4株优势乳酸菌均为L actob acillu s plan taru m,该结果与本研究结果相符,但也存在差异,本研究还发现了优势菌L acto bacillus pentosus,在La ctob acillu s菌群中所占比例为23.13%,同时还有发现大量其他乳酸菌如Lactobacillus farciminis、Lactobacillus brevis、Lactobacillus rham nosus和L ac tob acillu s c ase i等。另外,本实验首次从海南鱼茶中分离鉴定出Ba cillus th u ring ien sis、B a cillu s cereu s、E nterococcus fa ecium和E nteroco ccus fa eca lis等菌种。对比我国的鱼类发酵食品,李燕
[20]对黄山臭鳜鱼发酵过程中微生物多样性研究发现La cto bacillus sakei是主要优势菌,而在鱼茶样品中并未发现L ac tob acillu s sa ke i,差异可能是由于二者发酵方式不同及所在地域不同引起,臭鳜鱼采用低盐低温短期发酵制成,而海南为热带气候鱼茶也至少要发酵1 个月才能制成。对比国外的鱼类发酵食品,日本传统发酵鱼制品Saba-Narezushi中主要优势菌种是L acto bacillus cu rva tus、L acto coccus pisciu m和Leu conostoc gasicom itatum
[21],以上优势菌种均未在海南鱼茶中发现。缅甸有一种用淡水鱼与熟米饭混合发酵制成的传统食品,与鱼茶原料组成相似度较高,并且二者中均发现了丰富的Lactobacillus plantarum和L actoba cillu s fa rcim in is,但微生物多样性上也存在较大差异,缅甸鱼类发酵食品中的L a cto b a cillu s fu tsa ii、L a cto b a cillu s re u te ri、We isse lla p a ra m e se n te ro id e s和P e d io c o c c u s p en to sa ceu s
[2
2]均未在鱼茶中发现。对比海南保亭和白沙两地区鱼茶,L actob acillu s p lan ta ru m和L actob acillu s p ento su s是两地鱼茶发酵中的重要优势菌种,但从菌种丰富度的角度来看,白沙地区较为丰富。由上述鱼类发酵食品对比可见,鱼类发酵食品中微生物多样性十分丰富,地区之间差异较为明显,共同点是Lactobacillus属在鱼类食品发酵过程中发挥着重要作用。根据之前相似研究
[23-25],鱼茶中微生物的种类和数量与其生存及分离环境密切相关,自然环境的差异,黎族人家在制作鱼茶时的各家习惯,鱼茶制作过程涉及的发酵温度、发酵时间、制作方法甚至发酵容器都可能导致不同地区鱼茶中分离到的微生物种类及优势菌群有所不同。
研究结果表明,传统分离方法,16S rRNA基因序列同源性分析和qRT-PCR分析较好地揭示了海南黎族传统发酵食品中可培养微生物的丰富多样性,反映了微生物群落结构。研究发现并保存了大量有益菌种,例如L a c to b a c illu s p la n ta ru m对人体有特殊的生理作用,且在食品、饲料及医疗保健领域中将占主导地位
[26],L a c to b a c illu s p e n to su s应用在功能食品、橄榄发酵食品和生物表面活性剂有许多有意义成果
[27],B a c illu s th u rin g ien sis是重要的生物防治菌种
[28]。研究还为提高黎族鱼茶品质提供依据,陈平川
[29]在其对鱼酸初步研究中,便利用从鱼茶中分离出的植物乳杆菌L2进行纯种发酵,发酵时间缩短至25 d,风味接近自然发酵产品,优化了鱼茶生产工艺提高鱼茶产量及产品稳定性,可见本研究为后续海南当地有益微生物的开发利用打下基础。
参考文献:
[1] 佚名. 海南鱼茶[J]. 海洋与渔业, 2015(7): 67.
[2] 廖玉玲, 廖国一. 当代黎族饮食文化的基本特征及其成因[J]. 南宁职业技术学院学报, 2007, 12(3): 1-7.
[3] 许环烈. 黎族鱼茶[J]. 椰城, 2009(7): 21.
[4] 中国科学院学部“海南热带生物资源的保护和可持续利用”咨询组.关于海南热带陆海生物资源保护和利用的对策建议[J]. 中国科学院院刊, 2004, 19(3): 175-176.
[5] 后立琼. 苗族酸汤中乳酸菌的分离鉴定及发酵动力学模型研究[D].成都: 四川农业大学, 2012: 1-3; 44.
[6] 陈之兰, 杨吉霞, 李梦寒, 等. 西藏地区传统发酵乳中乳酸菌多样性及微生物数量分析[J]. 食品科学, 2013, 34(17): 140-145. DOI:10.7506/spkx1002-6630-201317031.
[7] LI X R, LIU X F, ZHANG H Y, et al. Microbial community diversity in douchi from Yunnan province using high-throughput sequencing technology[J]. Modern Food Science and Technology, 2014, 30(12): 61-67. DOI:10.13982/j.mfst.1673-9078.2014.12.011.
[8] 高秀芝, 易欣欣, 刘慧, 等. 东北传统豆酱发酵过程中微生物的多样性[J]. 生物技术通报, 2016, 32(4): 251-255. DOI:10.13560/j.cnki. biotech.bull.1985.2016.04.034.
[9] SARAVANAN C, GOPU V, SHETTY P H. Diversity and functional characterization of microflora isolated from traditional fermented food idli[J]. Journal of Food Science and Technology, 2015, 52(11): 7425-7432. DOI:10.1007/s13197-015-1791-6.
[10] LEE S H, AHN M J, HONG J S, et al. Diversity and community analysis of fermenting bacteria isolated from eight major Korean fermented foods using arbitrary-primed PCR and 16S rRNA gene sequencing[J]. Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(3): 453-461. DOI:10.1007/s13765-015-0062-6.
[11] 淩代文, 东秀珠. 乳酸菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 2001: 118-124.
[12] 萨日娜. 产γ-氨基丁酸乳球菌的鉴定及发酵特性的研究[D]. 呼和浩特: 内蒙古农业大学, 2011: 10-11.
[13] 付琳琳. 应用PCR-DGGE技术分析泡菜中乳酸菌的多样性[D]. 南昌: 南昌大学, 2005: 32-34.
[14] 乌日娜. 内蒙古传统酸马奶中乳杆菌的分离鉴定及16S rDNA序列同性分析[D]. 呼和浩特: 内蒙古农业大学, 2005: 18-20.
[15] 赵玉娟, 牛春华, 张雪, 等. 16S rRNA序列分析及其在乳酸菌分类、鉴定中的应用[J]. 食品科学, 2009, 30(7): 299-303.
[16] 华鹤良, 张军, 杨仁琴, 等. 乳酸菌复壮、鉴定及其优良菌株筛选[J].扬州大学学报(农业与生命科学版), 2013, 34(4): 27-31.
[17] VANHOUTTE T, de PRETER V, de BRANDT E, et al. Molecular monitoring of the fecal microbiota of healthy human subjects during administration of lactulose and Saccharom yces boulardii[J]. Applied and Environmental Microbiology, 2006, 72(9): 5990-5997. DOI:10.1128/AEM.00233-06.
[18] MATSUKI T, WATANABE K, FUJIMOTO J, et al. Use of 16S rRNA gene-targeted group-specific primers for real-time PCR analysis of predominant bacteria in human feces[J]. Applied and Environmental Microbiology, 2004, 70(12): 7220-7228. DOI:10.1128/ AEM.70.12.7220-7228.2004.
[19] 陈川平, 李从发. 海南鱼酸中乳酸菌的分离鉴定[J]. 热带农业工程, 2013, 37(3): 28-30.
[20] 李燕. 黄山臭鳜鱼发酵过程中微生物多样性的研究[D]. 杭州: 浙江工商大学, 2014: 1-2; 120-121.
[21] MATSUI H, TSUCHIYA R, ISOBE Y, et al. Analysis of bacterial community structure in Sa ba-Narezu sh i (N arezu shi of Mackerel) by 16S rRNA gene clone library[J]. Journal of Food Science and Technology, 2013, 50(4): 791-796. DOI:10.1007/s13197-011-0382-4.
[22] MOE N K T, THWE S M, SHIRAI T, et al. Characterization of lactic acid bacteria distributed in small fish fermented with boiled rice in Myanmar[J]. Fisheries Science, 2015, 81(2): 373-381. DOI:10.1007/ s12562-014-0843-6.
[23] LIU X F, LIU C J, ZHANG H Y, et al. The bacterial community structure of yond bap, a traditional fermented goat milk product, from distinct Chinese regions[J]. Dairy Science and Technology, 2015, 95(3): 369-380. DOI:10.1007/s13594-015-0216-7.
[24] 包秋华. 甘肃和四川省牦牛奶制品中乳酸菌的多样性研究[D]. 呼和浩特: 内蒙古农业大学, 2012: 46-52.
[25] LIU W J, ZHENG Y, KWOK L Y, et al. High-throughput sequencing for the detection of the bacterial and fungal diversity in Mongolian naturally fermented cow’s milk in Russia[J]. BMC Microbiology, 2015, 15(1): 385. DOI:10.1186/s12866-015-0385-9.
[26] 王水泉, 包艳, 董喜梅, 等. 植物乳杆菌的生理功能及应用[J]. 中国农业科技导报, 2010, 12(4): 49-55.
[27] 孙茂盛, 张岚, 刘敏, 等. 戊糖乳杆菌及其在食品工业中的应用[J]. 中国酿造, 2 0 1 5, 3 4(6): 11-1 3. DOI:1 0.11 8 8 2/ j.issn.0254-5071.2015.06.003.
[28] de ALMEIDA MELO A L, SOCCOL V T, SOCCOL C R. Bacillus thuringiensis: mechanism of action, resistance, and new applications: a review[J]. Critical Reviews in Biotechnology, 2016, 36(2): 317-326. DOI:10.3109/07388551.2014.960793.
[29] 陈平川. 海南鱼酸的初步研究[D]. 海口: 海南大学, 2013: 17-24.
Analysis of Microbial Diversity in Yucha, a Traditional Fermented Rice Food of Li Nationality from Hainan
WANG Xiaoru, XU Chuanbiao, PENG Xiangwen, ZHANG Jiachao*
(College of Food Science and Technology, Hainan University, Haikou 570228, China)
Abstract:In the present study, 28 Yucha (a traditional fermentation rice food of Li nationality in Hainan) samples collected from different Li nationality households in Baoting and Baisha areas of Hainan province were used to isolate and purify microbes by conventional culture method and further to determine microbial diversity by 16S rRNA sequencing analysis and quantitative real-time polymerase china reaction (qRT-PCR). A total of 22 bacterial species from six genera were identified. Among these, La ctobacillus, Bacillus and E nterococcus accounted for 68.56%, 18.04% and 10.82% of the total bacteria, respectively. Meanwhile, the copy numbers of genes in Lactobacillus, Bacillus and Enterococcus were 2.24 × 10
7, 1.72 × 10
5and 1.07 × 10
6, respectively, meaning that La ctobacillu s was the most predominant genus, with Lactobacillus plantarum and Lactobacillu s pen to sus being the most predominant species. The microbial diversity in Yucha from different areas was different. La ctob acillus rossiae was exclusively found in Yucha from Baoting while L. coryn iformis, L. fermentum, L. nam uren sis and L. senio ris in Yucha from Baisha. The results of the present study revealed the abundant microbial diversity and microbial community structure in Yucha, which could provide evidence to develop and use the beneficial microbial resources from Yucha.
Key words:Hainan; Li nationality; Yucha; microbial diversity; 16S rRNA sequencing analysis; qRT-PCR; phylogenetic analysis
DOI:10.7506/spkx1002-6630-201706021
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)06-0136-06
引文格式:
王小茹, 徐传标, 彭湘文, 等. 海南黎族鱼茶中微生物多样性分析[J]. 食品科学, 2017, 38(6): 136-141. DOI:10.7506/ spkx1002-6630-201706021. http://www.spkx.net.cn
WANG Xiaoru, XU Chuanbiao, PENG Xiangwen, et al. Analysis of microbial diversity in Yucha, a traditional fermented rice food of Li nationality from Hainan[J]. Food Science, 2017, 38(6): 136-141. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706021. http://www.spkx.net.cn
收稿日期:2016-06-15
基金项目:海南省高等学校科学研究项目(Hnky2016-12);海南大学科研启动基金项目(KYQD1548)
作者简介:王小茹(1994—),女,本科,研究方向为食品微生物。E-mail:WangXiaoru1210@163.com
*通信作者:张家超(1986—),男,教授,博士,研究方向为食品微生物。E-mail:zhjch321123@163.com




