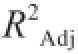 为0.993 48,可见该曲线拟合良好,可作为样品中蛋白质量浓度计算的方程模型。
为0.993 48,可见该曲线拟合良好,可作为样品中蛋白质量浓度计算的方程模型。
张 帅 1,2,曹 庸 2,*,梁晓莹 2,林婉如 2
(1.肇庆学院化学化工学院,广东 肇庆 526061;2.华南农业大学食品学院,广东 广州 510642)
摘 要:采用中空纤维膜超滤和葡聚糖凝胶层析相结合的方法对黑曲霉N5-5单宁酶进行纯化,然后对纯酶性质进行测定。结果显示,黑曲霉N5-5单宁酶用该方法纯化后,可纯化近20 倍,酶活力可回收23.30%。对纯酶作十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析,可知黑曲霉N5-5单宁酶为分子质量64.2 kD的单肽链蛋白。纯酶的酶促反应最适温度为45 ℃,且在25~45 ℃范围内热稳定性良好;酶促反应最适pH值为5.0,且在pH 5.0~5.5范围内酸碱稳定性良好。另外,反应动力学测定结果表明,该酶对底物没食子酸丙酯的米氏常数K m为0.916 mmol/L,最大反应速率v max为0.877 mmol/(L·min)。
关键词:单宁酶;黑曲霉;纯化;纯酶;性质测定
单宁酶,即单宁酰基水解酶(EC 3.1.1.20),是一种广泛存在于微生物及植物中的诱导酶,尤其是在丝状真菌中,以单宁酸、五倍子等作为诱导物时可大量产生,属于细胞膜结合酶,可分泌至胞外 [1-3]。单宁酶可专一性水解没食子酰单宁及鞣花单宁等水解型单宁以及没食子酸烷基酯中的酯键和缩酚羧键,生成没食子酸、葡萄糖、六羟基联苯二甲酸及醇类等物质 [4-6]。单宁酶因其对单宁物质的高效水解作用而应用于食品、饮料、酿酒、医药及化工等多个领域 [7-9]。
由微生物发酵获得的粗酶,通常含有多种杂蛋白及小分子化合物。将目标酶从粗酶中有效分离出来并获得纯酶,从而测定其酶学性质,是开展酶学研究的必要内容,对于酶在工业中的合理应用具有重要的理论指导意义。目前,国内外已对多种微生物单宁酶进行了纯化,各种单宁酶在酶学性质方面展现出了较大的差异。根据现有文献报道,微生物单宁酶大多是由一条或两条肽链组成的、分子质量通常在50~180 kD的酸性蛋白 [1,4,10-13]。
单宁酶的纯化,目前多采用“硫酸铵沉淀→离子交换层析→凝胶过滤层析”的传统方法 [14-2 0]。虽然这一具有普遍意义的方法对单宁酶纯化效果较好,但由于该法耗时较长、劳动强度较大,且硫酸铵和长时间操作也会对酶活力造成不利影响,因而本研究采用超滤与层析技术相结合的方法对黑曲霉N5-5单宁酶进行纯化,该法方便实用,工艺周期短,且实验过程中对酶活性影响较小。获得纯酶后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,确定该酶的蛋白质组成及分子质量,并对纯化效果进行评价。另外,对黑曲霉N5-5单宁酶的酶促反应最适温度、最适pH值、热稳定性、酸碱稳定性及反应动力学等基本性质进行测定。
1.1 材料与试剂
单宁酶粗酶液:参照前期工作 [21],通过黑曲霉N5-5(CCTCC M 2014051)固态发酵制备,酶活力471.35 U/mL。
没食子酸丙酯(propyl gallate,PG) 阿拉丁试剂(上海)有限公司;Sephadex G-150、叠氮化钠、二甲基亚砜、SDS、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺(tetramethylethylenediamine,TEMED)、溴酚蓝、甘氨酸、考马斯亮蓝G-250、三羟甲基氨基甲烷(Tris)、牛血清白蛋白(bovine serum albumin,BSA) 生工生物工程(上海)股份有限公司;蛋白Marker 日本Takara公司;其他试剂均为国产分析纯。
柠檬酸-柠檬酸三钠缓冲液(下简称缓冲液)及PG标准液参考前期工作 [21]的方法配制;非还原及还原SDSPAGE相关试剂参考郝福英等 [22]的方法配制。
1.2 仪器与设备
U-3 0 1 0型紫外-可见分光光度计 日本Hitach i公司;TUS-200型振荡型恒温金属浴 上海一恒科学有限公司;DHZ-C型恒温振荡器 太仓市强乐实验设备有限公司;中空纤维超滤膜管 广州能淼环保科技有限公司;FD-1PF型冷冻干燥机 北京德天佑科技发展有限公司;PowerPac HV 164-5056蛋白电泳仪、电泳槽美国Bio-Rad公司。
1.3 方法
1.3.1 蛋白质量浓度测定
采用考马斯亮蓝G-250法
[23]。以BSA为标准蛋白,与考马斯亮蓝G-25 0试剂作用后,在595 nm波长处测定吸光度A
595
nm,建立A
595
nm-BSA质量浓度标准曲线。样品蛋白质量浓度可由标准曲线求出。得到回归方程Y=0.008 X-0.028,校正决定系数
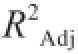 为0.993 48,可见该曲线拟合良好,可作为样品中蛋白质量浓度计算的方程模型。
为0.993 48,可见该曲线拟合良好,可作为样品中蛋白质量浓度计算的方程模型。
1.3.2 单宁酶活力测定
采用前期工作 [21]的方法测定单宁酶活力,并按式(1)计算比活力:

1.3.3 单宁酶纯化
采用超滤与层析技术相结合的方法纯化黑曲霉N5-5单宁酶。1)预处理:单宁酶粗酶液5 00 0 r/min离心2 0 min,取上清液;2)超滤:用切割分子质量(molecular weighe cut off,MWCO)20 kD的中空纤维膜将上清液超滤浓缩,浓缩液冻干,收集冻干样品并加适量水配成0.01 g/mL溶液,4 ℃条件下冷藏备用。上清液超滤后大部分分子质量低于20 kD的物质被滤弃。3)层析:称取Seph ad ex G-1 50葡聚糖凝胶5 g,置于200 mL 0.05 g/mL叠氮化钠溶液中,室温溶胀72 h后装柱层析。上样量2 mL;自然流速洗脱;洗脱样分管收集,每管4 mL,根据蛋白质量浓度变化,共收集30管。
测定各管溶液的单宁酶活力,将有较高酶活力的数管溶液冻干,各冻干样加适量水配成1.0 mg/mL溶液,分别作非还原SDS-PAGE分析。电泳后凝胶中含单一条带的,该条带即为单宁酶纯酶蛋白。按照相同的纯化方法,积累纯酶备用。
1.3.4 SDS-PAGE
采用郝福英等
[18]的方法进行SDS-PAGE。电泳结束后,根据凝胶中的蛋白条带位置,可计算单宁酶分子质量(M
w)。首先量出Mark er各蛋白条带中心及溴酚蓝指示剂距凝胶顶端的距离(分别记为s
M和s
B),然后计算出Marker各蛋白条带的相对迁移率m
R=s
M/s
B,建立lg M
w-m
R蛋白质分子质量标准曲线,标准曲线回归方程为Y=-1.307X+2.287,校正决定系数
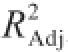 为0.992 67,可见该曲线拟合良好,可作为单宁酶分子质量计算的方程模型。计算出纯酶条带的m
R后,单宁酶分子质量可通过标准曲线求出。另外,测定粗酶、超滤酶(超滤浓缩后的单宁酶)及纯酶的比活力,通过比较分析,考察单宁酶的纯化效果。
为0.992 67,可见该曲线拟合良好,可作为单宁酶分子质量计算的方程模型。计算出纯酶条带的m
R后,单宁酶分子质量可通过标准曲线求出。另外,测定粗酶、超滤酶(超滤浓缩后的单宁酶)及纯酶的比活力,通过比较分析,考察单宁酶的纯化效果。
1.3.5 纯酶性质测定
配制0.0 1 mg/m L纯酶液,对其酶促反应最适温度、热稳定性、酶促反应最适p H值、酸碱稳定性及反应动力学等基本酶学性质进行测定,从而更好的应用于水解反应。
1.3.5.1 酶促反应最适温度测定
纯酶分别在25、30、35、40、45、50、55、60 ℃条件下恒温水浴60 min,测定各温度下的酶活力,以酶活力最高值为对照,计算各温度下的相对活力,最高者对应的温度即为酶促反应最适温度。
1.3.5.2 热稳定性测定
纯酶分别在25、35、45、50、55、60 ℃条件下恒温水浴3 h,恒温期间,各温度处理组分别在0.5、1、1.5、2、2.5、3 h时测定各温度下纯酶活力,以0.5 h时测定的酶活力为对照,计算不同处理时间的相对活力,考察不同温度下,酶活力随时间变化的关系。
1.3.5.3 酶促反应最适pH值测定
将缓冲液p H值分别调至3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5及7.0,然后在不同p H值的缓冲液中加入等体积纯酶液并测定酶活力,以酶活力最高值为对照,计算各p H值下的相对活力,最高者即为酶促反应最适p H值。
1.3.5.4 酸碱稳定性测定
在pH 4.0、4.5、5.0、5.5、6.0及6.5的缓冲液中分别加入等体积纯酶液,最适温度下恒温水浴12 h,期间分别在1、2、4、6、9、12 h时测定酶活力,以1 h时测定的酶活力为对照,计算不同时间下的相对活力,考察不同酸碱环境下,酶活力随时间变化的关系。
1.3.5.5 反应动力学性质测定
配制底物浓度([S])分别为0.5、1.0、1.5、2.0、2.5、3.0、4.0 mmol/L的PG溶液,分别在最适条件下反应2 min,通过反应前后吸光度A 270 nm的变化可求算出底物减少量[S]’,以单位时间内底物减少量计算不同底物浓度下的反应初速率v/(mmol/(L·min))(v=[S]’/2 min,即反应2 min时的平均速率可近似等于初速率 [22])。采用Lineweaver-Burk双倒数作图法 [24]计算单宁酶对底物PG的米氏常数K m和最大反应速率v max。Lineweaver-Burk方程如式(2)所示:
2.1 SDS-PAGE分析
将凝胶层析收集到的30 管洗脱样分别测定单宁酶活力(此处仅作比较,故以吸光度A 270 nm代表酶活力),将A 270 nm大于0.05的12~23号管蛋白作非还原SDS-PAGE,发现17号管蛋白电泳后的凝胶中仅有一条蛋白条带,因此可确定该蛋白条带为黑曲霉N5-5单宁酶。
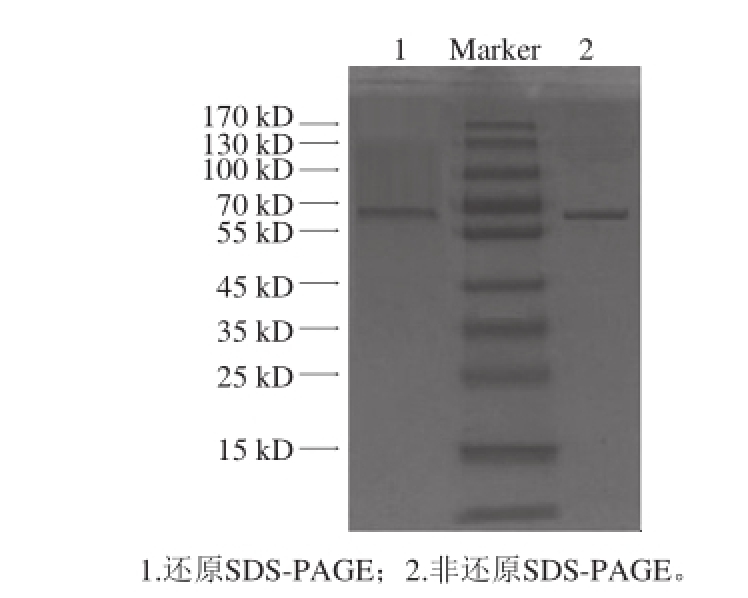
图1 纯酶SDS-PAGE分析
Fig. 1 SDS-PAGE analysis of purified tannase
由图1可知,非还原电泳和还原电泳结果均显示一条蛋白条带,表明黑曲霉N5-5单宁酶是由一条肽链形成的三级结构蛋白,根据蛋白质分子质量标准曲线,可计算其分子质量为64.2 kD,这与喻晓蔚 [25]报道的黑曲霉单宁酶分子质量较接近(63 kD)。
表1 黑曲霉N5-5单宁酶纯化效果
Table 1 Summary of the purification steps of tannase from Aspergillus niger N5-5
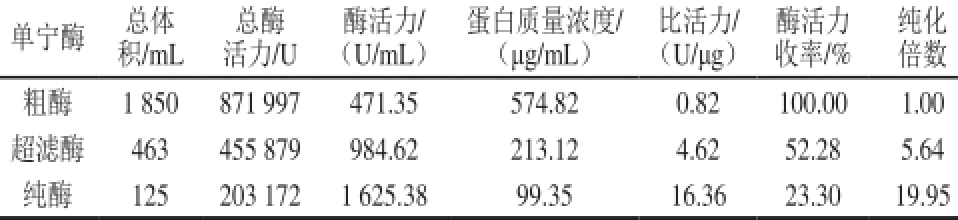
单宁酶总体总酶酶活力/蛋白质量浓度/比活力/酶活力纯化积/mL活力/U(U/mL)(μg/mL)(U/μg)收率/%倍数粗酶1 850 871 997 471.35 574.82 0.82 100.00 1.00超滤酶463 455 879 984.62 213.12 4.62 52.28 5.64纯酶125 203 172 1 625.38 99.35 16.36 23.30 19.95
由表1可知,黑曲霉N5-5单宁酶经纯化后,活力大大提升,相比粗酶可纯化近20 倍,酶活力可回收23.30%。虽然“超滤+层析”法相比传统方法并无纯化倍数优势(如Mahendran等 [1 6]采用传统方法可使一种拟青霉单宁酶纯化倍数达到30.5),但该法工艺周期相比传统方法可缩短50%以上,且获得的纯酶经电泳分析(图1)未见杂蛋白条带,可见纯化效果良好。
2.2 纯酶性质分析
2.2.1 酶促反应最适温度

图2 温度对酶活力的影响
Fig. 2 Effect of temperature on tannase activity
由图2可知,酶促反应最适温度为45 ℃。温度对酶促反应的影响表现在两方面:一方面,酶催化效率随温度的升高而增加,从25 ℃升至45 ℃时,酶活力随温度升高而增加;另一方面,当温度升至一定程度,随着酶蛋白变性,酶活力会逐渐降低直至完全丧失,从45 ℃升至60 ℃时,酶活力不断下降,60 ℃时,酶活力仅余39%。酶促反应最适温度是综合以上两方面效应的结果。
2.2.2 热稳定性分析
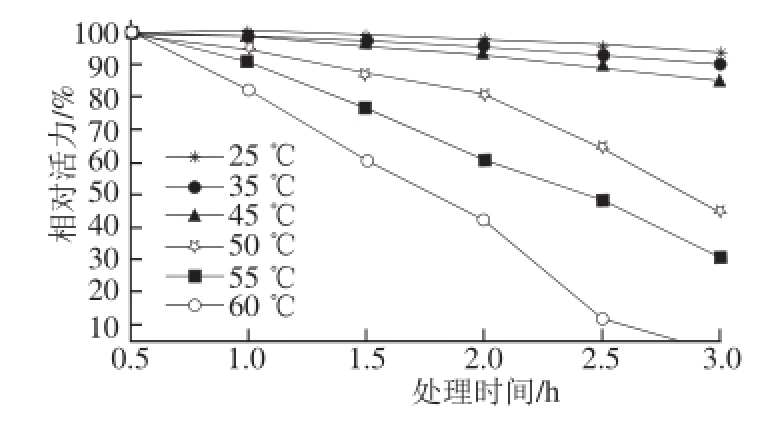
图3 单宁酶热稳定性
Fig. 3 Effect of temperatures on purified tannase stability
由图3可知,单宁酶在25 ℃和35 ℃恒温3 h,酶活力无明显变化,在最适温度45 ℃条件下恒温处理3 h后,仍有8 4.6%的酶活力,说明该酶在25~4 5 ℃时比较稳定。单宁酶在50 ℃条件下恒温处理2 h后,以及在55 ℃和60 ℃条件下恒温处理时,酶活力随时间延长而迅速下降,60 ℃条件下恒温处理3 h后,酶活力几乎完全丧失,说明该酶对高温较敏感,易导致失活。
2.2.3 酶促反应最适pH值

图4 pH值对酶活力的影响
Fig. 4 Effect of pH value on tannase activity
反应体系酸碱度对酶活力的影响是多方面的,如影响到酶分子构象,从而影响酶活力中心性能,使酶活力发生变化;影响酶的解离状态,而通常只有一种解离状态最适合酶促反应。由图4可知,酶促反应最适pH值为5.0,在pH 5.0~6.0的环境中,可保持较高酶活力,可见黑曲霉N5-5单宁酶是一种酸性水解酶。但当p H值低于5.0时,酶活力随pH值降低而迅速降低,在pH 3.0的强酸性环境中,残余酶活力已不足40%。
2.2.4 酸碱稳定性分析
由图5可知,单宁酶在pH 5.0和5.5的环境中45 ℃条件下恒温处理12 h,酶活力下降平缓,残余酶活力分别大于80%和70%,表明在pH 5.0~5.5的环境下,黑曲霉N5-5单宁酶稳定性良好。在pH 4.0时,酶活力下降较快,不利于酶促反应进行。

图5 单宁酶酸碱稳定性
Fig. 5 pH stability of purified tannase
2.2.5 反应动力学性质分析
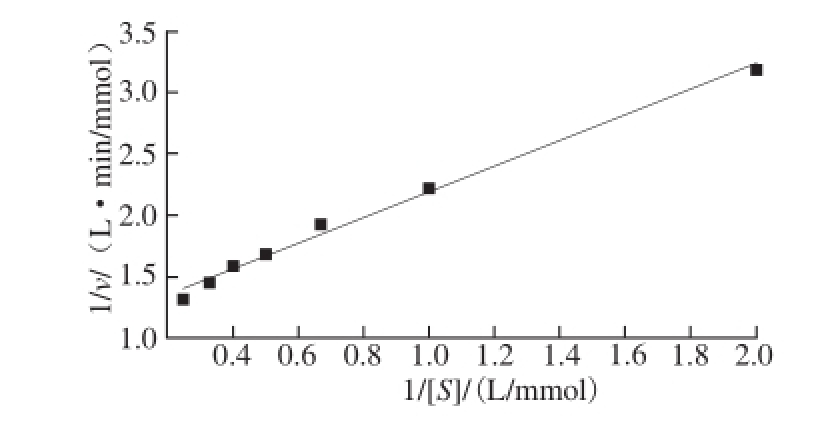
图6 单宁酶作用于PG的双倒数图
Fig. 6 Lineweaver-Burk plot of purifi ed tannase towards PG
用Lineweaver-Burk双倒数作图法,以酶促反应初速率倒数1/v对底物浓度倒数1/[S]作图(图6),经线性回归计算反应动力学参数。由图6可知,单宁酶对PG的水解作用符合米氏方程。标准曲线回归方程为Y=1.044X+ 1.140,
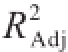 为0.990 66,表明该曲线拟合良好,可以作为反应动力学参数计算的方程模型。由回归方程可计算得:K
m为0.916 mmol/L,v
max为0.877 mmol/(L·min)。
为0.990 66,表明该曲线拟合良好,可以作为反应动力学参数计算的方程模型。由回归方程可计算得:K
m为0.916 mmol/L,v
max为0.877 mmol/(L·min)。
采用先将粗酶液进行中空纤维膜超滤(MWCO 20 k D),再将超滤酶液进行Sephadex G-150凝胶层析的方法,对黑曲霉N5-5单宁酶进行纯化,可纯化近20 倍。SDS-PAGE分析结果表明,黑曲霉N5-5单宁酶为单肽链蛋白,分子质量为64.2 k D。本研究所用的超滤与层析技术相结合的酶纯化方法,目前国内外鲜见报道,该方法纯化效果好,是一种非常有效的蛋白质纯化方法。此外,由于该方法可大大节约时间成本,且工艺简单、高效,因而适合纯酶制剂的工业化生产。
另外,获得纯酶后,对其酶促反应最适温度、最适pH值、热稳定性、酸碱稳定性及反应动力学等基本酶学性质进行了测定,从而更好的指导该单宁酶在水解反应中的应用。测定结果表明,酶促反应最适温度为45 ℃,最适pH值为5.0,在温度25~45 ℃范围内,以及pH 5.0~5.5范围内,黑曲霉N5-5单宁酶分别表现出良好的热稳定性和酸碱稳定性。另外,反应动力学测定结果表明,该酶对底物PG的K m为0.916 mmol/L,v max为0.877 mmol/(L·min)。
参考文献:
[1] AGUILAR C N, GUTIÉRREZ-SÁNCHEZ G. Review: sources, properties, application s an d poten tial uses of tan nin acyl hydrolase[J]. Food Science and Technology International, 2001, 7(5): 373-382. DOI:10.1106/69M3-B30K-CF7Q-RJ5G.
[2] VANIA B, GABRIELA A M. Tannase production by Paecilomyces v ariotii[J]. Bioresource Technology, 2007, 98(9): 1832-1837. DOI:10.1016/j.biortech.2006.06.031.
[3] 谢晓莉, 刘明, 邱树毅, 等. 黑曲霉B0201液体发酵产单宁酶最佳工艺条件研究[J]. 中国酿造, 2010, 29(8): 30-33. DOI:10.3969/ j.issn.0254-5071.2010.08.009.
[4] CHÁVEZ-GONZÁLEZ M, R ODRÍGUEZ-DURÁN L V, BALAGURUSAMY N, et al. Biotechnological advances and challenges of tannase: an overview[J]. Food and Bioprocess Technology, 2012, 5(2): 445-459. DOI:10.1007/s11947-011-0608-5.
[5] LEKHA P K, LONSANE B K. Production and application of tannin acyl hydrolase: state of the art[J]. Advances in Applied Microb io log y, 1 9 97, 44: 2 15-26 0. DOI:10.10 16/S 00 65-2164(08)70463-5.
[6] BATTESTIN V, MACEDO G A, de FREITAS V A P. Hydrolysis of epigallocatechin gallate using a tannase from P a ecilo m yces vario tii[J]. Food Chemistry, 2008, 108(1): 228-233. DOI:10.1016/ j.foodchem.2007.10.068.
[7] HONG Y H, JUNG E Y, SHIN K S, et al. Tannase-converted green tea catechins and their anti-wrinkle activity in humans[J]. Journal of Cosmetic Dermatology, 2013, 12(2): 137-143. DOI:10.1111/ jocd.12038.
[8] MESUT T. Co-production of tannase and pectinase by free and immobilized cells of the yeast Rhodotoru la g lutinis MP-10 isolated from tannin-rich persimmon (Diospyros kaki L.) fruits[J]. Bioprocess and Biosystems Engineering, 2013, 36(2): 165-172. DOI:10.1007/ s00449-012-0771-8.
[9] ZHANG S, GAO X Y, HE L P, et al. Novel trends for use of microbial tannases[J]. Preparative Biochemistry & Biotechnology, 2015, 45(3): 221-232. DOI:10.1080/10826068.2014.907182.
[10] YAO J, GUO G S, REN G H, et al. Production, characterization an d a p p licatio n s o f tan n ase[J]. Jo u rn al o f Mo lecu lar Catalysis B: Enzymatic, 2014, 101: 137-147. DOI:10.1016/ j.molcatb.2013.11.018.
[11] MANDAL S, GHOSH K. Optimization of tannase production and improvement of nutritional quality of two potential low-priced plant feedstuffs under solid state fermentation by P ich ia k u d ria vzev ii isolated from fi sh gut[J]. Food Biotechnology, 2013, 27(1): 86-103. DOI:10.1080/08905436.2012.755929.
[12] RIUL A J, GONCALVES H B, JORGE J A, et al. Characterization of a glucose- and solvent-tolerant extracellular tannase from Aspergillus pho enicis[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 85/86: 126-133. DOI:10.1016/j.molcatb.2012.09.001.
[13] SHARMA S, AGARWAL L, SAXENA R K. Purific ation, immobilization and characterization of tannase from Pe nic illium variable[J]. Bioresource Technology, 2008, 99(7): 2544-2551. DOI:10.1016/j.biortech.2007.04.035.
[14] ZHONG X F, PENG L S, ZHENG S L, et al. Secretion, purification, and characterization of a recombinant Aspergillus oryzae tannase in Pichia pa sto ris[J]. Protein Expression & Purification, 2004, 36(2): 165-169. DOI:10.1016/j.pep.2004.04.016.
[15] KALYANI M, KUMAR N R, SEKHER B S, et al. Purification, characterization and some studies on secondary structure of tannase from Aspergillus aw amori nakazawa[J]. Process Biochemistry, 2005, 40(10): 3251-3254. DOI:10.1016/j.procbio.2005.03.034.
[16] MAHENDRAN B, RAMAN N, KIM D J. Purification and characterization of tannase from Paecilomyces variotii: hydrolysis of tannic acid using immobilized tannase[J]. Applied Microbiology and Biotechnology, 2006, 70(4): 444-450. DOI:10.1007/s00253-005-0082-y.
[17] SHARMA K P, JOHN P J. Purifi cation and characterization of tannase and tannase gene from Enterobacter sp.[J]. Process Biochemistry, 2011, 46(1): 240-244. DOI:10.1016/j.procbio.2010.08.016.
[18] SHARMA S, BHAT T K, DAWRA R K. Isolation, purifi cation and properties of tannase from A sperg illus niger van Tieghem[J]. World Journal of Microbiology and Biotechnology, 1999, 15(6): 673-677. DOI:10.1023/A:1008939816281.
[19] BHARDWAJ R, SINGH B, BHAT T K. Purificatio n an d characterization of tannin acyl hydrolase from A spergillus n iger MTCC 2425[J]. Journal of Basic Microbiology, 2003, 43(6): 449-461. DOI:10.1002/jobm.200310273.
[20] FARIAS G M, GORBEA C, ELKINS J R, et al. Purification, characterization, and substrate relationships of the tannase from Cryph on ectria pa ra sitica[J]. Physiological and Molecular Plant Pathology, 1994, 44(1): 51-63. DOI:10.1016/S0885-5765(05)80094-3.
[21] 张帅, 刘飞, 朱华伟, 等. Plackett-Burman设计和响应面法优化单宁酶固体发酵培养基[J]. 广东农业科学, 2015, 42(12): 91-96. DOI:10.3969/j.issn.1004-874X.2015.12.019.
[22] 郝福英, 周先碗, 黄玉芝, 等. 生命科学实验技术[M]. 北京: 北京大学出版社, 2004: 3-7; 37.
[23] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1006/abio.1976.9999.
[24] LINEWEAVER H, BURK D. The determinatio n of enzyme dissociation constants[J]. Journal of the American Chemical Society, 1934, 56(3): 658-666. DOI:10.1021/ja01318a036.
[25] 喻晓蔚. 有机介质体系单宁酶生物合成棓酸酯键的研究[D]. 杭州:浙江大学, 2006: 108.
Purification and Enzymatic Properties of Tannase from Aspergillus niger N5-5
ZHANG Shuai
1,2, CAO Yong
2,*, LIANG Xiaoying
2, LIN Wanru
2
(1. College of Chemistry and Chemical Engineering, Zhaoqing University, Zhaoqing 526061, China; 2. College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:The crude tannase from Asperg illus n iger N5-5 was purified by hollow fiber membrane ultrafiltration and Sephadex G-150 gel chromatography. The properties of the purifi ed tannase were then determined. The results showed that the tannase from Aspergillus niger N5-5 could be purified about 20 folds with a 23.30% recovery. The enzyme was a 64.2 kD protein with a single peptide chain by sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis. The optimal temperature for the enzyme was 45 ℃, and it had good thermostability in the range of 25-45 ℃; the optimal pH value was 5.0, and the enzyme displayed good pH stability in the pH range of 5.0-5.5. In addition, the results of reaction kinetics showed that the K mand v maxvalues towards the substrate propyl gallate were 0.916 mmol/L and 0.877 mmol/(L·min), respectively.
Key words:tannase; Aspergillus niger; purifi cation; purified enzyme; characterization
DOI:10.7506/spkx1002-6630-201706022
中图分类号:TQ920.1
文献标志码:A
文章编号:1002-6630(2017)06-0142-05
引文格式:
张帅, 曹庸, 梁晓莹, 等. 黑曲霉N5-5单宁酶的纯化及酶学性质测定[J]. 食品科学, 2017, 38(6): 142-146. DOI:10.7506/ spkx1002-6630-201706022. http://www.spkx.net.cn
ZHANG Shuai, CAO Yong, LIANG Xiaoying, et al. Purifi cation and enzymatic properties of tannase from Aspergillus niger N5-5[J]. Food Science, 2017, 38(6): 142-146. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706022. http://www.spkx.net.cn
收稿日期:2016-05-10
基金项目:广东高校国际科技合作创新平台项目(2013gjhz0003)
作者简介:张帅(1978—),男,副教授,博士,主要从事食品化学研究。E-mail:Shuaizhang78525@hotmail.com
*通信作者:曹庸(1966—),男,教授,博士,主要从事食品化学研究。E-mail:caoyong2181@scau.edu.cn