宋连宝,赵 辉*
(黑龙江大学生命科学学院,农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150080)
摘 要:采用微包埋培养法结合流式细胞分选技术,对白酒窖泥中的细菌进行分离和筛选,分离到95 株细菌。经菌株生长实验从中筛选出8 株生长较缓慢的菌株LS4、LS27、LS32、LS37、LS64、LS66、LS69’、LS85,经气相色谱分析,LS66菌株产白酒香味物质较为丰富,确定其为出发菌株。对其进行形态学观察、生理生化和16S rDNA鉴定,该菌株可能为一株窖泥未培养功能菌株uncultured bacterium clone N8-7,对该菌株的培养条件进行初步研究,菌株生长的最适温度、最适pH值和最佳发酵接种量分别为35 ℃、pH 6.5和4%。
关键词:白酒;窖泥;细菌;微包埋;未培养
白酒以高粱等谷物为原料,酒曲为糖化发酵剂,经发酵、蒸馏、勾兑而成,是我国传统酿造饮品,为世界六大蒸馏酒之一 [1]。浓香型白酒以其独特的风味特征深受广大消费者喜爱 [2-4]。窖泥中微生物经过长期发酵,种群不断丰富,逐渐形成的以己酸菌、丁酸菌为主的窖泥微生态菌群体系,是浓香型白酒发酵的核心 [5-6]。有关窖泥微生物的分离大多集中在可培养层面上的研究 [7-13],很少有人对未培养功能菌进行研究。
Koch [14]首次介绍了纯培养技术,人们采用纯培养技术在自然界中获得了大量的微生物。基于分子生物学rRNA技术分析显示,自然界中大多数的微生物没有被培养出来 [15-1 6]。Stackebrandt等 [1 7]提出了“未培养微生物”的概念。分子生物学和宏基因组学明显地增加了我们对基因多样性的了解和一些有意义的假设 [18-19]。Button等 [20]提出了稀释培养法,即将传统培养基进行适当的稀释培养,实验证明此方法可以培养出许多新菌。戴欣等 [21]采用稀释培养法,从太湖中分离到3 株新菌种。Aoi等 [22]采用中空纤维膜室作为一种原位培养装置,放入模拟微生物生存的自然环境中进行培养,分离到的微生物数量远远高于传统培养法。Nichols等 [23]设计了一种高通量微生物分离芯片方法,通过这种方法,从土壤和海水中分离到大量新菌种。微生物包埋培养法是一门通过微生物包埋技术与流式细胞仪检测技术相结合的培养分离技术,其方法为将样品中的微生物先进行浓缩与琼脂糖混合制成微球,然后将微球放入层析柱中,连续通入低浓度的有机物培养液对包埋微球进行流动培养,结合流式细胞仪进行检测,将长有单菌落的微球通过流式细胞仪分选到加有丰富培养基的96 孔板中继续培养,最终获得纯培养微生物 [24]。Zengler等 [25]通过微生物包埋培养法结合流式细胞仪分选技术,从海水中分离到的150 株细菌,其中超过半数以上的菌株是此前未被培养的且基因组文库中没有存储。
本研究选取黑龙江省富裕老窖酒业有限公司的优质老窖泥为样品。通过微生物包埋模拟窖泥生境培养并结合流式细胞分选技术,对白酒窖泥中的细菌进行培养分离,经菌株生长实验和气相色谱分析从中筛选出一株生长较缓慢的功能菌株LS66,经形态学观察、生理生化和分子生物学鉴定,并对该菌株的培养条件进行初步研究。
1.1 材料与试剂
1.1.1 材料与菌株
窖泥取自黑龙江省富裕老窖酒业有限公司。
梭状芽孢杆菌(Bacillus fu siformis)C78 [28],由黑龙江大学生物工程专业实验室通过传统方法分离得到的高产己酸菌;酵母菌(Saccharomyces cerevisiae)267#,本实验室保藏的菌株。
1.1.2 试剂
Prob es Molecu ler活/死菌荧光染料试剂盒、低熔点琼脂糖、耐热DNA聚合酶、细菌基因组DNA试剂盒、2.5 mmol/L的d NTP混合液、10×聚合酶链式反应(polymerase chain reaction,PCR)Buffer、6×loading Buffer、EX Taq聚合酶(酶活力为5 U/μL) 、Mg Cl 2、DNA Marker DL2000、DNA Marker DL20000 生工生物工程(上海)股份有限公司;己酸、丁酸、乙酸乙酯、己酸乙酯、乳酸乙酯和乙酸正丁酯(均为色谱纯)天津市精细化工研究所。
1.1.3 培养基
模拟窖泥微生物生境培养基 [2 6]:窖泥浸出液,pH 7.0~7.2,121 ℃灭菌20 min。
加富培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g,加蒸馏水至1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
发酵培养基:葡萄糖60 g、蛋白胨10 g、KH 2PO 41.5 g、Mg SO 40.5 g、Na Cl 5 g、(NH 4) 2SO 41 g、CaCl 20.2 g,加蒸馏水至1 000 mL,pH 7.0,115 ℃灭菌20 min。
种子培养基 [2 7]:Na Ac 1 g、酵母膏0.1 g、(NH 4) 2SO 40.05 g、K 2HPO 40.04 g、MgSO 40.02 g、酒糟水30 g、黄浆水2 g、CaCO 30.5 g(需预先灭菌,接种前加入),加蒸馏水至100 mL,0.12 MPa灭菌30 min。接种前加入2 mL的乙醇。
1.2 仪器与设备
FACSCalibur流式细胞仪 美国BD公司;OS40-S电动搅拌器 大龙兴创实验仪器有限公司;UV755B紫外分光光度计 上海精密科学仪器有限公司;GS-15R高速冷冻离心机 上海兆茗电子科技有限公司;TProfessional Thermocycler PCR仪 德国Biometra公司;GC-2010气相色谱仪 日本岛津公司。
1.3 方法
1.3.1 样品采集与处理
用五点法采集窖泥,4 ℃冰箱保存;通过离心和滤膜过滤的方法收集窖泥中菌体,用灭菌的生理盐水使菌液终浓度为1.0×10 9CFU/mL,将制备的菌悬液放入40 ℃恒温水浴锅中待用。
1.3.2 微球的制备及包埋率的测定
配制含10 8CFU/mL的菌液与3 g/100 mL的琼脂糖混合液作为水相,40 ℃水浴备用;配制含体积分数1%的司盘8 0的石蜡油作为油相。取20 m L油相添加到离心管中,逐滴加入1 mL水相,37 ℃条件下1 800 r/min搅拌5 m in。转速不变,4 ℃冰浴冷却2 m in,然后90 0 r/min搅拌8 min。将离心管取下,3 0 0 0×g离心5 min,弃上清液,加入无菌水反复离心直至不含油滴为止 [29]。对微球的粒径及粒径分布进行测定 [30-31],按以下公式计算窖泥微生物包埋率 [32]。
1.3.3 模拟窖泥生境培养
将包埋好的微球放入灭菌的层析柱中,层析柱进口处为0.45 μm滤膜,出口处为8 μm滤膜,从进口处通入流动的无菌模拟窖泥微生物生境培养基,用蠕动泵控制流速为0.3 mL/h,注意流速不要太快,防止压强过大将装置破坏。30 ℃条件下培养3 周,定期更换模拟窖泥微生物生境培养基。
1.3.4 流式细胞仪分选和加富培养
用活菌荧光染料试剂盒将培养后的微球进行染色,同时,以包埋后没有经过培养的微球作对照。采用流式细胞仪以点对点的方式进行分选,将包有菌的微球分选到含加富培养基的9 6 孔细胞培养板中,每孔分选4 个微球,其中8 孔不分选微球作为对照组,37 ℃条件下培养2 周。
1.3.5 菌种纯化及保藏
将96 孔细胞培养板中明显变浑浊小孔的菌液进行分离纯化,纯化后菌株于4 ℃条件下斜面保藏。
1.3.6 出发菌株LS66的筛选
在原生境中的种群间存在着拮抗、寄生、协同、共生、群体效应和共代谢等复杂关系,传统培养时,这种平衡关系被破坏,平板上生长快的微生物会对生长慢的微生物起到种群抑制,或者产生超氧化物,超氧化物和自由基等物质对生长慢的微生物细胞进行破坏(而这种作用能被生境中产生的物质消除),从而表现出不可培养的特点 [33-34]。通过微生物包埋结合流式细胞仪分离到的微生物纯化后进行纯培养,生长缓慢的微生物摆脱了快速生长微生物的抑制,延长培养时间可能得到传统培养分离方法所得不到的微生物。
将实验组(包埋培养法分离的菌株)和对照组菌(梭状芽孢杆菌C78)分别接种在牛肉膏蛋白胨培养基中,每株菌接3 瓶,同时放在37 ℃恒温培养箱中培养,每隔12 h取样测定菌液OD 600 nm值和菌体干质量,记录24 h内的测定结果,筛选出生长速率较慢的菌株。
将生长慢的菌株按2%接种量接种到发酵培养基中,并按5%接种量接种酿酒酵母267#,同时对照组分别按2%和5%接种量接种梭状芽孢杆菌C78和酿酒酵母267#,37 ℃条件下静止培养。测定每天培养基中糖的消耗量,发酵结束后,将发酵液蒸馏,利用气相色谱分析发酵液中己酸、丁酸和己酸乙酯等的含量,选择发酵液中己酸、丁酸和己酸乙酯的含量较高的菌株作为白酒窖泥微包埋培养功能菌株。
1.3.7 气相色谱法检测发酵液中微量成分
色谱条件:PEG20 M(聚乙二醇)毛细管色谱柱(0.53 mm×30 m),内标为乙酸正丁酯,氢火焰离子检测器,进样器、检测器温度均为250 ℃,载气流速(N 2)1.0 mL/min,进样量0.1 μL。程序升温:初始温度40 ℃,保持5 min;10 ℃/min升至200 ℃,保持10 min。
配制酒中含有的主要酸、酯的单一标准样品与混合标准样品,均以乙酸正丁酯作为内标物,充分混匀后以0.1 μL的进样量进样,并且测出各物质的保留时间,根据出峰时间进行物质的定性。
1.3.8 白酒窖泥未培养功能菌株形态学观察和生理生化鉴定
根据《伯杰氏细菌鉴定手册》,对筛选出的白酒窖泥未培养功能菌株进行形态学描述和生理生化鉴定。
1.3.9 白酒窖泥未培养功能菌株16S rDNA鉴定
1.3.9.1 细菌基因组DNA的提取
按照细菌基因组DNA提取试剂盒说明书的步骤提取细菌LS6 6基因组DNA。通用引物为正向引物P1(5’-AGAGTTTGATCCTGGCTCAG-3’)和反向引物P2(5’-ACGGCTACCTTGTTACGACTT-3’)。
1.3.9.2 PCR扩增体系和程序
PCR体系(20 μL):Deionized H 2O 12 μL,10×PCR Bu ffer 2 μL,2.5 mo l/L Mg Cl 21.2 μL,25 mmol/L d NTPs 1.6 μL,Primer P1 1 μL,Primer P2 1 μL,模板DNA 1 μL,Taq DNA polymerase(5 U/μL)0.2 μL。PCR程序:94 ℃预变性10 min;94 ℃变性30 s,52 ℃退火1 min,72 ℃延伸1.5 min,进行32 个循环;最后72 ℃终延伸8 min。反应结束后保藏于4 ℃冰箱中。
1.3.9.3 目的片段与载体连接
通过连接试剂盒将回收产物连接至p MD1 9-T载体上,转化至DH5α感受态细胞,保存重组阳性克隆。
1.3.9.4 16S rDNA片段的测序与系统发育分析
将PCR产物送至生工生物工程(上海)股份有限公司进行测序。将测序结果与GenBank数据库进行BLAST比对分析,用MEGA5.1软件构建菌株系统发育树。
1.3.10 LS66生长曲线的绘制
按5%的接种量将菌株LS66接种到种子培养基中,37 ℃条件下培养,每隔2 h取样,采用稀释涂布法测定菌体浓度,绘制生长曲线。
1.3.11 LS66菌株可培养条件探索
以菌体浓度为考察依据,考察接种量、温度、初始pH值对菌株LS66生长的影响。
2.1 琼脂糖微球的制备及包埋率
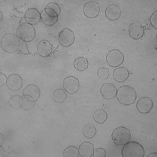
图1 琼脂糖微球图(×40)
Fig. 1 Agarose microspheres (× 40)
由图1可知,搅拌乳化法制备的琼脂糖微球粒径均一性较好,球形完整,微球分散性好无黏连,透明度较高。
微球粒径分布情况如图2所示,其平均粒径为178.52 μm,跨度为0.43(<1),说明微球呈单分散,此时制备的微球包埋率为36.7%。
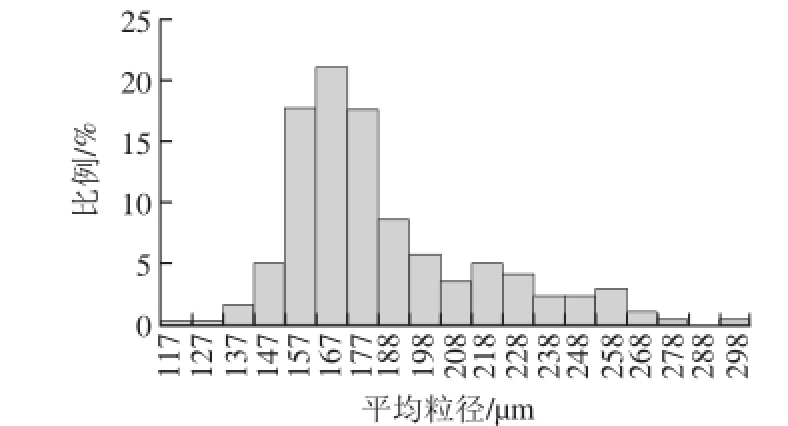
图2 琼脂糖微球粒径分布
Fig. 2 Size distribution of the agarose microspheres
2.2 模拟窖泥生境培养和流式细胞仪分选
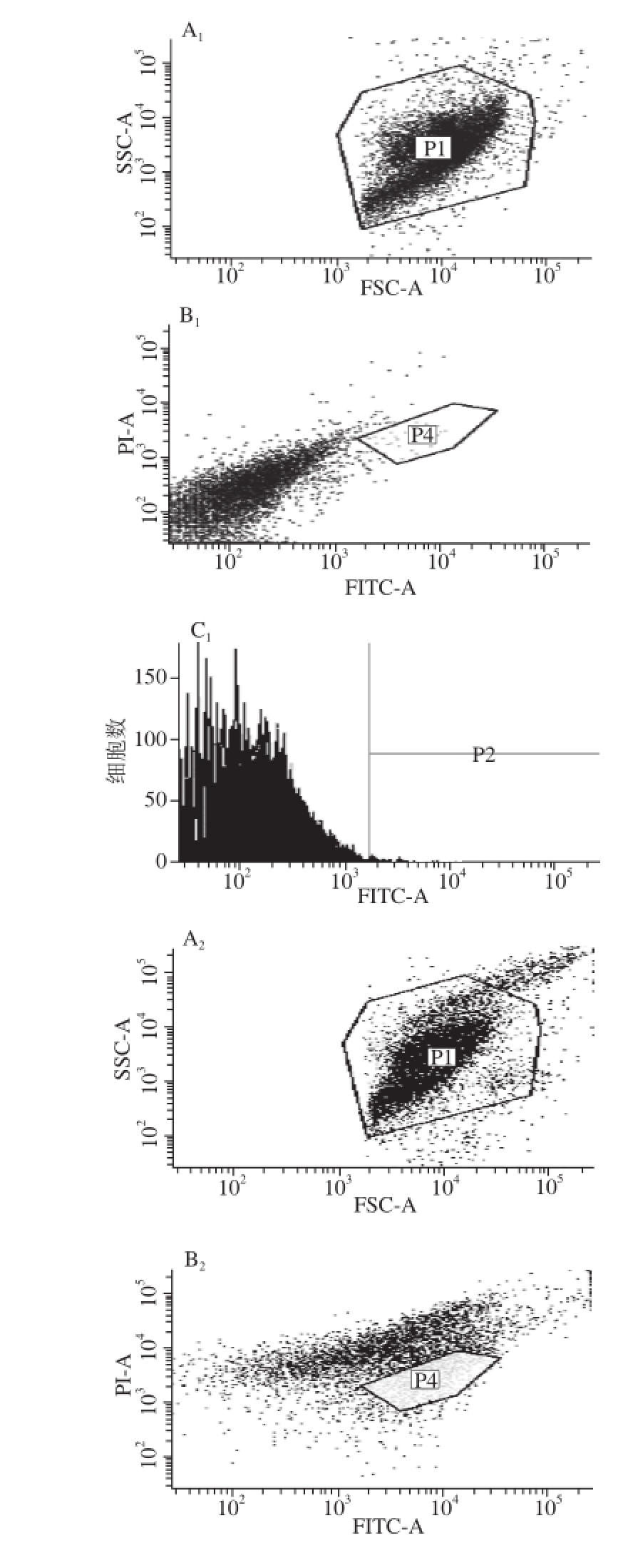
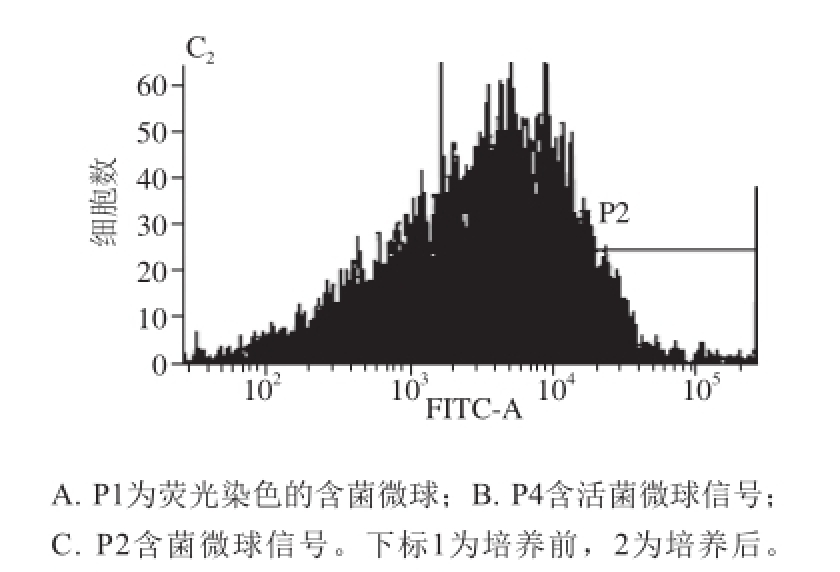
图3 微球培养前后流式细胞信号图
Fig. 3 Flow cytometry analysis before and after culture of microspheres
通过模拟窖泥环境进行培养,经流式细胞仪分选,通过比较分析培养前后流式细胞信号的差别可以确定分选信号位置,流式细胞分选仪信号如图3所示,图A 1与A 2中P1为分选的总信号;图B 1与B 2中P4为微球中包有菌的信号;图C 1与C 2为微球中包有菌的信号数目,通过图B 1与图B 2可以看出P4为流式分选信号,培养后P4的信号强度明显大于培养前P4的信号强度,将培养后含有P4信号的微球分选到含有加富培养基的96 孔板中,经加富培养分离到95 株菌。
2.3 加富培养、分离纯化及保藏

图4 96 孔板进行加富培养
Fig. 4 Enrichment culture on 96-well plates
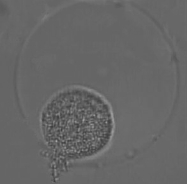
图5 菌落撑破微球(×40)
Fig. 5 Colonies bursting the microspheres (× 40)
如图4所示,经过培养3 周后,96 孔板有2/3左右的小孔由于菌落撑破微球使菌液变浑浊,继续培养发现分选微球的小孔不变浑浊,可能这些菌株处于休眠状态,菌落撑破微球(图5)。经分离纯化得到95 株菌,将其接种到试管斜面于4 ℃条件下保藏。
2.4 出发菌株LS66的筛选
表1 窖泥微包埋培养菌株筛选结果
Table 1 Screening of microencapsulated strains from Chinese liquor pit mud
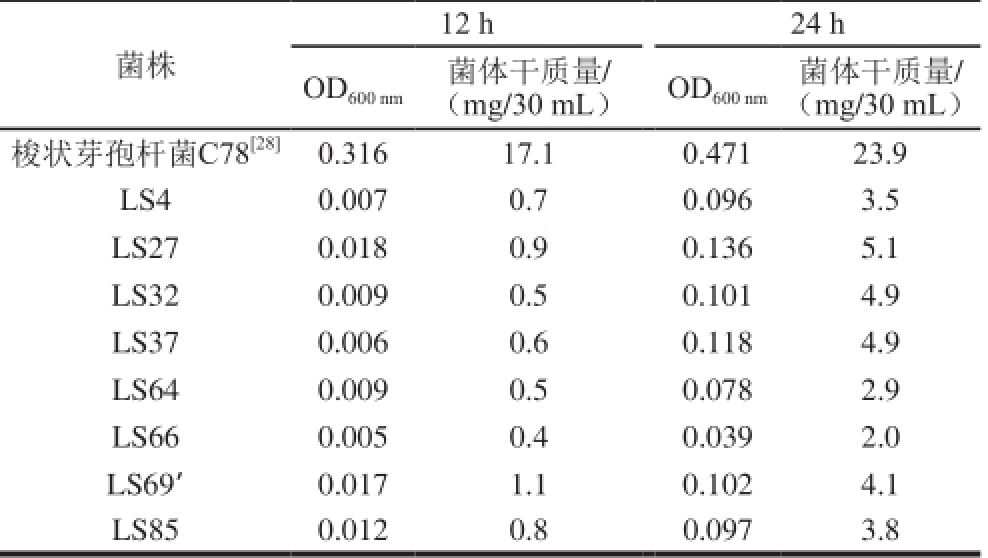
12 h 24 h菌株OD菌体干质量/OD菌体干质量/ 600 nm(mg/30 mL) 600 nm(mg/30 mL)梭状芽孢杆菌C78 [28]0.316 17.1 0.471 23.9 LS4 0.007 0.7 0.096 3.5 LS27 0.018 0.9 0.136 5.1 LS32 0.009 0.5 0.101 4.9 LS37 0.006 0.6 0.118 4.9 LS64 0.009 0.5 0.078 2.9 LS66 0.005 0.4 0.039 2.0 LS69’0.017 1.1 0.102 4.1 LS85 0.012 0.8 0.097 3.8
菌株筛选结果如表1所示,在12 h时,对照组的OD值和菌体干质量明显大于实验组,并且对照组发酵液出现明显的浑浊,而实验组发酵液没有明显的变化;在24 h时,对照组发酵液出现了大量的菌体沉淀,而实验组发酵液稍微变浑浊,但还没有菌体沉淀产生,间接地反映实验组菌体生长速率比对照组菌体的明显要慢。因此,这8 株菌很可能是未培养微生物,在此基础上进一步进行功能菌株的筛选。
表2 菌株发酵液微量成分
Table 2 Microamounts of aroma constituents detected in the fermentation broths of the isolated strains mg/100 mL
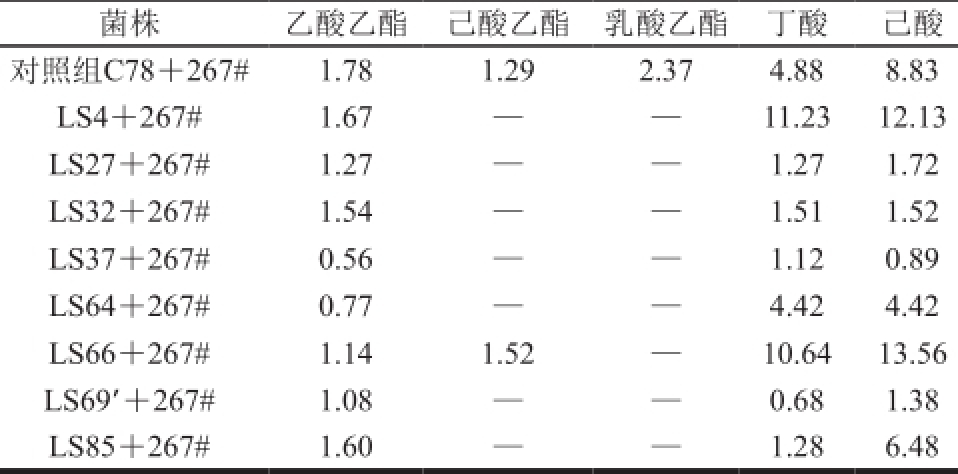
注:—.未检测出。
菌株乙酸乙酯己酸乙酯乳酸乙酯丁酸己酸对照组C78+267#1.78 1.29 2.37 4.88 8.83 LS4+267#1.67——11.23 12.13 LS27+267#1.27——1.27 1.72 LS32+267#1.54——1.51 1.52 LS37+267#0.56——1.12 0.89 LS64+267#0.77——4.42 4.42 LS66+267#1.14 1.52—10.64 13.56 LS69’+267#1.08——0.68 1.38 LS85+267#1.60——1.28 6.48
从表2可以看出,LS66产己酸、丁酸和己酸乙酯量要高,而这几种物质是浓香型白酒重要的香味物质,对提高白酒质量具有重要作用,因此选择LS66为本实验的研究菌株。
2.5 菌株LS66的鉴定
2.5.1 菌株LS66形态学和生理生化鉴定
LS66的菌落特征为圆形、透明、湿润、微隆起、边缘完整,并且LS66为革兰氏染色阳性、无芽孢和短杆的菌株。
表3 LS66菌株生理生化鉴定结果
Table 3 Physiological and biochemical identification of LS66
注:1.淀粉水解实验;2.明胶液化实验;3. H 2S产生实验;4. MR实验;5. V.P实验;6.柠檬酸盐利用实验;7.硝酸盐还原实验;8.过氧化酶实验;9.精氨酸脱羧基酶实验;10.产氨实验;+.反应结果阳性;-.反应结果阴性。
菌株1 2 3 4 5 6 7 8 9 10 LS66++---++++-
表4 LS66株菌糖醇类发酵产酸产气结果
Table 4 Acid and gas producing abilities of LS66
注:+.产酸不产气;-.既不产酸也不产气。
菌株葡萄蔗糖D-(+)-乳糖海藻D-海糊精D-(+)-D-阿淀粉D-甘D-山D-果D-棉D-核木糖醇果糖纤维糖麦芽糖糖藻糖木糖拉伯糖露糖梨醇糖籽糖糖二糖LS66+--------++---+---
未培养功能菌株生理生化特征如表3、4所示。根据形态学观察、显微镜观察和生理生化鉴定结果可初步鉴定LS66菌株为革兰氏阳性短杆菌属。
2.5.2 菌株LS66分子鉴定及系统发育树的构建

图6 PCR扩增产物电泳图
Fig. 6 Electrophoresis of PCR amplifi ed products from LS66
以菌株LS66基因组DNA为模板,以1.3.8.1节所设计的引物进行PCR扩增,其PCR扩增产物电泳结果如图6所示,可知在1 000~2 000 bp处有明亮的条带,说明LS66 16S rDNA序列长度约为1 500 bp。
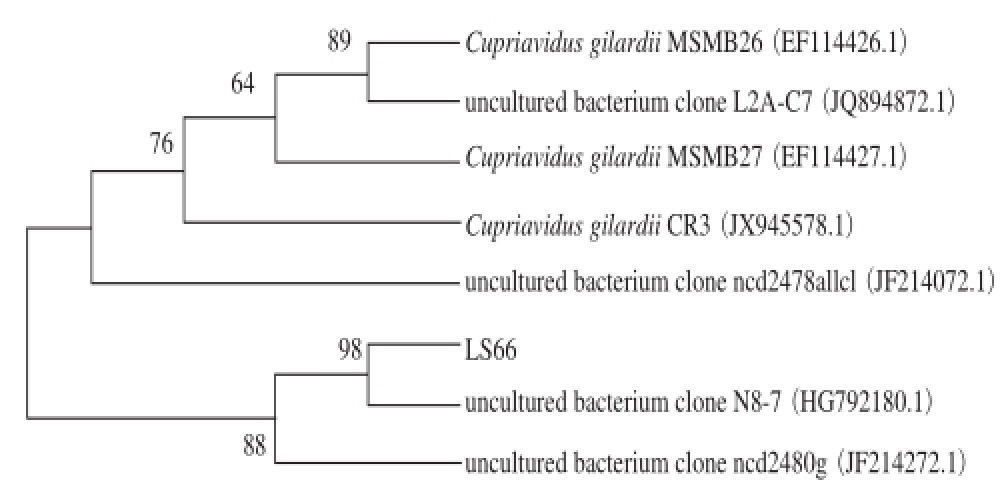
图7 LS66的16S rDNA的系统发育树
Fig. 7 Phylogenetic tree based on the 16S rDNA gene sequence of LS66
测序结果提交到NCBI中Gen Bank数据库,通过与已知序列进行相似性比对分析,相似性最高菌株为un cultured bacterium clon e N8-7,相似性为98%,并用MEGA5.1软件对LS6 6株菌进行构建发育树,结果如图7所示,结合形态学观察以及生理生化结果可知,菌株LS66疑似为一株未培养菌株uncultured bacterium clone N8-7。
2.6 菌株LS66生长曲线的绘制
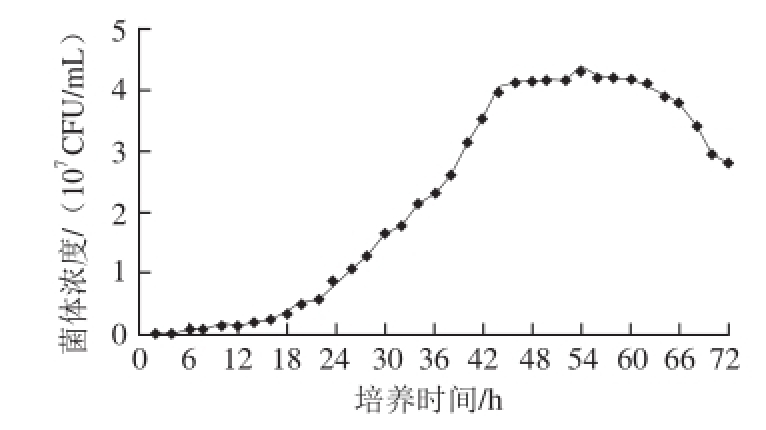
图8 LS66菌株的生长曲线
Fig. 8 Growth curve of LS66
由图8可知,LS 6 6菌株在培养0~1 8 h时处于滞缓期,1 8~48 h处于对数期,4 8~6 0 h处于稳定期,60~72 h处于衰亡期。
2.7 菌株LS66的可培养条件探索结果
2.7.1 最佳接种量的测定

图9 接种量对菌体浓度的影响
Fig. 9 Effect of inoculum amount of bacterial growth
取对数生长期的菌体,分别以1%、2%、3%、4%和5%的接种量分别接入培养基中,其他组分不变,37 ℃条件下培养48 h,采用稀释涂布法测定菌体浓度,结果如图9所示,在接种量4%时,菌体浓度达到最大,且随着接种量的增加,菌体达到的最大浓度基本不变,因此选择4%为最适接种量。
2.7.2 最佳温度的测定

图10 温度对菌体生长的影响
Fig. 10 Influence of temperature on bacterial growth
以4%的接种量,培养48 h,其他条件不变,采用稀释涂布法测定31~39 ℃范围内培养基菌体浓度,结果如图10所示,LS66菌株的最佳培养温度为35 ℃。
2.7.3 最佳初始pH值的测定
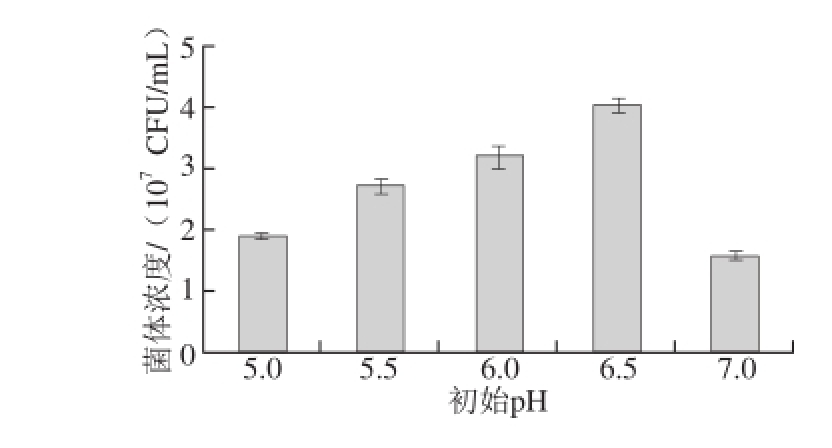
图11 初始pH值对菌体浓度的影响
Fig. 11 Influence of initial pH on bacterial growth
培养基的其他组分不变,只调节培养基的初始pH值为5.0、5.5、6.0、6.5、7.0,以5%接种量,35 ℃条件下培养48 h,采用稀释涂布法测定菌体浓度,结果如图11所示,菌体生长的最适pH值为6.5。
通过微包埋培养法结合流式细胞分选技术,对白酒窖泥中的细菌进行分离和筛选,经菌株生长实验和气相色谱分析,从中筛选出一株未培养功能菌株LS66,对其进行形态学观察、生理生化和16S rDNA鉴定,确定菌株LS66疑似为一株未培养菌株uncultured bacterium clone N8-7,对该菌株的培养条件进行初步研究,菌体生长的最适温度、最适pH值和最佳发酵接种量分别为35 ℃、6.5和4%。
微包埋培养法较适合传统培养法难于分离的特殊环境中微生物的分离,如海洋、土壤、白酒窖泥等样品中微生物的分离培养。通过微生物包埋模拟微生物生境培养结合流式分选技术,能够提高微生物的可培养性和分离效率,有望分离到新菌种,为白酒的生香及提高白酒的优级品率提供理论基础。
参考文献:
[1] 赖登, 东林. 世界著名六大蒸馏酒工艺特点、香味特征的研究[J]. 酿酒, 2007, 34(3): 106-110. DOI:10.3969/j.issn.1002-8110.2007.03.044.
[2] 杨军. 历届全国评酒会对白酒工业发展的指导作用[J]. 酿酒科技, 2006(6): 109-102. DOI:10.13746/j.njkj.2006.06.045.
[3] 王葳, 姜凤春, 赵彤, 等. 主要香型白酒生产工艺发展[J]. 酿酒科技, 2014(3): 88-89. DOI:10.3969/j.issn.1001-9286.2014.03.026.
[4] 刘子红, 李学思. 论北方地区浓香型白酒生产工艺特点[J]. 酿酒, 2013, 40(5): 63-68. DOI:10.3969/j.issn.1002-8110.2013.05.019.
[5] 施思, 王海英, 张文学, 等. 浓香型白酒不同-窖泥的微生物群落特征分析[J]. 酿酒科技, 2011(5): 38-41. DOI:10.7506/spkx1002-6630-201511034.
[6] 王海燕, 张晓君, 徐岩, 等. 浓香型和芝麻香型白酒酒醅中微生物菌群的研究[J]. 酿酒科技, 2008(2): 86-89. DOI:10.13746/ j.njkj.2008.02.020.
[7] 李东, 黄明. 浓香型白酒窖泥中放线菌对酒质的影响[J]. 酿酒科技, 2015(5): 73-74. DOI:10.13746/j.njkj.2015150.
[8] 林芬, 谢和, 姚玉萍, 等. 高产纤溶酶菌株的筛选及鉴定[J]. 贵州农业科学, 2010, 38(6): 101-103. DOI:10.3969/j.issn.1001-3601.2010.06.031.
[9] 马晓梅, 赵辉. 淀粉酶产生菌MSP13筛选及其产酶条件初步优化[J].食品科学, 2015, 36(11): 117-181. DOI:10.7506/spkx1002-6630-201511034.
[10] 万朕, 李莉, 郑裴, 等. 一株产丁酸菌的分离、纯化及产酸研究[J].酿酒, 2011, 38(1): 26-29. DOI:10.3969/j.issn.1002-8110.2011.01.010.
[11] 王晓丹, 李付丽, 胥思霞, 等. 一株产酯化酶菌株的分离鉴定及产酶[J].酿酒, 2014, 41(5): 42-47. DOI:10.3969/j.issn.1002-8110.2014.05.012.
[12] 徐军, 谭崇尧. 枝江老窖泥中己酸菌的分离纯化及培养条件的研究[J].酿酒科技, 2010(5): 42-43.
[13] 张劲, 刘超兰, 吴正云, 等. 基于荧光定量PCR技术的浓香型白酒窖泥中甲烷菌的检测[J]. 酿酒科技, 2014(7): 99-101. DOI:10.13746/ j.njkj.2014.0105.
[14] KOCH R. Zur Untersuchung von pathogenen organismen[D]. Berlin: Mitteilungen aus dem Kaiserlichen, 1881: 1-49.
[15] STEELE H L, JAEGER K E, DANIEL R, et al. Advances in recovery of novel biocatalysts from metagenomes[J]. Molecular Microbiology & Biotechnology, 2009, 16(1/2): 25-37. DOI:10.1159/000142892.
[16] UFART L, BOZONNET S, LAVILLE E, et al. Func tio na l metagenomics: construction an d high-throughpu t screening of fosmid libraries for discovery of novel carbohydrate-active enzymes[J]. Methods in Molecular Biology, 2016, 1399: 257-271. DOI:10.1007/978-1-4939-3369-3_15.
[17] STACKEBRANDT E, EMBLEY T M. Diversity of uncultured microorganisms in the environment[M]. Washington D. C.: ASM Press, 2000: 57-75. DOI:10.1007/978-1-4757-0271-2_5.
[18] HANDELSMAN J. Metagenomics: application of genomics to uncultured microorganisms[J]. Microbiology & Molecular Biology Reviews, 2012, 68(4): 669-685. DOI:10.1128/MMBR.68.4.669-685.2004.
[19] RIESENFELD C S, SCHLOSS P D, HANDELSMAN J. Metagenomics: genomic analysis of microbial communities[J]. Annual Review of Genetics, 2004, 38: 525-552. DOI:10.1146/annurev. genet.38.072902.091216.
[20] BUTTON D K, SCHUT F, QUANG P, et al. Viability and isolation of marine bacteria by dilution culture: theory, procedures, and initial results[J]. Applied & Environmental Microbiology, 1993, 59(3): 881-891.
[21] 戴欣, 王保军, 黄燕, 等. 普通和稀释培养基研究太湖沉积物可培养细菌的多样性[J]. 微生物学报, 2005, 45(2): 161-165. DOI:10.3321/ j.issn:0001-6209.2005.02.001.
[22] AOI Y, KINOSHITA T, HATA T, et al. Hollow-fiber membrane chamber as a device for in situ environmental cultivation[J]. Applied and Environmental Microbiology, 2009, 75(11): 3826-3833. DOI:10.1128/AEM.02542-08.
[23] NICHOLS D, CAHOON N, TRAKHTENBERG E M, et al. Use of ichip for high-throughput in situ cultivation of “uncultivable”microbial species[J]. Applied and Environmental Microbiology, 2010, 76(8): 2445-2450. DOI:10.1128/AEM.01754-09.
[24] ALAIN K, QUERELLOU J. Cultivating the uncultured: limits, advances and future challenges[J]. Extremophiles, 2009, 13(4): 583-594. DOI:10.1007/s00792-009-0261-3.
[25] ZENGLER K, TOLEDO G, RAPPÉ M, et al. Cultivating the uncultured[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(24): 15681-15686. DOI:10.1073/ pnas.252630999.
[26] 乔宗伟, 张文学, 张丽莺, 等. 浓香型白酒糟醅微生物分离培养基的选择研究[J]. 酿酒科技, 2004(6): 30-32. DOI:10.3969/ j.issn.1001-9286.2004.06.005.
[27] 姚万春, 唐玉明, 任道群. 浓香型白酒窖泥关键功能菌的优化培养[J].酿酒, 2010, 37(6): 18-21. DOI:10.3969/j.issn.1002-8110.2010.06.009.
[28] 赵辉, 敞颜, 王葳, 等. 浓香型白酒窖泥中高产己酸兼性厌氧细菌的分离鉴定[J]. 食品科学, 2012, 33(5): 177-182.
[29] 冀世奇. 海洋微生物高通量培养和分选技术的建立及应用[D]. 青岛: 中国海洋大学, 2011: 47-52. DOI:10.7666/d.y1928425.
[30] 杜丽娜, 王辰允, 梅兴国. 用SPSS软件计算微球平均粒径及粒径分布范围[J]. 数理医药学杂志, 2005, 18(2): 159-163. DOI:10.3969/ j.issn.1004-4337.2005.02.031.
[31] 刁瑞玉. 海洋微生物微包埋技术的建立: 单分散海藻酸钠微球的制备及其应用研究[D]. 青岛: 中国海洋大学, 2011: 9-16. DOI:10.7666/ d.y1927001.
[32] 熊涛, 冯超, 谢明勇. 植物乳杆菌NCU116微胶囊制备工艺的优化设计[J]. 食品科学, 2012, 33(1): 152-156.
[33] 曾建民, 曾振顺, 原红娟, 等. 难培养微生物培养方法的研究进展[J]. 生物技术进展, 2012, 2(3): 1 65-170. DOI:10.3969/ j.issn.2095-2341.2012.03.02.
[34] 牛丽纯, 孙玉芳, 赵天琦, 等. 未培养微生物的限制因素及培养方法研究进展[J]. 微生物前沿, 2014(3): 17-28. DOI:10.12677/ amb.2014.32003.
Screening of a Functional Bacterial Strain from Chinese Liquor Pit Mud by Microencapsulation Culture Method
SONG Lianbao, ZHAO Hui*
(Agricultural Microbiology Engineering Research Center, Ministry of Education, College of Life Science, Heilongjiang University, Harbin 150080, China)
Abstract:A total of 95 bacterial strains were isolated from Chinese liquor pit mud by the microencapsulation culture method through cell sorting using flow cytometry. Out of these isolates, the strains LS4, LS27, LS32, LS37, LS64, LS66, LS69’ and LS85 were selected for slow growth rates. Gas chromatography analysis demonstrated that LS66 was determined as the best one for the production of an abundance of aroma compounds in Chinese liquor. By morphological observation, physiological and biochemical tests and 16S rDNA sequence analysis, it was tentatively identified as an uncultured functional bacterium, termed N8-7. The optimal culture temperature, pH and inoculums size for this strain were determined to be 35 ℃, 6.5 and 4%, respectively.
Key words:liquor; pit mud; bacteria; microencapsulation; uncultured
DOI:10.7506/spkx1002-6630-201706024
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2017)06-0153-07
引文格式:
宋连宝, 赵辉. 包埋培养法筛选白酒窖泥中一株功能细菌[J]. 食品科学, 2017, 38(6): 153-159. DOI:10.7506/spkx1002-6630-201706024. http://www.spkx.net.cn
SONG Lianbao, ZHAO Hui. Screening of a functional bacterial strain from Chinese liquor pit mud by microencapsulation culture method[J]. Food Science, 2017, 38(6): 153-159. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706024. http://www.spkx.net.cn
收稿日期:2016-04-24
基金项目:黑龙江省博士后科研启动基金项目(LBH-Q13139)
作者简介:宋连宝(1988—),男,硕士研究生,研究方向为发酵工程。E-mail:363890264@qq.com
*通信作者:赵辉(1971—),男,教授,博士,研究方向为发酵工程。E-mail:zhaohui9463@sohu.com