冯 鑫 1,夏 宇 1,陈贵堂 2,胥佳佳 1,廖小军 3,赵立艳 1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.中国药科大学工学院,江苏 南京 210009;3.中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:以生姜皮为原料,经热水浸提法,乙醇醇沉得到生姜皮粗多糖。再经DEAE-纤维素-52阴离子交换柱和Sephadex G-100凝胶柱对所得粗多糖进行层析纯化,得到3 种水溶性生姜皮多糖(GE-1、GE-2、GE-3)。利用高效液相色谱与蒸发光散射检测器联用测定各多糖组分的分子质量,利用柱前衍生高效液相色谱法分析各多糖组分的单糖组成,通过紫外光谱扫描、红外光谱扫描进一步分析各组分多糖结构。结果表明3 种纯化多糖组分总糖含量分别为(98.06±0.15)%、(97.41±0.42)%、(97.89±0.22)%,分子质量分别为462、194 kD和376 kD。GE-1的单糖组成主要为甘露糖、葡萄糖、木糖,含有微量的半乳糖,其物质的量比为1.25∶6∶1;GE-2的单糖组成主要为甘露糖、葡萄糖和岩藻糖,其物质的量比为2.51∶9.25∶1;GE-3的单糖组成主要为甘露糖、核糖、半乳糖、阿拉伯糖,其物质的量比为17.39∶1∶1.89∶1.23。紫外光谱扫描结果显示3 种多糖组分无明显的核酸和蛋白质吸收峰,红外光谱结果分析得出GE-1、GE-2和GE-3含有多糖类物质的特征吸收峰。
关键词:生姜皮多糖;分离纯化;分子质量;单糖组成
生姜为姜科植物姜(Z in giber officinale Rosc.)的鲜根茎。生姜味辛、性温,有发汗解暑、温中止呕、化痰止咳的功效,是我国传统的中医药材和常用的香辛料 [1]。生姜在我国中部、东南部至西南部各省区广为栽培,在亚洲热带地区也是常见的栽培植物 [2]。作为我国常用的香辛料,目前对于生姜的研究主要集中在姜油树脂、姜辣素、姜酚等方面 [3-4]。姜味调味品与姜汁饮料是目前广受欢迎的2 种生姜产品,但在生产加工过程中,生姜皮成为副产物,极大地造成了生姜资源的浪费。多糖是生物体内一种重要的大分子,具有多种生物活性 [5-6]。其中生姜多糖具有抗溃疡、抗炎、抑菌、抗氧化、抗衰老、抗肿瘤、降血脂等 [7-13]作用,国内外学者对生姜多糖的分离纯化、结构与活性也进行了大量研究 [14-18]。但对生姜副产物中,生姜皮多糖的研究鲜见报道。
本实验利用生姜产品生产过程中所产生的副产物生姜皮为原料,提取生姜皮粗多糖,再经DEAE-纤维素-52阴离子交换柱和Sephadex G-100凝胶柱层析纯化,得到3种水溶性生姜皮多糖(GE-1、GE-2、GE-3),并研究了其分子质量、单糖组成等结构特性。为我国合理利用生姜副产物,实现其价值提供了理论依据。
1.1 材料与试剂
新鲜生姜购于南京市众彩农贸市场。
DEAE-纤维素-5 2 北京索莱宝科技有限公司;SephadexG-100 美国Pharmacia公司;普鲁兰多糖标品上海甄准生物科技有限公司;单糖标准品、溴化钾(光谱纯)、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、三氟乙酸(trifluoroacetic acid,TFA) 美国Sigma-Aldrich公司;苯酚、硫酸等其余试剂均为国产分析纯。
1.2 仪器与设备
DELTA-320 pH计 梅特勒-托利多仪器有限公司;层析柱(2.6 cm×30 cm) 上海煊盛生物科技有限公司;HL-2B恒流泵 上海青浦沪西仪器有限公司;Model 680酶标仪 美国Bio-Tek公司;1100高效液相色谱 美国Ag ilen t公司;ESD3 3 0 0蒸发光散射检测器 美国Alltech公司;高效液相层析柱 日本东曹株式会社;TENSOR27傅里叶变换红外光谱仪器 瑞士Bruker公司;UV-2450紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 生姜皮粗多糖的提取
新鲜生姜皮干燥至恒质量,粉碎,过80 目筛,得生姜皮粉。按料液比1∶10(g/mL)加体积分数85%乙醇溶液去除色素,得到生姜皮预处理粉。取预处理粉1 g,按液料比30∶1(mL/g)、提取时间2 h、提取温度70 ℃进行热水浸提。浸提液离心(5 000×g,15 min),取上清液,抽滤,过0.45 μm膜,将滤液旋蒸发至原来体积的1/3。多糖溶液与Sevag试剂以体积比4∶1混合,磁力搅拌器搅拌30 min,离心(5 000×g,15 min),重复上述步骤3 次,合并上清液。再加入4 倍体积无水乙醇,4 ℃条件下沉淀12 h,离心(5 000×g,15 min)取沉淀。冷冻干燥为生姜皮粗多糖。按下式计算粗多糖得率:
1.3.2 生姜皮粗多糖的分离纯化
1.3.2.1 DEAE-纤维素-52阴离子交换柱分离生姜皮粗多糖
称取100 mg生姜皮粗多糖,溶于20 mL去离子水中,用一次性塑料滴管将多糖溶液贴壁缓慢加样于DEAE-纤维素-52阴离子交换柱(2.6 cm×3 0 cm),同时打开柱下端出口使水缓慢流出。用去离子水,0.1、0.3、0.5 mol/L NaCl溶液依次洗脱(流速为1 mL/min,每管收集10 mL),利用苯酚-硫酸法追踪各管中多糖含量,以收集的管数为横坐标,于波长490 nm处测得的每管吸光度作为纵坐标,绘制洗脱曲线,根据峰值分段收集样品,合并收集液,透析48 h去盐,冻干后得各组分,记为G-1、G-2、G-3。
1.3.2.2 Sephadex G-100凝胶层析柱分离纯化生姜皮多糖
G-1、G-2、G-3组分分别配制成5 mg/m L的溶液10 mL,沿柱壁缓慢加入凝胶柱。经去离子水洗脱(流速为0.25 mL/min,每管收集10 mL),用苯酚-硫酸法追踪各管中的多糖含量,以收集的管数为横坐标、吸光度(490 nm)为纵坐标绘制洗脱曲线,根据吸收峰分段收集样品,旋蒸到适量体积,冷冻干燥得到生姜皮多糖的最终分离纯化产物,记为GE-1、GE-2、GE-3。
1.3.3 总糖含量的测定
总糖含量的测定参考王红萍等 [17]报道的硫酸-苯酚法并适当修改。绘制葡萄糖标准曲线并得到标准曲线的回归方程,y=0.012 1 x+0.048 4(R 2=0.999 2),其中,x为葡萄糖含量,y为波长490 nm处溶液吸光度。
取生姜皮粗多糖,用去离子水配制成100 μg/mL的多糖溶液。取多糖溶液0.5 mL,加入去离子水1.5 mL,再缓慢加入质量分数6%苯酚溶液1 mL、浓硫酸5 mL,充分小心混匀,静置冷却30 min后于波长490 nm处测定吸光度。根据葡萄糖标准曲线和吸光度计算得到各多糖组分中总糖含量。
1.3.4 生姜皮多糖的纯度鉴定及分子质量测定
1.3.4.1 高效液相色谱条件
参考伍乐芹等 [19]报道的方法,并适当修改。色谱条件:色谱柱TSK-gel G4000PWxl(300 mm×7.8 mm),蒸发光散射检测器雾化温度为58 ℃,压力为3.05 bar,检测灵敏度为7,流动相为重蒸水,柱温为35 ℃,流速为0.7 mL/min。
1.3.4.2 标准曲线的绘制
选择普鲁兰多糖(分子质量依次为19 626、43 714、101 237、202 898、371 868、745 558 D)作为标准品。将多糖标准品用流动相配制成质量浓度2.0 mg/mL溶液,经0.45 μm的滤膜过滤后通过高效液相色谱仪进行分析,以标准多糖样品分子质量的对数值(lg M w)为纵坐标、以样品出峰的保留时间为横坐标,绘制标准曲线。
1.3.4.3 样品的测定
称取生姜皮多糖纯化组分GE-1、GE-2、GE-3各10 mg,用流动相配制成2.0 mg/mL溶液,过0.45 μm的微孔滤膜,记录多糖样品在高效液相色谱分析后的出峰保留时间,通过保留时间与该色谱柱的标准普鲁兰标准品分子质量回归曲线的比较,计算得到各多糖组分的平均分子质量。
1.3.5 生姜皮多糖的单糖组成分析
1.3.5.1 混合单糖标品衍生化
采用PMP柱前衍生高效液相色谱法,具体参考刑丽红等 [20]报道的方法,并加以修改。准确移取50 μL混合单糖标准溶液与50 μL 0.6 mol/L NaOH溶液,混合摇匀。在100 μL的混合溶液中加入100 μL 0.5 mol/L的PMP-甲醇溶液,混合均匀,于70 ℃恒温鼓风干燥箱中反应2 h。反应液冷却后,加入100 μL 0.3 mol/L盐酸溶液中和并蒸干。加水和氯仿各1.5 mL,混合摇匀,静置分层后弃去氯仿层,重复操作萃取3 次。0.45 μm滤膜过滤后进行高效液相色谱分析。
1.3.5.2 高效液相色谱条件
色谱条件:Ph en o men ex C 18色谱柱(4.6 mm× 2 5 0 mm,5 μm);流动相0.1 mo l/L的磷酸缓冲液(pH 6.7)、缓冲液-乙腈(83∶17,V/V);示差折光检测器条件:柱温和检测器温度为25 ℃,流速为1 mL/min,进样体积为20 μL。
1.3.5.3 样品衍生化测定
用去离子水将纯化后的多糖各组分配制成2 mg/mL的多糖溶液,进行PMP柱前衍生化实验,0.45 μm滤膜过滤后进行高效液相色谱分析。
1.3.6 生姜皮多糖的紫外光谱分析
紫外光谱法能够鉴定多糖样品中是否还含有蛋白或核酸类杂质 [21]。称取5 mg样品溶解于10 mL去离子水,配成0.5 mg/mL的多糖溶液,紫外-可见分光光度计进行扫描,扫描波长为200~400 nm,检测是否有核酸和蛋白质的特征吸收峰。波长260 nm处的吸收峰是核酸吸收峰,波长280 nm处的吸收峰是蛋白质的特征吸收峰。
1.3.7 生姜皮多糖的红外光谱分析
多糖样品的红外光谱研究参考Jeddou等 [22]报道的KBr压片法,并适当修改。称取100~200 mg KBr粉末在恒温鼓风干燥箱中烘干,除去KBr中的水分,用压片机压成薄片。称取分离纯化得到的GE-1、GE-2、GE-3样品各1.5 mg,与100~150 mg的KBr粉末在玛瑙研钵中充分研磨均匀,再称取150 mg的光谱纯KBr作背景对照傅里叶变换红外光谱仪进行扫描。扫描次数32 次,扫描范围4 000~400 cm -1,分辨率2 cm -1。
2.1 生姜皮粗多糖的分离纯化
2.1.1 DEAE-纤维素-52层析柱分离纯化结果
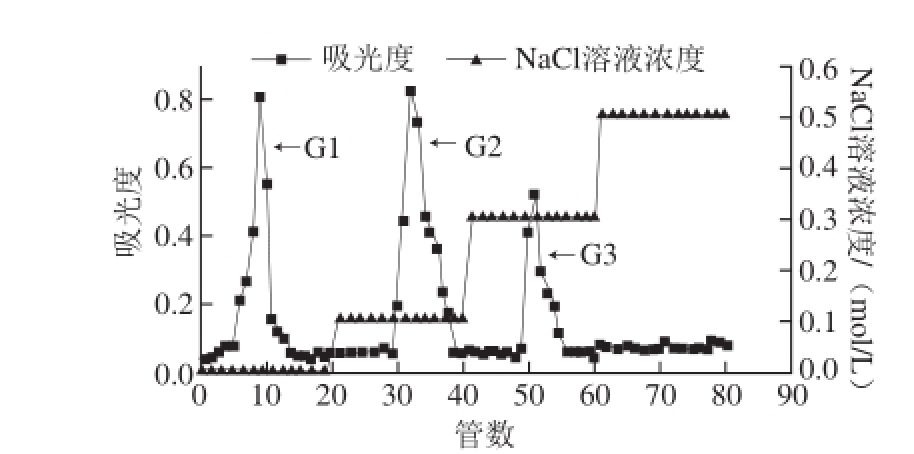
图1 生姜皮粗多糖经DEAE-纤维素-52凝胶层析柱分离的洗脱曲线
Fig. 1 Elution curve of ginger peel polysaccharides on DEAE-cellulose 52 column
如图1所示,经DEAE-纤维素-52层析柱分离出3 个组分,分别为去离子水洗脱出的G-1组分,0.1 mol/L NaCl溶液洗脱出的G-2组分和0.3 mol/L NaCl溶液洗脱出的G-3组分。其中,由去离子水洗脱得到的G-1组分为不带电荷的中性多糖,由NaCl溶液洗脱得到的G-2和G-3组分。按图1所示出峰管号,将各个组分合并收集,45 ℃旋转蒸发浓缩,去离子水透析48 h,当加入体积分数1%硝酸银溶液,检测去离子水不出现白色沉淀时,停止透析,冻干透析液,得到G-1、G-2和G-3三种生姜皮多糖组分,用于进一步的Sephadex G-100凝胶层析柱纯化。
2.1.2 Sephadex G-100凝胶层析柱分离纯化结果
如图2所示,G-1、G-2、G-3组分分别经Sephadex G-100凝胶层析柱分离纯化后得到了4 种组分,其中第2种组分多糖含量最少,占总糖含量的5.1%,因此将继续深入研究多糖含量较高的3 种组分。对这3 种生姜皮多糖组分的收集液分别进行浓缩、冻干,得到生姜皮多糖样品GE-1、GE-2和GE-3。
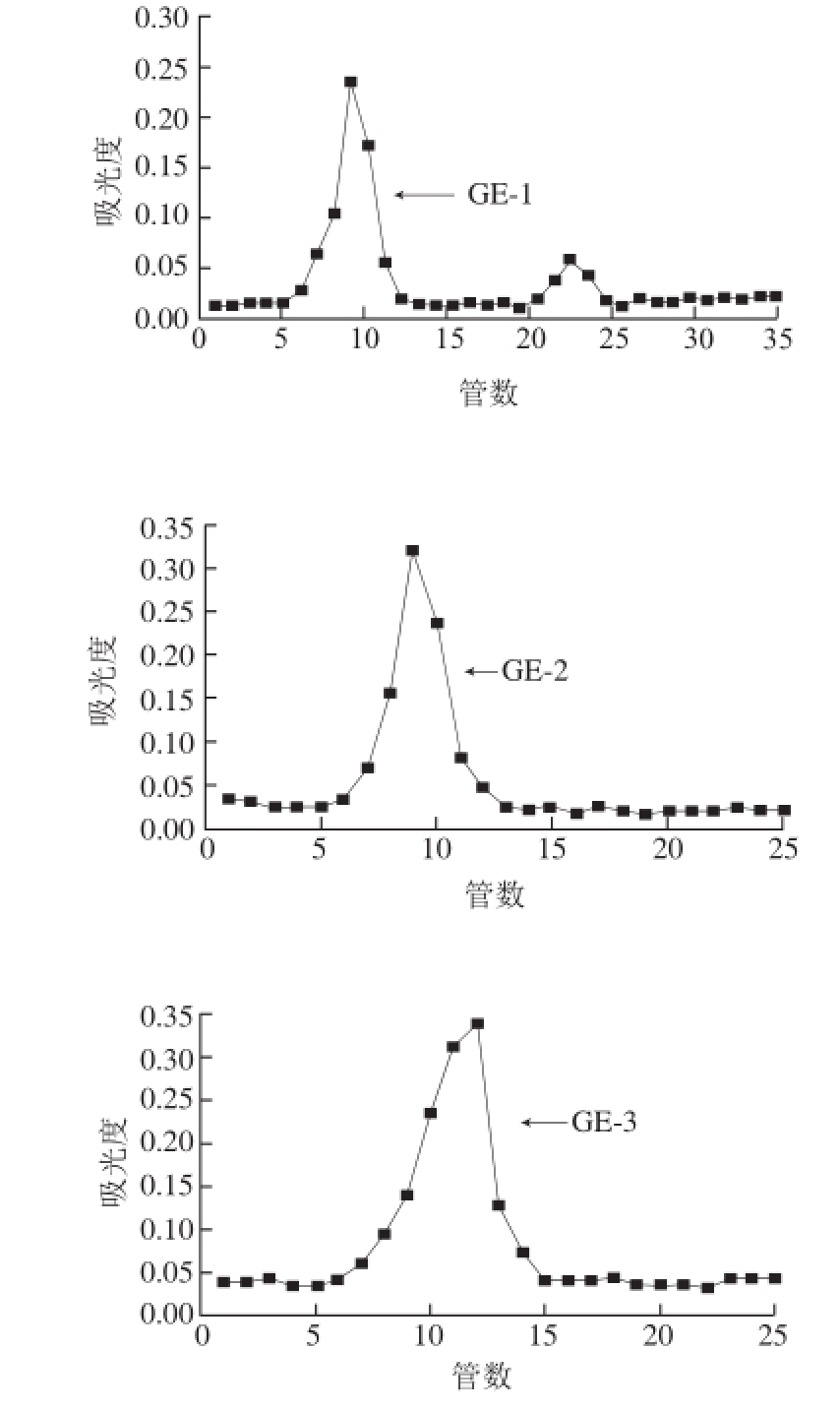
图2 生姜皮多糖的Sephadex G-100凝胶层析柱洗脱曲线
Fig. 2 Elution curve of ginger peel polysaccharide on Sephadex G-100 column
2.2 生姜皮多糖总糖含量的测定
表1 生姜皮粗多糖得率及纯化组分的总糖含量
Table 1 Total sugar contents of crude and purified ginger peel polysaccharide %

样品得率 总糖含量粗多糖1.92±0.85 43.16±0.71 GE-1 5.02±0.63 98.06±0.15 GE-2 10.77±0.33 97.41±0.42 GE-3 6.63±0.62 97.89±0.22
如表1所示,生姜粗多糖总糖含量为43.16%,GE-1、GE-2、GE-3的总糖含量分别为(98.06±0.15)%、(97.41±0.42)%和(97.89±0.22)%,各组分中总糖含量较高,可知纯化有效果。
2.3 生姜皮多糖的纯度鉴定及分子质量
2.3.1 生姜皮多糖纯度鉴定
如图3所示,3 种多糖组分的洗脱峰峰形较狭窄,且单一对称,表明纯化的生姜皮多糖GE-1、GE-2和GE-3是分子质量分布均一的纯度较高的多糖组分。
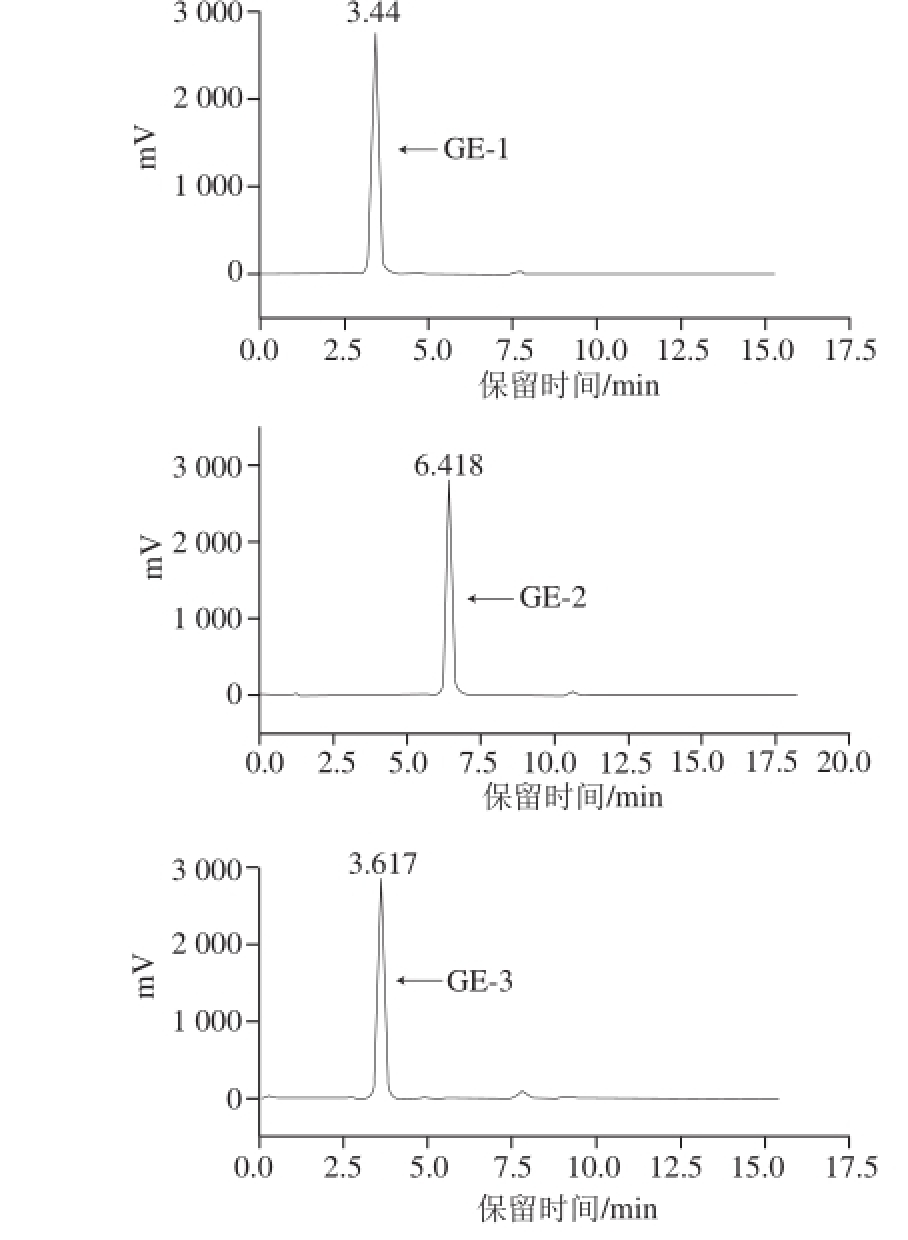
图3 生姜皮多糖的高效液相色谱图
Fig. 3 HPLC profiles of purified ginger peel polysaccharides
2.3.2 生姜皮多糖的分子质量
高效液相色谱与蒸发光散射检测器联用法测定的普鲁兰多糖分子质量的标准曲线回归方程:y=-0.507 4x+ 7.41(R 2=0.992 1),计算得出GE-1、GE-2和GE-3三种多糖组分的分子质量分别为462、194 kD和376 kD。
2.4 生姜皮多糖的单糖组成
2.4.1 混合单糖标准品PMP衍生化结果
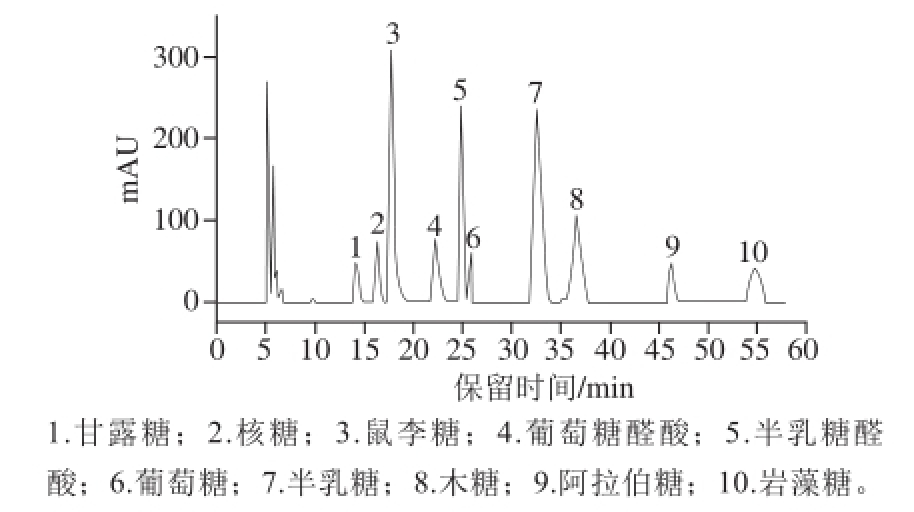
图4 混合单糖标准品的高效液相色谱图
Fig. 4 HPLC chromatogram of mixed monosaccharide standards
如图4所示,10 种标准单糖的峰形匀称,且各峰之间的间隔较为明显,各个标准单糖在高效液相色谱中能够较好的分离,标准单糖与图中色谱峰保留时间的对应关系如下:甘露糖14.106 min,核糖16.389 min,鼠李糖17.788 min,葡萄糖醛酸22.296 min,半乳糖醛酸24.892 min,葡萄糖25.821 min,半乳糖32.584 min,木糖36.615 min,阿拉伯糖46.559 min,岩藻糖54.760 min。
2.4.2 生姜皮多糖的单糖组成

图5 生姜皮多糖PMP衍生物的高效液相色谱图
Fig. 5 HPLC chromatograms of derivatives of ginger peel polysaccharides
表2 生姜皮多糖的单糖组成
Table 2 Monosaccharide compositions of ginger peel polysaccharides
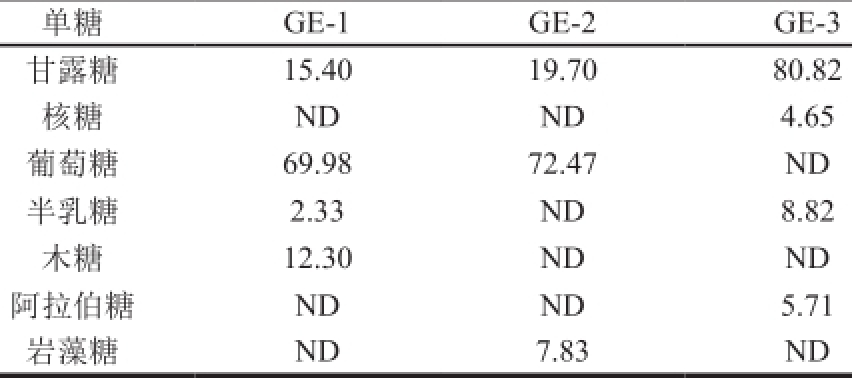
注:ND.未检出。
单糖GE-1 GE-2 GE-3甘露糖15.40 19.70 80.82核糖ND ND 4.65葡萄糖69.98 72.47 ND半乳糖2.33 ND 8.82木糖12.30 ND ND阿拉伯糖ND ND 5.71岩藻糖ND 7.83 ND
如图5所示,根据单糖标准品的保留时间分析得出,GE-1主要由甘露糖、葡萄糖、半乳糖、木糖组成,GE-2主要由甘露糖、葡萄糖、岩藻糖组成,GE-3主要由甘露糖、核糖、半乳糖、阿拉伯糖组成。如表2所示,GE-1主要是由甘露糖、葡萄糖、木糖以1.25∶6∶1的物质的量比例组成,含有微量的半乳糖。GE-2的生姜皮多糖由甘露糖、葡萄糖和岩藻糖以2.51∶9.2 5∶1的物质的量比例组成。GE-3由甘露糖、核糖、半乳糖、阿拉伯糖以17.39∶1∶1.89∶1.23的物质的量比例组成。
2.5 生姜皮多糖的紫外光谱分析
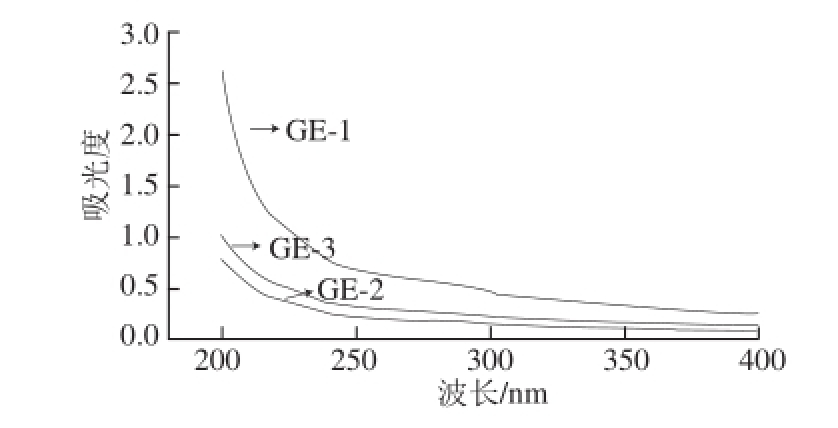
图6 生姜皮多糖紫外光谱图
Fig. 6 UV spectra of ginger peel polysaccharides
如图6所示,3 种多糖样品溶液在波长2 60 n m和280 nm处均无明显吸收峰,说明其中不含蛋白质、核酸等杂质。这是因为Sevag试剂法对蛋白的清除率较高,并且表明DEAE-纤维素-52阴离子交换柱和Sephadex G-100凝胶柱对于生姜皮多糖不仅能起到良好的分级纯化作用,并且也能有效的去除色素以及残余蛋白。
2.6 生姜皮多糖的红外光谱分析
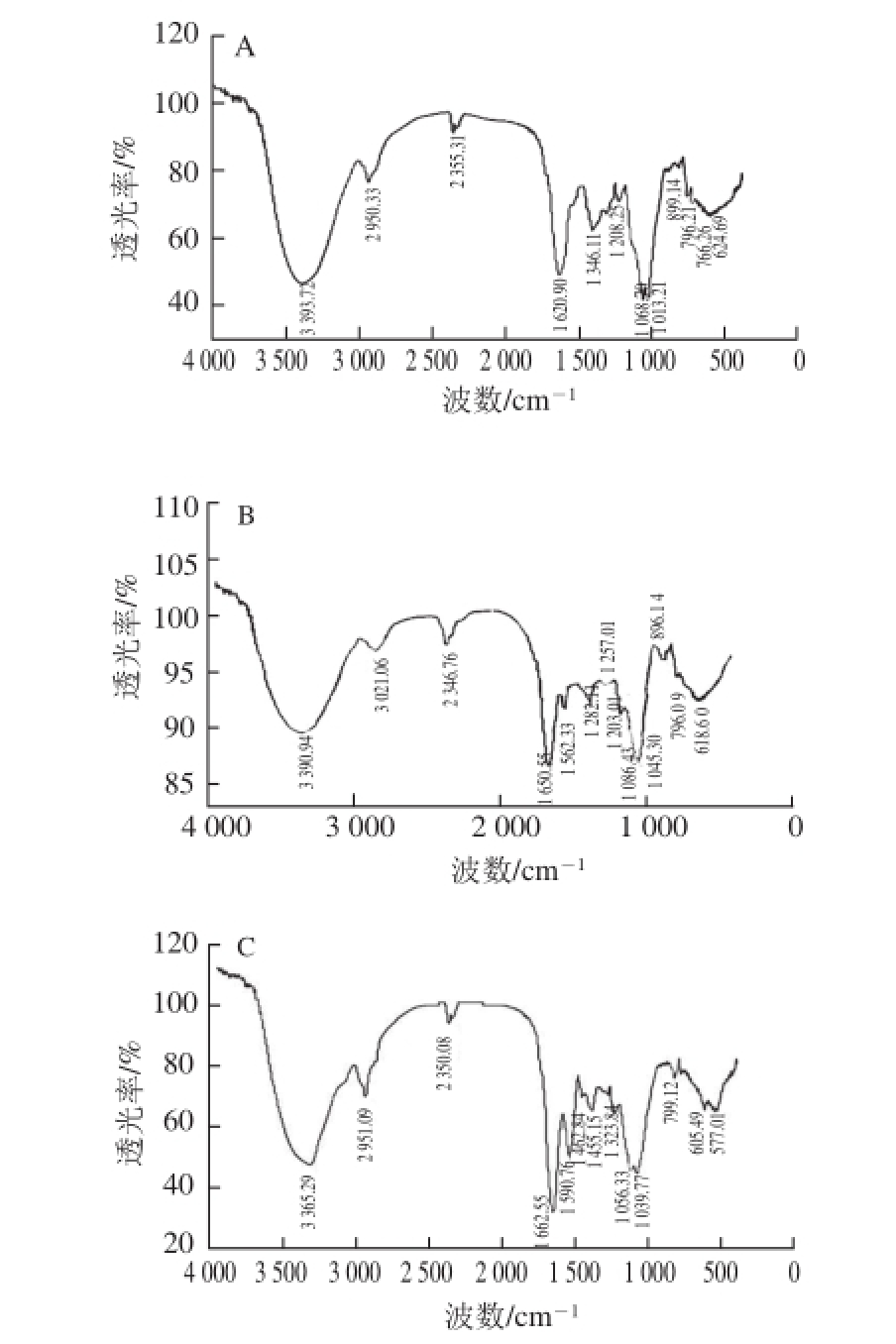
图7 生姜皮多糖的红外光谱图
Fig. 7 FT-IR spectra of ginger peel polysaccharides
如图7所示,3 种生姜多糖组分分别在3 3 93.72、3 390.94 cm -1和3 365.29 cm -1处产生的较宽的吸收峰是由于分子内和分子间的O—H伸缩振动而引起的 [23];分别在2 950.33、3 021.06 cm -1和2 951.09 cm -1处出现的特征吸收峰是甲基、亚甲基的C—H伸缩振动的吸收峰 [24];在2 360~2 340 cm -1产生的吸收峰是C—H和C≡N基团的特征峰 [25];在1 620.90、1 650.55 cm -1和1 662.55 cm -1处的吸收峰是由O—H的弯曲振动引起,表明有羰基的存在 [26];GE-1在1 346.11 cm -1处,GE-2在1 282.11、1 257.01 cm -1和1 203.01 cm -1处,以及GE-3在1 462.84、1 455.15 cm -1和1 323.84 cm -1处存在C—H的变角振动 [27];根据研究报道,呋喃糖在1 100~1 010 cm -1中间会有2 个的强吸收峰,吡喃糖在1 100~1 010 cm -1中间会出现3 个较强吸收峰。多糖在1 100~1 010 cm -1均出现了2 个吸收峰,显示多糖组分均含有呋喃糖环 [28-29];在1 000 cm -1以下区域称作指纹区,796 cm -1处吸收峰表明含有甘露糖。899 cm -1是β-型糖苷键C—H的变角振动吸收峰,在该处有吸收峰,说明组分是以β-型糖苷键链接。在766 cm -1处的吸收峰是α-D-木吡喃糖的特征吸收峰 [30]。
生姜皮粗多糖经DEAE-纤维素-52阴离子交换柱层析分离和Sephadex G-100凝胶柱层析纯化,得到3 种水溶性生姜皮多糖(GE-1、GE-2、GE-3)。通过分子质量和单糖组成分析得出,3 种组分分子质量分布较单一,GE-1、GE-2主要是由葡萄糖组成的杂多糖;GE-3是主要由甘露糖组成的杂多糖。紫外光谱扫描结果显示3 种多糖组分不含核酸和蛋白质,红外光谱结果分析得出GE-1、GE-2和GE-3含有多糖类物质的特征吸收峰,3 种多糖为呋喃糖。
研究生姜皮多糖的结构特征,为下一步研究生姜皮多糖的生物活性以及活性作用的机理提供了理论依据。从生姜皮中提取生姜皮多糖从能源和环境的角度降低了生姜皮对环境的污染,并提高了生姜的产业价值,具有极其重要的研究意义。
参考文献:
[1] 王啸. 生姜活性部位与成分研究进展[J]. 中医研究, 2009, 22(12): 53-55. DOI:10.3969/j.issn.1001-6910.2009.12.031.
[2] 胡炜彦, 张荣平, 唐丽萍, 等. 生姜化学和药理研究进展[J]. 中国民族民间医药, 2008, 17(9): 10-14. DOI:10.3969/j.issn.1007-8517.2008.09.004.
[3] 王忠宾, 辛国凤, 宋小艺, 等. 不同时期生姜加工品质及姜油树脂成分分析[J]. 食品科学, 2013, 34(6): 6-9. DOI:10.7506/spkx1002-6630-201306002.
[4] 王永丽, 李锋, 乔维维, 等. 姜辣素对培根风干成熟过程中微生物及生物胺形成的抑制效应[J]. 食品科学, 2015, 36(3): 29-34. DOI:10.7506/spkx1002-6630-201503006.
[5] CUI C, LU J, SUN-WATERHOUSE D, et al. Polysaccharides from L aminaria japonica: structural characteristics and antioxidant activity[J]. LWT-Food Science and Technology, 2016, 73(11): 602-608. DOI:10.1016/j.lwt.2016.07.005.
[6] 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2 0 1 0, 1 0(2): 1-1 1. DOI:1 0.3 9 6 9/ j.issn.1009-7848.2010.02.001.
[7] FUNK J L, FRYE J B, OYARZO J N, et al. Anti-inflammatory effects of the essential oils of ginger (Zingib er offi cinale Roscoe.) in experimental rheumatoid arthritis[J]. Pharmanutrition, 2016, 4(3): 123-131. DOI:10.1016/j.phanu.2016.02.004.
[8] WU S, FU X, YOU L, et al. Antio xid an t, antitu mor an d immunomodulatory activities of water-soluble polysaccharides in A b ru s c a n to n ie n sis[J]. International Jou rnal of Biological Macromolecules, 2016, 89(8): 707-716. DOI:707-716.10.1016/ j.ijbiomac.2016.04.005.
[9] PARK S H, KYEONG M S, HWANG Y, et al. Inhibition of LPS binding to MD-2 co-receptor for suppressing TLR4-mediated expression of inflammatory cytokine by 1-dehydro-10-gingerdione from dietary ginger[J]. Biochemical and Biophysical Research Communications, 2012, 419(4): 735-740. DOI:10.1016/j.bbrc. 2012.02.091.
[10] 宋琳琳, 沙靖全, 张磊, 等. 生姜粗多糖的提取及对脑缺血再灌注损伤大鼠的保护作用[J]. 辽宁中医杂志, 2015(12): 2433-2435.
[11] 夏树林, 吴庆松. 生姜多糖的提取及其抗疲劳作用[J]. 江苏农业科学, 2014, 42(4): 240-241. DOI:10.3969/j.issn.1002-1302.2014.04.090.
[12] 樊琛, 曾庆华, 赵娜娜, 等. 生姜抗自由基能力的检测[J]. 食品研究与开发, 2014, 35(24): 24-28. DOI:10.3969/j.issn.1005-6521.2014.24.007.
[13] 方伟斐, 孔梦晓, 王晓梅, 等. 生姜多糖理化性质及体外活性的检测[J]. 中国调味品, 2011, 36(9): 94-96. DOI:10.3969/ j.issn.1000-9973.2011.09.025.
[14] ZHANG Z, KONG F, NI H, et al. Structural characterization, α-glucosidase inhibitory and DPPH· scavenging activities of polysaccharides from guava[J]. Carbohydrate Polymers, 2016, 144(25): 106-114. DOI:10.1016/j.carbpol.2016.02.030.
[15] ZOU Y, CHEN X, MALTERUD K E, et al. Structural features and co mp lement fixin g activity o f p oly sacch arides fro m C o d o no p sis p ilo sula Nannf. var. m o de sta L. T. Shen roots[J]. Carbohydrate Polymers, 2014, 113(26): 420-429. DOI:10.1016/ j.carbpol.2014.07.036.
[16] WANG L, YAO Y, SANG W, et al. Structural feature s a nd immunostimu lating effects of three acidic poly saccharides isolated from P an ax q uinq uefo liu s[J]. International Journal of Biological Macromolecules, 2015, 80(9): 77-86. DOI:10.1016/ j.ijbiomac.2015.06.007.
[17] 王红萍, 郭庆森. 文山生姜叶多糖纯化工艺研究[J]. 文山学院学报, 2015, 28(6): 49-52. DOI:10.3969/j.issn.1674-9200.2015.06.013.
[18] ZHANG Z, WANG X, ZHANG J, et al. Potential antioxidant activities in vitro of polysaccharides extracted from ginger (Zingiber officinale)[J]. Carbohydrate Polymers, 2011, 86(2): 448-452. DOI:10.1016/j.carbpol. 2011.04.062.
[19] 伍乐芹, 张静, 孙润广, 等. 白术多糖的分离纯化与结构表征[J]. 高等学校化学学报, 2011, 32(12): 2812-2816.
[20] 邢丽红, 祝纯静, 孙伟红, 等. 柱前衍生-高效液相色谱法测定岩藻多糖的单糖及糖醛酸含量[J]. 中国渔业质量与标准, 2011, 1(1): 64-69.
[21] MOKNI G A, SILA A, MAKLOUF G I, et al. Structural, functional, and ACE inhibitory properties of water-soluble polysaccharides from chickpea fl ours[J]. International Journal of Biological Macromolecules, 2015, 75(4): 276-282. DOI:10.1016/j.ijbiomac.2015.01.037.
[22] JEDDOU K B, CHAARI F, MAKTOUF S, et al. Structural, functional, and antioxidant properties of water-soluble polysaccharides from potatoes peels[J]. Food Chemistry, 2016, 205(15): 97-105. DOI:10.1016/j.foodchem.2016.02.108.
[23] JIA X, ZHANG C, QIU J, et al. Purification, structural characterization and anticancer activity of the novel polysaccharides from Rhynchosia m inim a root[J]. Carbohydrate Polymers, 2015, 132(5): 67-71. DOI:10.1016 /j.carbpol.2015.05.059.
[24] 王书华, 饶娜, 安芳. 金莲花多糖的分离纯化及其抗氧化作用研究[J]. 中成药, 2013, 35(11): 2384-2389. DOI:10.3969/ j.issn.1001-1528.2013.11.016.
[25] 张颖, 曾艳, 张丽姣, 等. 蛹虫草菌糠多糖的分离纯化及结构组成分析[J]. 食品科学, 2014, 35(13): 54-58. DOI:10.7506/spkx1002-6630-201413010.
[26] CAI W, XU H, XIE L, et al. Purification, characterization and in vitro anticoagulant activity of polysaccharides from Gentiana scabra Bunge roots[J]. Carbohydrate Polymers, 2016, 140(20): 308-313. DOI:10.1016 /j.carbpol.2015.12.054.
[27] CHAI Y, ZHAO M. Purification, characterization and anti-proliferation activities of polysaccharides extracted from Viscu m c olo ra tum (Kom.) Nakai[J]. Carbohydrate Polymers, 2016, 149(20): 121-130. DOI:10.1016 /j.carbpol.2016.04.090.
[28] 李彬, 陈向楠, 张建法, 等. 产胞外多糖菌株的筛选及胞外多糖结构分析[J]. 生物技术通报, 2016, 32(5): 165-171. DOI:10.13560/j.cnki. biotech.bull.1985.2016.05.022.
[29] 韩丽荣, 程代, 王莉蕊, 等. 灰树花胞外多糖的结构及免疫调节活性[J].生物工程学报, 2016, 32(5): 648-656. DOI:10.13345/j.cjb.150399.
[30] SHI L. Bioactivities, isolation and pu rification methods of polysaccharides from natural products: a review[J]. International Journal of Biological Macromolecules, 2016, 92(11): 37-48. DOI:10.1016/j.ijbiomac.2016.06.100.
Purification and Structural Analysis of Polysaccharides from Ginger Peels
FENG Xin
1, XIA Yu
1, CHEN Guitang
2, XU Jiajia
1, LIAO Xiaojun
3, ZHAO Liyan
1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. College of Engineering, China Pharmaceutical University, Nanjing 210009, China; 3. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:Crude polysaccharides were extracted from ginger peels by hot water extraction and alcohol precipitation. DEAE-cellulose 52 and Sephadex G-100 gel filter column chromatographies were sequentially used to purify crude polysaccharides. The purified polysaccharides were designated as GE-1, GE-2 and GE-3, respectively. Their molecular weight distribution and monosaccharide compositions were analyzed by high performance liquid chromatography (HPLC). The structure of the deproteinized polysaccharides from ginger peels were analyzed and characterized by ultraviolet (UV) and infrared (IR) spectroscopy. The results showed that the total sugar contents of GE-1, GE-2 and GE-3 were (98.06 ± 0.15)%, (97.41 ± 0.42)% and (97.89 ± 0.22)%, respectively. Their molecular weights were 462, 194 and 376 kD, respectively. The structural analysis demonstrated that GE-1 was composed of mannose, glucose and xylose at a molar ratio of 1.25:6:1, GE-2 was composed of mannose, glucose and fucose at a molar ratio of 2.51:9.25:1, and GE-3 was composed of mannose, ribose, galactose and arabinose at a molar ratio of 17.39:1:1.89:1.23.
Key words:ginger peel polysaccharides; isolation and purification; molecular weight; monosaccharide composition
DOI:10.7506/spkx1002-6630-201706029
中图分类号:TQ929.2
文献标志码:A
文章编号:1002-6630(2017)06-0185-06
引文格式:
冯鑫, 夏宇, 陈贵堂, 等. 生姜皮多糖的分离纯化及其结构组成分析[J]. 食品科学, 2017, 38(6): 185-190. DOI:10.7506/ spkx1002-6630-201706029. http://www.spkx.net.cn
FENG Xin, XIA Yu, CHEN Guitang, et al. Purification and structural analysis of polysaccharides from ginger peels[J]. Food Science, 2017, 38(6): 185-190. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706029. http://www.spkx.net.cn
收稿日期:2016-07-29
基金项目:公益性行业(农业)科研专项(201303079)
作者简介:冯鑫(1993—),女,硕士研究生,研究方向为食品营养化学。E-mail:2015808114@njau.edu.cn
*通信作者:赵立艳(1977—),女,教授,博士,研究方向为食品营养与化学、食品质量与安全。E-mail:zhlychen@njau.edu.cn