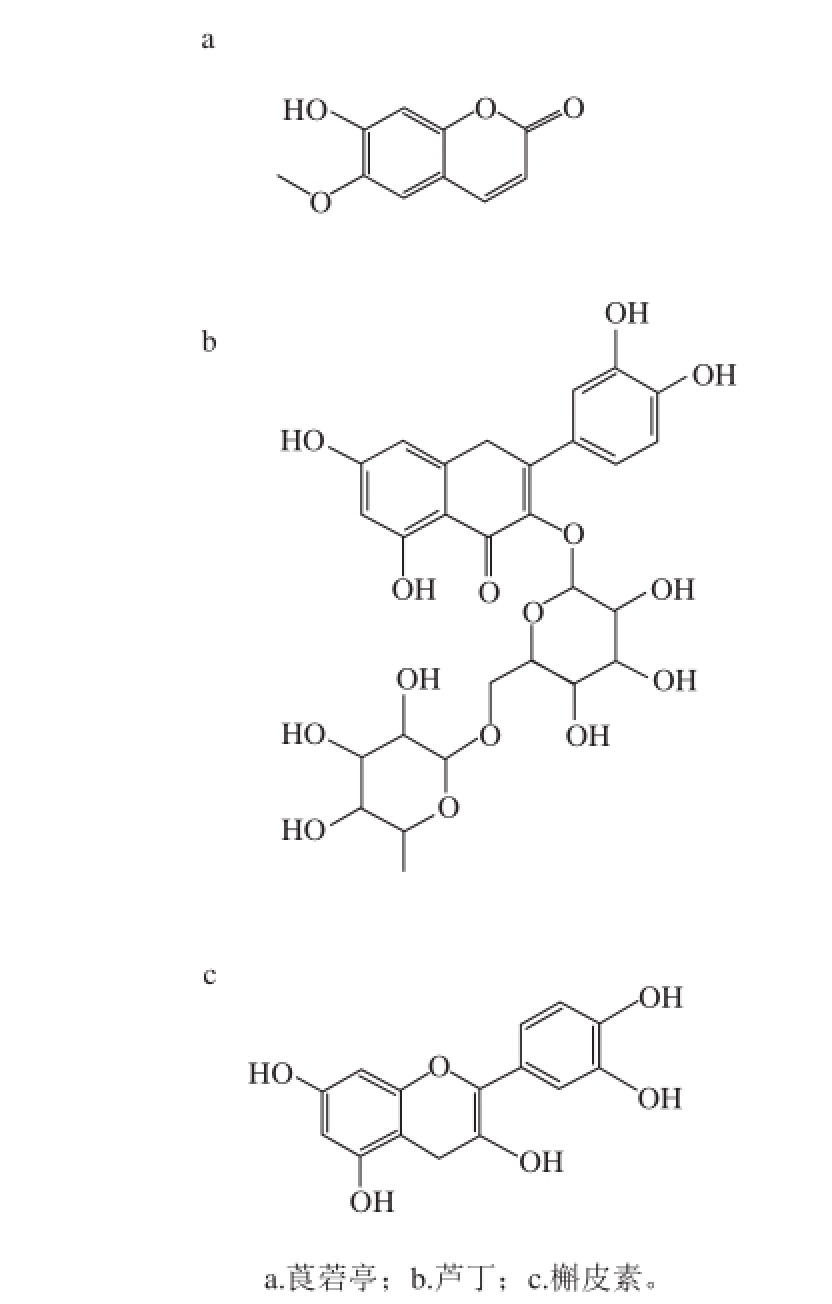
图1 植物素的化学结构
Fig. 1 Structural formula of phytochemical components
沈宋利 1,杨 健 2,沈燕飞 1,唐泽辉 1,陈梅兰 1,*
(1.浙江树人大学生物与环境工程学院,浙江 杭州 310015;2.美国关岛大学自然与应用科学学院,西太平洋热带研究中心,美国 关岛 GU 96923)
摘 要:采用超声萃取高效液相色谱法测定诺丽果粉中的莨菪亭、芦丁和槲皮素含量。为了提高萃取效率,实验系统地优化了影响萃取效率的因素(有机溶剂种类、有机溶剂与水的比例、萃取时间、萃取温度和超声频率)。结果表明,最佳萃取条件:萃取剂为体积分数80%甲醇溶液,萃取时间为30 min,萃取温度为20 ℃,超声频率为45 kHz。采用依利特Hypersil ODS柱(4.6 mm×250 mm,5 μm),以甲醇-0.1%三氟乙酸-乙腈溶液作为流动相进行梯度淋洗,流速1.0 mL/min,在检测波长365 nm,柱温25 ℃条件下,对莨菪亭、芦丁和槲皮素分离检测。方法具有良好的线性关系(r 2≥0.999 8)、检出限(≤1.30 µg/L)、回收率(90.67%~113.00%)和重复性(相对标准偏差不大于1.46%,n=8)。该方法准确可靠,可用于定性、定量测定诺丽果粉样品中的莨菪亭、芦丁和槲皮素。
关键词:超声萃取;莨菪亭;芦丁;槲皮素;诺丽果粉
诺丽(Morinda citrifolia)果是茜草科巴戟天属植物海巴戟天的果实。它全年生长,夏威夷人常使用成熟的黄色或白色诺丽果制成果汁和粉末作为有益健康并且具有治疗作用的食物 [1]。有研究表明诺丽果汁在清除自由基、抗癌、消炎、保护肝损伤和降低血糖治疗糖尿病等方面有一定的作用 [2-5],同时也有防治艾滋病、埃博拉出血热、心血管疾病和肿瘤等作用 [6-8]。诺丽果的这些作用主要因含有大量的有活性功能的植物素 [9],植物素是植物产生的天然物质,他们具有生物活性作用从而有益于人体健康,植物素种类较多,多数富含类胡萝卜素、黄酮类和异黄酮类物质。槲皮素、芦丁及莨菪亭,如图1所示,3 种植物素是诺丽果中关注较多的功能性化合物。槲皮素是已知最强抗癌剂之一,只要微量即可直接阻滞癌细胞增殖 [10]。芦丁具有抗菌消炎、抗辐射、防止血管破裂、止血和抗氧化等作用 [11-12]。莨菪亭是香豆素类衍生物,有抗氧化作用 [13],同时还具有抗真菌的作用,能有效抑制半裸镰刀病菌的生长 [14]。有研究报道,诺丽果中的植物素含量会因地域差异而不同,来自不同地域的莨菪亭、芦丁及槲皮素含量变化在0.064~6.87、0.053~2.75、0.015~0.20 mg/g之间 [9],也会因光照而加速损失 [15],所以不同品牌和种类的诺丽果汁植物素含量因地域不同存在一定差异 [14],也可能因贮存及包装条件不同造成其中植物素含量的变化,而诺丽果中槲皮素、芦丁及莨菪亭3 种植物素的含量是诺丽产品品质重要指标之一。目前国内对于药物或水果中莨菪亭、芦丁和槲皮素等活性物质的研究较多 [16-17],但是关于诺丽产品中槲皮素、芦丁及莨菪亭检测的研究鲜见报道。对于前处理方法报道较多的是利用固相萃取和液-液萃取水果、蔬菜和中药中槲皮素、芦丁和莨菪亭 [18-20]。其他的萃取技术包括利用苯乙烯-二乙烯苯树脂吸附-解吸方法萃取诺丽果中的多酚类物质 [21],超临界二氧化碳萃取黄酮类化合物 [22],离子液体微波辅助萃取法萃取中药中的芦丁 [23],加速溶剂萃取 [24],高压高温萃取葡萄皮中的酚类物质 [25]。这些萃取和预浓缩的方法都有各自的优点和缺点。例如,微波萃取可以缩短萃取时间和节省萃取剂用量,但是要特别注意微波泄露的问题,并且还需要再次进行离心处理 [26];加速溶剂萃取能够有效萃取固体和半固体基质样品,但是该实验需要能够承受高温和高压的昂贵设备 [27]。诺丽产品的质量会随水果产地、生产工艺和贮存条件的不同而产生变化。对诺丽产品中槲皮素、芦丁和莨菪亭的常规定量需要一个简单、高效和安全的萃取方法。超声波萃取是一种可供选择的方法,可以在常规实验室的超声波清洗器中进行简单实验操作 [2 8-29]。因此,本实验建立超声萃取高效液相色谱法分离及测定诺丽果粉中的槲皮素、芦丁和莨菪亭含量的方法。该分析方法操作简单、分析速度快,可满足产品的定性及定量分析。

图1 植物素的化学结构
Fig. 1 Structural formula of phytochemical components
1.1 材料与试剂
诺丽果粉由美国关岛大学杨健教授提供;固体橙味饮料果珍 市购。
乙腈、甲醇(均为色谱纯) 美国Te dia公司;芦丁(纯度≥98%)、莨菪亭(纯度98%)、三氟乙酸(光谱纯)、槲皮素(生化试剂,纯度98%) 美国阿拉丁试剂有限公司;实验用水为超纯水(电阻率18.2 MΩ·cm) 美国Millipore公司。
1.2 仪器与设备
1200 series高效液相色谱仪(由高压六通进样阀、在线脱气仪、梯度混合仪和UV-Vis检测器组成) 美国Agilent公司;KQ-300GVD型三频恒温数控超声波清洗器昆山市超声仪器有限公司;BS-2 2 4S型电子分析天平赛多利斯科学仪器(北京)有限公司;柱温箱 深圳天为机电设备有限公司;Finnpipette F1单道移液器 赛默飞世尔科技有限公司。
1.3 方法
1.3.1 样品前处理
称取诺丽果粉0.04 g于10 mL容量瓶中,加入2.0 mL超纯水充分摇匀溶解,再加入8.0 mL甲醇,以频率为45 k Hz,温度为20 ℃超声提取30 min后,得到溶液离心2 min(3 000 r/min),取上清液过0.45 µm微孔滤膜后进样分析。每份样品平衡测定3 次。
1.3.2 标准溶液的配制
分别称取3 种植物素各0.01 g,用甲醇溶解并定容,配制质量浓度为1 000 mg/L的贮备液,于4 ℃冰箱备用。分别移取一定量的贮备液至10m L的容量瓶中,用甲醇定容,配制质量浓度分别为0.05、0.10、1.00、10.0、30.00、40.0、50.0 mg/L。
1.3.3 萃取方法
萃取条件:萃取剂为体积分数80%甲醇溶液,超声萃取频率为45 kHz,萃取时间为30 min,萃取温度为20 ℃。通过计算加标回收率和相对萃取效率得出最佳萃取条件。准确称取2 份诺丽果粉,1 份加入标准样品,另外1 份不加标准样品,根据测定结果按公式(1)计算加标回收率和萃取效率。其中萃取效率以测定结果未加标平行样中测定最大值作为基准100%,按公式(2)计算其他未加标平行样的相对萃取效率 [30]。
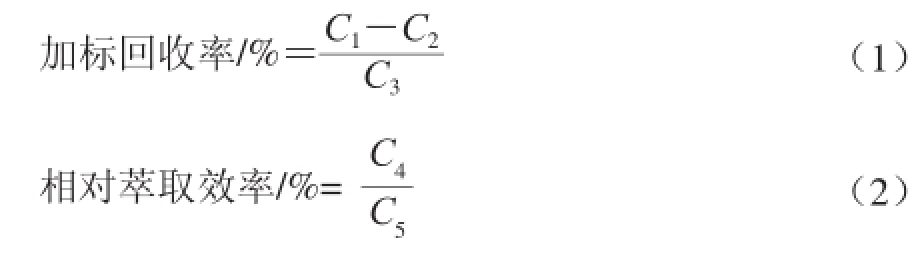
式中:C 1为加标样品的实测质量浓度/(μg/mL);C 2为对照组的本底质量浓度/(μg/mL);C 3为实际加标质量浓度/(μg/m L);C 4为不同萃取条件下的质量浓度/(μg/mL);C 5为不同条件下该组样品所测质量浓度的最大值/(μg/mL)。
1.3.4 色谱条件
依利特Hy p ersil ODS柱(4.6 m m×2 5 0 m m,5 μm);流动相:乙腈(A)、体积分数0.1%三氟乙酸溶液(B)和甲醇(C);梯度洗脱程序:0~14.0 min,1 0%~2 0% A,8 0%~6 0% B和1 0%~2 0% C;1 4.0~1 6.0 m in,2 0%~4 0% A,6 0%~3 0% B和2 0%~3 0% C;1 6.0~2 2.0 min,4 0%A,3 0% B和30% C;22.0~25.0 min,40%~10% A,30%~80% B和40%~10% C;流速1.0 mL/min;进样量20 µL,柱温25 ℃,检测波长365 nm。
2.1 样品萃取方法的优化
为考察不同萃取条件对3 种植物素萃取效果的影响,用萃取效率和加标回收率评估萃取的最优条件。
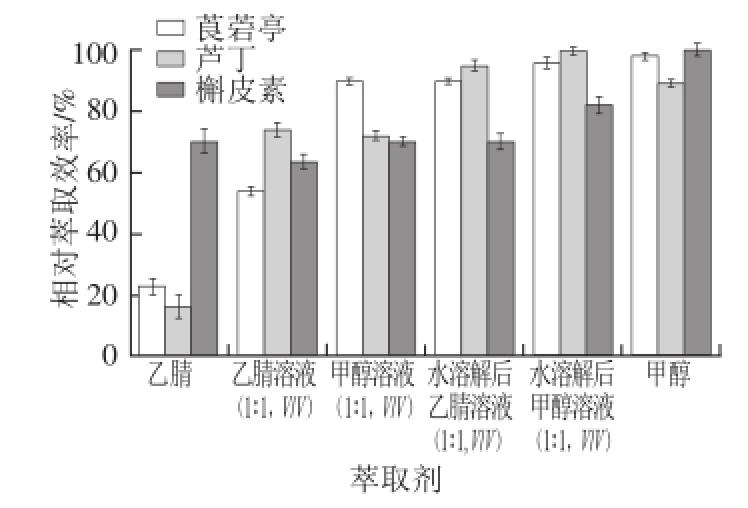
图2 萃取剂的优化
Fig. 2 Optimization of extraction solvent
2.1.1 萃取剂的选择
分别采用乙腈、甲醇、乙腈溶液(1∶1,V/V)、甲醇溶液(1∶1,V/V)、样品先分散在水中后用甲醇溶液(1∶1,V/V)萃取和样品先分散在水中后用乙腈溶液(1∶1,V/V)萃取,6 种萃取方法萃取样品中的3 种植物素,结果表明诺丽果粉较难溶于乙腈,因此实验未做加标回收率,故表1~3未列出乙腈的萃取加标回收率,同样诺丽果粉在甲醇中的溶解度也较低。从表1~3以及图2可以看出,甲醇的加标回收率及萃取效率相对较为理想(实验时取样量以刚好能被甲醇溶解),但因为诺丽果粉在甲醇中溶解度较低,当样品中植物素含量较低,需要加大取样量时,该方法就会受到限制。综合考虑,采用先将诺丽果粉分散在水中,再用甲醇溶液萃取,该方法萃取效率及加标回收率都较好,且不受高浓度诺丽果粉的影响。
表1 不同萃取剂对莨菪亭的加标回收率及样品萃取效率
Table 1 Recoveries and extraction efficiencies of scopoletin with different solvents

萃取剂甲醇乙腈溶液甲醇溶液水溶解后甲醇溶液水溶解后乙腈溶液(1∶1,V/V)(1∶1,V/V)(1∶1,V/V)(1∶1,V/V)加标回收率/%106 114 114 102 98实际样品测定2.05 1.13 1.81 1.98 2.00质量浓度/(mg/L)
表2 不同萃取剂对芦丁的加标回收率及样品萃取效率
Table 2 Spiked recoveries and extraction efficiencies of rutin with different solvents
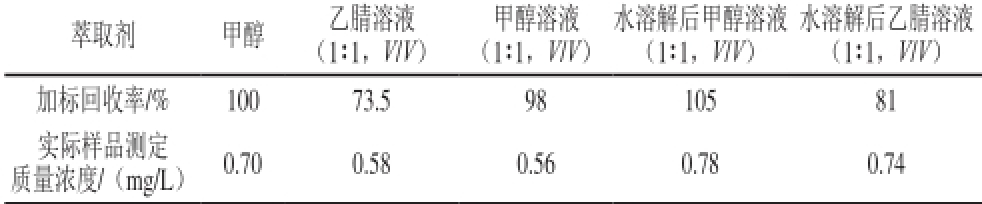
萃取剂甲醇乙腈溶液甲醇溶液水溶解后甲醇溶液水溶解后乙腈溶液(1∶1,V/V)(1∶1,V/V)(1∶1,V/V)(1∶1,V/V)加标回收率/%100 73.5 98 105 81实际样品测定0.70 0.58 0.56 0.78 0.74质量浓度/(mg/L)
表3 不同萃取剂对槲皮素的加标回收率及样品萃取效率
Table 3 Recoveries and extraction efficiencies of quercetin with different solvents

萃取剂甲醇乙腈溶液甲醇溶液水溶解后甲醇溶液水溶解后乙腈溶液(1∶1,V/V)(1∶1,V/V)(1∶1,V/V)(1∶1,V/V)加标回收率/%88 93 30 81 69实际样品测定0.27 0.17 0.19 0.21 0.19质量浓度/(mg/L)
2.1.2 萃取溶剂甲醇和水的比例
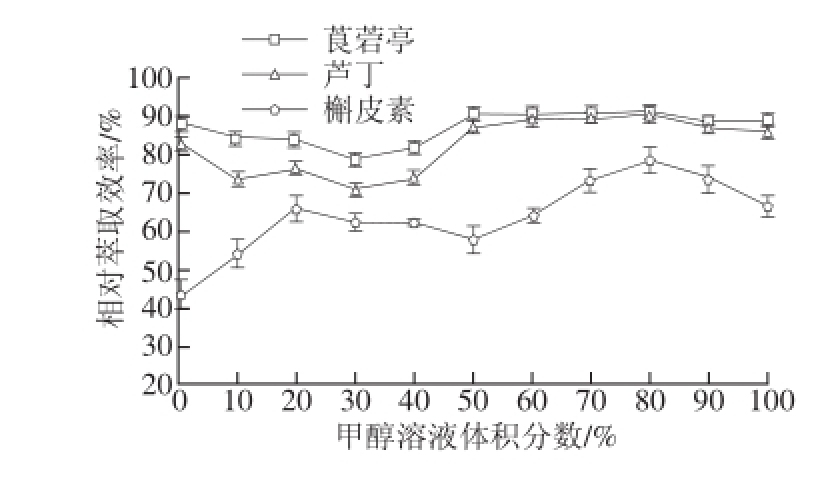
图3 甲醇体积分数对相对萃取效率的影响
Fig. 3 Effect of aqueous methanol concentration on extraction efficiency
分别采用不同体积分数甲醇溶液进行萃取实验,使甲醇在溶剂中的比例分别为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%。如图3所示,当体积分数80%甲醇溶液为溶剂时,3 种植物素的相对萃取效率最高。
2.1.3 超声频率的选择
用体积分数80%甲醇溶液作为萃取剂,分别设置超声频率为45、80、100 kHz对样品进行处理,实验结果表明:超声频率为45 kHz时,相对萃取效率分别为莨菪亭98%、芦丁95%、槲皮素90%;超声频率为80 kHz时,相对萃取效率分别为莨菪亭98%、芦丁94%、槲皮素91%;超声频率为1 0 0 k Hz时,相对萃取效率分别为莨菪亭96%、芦丁92%、槲皮素87%。可见,随着超声频率的变化,萃取效率变化不明显,因此本实验选用超声频率为45 kHz。
2.1.4 萃取时间的选择

图4 萃取时间对相对萃取效率的影响
Fig. 4 Effect of extraction time on extraction efficiency
诺丽果粉中分别添加莨菪亭、芦丁和槲皮素为30、20 μg和10 μg,考察萃取时间10、15、20、25、30、35、40 min对植物素提取效率的影响,如图4所示,萃取时间为30 min时对植物素的相对萃取效率最优。
2.1.5 萃取温度的选择
诺丽果粉中分别添加莨菪亭、芦丁和槲皮素为30、20 μg和10 μg,考察萃取温度10、15、20、25、30、35、 40 ℃对植物素萃取效率的影响,如图5所示,萃取温度为20 ℃时对植物素的萃取效率最优。
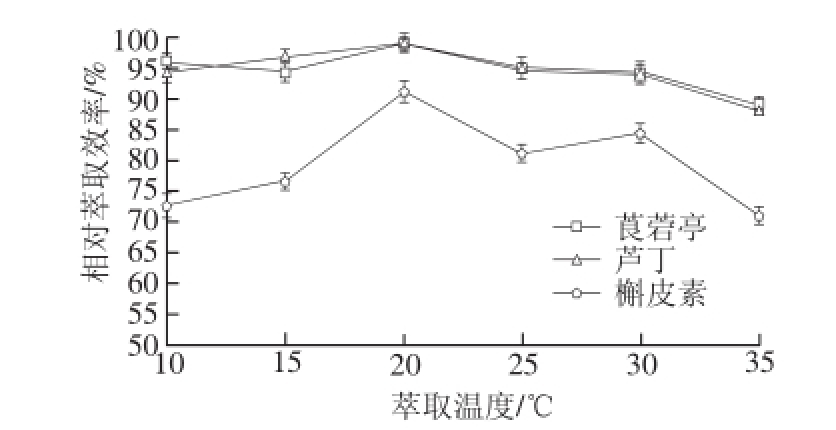
图5 萃取温度对相对萃取效率的影响
Fig. 5 Effect of extraction temperature on extraction efficiency
2.2 色谱条件优化
2.2.1 流动相的选择
开始采用不同比例的乙腈溶液、乙腈-0.1%三氟乙酸溶液、甲醇溶液、甲醇-0.1%三氟乙酸溶液和乙腈-1%乙酸溶液作为流动相进行一系列预实验,结果发现,采用乙腈溶液作为流动相时,芦丁峰形不佳且槲皮素响应很低;乙腈-0.1%三氟乙酸溶液作为流动相时,植物素峰形不佳;甲醇溶液作为流动相时,槲皮素不出峰;甲醇-0.1%三氟乙酸溶液作为流动相时,植物素响应低且峰形不佳;乙腈-1%乙酸溶液作为流动相时,植物素不能分离且响应不高;最后改用甲醇-0.1%三氟乙酸-乙腈溶液作为流动相后,获得了理想的色谱峰形和分离效果。由于莨菪亭和芦丁的保留时间比较接近,而槲皮素的保留时间较长,为了3 种植物素的理想分离且缩短出峰时间,因此采用梯度洗脱方式,优化后按1.3.4节方法梯度洗脱。
2.2.2 色谱柱的选择
分别考察了依利特Hy p ersil ODS柱(4.6 mm× 2 5 0 m m,5 μm)、依利特Sin o Ch ro m ODS-BP(4.6 mm×2 0 0 m m,5 μm)和安捷伦TC-C 18柱(4.6 mm×250 mm,5 μm)3 种具有不同选择性固定相的色谱柱对于3 种植物素的分离效果及峰形是否对称。结果表明:植物素在不同固定相色谱柱上的分离选择性有一定差异,但3 根色谱柱基本能够实现基线分离,从峰形上考虑,采用依利特Hypersil ODS色谱柱(4.6 mm×250 mm,5 μm)获得了理想的峰形,如图6所示。
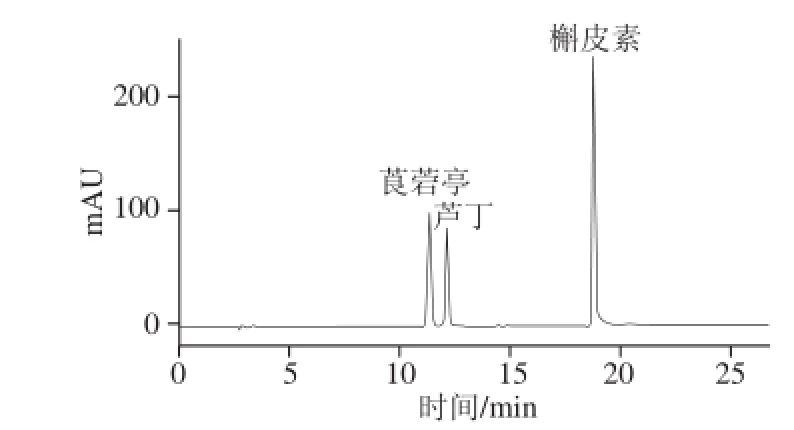
图6 标准样品色谱图
Fig. 6 Chromatogram of analyte standards
2.3 方法线性范围、重复性和检出限
在最佳色谱条件下,莨菪亭、芦丁、槲皮素的线性方程(线性范围为0.0 5、0.1 0、1.0 0、1 0.0 0、30.00、40.00、50.00 mg/L),相关系数和相对标准偏差(30.0 0 mg/L的标准溶液重复进样8 次)及检出限(R SN=3)如表4所示。方法在较宽的线性范围内有良好的线性(r 2≥0.999 8)、检出限(≤1.30 μg/L)、回收率(90.67%~11 3.0 0%)和重复性(相对标准偏差不大于1.46%)。
表4 线性范围、重复性及检出限
Table 4 Linear range, reproducibility and limits of detection of the developed method
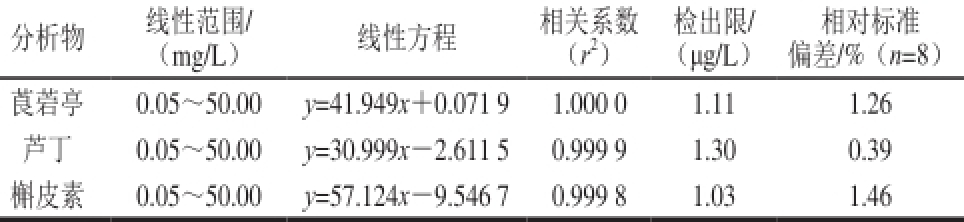
注:表中y为峰面积,x为质量浓度(mg/L)。
分析物线性范围/线性方程相关系数检出限/相对标准(mg/L)(r 2)(μg/L)偏差/%(n=8)莨菪亭0.05~50.00 y=41.949x+0.071 9 1.000 0 1.11 1.26芦丁0.05~50.00 y=30.999x-2.611 5 0.999 9 1.30 0.39槲皮素0.05~50.00 y=57.124x-9.546 7 0.999 8 1.03 1.46
2.4 方法的回收率和样品测定
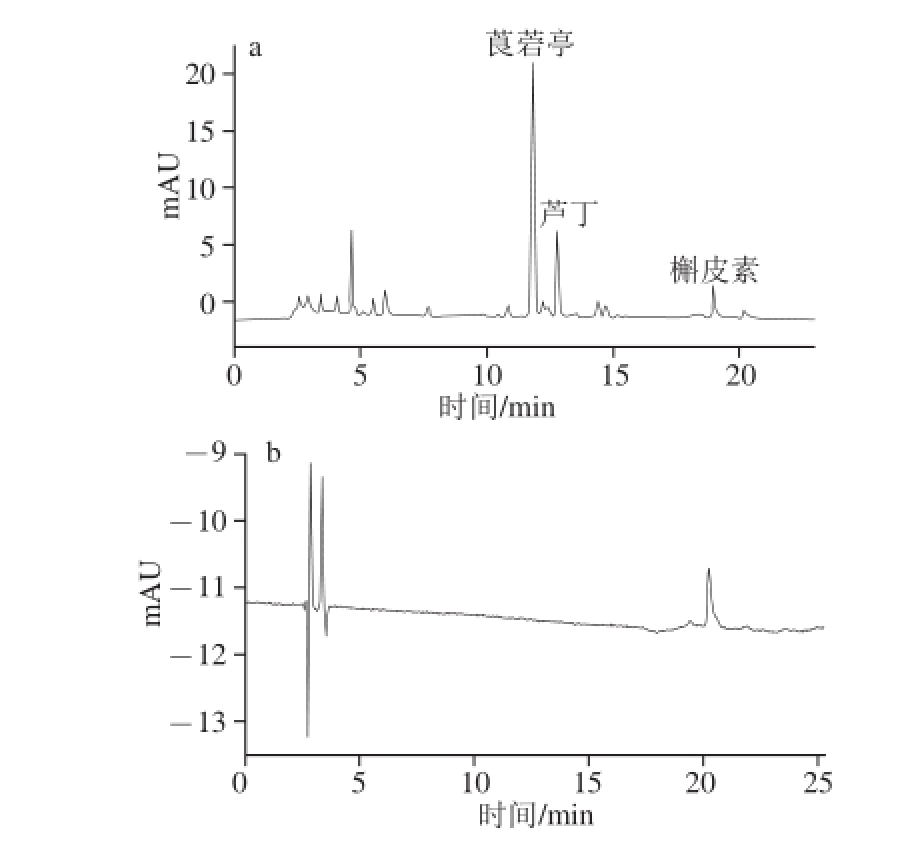
图7 诺丽果粉样品(a)和果珍样品(b)色谱图
Fig. 7 Chromatogram of noni power (a) and Tang samples (b)
为考察基体对测定方法的影响,按1.3.1节前处理方法,分别处理诺丽果粉和果珍,并用1.3.4节方法进行测定,如图7所示。另取2 种果粉各3 份,分别加入莨菪亭、芦丁和槲皮素30.0、20.0、10.0 μg,果珍中3 种植物素加标量为15.0 μg,测定加标回收率,结果见表5。诺丽果粉中莨菪亭含量较高,芦丁含量次之,而槲皮素含量较低。市场购买的果珍饮料不含这3 种活性物质,对样品的加标回收率方法学考察表明回收率可以接受。
表5 实际样品测定结果和加标回收率
Table 5 Contents of three analytes and spiked recoveries in real samples
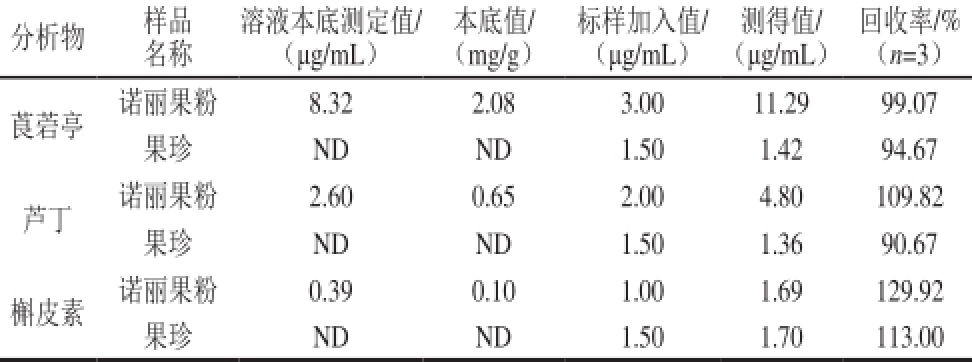
注:ND.未检出。
分析物样品溶液本底测定值/本底值/标样加入值/测得值/回收率/%名称(μg/mL)(mg/g)(μg/mL)(μg/mL)(n=3)莨菪亭诺丽果粉8.32 2.08 3.00 11.29 99.07果珍ND ND 1.50 1.42 94.67芦丁诺丽果粉2.60 0.65 2.00 4.80 109.82果珍ND ND 1.50 1.36 90.67槲皮素诺丽果粉0.39 0.10 1.00 1.69 129.92果珍ND ND 1.50 1.70 113.00
将诺丽果粉样品用水溶解再加入甲醇,用超声提取,萃取时间3 0 min、萃取温度2 0 ℃、超声频率45 kHz。用依利特Hypersil ODS柱即可对莨菪亭、芦丁和槲皮素的样品进行分析。方法用于果珍分析时,加标回收率为90.67%~113.00%。实验结果表明:方法简单、准确、灵敏度高且成本较低,可用于果粉中莨菪亭、芦丁和槲皮素的测定。
利用建立的方法对来自美国关岛的诺丽果粉进行了检测,结果发现诺丽果粉中的植物素的含量莨菪亭、芦丁和槲皮素分别为2.08、0.65、0.10 mg/g,与文献[9]报道结果相比,芦丁、槲皮素和莨菪亭含量较高,可见,来自美国关岛的诺丽果粉品质较好。
超声萃取高效液相色谱分离紫外检测法测定诺丽果粉中莨菪亭、芦丁和槲皮素,实验时只需先用一定量的纯水将其溶解分散后,再加入体积分数80%甲醇溶液进行超声萃取,萃取液过滤后可直接进样分析,方法使用设备简单、操作容易,可应用于实际产品的检测。
参考文献:
[1] BROWN A C. Anticancer activity of Mo rind a citrifo lia (Noni) fruit: a review[J]. Phytotherapy Reseach, 2012, 26(10): 1427-1440. DOI:10.1002/ptr.4595.
[2] 刘印忠, 马德禄, 高建华, 等. 诺丽果汁对四氯化碳引起肝损伤小鼠的肝保护作用[J]. 天津药学, 2008, 20(2): 6-8. DOI:10.3969/ j.issn.1006-5687.2008.02.003.
[3] 谢文利, 朱江, 晋玉章. 诺丽果汁对D-半乳糖胺致肝损伤的保护作用[J]. 食品研究与开发杂志, 2008, 29(9): 17-19. DOI:10.3969/ j.issn.1005-6521.2008.09.006.
[4] NERURKARA P V, NISHIOKAA A, ECKA P O, et al. Regulation of glucose metabolism via hepatic forkhead transcription factor 1(FoxO1) by M orinda citrifolia (Noni) in high-fat diet-induced obese mice[J]. British Journal of Nutrition, 2012, 108(2): 218-228. DOI:10.1017/ S0007114511005563.
[5] LIN Y L, CHOU C H, YANG D J, et al. Hypolipidemic and antioxidative effects of noni (Morinda citrifolia L.) juice on high-fat/ cholesterol-dietary hamsters[J]. Plant Foods Human Nutrion, 2012, 67(3): 294-302. DOI:10.1007/s11130-012-0309-x.
[6] 梁光裕. 诺丽果汁防治艾滋病的量子医学研究[J]. 知识经济, 2007(1): 70-73.
[7] 梁光裕. 诺丽果汁的量子医学最新研究报告[J]. 知识经济, 2007(5): 54-58.
[8] 梁光裕. 诺丽果汁防治埃博拉出血热的研究[J]. 知识经济, 2007(2): 68-69.
[9] DENG Shixin, WEST B J, JARAKAE J C. A quantitative comparison of phytochemical components in global noni fruits and their commercial products[J]. Food Chemistry, 2010, 122(1): 267-270. DOI:10.1016/j.foodchem.2010.01.031.
[10] 朱蕾, 何丽娅. 槲皮素抗癌作用的分子机制[J]. 武汉科技大学学报(自然科学版), 2 004, 27(2): 194-1 96. DOI:1 0.3 96 9/ j.issn.1674-3644.2004.02.027.
[11] DUSSOSSOA E, BRATB P, BONYA E, et al. Characterization, antioxidative and anti-inflammatory effects of Costa Rican noni juice (Mo rin d a c itrifolia L.)[J]. Journal of Ethnopharmacology, 2011, 133(1): 108-115. DOI:10.1016/j.jep.2010.08.063.
[12] 林静. 芦丁的临床药理特点[J]. 中国临床药理学杂志, 2009, 25(3): 256-263. DOI:10.3969/j.issn.1001-6821.2009.03.019.
[13] 杨淑娟, 苏正德, 王美燕, 等. Noni (Morinda c itrifolia)果汁中莨菪亭及其衍生物之分离与鉴定[J]. 台湾农业化学与食品科学, 2009, 47(6): 300-309. DOI:10.6578/TJACFS.2009.034.
[14] SHUKLA Y N, SRIVASTAVA A, KUMAR S, et al. Phytotoxic and antimicrobial constituents of Argyreia speciosa and Oenothera bien nis[J]. Journal of Ethnopharmacology, 1999, 67(2): 241-245. DOI:10.1016/S0378-8741(99)00017-3.
[15] YANG J, GADI R, PAULINO R, et al. Total phenolics, ascorbic acid, and antioxidant capacity of noni (M orind a citrifolia L.) juice and powder as affected by illumination during storage[J]. Food Chemistry, 2010, 122(3): 627-632. DOI:10.1016/j.foodchem.2010.03.022.
[16] 谢婷. HPLC梯度洗脱法同时测定参杞酒中的党参炔苷、东莨菪苷、东莨菪亭、槲皮素、山柰酚和异鼠李素[J]. 国际药学研究杂志, 2016, 43(5): 998-1001. DOI:10.13220/j.cnki.jipr.2016.05.037.
[17] 张慧月, 耿晖, 董琼, 等. HPLC法同时测定山楂中芦丁和槲皮素含量[J]. 辽宁中医药大学学报, 2016, 18(1): 64-66. DOI:10.13194/ j.issn.1673-842x.2016.01.021.
[18] 汤道权, 张尊建, 高媛媛, 等. 固相萃取-高效液相色谱法测定银杏叶提取物中芦丁、槲皮素、山柰酚和异鼠李素[J]. 中草药杂志, 2009, 40(1): 56-60. DOI:10.3321/j.issn:0253-2670.2009.01.016.
[19] 王怀松, 姜安, 彭江涛, 等. 固相萃取-高效液相色谱法测定栀子中芦丁含量[J]. 理化检验: 化学分册, 2013, 49(10): 1239-1241.
[20] 姜楠, 王蒙, 韦迪哲, 等. 高效液相色谱测定樱桃酚类物质[J]. 食品工业科技, 2016, 37(7): 288-291. DOI:10.13386/j.issn1002-0306.2016.07.047.
[21] LIU Qian, CAI Wensheng, SHAO Xueguang. Determination of seven polyphenols in water by high performance liquid chromatography combined with preconcentration[J]. Talanta, 2008, 77(2): 679-683. DOI:10.1016/j.talanta.2008.07.011.
[22] BIMAKR M, RAHMAN R A, GANJLOO A, et al. Optimization of supercritical carbon dioxide extraction of bioactive flavonoid compounds from spearmint (Me nth a sp ica ta L.) leaves by using response surface methodology[J]. Food and Bioprocess Technology, 2012, 5(3): 912-920. DOI:10.1007/s11947-010-0504-4.
[23] ZENG H, WANG Y Z, KONG J H, et al. Ionic liquid-based microwaveassisted extraction of rutin from Chinese medicinal plants[J]. Talanta, 2010, 83(2): 582-590. DOI:10.1016/j.talanta.2010.10.006.
[24] CHEN Z Y, HUANG S J, SU Q D, et al. Pressurized liquid extraction and HPLC analysis for determination of polyphenols in tobacco[J]. Asian Journal of Chemistry, 2013, 25(7): 3889-3892. DOI:10.14233/ ajchem.2013.13832.
[25] CASAZZA A A, ALIAKBARIAN B, SANNITA E, et al. Highpressure high-temperature extraction of phenolic compounds from grape skins[J]. International Journal of Food Science and Technology, 47(2): 399-405. DOI:10.1111/j.1365-2621.2011.02853.x.
[26] PARE J R J, BELANGER J M R, STAFFORD S S, et al. Microwaveassisted process (MAP(TM))-a new tool for the analytical laboratory[J]. Tace-trends in Analytical Chemistry, 1994, 13(4): 176-184. DOI:10.1016/0165-9936(94)87033-0.
[27] WU H W, CHEN M L, FAN Y C, et al. Determination of rutin and quercetin in Chinese herbal medicine by ionic liquid-based pressurized liq u id extraction-liquidchromato g raphy-chemiluminesc ence detection[J]. Talanta, 2010, 88(1): 222-229.
[28] YANG Y, ZHANG F. Ultra so u nd-a ssiste d ex tra ctio n of rutin and quercetin from E u o n ym u s a la tu s (Thunb.) Sieb[J]. Ultrasonics Sonochemistry, 2008, 15(4): 308-313. DOI:10.1016/ j.ultsonch.2007.05.001.
[29] 邓永利, 周光明, 陈军华, 等. 离子液体辅助超声萃取-高效液相色谱同时测定半边莲中6 种黄酮类化合物[J]. 食品科学, 2016, 37(20): 37-41. DOI:10.7506/spkx1002-6630-201620007.
[30] 朱海豹, 姚超英, 汪玲, 等. 离子液体水溶液萃取-离子色谱测定土壤中酚类化合物[J]. 浙江大学学报(理学版), 2010, 37(2): 197-200. DOI:10.3785/j.issn.1008-9497.2010.02.016.
Determination of Scopoletin, Rutin, and Quercetin in Noni (Morinda citrifolia) Fruit Powder by Ultrasonic Extraction Coupled with High Performance Liquid Chromatography
SHEN Songli
1, YANG Jian
2, SHEN Yanfei
1, TANG Zehui
1, CHEN Meilan
1,*
(1. College of Biology and Environmental Engineering, Zhejiang Shuren University, Hangzhou 310015, China; 2. Western Pacific Tropical Research Center, College of Natural and Applied Sciences, University of Guam, Mangilao, Guam GU 96923, USA)
Abstract:Noni (M o rind a citrifolia) powders are botanical dietary supplement providing purported health benefits, such as scavenging free radicals, anti-cancer activity, and anti-inflammatory effect. This study aimed to optimize the ultrasonic extraction condition and to determine the contents of scopoletin, rutin, and quercetin in noni powders by high performance liquid chromatography (HPLC). Th e optimized extraction parameters that provided the maximum extraction efficiency were determined as follows: a mixture of methanol and water as extraction solvent, 80%; extraction time, 30 min; temperature, 20 ℃ and ultrasonic frequency, 45 k Hz. With an Elite Hypersil ODS column (4.6 mm × 250 mm,5 μm), the HPLC separation was achieved by a gradient mobile phase composed of acetonitrile, methanol, and H 2O with a flow rate of 1.0 mL/min at a column temperature of 25 ℃. The quantitative analysis of scopletin, rutin, and quercetin exhibited a good linear relationship, r 2≥0.999 8, low detection limit (≤ 1.30 µg/L), high recovery (90.67%-113.00%), and good repeatability (RSD ≤ 1.46%, n = 8). The method proved to be accurate reliable, and suitable for the determination of scopletin, rutin and quercetin in noni powders.
Key words:ultrasonic extraction; scopoletin; rutin; quercetin; noni powder
DOI:10.7506/spkx1002-6630-201706030
中图分类号:TS255.4
文献标志码:A
文章编号:1002-6630(2017)06-0191-06
引文格式:
沈宋利, 杨健, 沈燕飞, 等. 超声萃取高效液相色谱法测定诺丽果粉中的莨菪亭、芦丁和槲皮素含量[J]. 食品科学, 2017, 38(6): 191-196. DOI:10.7506/spkx1002-6630-201706030. http://www.spkx.net.cn
SHEN Songli, YANG Jian, SHEN Yanfei, et al. Determination of scopoletin, rutin, and quercetin in noni (Morinda citrifolia) fruit powder by ultrasonic extraction coupled with high performance liquid chromatography[J]. Food Science, 2017, 38(6): 191-196. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706030. http://www.spkx.net.cn
收稿日期:2016-05-29
基金项目:浙江省自然科学基金项目(Z14B070001)
作者简介:沈宋利(1990—),男,助理工程师,学士,主要从事色谱分离分析研究。E-mail:1139106881@qq.com
*通信作者:陈梅兰(1964—),女,教授,硕士,主要从事色谱分离分析研究。E-mail:rain-lake@163.com