表1 响应面试验因素与水平
Table 1 Actual levels and coded levels of independent variable used for response surface analysis
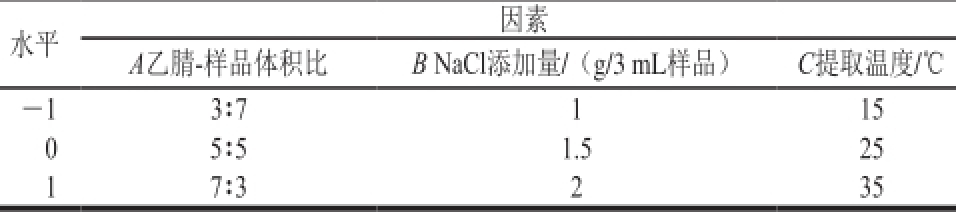
水平因素A乙腈-样品体积比B NaCl添加量/(g/3 mL样品)C提取温度/℃-1 3∶7 1 15 0 5∶5 1.5 25 1 7∶3 2 35
陈 霞 1,王 波 2,叶 融 3,李 敏 1,周继亘 1,张 波 1,韩舜愈 1,*
(1.甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃 兰州 730000;3.北京林业大学生物科学与技术学院,北京 100083)
摘 要:基于溶剂诱导萃取,使用响应面法优化水系基质中棒曲霉的提取工艺,并对4 种不同水系基质的料液比(V/V)进行选择。在单因素试验基础上,以棒曲霉素转移率为指标,响应面法优化溶剂诱导萃取的条件,并在不同料液比的4 种水系基质中进行加标回收实验。通过溶剂诱导分层,获得棒曲霉素的最佳萃取条件为乙腈-样品体积比7∶3、NaCl添加量1.4 g/3 mL样品、提取温度34 ℃,此条件下,棒曲霉素转移率为90.47%。在此最优条件下,苹果基质的最优料液比为7∶3,浓缩苹果汁、酿酒葡萄和葡萄酒基质的最优料液比均为1∶9,加标回收率分别为91.08%、85.51%、88.74%、89.17%。同时与中华人民共和国出入境检验检疫行业标准SN/T 2008—2007《进出口果汁中棒曲霉毒素的检测方法 高效液相色谱法》进行比较,结果显示该前处理方法溶剂使用量少、操作简单且重复性好。综上,响应面法优化溶剂诱导分相萃取棒曲霉素的结果可靠,为水系基质中棒曲霉素的萃取提供了一种全新、快速的前处理方法。
关键词:高效液相色谱;响应面;棒曲霉素;水系基质;溶剂诱导萃取
棒曲霉素,化学名称为4-羟基-4 H-呋[3,2 C]吡喃2(6 H)-酮,是由青霉菌属、曲霉菌属、裸囊菌属等霉菌产生的一类有毒化合物 [1]。这种毒素主要存在于苹果及其制品中,在梨、杏、桃、草莓和葡萄中也有发现 [2],具有潜在的致癌、致畸和致突变等毒副作用 [3]。Gonzalo等 [4]在‘赤霞珠’葡萄汁中也检测到了棒曲霉素,其含量在发酵过程中减少了85%左右,同时Scott [5]、Ough [6]等研究表明棒曲霉素在发酵期间由于降解和吸附等作用含量会降低,这都说明葡萄酒中有存在棒曲霉素的风险,这必然会对人体健康构成潜在威胁。虽然目前我国对于酒中的该毒素未受管制 [7-8],但是其监测工作却不容忽视。因此,能够高效、快速地测定棒曲霉素的含量是一项具有前瞻性的工作,有着非常重要的现实意义。
随着人们对健康问题的关注,食品法典委员会 [9]规定苹果汁中棒曲霉素的最高水平为50 μg/L。欧盟规定苹果汁、苹果酒及苹果汁饮料中棒曲霉素最高限量为50 μg/L,固体和婴幼儿用苹果产品中棒曲霉素残留量需分别小于25 μg/kg和10 μg/kg [7]。我国卫生部建立了新的关于食品中真菌毒素安全的国家标准 [10],规定苹果和山楂制品中棒曲霉素的最大限量为50 μg/kg。
关于棒曲霉素的检测,方法主要有纸色谱法 [11]、薄层色谱法 [12]、气相色谱-质谱联用法 [13]、液相色谱-质谱联用法 [14]以及胶束电动毛细管电泳 [15],近年来高效液相色谱(high performance liquid chromatography,HPLC)法 [16-17]发展迅速,它具有高效、快速等特点。目前,HPLC法检测棒曲霉素时常用的前处理方法有液液萃取法、固相萃取法 [1 8]。对于传统的液液萃取方法,提取溶剂为疏水性有机溶剂,考虑到与流动相的兼容问题,进样前需浓缩复溶,提取过程繁琐、耗时、溶剂使用量大,此外,由于棒曲霉素在碱性溶液中不稳定,在净化过程中为避免棒曲霉素的损失,必然对实验人员的操作技能要求较高,导致结果的重现性较差。固相萃取小柱价格昂贵,需经过活化、平衡、上样、冲洗及洗脱等多个步骤,耗时长且操作繁琐,可见,一个理想的样品处理方法应该是能够有效地消除干扰、自动富集目标物且简单经济。然而,利用响应面法来优化NaCl诱导分相萃取前处理技术是否能有效地提高水系基质中棒曲霉素的提取率还鲜见报道。
本实验首先利用响应面法优化NaCl诱导分相萃取水系基质中棒曲霉素的工艺,确定其最佳提取条件;然后通过对4 种不同水系基质的料液比(V/V)进行选择,确定其最佳比例,旨在为棒曲霉素的快速检测提供参考。
1.1 材料与试剂
赤霞珠葡萄酒 实验室酿制(酒精度11.5%(V/V));浓缩苹果汁、苹果 市购;酿酒葡萄(经检测都无棒曲霉素残留) 甘肃农业大学葡萄园。
酿酒酵母(红佳酿) 意大利Enartis公司;棒曲霉素标准品 美国Sigma公司;乙腈(色谱纯) 德国Merck KGaA公司;乙酸乙酯、乙酸铵、氯化钠、冰乙酸均为国产分析纯;蒸馏水 广州屈臣氏公司。
1.2 仪器与设备
Waters2695型HPLC仪(配二极管阵列检测器) 美国Waters公司;DKB-501A型恒温水浴锅 上海精宏实验设备有限公司;MGS-HEAT氮吹仪 日本Eyela公司;T25 BASIC分散机 北京中联科仪科技有限公司;移液枪美国Thermo Electron公司;CP214电子天平 上海奥豪斯仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
标准贮备液:用5 mL乙酸乙酯溶解5 mg棒曲霉毒素后,移入25 mL的容量瓶,乙酸乙酯定容至刻度,配成质量浓度约为20 0 μg/m L的标准储备液,在-20 ℃冷冻保存。
标准工作液:取500 μL的棒曲霉毒素标准溶液(相当于5 μg),用氮气吹干后溶解于5 mL p H 4.0水中,配成质量浓度为1 μg/mL,根据需要再用pH 4.0水稀释,配成适当质量浓度的标准工作液。
1.3.2 HPLC条件
色谱柱:PLATISIL TMODS(2 5 0 mm×4.6 mm,5 μm);流动相:A为水(80 mmol/L乙酸铵),B为乙腈,A、B体积比95∶5;流速1.0 mL/min;进样量10 μL;柱温35 ℃;检测波长276 nm。
1.3.3 样品检测
1.3.3.1 样品前处理
赤霞珠葡萄酒:经除梗破碎、浸渍、酒精发酵等步骤酿制而成;苹果:将苹果洗净、切碎,取1.7 g于50 mL离心管中,加水定容至30 mL,均质、过滤、离心后备用;酿酒葡萄:将葡萄颗粒除梗、清洗、破碎、过滤、离心后备用;待测样品于4 ℃保存,12 h内测定。
1.3.3.2 棒曲霉素的检测
准确量取3 mL供试样品,置于50 mL离心管中,温度保持在34 ℃,分别加入7 mL乙腈提取液、1.4 g NaCl,将所得溶液密封涡旋振荡3 min后,8 00 0 r/min离心5 min,取上清液40 ℃条件下氮气吹至近干,残余物质用1 mL pH 4.0的水溶液复溶,经0.22 μm微孔滤膜过滤后供HPLC仪测定。
1.3.4 棒曲霉素最佳萃取条件的确定
在棒曲霉素稳定的参数条件下设计单因素试验。结果表明,在乙腈-样品体积比5∶5、NaCl添加量1.5 g/3 mL样品、提取温度25 ℃时棒曲霉素在水相与有机相之间的转移率较好,因此选取乙腈-样品体积比、NaCl添加量、提取温度作为试验考察因素,以棒曲霉素在两相间的转移率为因变量,应用Design-Expert V8.0.6软件,设计三因素三水平的响应面试验,因素与水平见表1。
表1 响应面试验因素与水平
Table 1 Actual levels and coded levels of independent variable used for response surface analysis

水平因素A乙腈-样品体积比B NaCl添加量/(g/3 mL样品)C提取温度/℃-1 3∶7 1 15 0 5∶5 1.5 25 1 7∶3 2 35
1.4 数据分析
每个实验组设3 个平行,数据采用Microsoft Office Excel 2007(Microsoft Co.,Redmond,USA)进行处理,Design-Expert V8.0.6软件对数据进行响应面分析。
2.1 诱导分相剂的选择
有文献 [19]报道,几乎所有与乙腈互溶的疏水性溶剂都能作为诱导分相剂诱导乙腈-水体系分层,因此,本实验选择了具有代表性的不含氧诱导剂如二氯甲烷、无机盐如氯化钠及含氧诱导剂如乙酸乙酯对棒曲霉素标准溶液(1 mg/L)进行诱导分相萃取,比较了水层和乙腈层中棒曲霉素的含量,确定棒曲霉素的转移率。结果显示采用乙酸乙酯作为诱导分相剂进行提取时,目标物的转移率较低,使用二氯甲烷进行分相时,随着两相比例的变化,分层效果差,乳化现象严重,当使用NaCl作为分相剂时,少量NaCl即可以使两相分离且效果明显,转移率达90.47%,可以证明棒曲霉素高选择性的转移至乙腈层中。因此选择NaCl作为诱导剂。
2.2 响应面试验结果
由2.1节的结果可知,使用NaCl作为诱导剂时棒曲霉素的萃取效果最好,此外,通过极差对单因素水平进行筛选,最终选择乙腈-样品体积比、NaCl添加量、提取温度为考察因素,通过响应面法对3 个单因素进行分析,得到的试验方案及结果见表2。
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis

试验号A乙腈-样品B NaClC提取Y棒曲霉素体积比添加量温度转移率/% 1 -1-1-1 80.26 2 1 -1-1 84.91 3 -1 1-1 90.21 4 1 1 -1 89.15 5 -1-1 1 87.53 6 1 -1 1 90.22 7 -1 1 1 89.97 8 1 1 1 89.75 9-1.68 0 0 90.88 10 1.68 0 0 90.59 11 0-1.68 0 80.26 12 0 1.68 0 88.69 13 0 0-1.68 85.77 14 0 0 1.68 89.4 15 0 0 0 91.17 16 0 0 0 91.09 17 0 0 0 90.67 18 0 0 0 89.99 19 0 0 0 91.23 20 0 0 0 90.12
利用Design-Expert V8.0.6软件对表2数据进行方差分析,得到结果如表3所示。由表3可知,NaCl添加量(P<0.01)和提取温度(P<0.01)对棒曲霉素在水相与有机相之间的转移影响极显著。以棒曲霉素的转移率为响应值,经回归拟合后,得到回归方程:Y/%=0.41A+ 2.2 2 B+1.39 C-1.08 A B-0.14 A C-0.53 B C+0.08 A 2-2.13B 2-1.03C 2。
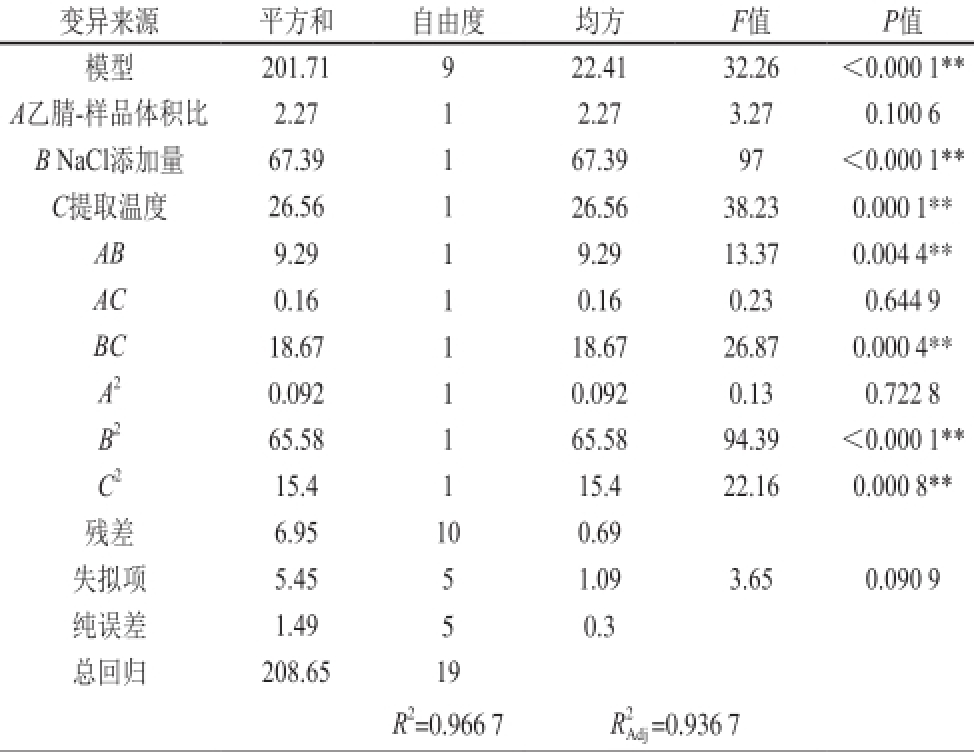
表3 方差分析
Table 3 Analysis of variance for the fitted regression model
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
变异来源平方和自由度均方F值P值模型201.71 9 22.41 32.26<0.000 1** A乙腈-样品体积比2.27 1 2.27 3.27 0.100 6 B NaCl添加量67.39 1 67.39 97<0.000 1** C提取温度26.56 1 26.56 38.23 0.000 1** AB 9.29 1 9.29 13.37 0.004 4** AC 0.16 1 0.16 0.23 0.644 9 BC 18.67 1 18.67 26.87 0.000 4** A 20.092 1 0.092 0.13 0.722 8 B 265.58 1 65.58 94.39<0.000 1** C 215.4 1 15.4 22.16 0.000 8**残差6.95 10 0.69失拟项5.45 5 1.09 3.65 0.090 9纯误差1.49 5 0.3总回归208.65 19 R 2=0.966 7 R 2 Adj=0.936 7
据方差分析结果,上述回归方程描述与响应面值之间的关系时因其模型的P值小于0.05(显著),失拟项检验的P值为0.090 9(不显著),R 2=0.966 7,表明模型充分拟合试验数据 [20-21],变异系数为0.94%,说明模型的置信度高,方程能较好地反映真实的实验值。综上,该方程是棒曲霉素转移率与萃取工艺各参数的合适数学模型。所以,可以利用此回归方程确定水系溶液中棒曲霉素的最佳提取工艺。由表3还可知,B、C、A B、B C的影响极显著,而A、AC的影响不显著。

图1 各因素交互作用对棒曲霉素转移率影响的响应面和等高线图
Fig. 1 Response surface and contour plots for the effect of operating parameters on the transportation rate of patulin
响应面图可较直观地看出各因素交互作用对棒曲霉素转移率的影响,若曲线越陡峭,则表明该因素对棒曲霉素转移率的影响越大,相应表现为响应值变化的大小 [22]。从图1可以看出,NaCl添加量对棒曲霉素转移率的影响最大,提取温度次之,表3回归分析结果也与此相吻合,NaCl添加量和提取温度二者对应的P值都小于0.05,均达到了显著水平。同时,从图1a、c还可以看出,NaCl添加量和乙腈-样品体积比的交互作用与NaCl添加量和提取温度的交互作用相比,后者对棒曲霉素转移率的作用比前者显著,P值分别为0.004 4和0.000 4。
通过软件分析确定最佳棒曲霉素提取工艺为乙腈-样品体积比6.96∶3.04、NaCl添加量1.4 g/3 mL样品、提取温度为34.3 ℃,此条件下棒曲霉素转移率的理论值为91.41%。根据所得的分析数据进行3 组验证实验,为实际操作方便,将上述最优提取条件简化为乙腈-样品体积比7∶3、NaCl添加量1.4 g/3 mL样品、提取温度34 ℃,得棒曲霉素平均转移率为90.47%,测定结果稳定,偏差不大,证明该结果合理可靠。
以上对棒曲霉素在水相与有机相之间的转移条件进行了优化,但在实际样品检测过程中,由于基质效应的存在,棒曲霉素在两相之间的转移可能受到影响,因此后续实验中对不同样品的基质效应进行了评估。实验选用苹果、浓缩苹果汁、酿酒葡萄和葡萄酒4种样品,在优化好的提取条件下进行了加标回收实验,在实验过程中,对料液比(配制样品溶液时样品与水的体积比)进行了选择,从而将基质效应的影响降到最低。
表4 不同料液比条件下不同样品的加标回收实验结果
Table 4 Recoveries of patulin from spiked blank samples with different solid-to-liquid ratios

料液比加标回收率/%(V/V)苹果浓缩苹果汁酿酒葡萄葡萄酒1∶9 71.36±0.36 85.51±0.11 88.74±0.08 89.17±0.04 2∶8 76.49±0.31 78.05±0.05 77.06±0.13 72.59±0.02 1∶1 78.35±0.09 67.92±0.04 78.35±0.15 80.29±0.07 7∶3 91.08±0.34 0±0.00 79.55±0.02 78.87±0.07纯样品90.15±0.04 0±0.00 72.45±0.07 71.35±0.14
由表4可知,对于苹果样品,当其料液比为7∶3时加标回收率为91.08%,达到最大,与直接使用纯样品结果相差不大,而在其他料液比条件下回收率都相对较低,这可能是因为固体样品在均质过程中已加入了部分水分,减弱了基质效应,因此较大的样品量对回收率的影响并不明显。对于浓缩苹果汁,其样品呈黏稠状,样品量过大,则基质效应明显,干扰回收,这与实验结果相吻合,当料液比为1∶9时回收率最大为85.51%。酿酒葡萄与葡萄酒成分都较为复杂,最大区别在于后者含有乙醇,乙醇的存在可能会改变棒曲霉素在水系基质中的溶解性,从而影响其回收率,但由表中数据可知,乙醇对棒曲霉素提取的影响并不一致,分析可能是因为葡萄酒基质中的脂肪酸、酯类、醇类和糖类等都可能与棒曲霉素一起被提取出来 [23],从而影响棒曲霉素在葡萄酒中的回收率,在二者的综合作用下回收率的变化规律并不明显。因此,当料液比为1∶9时,稀释了这些物质的质量浓度,从而减少基质的干扰,获得了较理想的回收率。
2.3 前处理方法比较
利用HPLC检测棒曲霉素时,将优化后的前处理方法与中华人民共和国出入境检验检疫行业标准SN/T 2008—2007《进出口果汁中棒曲霉毒素的检测方法 高效液相色谱法》进行了比较,结果如表5所示。
表5 HPLC检测棒曲霉素的前处理方法比较
Table 5 Comparison of pretreatment methods in HPLC analysis of patulin

萃取溶剂萃取方法萃取有机溶剂回收率/%次数用量/mL(n=8)本方法乙腈涡旋,NaCl分层1 7 85.51~91.08(NaCl诱导萃取)SN/T 2008—2007乙酸乙酯涡旋静置,Na 2CO 3净4 35 74.75~89.43(液液萃取)化,MgSO 4脱水
由表5可知,用乙腈进行萃取的样品前处理过程更加简单快速,萃取次数少,溶剂使用量仅为行标方法的1/5,节约了实验成本,且回收率与行标方法相当,满足样品检测要求。同时,由于避免了Na 2CO 3溶液的使用,降低了棒曲霉素的损失,因此,该样品前处理方法具有更大的优势。
2.4 实际样品检测结果
以完整、健康的样品为对照,取不同腐烂程度的苹果、酿酒葡萄及其相关产品进行检测,按1.3.3节的方法进行前处理,按1.3.2节的HPLC条件进样分析,通过与棒曲霉毒素标准色谱图的保留时间及其光谱图辅助定性,结果见图2,每个样品重复3 次。


图2 样品测定HPLC图
Fig. 2 HPLC Chromatograms of different matrix samples
由表6可知,除葡萄酒样品和健康样品棒曲霉素含量低于检测限(小于10 μg/kg)外,其余样品均有棒曲霉素检出,且腐烂苹果样品含量最高,达到243.67 μg/kg。此外,通过NaCl诱导相变萃取方法和SN/T 2008—2007方法对样品检测结果的比较发现,NaCl诱导相变萃取的检测结果除了与行标方法具有相当的准确度外,溶剂使用量仅为行标方法的1/5,不仅实现了样品的自动浓缩且重复性好,故使用NaCl诱导相变萃取能够对棒曲霉素进行简单快速的提取。再者,用优化的前处理方法对实际样品进行检测时,虽在腐烂的葡萄上能检出棒曲霉素,但在葡萄酒中棒曲霉素的含量低于检出水平,其具体原因还有待进一步的研究。
表6 不同处理的样品含量测定结果(n=3)
Table 6 Results obtained for samples measured with different treatment methods (n=3) μg/L
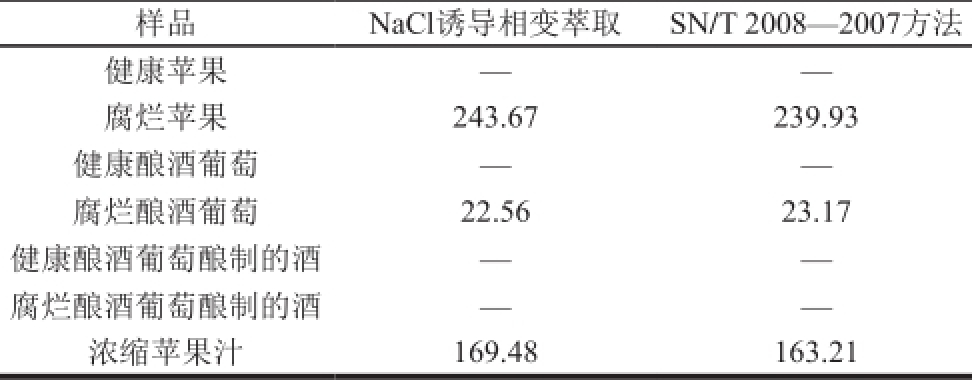
注:—.低于检出限。
样品NaCl诱导相变萃取SN/T 2008—2007方法健康苹果——腐烂苹果243.67 239.93健康酿酒葡萄——腐烂酿酒葡萄22.56 23.17健康酿酒葡萄酿制的酒——腐烂酿酒葡萄酿制的酒——浓缩苹果汁169.48 163.21
本实验利用响应面法优化溶剂诱导分相萃取棒曲霉素的结果可靠,得到水系基质中棒曲霉素的最佳提取条件为乙腈-样品体积比7∶3、NaCl添加量1.4 g/3 mL样品、提取温度34 ℃。在此条件下,棒曲霉素转移率为90.47%,与预测值(91.41%)相差不大。影响棒曲霉素转移率大小的因素主次顺序为Na Cl添加量>提取温度>乙腈-样品体积比。在优化条件下,苹果样品的最优料液比为7∶3(V/V),浓缩苹果汁、酿酒葡萄和葡萄酒样品的最优料液比都为1∶9(V/V),对应的加标回收率分别为91.08%、85.51%、88.74%、89.17%。
将Na Cl诱导相变萃取方法和液液萃取方法比较发现,NaCl诱导相变萃取的检测结果除了与液液萃取方法具有相当的准确度外,溶剂使用量仅为液液萃取方法的1/5,既实现了样品的自动浓缩,又获得了好的重复性,故NaCl诱导相变萃取是一种稳定可靠的前处理方法。
参考文献:
[1] MOUKAS A, PANAGIOTOPOULOU V, MARKAKI P. Determination of patulin in fruit ju ices u sing HPLC-DAD and GC-MSD techniques[J]. Food Chemistry, 2008, 109(4): 860-867. DOI:10.1016/ j.foodchem.2008.01.015.
[2] BONERBA E, CECI E, CONTE R, et al. Survey of the presence of patulin in fruit juices[J]. Food Additives and Contaminants: Part B, 2010, 3(2): 114-119. DOI:10.1080/19393210.2010.490882.
[3] MORALES H, MARIN S, CENTELLES X, et al. Cold and ambienr deck storage prior to processing as a critical control point for patulin accumulation[J]. International Journal of Food Microbiology, 2007, 116(2): 260-265. DOI:10.1016/j.ijfoodmicro.2007.01.004.
[4] DÍAZ G A, YAÑEZ L, GUZMÁN B L. Low occurrence of patulinproducing strains of Penicillium in grapes and patulin degradation during winemaking in chile[J]. American Journal of Enology and Viticulture, 2011, 62(4): 268-272. DOI:10.5344/ajev.2011.11034.
[5] SCOTT P M, FULEKI T, HARWIG J. Patulin content of juice and wine produced from moldy grapes[J]. Journal of Agricultural and Food Chemistry, 1977, 25(2): 434-437. DOI:10.1021/jf60210a024.
[6] OUGH C S, CORISON C A. Measurement of patulin in grapes and wines[J]. Journal of Food Science, 2006, 45(3): 476-478. DOI:10.1111/ j.1365-2621.1980.tb04079.x.
[7] Official Journal of the European Communities. Commission Regulation (EC) No.1881/2006 of (December 2006) setting maximum levels of certain contaminants in foodstuffs[S].
[8] MOAKE M M, PADILLA-ZAKOUR O I, WOROBO R W. Comprehensive review of patulin control methods in foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2005, 4(1): 8-21. DOI:10.1111/j.1541-4337.2005.tb00068.x.
[9] Codex Alimentarius Commission/Recommended Code of Practice. Code of practice for the prevention and reduction of patulin contamination in apple juice and apple juice ingredients in other beverages[S].
[10] 卫生部. 食品中真菌毒素限量: GB 2761—2011[S]. 北京: 中国标准出版社, 2011.
[11] 李静, 徐银, 操庆国. 棒曲霉素检测方法研究进展[J]. 中国科技信息, 2011, 73(24): 122-123.
[12] SHEPHARD G S, LEGGOTT N L. Chromatographic determination of the mycotoxin patulin in fruit and fruit juices[J]. Journal of Chromatography A, 2000, 882(1/2): 17-22. DOI:10.1016/S0021-9673(99)01341-2.
[13] 毛艳玲, 蔡艳, 罗昊轩, 等. 苹果中展青霉素的气相色谱-质谱检测研究[J]. 核农学报, 2015, 29(9): 1757-1765. DOI:10.11869/ j.issn.100-8551.2015.09.1757.
[14] BELTRÁN E, IBÁEZ M, SANCHO J V, et al. Determination of patulin in apple and derived products by UHPLC-MS/MS. Study of matrix effects with atmospheric pressure ionisation sources[J]. Food Chemistry, 2014, 142(1): 400-407. DOI:10.1016/ j.foodchem.2013.07.069.
[15] MURILLO-ARBIZU M, GONZÁLEZ-PEAS E, AMÉZQUETA S. Comparison between capillary electrophoresis and high performance liquid chromatography for the study of the occurrence of patulin in apple juice intended for infants[J]. Food and Chemical Toxicology, 2010, 48 (8/9): 2429-2434. DOI:10.1016/j.fct.2010.06.003.
[16] 周克权, 王君, 刘秀梅. 苹果汁中展青霉素和羟甲基糠醛的高效液相色谱测定方法[J]. 中国食品学报, 2003, 3(3): 24-29. DOI:10.3969/ j.issn.1009-7848.2003.03.005.
[17] 孟瑾, 黄菲菲, 吴榕, 等. 高效液相色谱法测定苹果及山楂制品中的展青霉素[J]. 上海农业学报, 2009, 25(1): 27-31. DOI:10.3969/ j.issn.1000-3924.2009.01.007.
[18] 李静, 岳田利, 陈冬梅, 等. 基于SPE-HPLC的浓缩苹果汁中棒曲霉素检测方法的研究[J]. 食品科技, 2007, 32(5): 242-245.
[19] 张鸣珊, 刘国柱, 李圣军, 等. 溶剂诱导相变萃取法用于高效液相色谱-质谱分析的血浆样品前处理[J]. 高等学校化学学报, 2010, 31(8): 1517-1521.
[20] SIN H N, YUSOF S, HAMID N S A, et al. Optimization of hot water extraction for sapodilla juice using response surface methodology[J]. Journal of Food Engineering, 2006, 75(3): 352-358. DOI:10.1016/ j.jfoodeng.2005.03.005.
[21] 邹建国, 刘飞, 刘燕燕, 等. 响应面法优化微博辅助提取枳壳中总黄酮工艺[J]. 食品科学, 2012, 33(2): 24-28.
[22] 吴晖, 赖富饶, 胡筱波. 响应面分析法优化油菜花粉多糖提取工艺的研究[J]. 食品与机械, 2007, 23(5): 66-70. DOI:10.3969/ j.issn.1003-5788.2007.05.019.
[23] IONARA R P, ANDRE D K, JOS S, et al. Development optimization and validation of a multimethodfor the determination of 36 mycotoxins in wines by liquid chromatography-tandem mass spectrometry[J]. Talanta, 2014, 129: 352-363. DOI:10.1016/j.talanta.2014.05.017.
Optimization of Solvent Induced Phase Transition Extraction of Patulin from Aqueous Matrix by Response Surface Methodology for HPLC Analysis
CHEN Xia
1, WANG Bo
2, YE Rong
3, LI Min
1, ZHOU Jigen
1, ZHANG Bo
1, HAN Shunyu
1,*
(1. Key Laboratory of Viticulture and Oenology of Gansu Province, College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China; 2. Central Laboratory of Technical Center of Gansu Entry-Exit Inspection and Quarantine Bureau, Lanzhou 730000, China; 3. College of Biological Sciences and Technology, Beijing Forestry University, Beijing 100083, China)
Abstract:Response surface methodology was adopted to optimize the extraction of patulin from an aqueous matrix. Meanwhile, the optimal solid-to-liquid ratios (V/V) for four different aqueous matrixes were selected. Optimization of the extraction conditions for improved recovery of patulin was done by the combined use of one-factor-at-a-time method and response surface methodology. Recovery experiments were conducted with spiked samples at solid-to-liquid ratios using four different aqueous matrixes. The optimal extraction conditions established were as follows: acetonitrile to aqueous sample ratio, 7:3; NaCl dosage, 1.4 g/3 mL sample; and extraction temperature, 34 ℃. Under these conditions, the recovery of patulin was 90.47%, and the optimal solid-to-liquid ratios were 7:3 for apple pulp matrix and 1:9 for concentrated apple juice, wine grape and wine, giving a recovery of 91.08%, 85.51%, 88.74% and 89.17% from spiked samples, respectively. At the same time, over the entry-exit inspection and quarantine industry standard method (SN/T 2008-2007), the pre-treatment method was advantageous in terms of less solvent consumption, simple operation and good reproducibility. Collectively, we concluded that the solvent induced phase transition extraction of patulin optimized by response surface methodology yielded reliable predictions and it had the potential to provide a new pretreatment method for the extraction of patulin from aqueous matrices.
Key words:high performance liquid chromatography (HPLC); response surface methodology; patulin; aqueous matrix; solvent induced phase transition extraction
DOI:10.7506/spkx1002-6630-201706034
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)06-0215-06
收稿日期:2016-06-30
基金项目:国家自然科学基金地区科学基金项目(31160310)
作者简介:陈霞(1990—),女,硕士研究生,研究方向为农产品加工贮藏及葡萄酒安全。E-mail:841279724@qq.com
*通信作者:韩舜愈(1963—),男,教授,博士,研究方向为果蔬加工及葡萄酒风味化学。E-mail:gsndhsy@163.com
引文格式:
陈霞, 王波, 叶融, 等. 响应面试验优化溶剂诱导萃取水系基质中棒曲霉素工艺及其检测分析[J]. 食品科学, 2017, 38(6): 215-220. DOI:10.7506/spkx1002-6630-201706034. http://www.spkx.net.cn
CHEN Xia, WANG Bo, YE Rong, et al. Optimization of solvent induced phase transition extraction of patulin from aqueous matrix by response surface methodology for HPLC analysis[J]. Food Science, 2017, 38(6): 215-220. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706034. http://www.spkx.net.cn