表1 正交试验因素与水平
Table 1 Factors and their coded levels used for orthogonal array design
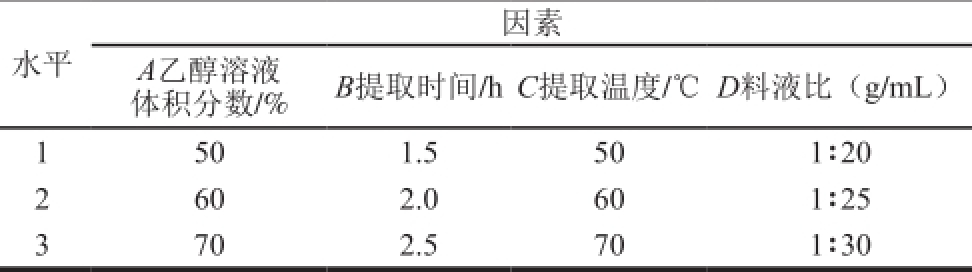
因素水平A乙醇溶液B提取时间/h C提取温度/℃D料液比(g/mL)体积分数/% 1 50 1.5 50 1∶20 2 60 2.0 60 1∶25 3 70 2.5 70 1∶30
张国强,郭晓东,薛文华,兰小中*
(西藏农牧学院,西藏 林芝 860000)
摘 要:以西藏野生卷叶黄精为原料,用乙醇提取其中的多酚类物质,通过单因素试验和正交试验,探讨提取温度、料液比、乙醇溶液体积分数和提取时间对多酚提取效果的影响并确定最佳提取工艺。利用DPPH自由基、超氧阴离子自由基、羟自由基活性检测法,研究其抗氧化活性。结果表明:提取温度70 ℃、料液比1∶25(g/mL)、乙醇溶液体积分数70%、提取时间2.5 h时,多酚提取量最大,达到19.8 mg/g;以VC为对照,在最优工艺条件下测定多酚提取物清除能力,多酚提取物具有较强的抗氧化活性,是一种极具潜力的天然抗氧化剂。
关键词:卷叶黄精;多酚;提取;抗氧化活性
卷叶黄精(Polygonatum cirrhifolium),属于百合科(Liliaceae)黄精属(Ploygonatum)多年生草本植物,为常用药食同源中药,藏名译音“可口梨”。黄精性味甘平,具有补气养阴、降血压、降血糖、降血脂、润肺、益肾、健脾等功效,被誉为“长生不老和延年益寿”药。汉朝的《神农本草经》、明朝的《本草纲目》和藏医名著《晶珠本草》均有其药膳食补功效的记载 [1]。黄精主要含有多糖、皂苷、生物碱、氨基酸、木脂素、黄酮、酚类、蒽醌等多种化学成分 [1]。陈克克等 [2]认为黄精多酚类化合物可能是一些活性因子,使得黄精发挥多种药理作用。
多酚是一类具有多羟基酚类化合物的总称,包括黄酮类、单宁类、酚酸类以及花色苷类等,是一种具有清除活性自由基、降糖降脂、抗衰老、防辐射和抗氧化等活性的天然抗氧剂 [3],存在于植物、果蔬及药材中 [4],是一种次级代谢产物。植物多酚主要从植物的根、皮、果、叶中提取,已有研究表明多酚类物质具有清除活性过氧自由基、延缓衰老、预防心血管疾病、抗癌、抗凝血、抗过敏、抗炎等生理功能 [4-7],此外还是一种天然抗氧化剂。多酚类物质的多种功能使其在食品、医药、化学及化妆品等领域日益成为关注的研究对象 [8-9]。
目前有关黄精的研究主要集中在滇黄精(P o lyg on a tum kin gia nu m Coll. Et Hemsl)、多花黄精(Polygonatum cyrtonema)和黄精(Polygonatum sibircum Red.),而关于卷叶黄精(Polygonatum cirrhifolium)的研究相对较少 [10]。研究表明,黄精、多花黄精、滇黄精和卷叶黄精,在植物形态上具有比较明显的区别,具有相似的化学成分,但各化学成分含量具有明显的区别 [11]。黄精中多糖的提取和抗氧化活性已有部分研究 [12-13],而关于黄精中的多酚类物质的提取和抗氧化活性研究以及西藏野生卷叶黄精中的多酚类物质研究鲜见报道。为充分利用黄精资源,进一步提高其经济价值,本实验以西藏野生卷叶黄精为原料,研究探讨其多酚类物质的最佳提取工艺,并研究提取物的抗氧化活性。通过研究为西藏野生卷叶黄精的综合利用和生产天然抗氧化剂以及功能性食品开发提供参考依据。
1.1 材料与试剂
野生黄精采自西藏林芝市巴宜区,由西藏农牧学院兰小中教授鉴定为卷叶黄精(P o ly g o n a tu m cirrhifolium)。
没食子酸标准品 国药集团化学试剂有限公司;福林-酚试剂 上海喜润化学工业有限公司;1,1-二苯基-2-三硝基苯肼(1,1-d iph enyl-2-p icrylhyd razy l,DPPH) 美国Sigma公司;浓盐酸、Tris-HCl萃取液、邻苯三酚、无水乙醇、石油醚、碳酸钠、硫酸亚铁、过氧化氢、水杨酸、VC均为国产分析纯试剂。
1.2 仪器与设备
UV-2100型紫外-可见分光光度计 上海尤尼柯仪器有限公司;30B型粉碎机 江阴市丰华药化机械厂;RE-8 6型旋转蒸发仪 上海本波仪器有限公司;FDU-2100型冷冻干燥器 日本Eyela公司;JA-2004型电子天平 上海精天电子仪器厂;80-2B型离心机 上海安亭科学仪器厂;GZX-9146MBE型电热恒温鼓风干燥箱上海博讯实业有限公司医疗设备厂;HH-6型数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 黄精预处理
将成熟的黄精切片,并于45 ℃恒温干燥箱中持续烘12 h,然后将温度升至60 ℃继续烘8 h至黄精达到完全干燥状态,然后将其取出。利用粉碎机将其粉碎,过60 目筛,粉碎后的黄精粉末呈灰黄色,于60 ℃恒温干燥箱中干燥2 h直到恒质量,冷藏避光保存备用。
1.3.2 多酚提取工艺流程
黄精→预处理→粉碎过40 目筛→筛分→石油醚脱脂→乙醇恒温水浴提取→过滤→取滤液离心→多酚粗提液。
1.3.3 多酚的提取工艺优化
采用单因素试验和正交试验设计进行优化。单因素为乙醇溶液体积分数、提取温度、料液比和提取时间。试验中每个因素水平提取3 次,算出平均值即为多酚提取量。在单因素试验的基础上,采用正交试验进一步优化,试验设计如表1所示。
表1 正交试验因素与水平
Table 1 Factors and their coded levels used for orthogonal array design

因素水平A乙醇溶液B提取时间/h C提取温度/℃D料液比(g/mL)体积分数/% 1 50 1.5 50 1∶20 2 60 2.0 60 1∶25 3 70 2.5 70 1∶30
1.3.4 没食子酸标准曲线
采用福林-酚法测定 [2,1 3-1 5]。准确称取0.250 0 g没食子酸,加入20 mL体积分数60%乙醇溶液溶解并用蒸馏水稀释定容至100 mL,得到没食子酸标准液质量浓度为0.500 mg/mL。分别吸取1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mL于1~8号25 mL具塞比色管中,各加入2 mL福林-酚试剂,混合均匀,在5 min内加入5 mL 20%碳酸钠溶液,最后稀释定容至25 m L,然后在50 ℃恒温水浴中加热45 min,避光静置冷却。以试剂空白作参比溶液,即加入2 mL福林-酚试剂和5 mL 20%碳酸钠溶液稀释定容至25 mL,记作0号管。用1 cm比色皿于波长765 nm处测定其吸光度。进行重复实验,每个质量浓度平行测定3 次,求其平均值,以没食子酸质量浓度为横坐标、吸光度为纵坐标绘制标准曲线,得到吸光度A与没食子酸标准溶液质量浓度(C,mg/L)之间方程为A=0.121 5C+ 0.0 5 1 7,R 2为0.9 9 7 1,在所取的质量浓度范围内(1.0~8.0 mg/L)具有较好的线性相关性。
1.3.5 多酚提取量的测定
取黄精多酚提取液1.0 mL,置于50 mL具塞比色管中,记作1号试样管,按没食子酸标准曲线制作的方法测定黄精多酚吸光度。即加入2 mL福林-酚试剂,混合均匀,在5 min内加入5 mL 20%碳酸钠溶液,最后稀释定容至50 mL。然后在50 ℃恒温水浴中加热45 min。避光静置冷却,然后以试剂空白作参比溶液,即加入2 mL福林-酚试剂和5 mL 20%碳酸钠溶液稀释定容至50 mL,记作0号对比管。用1 cm比色皿于波长765 nm处测定其吸光度 [16]。利用标准曲线或回归方程通过吸光度来计算样品中多酚含量 [17],按公式(1)计算。
式中:C为没食子酸的质量浓度/(mg/mL);V为溶液体积/mL;n为稀释倍数;m为取样量/g。
1.3.6 抗氧化活性检测
1.3.6.1 DPPH自由基清除率测定 [18-22]
首先用无水乙醇配制2×10 -4mol/L的DPPH溶液,避光贮存于室温条件下备用。然后取不同质量浓度(40.0、80.0、120.0、240.0、340.0、440.0 mg/L)的黄精多酚溶液各2.0 mL于1~6号25 mL具塞试管,然后分别加入2×10 -4mol/L DPPH溶液2.0 mL,充分摇匀混合,在室温条件下放置30 min后,以无水乙醇作参比液,测定其在波长5l7 nm处的吸光度A 1;再测定2.0 mL 2×10 -4mol/L DPPH溶液与2.0 mL无水乙醇混合液吸光度A 0;最后测定2.0 mL多酚提取液与2.0 mL无水乙醇混合液的吸光度A 2。进行3 次平行测定,计算平均值,进而计算吸光度和清除率。以蒸馏水作空白参比液,记作0号管,VC作标准抗氧化剂。DPPH自由基清除率按公式(2)计算:
1.3.6.2 超氧阴离子自由基(
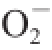 ·)清除率测定
[23-26]
·)清除率测定
[23-26]
取不同质量浓度(20.0、40.0、60.0、80.0、100.0、120.0 mg/L)的黄精多酚溶液各2.0 mL于1~6号25 mL具塞试管,然后分别加入0.05 mol/L的Tris-HCl缓冲溶液(p H 8.2)2.5 mL,稀释定容至刻度,再加入30 mmol/L邻苯三酚溶液0.5 mL,混合摇匀。将其置于25 ℃条件下恒温水浴中反应10 min,取该混合液2.0 mL于比色皿中,测定其在波长325 nm处的吸光度A
325
nm,每隔3 0 s测定1 次,4 min后加入8 mol/L盐酸终止,反应结束,以时间为横坐标、吸光度为纵坐标绘制线性图,该图的斜率即为ΔA
0、ΔA。进行3 次平行测定,计算平均值和清除率。以蒸馏水作空白参比溶液,记作0号管,VC作标准抗氧化剂。
 ·清除率按公式(3)计算:
·清除率按公式(3)计算:
1.3.6.3 羟自由基(·OH)清除率测定 [27-29]
取不同质量浓度(5.0、10.0、15.0、20.0、40.0、60.0 mg/mL)的黄精多酚溶液各2.0 mL于1~6号25 mL具塞试管,然后分别加入2.0 mL 6 mmol/L的硫酸亚铁溶液和2.0 mL 6 mmol/L的过氧化氢溶液,静置10 min,再加入6 mmol/L的水杨酸溶液2.0 mL,充分摇匀混合,在室温条件下静置30 min后,以无水乙醇作参比液,测定其在波长510 nm处的吸光度A 1;再用无水乙醇代替多酚提取液测定混合液的吸光度A 0;最后用无水乙醇代替水杨酸测定混合液的吸光度A 2。进行3 次平行测定,计算平均值和清除率。以蒸馏水作空白参比溶液,记作0号管,VC作标准抗氧化剂。·OH清除率按公式(4)计算:
2.1 单因素试验结果
2.1.1 乙醇溶液体积分数对多酚提取量的影响
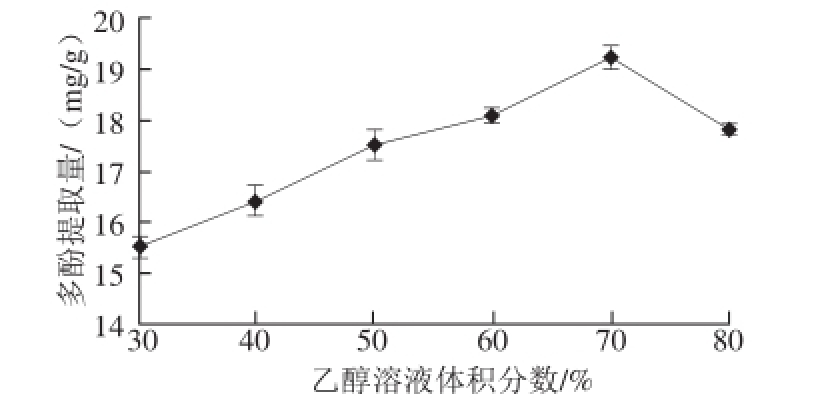
图1 乙醇溶液体积分数对多酚提取量的影响
Fig. 1 Effect of ethanol concentration on the extraction efficiency of polyphenols
准确称取黄精粉末6 份,每份0.5 g。在乙醇溶液体积分数分别为30%、40%、50%、60%、70%、80%的溶剂中,提取2 h,其他条件均相同,其中料液比1∶20,提取温度60 ℃。由图1可知,多酚提取量随乙醇溶液体积分数的增加显著增大(P<0.05),在70%时达到最大值为(19.2±0.2)mg/g,随后逐渐减小。可能原因是多酚类物质与蛋白质、多糖、生物碱通过氢键、疏水键结合,乙醇溶液体积分数较低时,水溶性糖类等物质会溶出,影响多酚的提取,随着乙醇溶液体积分数的增加,多酚与乙醇溶剂的极性越来越接近,根据相似相溶原理,多酚的提取量会增大,同时乙醇为有机溶剂在一定浓度条件下能有效地破坏氢键和疏水键也有利于多酚的溶出;但乙醇溶液体积分数过高时,一些脂溶性成分会浸出,同时乙醇与多酚类物质极性差异变大,还有乙醇溶液在高体积分数条件下会挥发出来,这些都会影响多酚的提取效果 [30]。
2.1.2 提取时间对多酚提取量的影响
准确称取黄精粉末8 份,每份0.5 g。在60 ℃恒温水浴中分别提取1、1.5、2、2.5、3、3.5、4、4.5 h,其他条件均相同,其中料液比1∶2 0,乙醇溶液体积分数60%,提取温度60 ℃。由图2可知,多酚提取量随提取时间的延长显著增大(P<0.05),在2.5 h时达到最大值为(18.9±0.2)mg/g,随后逐渐减小,最后趋于稳定。可能原因是提取时间越长,浸提液与被提物质作用时间也越长,有利于多酚类物质的释放;但当时间过长时,由于多酚不稳定,提取中会有氧气进入,导致多酚氧化分解,同时也使能耗增加,多酚提取量下降。综合考虑,最佳提取时间为2.5 h。

图2 提取时间对多酚提取量的影响
Fig. 2 Effect of extraction time on the extraction efficiency of polyphenols
2.1.3 提取温度对多酚提取量的影响

图3 提取温度对多酚提取量的影响
Fig. 3 Effect of temperature on the extraction efficiency of polyphenols
准确称取黄精粉末7 份,每份0.5 g。分别置于30、40、50、60、70、80、90 ℃水浴条件下,提取2 h,其他条件均相同,其中料液比1∶20,乙醇溶液体积分数60%。由图3可知,多酚提取量随温度的升高显著增大(P<0.05),在70 ℃时达到最大值为(19.4±0.3)mg/g,随后逐渐减小。可能原因是温度升高,分子热运动速度加快,更有利于多酚类物质的扩散、溶出、渗透,溶剂渗透作用也增大,因而多酚提取量提高;但温度过高时多酚类不稳定易发生氧化、聚合或降解,乙醇在高温条件下也会因挥发而损失,不利于多酚提取,因而多酚提取量降低。2.1.4 料液比对多酚提取量的影响
准确称取黄精粉末7 份,每份0.5 g。当料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g/mL)时,提取2 h,其他条件均相同,其中提取温度60 ℃,乙醇溶液体积分数为60%。由图4可知,多酚提取量随料液比的减小显著增大(P<0.05),在料液比1∶25时达到最大值为(18.5±0.1)mg/g,随后逐渐减小最后趋于稳定。可能原因是多酚类物质与蛋白质、多糖、生物碱通过氢键、疏水键结合,有机溶剂可以起到破坏结合键的作用,因而在一定范围内,通过增加溶剂的用量可以促进多酚的溶出。随着溶剂的用量增加,多酚的溶出已达极限,而有机溶剂继续溶出了较多的色素、非多酚醇溶性杂质等成分,从而影响了多酚的提取效果,导致多酚提取量逐渐减小直至稳定。
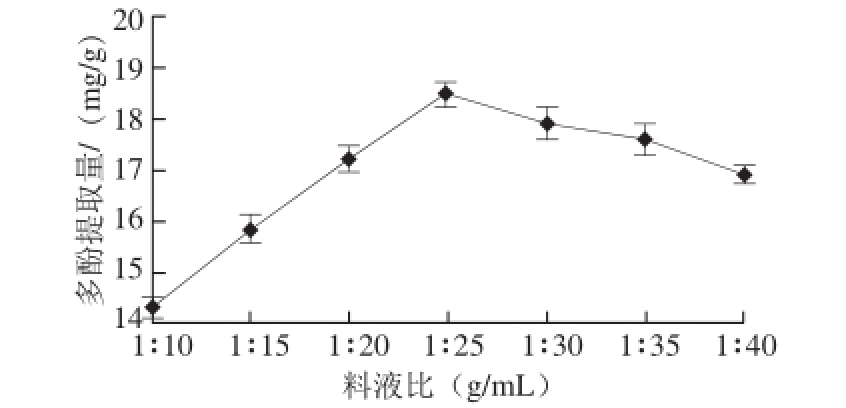
图4 料液比对多酚提取量的影响
Fig. 4 Effect of solid-to-liquid ratio on the extraction efficiency of polyphenols
2.2 正交试验设计及结果
通过单因素试验可以看出,黄精中多酚提取量受乙醇溶液体积分数、提取时间、提取温度和料液比这4 个因素的影响较大。故设计四因素三水平L 9(3 4)正交试验,考察结果用多酚提取量来表示,并对优组合进行验证实验。
表2 正交试验设计及结果
Table 2 Orthogonal array design with experimental results
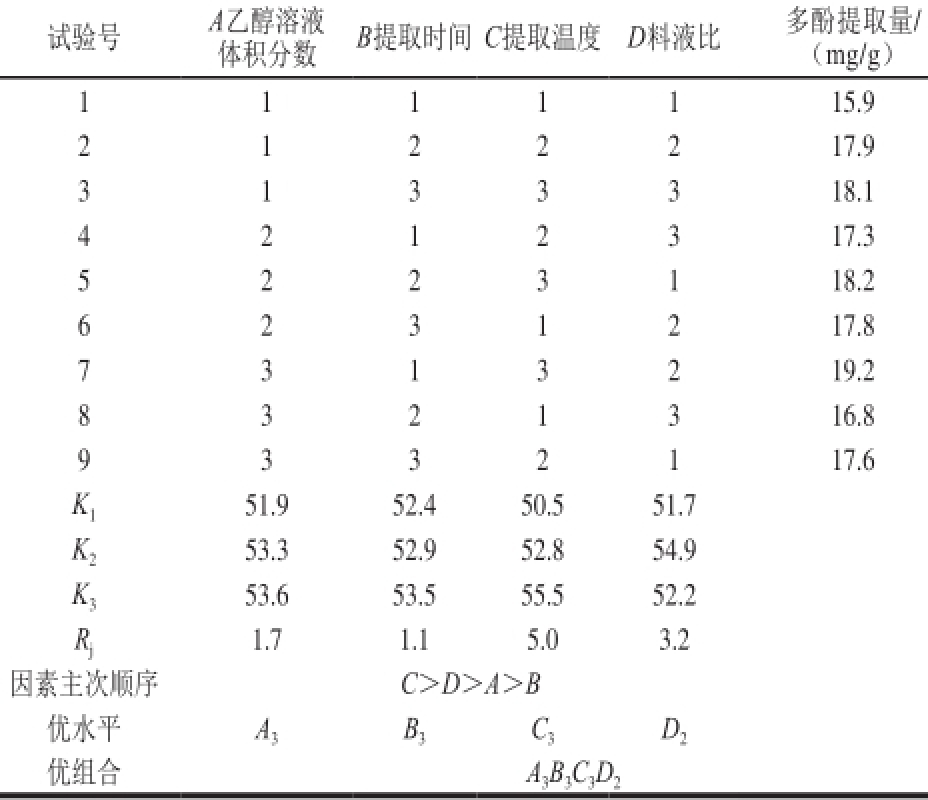
试验号A乙醇溶液B提取时间C提取温度D料液比多酚提取量/体积分数(mg/g)1 1 1 1 1 15.9 2 1 2 2 2 17.9 3 1 3 3 3 18.1 4 2 1 2 3 17.3 5 2 2 3 1 18.2 6 2 3 1 2 17.8 7 3 1 3 2 19.2 8 3 2 1 3 16.8 9 3 3 2 1 17.6 K 151.9 52.4 50.5 51.7 K 253.3 52.9 52.8 54.9 K 353.6 53.5 55.5 52.2 R j1.7 1.1 5.0 3.2因素主次顺序 C>D>A>B优水平A 3B 3C 3D 2优组合A 3B 3C 3D 2
表3 正交试验方差分析
Table 3 Analysis of variance of the extraction efficiency of polyphenols with various extraction conditions

注:F 0.05(2,2)=19.00;F 0.01(2,2)=99.00;*.P<0.05,差异显著。
因素平方和自由度均方F值A乙醇溶液体积分数 0.548 9 2 0.274 4 2.71误差e(B提取时间)0.202 2 2 0.101 1 1.00 C提取温度4.175 6 2 2.087 8 20.65* D料液比1.975 6 2 0.987 8 9.77总和6.902 2 8
由表2可知,影响多酚提取效果的四因素主次顺序为C>D>A>B,即提取温度>料液比>乙醇体积分数>提取时间;提取最佳工艺条件为A 3B 3C 3D 2,即乙醇溶液体积分数70%、提取时间2.5 h、提取温度70 ℃、料液比1∶25。
由表3可知,F 0.05(2,2)<F 提取温度<F 0.01(2,2),所以提取温度对多酚提取效果有显著影响;F 乙醇溶液体积分数<F 0.05(2,2),F 提取时间<F 0.0 5(2,2),F 料液比<F 0.05(2,2),所以乙醇溶液体积分数、提取时间、料液比影响不显著。4个因素中,提取时间影响最小,可以当作试验误差进行处理,而其他3个因素中提取温度为主要影响因素。
2.3 提取最佳工艺验证实验
准确称取黄精粉末3 份,每份0.5 g,按照正交试验最佳提取工艺条件进行提取,即乙醇溶液体积分数70%、提取时间2.5 h、提取温度70 ℃、料液比1∶25,进行3 次重复性实验,验证黄精中多酚提取量。结果表明,经过验证实验,提取最佳工艺条件为A 3B 3C 3D 2,即乙醇溶液体积分数70%、提取时间2.5 h、提取温度70 ℃、料液比1∶25,多酚提取效果高于以上9 个试验组合,平均提取量为(19.8±0.1)mg/g,在此工艺条件下重复性好,稳定可行。
2.4 DPPH自由基清除能力的测定
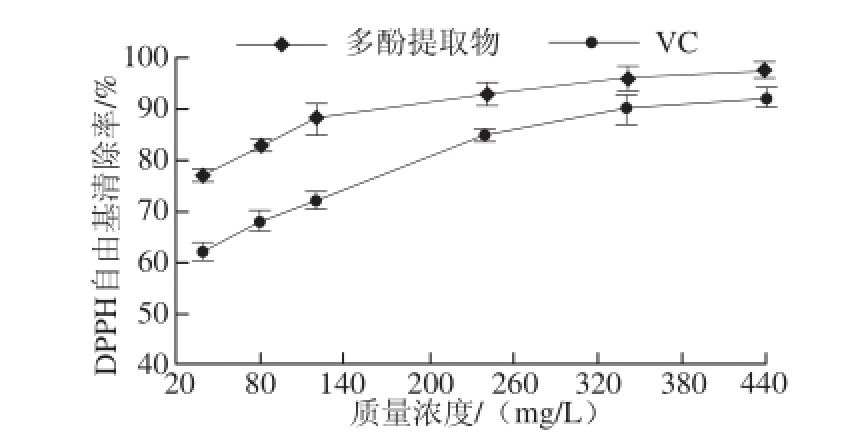
图5 不同质量浓度样品溶液对DPPH自由基清除效果
Fig. 5 DPPH free radical scavenging effect of polyphenols from Polygonatum cirrhifolium at different concentrations
由图5可知,多酚提取物和VC都有清除DPPH自由基的作用。随着多酚提取物和VC质量浓度的增大,其对DPPH自由基的清除能力均先逐渐增强最后趋于恒定。从整体来看,天然的黄精多酚提取物的DPPH自由基清除能力显著强于人工合成的VC(P<0.05)。一般选择黄精质量浓度不小于120.0 mg/L,有较强的抗氧化能力。结果表明多酚提取物质量浓度为440.0 mg/L时对DPPH自由基清除能力达到最大,清除率为(98.00±1.40)%。
2.5
 ·清除能力的测定
·清除能力的测定
由图6可知,多酚提取物和VC都有清除
 ·的作用。当多酚提取物质量浓度小于48.0 mg/L时,清除能力弱于VC;质量浓度为48.0 mg/L时,多酚提取物和VC清除能力相同;质量浓度大于48.0 mg/L时,多酚提取物清除能力显著强于VC(P<0.05),且随着多酚提取物质量浓度的增大,其对
·的作用。当多酚提取物质量浓度小于48.0 mg/L时,清除能力弱于VC;质量浓度为48.0 mg/L时,多酚提取物和VC清除能力相同;质量浓度大于48.0 mg/L时,多酚提取物清除能力显著强于VC(P<0.05),且随着多酚提取物质量浓度的增大,其对
 ·的清除能力也显著增强(P<0.05)。一般选择质量浓度不小于80.0 mg/L,有较强的抗氧化能力。结果表明多酚提取物质量浓度在120.0 mg/L时对
·的清除能力也显著增强(P<0.05)。一般选择质量浓度不小于80.0 mg/L,有较强的抗氧化能力。结果表明多酚提取物质量浓度在120.0 mg/L时对
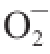 ·清除能力达到最大,清除率为(79.00±1.00)%。
·清除能力达到最大,清除率为(79.00±1.00)%。

图6 不同质量浓度样品溶液对
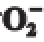 ·清除效果
·清除效果
Fig. 6 Superoxide anion free radical scavenging effect of polyphenols from Polygonatum cirrhifolium at different concentrations
2.6 ·OH清除能力的测定

图7 不同质量浓度样品溶液对·OH清除效果
Fig. 7 Hydroxyl free radical scavenging effect of polyphenols from Polygonatum cirrhifolium at different concentrations
由图7可知,多酚提取物和VC都有清除·OH的作用。多酚提取物和VC对·OH均有较强的清除能力,且随着样品质量浓度的增大,其对·OH的清除能力先逐渐增强最后趋于恒定。当多酚提取物质量浓度小于7.0 mg/L时,清除能力弱于VC;质量浓度等于7.0 mg/L时,多酚提取物和VC清除能力相同;质量浓度大于7.0mg/L时,多酚提取物清除能力显著强于VC(P<0.05)。一般选择质量浓度不小于40.0mg/L,有较强的抗氧化能力。结果表明多酚提取物质量浓度在60.0 mg/L时对·OH清除能力达到最大,清除率为(88.00±1.80)%。
黄精中多酚提取物的最优组合为乙醇溶液体积分数70%、提取时间2.5 h、提取温度70 ℃、料液比1∶25,此时多酚提取量高达(19.8±0.1)mg/g。此方法原料为黄精粉末,成本较低,提取效果较好,适合大批量生产。
通过DPPH自由基、O 2 -·和·OH清除的抗氧化实验,证实黄精中多酚提取物比VC有更高的抗氧化性,可以作为优良的天然抗氧化物质,为进一步深入开展对其结构、活性的研究提供理论依据,并有望发展成为抗氧化功能性食品或食品添加剂,有利于提高黄精中多酚的综合利用价值。
参考文献:
[1] 庞玉新, 赵致, 袁瑷, 等. 黄精的化学成分及药理作用[J]. 山地农业生物学报, 2003, 22(6): 547-550. DOI:10.15958/j.cnki. sdnyswxb.2003.06.016.
[2] 陈克克, 史丽, 李莺, 等. 黄精总黄酮和总酚的含量测定[J]. 陕西农业科学, 2012, 58(1): 58-60. DOI:10.3969/j.issn.0488-5368.2012.01.021.
[3] 王雪飞, 张华. 多酚类物质生理功能的研究进展[J]. 食品研究与开发, 2012, 33(2): 211-214. DOI:10.3969/j.issn.1005-6521.2012.02.062.
[4] BALASUNDRAM N, SUNDRAM K, SAMMAN S. Phenolic compounds in plants and agri-industrial by-products: antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006, 99(1): 191-203. DOI:10.1016/j.foodchem.2005.07.042.
[5] QUINONES M, MIGUEL M, ALEIXANDRE A, et al. Beneficial effects of polyphenols on cardiovascular disease[J]. Pharmacological Research, 2013, 68(1): 125-131. DOI:10.1016/j.phrs.2012.10.018.
[6] 张力平, 孙长霞, 李俊清, 等. 植物多酚的研究现状及发展前景[J]. 林业科学, 2005, 41(6): 157-162. DOI:10.3321/j.issn:1001-7488.2005.06.027.
[7] 赵伟, 李建科, 何晓叶, 等. 几种常见植物多酚降血脂作用及机制研究进展[J]. 食品科学, 2014, 35(2): 258-263. DOI:10.7506/spkx1002-6630-201421051.
[8] 戴宛蓉, 傅群, 欧阳玉祝, 等. 田基黄多酚提取物对芝麻油的抗氧化稳定性研究[J]. 广东化工, 2013, 40(18): 23-24. DOI:10.3969/ j.issn.1007-1865.2013.18.012.
[9] 石碧, 狄莹. 植物多酚[M]. 北京: 科学出版社, 2000: 154-198.
[10] 陈辉, 冯珊珊, 孙彦君, 等. 3 种药用黄精的化学成分及药理活性研究进展[J]. 中草药, 2015, 46(15): 2329-2338. DOI:10.7501/ j.issn.0253-2670.2015.15.025.
[11] 孙哲. 三种黄精资源调查及卷叶黄精质量评价[D]. 北京: 北京中医药大学, 2009: 60-78.
[12] 毕研文, 杨永恒, 宫俊华, 等. 黄精和多花黄精中多糖及薯蓣皂苷元的含量测定[J]. 长春中医药大学学报, 2010, 26(5): 649-650. DOI:10.13463/j.cnki.cczyy.2010.05.063.
[13] 徐兵兵, 于勇杰, 吴帆, 等. 黄精多糖研究综述[J]. 中国野生植物资源, 2015, 34(4): 38-46. DOI:10.3969/j.issn.1006-9690.2015.04.009.
[14] 陈东方, 师俊玲, 胡新中. 纤维素酶水解处理提高燕麦全粉中总多酚含量与抗氧化活性[J]. 食品科学, 2016, 37(1): 56-62. DOI:10.7506/spkx1002-6630-201601011.
[15] CHEN Y S, CHEN G, FU X, et al. Phytochemical profiles and antioxidant activity of different varieties of Adinandra Tea (Adinandra Jack)[J]. Journal of Agricultural and Food Chemistry, 2015, 63(1): 169-176. DOI:10.1021/jf503700v.
[16] 赵国建, 肖春玲, 王向东, 等. 甘薯中多酚提取新工艺及抗氧化研究[J]. 中国食品学报, 2011, 11(5): 65-69. DOI:10.3969/ j.issn.1009-7848.2011.05.011.
[17] 张根生, 候静, 张铭东, 等. 松仁红衣多酚的提取及体外抗氧化活性研究[J]. 食品工业科技, 2014, 35(23): 252-256. DOI:10.13386/ j.issn1002-0306.2014.23.045.
[18] 陈敏佳, 蒋玉蓉, 袁俊杰, 等. 藜麦叶片多酚最佳提取工艺及其抗氧化性研究[J]. 中国粮油学报, 2016, 31(1): 101-106. DOI:10.3969/ j.issn.1003-0174.2016.01.020.
[19] 江慎华, 王书源, 马海乐, 等. 丁香活性物质提取工艺优化与抗氧化活性研究[J]. 农业机械学报, 2010, 41(1): 132-138. DOI:10.3969/ j.issn.1000-1298.2010.01.026.
[20] MEOT-DUROS L, CHRISTIAN M. Antioxidant activity and phenol content of C rithm u m maritim u m L. leaves[J]. Plant Physiology and Biochemistry, 2009, 47(1): 37-41. DOI:10.1016/j.plaphy.2008.09.006.
[21] 张晓璐, 徐凯宏. 山楂叶总黄酮清除DPPH和超氧阴离子自由基的活性研究[J]. 林业科技, 2008, 33(5): 51-54. DOI:10.3969/ j.issn.1001-9499.2008.05.018.
[22] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36. DOI:10.1016/j.foodchem.2004.01.075.
[23] 徐颖, 樊明涛, 冉军舰, 等. 不同品种苹果籽总酚含量与抗氧化相关性研究[J]. 食品科学, 2015, 36(1): 79-83. DOI:10.7506/spkx1002-6630-201501015.
[24] 马庆一, 张霞, 熊卫东, 等. 红薯梗中清除自由基活性成分的研究[J]. 食品科学, 2003, 24(6): 145-148. DOI:10.3321/j.issn:1002-6630.2003.06.038.
[25] 甘芝霖, 倪元颖, 郭悦, 等. 大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J]. 农业工程学报, 2015, 31(24): 298-306. DOI:10.11975/ j.issn.1002-6819.2015.24.045.
[26] 邹容, 游玉明, 陈泽雄, 等. 干燥方式对金银花多酚组分及其抗氧化活性的影响[J]. 食品科学, 2016, 37(5): 78-83. DOI:10.7506/ spkx1002-6630-201605015.
[27] 陈晨, 胡文忠, 田沛源, 等. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J]. 食品科学, 2014, 35(2): 12-17. DOI:10.7506/ spkx1002-6630-201402003.
[28] 刘琴, 张薇娜, 朱媛媛, 等. 不同产地苦荞籽粒中多酚的组成、分布及抗氧化性比较[J]. 中国农业科学, 2014, 47(14): 2840-2852. DOI:10.3864/j.issn.0578-1752.2014.14.014.
[29] 张艳军, 杨途熙, 魏安智, 等. 花椒果皮中总黄酮与多酚的积累及其抗氧化活性研究[J]. 西北植物学报, 2013, 33(3): 620-625. DOI:10.3969/j.issn.1000-4025.2013.03.028.
[30] 刘仙俊, 范向前, 史起鹏, 等. 燕麦总多酚的微波辅助提取工艺研究[J]. 食品研究与开发, 2016, 37(17): 55-59. DOI:10.3969/ j.issn.1005-6521.2016.17.015.
Extraction and Antioxidant Activities of Polyphenols from Tibetan Wild Polygonatum cirrhifolium
ZHANG Guoqiang, GUO Xiaodong, XUE Wenhua, LAN Xiaozhong*
(XiZang Agriculture and Animal Husbandry College, Linzhi 860000, China)
Abstract:This study aimed to optimize the extraction of polyphenols from Titeban wild Polygo natum cirrh ifolium using ethanol as the extraction solvent. Towards this goal, one-factor-at-a-time method and orthogonal array design were employed to analyze the effects of extraction temperature, solid to liquid ratio, ethanol concentration, and extraction time on extraction effi ciency. Furthermore, the antioxidant activities of polyphenol extracts were assessed by 1,1-diphenyl-2-picrylhydrazyl (DPPH), superoxide anion and hydroxyl free radical scavenging assays. The results showed the maximum extraction efficiency of polyphenols was achieved after 2.5 h extraction using 70% ethanol as the extraction solvent at a solid to solvent ratio of 1:25 (g/mL) at 70 ℃. The polyphenol extracts from P. cirrhifolium obtained under the optimized conditions had strong free radical scavenging capacities in comparison with VC, thus being a potential source of natural antioxidants.
Key words:Polygonatum cirrhifolium; polyphenols; extraction; antioxidant activity
DOI:10.7506/spkx1002-6630-201706037
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)06-0236-06
引文格式:
张国强, 郭晓东, 薛文华, 等. 西藏野生卷叶黄精多酚的提取及其抗氧化活性分析[J]. 食品科学, 2017, 38(6): 236-241.
DOI:10.7506/spkx1002-6630-201706037. http://www.spkx.net.cn
ZHANG Guoqiang, GUO Xiaodong, XUE Wenhua, et al. Extraction and antioxidant activities of polyphenols from Tibetan wild Po lygonatum cirrhifolium[J]. Food Science, 2017, 38(6): 236-241. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201706037. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:国家自然科学基金地区科学基金项目(31260371);西藏特色农牧资源协同创新中心-藏药材项目(2014-2016);
西藏自治区科技厅重点科研项目(2016-2017);西藏农牧学院青年骨干教师支持计划项目(2015XYD08)
作者简介:张国强(1982—),男,副教授,博士,研究方向为资源活性物质分离纯化。E-mail:guoqiang2008@163.com
*通信作者:兰小中(1973—),男,教授,博士,研究方向为药用植物生物化学与分子生物学。E-mail:lanxiaozhong@163.com