马 艳 1,李婷婷 2,*,崔方超 1,励建荣 1,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.大连民族大学生命科学学院,辽宁 大连 116600)
摘 要:为研究蜂房哈夫尼亚菌(Hafnia alvei)Ha-01生物被膜形成的过程及不同培养条件(碳源、p H值、NaCl质量分数、黏附材料)对其生物被膜形成的影响,采用超声波平板法及扫描电镜法研究不同培养条件下菌株Ha-01生物被膜活菌数及生长情况,并通过添加外源标准群体感应信号分子(N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,AHLs))中的C 6-HSL研究了AHLs与其生物被膜形成的关系。结果显示,菌株Ha-01生物被膜的形成与培养时间密切相关;在不同碳源的培养条件下形成生物被膜能力不同,其中在以木糖为培养基时形成量最大,达到7.51(lg(CFU/cm 2)),与在LB培养基中相比增加10.28%;在中性培养条件下更利于其生物被膜的形成,活菌数为7.77(lg(CFU/cm 2));在NaCl质量分数为2%时,其生物被膜产生量最大,活菌数为7.18(lg(CFU/cm 2));在不同黏附材料上生物被膜形成能力从大到小依次为铝片、锌片、玻璃片,活菌数分别为7.22、6.4 8、6.11(lg(CFU/cm 2));且添加C 6-HSL量越多,其生物被膜产生能力越强。研究表明,培养条件能够影响菌株Ha-01生物被膜形成,且AHLs可以调控其生物被膜形成。
关键词:蜂房哈夫尼亚菌;生物被膜;群体感应信号分子;培养条件
生物被膜是指微生物在生长过程中为适应外界环境而附着于生物或非生物物质表面,并通过分泌一些胞外聚合物将其包裹而形成的复杂三维多细胞结构,具有遗传差异性 [1-2]。生物被膜的形成与很多因素有关,如营养物质的减少、不良环境的抵抗等,一旦生物被膜形成,它们就很难被清除掉。同时,它们所分泌的胞外聚合物能够很好地抵抗可以杀死浮游菌的杀菌剂等物质 [3-4]。在食品生产加工过程中,细菌能够黏附在加工设备表面形成生物被膜,难以进行清除,它们不仅会腐蚀食品加工设备表面,同时会造成食品污染,影响食品安全 [5]。有研究表明,能够分泌信号分子并由细菌基因及其表型特征所调节的具有密度依赖性的群体感应(quorum sensing,QS)系统在生物被膜形成过程中起到重要作用,它们能够通过作用于细菌的胞外聚合物,进而降低其抗药性 [6]。如铜绿假单胞菌(P seudomonas a eruginosa)的las系统对其生物被膜结构的形成具有重要作用,AHLs可以通过调控细菌黏附作用、游动等来调控其生物被膜的产生 [7-8]。
蜂房哈夫尼亚菌(Hafn ia a lvei)为兼性厌氧型革兰氏阴性杆菌,有鞭毛,属于肠杆菌科蜂房哈夫尼亚属唯一一种细菌,既是细菌性食品污染菌,又是条件致病菌。目前已经有研究表明,蜂房哈夫尼亚菌能够形成生物被膜进行抵抗外界不良环境,进而维持其生长繁殖 [9-10],但是对于生长条件与蜂房哈夫尼亚菌生物被膜形成的关系及QS系统对其致病机制的影响等相关研究较少,所以研究不同培养条件及群体感应信号分子对其生物被膜形成的影响具有重要意义。
目前对于细菌生物被膜的测定包括定性和定量两个方面。其中定性检测包括显微镜技术法、银染法;定量检测主要包括平板擦拭法、超声波平板法、微孔板检测法等 [11-12]。由于生物被膜形成能够影响食品安全,所以对于生物被膜中活菌数的测定更为重要。而传统的采用结晶紫染色的96 孔板法,虽然能够较准确的反映生物被膜含量,但是只对实验室进行生物被膜研究比较有利 [13]。根据李焕新 [14]的研究可知,常规的采用微孔板法等吸光度测定法对生物被膜进行定量研究时,测定的为总细菌数,不能判断菌体的活性状态,而采用超声波平板计数法进行测定时,超声波作用能够使生物被膜从附着面有效分离,且能使细菌存活率在99%以上。
本实验以腐败大菱鲆中分离得到的一株蜂房哈夫尼亚菌为研究对象,通过超声波平板法和扫描电镜法研究了其生物被膜形成过程、不同培养条件下(碳源、p H值、NaCl质量分数、黏附材料)其生物被膜产生情况以及添加外源标准AHLs对生物被膜形成的影响,为进一步研究如何抑制蜂房哈夫尼亚菌生物被膜形成提供了一定的理论依据。
1.1 材料与试剂
1.1.1 菌株
蜂房哈夫尼亚菌Ha-01为渤海大学食品科学研究所保藏,使用时在LB液体培养基中,28 ℃、160 r/min摇床过夜培养活化。
1.1.2 试剂
C 6-HSL 美国Sigma公司;铝片、锌片 上海迈砷化工有限公司;LB液体培养基 北京陆桥生物技术有限公司。
AB培养基 [15]:Fe SO 4·7H 2O 0.0 02 5 g/L、Ca Cl 20.01 g/L、KCl 0.1 5 g/L、Mg SO 4·7 H 2O 0.3 g/L、NH 4Cl 1 g/L、NaH 2PO 41 g/L、K 2HPO 43 g/L、酪蛋白水解氨基酸5 g/L、不同碳源5 g/L。碳源分别为葡萄糖、木糖、蔗糖、果糖、乳糖和麦芽糖。
1.1.3 仪器与设备
S-4800场发射扫描电子显微镜 日本日立公司;LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;BPS-100CA恒温恒湿培养箱 上海一恒科技有限公司;MS105UD电子分析天平 梅特勒-托利仪器有限公司;SK8210HP超声波清洗器 上海科导超声仪器有限公司。
1.2 方法
1.2.1 材料预处理
玻璃片(普通盖玻片,10 mm×10 mm)预处理:置于2%盐酸溶液中浸泡24 h后,用蒸馏水洗净、烘干,灭菌备用。
铝片、锌片(纯度≥99.0%,厚度0.20 mm)预处理:首先将铝片、锌片分别用抛光机打磨去除表面氧化层后,切割成10 mm×10 mm大小,然后放入无水乙醇中超声15 min,再放入去离子水中超声15 min,然后烘干,灭菌备用。
1.2.2 超声波平板法测定不同培养条件对蜂房哈夫尼亚菌Ha-01生物被膜的影响
1.2.2.1 碳源对蜂房哈夫尼亚菌Ha-01生物被膜的影响
参照Jahid等 [16]的方法稍作修改进行测定。在灭菌后的培养皿中加入100 μL 10 7CFU/mL的蜂房哈夫尼亚菌Ha-01和10 mL LB液体培养基或含不同碳源的AB培养基,然后放入处理好的玻璃片,28 ℃条件下培养24 h后取出玻璃片,用无菌磷酸盐缓冲液冲洗3 次去除浮游菌,然后将玻璃片置于10 mL磷酸盐缓冲液中,53 kHz、25 ℃条件下超声处理10 min。将得到的菌悬液使用磷酸盐缓冲液进行梯度稀释,并采用平板计数法进行计数。
1.2.2.2 pH值及NaCl质量分数对菌株Ha-01生物被膜的影响
在灭菌后的培养皿中加入100 μL 10 7CFU/mL的蜂房哈夫尼亚菌Ha-01和10 mL不同pH值(5、6、7、8、9)或不同NaCl质量分数(0%、0.5%、1.0%、2.0%、3.0%、5.0%)的液体培养基,然后放入处理好的玻璃片,28 ℃条件下培养24 h。然后参照1.2.2.1节的方法进行测定。
1.2.2.3 黏附材料对菌株Ha-01生物被膜的影响
在灭菌后的培养皿中加入100 μL 10 7CFU/mL的蜂房哈夫尼亚菌Ha-01和10 mL LB液体培养基,然后分别放入处理好的玻璃片、铝片、锌片,28 ℃条件下培养24 h。然后按照1.2.2.1节方法进行测定。
1.2.2.4 外源标准C 6-HSL对菌株Ha-01生物被膜形成的影响
在灭菌后的培养皿中加入100 μL 10 7CFU/mL的蜂房哈夫尼亚菌Ha-01和10 mL含不同添加量(25、50、75、100 μL)的C 6-HSL(2 mg/mL)的LB液体培养基,然后放入处理好的玻璃片,28 ℃条件下培养24 h。然后按照1.2.2.1节方法进行测定。
1.2.3 扫描电子显微镜观察不同培养条件下菌株Ha-01生物被膜的形成
1.2.3.1 生物被膜形成过程的观察
参考邓旗 [17]的方法并稍作修改。在灭菌后的培养皿中加入100 μL 10 7CFU/mL的蜂房哈夫尼亚菌Ha-01和10 mL LB液体培养基,然后分别放入处理好的玻璃片,2 8 ℃条件下培养。取出不同培养阶段的玻璃片,用无菌水冲洗3 次,然后放入4 ℃预冷的2.5%戊二醛中浸泡4 h,取出后先分别放入50%、70%、80%、90%乙醇中浸泡10 min,再于100%无水乙醇中浸泡2 次,15 min/次,再经醋酸异戊酯置换2 次,15 min/次,取出后放入紫外灭菌后的超净台内自然风干。样品喷金后,使用扫描电子显微镜进行观察。
1.2.3.2 菌株Ha-01在不同载体材料上生物被膜的形成
在灭菌后的培养皿中加入100 μL 10 7CFU/mL蜂房哈夫尼亚菌Ha-01和10 mL LB液体培养基,然后分别放入处理好的玻璃片、铝片、锌片,28 ℃条件下培养24 h。然后按照1.2.3.1节方法进行处理。
1.2.3.3 菌株Ha-01在添加外源标准C 6-HSL时生物被膜的生长情况
在灭菌后的培养皿中加入100 μL 10 7CFU/mL的蜂房哈夫尼亚菌Ha-01和10 mL含不同添加量(25、50、75、100 μL)的C 6-HSL(2 mg/mL)的LB液体培养基,然后放入处理好的玻璃片,28 ℃条件下培养24 h。然后按照1.2.3.1节方法进行处理。
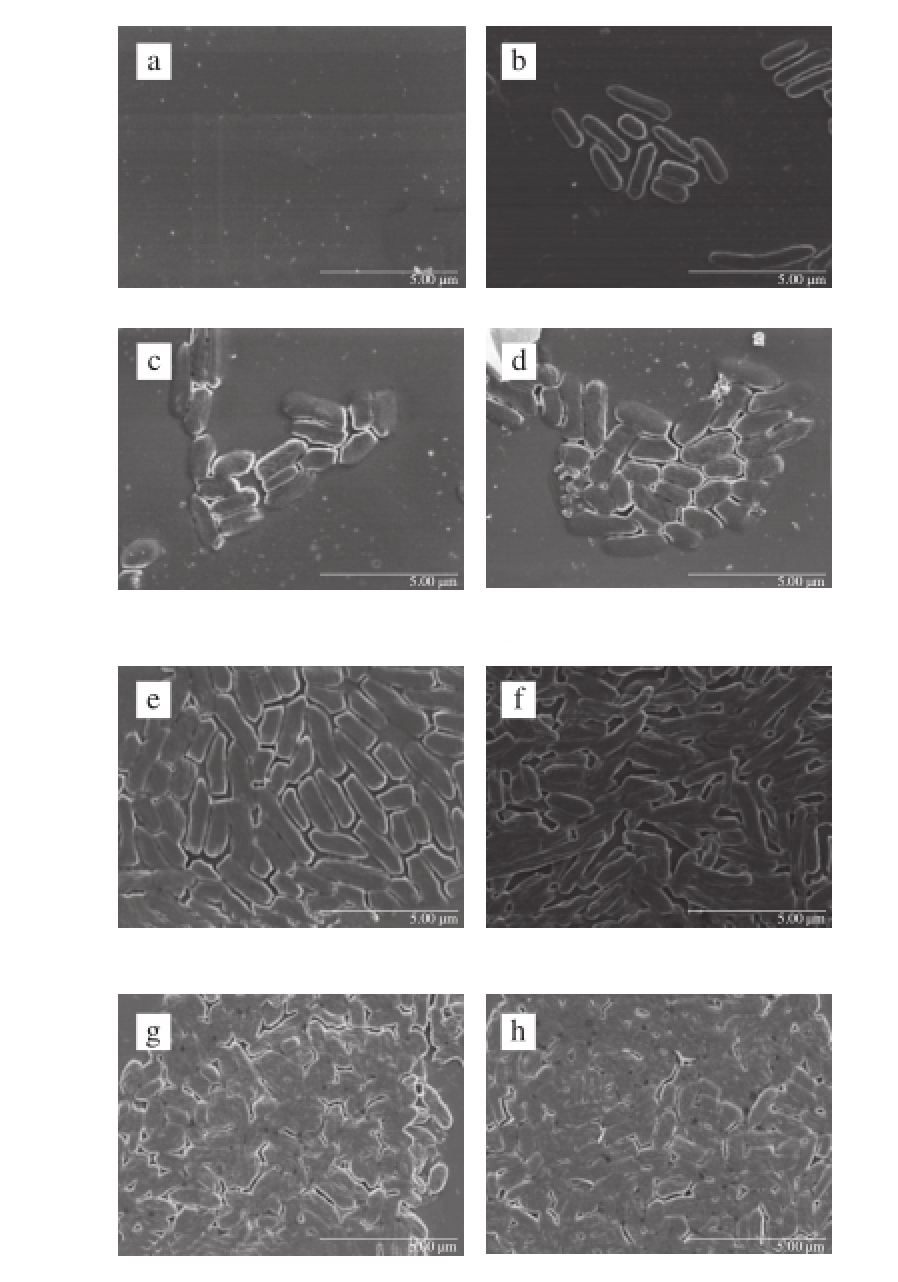
2.1 菌株Ha-01在玻璃片上形成生物被膜的动态过程


图1 菌株Ha-01在玻璃片上培养不同时间时生物被膜形成扫描电镜图Fig. 1 SEM images of Ha-01 biofi lm formation on glass
细菌生物被膜形成是一个动态过程,主要包括细菌黏附、形成和成熟、聚集和分散3 个阶段 [18-19]。图1为蜂房哈夫尼亚菌Ha-01在玻璃片上形成生物被膜的过程。由图1a~d可知,0~12 h为蜂房哈夫尼亚菌Ha-01生物被膜形成的附着期,菌体开始黏附于玻璃片表面,从稀疏逐渐变得密集,菌体之间也开始出现聚集的现象;12~72 h菌体开始快速生长,出现大量团聚现象并逐渐被胞外聚合物所包围,说明此阶段为生物被膜的形成和成熟期(图1d~h);到84 h时,生物被膜量出现减少,部分菌体开始脱离玻璃片表面,说明此时生物被膜已经开始进入衰亡期(图1i)。
2.2 菌株Ha-01在不同碳源培养下生物被膜活菌数的变化
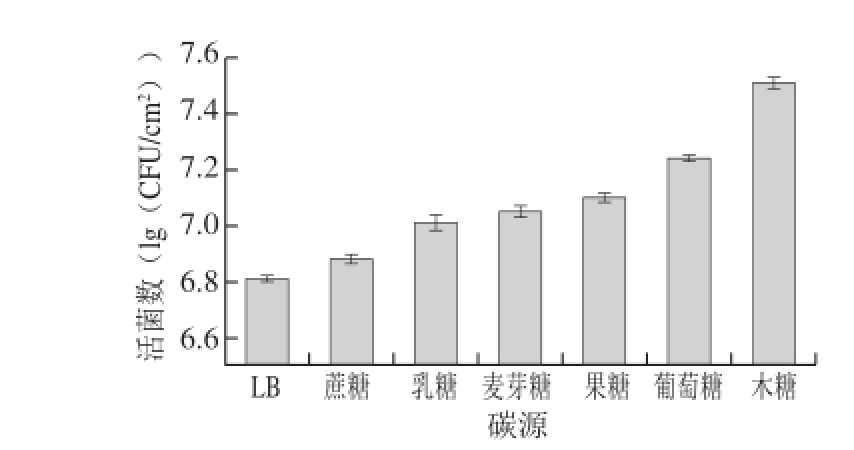
图2 碳源对菌株Ha-01生物被膜活菌数的影响
Fig. 2 Effect of different carbon sources on the viable cell count of strain Ha-01 biofilm
由图2可知,不同碳源能够影响菌株Ha-01生物被膜的形成,且在添加不同碳源的AB培养基中生物被膜形成能力均大于在LB液体培养基中的形成能力。其中在LB肉汤中菌株Ha-01生物被膜活菌数最少,为6.81(lg(CFU/cm 2));而在以木糖为碳源的AB培养基中,菌株Ha-01生物被膜活菌数最多,达到7.51(lg(CFU/cm 2)),相比于在LB培养基中时生物被膜活菌数增加了10.28%。根据活菌数可知,在不同碳源培养基中菌株Ha-01生物被膜形成能力从大到小依次为:木糖、葡萄糖、果糖、麦芽糖、乳糖、蔗糖。根据王桂洋 [20]的研究可知,生物被膜形成能力的强弱与细菌所获得的总糖含量相关,糖可以作为促进细菌生长的碳源物质,外加糖分既能促进细菌生长,又可以促进其生物被膜形成。所以蜂房哈夫尼亚菌在不同碳源培养基中生物被膜形成量不同的原因可能为菌株Ha-01对不同糖类的利用能力不同。
2.3 菌株Ha-01在不同pH值培养条件下生物被膜活菌数的变化
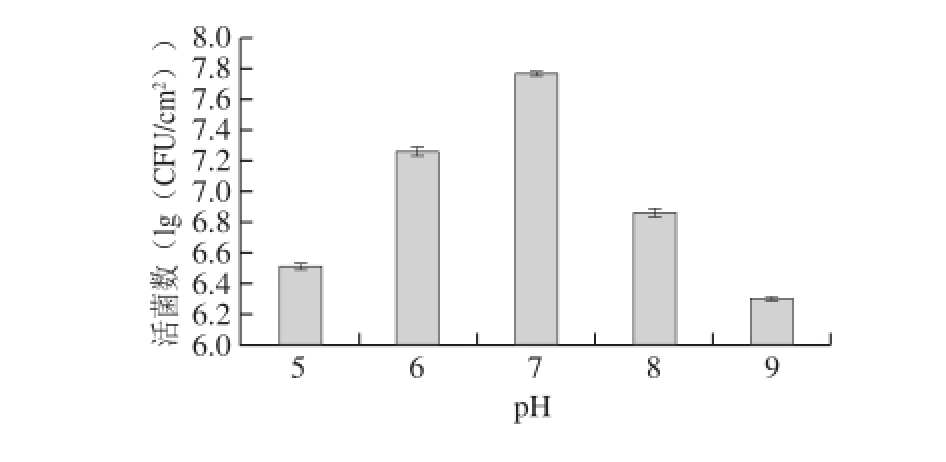
图3 pH值对菌株Ha-01生物被膜活菌数的影响
Fig. 3 Effect of pH on the viable cell count of strain Ha-01 biofilm
由图3可知,菌株Ha-0 1在中性条件下生物被膜形成量大于在碱性或酸性条件下。其中在p H 7的条件下培养时,生物被膜形成量最大,活菌数为7.77(lg(CFU/cm 2));在酸性条件pH 5时,其生物被膜活菌数为6.51(lg(CFU/cm 2));在碱性条件p H 9时,其生物被膜活菌数为6.30(lg(CFU/cm 2))。
在酸性条件下,微生物胞外分泌物可能会发生变性,而生物被膜的形成与其胞外聚合物相关,所以不利于其生物被膜的形成;在碱性条件下,p H值过高影响菌体的聚集,同样不利于其生物被膜的形成 [21-22]。因此,生长环境中p H值过低或过高均能够抑制微生物生物被膜的形成。
2.4 菌株Ha-01在不同NaCl质量分数培养条件下生物被膜活菌数的变化
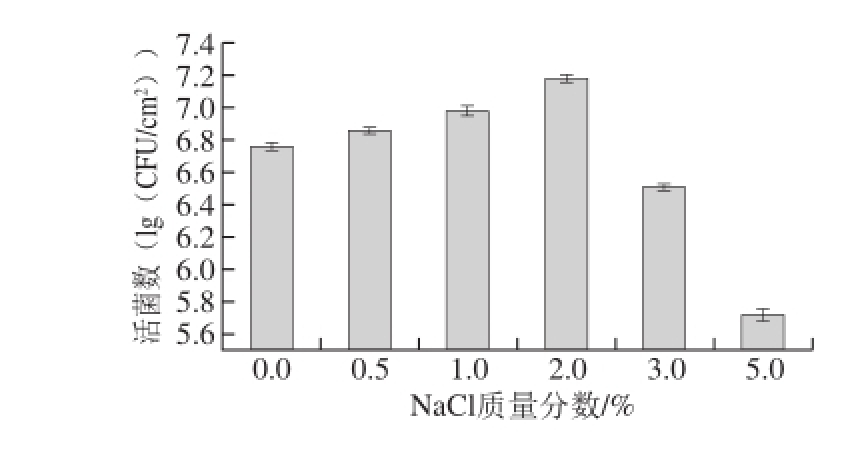
图4 NaCl质量分数对菌株Ha-01生物被膜活菌数的影响
Fig. 4 Effect of NaCl concentration on the viable cell count of strain Ha-01 biofilm
由图4可知,当NaCl质量分数在0~2%范围内时,菌株Ha-01生物被膜产生量随着盐质量分数的升高而增大,当NaCl质量分数达到2%时,菌株Ha-01生物被膜形成量最大,活菌数为7.18(lg(CFU/cm 2));当NaCl质量分数超过2%时,其生物被膜形成受到抑制,在NaCl质量分数为5%时,活菌数减少为5.72(lg(CFU/cm 2))。根据Knobloch等 [23]的研究可知,在一定NaCl质量分数范围内,盐质量分数能够促进细菌生物被膜产生的原因可能为Na +可以影响其端鞭毛的运动,进而能够影响其生物被膜的形成。
2.5 不同材料对菌株Ha-01生物被膜形成的影响
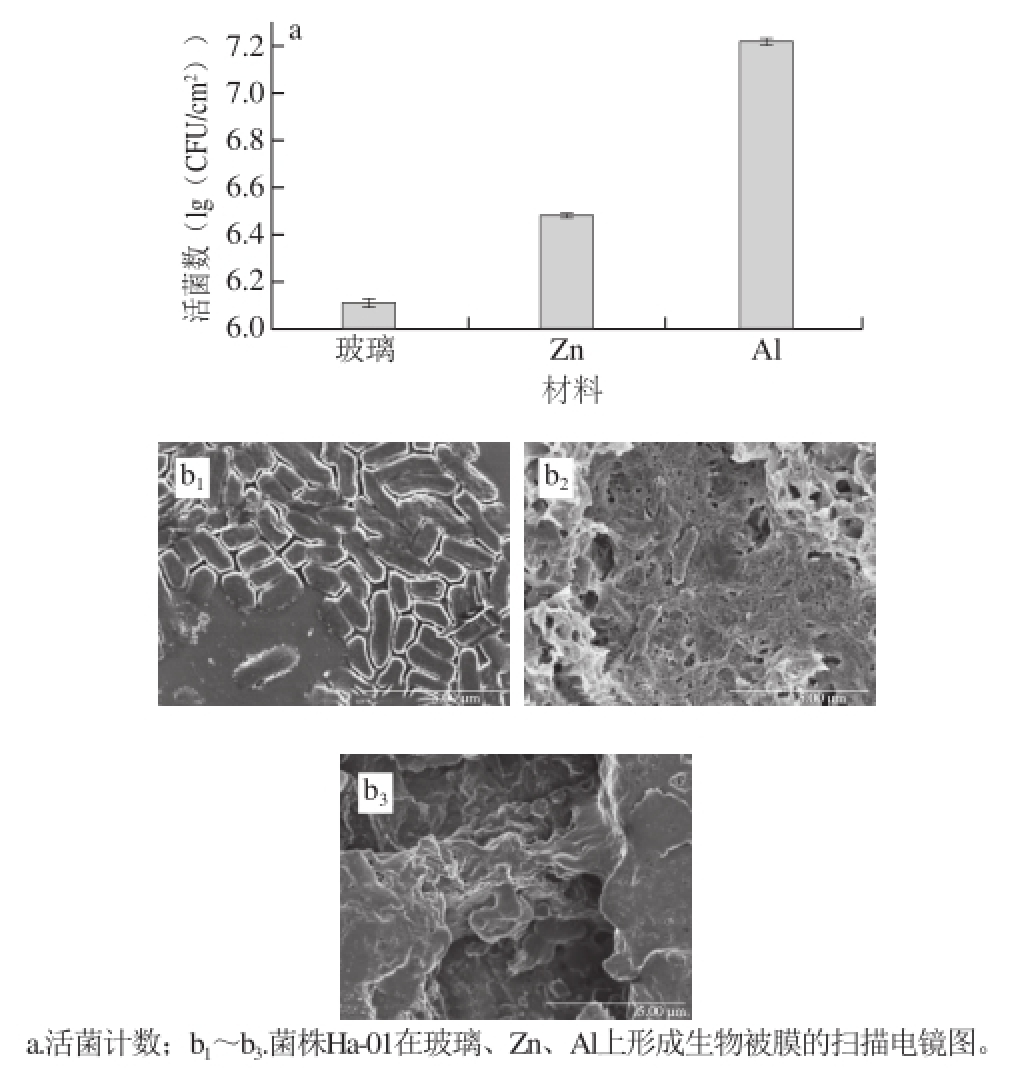
图5 不同载体材料对菌株Ha-01生物被膜形成的影响
Fig. 5 Biofilm formation of strain Ha-01 on different materials
由图5a可知,菌株Ha-01在3种材料上形成能力由大到小依次为:铝片>锌片>玻璃片,生长的活菌数分别为7.22、6.48、6.11(lg(CFU/cm 2))。由图5b可知,在培养24 h后,可观察到菌株Ha-01在玻璃片上菌体较多,正在进行聚集,处于生物被膜的形成期;在锌片上已经形成致密的生物被膜层,菌体被大量的胞外聚合物所包围,能观察到少数菌体附着在其生物被膜表面或孔壁上;在铝片上其生物被膜出现堆叠现象,已经形成复杂的立体结构,观察不到明显菌体。
根据Johnson [2 4]的研究可知,细菌生物被膜的产生与其黏附量有关,细菌黏附作用能够促进其生物被膜形成。因此,菌株Ha-01在3 种材料上生物被膜形成量不同的原因可能为玻璃表面比较光滑,不利于细菌的黏附,进而其生物被膜形成能力最弱;而在铝片上更易于蜂房哈夫尼亚菌的黏附,能够促进其形成生物被膜。
2.6 外源标准C 6-HSL对菌株Ha-01生物被膜形成的影响
由图6可知,外源标准C 6-HSL可以促进菌株Ha-01生物被膜的形成,且随着添加量的增大,其生物被膜形成能力增强。其中,图6 a为添加不同体积的C 6-HSL对菌株Ha-0 1生物被膜活菌数的影响。在添加外源标准C 6-HSL时,菌株Ha-01生物被膜活菌数显著增加(P<0.05)。
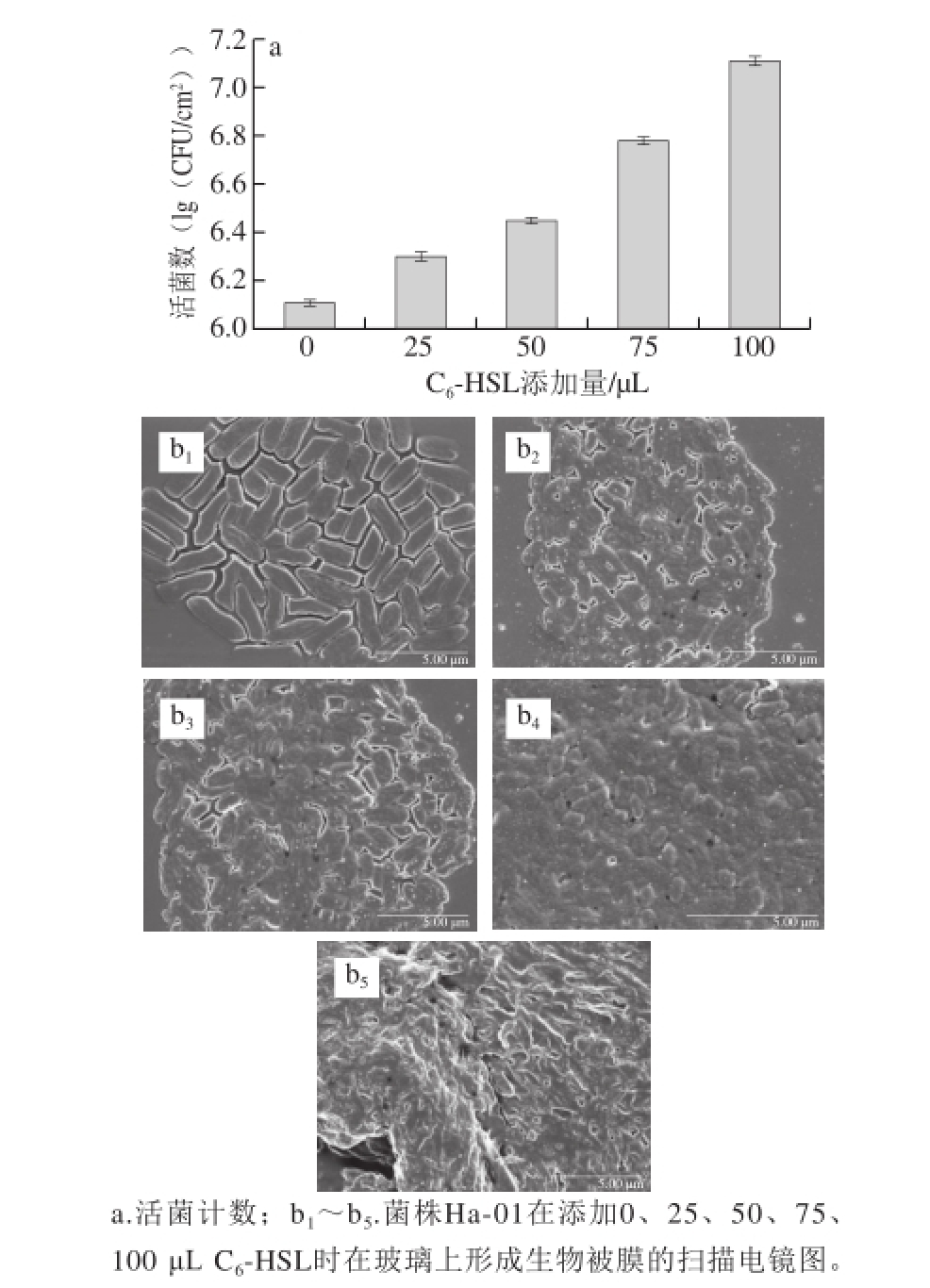
图6 不同添加量外源标准C
6-HSL对菌株Ha-01生物被膜形成的影响
Fig. 6 Effects of exogenous C
6-HSL on the biofi lm formation of strain Ha-01
由图6b可以观察到,在培养24 h后,菌株Ha-01在不添加外源标准C 6-HSL的情况下,在玻璃片上刚出现聚集现象;在添加25 μL C 6-HSL时,其生物被膜已经出现明显团聚现象;在添加75 μL C 6-HSL时,出现大量的菌体团聚,且被胞外聚合物所包围,覆盖整个表面;当C 6-HSL添加量增加到100 μL时,生物被膜已经出现明显堆叠现象,观察不到明显菌体存在。说明AHLs能够调控蜂房哈夫尼亚菌生物被膜的形成。这与崔方超等 [25]研究的群体感应系统能够调控荧光假单胞菌生物被膜的形成结果相类似。
本研究采用扫描电镜法研究了蜂房哈夫尼亚菌生物被膜形成过程,并结合超声波平板法研究了不同培养条件对其生物被膜形成的影响及外源标准信号分子C 6-HSL对其生物被膜的调控作用。结果表明,蜂房哈夫尼亚菌生物被膜的形成经历了附着期、形成和成熟期、衰亡期3 个阶段,其生物被膜的形成受培养条件的影响。同时可知,由AHLs介导的群体感应系统可以调控其生物被膜的形成。
参考文献:
[1] SPERANZA B, CORBO M R, SINIGAGLIA M. Effects of nutritional and environmental conditions on Salmonella sp. biofilm formation[J]. Journal of Food Science, 2011, 76(1): 12-16. DOI:10.1111/j.1750-3841.2010.01936.x.
[2] JAHID I K, HA S D. A review of microbial biofilms of produce: future challenge to food safety[J]. Food Science and Biotechnology, 2012, 21(2): 299-316. DOI:10.1007/s10068-012-0041-1.
[3] RONEN A, SEMIAT R, DOSORETZ C G. Antibacterial efficiency of composite nano-Zn O in biofilm development in flow-through systems[J]. Desalination and Water Treatment, 2013, 51(4/5/6): 988-996. DOI:10.1080/19443994.2012.693698.
[4] JEFFERSON K K. What drives bacteria to produce a biofilm?[J]. FEMS Microbiology Letters, 2004, 236(2): 163-173. DOI:10.1016/ j.femsle.2004.06.005.
[5] LEBERT I, LEROY S, TALON R. Effect of industrial and natural biocides on spoilage, pathogenic and technological strains grown in biofilm[J]. Food Microbiology, 2007, 24(3): 281-287. DOI:10.1016/ j.fm.2006.04.011.
[6] JAHID I K, HAN N, HA S D. Inactivation kinetics of cold oxygen plasma depend on incubation conditions of Aerom onas hyd ro phila biofilm on lettuce[J]. Food Research International, 2014, 55: 181-189. DOI:10.1016/j.foodres.2013.11.005.
[7] PILETSKA E V, STAVROULAKIS G, LARCOMBE L D, et al. Passive control of quorum sensing: prevention of P seu do m o n a s a e ru g in o sa bio film formatio n by imp rin te d po ly mers[J]. Biomacromolecules, 2011, 12(4): 1067-1071. DOI:10.1021/ bm101410q.
[8] KJELLEBERG S, MOLIN S. Is there a role for quorum sensing signals in bacterial biofilms?[J]. Current Opinion in Microbiology, 2002, 5(3): 254-258. DOI:10.1016/S1369-5274(02)00325-9.
[9] JACK R F, RINGELBERG D B, WHITE D C. Differential corrosion rates of carbon steel by combinations of Bacillus sp., Ha fnia alvei and D esulfovibrio gig as established by phospholipid analysis of electrode biofilm[J]. Corrosion Science, 1992, 33(12): 1843-1853. DOI:10.1016/0010-938X(92)90188-9.
[10] VIANA E S, CAMPOS M E M, PONCE A R, et al. Biofilm formation and acyl homoserine lactone production in Hafnia alvei isolated from raw milk[J]. Biological Research, 2009, 42(4): 427-436. DOI:10.4067/ S0716-97602009000400004.
[11] 杨葆华, 韩北忠, 陈晶瑜, 等. 超声波平板法检测金黄色葡萄球菌生物被膜的研究[J]. 食品研究与开发, 2007, 28(10): 136-139. DOI:10.3969/j.issn.1005-6521.2007.10.043.
[12] 王蓓, 吴灶和, 简纪常, 等. 超声波平板法检测溶藻弧菌HY9901生物被膜的研究[J]. 水产科学, 2009(7): 378-382. DOI:10.16378/ j.cnki.1003-1111.2009.07.014.
[13] 毛巍. 牛乳中金黄色葡萄球菌生物被膜形成条件的研究[D]. 呼和浩特: 内蒙古农业大学, 2010: 7.
[14] 李焕新. 聚乙烯表面生物被膜的形成及其抑制[D]. 北京: 中国科学院研究生院, 2009: 38.
[15] ZIMMER B L, MAY A L, BHEDI C D, et al. Quorum sensing signal production and microbial interactions in a polymicrobial disease of corals and the coral surface mucopolysaccharide layer[J]. PLoS ONE, 2014, 9(9): e108541. DOI:10.1371/journal.pone.0108541.
[16] JAHID I K, MIZAN M F R, HA A J, et al. Effect of salinity and incubation time of planktonic cells on biofilm formation, motility, exopro tease pro d uction, a n d quoru m sensin g of A ero m o n a s hydrophila[J]. Food Microbiology, 2015, 49: 142-151. DOI:10.1016/ j.fm.2015.01.016.
[17] 邓旗. 对虾特定腐败菌生物被膜的形成特性及抗菌脂肽的控制作用[D]. 湛江: 广东海洋大学, 2013: 13.
[18] 刘琳, 谭小娟, 贾爱群. 细菌群体感应与细菌生物被膜形成之间的关系[J]. 微生物学报, 2012, 52(3): 271-278. DOI:10.13343/j.cnki. wsxb.2012.03.001.
[19] KNIGHT G C, NICOL R S, MCMEEKIN T A. Temperature step changes: a novel approach to control biofilms of S trep toco ccus thermophilus in a pilot plant-scale cheese-milk pasteurisation plant[J]. International Journal of Food Microbiology, 2004, 93(3): 305-318. DOI:10.1016/j.ijfoodmicro.2003.11.013.
[20] 王桂洋. 壳聚糖对希瓦氏菌生物被膜抑制和清除作用的研究[D].杭州: 浙江工商大学, 2015: 18.
[21] SILLANPÄÄ J, NALLAPAREDDY S R, SINGH K V, et al. Characterization of the ebp fmpilus-encoding operon of Enterococcus faecium and its role in biofilm formation and virulence in a murine model of urinary tract infection[J]. Virulence, 2010, 1(4): 236-246. DOI:10.4161/viru.1.4.11966.
[22] KONTO-GHIORGHI Y, MAIREY E, MALLET A, et al. Dual role for pilus in adherence to epithelial cells and biofilm formation in Streptoco ccus ag alactiae[J]. PLoS Pathogens, 2009, 5(5): 1-13. DOI:10.1371/journal.ppat.1000422.
[23] KNOBLOCH J K M, BARTSCHT K, SABOTTKE A, et al. Biofi lm formation by Staphylococcus epidermidis depends on functional RsbU, an activator of thesigB operon: differential activation mechanisms due to ethanol and salt stress[J]. Journal of Bacteriology, 2001, 183(8): 2624-2633. DOI:10.1128/JB.183.8.2624-2633.2001.
[24] JOHNSON L R. Microcolony and biofilm formation as a survival strategy for bacteria[J]. Journal of Theoretical Biology, 2008, 251(1): 24-34. DOI:10.1016/j.jtbi.2007.10.039.
[25] 崔方超, 李婷婷, 刘明爽, 等. 大菱鲆荧光假单胞菌的群体感应现象及不同碳源培养下的腐败特性研究[J]. 现代食品科技, 2015, 31(12): 49-55. DOI:10.13982/j.mfst.1673-9078.2015.12.008.
Influences of Different Culture Conditions and Quorum Sensing Signaling Molecules on the Biofilm Formation of Hafnia alvei
MA Yan
1, LI Tingting
2,*, CUI Fangchao
1, LI Jianrong
1,*
(1. National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, College of Food Science and Technology, Bohai University, Jinzhou 121013, China; 2. College of Life Science, Dalian Minzu University, Dalian 116600, China)
Abstract:This study aimed to investigate the process of biofilm formation of Hafnia a lvei Ha-01, and to examine the influences of different culture conditions (carbon source, pH, NaCl concentration, and adhesive material) on the number of viable cells in biofi lm formed by H afn ia alvei and its growth properties by the ultrasonic plate method and scanning electron microscopy (SEM), and we also assessed the relationship between exogenous N-acyl-homoserine lactone (C 6-HSL) as a quorum-sensing (QS) signal molecule and the biofi lm formation of Hafnia alvei. The results indicated that the biofilm formation of strain Ha-01 was closely related to incubation time. The biofi lm formation ability of Ha-01 varied depending on carbon source, and when xylose was used as carbon source, its biofi lm formation ability reached the strongest level of 7.51 (lg (CFU/cm 2)), which was increased by 10.28% as compared with that in LB medium. The biofilm formation ability of Ha-01 was stronger under neutral conditions, with the viable cell count reaching 7.7 7 (lg (CFU/cm 2)). At a Na Cl co n cen tratio n o f 2%, the b io film formatio n was the h ig h est, reachin g 7.18 (lg (CFU/cm 2)). The biofilm formation ability of Ha-01 on different material surfaces was deceased in the order of Al, Zn, and glass. The numbers of viable cells on these materials were 7.22, 6.48, and 6.11 (lg (CFU/cm 2)),respectively. The biofi lm formation ability became stronger with the increase of exogenous C 6-HSL. In conclusion, culture conditions could affect the biofilm formation of H a fn ia alvei, which could be regulated by AHLs.
Key words:Hafnia alvei; biofi lm; AHLs; culture conditions
DOI:10.7506/spkx1002-6630-201706007
中图分类号:S984.1
文献标志码:A
文章编号:1002-6630(2017)06-0042-06
收稿日期:2016-05-19
基金项目:国家自然科学基金面上项目(31471639);国家自然科学基金青年科学基金项目(31301572);
中国博士后科学基金项目(2014M552302);高等学校博士学科点专项科研基金课题(20113326130001);
重庆市博士后资助项目(Xm2014041)
作者简介:马艳(1989—),女,硕士研究生,研究方向为水产品贮藏加工与质量安全控制。E-mail:myan9102@163.com
*通信作者:李婷婷(1978—),女,副教授,博士,研究方向为水产品贮藏加工及安全控制。E-mail:tingting780612@163.com
励建荣(1964—),男,教授,博士,研究方向为水产品和果蔬贮藏加工、食品安全。E-mail:lijr6491@163.com
引文格式:
马艳, 李婷婷, 崔方超, 等. 不同培养条件及群体感应信号分子对蜂房哈夫尼亚菌生物被膜的影响[J]. 食品科学, 2017, 38(6): 42-47. DOI:10.7506/spkx1002-6630-201706007. http://www.spkx.net.cn
MA Yan, LI Tingting, CUI Fangchao, et al. Influences of different culture conditions and quorum sensing signaling molecules on the biofilm formation of Hafnia alvei[J]. Food Science, 2017, 38(6): 42-47. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706007. http://www.spkx.net.cn