表1 不同蛋白酶的用量和反应条件
Table 1 Reaction conditions and dosages of different proteases

蛋白酶反应温度/℃反应pH加酶量/(U/g)碱性蛋白酶60 8 5 000风味蛋白酶50 6.5 5 000中性蛋白酶45 7 5 000胰蛋白酶37 8 5 000
包美丽 1,2,杨添植 1,张立钢 3,赵玉红 1,*
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江民族职业学院,黑龙江 哈尔滨 150066;3.东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:为探索制备马鹿茸降血糖肽的最佳工艺条件,以α-葡萄糖苷酶抑制率为指标,从碱性蛋白酶、风味蛋白酶、中性蛋白酶和胰蛋白酶中筛选出两种酶,根据其体外降血糖效果确定酶的作用顺序,再以水解度、α-葡萄糖苷酶抑制率和蛋白质回收率为指标进行单因素试验和正交试验,优化降血糖肽制备工艺条件。结果表明:碱性蛋白酶和风味蛋白酶比中性蛋白酶和胰蛋白酶更适合用于制备马鹿茸降血糖肽。采用碱性蛋白酶-风味蛋白酶顺序对马鹿茸进行水解,所得酶解产物的α-葡萄糖苷酶抑制率、蛋白质回收率和水解度较高,分别为21.11%、39.12%、19.88%。通过单因素试验和正交试验确定双酶酶解最佳工艺条件为先用碱性蛋白酶在pH 8.0、60 ℃、底物质量分数12%、加酶量5 000 U/g条件下酶解3 h,再用风味蛋白酶于p H 6.5、45 ℃、底物质量分数5%、加酶量6 000 U/g条件下酶解1 h。双酶分步水解终产物的α-葡萄糖苷酶抑制率受质量浓度的影响,当质量浓度为3 mg/mL时,α-葡萄糖苷酶抑制率可达94.09%,IC 50值为1.82 mg/mL。碱性蛋白酶-风味蛋白酶双酶分步水解马鹿茸可获得高α-葡萄糖苷酶抑制率的降血糖肽。
关键词:马鹿茸;酶解;降血糖肽
糖尿病是一组由于胰岛素分泌缺陷或胰岛素作用障碍所致的以高血糖为特征的代谢性疾病。世界卫生组织按照其病因和发病机制将其大致分为四类,即Ⅰ型糖尿病、Ⅱ型糖尿病、特殊类型糖尿病和妊娠期糖尿病。其中,Ⅱ型糖尿病人数约占糖尿病总人数的90%,主要发病机制的特征为胰岛素抵抗、胰岛分泌缺陷。Ⅱ型糖尿病的早期,首先表现的是餐后高血糖,而空腹血糖正常或稍高,空腹尿糖也呈阴性,并且这种餐后血糖高而空腹血糖稍高或正常的糖尿病人,临床表现口渴、多饮、多尿和消瘦的症状多不明显。因此,餐后高血糖的早期预防和诊疗是遏制其向Ⅱ型糖尿病转化的重要途径。而餐后高血糖的发生与α-葡萄糖苷酶的活性密切相关,这种酶的活性越强,其水解淀粉和低聚糖的量就越多,进而导致葡萄糖在小肠黏膜上的吸收速度加快 [1]。通过抑制α-葡萄糖苷酶的活性可以有效地降低餐后高血糖的发生 [2]。活性多肽因其分子质量小、结构相对简单、易被人体吸收等特性,近年来备受研究者们的关注。田应娟 [3]利用Alcalase对啤酒糟进行酶解,以α-葡萄糖苷酶抑制率为指标,制备出具有降血糖功能的活性多肽;张海娜 [4]利用碱性蛋白酶和复合蛋白酶酶解蚕蛹,制备出具有降血糖功能的活性多肽;Oseguera-Toledo等 [5]利用Alcalase和菠萝蛋白酶对难煮绿豆进行酶解,以α-葡萄糖苷酶抑制率为指标,制备出具有降血糖功能的活性肽。
鹿茸为鹿科动物梅花鹿或马鹿尚未骨化的幼角。雄鹿的嫩角没有长成硬骨时,带茸毛,含血液,叫做鹿茸。鹿茸始载于《神农本草经》,是传统的名贵中药,主要含有脂类、多糖、多胺、蛋白质及多肽、激素样物质、生物碱基等多种化学成分,具有增强记忆力、抗衰老、抗氧化、抑制单胺氧化酶活性等功能 [6-11]。
鹿茸含有丰富的蛋白质和氨基酸,其含量约占干质量的一半,以三杈鹿茸为例,其氨基酸的总质量分数达到48.57%,必须氨基酸质量分数平均值为14.98% [12]。另外,研究发现马鹿茸多肽具有抗疲劳 [13]、促进表皮细胞和成纤维细胞增殖及皮肤创伤愈合的作用 [14-15],且马鹿茸多肽对表皮细胞的增殖作用强于梅花鹿茸多肽 [16]。梅花鹿鹿茸多肽具有抗氧化 [17]、增强机体的细胞免疫功能 [18]等作用。目前马鹿茸降血糖肽的制备方法有酸提醇沉法 [19-20],而采用双酶法制备马鹿茸降血糖肽的研究未见报道。本实验从4 种蛋白酶中筛选出碱性蛋白酶和风味蛋白酶对新鲜马鹿茸进行酶解,以抑制α-葡萄糖苷酶活性为主要评价指标优化马鹿茸降血糖肽的制备条件,为鹿茸在降血糖方面的深入研究提供依据。
1.1 材料与试剂
新鲜马鹿茸由黑龙江大庄园集团提供。
碱性蛋白酶2.4L 丹麦诺维信(中国)公司;风味蛋白酶、4-硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenylα-D-glucopyranoside,PNPG) 上海源叶生物科技有限公司;中性蛋白酶 北京奥博星生物技术有限责任公司;胰蛋白酶 上海艾研生物科技有限公司;α-葡萄糖苷酶 美国Sigma公司;石油醚、氢氧化钠、浓硫酸、浓盐酸等均为分析纯。
1.2 仪器与设备
Hitachi L-8900型氨基酸全自动分析仪 日本日立公司;DK-8D型电热恒温水浴槽 上海一恒科学仪器有限公司;EL20型pH计 梅特勒-托利多仪器(上海)有限公司;722型可见分光光度计 上海光谱仪器有限公司;ELx800NB型酶标仪 美国Bio-Tek公司。
1.3 方法
1.3.1 马鹿茸冻干粉的制备
将新鲜的马鹿茸皮毛去除,切成2~3 cm 3小块,用预先冷却(4 ℃)的去离子水冲洗至无血色,再用冷冻干燥机进行干燥,低温粉碎,过80 目筛,过筛后的粉末用石油醚去脂,于-40 ℃条件下保存备用。
1.3.2 蛋白酶活力测定
蛋白酶活力测定采用福林-酚法 [21]。
1.3.3 蛋白酶的选择
取去脂后马鹿茸粉,加入一定量的蒸馏水,将底物质量分数配制成10%,再用NaOH或HCl调节体系pH值至各蛋白酶的最适pH值,加一定量的蛋白酶,在各酶的最适温度条件下进行酶解,反应240 min后置于90 ℃水浴中灭酶10 min,4 000 r/min离心20 min,分别取酶解上清液,制成冻干粉于4 ℃保存。将冻干粉酶解后分别以α-葡萄糖苷酶抑制率、水解度和蛋白质回收率为指标进行分析,根据实验结果筛选出α-葡萄糖苷酶抑制率高的两种蛋白酶进行双酶水解实验。不同蛋白酶的用量和反应条件见表1。
表1 不同蛋白酶的用量和反应条件
Table 1 Reaction conditions and dosages of different proteases

蛋白酶反应温度/℃反应pH加酶量/(U/g)碱性蛋白酶60 8 5 000风味蛋白酶50 6.5 5 000中性蛋白酶45 7 5 000胰蛋白酶37 8 5 000
1.3.4 双酶水解实验
根据蛋白酶的选择实验结果,改变筛选出的两种酶的反应顺序,分别测定不同顺序的两种蛋白酶酶解产物的α-葡萄糖苷酶抑制率、水解度和蛋白质回收率。酶解步骤为在一定条件下向马鹿茸水溶液中加入第1种蛋白酶进行酶解后,90 ℃水浴灭酶,调节温度、pH值后,再加入第2种蛋白酶继续酶解。待3 项指标测定后,确定酶解顺序,在不同反应时间、温度、p H值、底物质量分数和加酶量条件下进行酶解实验,测定不同条件下的α-葡萄糖苷酶抑制率、水解度和蛋白质回收率,从而确定较适合的反应时间、温度、pH值、底物质量分数和加酶量。
1.3.5 水解度测定
采用pH-stat法 [22],水解度计算如式(1)所示:
式中:B为水解过程中Na OH的消耗量/m L;N b为Na OH的浓度/(mol/mL);α为—NH 2解离度;M P为原料中蛋白质质量/g;h to t为1 g原料蛋白质中总肽键含量/(mmol/g)。
马鹿茸总肽键含量由组成马鹿茸氨基酸含量组成计算得出,氨基酸含量组成测定参照GB/T 5009.124—2003《食品中氨基酸的测定》。
1.3.6 蛋白质回收率测定
蛋白质含量测定按照GB 5009.5—2010《食品中蛋白质的测定》进行。马鹿茸酶解产物蛋白质回收率按式(2)计算:
1.3.7 α-葡萄糖苷酶抑制率测定
α-葡萄糖苷酶抑制率测定参照Li Ting等 [23]的方法,略加修改。取2 mg/mL的马鹿茸蛋白酶水解液100 μL,加入0.16 U/mL的α-葡萄糖苷酶溶液50 μL,于37 ℃水浴10 min后,加入2.5 mmol/L的底物PNPG溶液50 μL,于37 ℃水浴15 min后,立即加入1 mol/L的Na 2CO 3溶液100 μL终止反应,用酶标仪在波长405 nm处测定吸光度A 1,另取100 μL磷酸盐缓冲溶液代替酶解液,测定其吸光度A 0,再测定只有酶解液反应体系的吸光度A 2,每组实验做5 次平行。IC 50利用calcdemo2.0计算得出,按式(3)计算抑制率:
1.4 数据处理
采用Origin 9.2制图,采用SPSS 20.0对数据进行方差分析、显著性检验,显著性水平设置P<0.05。
2.1 蛋白酶酶活力测定结果
利用福林-酚法,测定碱性蛋白酶、风味蛋白酶、中性蛋白酶、胰蛋白酶4 种蛋白酶活力,分别为207 445 U/mL和34 556、71 136、91 659 U/g。所得结果将为水解实验中蛋白酶的添加量提供依据。
2.2 马鹿茸总肽键含量的确定
根据GB/T 5009.124—2003,测得马鹿茸含有17 种氨基酸,从表2可知,马鹿茸蛋白含量为43.029%,总肽键含量为7.38 mmol/g。
表2 马鹿茸氨基酸含量
Table 2 Amino acid contents of red deer antlers

检测项目含量/%分子质量/u天冬氨酸3.461 133.10苏氨酸1.485 119.12丝氨酸1.900 105.06谷氨酸4.990 147.13甘氨酸7.453 75.07丙氨酸3.517 89.09胱氨酸0.781 240.29缬氨酸1.506 117.15蛋氨酸0.408 149.21异亮氨酸0.683 131.17亮氨酸2.733 131.17酪氨酸1.308 181.19苯丙氨酸1.822 165.19赖氨酸2.332 146.19组氨酸0.800 155.16精氨酸3.254 174.20脯氨酸4.325 115.13总和43.029
2.3 蛋白酶的选择
由于不同蛋白酶的酶切作用方式及酶切位点不同,其马鹿茸酶解产物对α-葡萄糖苷酶抑制率强弱也有很大的差异,而且小分子肽在被人体吸收后才具有一定的生理活性,要富集小分子肽就必须基于一定的水解程度,因此,为了选择合适的蛋白酶,本实验选取了4 种蛋白酶分别对马鹿茸进行水解,以α-葡萄糖苷酶的抑制率为指标,筛选出两种强抑制率的酶解产物用酶,并进行下一步双酶水解实验。
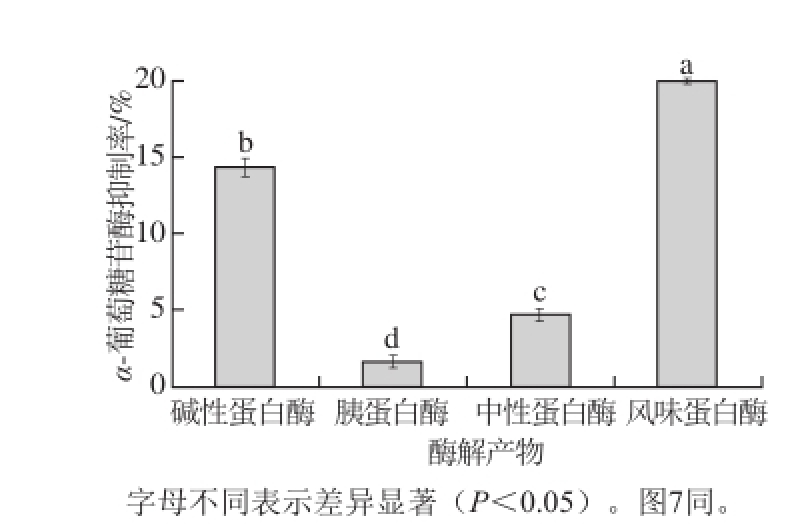
图1 蛋白酶酶解产物对α-葡萄糖苷酶抑制率的影响
Fig. 1 Effects of different proteases on the α-glycosidase inhibitory activity of hydrolysates
从图1可以看出,风味蛋白酶的酶解产物对α-葡萄糖苷酶抑制率最高为19.93%,其次是碱性蛋白酶,其对α-葡萄糖苷酶抑制率为14.03%,中性蛋白酶和胰蛋白酶对α-葡萄糖苷酶抑制率更低,分别为4.78%和1.62%。因此,选取碱性蛋白酶和风味蛋白酶进行下一步酶解实验。
2.4 酶解顺序的确定
根据蛋白酶的选择实验结果,选取具有较强抑制率的碱性蛋白酶和风味蛋白酶进行水解,并改变两种酶的作用顺序,考察酶解顺序对酶解效果的影响,结果如表3所示。
表3 酶解顺序对酶解产物α-葡萄糖苷酶抑制率的影响
Table 3 Effects of sequences of hydrolysis steps on the α-glycosidase inhibitory activity of hydrolysates %

注:同列字母不同表示差异显著(P<0.05)。
双酶顺序α-葡萄糖苷酶蛋白质回收率水解度抑制率碱性蛋白酶-风味蛋白酶21.11±0.65 a39.12±0.37 a19.88±0.54 a风味蛋白酶-碱性蛋白酶10.35±0.46 b33.65±0.75 b16.72±0.42 b
由表3可知,酶解顺序为碱性蛋白酶-风味蛋白酶的酶解产物对α-葡萄糖苷酶抑制率、蛋白质回收率和水解度分别为21.11%、39.12%和19.88%,均高于酶解顺序为风味蛋白酶-碱性蛋白酶的酶解产物的实验效果(P<0.05)。这可能是因为风味蛋白酶是一种真菌蛋白酶和肽酶的复合体,它包含内切蛋白酶和外切肽酶两种活性,当马鹿茸粉先用碱性蛋白酶酶解,再用风味蛋白酶进行酶解后所产生的肽段的氨基酸排列顺序可能对α-葡萄糖苷酶具有更强的抑制效果。因此,双酶酶解顺序采用碱性蛋白酶-风味蛋白酶。
2.5 双酶水解工艺优化
2.5.1 双酶水解单因素试验结果
2.5.1.1 酶解时间对酶解效果的影响
由图2可知,随着酶解时间的延长,马鹿茸在两种蛋白酶的作用下,水解度和蛋白质回收率都呈上升趋势,当酶解时间达到3 h时,碱性蛋白酶酶解产物对α-葡萄糖苷酶抑制率达到最高为24.27%,此时其水解度为22.23%,当超过3 h后,水解度增长平缓,且其酶解产物的α-葡萄糖苷酶抑制率骤然下降。这可能是因为随着酶解反应的进行,蛋白质大分子逐渐被分解为多肽和氨基酸的混合物,一方面酶切的作用位点开始减少,碱性蛋白酶活性下降;另一方面酶与底物结合的中间产物及终产物增多,对反应有抑制效果,从而反应趋于平缓 [3],故碱性蛋白酶的最适酶解时间为3 h;风味蛋白酶在酶解1 h时,酶解产物对α-葡萄糖苷酶抑制最高,达到32.41%,当反应时间为2 h时,其水解度最高,超过3 h,水解度增长平缓,且酶解产物的α-葡萄糖苷酶抑制率开始下降,蛋白质回收率增长缓慢,故风味蛋白酶的最适酶解时间为1 h。
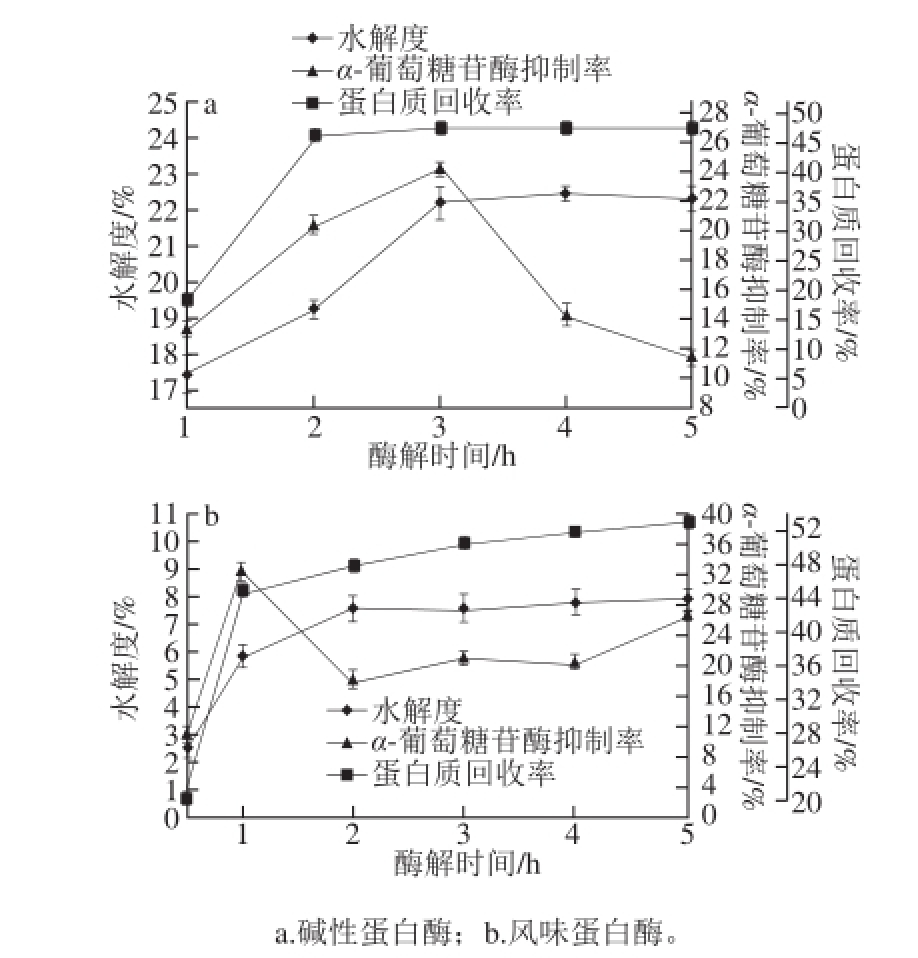
图2 酶解时间对酶解效果的影响
Fig. 2 Effects of time on hydrolysis effi ciency
2.5.1.2 pH值对酶解效果的影响
p H值能影响酶活性部位上有关基团的解离,进而影响与底物蛋白的结合与催化,酶只有在其最适的p H值条件下,才能使酶反应速率达到最大。由图3a所示,当pH值为8.0时,碱性蛋白酶酶解产物的α-葡萄糖苷酶抑制率最高,而当p H值为8.5时,其水解度最高,这可能是由于当pH值为8.0时,其酶解产物的肽段的氨基酸排列序列具有强抑制效果,而p H值超过8.0后,虽然其水解度提高,但其酶解产物对α-葡萄糖苷酶抑制效果逐渐下降,且当pH值超过8.5后,因酶活力减弱使其蛋白质回收率骤然下降,因此,碱性蛋白酶的最适酶解p H值为8.0,这与田应娟 [3]研究的啤酒糟多肽降血糖活性中,碱性蛋白酶水解最适pH值的确定结果一致;由图3b可知,当pH值为6.5时,风味蛋白酶酶解产物的α-葡萄糖苷酶抑制率最高,达到17.74%,且其水解度也达到最高,当pH值超过6.5后,酶解产物的α-葡萄糖苷酶抑制率、水解度和蛋白质回收率均有所下降,这可能是由于此时蛋白酶活力开始减弱,因此,风味蛋白酶的最适酶解pH值为6.5。

图3 pH值对酶解效果的影响
Fig. 3 Effects of initial pH on hydrolysis efficiency
2.5.1.3 酶解温度对酶解效果的影响

图4 酶解温度对酶解效果的影响
Fig. 4 Effects of temperature on hydrolysis efficiency
不同酶都有其最适催化温度,酶解温度过低或过高,酶的活性会降低,而酶解温度过高时,酶失活甚至变性。由图4a可知,随着温度的上升,水解度和蛋白质回收率都逐渐升高,当温度达到60 ℃时,碱性蛋白酶水解度最高,此时酶解产物的α-葡萄糖苷酶抑制率也达到最大值,当温度超过60 ℃时,酶的活性减弱,从而使其水解度、蛋白质率回收率和酶解产物的α-葡萄糖苷酶抑制率都下降,因此,60 ℃为碱性蛋白酶的最适反应温度,这与梁凯 [24]研究的汉麻籽粕降血糖肽的酶法制备中,碱性蛋白酶酶解温度的确定结果一致;由图4b可知,风味蛋白酶在45 ℃时,酶解产物的α-葡萄糖苷酶抑制率达到最大值19.89%,当温度为55 ℃时,其水解度达到最大值,当超过55 ℃时,水解度和蛋白质回收率都增长平缓,且酶解产物的α-葡萄糖苷酶抑制率逐渐下降,因此,45 ℃为风味蛋白酶的最适反应温度。
2.5.1.4 底物质量分数对酶解效果的影响

图5 底物质量分数对酶解效果的影响
Fig. 5 Effects of substrate concentration on hydrolysis efficiency
由图5可知,随着底物质量分数的增加,水解度和蛋白质回收率都逐渐提高,当底物质量分数分别为12%和5%时,碱性蛋白酶和风味蛋白酶酶解产物的α-葡萄糖苷酶抑制率最高,分别达到23.27%和33.61%,随着底物质量分数的增加,其水解度和蛋白质回收率增长平缓,其酶解产物的α-葡萄糖苷酶抑制率都开始下降。这可能是因为加大底物质量分数后,体系中有效水分减少,底物与蛋白酶之间的扩散和运动受到限制 [25],抑制了水解作用,最终水解度降低。因此,先用碱性蛋白酶酶解时,底物质量分数选择12%;再用风味蛋白酶继续酶解时,底物质量分数选择5%。
2.5.1.5 加酶量对酶解效果的影响
由图6所示,随着加酶量的增加,水解度和蛋白质回收率都呈上升趋势,当加酶量分别为5 000 U/g和6 000 U/g时,碱性蛋白酶和风味蛋白酶酶解产物的α-葡萄糖苷酶抑制率达到最高,分别为20.47%和25.52%,随着加酶量的增加,其水解度和蛋白质回收率都趋于平缓,其酶解产物的α-葡萄糖苷酶抑制率都骤然下降,这可能是由于当酶浓度低于底物质量分数时,增加酶用量可以加快反应速率,当酶浓度高于底物质量分数时,酶量达到酶解的饱和状态,反应速率开始由底物质量分数决定,此时继续增加酶的用量对水解度的影响不大 [26],因此,当加酶量分别为5 000 U/g和6 000 U/g时,碱性蛋白酶和风味蛋白酶酶解产物对α-葡萄糖苷酶抑制作用最强。

图6 加酶量对酶解效果的影响
Fig. 6 Effects of E/S ratio on hydrolysis efficiency
2.5.2 双酶水解正交试验结果
在双酶酶解马鹿茸降血糖肽工艺中,酶解温度和p H值在酶解反应中具有相对特定的范围,因此将酶解温度和p H值固定不变 [27],即碱性蛋白酶的p H 8.0、酶解温度60 ℃,风味蛋白酶的pH 6.5、酶解温度45 ℃。通过双酶水解的单因素试验结果分析,采用L 18(3 6)正交试验,试验设计与结果见表4。
根据表4极差分析结果可知,以水解度为指标的因素影响程度依次为F>C>E>A>D>B,最佳组合为F 3C 3E 3A 3D 3B 2;以α-葡萄糖苷酶抑制率为指标的因素影响程度依次为E>F>B>A>C>D,最佳组合为E 2F 2B 2A 2C 2D 2;以蛋白质回收率为指标的因素影响程度依次为F>B>E>A>C>D,最佳组合为F 3B 3E 3A 3C 3D 1。
表4 正交试验设计及结果
Table 4 Orthogonal array design with experimental results

碱性蛋白酶作用风味蛋白酶作用α-葡萄糖试验号B底物质量C酶解D加酶量/E底物F酶解水解苷酶抑制蛋白质A加酶量/度/%回收率/%(U/g)分数/%时间/h(U/g)质量分数/%时间/h率/% 1 1(4 000)1(10)1(2)1(5 000)1(2)1(0.5)11.78 15.19 37.13 2 1 2(12)2(3)2(6 000)2(5)2(1.0)13.18 25.04 46.07 3 1 3(14)3(4)3(7 000)3(8)3(1.5)13.67 16.04 47.15 4 2(5 000)1 1 2 2 3 13.05 23.05 44.09 5 2 2 2 3 3 1 12.95 21.72 43.6 6 2 3 3 1 1 2 13.01 16.16 45.69 7 3(6 000)1 2 1 3 2 13.4 21.83 44.62 8 3 2 3 2 1 3 13.41 16.16 46.13 9 3 3 1 3 2 1 12.29 15.55 42.85 10 1 1 3 3 2 2 13.2 22.17 42.83 11 1 2 1 1 3 3 13.07 20.13 47.01 12 1 3 2 2 1 1 12.36 13.98 40.51 13 2 1 2 3 1 3 13.33 19.14 42.78 14 2 2 3 1 2 1 12.72 19.98 43.11 15 2 3 1 2 3 2 12.96 21.81 47.49 16 3 1 3 2 3 1 12.96 17.8 40.48 17 3 2 1 3 1 2 12.62 18.96 45.41 18 3 3 2 1 2 3 13.53 16.77 47.71 k 112.88 12.95 12.63 12.92 12.75 12.51 k 213.00 12.99 13.13 12.99 13.00 13.06水解度k 13.04 12.97 13.16 13.01 13.17 13.34 3R 0.16 0.04 0.53 0.09 0.42 0.83 k 118.76 19.86 19.12 18.34 16.60 17.37 α-葡萄糖k 20.31 20.33 19.75 19.64 20.43 21.00苷酶抑 2制率k 317.85 16.72 18.05 18.93 19.89 18.55 R 2.46 3.61 1.70 1.30 3.83 3.63 k 143.45 41.99 44.00 44.21 42.94 41.28蛋白质k 244.46 45.22 44.22 44.13 44.44 45.35回收率k 344.53 45.23 44.23 44.1 45.06 45.81 R 1.08 3.24 0.23 0.11 2.12 4.53
由表4可知,对于不同指标而言,不同因素的影响程度不同,因此需要根据各因素对3 个指标的影响程度综合平衡,确定最优工艺条件。通过极差分析,在碱性蛋白酶作用时,加酶量对3 个指标都是次要因素,虽然对于水解度和蛋白质回收率而言,都是取A 3好,但是α-葡萄糖苷酶抑制率是酶解工艺中最重要的指标,对酶解条件的确定影响较大,因此加酶量选择5 000 U/g;碱性蛋白酶酶解底物质量分数对蛋白质回收率和α-葡萄糖苷酶抑制率的影响分别排在第2位和第3位,所以考虑B 2和B 3,对于水解度和蛋白质回收率而言,取B 2或B 3相差不大(P<0.05),而从α-葡萄糖苷酶抑制率可知,取B 2较好,因此酶解底物质量分数选择12%;酶解时间对水解度的影响虽然大于对α-葡萄糖苷酶抑制率和蛋白质回收率的影响,但是α-葡萄糖苷酶抑制率作为3 个指标中最重要的指标,应优先考虑,因此碱性蛋白酶酶解时间选择3 h。在风味蛋白酶作用时,加酶量对3 个指标的影响都排在末位,且取D 1或D 3对水解度和蛋白质回收率影响不大(P<0.05),而α-葡萄糖苷酶抑制率作为酶解工艺中最重要的指标,加酶量最终选择6 000 U/g;底物质量分数对α-葡萄糖苷酶抑制率的影响排在第1位,因此风味蛋白酶酶解底物质量分数选择5%;酶解时间对水解度和蛋白质回收率的影响都排在第1位,且都是F 3较好,而对α-葡萄糖苷酶抑制率的影响排在第2位,本着降低消耗原则,酶解时间最终选择1 h。
通过综合平衡法可知,本实验的最优条件为A 2B 2C 2D 2E 2F 2,即先用碱性蛋白酶于p H 8.0、60 ℃、底物质量分数12%、加酶量5 000 U/g条件下酶解3 h,再用风味蛋白酶于pH 6.5、45 ℃、底物质量分数5%、加酶量6 000 U/g条件下酶解1 h。在此酶解条件下,马鹿茸酶解产物的水解度、α-葡萄糖苷酶抑制率、蛋白质回收率分别为18.07%、39.65%、58.74%。
2.5.3 双酶酶解终产物对α-葡萄糖苷酶抑制率的影响

图7 双酶酶解终产物质量浓度对α-葡萄糖苷酶抑制率的影响
Fig. 7 α-Glycosidase inhibitory activity of the final hydrolysate at various concentrations
采用正交试验优化的最适条件,研究双酶酶解终产物质量浓度对α-葡萄糖苷酶抑制率的影响,如图7所示,随着马鹿茸双酶酶解终产物质量浓度的增加,其α-葡萄糖苷酶抑制率随之增加,当质量浓度为3 mg/mL时,α-葡萄糖苷酶抑制率最高,可达94.09%,这一结果高于Oseguera-Toledo等 [5]研究的难煮绿豆降血糖肽的α-葡萄糖苷酶抑制率和周涵黎等 [28]研究的洋葱多肽的α-葡萄糖苷酶抑制率。而后,随着终产物质量浓度的增加,其抑制率开始减弱,其IC 50值为1.82 mg/mL,这与阳性对照阿卡波糖IC 50值基本接近 [29]。这可能是因为多肽进入到了α-葡萄糖苷酶的活性口袋,深入酶的催化活性中心,占据其活性中心部位,使底物无法顺利进入α-葡萄糖苷酶的催化区域并产生结合,从而表现出抑制作用 [30]。
碱性蛋白酶和风味蛋白酶比中性蛋白酶和胰蛋白酶更适合制备马鹿茸降血糖肽,适宜的水解顺序为碱性蛋白酶-风味蛋白酶。制备马鹿茸降血糖肽的最适水解条件为先用碱性蛋白酶于pH 8.0、60 ℃、底物质量分数12%、加酶量5 000 U/g条件下酶解3 h,再用风味蛋白酶于pH 6.5、45 ℃、底物质量分数5%、加酶量6 000 U/g条件下酶解1 h。在此条件下获得的酶解终产物受质量浓度的影响,当质量浓度为3 mg/mL时,α-葡萄糖苷酶抑制率可达94.09%,IC 50值为1.82 mg/mL。碱性蛋白酶-风味蛋白酶双酶分步水解马鹿茸可获得高α-葡萄糖苷酶抑制率的降血糖肽。
参考文献:
[1] GRAY D M. Carbohydrate digestion and absorption-role of small intestine[J]. New England Joural of Medicine, 1975, 292: 1225-1230. DOI:10.1056/NEJM197506052922308.
[2] KRENTZ A J, BAILEY C J. Oral antidiabetic agents: curret role in type 2 diabetes mellitus[J]. Drugs, 2005, 65(3): 385-411.
[3] 田应娟. 啤酒糟多肽的分离纯化及降血糖活性研究[D]. 广州: 华南理工大学, 2011: 24.
[4] 张海娜. 蚕蛹活性多肽的制备及降血压、降血糖活性研究[D]. 重庆: 西南大学, 2013: 51.
[5] OSEGUERA-TOLEDO M E, GONZALEZ-ELVIRA D M, AMAYALLANO S L. Hard-to-cook bean (Ph a se o lu s vulga ris L.) proteins hydrolyzed by alcalase and bromelain produced bioactive peptide fractions that inhibit targets of type-2 diabetes and oxidative stress[J]. Food Research International, 2015, 76: 839-851. DOI:10.1016/ j.foodres.2015.07.046.
[6] SUNWOO H H, NAKANO T, SIM J S. Effect of water-soluble extrac from anlter of wapiti (Cervus elaphus) on the growth of fibroblasts[J]. Canadian Journal of Animal Science, 1997, 77: 343-345.
[7] 陈晓光, 常一丁, 崔志勇, 等. 鹿茸提取物对老年小鼠衰老指标的影响[J]. 中药药理与临床, 1992, 8(2): 17-20. DOI:10.13412/j.cnki. zyyl.1992.02.006.
[8] 陈晓光, 贾越光, 王本祥. 鹿茸提取物对老年小鼠单胺氧化酶抑制作用的研究[J]. 中国中药杂志, 1992, 17(2): 107-110.
[9] WANG B X, ZHAO X H, QI S B, et al. Effects of repeated administration of deer antler (Rokujo) extract on biochemical changes related to aging in senescence-accelerated mice[J]. Chemical & Pharmaceutical Bulletin (Tokyo), 1988, 36(7): 2587-2592. DOI:10.1248/cpb.36.2587.
[10] WANG B X, ZHAO X H, YANG X W, et al. Identification of the inhibitor for monoamine oxidase B in the extract from deer antler (Rokujo)[J]. Journal of Medical and Pharmaceutical Society for WAKAN-YAKU, 1988, 5: 116-122.
[11] WANG B X, ZHAO X H, YANG X W, et al. Inhibition of lipid peroxidation of deer antler (Rokujo) extract in vivo and in v itro[J]. Journal of Medical and Pharmaceutical Society for WAKAN-YAKU, 1988, 5: 123-128.
[12] 李泽鸿, 武丽敏, 姚玉霞, 等. 梅花鹿鹿茸不同产品中氨基酸含量比较[J]. 氨基酸和生物资源, 2007, 29(3): 16-18. DOI:10.3969/ j.issn.1006-8376.2007.03.005.
[13] 胡太超, 刘玉敏, 陶荣珊, 等. 鹿茸多肽的抗疲劳作用机制研究[J]. 吉林农业大学学报, 2015, 37(4): 469-475. DOI:10.13327/j.jjlau.2015.2399.
[14] ZHOU Q L, GUO Y J, WANG L J, et al. Velvet antler polypeptides promoted proliferation of chondrocytes and osteoblast precursors and fracture healing[J]. Acta Pharmacologica Sinica, 1999, 20(3): 279-282.
[15] 郭颖杰, 周秋丽, 刘平, 等. 鹿茸多肽对骨、软骨细胞增殖的实验研究[J]. 中国生化药物杂志, 1998, 19(2): 74-76.
[16] 周秋丽, 刘永强, 王颖, 等. 梅花鹿茸和马鹿茸多肽化学性质及生物活性比较[J]. 中国中药杂志, 2001, 26(10): 699-702.
[17] 王华, 黄宜兵, 高科翔, 等. 酶解鹿茸肽的制备、纯化及抗氧化活性[J].高等学校化学学报, 2010, 31(12): 2390-2395.
[18] 潘风光, 孙威, 周玉, 等. 梅花鹿鹿茸活性多肽的提取及免疫功效的初步研究[J]. 中国生物制品学杂志, 2007, 20(9): 669-673. DOI:10.3969/j.issn.1004-5503.2007.09.011.
[19] 张双健, 姜宁, 朱静, 等. 马鹿茸干品多肽降糖活性研究[J]. 药物生物技术, 2013, 20(6): 532-534.
[20] 姜宁, 张双健, 朱静, 等. 一种新型马鹿茸多肽纯化、鉴定及体外降血糖活性[J]. 中国医科大学学报, 2016, 47(3): 363-367. DOI:10.11665/j.issn.1000-5048.20160320.
[21] 全国食品工业标准化技术委员会. 蛋白酶活性的测定方法: GB/T 23527—2009[S]. 北京: 中国标准出版社, 2009.
[22] ADLER-NISSEN J. Control of the proteolytic reaction and of the level of bitterness in protein hydrolysis processes[J]. Journal of Chemical Technology & Biotechnology, 2008, 34(3): 215-222. DOI:10.1002/ jctb.280340311.
[23] LI T, ZHANG X D, SONG Y W, et al. A microplate-based screening method for alpha-glucosidase inhibitors[J]. 中国临床药理学与治疗学, 2005(10): 1128-1134.
[24] 梁凯. 汉麻籽粕降血糖肽的酶法制备及其分离纯化[D]. 广州: 华南理工大学, 2014: 29.
[25] GONZÀLEZ-TELLO P, CAMACHO F, JURADO E, et al. Enzymatic hydrolysis of whey proteins: Ⅰ. kinetic models[J]. Biotechnology and Bioengineering, 1994, 44(4): 523-528. DOI:10.1002/bit.260440415.
[26] 许丹. 鱿鱼皮胶原蛋白肽的制备及其对类风湿性关节炎的作用的研究[D]. 舟山: 浙江海洋学院, 2012: 15.
[27] 刘振锋, 戴圣佳, 吕卫金, 等. 双酶分步水解制备鱿鱼皮胶原蛋白肽的工艺条件优化[J]. 食品科技, 2015, 40(3): 148-153. DOI:10.13684/ j.cnki.spkj.2015.03.038.
[28] 周涵黎, 吴悠, 李婷, 等. 洋葱多肽的凝胶色谱分离及体外降糖活性研究[J]. 食品科技, 2016, 41(9): 235-238. DOI:10.13684/j.cnki. spkj.2016.09.047.
[29] 李波, 包怡红, 高锋, 等. 红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J]. 食品工业科技, 201 5, 36(1): 6 3-69. DOI:10.13386/j.issn1002-0306.2015.01.004.
[30] 林鸿佳. 具有α-糖苷酶抑制作用的啤酒糟多肽的分离及其作用机理研究[D]. 广州: 华南理工大学, 2013: 56; 58.
Optimization of Preparation of Hypoglycemic Peptides from Red Deer (Cervus elaphus) Antlers by Two-Step Enzymatic Hydrolysis and Their α-Glucosidase Inhibitory Activity
BAO Meili
1,2, YANG Tianzhi
1, ZHANG Ligang
3, ZHAO Yuhong
1,*
(1. School of Forestry, Northeast Forestry University, Harbin 150040, China; 2. Heilongjiang Vocational College for Nationalities, Harbin 150066, China; 3. College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:This study was designed to optimize the enzymatic preparation of hypoglycemic peptides from red deer (Cervus elaphus) antlers. Alcalase, flavourzyme, neutral protease and trypsin were comparatively evaluated based on α-glucosidase inhibitory activity of hydrolysates to select two suitable enzymes for sequential hydrolysis of red deer antlers. The sequences of two hydrolysis steps were compared for better hypoglycemic activity in vitr o and the hydrolysis conditions were optimized based on degree of hydrolysis (DH), α-glucosidase inhibitory activity and protein recovery with one-factor-at-atime method and orthogonal array design. The results showed that alcalase and fl avourzyme were found to be more suitable and sequential use of alcalase followed by flavourzyme was optimal for higher percentage inhibition of α-glucosidase activity, DH and protein recovery, reaching 21.11%, 19.88% and 39.12%, respectively. The optimal hydrolysis conditions were obtained as follows. Red deer antlers were hydrolyzed firstly with 5 000 U/g alcalase at an initial pH of 8.0 and 60 ℃ with a substrate concentration of 12% for 3 h, and then with 6 000 U/g flavourzyme for 1 h at 45 ℃ with a substrate concentration of 5% after pH adjustment to 6.5. The final hydrolysate exhibited concentration-dependent α-glucosidase inhibitory activity, with a percentage inhibition of 94.09% at 3 mg/mL and IC 50value of 1.82 mg/mL. It was concluded that alcalase-flavourzyme hydrolysis would provide an efficient way to prepare hypoglycemic peptides from red deer antlers.
Key words:Cervus elaphus antler; enzymatic hydrolysis; hypoglycemic peptide
DOI:10.7506/spkx1002-6630-201706014
中图分类号:O629.72
文献标志码:A
文章编号:1002-6630(2017)06-0088-08
收稿日期:2016-04-24
基金项目:中央高校基本科研业务费专项(2572014CAQ02);黑龙江省高校科技成果产业化前期研发培育项目(1254CGZH14)
作者简介:包美丽(1985—),女,助教,硕士研究生,研究方向为功能性食品。E-mail:gaowabml@163.com
*通信作者:赵玉红(1968—),女,副教授,博士,研究方向为天然产物化学。E-mail:zhao@nefu.edu.cn
引文格式:
包美丽, 杨添植, 张立钢, 等. 双酶法制备马鹿茸降血糖肽工艺优化及其对α-葡萄糖苷酶的抑制效果[J]. 食品科学, 2017, 38(6): 88-95. DOI:10.7506/spkx1002-6630-201706014. http://www.spkx.net.cn
BAO Meili, YANG Tianzhi, ZHANG Ligang, et al. Optimization of preparation of hypoglycemic peptides from red deer (Cervu s elap hus) antlers by two-step enzymatic hydrolysis and their α-glucosidase inhibitory activity[J]. Food Science, 2017, 38(6): 88-95. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706014. http://www.spkx.net.cn