于 慧,李明艳,张 典,崔明晓
(鲁东大学食品工程学院,山东 烟台 264025)
摘 要:运用响应面分析方法对裙带菜蛋白酶解工艺条件进行优化。经单酶筛选,在单因素试验基础上,以亚铁离子螯合率和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为主要指标,水解度为辅助指标,研究酶解时间、酶解温度、p H值、底物质量浓度、加酶量对裙带菜蛋白酶解产物抗氧化活性和水解度的影响,并比较优化条件下的酶解液与常用天然抗氧化剂抗坏血酸、合成抗氧化剂丁基羟基茴香醚(butyl hydroxyanisole,BHA)的抗氧化活性。结果表明:复合蛋白酶是裙带菜蛋白酶解的最适用酶,酶解液螯合亚铁离子能力和清除DPPH自由基的最优条件为酶解时间8.1 h、酶解温度50 ℃、pH 7.0、底物质量浓度15 g/L、加酶量0.2%(0.3 AU/g裙带菜粉末)。在此条件下,酶解液的亚铁离子螯合率为88.58%,DPPH自由基清除率为59.22%,水解度为29.72%。对比常用抗氧化剂,在亚铁离子螯合能力方面,酶解液显著高于0.01%抗坏血酸和0.01% BHA(P<0.05),而在DPPH自由基清除能力和还原能力方面,酶解液低于0.01%抗坏血酸和0.01% BHA(P<0.05)。
关键词:裙带菜;酶解;响应面;抗氧化活性;水解度
裙带菜(Un daria p inna tifida)属褐藻门、褐子纲、海带目、翅藻科、裙带菜属,是经济价值、药用价值很高的大型褐藻,含有多种营养物质,除多糖和粗纤维外,其蛋白质含量约占藻体的14%~17%,仅次于龙须菜和紫菜 [1-2]。在我国裙带菜广泛分布或养殖于大连、烟台、威海、荣城、青岛和嵊泗群岛等海域,而烟台海域有丰富的裙带菜资源,且价格便宜 [2]。目前,关于裙带菜的研究主要集中在多糖和类胡萝卜素上,工业上对裙带菜的综合利用主要以提取海藻酸钠和碘为主,工业利用率仅达3 0%左右,还有5 0%以上的海藻成分成为废弃物,其中蛋白质占60%,未得到有效利用 [3]。这不仅浪费了大量的自然资源,还带来了一系列环境污染问题 [4]。抗氧化肽是目前国内外研究较多的一种生物活性肽,具有抑制、延缓脂质氧化,保护人体组织器官免受自由基侵害的作用。食源性蛋白质通过水解作用得到的抗氧化肽具有安全性高、抗氧化性强和易被吸收等特点,因此在食品、制药和化妆品行业中具有极大的潜在利用价值 [5-7]。尤其近几年,有关海藻生物活性多肽的研究也极为活跃,研究人员已从海藻中分离得到多种可清除体内自由基,具有抗氧化作用的海藻活性肽 [8-12],而酶解制备裙带菜蛋白中抗氧化肽的报道较少,Je等 [13]从韩国产裙带菜的酶解产物中获得了水溶性抗氧化物质,发现其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基具有较强的清除能力,但对超氧阴离子自由基的清除能力较弱,总体清除自由基能力弱于VC,显示了裙带菜能够作为水溶性抗氧化剂的新资源。
本实验利用复合蛋白酶水解裙带菜蛋白,在单因素试验基础上,运用响应面分析法对水解工艺条件进行优化并研究酶解液的抗氧化活性,旨在为酶解制备生物活性肽和裙带菜的深加工提供一定理论依据。
1.1 材料与试剂
裙带菜(U n d a ria p in n a tifid a),采于山东烟台渤海海域。使用前清洗、冻干、粉碎并过80 目筛后置于-18 ℃保存用(蛋白质含量为14.73%)。
复合蛋白酶(1.5 AU/g) 丹麦诺维信有限公司;碱性蛋白酶(2.4 AU/g) 南京诚纳化工有限公司;胃蛋白酶(3 000 U/g) 上海蓝季科技发展有限公司;胰蛋白酶(50 000 U/g) 国药集团化学试剂有限公司;木瓜蛋白酶(25 U/g) 北京奥博星生物技术有限责任公司;DPPH、菲洛嗪 美国Sigma公司;抗坏血酸、三氯乙酸、三氯化铁、铁氰化钾、无水乙醇等均为分析纯。
1.2 仪器与设备
pB-10型p H计 新锐仪表仪器有限公司;ZHWY-1102双层恒温培养振荡器 上海智城分析仪器制造有限公司;LGJ-18S真空冷冻干燥机 北京松源华兴科技发展有限公司;XMTD-2MA电热恒温水浴锅 山东省龙口市先科仪器公司;TDL-5-A离心机 上海安亭科学仪器厂;XW-80A微型旋涡混合仪 上海沪西分析仪器厂有限公司;721型可见分光光度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 裙带蛋白酶解工艺流程 [13]
裙带菜粉末→加磷酸缓冲溶液→调整酶解条件→酶解→灭酶(8 5 ℃,15 min)→离心(5 000 r/min、20 min)→取上清液→裙带菜蛋白酶解液
1.3.2 总氮含量的测定
采用凯氏定氮法 [14]。
1.3.3 水解度的测定
采用甲醛滴定法 [15]。
1.3.4 酶解液DPPH自由基清除能力的测定 [16]
取2 mL 0.2 mmol/L的DPPH乙醇溶液置于不同试管中,再加入2 mL裙带菜蛋白酶解液,混合均匀,室温条件下避光反应30 min,在517 nm波长处测定吸光度。同时以2 mL DPPH乙醇溶液与2 mL磷酸缓冲溶液的混合液做对照实验;2 mL乙醇与2 mL样品混合液做空白实验。按式(1)进行DPPH自由基清除率的计算:
式中:A 1为加酶解液后DPPH溶液的吸光度;A 2为空白酶解液的吸光度;A 3为未加酶解液时DPPH溶液的吸光度。
1.3.5 酶解液对亚铁离子螯合能力的测定 [17]
取2 m L裙带菜蛋白酶解液于试管中,加入2.7 mL蒸馏水和0.1 mL 2 mmol/L的FeCl 2溶液,再加入0.2 mL 5 mmol/L 的菲洛嗪溶液振荡使其充分混匀,室温条件下反应10 min,于波长562 nm处测定其吸光度。用蒸馏水代替样品溶液做对照实验,用蒸馏水代替菲洛嗪溶液做空白实验。按式(2)进行亚铁离子螯合率的计算:
式中:A 1为实验组的吸光度;A 2为空白组的吸光度;A 3为对照组的吸光度。
1.3.6 还原力的测定 [18]
取1 m L裙带菜蛋白酶解液于试管中,加2.5 mL 0.2 mol/L的磷酸缓冲液(p H 6.6)、2.5 mL 1%铁氰化钾溶液,混匀后于5 0 ℃水浴保温3 0 min,再加入2.5 m L 10%的三氯乙酸溶液,混匀后3 000 r/min离心1 0 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 m L 0.1% Fe Cl 3溶液,混匀静置1 0 min后,于波长700 nm处测定其吸光度,记为酶解液的还原力。吸光度越大,表示还原能力越强。
1.3.7 最佳酶种类的选择
参照Je等 [13]的方法,称取1 g裙带菜粉末于250 mL锥形瓶中,加入1 0 0 m L磷酸缓冲溶液,再分别加入100 mg胰蛋白酶、胃蛋白酶、碱性蛋白酶、复合蛋白酶及木瓜蛋白酶,于各自最适水解温度水解8 h,各蛋白酶的水解条件见表1。酶解结束后,85 ℃灭酶15 min,5 000 r/min离心10 min后,取上清液测定各酶解液的亚铁离子螯合率、DPPH自由基清除率及水解度,通过比较确定最适用酶。
表1 不同蛋白酶水解实验条件
Table 1 Experimental conditions for different proteases
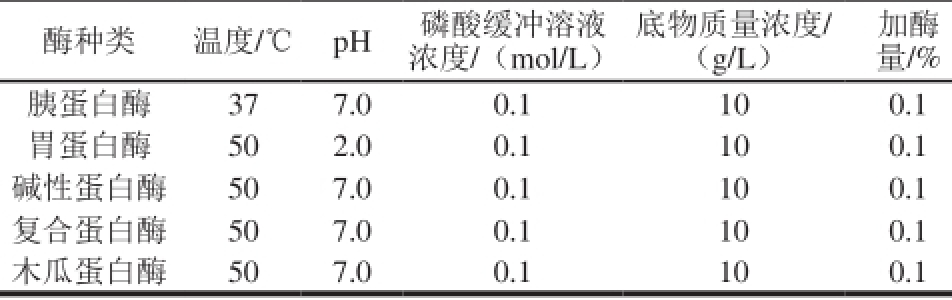
酶种类温度/℃pH磷酸缓冲溶液底物质量浓度/加酶浓度/(mol/L)(g/L)量/%胰蛋白酶37 7.0 0.1 10 0.1胃蛋白酶50 2.0 0.1 10 0.1碱性蛋白酶50 7.0 0.1 10 0.1复合蛋白酶50 7.0 0.1 10 0.1木瓜蛋白酶50 7.0 0.1 10 0.1
1.3.8 酶解条件单因素试验
1.3.8.1 酶解时间的确定
选取复合蛋白酶,在底物质量浓度10 g/L、加酶量0.1%、酶解温度50 ℃、pH 7.0的条件下,选取酶解时间为2、4、6、8、10 h,考察酶解时间对裙带菜蛋白水解度及酶解液亚铁离子螯合能力和DPPH自由基清除能力的影响。
1.3.8.2 pH值的确定
选取复合蛋白酶,在酶解时间8 h、底物质量浓度10 g/L、加酶量0.1%、酶解温度50 ℃的条件下,选取pH值为5.5、6.0、6.5、7.0、7.5,考察pH值对裙带菜蛋白水解度及酶解液亚铁离子螯合能力和DPPH自由基清除能力的影响。
1.3.8.3 酶解温度的确定
选取复合蛋白酶,在酶解时间8 h、底物质量浓度10 g/L、加酶量0.1%、pH 7.0的条件下,选取酶解温度分别为35、40、45、50、55 ℃,考察酶解温度对裙带菜蛋白水解度及酶解液亚铁离子螯合能力和DPPH自由基清除能力的影响。
1.3.8.4 底物质量浓度的确定
选取复合蛋白酶,在酶解时间8 h、加酶量0.1%、酶解温度50 ℃、p H 7.0的条件下,选取底物质量浓度1、5、1 0、15、20 g/L,考察底物质量浓度对裙带菜蛋白水解度及酶解液亚铁离子螯合能力和DPPH自由基清除能力的影响。
1.3.8.5 加酶量的确定
选取复合蛋白酶,在酶解时间8 h、底物质量浓度15 g/L、酶解温度50 ℃、pH 7.0的条件下,选取加酶量为0.02%、0.1%、0.2%、0.3%、0.4%,考察加酶量对裙带菜蛋白水解度及酶解液亚铁离子螯合能力和DPPH自由基清除能力的影响。
1.3.9 响应面优化试验
根据单因素试验结果,运用Box-Behnken设计原理,以酶解时间(X 1)、pH值(X 2)、酶解温度(X 3)为变量,展开三因素三水平的响应面试验,因素与水平设计见表2。采用F检验对试验结果进行方差分析以评价模型的统计意义。数据分析软件采用Design-Expert 8.0.6.1。
表2 Box-Behnken试验设计因素与水平
Table 2 Independent variables and their coded and actual values used in Box-Behnken experimental design
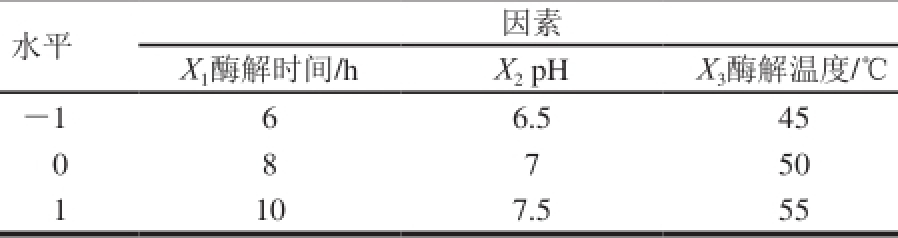
水平因素X 1酶解时间/h X 2pH X 3酶解温度/℃-1 6 6.5 45 0 8 7 50 1 10 7.5 55
1.4 数据处理
采用Tukey-Kramer post-hoc test对实验结果进行差异显著性分析,用Excel 2010软件对数据进行平均数和标准偏差的统计分析并作图。
2.1 酶种类的选择
表3 不同蛋白酶对裙带菜蛋白酶解效果的影响
Table 3 Effect of protease type on hydrolysis effi ciency of Undaria pinnatifi da protein %
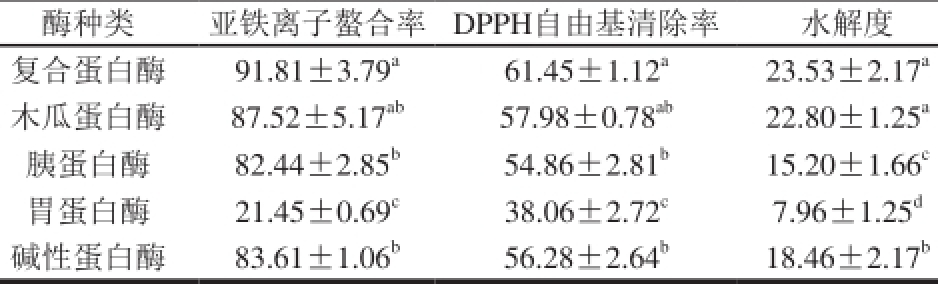
注:同列字母不同表示差异显著(P<0.05)。下同。
酶种类亚铁离子螯合率DPPH自由基清除率水解度复合蛋白酶91.81±3.79 a61.45±1.12 a23.53±2.17 a木瓜蛋白酶87.52±5.17 ab57.98±0.78 ab22.80±1.25 a胰蛋白酶82.44±2.85 b54.86±2.81 b15.20±1.66 c胃蛋白酶21.45±0.69 c38.06±2.72 c7.96±1.25 d碱性蛋白酶83.61±1.06 b56.28±2.64 b18.46±2.17 b
由表3可知,复合蛋白酶、胰蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶5 种蛋白酶的酶解产物均有一定的亚铁离子螯合能力和DPPH自由基清除能力。然而由于不同蛋白酶具有不同的特异酶切位点,可水解蛋白质长肽链上不同的部位,所以酶解产物的抗氧化活性就有所不同 [19]。其中,复合蛋白酶和木瓜蛋白酶的酶解产物具有最高的亚铁离子螯合能力和DPPH自由基清除能力,且水解效果最好,但二者不存在显著性差异(P>0.05),其次是碱性蛋白酶、胰蛋白酶,胃蛋白酶酶解产物的亚铁离子螯合能力和DPPH自由基清除能力最低,且水解效果最差。说明复合蛋白酶和木瓜蛋白酶对裙带菜蛋白水解较为彻底,能得到大量裙带菜蛋白水解的具有抗氧化活性的小分子肽。复合蛋白酶是针对水解食物蛋白质开发的杆菌蛋白酶复合物,与其他内切蛋白酶相比,具有明显优势是其所得的酶解液没有苦味,提高了酶解产物质量 [20]。所以选择复合蛋白酶作为酶解裙带菜蛋白的实验用酶。
2.2 单因素试验结果
2.2.1 酶解时间的选择

图1 酶解时间的影响
Fig. 1 Effect of hydrolysis time on hydrolysis efficiency of Undaria pinnatifi da protein
由图1可知,随着酶解时间的延长,在一定范围内,亚铁离子螯合能力、DPPH自由基清除能力和水解度不断增加,当时间为8 h时,亚铁离子螯合率为98.48%,DPPH自由基清除率为5 6.7 8%,水解度为2 8.5 9%,均达到最高值。此后,随着酶解时间的延长,底物逐渐被转化,一些具有抗氧化活性的肽段被过度水解为更小的肽段和氨基酸等,因而酶解液的亚铁离子螯合率、DPPH自由基清除率和水解度开始降低。由此,酶解时间以8 h为宜。
2.2.2 pH值的选择
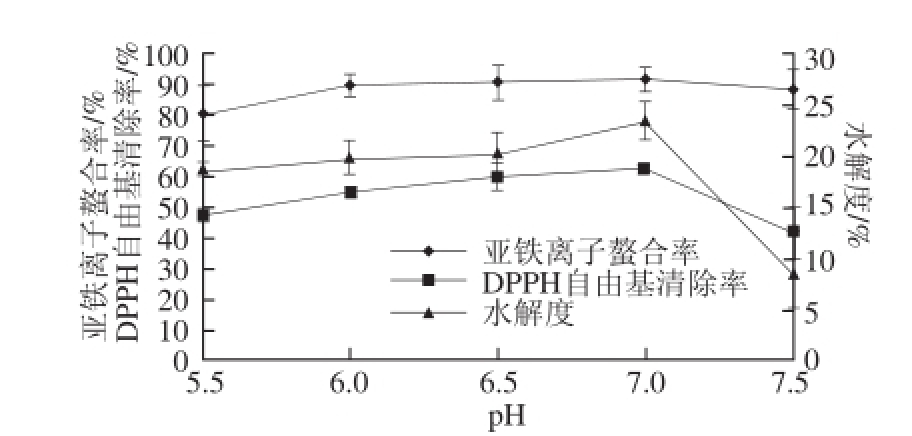
图2 pH值的影响
Fig. 2 Effect of pH on hydrolysis efficiency of Undaria pinnatifida protein
pH值影响酶的稳定性,改变pH值大小,会影响蛋白酶分子的空间构象、与催化有关基团的解离状况、酶分子及底物的结合状态及酶-底物复合物的解离,从而影响酶解反应,所以p H值对酶解反应影响很大 [21]。由图2可知,随着p H值的升高,亚铁离子螯合率、DPPH自由基清除率和水解度开始逐渐增大,当pH值为7.0时,亚铁离子螯合率、DPPH自由基清除率及水解度均达到最大值,分别为为91.79%、62.92%和23.53%。此后,随着pH值升高,DPPH自由基清除率及水解度均开始迅速减小。由此,酶解裙带菜蛋白的pH值以7.0为宜。
2.2.3 酶解温度的选择

图3 酶解温度的影响
Fig. 3 Effect of temperature on hydrolysis efficiency of Undaria pinnatifi da protein
由图3可知,在一定温度范围内,随着酶解温度的升高,亚铁离子螯合率、DPPH自由基清除率和水解度呈现先升高后降低的趋势,当酶解温度为50 ℃时,亚铁离子螯合率、DPPH自由基清除率及水解度均达到最大值,分别为91.12%、57.44%和23.94%。当酶解温度超过50 ℃时,抗氧化活性及水解度呈下降趋势。可见,在酶解过程中,适当提高温度可增加酶的活力,促进水解及抗氧化肽的产生,若温度过高,酶蛋白变性,酶的稳定性下降,酶解效率也随之降低。因此,裙带菜蛋白的酶解温度以50 ℃为宜。
2.2.4 底物质量浓度的选择
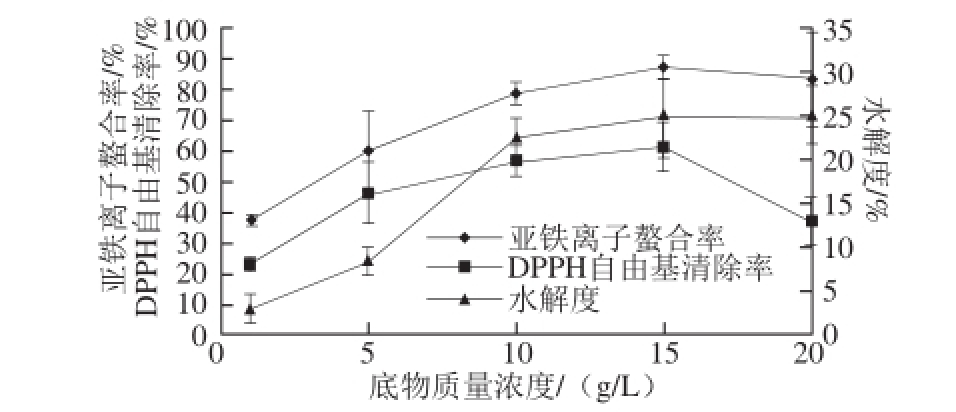
图4 底物质量浓度的影响
Fig. 4 Effect of substrate concentration on hydrolysis efficiency of Undaria pinnatifi da protein
由图4可知,随着底物质量浓度的增加,亚铁离子螯合率、DPPH自由基清除率及水解度逐渐增大,在底物质量浓度为15 g/L时,达到最大值,分别为86.82%、60.85%和24.98%,当底物质量浓度继续增大时,亚铁离子螯合率和DPPH自由基清除率开始减小。这是因为当底物质量浓度小于15 g/L时,随着其质量浓度的增加,水解蛋白较为彻底,致使水解度和抗氧化活性的提高;而当底物质量浓度大于15 g/L时,酶解液过于黏稠,可能使具有抗氧化活性的成分在分离时相对损失增加而致使抗氧化活性降低。因此,酶解裙带菜蛋白的底物质量浓度以15 g/L为宜。
2.2.5 加酶量的选择
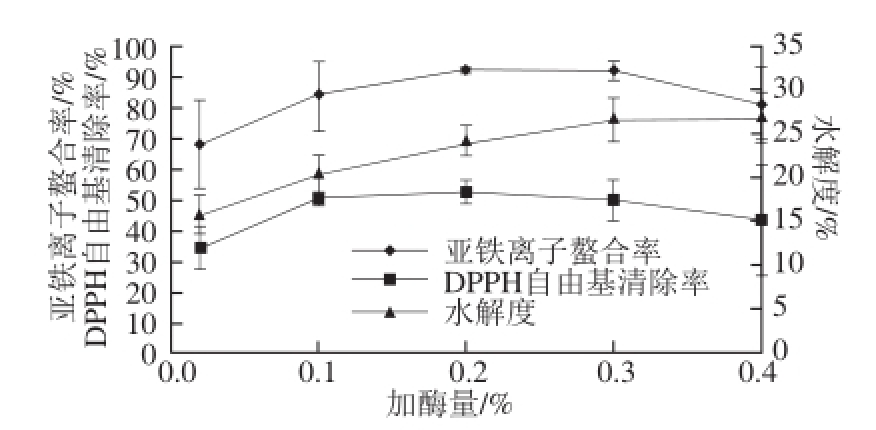
图5 加酶量的影响
Fig. 5 Effect of enzyme dosage on hydrolysis efficiency of Undaria pinnatifida protein
由图5可知,随着加酶量的增加,亚铁离子螯合率和DPPH自由基清除率呈现先升高后降低的趋势,且在加酶量0.2%时取得最大值,分别为91.94%和52.29%。而水解度呈现逐渐增加,在加酶量为0.3%时趋于平稳,但此时由于水解过度,导致亚铁离子螯合能力和DPPH自由基清除能力下降。所以酶解裙带菜蛋白的加酶量以0.2%为宜。
2.3 响应面试验结果
根据单因素试验结果,底物质量浓度和加酶量对抗氧化活性和水解度的影响不如其他3个因素,因此以酶解时间、pH值、酶解温度为变量,进行三因素三水平的响应面试验。
表4 Box-Behnken试验设计及结果
Table 4 Box-Behnken design with experimental results

试验X 1酶解XpH X 3酶解Y 1亚铁离子Y 2DPPH自由Y 3水号时间 2温度螯合率/%基清除率/%解度/% 1 1 0 1 49.52 26.68 20.29 2 0 1 1 56.22 27.43 22.23 3 1-1 0 41.90 40.74 23.43 4 1 0-1 31.09 32.30 22.23 5 1 1 0 54.72 31.81 23.67 6-1 1 0 63.90 25.81 26.81 7 0 0 0 82.60 59.01 29.71 8 0 1-1 37.44 29.63 26.57 9 0 0 0 88.96 58.42 30.44 10 0 0 0 93.37 53.21 28.99 11-1 0 1 47.52 22.64 22.47 12 0-1-1 32.31 30.81 24.16 13-1-1 0 42.39 37.69 18.84 14 0 0 0 89.00 58.40 28.99 15 0 0 0 90.92 63.03 29.71 16-1 0-1 38.83 17.04 21.74 17 0-1 1 51.08 40.92 27.30
复合蛋白酶水解裙带菜蛋白的工艺条件优化根据Box-Behnken试验设计进行了17 组试验,5 组为中心点重复试验(表4)。由于抗氧化值与水解度不存在线性关系 [22],但可能在一定范围内水解度对抗氧化活性有促进作用,为了选取裙带菜蛋白酶解液抗氧化活性的最大值,本实验把抗氧化活性作为最接近水解条件的第一指标,水解度作为辅助指标,利用Design-Expert 8.0.6.1软件对亚铁离子螯合能力(Y 1)、DPPH自由基清除能力(Y 2)与各水解因素进行多元回归拟合。得二次多项式拟合方程为:Y 1=88.96-1.93 X 1+5.58 X 2+8.08 X 3-2.17 X 1X 2+ 2.4 4 X 1X 3+2.5×1 0 -3X 2X 3-2 0.3 8 X 1 2-1 7.8 6 X 2
2-26.84X 3 2;Y 2=58.42+3.54X 1-4.44X 2+0.99X 3+0.74X 1X 2-2.81X 1X 3-3.08X 2X 3-15.97X 1 2-8.44X 2
2-17.78X 3
2。
表5 亚铁离子螯合率二次回归方程方差分析结果Table 5 Analysis of variance of regression equation for ferrous ion-chelating ability
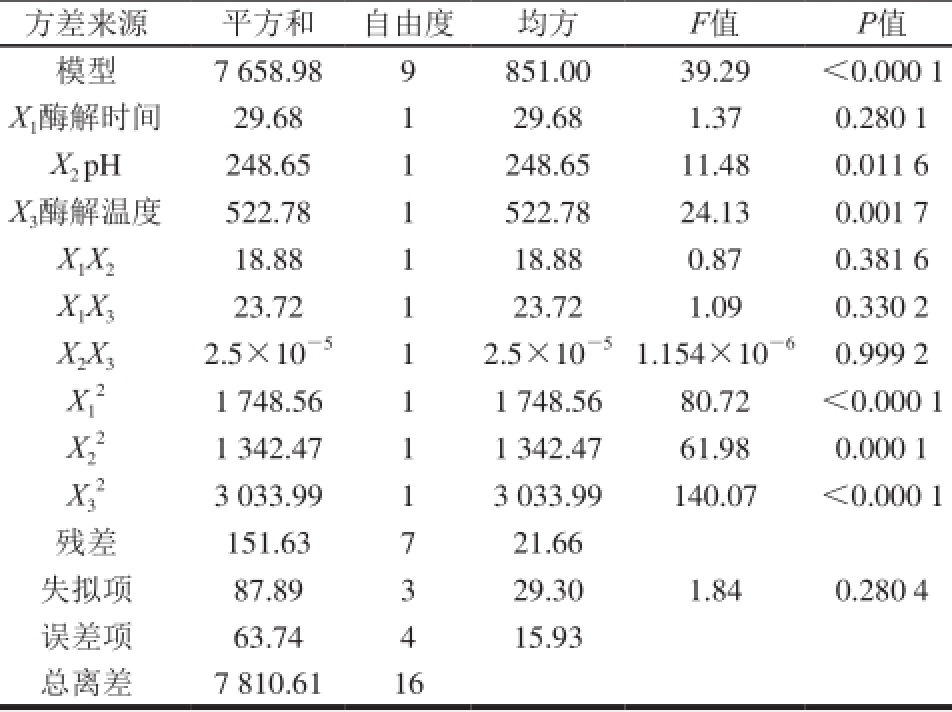
方差来源平方和自由度均方F值P值模型7 658.98 9 851.00 39.29<0.000 1 X 1酶解时间29.68 1 29.68 1.37 0.280 1 X 2 pH 248.65 1 248.65 11.48 0.011 6 X 3酶解温度522.78 1 522.78 24.13 0.001 7 X 1X 218.88 1 18.88 0.87 0.381 6 X 1X 323.72 1 23.72 1.09 0.330 2 X 2X 32.5×10 -51 2.5×10 -51.154×10 -60.999 2 X 21 748.56 1 1 748.56 80.72<0.000 1 1 X 21 342.47 1 1 342.47 61.98 0.000 1 2 X 23 033.99 1 3 033.99 140.07<0.000 1 3残差151.63 7 21.66失拟项87.89 3 29.30 1.84 0.280 4误差项63.74 4 15.93总离差7 810.61 16
表6 DPPH自由基清除率二次回归方程方差分析结果
Table 6 Analysis of variance of regression equation for DPPH radical scavenging activity
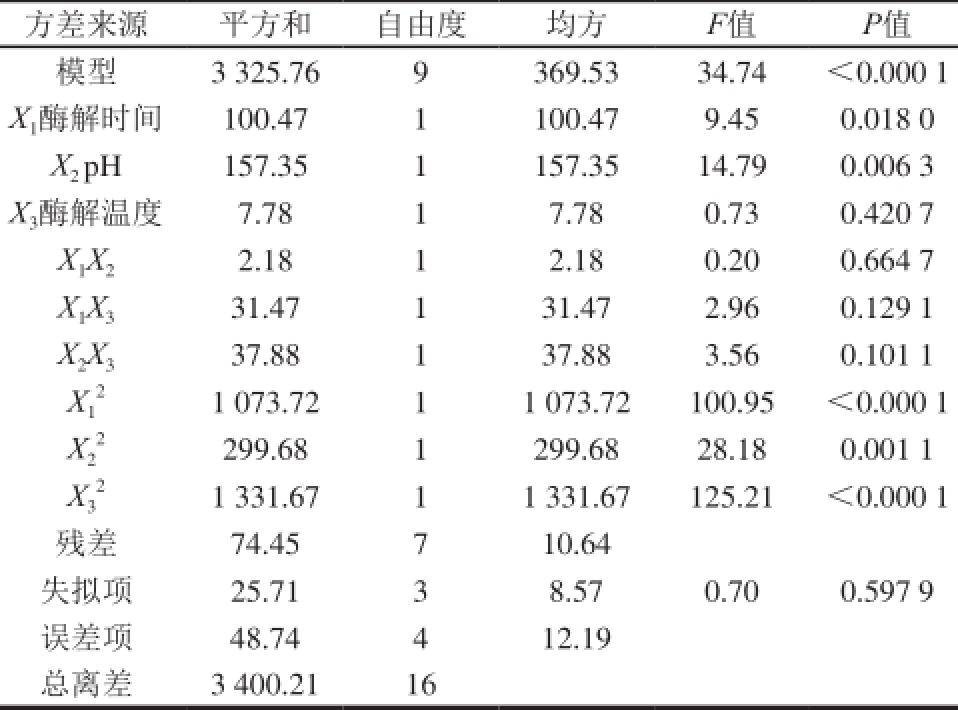
方差来源平方和自由度均方F值P值模型3 325.76 9 369.53 34.74<0.000 1 X 1酶解时间100.47 1 100.47 9.45 0.018 0 X 2pH 157.35 1 157.35 14.79 0.006 3 X 3酶解温度7.78 1 7.78 0.73 0.420 7 X 1X 22.18 1 2.18 0.20 0.664 7 X 1X 331.47 1 31.47 2.96 0.129 1 X 2X 337.88 1 37.88 3.56 0.101 1 X 21 073.72 1 1 073.72 100.95<0.000 1 1 X 2299.68 1 299.68 28.18 0.001 1 2 X 21 331.67 1 1 331.67 125.21<0.000 1 3残差74.45 7 10.64失拟项25.71 3 8.57 0.70 0.597 9误差项48.74 4 12.19总离差3 400.21 16
Y 1方程回归模型的决定系数R 2为0.980 6,P<0.000 1,说明模型达到极显著水平,失拟项P为0.280 4,影响不显著,说明该方程拟合良好;Y 2方程回归模型的决定系数R 2为0.978 1,P<0.000 1,说明模型达到极显著水平,失拟项P为0.597 9,影响不显著,说明该方程拟合良好 [23-27]。因此,可以应用Y 1和Y 2两个方程描述各响应变量与两个响应值之间的关系,以评价各因素对相应值影响的显著性。
由表5和图6可以看出,响应值为亚铁离子螯合率的模型,各响应因素影响程度依次为:X 3>X 2>X 1,酶解温度对于酶解液亚铁离子螯合率的影响最大;由表6和图7可以看出,响应值为DPPH自由基清除率的模型,各响应因素影响程度依次为:X 2>X 1>X 3,p H值对于酶解液DPPH自由基清除率的影响最大。
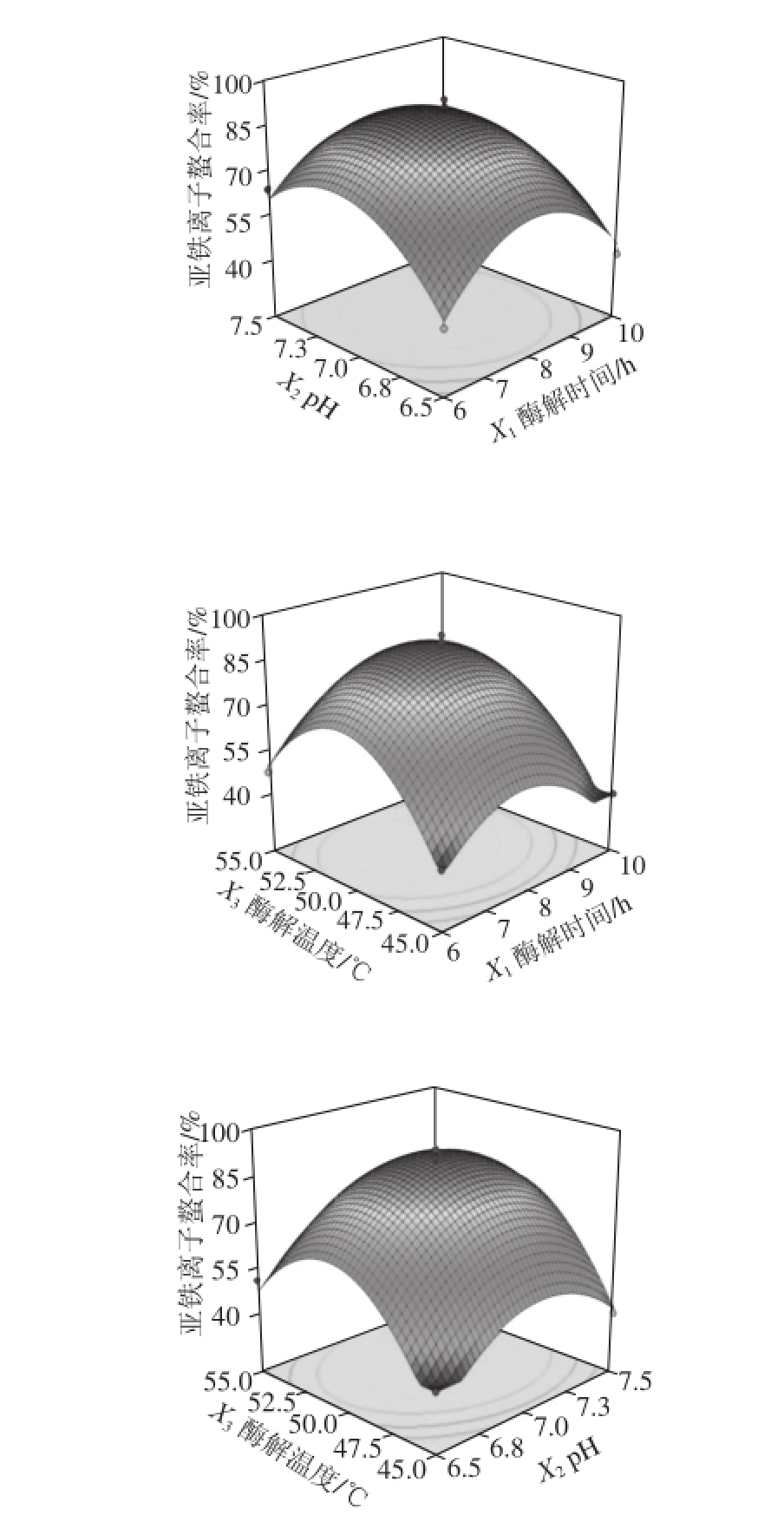
图6 各因素交互作用对亚铁离子螯合能力的影响
Fig. 6 Response surface plots for the interactive effects of different variables on ferrous ion-chelating ability
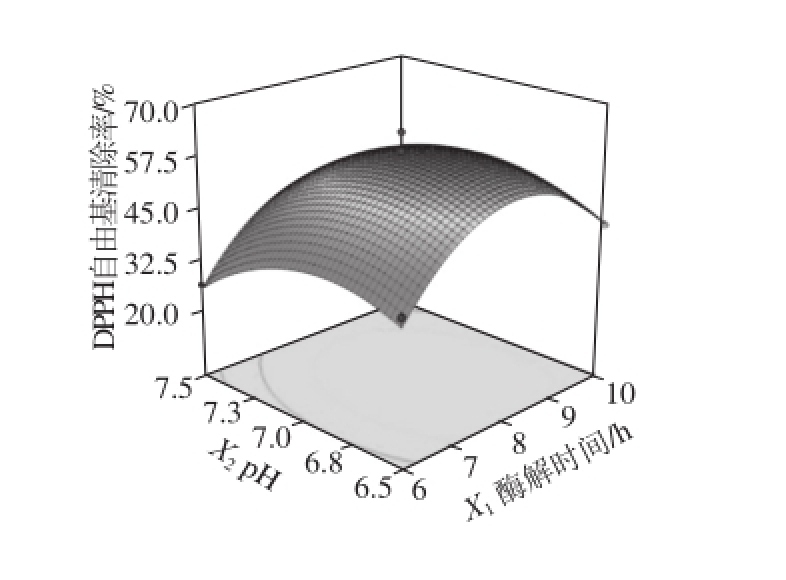
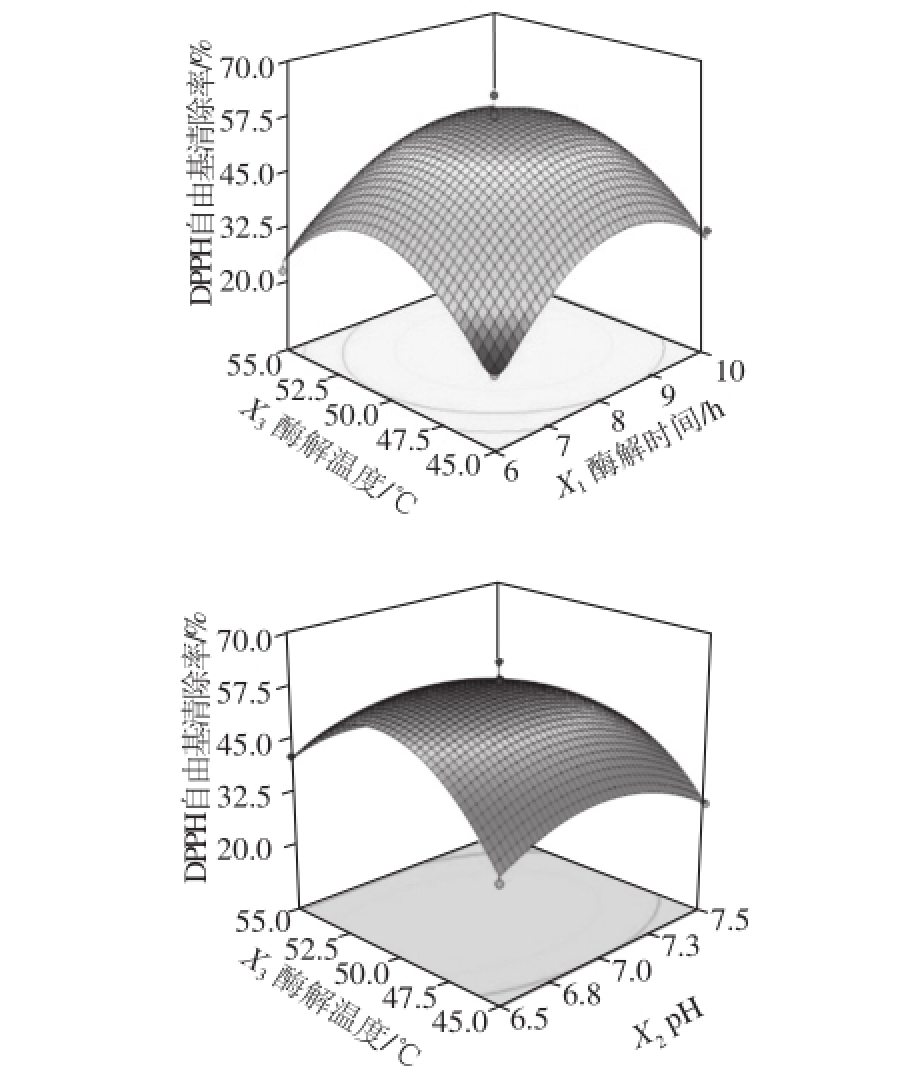
图7 各因素交互作用对DPPH自由基清除能力的影响
Fig. 7 Response surface plots for the interactive effects of different variables on DPPH radical scavenging activity
2.4 验证实验结果
根据Box-Behnken试验所得出的结果以及二次多项式回归方程,再利用Design-Expert 8.0.6.1软件获得了最佳酶解条件的各因素组合为酶解时间8.1 h、酶解温度50.5 ℃、pH 7.0、底物质量浓度15 g/L、加酶量0.2%,此时预测的亚铁离子螯合能力为89.3%,DPPH自由基清除能力为58.5%,水解度为29.56%。为检验模型预测的准确性,选取酶解时间8.1 h、酶解温度50 ℃、p H 7.0、底物质量浓度15 g/L、加酶量0.2%,做3组平行实验进行验证,得到的亚铁离子螯合率达88.58%,DPPH自由基清除率达59.22%,水解度达29.72%,此结果与最佳理论条件下所得的结果误差均在1%以内。由此可见,以抗氧化活性为指标,采用响应面法对复合蛋白酶酶解裙带菜蛋白工艺条件进行优化是行之有效的。
2.5 酶解液与其他抗氧化剂的比较
亚铁离子螯合能力、DPPH自由基清除能力和还原能力是评价抗氧化剂抗氧化能力的3 个重要方面。表7显示,参考文献[16]对比0.01%抗坏血酸和0.0 1%丁基羟基茴香醚(b uty l hydroxy aniso le,BHA),最优条件下裙带菜蛋白酶解液显著拥有更强的亚铁离子螯合能力(P<0.05),达到了88.58%。与酶解前的裙带菜相比,其亚铁离子螯合能力显著提高(P<0.05)。在DPPH自由基清除能力和还原能力方面,最优条件下裙带菜蛋白蛋白酶解液显示出了一定的抗氧化能力,但均不如0.01%抗坏血酸和0.01% BHA的抗氧化能力(P<0.05),然而对比于酶解前的裙带菜,最优条件下裙带菜蛋白酶解液的DPPH自由基清除能力有明显优势(P<0.05)。这些均说明了最优条件下裙带菜蛋白酶解液有较好的抗氧化能力,尤其在亚铁离子螯合能力方面。
表7 裙带菜蛋白酶解液与常用抗氧化剂之间抗氧化能力的比较
Table 7 Comparison of antioxidant activities between the hydrolysate and common antioxidants
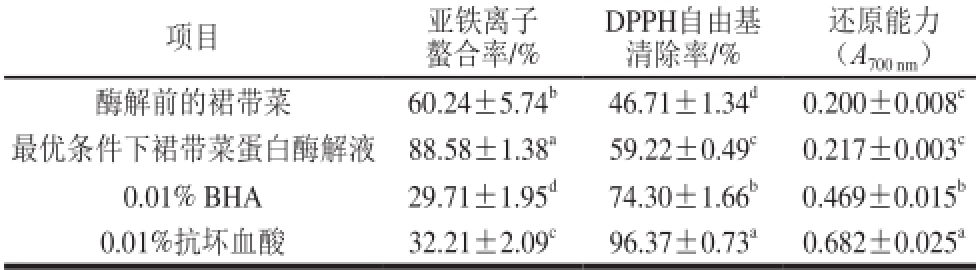
项目亚铁离子DPPH自由基还原能力螯合率/%清除率/%(A 700 nm)酶解前的裙带菜60.24±5.74 b46.71±1.34 d0.200±0.008 c最优条件下裙带菜蛋白酶解液88.58±1.38 a59.22±0.49 c0.217±0.003 c0.01% BHA 29.71±1.95 d74.30±1.66 b0.469±0.015 b0.01%抗坏血酸32.21±2.09 c96.37±0.73 a0.682±0.025 a
抗氧化剂的作用表现在多个方面,不同类型的抗氧化剂,有其不同特点。近年来较为关注的海藻多肽的抗氧化活性,包含较为复杂的反应模式,如电子/氢供体、金属离子螯合、自由基清除和还原能力。海藻蛋白酶解液的抗氧化活性受水解程度的影响,酶解前的海藻蛋白由于结构紧密、水溶性等问题而抗氧化能力较小,通过蛋白酶水解打破了海藻蛋白天然结构,从而形成更多的开放、暴露氨基酸残基,通过上述反应模式实现抗氧化作用。可溶性抗氧化多肽的增加是蛋白酶解液抗氧化能力提高的主要原因。本研究发现,裙带菜在蛋白酶解后,亚铁离子螯合能力和DPPH自由基清除能力均显著提高(表6),且随着酶解时间的延长、水解度的增加而增强(图1)。这些结果说明抗氧化能力的提高,与其酶解后抗氧化多肽的产生有关。但抗氧化能力与其蛋白水解度之间不存在线性关系,只有在特定的水解方式和程度下,酶解物才具有较强的抗氧化能力。这表明特定的组分,如多肽类型、暴露氨基酸残基比例与类型,也是重要的影响因素
[16]。裙带菜的不同蛋白酶解液,其抗氧化能力有显著差异(表3),这个差异与其蛋白水解度相关性不强(表3),这些结果说明了裙带菜蛋白酶解的特定组分与其抗氧化能力有关。过渡金属离子(如亚铁离子等微量元素),能够催化促进活性氧(如·OH、
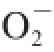 ·)的产生,从而氧化不饱和脂类、蛋白质等。抗氧化剂可以通过与这些金属促氧化剂螯合而实现抗氧化的效果。本研究结果表明,对比常用的天然抗氧化剂抗坏血酸和合成抗氧化剂BHA,裙带菜中的水溶性物质拥有更强的亚铁离子螯合能力,这可能与裙带菜中存在的海藻酸盐等多糖及酚类等物质有关
[17]。而裙带菜蛋白酶解后亚铁离子螯合能力进一步显著增强,并且随着水解度的增加而增强(图1~5),这可能是由于肽键断裂使自由氨基和羧基浓度增加,从而隔离了体系内促氧化的金属离子以达到抗氧化效果。另外还可能是由于某些暴露的氨基酸残基增加引起的,如组氨酸,它是常见的具有金属螯合能力的氨基酸
[28]。通过对蛋白质立体结构的酶解,使具有金属螯合能力的氨基酸残基更多地暴露于水溶液中,增强了与亚铁离子的螯合能力。然而,裙带菜蛋白酶解液的亚铁离子螯合能力随着蛋白水解度上升,达到峰值后,反而随蛋白水解度的进一步上升而降低(图5),这暗示了裙带菜蛋白酶解多肽中有螯合亚铁离子的空间结构存在,随着水解程度加深而遭到破坏,从而减弱了亚铁离子螯合能力。近年来铁元素强化食品的社会需求越来越多,具有亚铁离子螯合能力的安全有效的抗氧化剂非常受关注,因此,这种可食用性天然多肽值得进一步的深入研究和开发利用
[29]。
·)的产生,从而氧化不饱和脂类、蛋白质等。抗氧化剂可以通过与这些金属促氧化剂螯合而实现抗氧化的效果。本研究结果表明,对比常用的天然抗氧化剂抗坏血酸和合成抗氧化剂BHA,裙带菜中的水溶性物质拥有更强的亚铁离子螯合能力,这可能与裙带菜中存在的海藻酸盐等多糖及酚类等物质有关
[17]。而裙带菜蛋白酶解后亚铁离子螯合能力进一步显著增强,并且随着水解度的增加而增强(图1~5),这可能是由于肽键断裂使自由氨基和羧基浓度增加,从而隔离了体系内促氧化的金属离子以达到抗氧化效果。另外还可能是由于某些暴露的氨基酸残基增加引起的,如组氨酸,它是常见的具有金属螯合能力的氨基酸
[28]。通过对蛋白质立体结构的酶解,使具有金属螯合能力的氨基酸残基更多地暴露于水溶液中,增强了与亚铁离子的螯合能力。然而,裙带菜蛋白酶解液的亚铁离子螯合能力随着蛋白水解度上升,达到峰值后,反而随蛋白水解度的进一步上升而降低(图5),这暗示了裙带菜蛋白酶解多肽中有螯合亚铁离子的空间结构存在,随着水解程度加深而遭到破坏,从而减弱了亚铁离子螯合能力。近年来铁元素强化食品的社会需求越来越多,具有亚铁离子螯合能力的安全有效的抗氧化剂非常受关注,因此,这种可食用性天然多肽值得进一步的深入研究和开发利用
[29]。
裙带菜蛋白酶解液的DPPH自由基清除能力的提高,可能与小分子多肽有关。目前研究表明小分子多肽可在氧化外层形成薄膜,从而在目标物周围形成保护膜。彭新颜等 [16]研究表明,乳清蛋白的抗脂质氧化能力和DPPH自由基清除能力,随着其水解时间的延长而增加,这表明了小分子多肽有更好的DPPH自由基清除能力。猪血红蛋白水解物自由基清除能力与其相似,与未水解物相比,水解物具有显著的DPPH自由基清除能力 [30]。本研究中的裙带菜蛋白酶解液的自由基清除能力与乳清蛋白及血红蛋白极其相似,因此,裙带菜蛋白酶解后,其自由基清除能力的提高也与小分子多肽相关。
实验确定了酶解裙带菜蛋白的最佳用酶为复合蛋白酶。通过单因素试验和响应面试验分析,得优化裙带菜蛋白的最佳工艺条件为:酶解时间8.1 h、酶解温度50 ℃、p H 7.0、底物质量浓度1 5 g/L、加酶量0.2%(0.3 AU/g裙带菜粉末)。在此条件下酶解裙带菜蛋白,亚铁离子螯合率为88.58%,DPPH自由基清除率为59.22%,水解度为29.72%。对比常用抗氧化剂,在亚铁离子螯合能力方面,酶解液显著高于0.01%抗坏血酸和0.01% BHA(P<0.05),而在DPPH自由基清除能力和还原能力方面,酶解液低于0.01%抗坏血酸和0.01% BHA(P<0.05)。此结果可为今后裙带菜蛋白抗氧化活性肽的分离纯化提供理论依据。
参考文献:
[1] 周峙苗, 何清, 马晓宇. 东海红藻龙须菜的营养成分分析及评价[J].食品科学, 2010, 31(9): 284-287.
[2] 李兴霞, 董淑风, 刘禾蔚. 烟台海域裙带菜营养成分分析及评价[J].安徽农业科学, 2010, 38(33): 18768-18769; 18772. DOI:10.3969/ j.issn.0517-6611.2010.33.056.
[3] 王明艳, 周琴, 杨俊, 等. 响应面法同步优化裙带菜中蛋白和多糖提取工艺[J]. 食品科学, 2012, 33(24): 66-71. DOI:10.7506/spkx1002-6630-201224014.
[4] 苌钊. 裙带菜的综合利用研究[D]. 青岛: 中国海洋大学, 2013.
[5] 张晖, 唐文婷, 王立, 等. 抗氧化肽的构效关系研究进展[J].食品与生物技术学报, 20 1 3, 32(7): 6 7 3-6 79. DOI:10.396 9/ j.issn.1673-1689.2013.07.001.
[6] 阮晓慧, 韩军岐, 张润光, 等. 食源性生物活性肽制备工艺、功能特性及应用研究进展[J]. 食品与发酵工业, 2016, 42(6): 248-253. DOI:10.13995/j.cnki.11-1802/ts.201606043.
[7] 刘铭, 刘玉环, 王允圃, 等. 制备、纯化和鉴定生物活性肽的研究进展及应用[J]. 食品与发酵工业, 2016, 42(4): 244-251. DOI:10.13995/ j.cnki.11-1802/ts.201604045.
[8] HEO S J, PARK E J, LEE K W, et al. Antioxidant activities of enzymatic extracts from brown seaweeds[J]. Bioresource Technology, 2005, 96: 1613-1623. DOI:10.1016/j.biortech.2004.07.013.
[9] 陈志华, 吴文惠, 王幸, 等. 海藻肽的化学结构特征和活性作用研究进展[J]. 氨基酸和生物资源, 2010, 32(2): 66-69. DOI:10.3969/ j.issn.1006-8376.2010.02.019.
[10] SHEIH I C, WU T K, FANG T J. Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems[J]. Bioresource Technology, 2009, 100: 3419-3425. DOI:10.1016/j.biortech.2009.02.014.
[11] 万海霞, 杨政茂, 魏玉西, 等. 多管藻蛋白质酶解多肽的抗氧化活性研究[J]. 中国海洋药物杂质, 2011, 30(1): 6-10.
[12] OU Y, QIAO Y Y, WANG W Y, et al. Antioxidative peptides prepared from S p iru lina platensis and its antioxidative activities in vitro[J]. Journal of Food Science and Biotechnology, 2014, 33: 22-26.
[13] JE J Y, PARK P J, KIM E K, et al. Antioxidant activity of enzymatic extracts from the brown seaweed Undaria pinnatifida by electron spin resonance spectroscopy[J]. LWT-Food Science Technology, 2009, 42: 874-878. DOI:10.1016/j.lwt.2008.10.012.
[14] 张水华. 食品分析[M]. 北京: 中国轻工业出版社, 2004: 156-160.
[15] 周慧江, 朱振宝, 易建华. 核桃蛋白水解物水解度测定方法比较[J]. 粮食与油脂, 2012, 25(2): 28-30. DOI:10.3969/j.issn.1008-9578.2012.02.008.
[16] 彭新颜, 孔保华, 熊幼翎. 乳清蛋白水解物抗氧化活性的研究[J]. 食品科学, 2009, 30(3): 167-172. DOI:10.3321/j.issn:1002-6630.2009.03.037.
[17] WANG T, JONSDOTTIR R, KRISTINSSON H G. et al. Enzymeenhanced extraction of antioxidant ingredients from red algae P alm aria p alm ate[J]. LWT-Food Science Technology, 2010, 43: 1387-1393. DOI:10.1016/j.lwt.2010.05.010.
[18] SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R. Purification and identification of antioxidant peptides from the skin protein hydrolysate of two marine fi shes, horse mackerel (Magalaspis co rdyla) and croaker (Otolithes ruber)[J]. Amino Acids, 2012, 42: 1641-1649. DOI:10.1007/s00726-011-0858-6.
[19] 赵春江, 孙进, 彭莉娟, 等. 响应面法优化鸡腿菇子实体蛋白酶解工艺条件[J]. 中国食品学报, 2013, 13(6): 88-96.
[20] 谢静, 李宗军. Protamex复合蛋白酶酶解猪骨粉最佳条件研究[J]. 食品工业科技, 2009, 30(9): 196-198.
[21] 李俊江, 潘道东, 郭宇星, 等. 鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究[J]. 食品科学, 2012, 33(3): 126-130.
[22] 唐道邦, 裴小平, 徐玉娟, 等. 响应曲面法优化鸡肉蛋白抗氧化肽制备工艺研究[J]. 食品科学, 2010, 31(6): 86-90.
[23] 王占一, 戴博, 张立华, 等. 石榴皮多糖硒酸酯制备工艺参数优化及其结构分析[J]. 食品科学, 2016, 37(10): 40-46. DOI:10.7506/ spkx1002-6630-201610008.
[24] 千春录, 侯顺超, 殷健东, 等. 响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性[J]. 食品科学, 2016, 37(10): 76-81. DOI:10.7506/spkx1002-6630-201610013.
[25] 厉望, 靳挺, 武玉学. 带鱼蛋白酶解条件优化及酶解物抗氧化性能[J].食品科学, 2013, 34(9): 234-239. DOI:10.7506/spkx1002-6630-201309048.
[26] 常飞, 杨雪果, 肖士成, 等. 脱脂羊脑蛋白酶解条件优化及酶解产物体外抗氧化活性[J]. 食品科学, 2015, 36(3): 114-121. DOI:10.7506/ spkx1002-6630-201503022.
[27] 马艺丹, 刘红, 马思聪, 等. 神秘果种子多糖的响应面优化提取及其抗氧化活性研究[J]. 食品工业科技, 2016, 37(10): 289-294. DOI:10.13386/j.issn1002-0306.2016.10.050.
[28] 彭新颜, 孔保华, 熊幼翎. 由碱性蛋白酶制备的乳清蛋白水解物抗氧化活性的研究[J]. 中国乳品工业学报, 2008, 36(4): 8-12. DOI:10.3969/j.issn.1001-2230.2008.04.002.
[29] 刘温, 楼乔明, 杨文鸽, 等. 多肽金属元素螯合物研究进展[J]. 食品与发酵工业, 2014, 40(4): 142-146. DOI:10.13995/j.cnki.11-1802/ ts.2014.04.006.
[30] CHANG C Y, WU K C, CHIANG S H. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J]. Fo od Chemistry, 2 00 7, 1 00: 15 3 7-1 54 3. DOI:1 0.1 0 1 6/ j.foodchem.2005.12.019.
Optimization of Enzymatic Hydrolysis of Undaria pinnatifida Protein and Antioxidant Activity of Its Hydrolysate
YU Hui, LI Mingyan, ZHANG Dian, CUI Mingxiao
(School of Food Engineering, Ludong University, Yantai 264025, China)
Abstract:This paper deals with the optimization of the process conditions for the enzymatic hydrolysis of Und a ria pinnatifida protein using response surface methodology (RSM). With this aim in mind, after selection of an appropriate enzyme, the effects of hydrolysis time, p H, hydrolysis temperature, substrate concentration and enzyme dosage on the degree of hydrolysis and the antioxidant activity of hydrolysates were investigated using RSM based on one-factor-at-atime experiments. The optimized hydrolysate was compared with the natural antioxidant ascorbic acid and the synthetic antioxidant butyl hydroxyanisole (BHA) in regard to their antioxidant activity. The results showed that protamex was the best enzyme for the hydrolysis of U. pinnatifida protein. The optimal conditions that provided ferrous ion-chelating ability and 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging activity were determined as follows: hydrolysis time, 8.1 h; pH, 7.0; hydrolysis temperature, 50 ℃; substrate concentrate, 15 g/L; and enzyme dosage, 0.2% (0.3 AU/g). Under these conditions, the rate of chelation of ferrous ion by the hydrolysate was up to 88.58%, which was significantly higher than that by 0.01% ascorbic acid and BHA (P < 0.05). However, in terms of DPPH free radical scavenging percentage (59.22%) and reducing power, the hydrolysate was inferior to 0.01% ascorbic acid and BHA (P < 0.05).
Key words:Undaria pinnatifida; enzymatic hydrolysis; response surface methodology; antioxidant activity; hydrolysis degree
DOI:10.7506/spkx1002-6630-201706015
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2017)06-0096-08
引文格式:
于慧, 李明艳, 张典, 等. 响应面试验优化裙带菜蛋白酶解工艺及酶解液抗氧化活性[J]. 食品科学, 2017, 38(6): 96-103.
DOI:10.7506/spkx1002-6630-201706015. http://www.spkx.net.cn
YU Hui, LI Mingyan, ZHANG Dian, et al. Optimization of enzymatic hydrolysis of Undaria pinnatifid a protein and antioxidant activity of its hydrolysate[J]. Food Science, 2017, 38(6): 96-103. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201706015. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:教育部留学回国人员科研启动基金项目(第49批);鲁东大学引进人才项目(LY2013022)
作者简介:于慧(1982—),女,讲师,博士,研究方向为水产品加工与贮藏。E-mail:zoehuihui@hotmail.com