
图1 MgCl
2对低钠盐KCG-M混合凝胶保水性的影响
Fig. 1 Effect of MgCl
2on the WHC of low-salt KCG-M gel
谢婷婷,姚 静,李月双,周 颖,潘 杰,陈从贵*
(合肥工业大学食品科学与工程学院,安徽 合肥 230009)
摘 要:针对减脂减盐引起的肉凝胶品质劣变问题,基于镁离子的生理功能和κ-卡拉胶(κ-carrageenan,KCG)食用及补偿作用,以肉中具有凝胶形成能力的肌球蛋白(myosin,M)为研究对象,考察MgCl 2添加量(0~12 mmol/L)对KCG-M(质量比15∶85)混合凝胶保水性(water-holding capacity,WHC)和硬度的影响,并从KCG-M混合溶胶流变特性、热学特性及凝胶微观结构角度,探讨其影响机制。结果表明,添加6~10 mmol/L的MgCl 2可减弱KCG-M、M-M等分子间相互作用,降低混合体系的热稳定性(热相变温度T peak1值减小)和热诱导凝胶能力,并通过形成细密的三维网状凝胶结构而截留水分子,由此显著提高了低钠盐KCG-M混合凝胶的WHC,并降低了凝胶的硬度(P<0.05)。这一结果将为开发适于老年人等特定人群消费的低钠盐、多汁性肉制品提供了可能性。
关键词:肌球蛋白;凝胶特性;氯化镁;κ-卡拉胶
肌球蛋白(myosin,M)是肌原纤维蛋白的主要组成部分(约占50%~55%),是形成热诱导凝胶的主要蛋白质 [1],其凝胶特性与肉制品质构、保水等凝胶特性紧密相关 [2],并受多种因素影响,如pH值 [3]、盐离子种类 [4-5]、非蛋白物质(如多糖) [6]等。
食盐(NaCl)是制造肉类制品不可或缺的辅料,影响着肉制品的保水性(water holding capacity,WHC)、质构、风味、货架期等 [7-8]。但是,过量摄入食盐对人体有害,与过量摄入食盐相关的非传染性高血压已成为威胁人类健康的第一因子 [9]。为此,世界卫生组织(World Health Organization,WHO)近年来一直在推行全球“促进健康饮食”计划,倡导消费低盐食品,即低钠盐食品。肉制品是人类膳食中食盐的主要来源之一,肉制品的食盐约占加工食品钠盐含量的16%~25% [10],开展低盐肉制品开发研究具有重要意义。
MgCl 2与降低血压有关 [11],它参与体内多种代谢,是生命活动中必需的宏量元素 [12-13]。MgCl 2与NaCl具有类似的咸味等特征 [14],同时影响着肉蛋白的凝胶特性 [5,15],在减盐肉制品中得到了应用 [16-17]。κ-卡拉胶(κ-carrageenan,KCG)在肉制品中扮演着重要角色,可补偿减脂减盐引起的肉凝胶品质劣变,用于生产低盐、低脂凝胶类肉制品 [18]。但是,目前MgCl 2对KCG-M体系凝胶特性影响的研究鲜见文献报道。
本研究以低钠盐(NaCl添加量<2.5%)为前提,以鸡胸肉中具有凝胶形成能力的M为对象,单因素试验观察MgCl 2添加量(0~12 mmol/L)对KCG-M(质量比15∶85)混合凝胶WHC和硬度的影响,并从KCG-M混合溶胶流变特性、热学特性及凝胶微观结构角度,探讨其影响机制,旨在为开发出适合特定人群的低钠盐肉制品提供依据。
1.1 材料与试剂
鸡大胸肉购自安徽省合肥家乐福超市;氯化镁(MgCl 2·6H 2O,食品级) 连云港日丰钙镁有限公司;KCG 丹尼斯克(中国)有限公司。
氯化钾、氯化镁、磷酸氢二钾、磷酸二氢钾、焦磷酸钠、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(均为分析纯) 国药集团化学试剂有限公司;曲拉通X-100(分析纯) BBI生命科学有限公司;二硫苏糖醇(分析纯) 美国Life Science公司;牛血清蛋白上海生工生物公司。
1.2 仪器与设备
BCD-460冰箱 合肥晶弘电器有限公司;BSA/24S电子分析天平 德国赛多利斯股份公司;8S-1磁力搅拌器、HH-56数显恒温水浴锅 江苏金坛金城国胜实验仪器厂;DS-1组织捣碎匀浆机 上海越磁电子科技有限公司;FA25高剪切乳化机 德国Fluko公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;CT14RD冷冻离心机 上海天美生化仪器设备有限公司;TA-XT Plus质构仪 英国Stable Micro System公司;HR-3型Discovery流变仪、Q200型差示扫描量热仪(differential scanning calorimetry,DSC) 美国TA公司;JSM 6490LV扫面电子显微镜(scanning electron microscope,SEM) 日本Jeol公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 M提取及其标准提取液的制备
M提取:参照Chen Xing等 [19]方法,并稍作修改。首先,取150 g鸡胸肉糜计入400 mL Rigor Buffer(0.1 mol/L KCl、20 mmol/L磷酸钾盐、1 mmol/L EDTA,pH 7.0)缓冲液,加入二硫苏糖醇,使其含量为1 mmol/L,然后高速组织捣碎机绞碎;再加入曲拉通X-100使其质量分数为1%,10 000 r/min均质3 min,然后4 ℃、8 000×g高速离心10 min,收集沉淀。加入3 倍体积的提取液(0.3 mol/L KCl、0.1 mol/L磷酸二氢钾盐、50 mmol/L磷酸氢二钾盐、50 mmol/L EDTA-2Na、4 mmol/L焦磷酸钠,pH 6.5),电磁搅拌器搅拌提取10~15 min,4 ℃、5 000×g高速离心12 min,取上清液。加入14 倍体积的预冷的1 mmol/L EDTA-2Na(pH 7.0)溶液沉降90 min。虹吸取出上清液,剩余部分4 ℃、10 000×g高速离心6 min,取沉淀。将所得沉淀物溶解于等体积的0.6 mol/L溶解液(0.36 mol/L NaCl、0.24 mol/L KCl、10 mmol/L磷酸盐缓冲液,pH 6.0)中,充分搅拌溶解后,再分别添加焦磷酸钠、MgCl 2和三磷酸腺苷二钠,使3 种试剂的终浓度分别达到5、5、2 mmol/L,然后搅拌30 min,4 ℃、10 000×g离心20 min,取上清液。在上清液中加入9 倍体积的预冷水,过夜沉降。虹吸去除上清液后4 ℃、10 000×g高速离心6 min,取沉淀。再将沉淀物溶解于上述等体积0.6 mol/L溶解液中,并重复上述搅拌、离心的整个过程,最终获得的上清液即为M溶液。将提取的M溶液装入透析袋,并在3 倍体积的透析液(0.36 mol/L NaCl、0.24 mol/L KCl、10 mmol/L磷酸盐缓冲液,pH 6.0)中透析24 h,中间更换透析液4 次。经透析后的M溶液置于4 ℃冷藏、待用,并在一周内使用完毕。为了避免蛋白质变性失活,整个操作过程在0~4 ℃条件下进行。
M标准提取液制备:根据韩敏义 [20]的方法,用牛血清蛋白作为标准蛋白,建立标准曲线,测定M溶液浓度;用缓冲溶液(0.36 mol/L NaCl、0.24 mol/L KCl、10 mmol/L磷酸盐缓冲液,pH 6.0)将M溶液质量浓度调整至20 mg/mL。
1.3.1.2 MgCl 2-KCG-M混合溶胶制备
向100 mL标准化的M溶液中加入15% KCG [19](m/m,相对于蛋白质),在4 ℃条件下缓慢搅拌30 min(尽量减少气泡产生)后,均质2 min,使KCG和M充分混匀,再向KCG-M混合溶液中添加MgCl 2,并使其浓度分别为0、2、4、6、8、10、12 mmol/L,搅拌15 min使其充分混匀,制得MgCl 2-KCG-M混合溶胶,在4 ℃条件下静置过夜(约12 h),用于流变学、热学特性检测及凝胶制备。
1.3.1.3 MgCl 2-KCG-M混合凝胶制备
取上述混合溶胶10 mL,分别放入10 mL小烧杯(φ25 mm×36 mm)中,然后置于25 ℃水浴锅中,以2 ℃/min的升温速率,加热至80 ℃,并在80 ℃保温30 min;取出小烧杯并置于冰水浴中冷却10 min,即得MgCl 2-KCG-M凝胶,在4 ℃条件下静置过夜(约12 h),待检测。
1.3.2 指标测定
1.3.2.1 低钠盐KCG-M混合凝胶WHC的测定
参照Kocher等 [21]的方法。每个处理组重复5次。
1.3.2.2 低钠盐KCG-M混合凝胶硬度的测定
参照Zhou Yanzi等 [6]的方法。采用质构仪的GMIA凝胶程序测定。每个处理组重复5次。
1.3.2.3 低钠盐KCG-M混合溶胶流变特性的测定
参照Dirk等 [2]的方法,并略作修改。流变仪采用振荡模式,使用40 mm平行板,量取MgCl 2-KCG-M混合溶胶约1.85 mL,置于上下板间距1 000 μm空隙中,以2 ℃/min的升温速率从20 ℃加热至80 ℃,再以4 ℃/min的降温速率从80 ℃降至20 ℃,期间采用的测量参数为频率0.1 Hz,应变2 %。记录升温和降温过程的储能模量(G’)的变化。
1.3.2.4 DSC分析
参照Chen Haihua等 [22]的方法,称取约13 mg样品溶液密封在坩埚中,用密封的空坩埚作为参比。测量时先在20 ℃平衡10 min,再以5 ℃/min升温速率升温至85 ℃,最后在85 ℃平衡5 min。利用Universal Analysis 2000(TA Instruments)软件分析其热相变温度T。每个处理重复3次。
1.3.2.5 SEM观察
参照Ma Fei等 [23]的方法,将制备好的MgCl 2-KCG-M凝胶进行切片、固定、漂洗、脱水处理,冷风去除易挥发有机溶剂后,冷冻干燥15 h,最后喷金、SEM观察。
1.4 数据分析
用Excel 2010软件计算实验数据均值和标准偏差;用Statistix 8.1进行显著性分析,且差异显著水平为P<0.05;用Origin 8.5软件作图。
2.1 MgCl 2对低钠盐KCG-M混合凝胶WHC的影响
如图1所示,MgCl 2能够增加KCG-M混合凝胶保水性。从整体上看,随着MgCl 2浓度增大,混合凝胶WHC呈先升后降的趋势。与对照组(未添加MgCl 2组)相比,当MgCl 2浓度为6~10 mmol/L时,WHC显著上升(P<0.05),且在MgCl 2浓度8 mmol/L时,WHC达到最大值;但当MgCl 2浓度为12 mmol/L时,WHC显著下降(P<0.05)。

图1 MgCl
2对低钠盐KCG-M混合凝胶保水性的影响
Fig. 1 Effect of MgCl
2on the WHC of low-salt KCG-M gel
张秋会等 [5]研究了盐类对M凝胶WHC的影响,发现Mg 2+对M凝胶WHC影响不明显,与本实验结果不同。这可能是因为两者体系不同,前者研究的是M纯体系,本实验研究的是M与KCG的复合体系,而M的凝胶特性又受到非蛋白添加物(如多糖)的影响,最终导致MgCl 2的作用效果不同。
对于MgCl 2-KCG-M这个复杂体系,影响凝胶特性的因素极其复杂。有学者研究认为,对于KCG与肉蛋白复合的凝胶体系,KCG虽然以凝胶片段形式存在于蛋白凝胶网络结构的空隙中,但可通过KCG束缚水分 [2];或者通过静电作用,从而提高了肉蛋白凝胶的保水性 [24]。另有研究报道提出,阳离子能够影响蛋白质和多糖分子间的相互作用力 [25],进而促进蛋白质与KCG间的协同作用 [24],从而提高混合凝胶的保水性。此外,过高浓度的Mg 2+破坏了分子间(如蛋白质-蛋白质、蛋白质-水等)的相互作用力,进而降低肉蛋白凝胶的保水性 [4]。这些结果的综合影响,可能是导致MgCl 2-KCG-M凝胶WHC值随着MgCl 2浓度增加而先升后降的原因。
2.2 MgCl 2对低钠盐KCG-M混合凝胶硬度的影响

图2 MgCl
2对低钠盐KCG-M混合凝胶硬度的影响
Fig. 2 Effect of MgCl
2on the hardness of low-salt KCG-M gel
如图2所示,从整体趋势上看,随着MgCl 2浓度增加,凝胶硬度呈下降趋势,且当MgCl 2浓度大于2 mmol/L时,凝胶硬度下降显著(P<0.05)。Xiong Youling L.等 [26]研究发现,浓度大于5 mmol/L的MgCl 2处理鸡胸肉,也会降低鸡胸肉肌原纤维蛋白的凝胶硬度。
值得一提的是,与纯M凝胶硬度相比,添加15%的KCG能够显著增强M的凝胶硬度(P<0.05)(未在图2中显示)。Chen Xing等 [19]研究发现,未经高压处理组中,添加15% KCG的M凝胶硬度显著高于纯M的凝胶硬度(P<0.05),与本实验结果一致。在本实验中,尽管添加的MgCl 2会导致KCG-M混合凝胶硬度的降低,但MgCl 2-KCG-M凝胶硬度仍显著高于纯M凝胶硬度(P<0.05)。因此,MgCl 2与KCG存在互补作用,可用于调控混合肉凝胶的硬度,满足不同的产品需求。
Hunt等 [27]研究认为,肉蛋白凝胶硬度的增加,可能是通过卡拉胶的硫酸基团和蛋白质间的静电作用,促使分子间聚集。然而,二价盐离子Ca 2+、Mg 2+、Zn 2+会改变蛋白质结构,还会与蛋白质侧链的负电荷互相作用,从而减少蛋白质分子间的静电作用,最终导致蛋白质-蛋白质间的相互作用及蛋白质-水相互作用的改变 [28-29]。加入的MgCl 2可能减弱了蛋白质-多糖、蛋白质-蛋白质的相互作用,并且Mg 2+与蛋白质侧链-COOH能够形成盐桥 [30],导致蛋白质迅速聚集 [31],易于形成柔软的凝胶 [32],进而显示出本实验的结果。另外,MgCl 2引起的KCG-M凝胶高保水性能,也可能导致KCG-M凝胶硬度的降低。
2.3 MgCl 2对低钠盐KCG-M混合溶胶流变特性的影响
流变特性在肉类加工中是一种非常重要的功能特性。流变特性的变化可以间接反映肌肉蛋白在凝胶过程中蛋白质与蛋白质亚基的构象变化 [33]。流变参数有储能模量(G’)、损失模量(G”)等。其中,G’代表流变体中的弹性部分,可以在一定程度上反映凝胶强度。
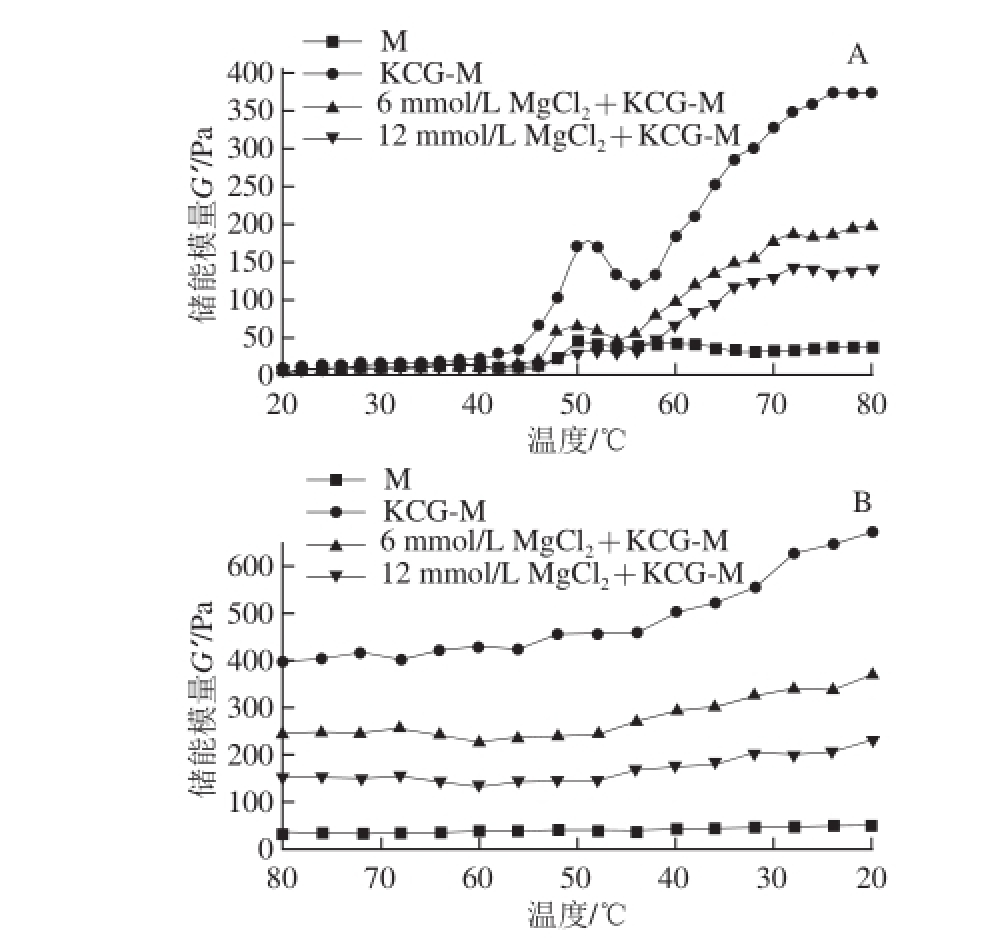
图3 MgCl
2对低钠盐KCG-M混合溶胶升温(A)-降温(B)过程储能模量(G’)的影响
Fig. 3 Effect of MgCl
2on the storage modulus (G’) of low-salt KCG-M system during heating (A) and cooling (B)
如图3A所示,纯M组在加热过程中,G’出现两个峰形。第1个峰始于48 ℃,在50 ℃时G’达到最大,超过62 ℃时G’开始下降,而在随后的加热过程中G’值一直平缓增加。当温度在46~52 ℃时,为“凝胶形成”阶段,M头部和铰链部分变性展开,并发生聚集作用,使G’增加,但形成的凝胶结构较疏松;在52~68℃时,为“凝胶减弱”阶段,可能由于动力学原因,G′迅速下降 [6];而在68~80 ℃时,为“凝胶加强”阶段,M充分展开,且通过蛋白质聚集、交联,形成网状结构和不可逆热诱导凝胶,提高了凝胶强度 [34]。与纯M相比,KCG-M复合凝胶的G′值显著提高,且受热过程中呈现的“凝胶形成”和“凝胶减弱”G’峰形,类似于纯M的G’峰形。但是在“凝胶加强”阶段,G’急剧增加;冷却过程中,随着温度的降低,M的G’值增加缓慢,而KCG-M的G’值增大显著,如图3B所示,均与前期的研究结果 [6]相似。
与KCG-M组相比,添加的MgCl 2会使KCG-M受热过程中的G’呈现下降趋势,且随着MgCl 2浓度的提高,下降的程度加重(图3A),这也印证了图2中KCG-M混合凝胶硬度的变化结果。添加低浓度MgCl 2(6 mmol/L)时,KCG-M的G’曲线形状无显著变化,只是峰值左移,说明KCG-M对混合体系的流变特性仍起主导作用。而添加高浓度MgCl 2(12 mmol/L)时,KCG-M的G’不仅数值减小,而且其曲线特征峰消失,说明高浓度MgCl 2导致了KCG-M流变特性的本质变化。其原因可能在于:添加高浓度MgCl 2时,其中的Mg 2+与M侧链形成的盐桥作用增强,从而减弱了KCG-M、M-M的相互作用,进而减弱KCG在与M形成凝胶时的作用,最终导致混合凝胶硬度的下降。徐幸莲 [15]研究了Mg 2+对兔肉M流变特性的影响,发现Mg 2+能够提高肌球蛋白的G′;本实验结果与之不同,其原因可能是两者体系不同。
冷却过程中(图3B),尽管MgCl 2-KCG-M体系的G′值变化平缓,但随着MgCl 2浓度的增大,MgCl 2-KCG-M体系的G′值下降显著。可见,高浓度的MgCl 2仍会弱化混合体系凝胶冷却过程中内部大分子间的交联作用(如KCG-M、M-M作用等),致使凝胶网络变得疏松,从而降低了MgCl 2-KCG-M混合凝胶的硬度(图2)。
2.4 MgCl 2对低钠盐KCG-M混合溶胶热学特性的影响
表 1 MgCl
2对低钠盐KCG-M热相变温度(T)的影响
Table 1 Effect of MgCl
2on the thermal phase transition temperatures (T) of low-salt KCG-M

注:DSC峰值均为3 次重复,表示为
 ±s;同列肩标不同字母表示有显著性差异(P<0.05)。
±s;同列肩标不同字母表示有显著性差异(P<0.05)。
组别热相变温度/℃Tpeak1Tpeak2 M 52.89±0.62 b68.00±0.49 aKCG-M56.03±0.19 a68.26±0.90 a6 mmol/L MgCl 2+KCG-M53.19±0.20 ab67.00±0.78 a12 mmol/L MgCl 2+KCG-M51.63±1.53 b66.33±1.22 a
肉蛋白有3 个典型的热相变温度范围,分别是43~67(M及其亚基)、67~69 ℃(肌浆蛋白)和71~83 ℃(肌动蛋白) [23,35]。而M的典型相变温度范围分别为40.9~63.3 ℃(T peak1,M的头部,HMM)和62.2~68.6℃(T peak2,M的尾部,LMM) [22,36]。
如表1所示,M的两个相变温度分别为52.89 ℃(T peak1)和68.00 ℃(T peak2);添加的KCG能够显著增加M的T peak1(P<0.05),并使得T peak2略微上升。可见,添加的KCG促使了KCG和M之间相互作用的形成。有研究 [37]指出,在低离子强度、pH 7.0条件下,牛血清蛋白能够与KCG通过弱的静电作用形成弱的复合物,从而降低了牛血清蛋白的变性温度,而在pH 6.5条件下,牛血清蛋白与KCG之间的静电作用能够被增强。
与未添加MgCl 2的KCG-M相比,12 mmol/L的MgCl 2导致了KCG-M的T peak1显著降低(P<0.05),而各处理组之间的T peak2值差异不显著(P>0.05)。从整体趋势上讲,加入的MgCl 2导致了KCG-M相变温度的降低,这不仅与2.3节中流变特性变化的结果一致,也进一步说明了高浓度(12 mmol/L)的MgCl 2对KCG-M、M-M分子间相互作用力的破坏性更大。有研究 [31]指出,MgCl 2会导致黄尾金梭鱼M的热稳定性降低,而且与MgCl 2浓度有关,MgCl 2浓度越大,其M的热稳定性越差,与本实验结果相似。加入的MgCl 2减弱了KCG-M、M-M的相互作用,从而可能减弱了凝胶化,导致KCG-M的热诱导凝胶能力降低,最终造成KCG-M混合凝胶硬度的降低。
2.5 MgCl 2对低钠盐KCG-M混合凝胶微观结构的影响

图4 MgCl
2对低钠盐KCG-M凝胶微观结构影响的SEM图
Fig. 4 SEM images of microstructure of the low-salt KCG-M gel with MgCl
2added
如图4A 1、A 2所示,未添加MgCl 2的KCG-M混合凝胶,其微观结构呈现出大孔洞和粗交联的三维网状结构,与Chen Xing等 [19]观察到的未经高压处理组的结果相似。从图4B 1、B 2可以看到,加入低浓度(6 mmol/L)MgCl 2的KCG-M凝胶微观结构,其孔径变小,数量减少,与未添加的对照组相比,三维网状结构较为致密、均匀。当MgCl 2浓度增加到12 mmol/L时,结构变得疏松多孔,不紧实,且孔洞数量明显增加,与对照组相比,聚集增多且更加均匀,但是交联链较细(图4C 1、C 2)。
Nayak等 [38]研究发现,添加了低浓度(0.05%)MgCl 2的牛血清蛋白凝胶微观结构更加均匀致密,与本实验添加6 mmol/L的MgCl 2的KCG-M凝胶微观结构相似。
肉制品的质构、保水性等功能特性受其凝胶三维网状结构的影响,而凝胶网络结构的形成又是蛋白质变性、展开和聚集的结果,而且蛋白质变性和聚集的相对速度决定着蛋白质凝胶微观结构的变化和性质 [39]。上述流变特性和热学特性分析结果显示,添加MgCl 2时,尤其是高浓度(12 mmol/L)的MgCl 2会弱化凝胶内部KCG-M、M-M等大分子间的交联作用,导致了KCG-M凝胶能力的下降,可能会诱发凝胶细链交联疏松结构的形成(图4C),从而减小了凝胶的硬度(图2)和WHC(图1)。另一方面,加入低浓度(6 mmol/L)的MgCl 2,可形成较致密、均匀的KCG-M凝胶网络结构(图4B),制约了水分的流动,从而提高了WHC值(图1)。
添加适量浓度(6~10 mmol/L)的MgCl 2,可通过减弱KCG-M、M-M等分子间的相互作用,降低混合体系的热稳定性(T peak1值减小)和热诱导凝胶能力,并通过形成细密的三维网状凝胶结构而截留水分子,由此导致了低钠盐KCG-M混合凝胶WHC的提高和凝胶硬度的降低。这将为开发适于老年人等特定人群消费的低钠盐、多汁性肉制品,及为调控混合肉凝胶的硬度满足不同的产品需求提供了可能性。
参考文献:
[1] 赵春青, 彭增起. 肌球蛋白功能特性的研究进展[J]. 肉类研究, 2002, 16(1): 17-19. DOI:10.3969/j.issn.1001-8123.2002.01.006.
[2] DIRK V, NICO N, PAUL V D M, et al. Infuence of κ-carrageenan on the thermal gelation of salt-soluble meat proteins[J]. Meat Science, 2005, 70(1): 161-166. DOI:10.1016/j.meatsci.2004.12.007.
[3] WU Ye, XU Ke, XU Xinglian, et al. Effect of pH on gelation properties of rabbit myosin[J]. 食品科学, 2010, 31(9): 6-11.
[4] 邓丽, 芮汉明. Ca 2+、Mg 2+和磷酸盐对鸡肉盐溶蛋白质凝胶保水性和凝胶特性影响的研究[J]. 现代食品科技, 2005, 21(2): 24-26. DOI:10.3969/j.issn.1673-9078.2005.02.008.
[5] 张秋会, 周向辉, 李苗云, 等. 鸡肌球蛋白凝胶保水性研究[J]. 内蒙古农业大学学报: (自然科学版), 2014, 35(1): 120-124.
[6] ZHOU Yanzi, CHEN Conggui, CHEN Xing, et al. Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin[J]. Journal Agricultural and Food Chemistry, 2014, 62(12): 2655-2662. DOI:10.1021/jf405381z.
[7] BARAT J M, TOLDRÁ F. Reducing salt in processed meat products[J]. Processed Meats Improving Safety Nutrition and Quality, 2011, 13: 331-345. DOI:10.1533/9780857092946.2.331.
[8] DESMOND E. Reducing salt: a challenge for the meat industry[J]. Meat Science, 2006, 74(1): 188-196. DOI:10.1016/ j.meatsci.2006.04.014.
[9] World Health Organization (WHO). Global status report on noncommunicable diseases 2010[R]. Geneva: WHO document production services, 2011: 176.
[10] World Health Organization. Diet, nutrition and the prevention of chronic diseases: report of a joint WHO/FAO expert consultation[R]. Geneva: WHO, 2003: 149.
[11] SUN H A J, III E R M, GUALLAR E, et al. The effect of magnesium supplementation on blood pressure: a meta-analysis of randomized clinical trials[J]. American Journal of Hypertension, 2002, 15(8): 691-696. DOI:10.1016/S0895-7061(02)02964-3.
[12] BARAT J M, PÉREZ-ESTEVE E, ARISTOY M C, et al. Partial replacement of sodium in meat and fsh products by using magnesium salts. A review[J]. Plant and Soil, 2013, 368(1/2): 179-188. DOI:10.1007/s11104-012-1461-7.
[13] 李相伍, 文永植. 镁与糖尿病[J]. 微量元素与健康研究, 2008, 25(4): 43-50. DOI:10.3969/j.issn.1005-5320.2008.04.025.
[14] MITCHELL M, BRUNTON N P, WILKINSON M G. Current salt reduction strategies and their effect on sensory acceptability: a study with reduced salt ready-meals[J]. European Food Research & Technology, 2011, 232(3): 529-539. DOI:10.1007/s00217-010-1420-6.
[15] 徐幸莲. 兔骨骼肌肌球蛋白热诱导凝胶特性及成胶机制研究[D]. 南京: 南京农业大学, 2003: 64-108.
[16] TOTOSAUS A, PÉREZ-CHABELA M L. Textural properties and microstructure of low-fat and sodium-reduced meat batters formulated with gellan gum and dicationic salts[J]. LWT-Food Science and Technology, 2009, 42(2): 563-569. DOI:10.1016/j.lwt.2008.07.016.
[17] MÓNICA A, MARÍA-CONCEPCIÓN A, JOSÉ M B, et al. Biochemical and sensory changes in dry-cured ham salted with partial replacements of NaCl by other chloride salts[J]. Meat Science, 2012, 90(2): 361-367. DOI:10.1016/j.meatsci.2011.07.023.
[18] MA Fei, CHEN Conggui, ZHENG Lei, et al. Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl 2and κ-carrageenan[J]. Meat Science, 2013, 95(1): 22-26. DOI:10.1016/j.meatsci.2013.04.025.
[19] CHEN Xing, CHEN Conggui, ZHOU Yanzi, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40: 262-272. DOI:10.1016/j.foodhyd.2014.03.018.
[20] 韩敏义. 兔骨骼肌肌球蛋白浊度、溶解度及热诱导凝胶强度研究[D].南京: 南京农业大学, 2003: 11-15.
[21] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science, 1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x.
[22] CHEN Haihua, XU Shiying, WANG Zhang. Interaction between faxseed gum and meat protein[J]. Journal of Food Engineering, 2007, 80(4): 1051-1059. DOI:10.1016/j.jfoodeng.2006.08.017.
[23] MA Fei, CHEN Conggui, SUN Gaojun, et al. Effects of high pressure and CaCl 2on properties of salt-soluble meat protein gels containing locust bean gum[J]. Innovative Food Science and Emerging Technologies, 2012, 14(2): 31-37. DOI:10.1016/j.ifset.2011.12.001.
[24] PIETRASIK Z, JARMOLUK A. Effect of sodium caseinate and κ-carrageenan on binding and textural properties of pork muscle gels enhanced by microbial transglutaminase addition[J]. Food Research International, 2003, 36(3): 285-294. DOI:10.1016/S0963-9969(02)00170-9.
[25] MONTERO P, PÉREZ-MATEOS M. Effects of Na +, K +and Ca 2+on gels formed from fsh mince containing a carrageenan or alginate[J]. Food Hydrocolloids, 2002, 16(4): 375-385. DOI:10.1016/S0268-005X(01)00110-2.
[26] XIONG Youling L., BREKKE C J. Gelation properties of chicken myofbrils treated with calcium and magnesium chlorides[J]. Journal of Muscle Foods, 1991, 2(1): 21-36. DOI:10.1111/j.1745-4573.1991.tb00438.x.
[27] HUNT A, PARK J W. Alaska pollock fish protein gels as affected by refned carrageenan and various salts[J]. Journal of Food Quality, 2013, 36(1): 51-58. DOI:10.1111/jfq.12010.
[28] YONGSAWATDIGUL J, SINSUWAN S. Aggregation and conformational changes of tilapia actomyosin as affected by calcium ion during setting[J]. Food Hydrocolloids, 2007, 21(3): 359-367. DOI:10.1016/j.foodhyd.2006.04.006.
[29] DING Y, LIU Y, YANG H, et al. Effects of CaCl 2on chemical interactions and gel properties of surimi gels from two species of carps[J]. European Food Research and Technology, 2011, 233(4): 569-576. DOI:10.1007/s00217-011-1546-1.
[30] ARFAT Y A, BENJAKUL S. Impact of zinc salts on heat-induced aggregation of natural actomyosin from yellow stripe trevally[J]. Food Chemistry, 2012, 135(4): 2721-2727. DOI:10.1016/ j.foodchem.2012.06.109.
[31] LERTWITTAYANON K, BENJAKUL S, MAQSOOD S, et al. Effect of different salts on dewatering and properties of yellowtail barracuda surimi[J]. International Aquatic Research, 2013, 5(1): 1-12. DOI:10.1186/2008-6970-5-10.
[32] SAGUER E, SEDMAN J, FORT N, et al. Structure-functionality relationships of porcine plasma proteins probed by FTIR spectroscopy and texture analysis[J]. Food Hydrocolloids, 2008, 22(3): 459-467. DOI:10.1016/j.foodhyd.2007.01.004.
[33] LANTTO R, PUOLANNE E, KALKKINEN N, et al. Enzyme-aided modification of chicken-breast myofibril proteins: effect of laccase and transglutaminase on gelation and thermal stability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9231-9237. DOI:10.1021/jf051602a.
[34] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth founder myosin[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1016-1023.
[35] SMYTH A B, SMITH D M, VEGA-WARNER V, et al. Thermal denaturation and aggregation of chicken breast muscle myosin and subfragments[J]. Journal Agricultural and Food Chemistry, 1996, 44(4): 1005-1010.
[36] AMAKO D E N, XIONG Youling L.. Effects of carrageenan on thermal stability of proteins from chicken thigh and breast muscles[J]. Food Research International, 2001, 34(Suppl 2/3): 247-253. DOI:10.1016/S0963-9969(00)00161-7.
[37] GALAZKA V B, SMITH D, LEDWARD D A, et al. Complexes of bovine serum albumin with sulphated polysaccharides: effects of pH, ionic strength and high pressure treatment[J]. Food Chemistry, 1999, 64(3): 303-310.
[38] NAYAK R, KENNEY P B, SLIDER S, et al. Cook yield, texture and gel ultrastructure of model beef batters as affected by low levels of calcium, magnesium and zinc chloride[J]. Journal of Food Science, 1998, 63(6): 945-950. DOI:10.1111/j.1365-2621.1998.tb15829.x.
[39] LIU R, ZHAO S M, XIONG S B, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639. DOI:10.1016/j.meatsci.2008.02.014.
Effect of MgCl 2on Gel Properties of Chicken Breast Myosin Containing κ-Carrageenan and Low-Sodium Salt
XIE Tingting, YAO Jing, LI Yueshuang, ZHOU Ying, PAN Jie, CHEN Conggui*
(School of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:Concerning the problem of quality deterioration caused by fat and salt reduction in meat gels, we investigated the effect of MgCl 2addition (0–12 mmol/L) on the water-holding capacity (WHC) and hardness of κ-carrageenan-chicken breast myosin (m/m, 15:85) gel based on the physiological function of magnesium ion and the applicability of KCG (κ-carrageenan) as a food additive and compensation for the reduction of fat and salt contents as well as the importance of myosin (M) in the gelation of meat products, and we also explored the underlying mechanism with respect to the rheological properties, thermal properties and microstructure of the mixed gel. The results showed that the addition of 6-10 mmol/L MgCl 2could decrease the thermal stability (reduced phase transition temperature, T peak1) and gelation ability (reduced G’) of the KCG-M gel by weakening the molecular interactions such as KCG-M and M-M, and retain water by forming three-dimensional compact gel networks. These changes could result in improved WHC and reduced gel hardness (P < 0.05). This suggested the possibility of developing low-salt and juicy meat products for the elderly and other special populations.
Key words:myosin; gel properties; MgCl 2; κ-carrageenan
DOI:10.7506/spkx1002-6630-201701006
中图分类号:TS251.51
文献标志码:A
文章编号:1002-6630(2017)01-0035-06
引文格式:
谢婷婷, 姚静, 李月双, 等. MgCl 2对低钠盐κ-卡拉胶-肌球蛋白凝胶特性的影响[J]. 食品科学, 2017, 38(1): 35-40.
DOI:10.7506/spkx1002-6630-201701006. http://www.spkx.net.cn
XIE Tingting, YAO Jing, LI Yueshuang, et al. Effect of MgCl 2on gel properties of chicken breast myosin containing κ-carrageenan and low-sodium salt[J]. Food Science, 2017, 38(1): 35-40. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201701006. http://www.spkx.net.cn
收稿日期:2016-03-06
基金项目:国家自然科学基金面上项目(31271893)
作者简介:谢婷婷(1989—),女,硕士研究生,研究方向为肉制品加工。E-mail:xietingting822@163.com
*通信作者:陈从贵(1963—),男,教授,硕士,研究方向为肉制品加工及副产物综合利用。E-mail:ccg1629@163.com