
储建军 1,傅玲琳 1,王 翀 1,周德庆 2,王海燕 3,王彦波 1,*
(1.浙江工商大学食品与生物工程学院,浙江省食品微生物技术研究重点实验室,浙江 杭州 310018;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071;3.南京财经大学管理科学与工程学院,江苏 南京 210046)
摘 要:为明确冰温保活对缢蛏品质的影响,应用Illumina MiSeq高通量测序技术研究缢蛏冰温保活过程中微生物多样性变化,并以保活期终点鉴定得到的优势腐败菌假单胞菌(Pseudomonas spp.)为研究对象,建立和验证不同温度条件下的生长动力学模型。结果表明:缢蛏初始菌相中,优势菌为弓形杆菌(Arcobacter spp.)、拟杆菌科未分类属和Psychrilyobacter spp.,比例分别为16.2%、8.4%和7.2%。保活期终点时,假单胞菌数目明显增多,成为优势腐败菌,所占比例为26.2%。次优势菌为弧菌科未分类属、嗜冷单胞菌(Psychromonas spp.)、弓形杆菌和Psychrilyobacter spp.,比例分别为17.8%、14.4%、13.0%和11.8%。修正的Gompertz模型能够有效拟合低温(-1.5~15.0 ℃)条件下假单胞菌的生长,所得的相关系数R 2均在0.98以上,偏差度和准确度均在可接受范围之内。采用平方根模型拟合温度与最大比生长速率μ max、温度与延滞时间λ的关系,相关系数R 2分别为0.963和0.970,线性关系良好,建立的Gompertz模型可对-1.5~15.0 ℃温度范围内假单胞菌的生长进行预测。
关键词:缢蛏;冰温保活;高通量测序;菌相分析;动力学模型
缢蛏(Sinonovacula constricta)是双壳类软体动物,俗称蛏子,是我国四大海产养殖贝类之一,广泛分布在我国南北海岸和韩国、日本沿海 [1]。其营养丰富,肉味鲜美,具有高蛋白、低脂肪、维生素含量高等优点,但极易腐败变质,因此,缢蛏在贮运过程中的保活是目前亟待解决的科研问题之一。生态冰温保活技术最早起源于日本,现已逐渐用于海产贝类的保活保鲜 [2]。其是通过将产品的温度控制在特定的冰温带范围内,使贝类进入休眠状态以维持其组织细胞活性。同时,冰温对有害微生物生长及各种酶的活性具有明显的抑制作用,有利于贝类的长时间保活 [3]。目前该技术受到国内外普遍关注,有学者采用生态冰温法分别对泥蚶 [4]、波纹巴非蛤 [5]、近江牡蛎 [6]和海湾扇贝 [7]等贝类进行了保活研究,但在缢蛏冰温保活方面的研究报道极少。
研究表明,水产食品菌相变化及优势腐败菌研究对其货架期具有重要的意义,传统分析菌相的方法(如变性梯度凝胶电泳、构建文库等)操作复杂、成本高,无法达到深入研究环境微生物多样性的目的。新一代Illumina MiSeq高通量测序摆脱了传统研究中微生物分离培养的技术限制,可以对特定环境中的整个细菌微生物群落进行分析,具有通量高、准确性高、速度快、信息全等特点,尤其在鉴定低丰度微生物群落及种类方面具有非常大的优势 [8]。
鉴于此,本实验以缢蛏为原料,应用Illumina MiSeq高通量测序技术研究了缢蛏冰温保活过程中菌相动态变化,并以保活期终点鉴定得到的优势腐败菌假单胞菌(Pseudomonas spp.)为研究对象,建立和验证了不同温度条件下假单胞菌的生长动力学模型。本研究旨在为缢蛏贮运、销售过程中的保活保鲜、延长产品保活期提供理论参考和技术依据。
1.1 材料与试剂
缢蛏购于浙江省宁波象山水产养殖基地,实验室暂养后挑选大小均一、壳长(5.0±0.5) cm、壳宽(1.5±0.3) cm的个体备用。
基因组DNA提取试剂盒、QIAquick胶回收试剂盒德国Qiagen公司;MiSeq试剂盒 美国Illumina公司;CFC选择性培养基 青岛海博公司。
1.2 仪器与设备
低温恒温培养箱 日本Sanyo公司;MiSeq高通量测序仪 美国Illumina公司;Nanodrop 2000超微量分光光度计 美国Thermo Scientific公司;Sure Cycler 8800型聚合酶链式反应(polymerase chain reaction,PCR)仪美国Aglient公司。
1.3 方法
1.3.1 样品保活与采集
缢蛏样品随机置于低温恒温培养箱中进行无水低温保活,根据预实验温度分别设置为-1.5(冰温保活)、5.0、10.0、15.0、20.0 ℃。前期实验表明此温度条件下缢蛏存活时间分别为264、192、144、96、72 h。保活过程中,每隔适当时间随机抽取样品用于优势腐败菌计数。对于冰温保活的样品,分别挑选了初始时间样品(0 h)、保活中期时间样品(132 h)和保活终点时间样品(264 h),通过Illumina MiSeq高通量测序仪分析菌相动态变化规律。
1.3.2 总DNA提取和高通量测序
采用基因组提取试剂盒提取缢蛏样本总DNA,提取的总DNA经Nanodrop 2000超微量分光光度计测定纯度,-80 ℃保存备用。对提取的菌群16S rDNA基因的V3~V4可变区进行PCR扩增,特异性上游引物PF(5’-CCTACGGGNGGCWGCAG-3’),下游引物PR(5’-GACTACHVGGGTATCTAATCC-3’)。样品通过Illumina MiSeq高通量测序后进行分析 [9]。
1.3.3 数据处理和生物信息学分析
采用Flash软件(version 1.2.7)对MiSeq双末端(Paired-end)测序得到的原始数据进行拼接,同时用Qiime软件(version 1.7.0)对序列进行过滤,用Mothur软件(version 1.31.2)中Uchime的方法去除嵌合体序列,获得最终用于生物信息学分析的优质序列。应用Qiime软件,根据序列相似度在97%水平上,将序列归为多个操作分类单元(operational taxonomic unit,OTU),并调用RDP-classifier对OTU代表序列进行注释,调用BLAST软件对序列数据库进行比对,得到每个OTU的分类学信息。通过对OTUs进行稀释度曲线分析、丰度分布分析、Alpha多样性分析(Chao1指数、Ace指数和Shannon指数)以及物种在各个分类水平上的群落结果统计分析,得到微生物群落结构组成,鉴定优势腐败菌 [10-11]。
1.3.4 优势腐败菌生长动力学模型建立与检验
假单胞菌计数参照Li Miaoyun等 [12]的方法稍作修改,每隔适当时间无菌称取不同恒温条件下保活的缢蛏样品25 g,加入225 mL 8.5%的无菌生理盐水,匀浆,按1∶10进行梯度稀释,取合适稀释度,用涂布平板法测得活菌数(37.0 ℃条件下培养24 h),每个稀释度做3 次平行。
研究表明,修正的Gompertz模型能准确预测微生物的生长 [13-14]。应用Origin软件(version 9.0),采用修正的Gompertz模型拟合不同温度条件下假单胞菌生长的实验数据,得到相应的初级模型参数。模型表述如下:

式中:t为时间/h;N(t)是在时间t时的菌落数/(CFU/g);N 0和N max分别为初始和最大菌落数/(CFU/g);μ max为微生物生长的最大比生长速率/h -1;λ为微生物生长的延滞时间/h。
平方根模型是为了描述温度与初级模型中假单胞菌生长特定动力学参数之间的关系 [15-16],用于次级模型的建立。方程式如式(2)、(3)所示:

式中:T为实验温度/℃;T min λ和T min μ为假单胞菌的最低生长温度,即在此温度条件下假单胞菌没有代谢活动,最大比生长速率为零;b为常数。
通过计算偏差因子(bias factor,B f)和准确因子(accuracy factor,A f)以及均方误差(mean square error,MSE)来衡量实验实测值与模型预测值之间的接近程度,以评价所建立的假单胞菌生长动力学模型的可靠性。B f、A f、MSE方程式如式(4)~(6)所示:
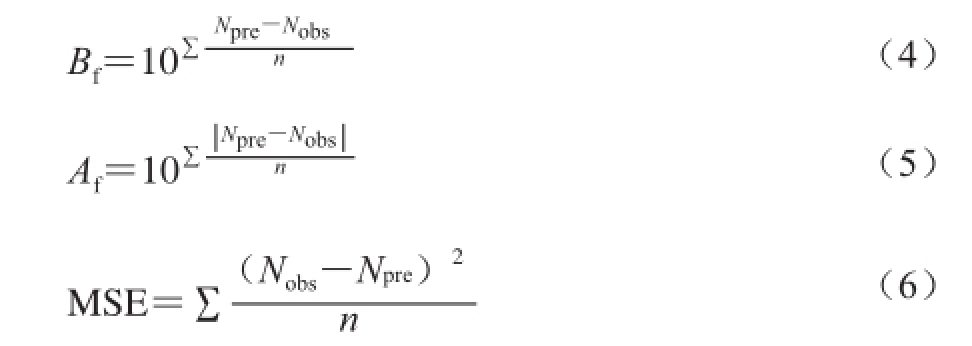
式中:N obs是实际测得的假单胞菌数;N pre是模型预测得到的与实测值同一时间的假单胞菌数;n是实验次数。
1.4 数据统计分析
应用Microsoft Excel 2007软件进行绘图。应用SPSS软件(version 17.0)对实验数据进行统计分析,显著性分析采用单因素ANOVA分析,P<0.05认为具有显著性差异。应用Origin软件(version 9.0)对实验数据进行非线性回归分析,得到相关系数R 2,应用 Levenberg Marquardt迭代法估计待定参数,置信区间设定为95%。
2.1 稀释曲线、菌群物种丰度以及多样性分析

图1 缢蛏样品的稀释度曲线
Fig. 1 Rarefaction curves for Sinonovacula constricta samples
本研究应用Illumina高通量测序技术对冰温保活缢蛏微生物多样性进行分析,稀释曲线如图1所示,随着测序序列数目的增加,3 个样品稀缺曲线趋于平缓、指数基本达到饱和,增加测序数量对发现新的OTU的边际贡献很小,表明本研究中3 个样品的测序数据量足以用来反映样品的微生物多样性 [17]。
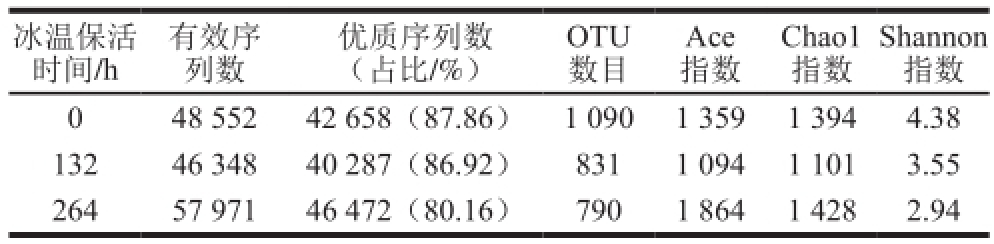
表 1 缢蛏样品菌群OTU数目及Alpha多样性指数
Table 1 Number of OTUs, diversity and richness indices of bacterial community in Sinonovacula constricta samples
冰温保活时间/h有效序列数优质序列数(占比/%)OTU数目Ace指数Chao1指数Shannon指数048 55242 658(87.86)1 0901 3591 3944.38 13246 34840 287(86.92)8311 0941 1013.55 26457 97146 472(80.16)7901 8641 4282.94
不同时间点冰温保活缢蛏样品菌群OTU数及Alpha多样性指数见表1,在0、132、264 h的缢蛏样品中获得的细菌优质序列数分别为42 658、40 287、46 472条。在97%的相似水平上对优质序列进行归类操作,获得的OTU数分别为1 090、831和790,表明冰温保活对缢蛏微生物群落变化影响较大,部分细菌生长受到明显抑制。Alpha多样性是对单个样品中物种多样性的分析,包括Ace指数、Chao1指数和Shannon指数。其中Ace和Chao1是群落丰富度指数,值越大说明群落丰富度越高。Shannon是群落多样性指数,值越大说明群落多样性越高 [18-19]。由表1可知,随着保活时间的延长,Shannon逐渐减小,说明-1.5 ℃冰温缢蛏细菌组成多样性逐渐降低。Ace和Chao1增大,说明接近保活期终点时样品细菌群落丰富度有所提高。
2.2 微生物菌群结构和优势腐败菌分析

图2 缢蛏样品中细菌在门(a)和属(b)水平上的相对丰度分析
Fig. 2 Relative abundance of classifed bacterial phyla and genera in microbiota of Sinonovacula constricta samples
通过对所有样品中微生物的16S rRNA基因的V3~V4可变区序列进行Illumina MiSeq测序,共检测到40 个菌门,79 个纲,128 个目,175 个科和223 个属。在门水平(图2a)上分析,新鲜样品中优势菌为变形菌门Proteobacteria(47.9%)、其次为拟杆菌门Bacteroidetes(14.1%)、梭杆菌门Fusobacteria(8.7%)和厚壁菌门Firmicutes(6.2%),其他菌门细菌含量均很小。当到达保活期终点时,变形菌门细菌数增至80.2%。Trabal等 [20]通过高通量焦磷酸测序研究了3 种牡蛎样品在不同生长时期菌相组成变化,结果发现,主要优势菌均为变形菌门细菌,这与本研究结果一致,说明海洋贝类初始菌相组成在门水平上存在极大相似性。
在属水平(图2b)上可以看出,缢蛏初始菌相较复杂,分析得到的相对丰度高于1%的菌属共有16 种,主要的优势菌为弓形杆菌属(16.2%)、Psychrilyobacter spp.(7.2%)和拟杆菌科未分类属(8.4%)。庄荣玉等 [21]在对鲜活缢蛏菌群组成研究中发现,优势菌为弧菌属(Vibrio spp.),所占比例为50.9%,其次是无色菌属(Achromobacter spp.)和黄杆菌属(Flavobocterium spp.),这与本研究中分析得出的结果有所不同。分析造成这种差异的主要原因可能有两种:一是缢蛏生活水环境不同;二是缢蛏捕获时间不同。Lee等 [22]通过高通量测序的方法比较了不同时间和区域捕获的鲍鱼初始菌相差异性,发现所有样品初始菌相均由α-变形菌纲和γ-变形菌纲组成,主要优势菌为嗜冷杆菌属(Psychrobacter spp.),但同一区域不同采样时间点的鲍鱼样品菌群结构组成明显不同。
在后期冰温保活过程中,细菌菌相逐渐单一,初始优势菌属所占比例逐渐减少,保活期终点时,假单胞菌数目明显增多,占到菌群总数的26.2%,为冰温保活缢蛏的优势腐败菌。次优势菌为弧菌科未分类属(17.8%)、嗜冷单胞菌(14.1%)、弓形杆菌(13.0%)和Psychrilyobacter spp.(11.8%)。这与Cruz-Romero等 [23]的研究结果一致,其研究发现,假单胞菌属是牡蛎2 ℃低温保藏过程中的优势腐败菌。Cao Rong等 [24]研究也发现,5 ℃条件下保藏的太平洋牡蛎,假单胞菌为优势腐败菌,所占比例达到73%。其次为弧菌,所占比例为20%。作为一种嗜低温好氧菌,假单胞菌可在较低温度条件下通过分解海产品组织中蛋白和脂质进行生长繁殖,多为低温冷藏的贝类、甲壳类和鱼类的优势腐败菌,但不同的冷藏、保活温度和处理方式对样品菌相组成和优势腐败菌影响较大。Madigan等 [25]采用16S rRNA焦磷酸测序法研究了太平洋牡蛎和悉尼岩牡蛎4 ℃低温冷藏过程中菌相动态变化,结果发现,2 种牡蛎初始菌相均由变形菌门、无壁菌门(Tenericutes)和螺旋体(Spirochetes)组成,假交替单胞菌(Pseudoalteromonas spp.)和弧菌是冷藏过程中的主要优势腐败菌,在太平洋牡蛎中两者所占比例分别为10.3%和26.3%,悉尼岩牡蛎中两者所占比例分别为40.5%和25.3%。Wood等 [26]研究发现,低温(6±2) ℃不仅不能抑制牡蛎中细菌群落丰富度和多样性增加,反而更加有利于主要细菌的生长,这也导致了低温冷藏条件下不同贝类菌相动态变化的差异性。
2.3 优势腐败菌生长动力学模型建立
2.3.1 初级模型建立
根据不同温度条件下(-1.5、5.0、10.0、15.0、20.0 ℃)假单胞菌生长的实测值,由修正的Gompertz模型拟合得到曲线如图3所示,假单胞菌呈典型的S型生长,初级模型拟合结果见式(7)~(11)所示:

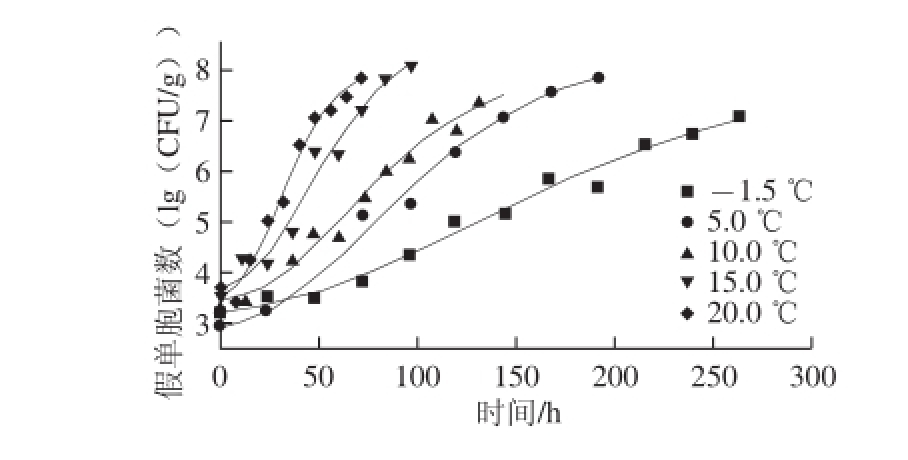
图3 不同温度条件下假单胞菌生长拟合曲线
Fig. 3 Raw data and ftted growth curves for modifed Gompertz model at fve different temperatures
表 2 假单胞菌生长动力学参数
Table 2 Gompertz model parameters for the growth curves of Pseudomonasspp.

温度/℃初始菌落数N 0(lg(CFU/g))最大菌落数N max(lg(CFU/g))延滞时间λ/h最大比生长速率μ max/h -1MSER Adj 2-1.53.0978.19430.7650.0190.0340.982 5.02.8528.49623.1690.0380.0590.983 10.03.3838.20220.4930.0410.0420.981 15.03.6028.96213.7250.0650.1380.952 20.03.5128.06710.5260.1000.0480.982
由表2可看出,修正的Gompertz方程能较好地预测本实验中假单胞菌的生长,在-1.5、5.0、10.0、20.0 ℃条件下回归相关系数值R 2均高于0.98,MSE较小,说明模型拟合程度高。而在15.0 ℃条件下R 2仅为0.95,MSE为0.138,模型拟合程度较低,说明采用单一模型对不同温度微生物进行预测难度较大,实验中必须根据不同条件找出预测假单胞菌生长的最适模型 [27]。随着保活温度的升高,假单胞菌最大比生长速率明显变大,而延滞期则逐渐缩短,说明冰温对缢蛏保活过程中假单胞菌的生长具有明显的抑制作用,这与Gospavic等 [28]的研究结果一致。
2.3.2 二级模型建立
Belehradek模型能够拟合温度与假单胞菌生长动力学参数(μ max和λ)之间的关系。在95%置信区间水平上,温度与(μ max) 0.5和(1/λ) 0.5呈现良好的线性关系,模型的相关系数值R 2分别为0.963和0.970。温度与最大比生长速率的关系见方程(12),温度与延滞时间的关系见方程(13)。
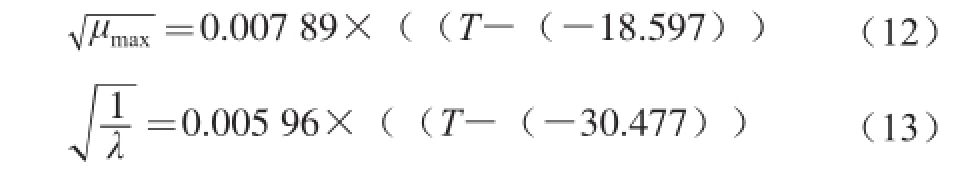
2.3.3 生长动力学模型检验
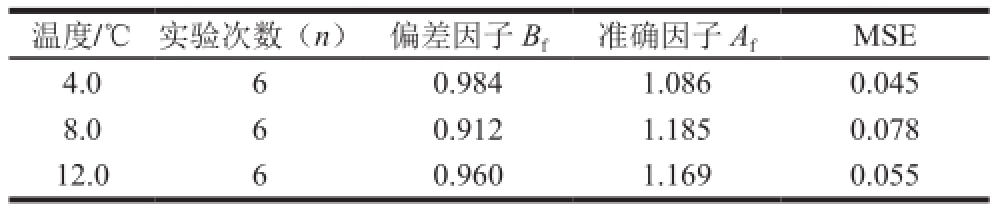
B f为观察值和预测值之间的差异提供了一个衡量的指标,A f则是作为衡量所建模型准确度的一个标准。一般认为B f介于0.8~1.2之间、A f介于1.0~1.2之间模型可被接受。A f值越接近于1时,模型预测效果越好。4.0、8.0、12.0 ℃条件下假单胞菌预测的B f和A f见表3,模型的B f均接近于1,MSE都很小,分别为0.045、0.078和0.055,说明所建立的动力学模型能很好预测在-1.5~15.0 ℃温度范围内假单胞菌的生长动态。宋志强等 [29]研究发现,修正的Gompertz模型能很好预测假单胞菌在8、12 ℃恒定温度条件下鱼腩中的生长动态,预测值的上下波动幅度和误差均在10%以内。Li Miaoyun等 [30]通过修正的Gompertz模型拟合了不同恒温条件下保藏的生猪肉中假单胞菌的生长,发现其MSE同样很小。说明该模型在预测假单胞菌生长方面可靠性良好。
表 3 不同温度条件下假单胞菌的B
f、A
f和MSE
Table 3 Bias factor, accuracy factor and MSE for the predicted values of Pseudomonas spp. in live Sinonovacula constricta stored at 4, 8 and 12 ℃, respectively
温度/℃实验次数(n)偏差因子 B f准确因子 A fMSE 4.060.9841.0860.045 8.060.9121.1850.078 12.060.9601.1690.055
本研究通过Illumina MiSeq高通量测序全面分析了缢蛏冰温保活过程中的菌相动态变化,丰富了对于冰温保活缢蛏微生物多样性的认识,鉴定得到缢蛏冰温保活过程中的优势腐败菌为假单胞菌。假单胞菌生长动力学模型的建立为预测冰温缢蛏的品质和新鲜度的评定提供了有力的证据,本实验中采用修正的Gompertz 初级模型能够很好描述地较低温度条件下(-1.5~15.0 ℃)缢蛏中假单胞菌的生长变化规律,回归方程相关系数R 2均在0.98以上。二级平方根模型中温度与最大比生长速率和延滞时间具有良好的线性关系。偏差度和准确度均在可接受范围之内,所建的Gompertz模型可用于-1.5~15.0 ℃温度范围内假单胞菌生长和缢蛏品质的预测。
参考文献:
[1] SHEN H D, LIU G F, FANG L, et al. Effect of microalgae and temperature on absorption efficiency of razor clam (Sinonovacula constricta Lamark, 1818)[J]. Aquaculture Research, 2013, 44(10): 1524-1530. DOI:10.1111/j.1365-2109.2012.03159.x.
[2] 吴雪丽, 刘红英, 韩冬娇. 冰温结合生物保鲜剂对扇贝的保鲜效果[J].食品科学, 2014, 35(10): 273-277.
[3] WANG L, LIU Z, DONG S, et al. Effects of vacuum and modified atmosphere packaging on microbial flora and shelf-life of pacific white shrimp (Litopenaeus vannamei) during controlled freezing-point storage at -0.8 ℃[J]. Food Science and Technology Research, 2014, 20(6): 1141-1152.
[4] 徐若, 曹井志, 包建强. 泥蚶无水低温保活技术研究[J]. 食品工业科技, 2008, 29(5): 256-258.
[5] 王学娟, 秦小明, 林华娟, 等. 波纹巴非蛤在低温保活过程中主要营养成分变化[J]. 食品科技, 2008, 33(6): 90-93.
[6] 费星, 秦小明, 林华娟, 等. 近江牡蛎在净化和生态冰温保活过程中主要营养成分的变化[J]. 食品科技, 2010, 35(3): 68-71.
[7] 申淑琦, 万玉美, 王小瑞, 等. 海湾扇贝低温无水保活过程中营养成分和生化特性的变化[J]. 大连海洋大学学报, 2014(6): 633-637.
[8] QU Y, ZHANG X, SHEN W, et al. Illumina MiSeq sequencing reveals long-term impacts of single-walled carbon nanotubes on microbial communities of wastewater treatment systems[J]. Bioresource Technology, 2016, 211: 209-215. DOI:10.1016/j.biortech.2016.03.043.
[9] YOU J, WU G, REN F, et al. Microbial community dynamics in Baolige oilfeld during MEOR treatment, revealed by Illumina MiSeq sequencing[J]. Applied Microbiology and Biotechnology, 2015, 100(3): 1469-1478.
[10] CARROLL I M, RINGELKULKA T, SIDDLE J P, et al. Characterization of the fecal microbiota using high-throughput sequencing reveals a stable microbial community during storage[J]. PLoS ONE, 2012, 7(10): e46953-e46953.
[11] FAN W, HUO G, LI X, et al. Diversity of the intestinal microbiota in different patterns of feeding infants by Illumina high-throughput sequencing[J]. World Journal of Microbiology and Biotechnology, 2013, 29(12): 2365-2372.
[12] LI Miaoyun, LI Yuanhui, HUANG Xianqing, et al. Evaluating growth models of Pseudomonas spp. in seasoned prepared chicken stored at different temperatures by the principal component analysis (PCA)[J]. Food Microbiology, 2014, 40(3): 41-47. DOI:10.1016/ j.fm.2013.11.014.
[13] CHATTERJEE T, CHATTERJEE B K, MAJUMDAR D, et al. Antibacterial effect of silver nanoparticles and the modeling of bacterial growth kinetics using a modified Gompertz model[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2015, 1850(2): 299-306. DOI:10.1016/j.bbagen.2014.10.022.
[14] WANG L, XU C, HUANG P, et al. Single- and multi-cycle high hydrostatic pressure treatment on microbiological quality of mud snail (Bullacta exarata) during refrigerated storage[J]. Food Control, 2016, 65: 1-7. DOI:10.1016/j.foodcont.2016.01.010.
[15] FANG T, HUANG L, LIU L, et al. Mathematical modeling of growth of Salmonella spp. and spoilage microorganisms in raw oysters[J]. Food Control, 2015, 53: 140-146.
[16] POWELL S M, RATKOWSKY D A, TAMPLIN M L. Predictive model for the growth of spoilage bacteria on modified atmosphere packaged Atlantic salmon produced in Australia[J]. Food Microbiology, 2015, 47: 111-115. DOI:10.1016/j.fm.2014.12.001.
[17] LI L, XIE B, DONG C, et al. Can closed artificial ecosystem have an impact on insect microbial community? A case study of yellow mealworm (Tenebrio molitor L.)[J]. Ecological Engineering, 2016, 86: 183-189.
[18] FAN L M, BARRY K, HU G D, et al. Bacterioplankton community analysis in tilapia ponds by Illumina high-throughput sequencing[J]. World Journal of Microbiology and Biotechnology, 2016, 32(1): 1-11.
[19] SUN W, XIAO H, PENG Q, et al. Analysis of bacterial diversity of Chinese Luzhou-favor liquor brewed in different seasons by Illumina MiSeq sequencing[J]. Annals of Microbiology, 2016, 66(3): 1-9.
[20] TRABAL F N, MAZÓNSUÁSTEGUI J M, VÁZQUEZJUÁREZ R, et al. Changes in the composition and diversity of the bacterial microbiota associated with oysters (Crassostrea corteziensis, Crassostrea gigas and Crassostrea sikamea) during commercial production[J]. FEMS Microbiology Ecology, 2014, 88(1): 69-83. DOI:10.1111/1574-6941.12270.
[21] 庄荣玉, 黄晓春, 薛长湖, 等. 鲜活缢蛏肉质细菌菌群组成分析[J].食品与发酵工业, 2007, 33(1): 43-44.
[22] LEE M J, LEE J J, CHUNG H Y, et al. Analysis of microbiota on abalone (Haliotis discus hannai) in South Korea for improved product management[J]. International Journal of Food Microbiology, 2016, 234: 45-52. DOI:10.1016/j.ijfoodmicro.2016.06.032.
[23] CRUZ-ROMERO M, KELLY A L, KERRY J P. Effects of highpressure treatment on the microflora of oysters (Crassostrea gigas) during chilled storage[J]. Innovative Food Science and Emerging Technologies, 2008, 9(4): 441-447. DOI:10.1016/j.ifset.2008.04.002
[24] CAO R, XUE C H, LIU Q. Changes in microbial flora of Pacific oysters (Crassostrea gigas) during refrigerated storage and its shelf-life extension by chitosan[J]. International Journal of Food Microbiology, 2009, 131(2/3): 272-276. DOI:10.1016/j.ijfoodmicro.2009.03.004.
[25] MADIGAN T L, BOTT N J, TOROK V A, et al. A microbial spoilage profile of half shell Pacific oysters (Crassostrea gigas) and Sydney rock oysters (Saccostrea glomerata)[J]. Food Microbiology, 2014, 38: 219-227. DOI:10.1016/j.fm.2013.09.005.
[26] WOOD R R, ARIAS C R. Dynamics of bacterial communities in postharvested eastern oyster (Crassostrea virginica) maintained under refrigeration[J]. Journal of Aquatic Food Product Technology, 2015, 24(1): 300-312.
[27] LEE Y J, JUNG B S, YOON H J, et al. Predictive model for the growth kinetics of Listeria monocytogenes in raw pork meat as a function of temperature[J]. Food Control, 2014, 44: 16-21. DOI:10.1016/j.foodcont.2014.03.024.
[28] GOSPAVIC R, KREYENSCHMIDT J, BRUCKNER S, et al. Mathematical modelling for predicting the growth of Pseudomonas spp. in poultry under variable temperature conditions[J]. International Journal of Food Microbiology, 2008, 127(3): 290-297. DOI:10.1016/ j.ijfoodmicro.2008.07.022.
[29] 宋志强, 刘超群, 侯温甫. 鱼腩中假单胞菌预测模型的建立与货架期预测[J]. 食品科学, 2013, 34(22): 292-297.
[30] LI Miaoyun, NIU Huimin, ZHAO Gaiming, et al. Analysis of mathematical models of Pseudomonas spp. growth in pallet-package pork stored at different temperatures[J]. Meat Science, 2013, 93(4): 855-864. DOI:10.1016/j.meatsci.2012.11.048.
Changes in Microbial Community and Dynamic Models for the Growth of Specifc Spoilage Bacteria in Sinonovacula constricta during Controlled Freezing-Point Storage
CHU Jianjun
1, FU Linglin
1, WANG Chong
1, ZHOU Deqing
2, WANG Haiyan
3, WANG Yanbo
1,*
(1. Key Laboratory for Food Microbial Technology of Zhejiang Province, School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 3. School of Management Science and Industrial Engineering, Nanjing University of Finance and Economics, Nanjing 210046, China)
Abstract:This study was designed to explore the effect of controlled freezing-point storage (CFPS) on the quality of Sinonovacula constricta. The structure and dynamics of the microbial community in Sinonovacula constricta during CFPS was investigated by Illumina high-throughput sequencing technology. The growth kinetics of specific spoilage bacteria (Pseudomonas spp.) was modeled and validated at different temperatures. The results showed that the initial bacterial fora in fresh Sinonovacula constricta was composed of Arcobacter spp. (16.2%), Bacteroidales (8.4%) and Psychrilyobacter spp. (7.2%). At the end of the survival period, Pseudomonas spp. became the specifc spoilage bacteria, which accounted for 26.2% of the total bacterial population, followed by Vibrionaceae, Psychromonas spp., Arcobacter spp. and Psychrilyobacter spp., with proportions of 17.8%, 14.4%, 13.0% and 11.8%, respectively. The growth dynamics of Pseudomonas spp. at low temperatures (−1.5-15.0 ℃) could be described by the modifed Gompertz model. The determination coeffcient (R 2) of the model exceeded 0.98 and both the bias factor and accuracy factor were within a statistically acceptable range. The square-root model for temperature dependence of the specifc growth rate and lag-phase duration showed good linearity with determination coeffcients (R 2) of 0.963 and 0.970, respectively. The Gompertz model established could predict the growth of Pseudomonas spp. in the range of −1.5-15.0 ℃.
Key words:Sinonovacula constricta; controlled freezing-point storage; high-throughput sequencing; microforal analysis; dynamic model
DOI:10.7506/spkx1002-6630-201701018
中图分类号:中图分类号:TS254.4 文献标志码:A 文章编号:1002-6630(2017)01-0110-06
收稿日期:2016-08-15
基金项目:“十二五”国家科技支撑计划项目(2015BAD17B01)
作者简介:储建军(1991—),男,硕士研究生,研究方向为食品质量与安全。E-mail:chujianjunstar@163.com
*通信作者:王彦波(1978—),男,教授,博士,研究方向为食品安全与质量控制。E-mail:wangyb@mail.zjgsu.edu.cn
引文格式:
储建军, 傅玲琳, 王翀, 等. 缢蛏冰温保活过程中菌相变化及优势腐败菌生长动力学建模[J]. 食品科学, 2017, 38(1): 110-115. DOI:10.7506/spkx1002-6630-201701018. http://www.spkx.net.cn
CHU Jianjun, FU Linglin, WANG Chong, et al. Changes in microbial community and dynamic models for the growth of specifc spoilage bacteria in Sinonovacula constricta during controlled freezing-point storage[J]. Food Science, 2017, 38(1): 110-115. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201701018. http://www.spkx.net.cn