
图1 抗氧化肽KWFH质谱图
Fig. 1 Mass spectrum of KWFH
王 莹 1,2,邢 杰 2,李幸芳 2,殷涌光 1,2,*
(1.吉林大学生物与农业工程学院,吉林 长春 130025;2.吉林大学食品科学与工程学院,吉林 长春 130062)
摘 要:为了探究高压脉冲电场(pulsed electric field,PEF)提高抗氧化肽活性的机制,以抗氧化肽KWFH为实验材料,以1,1-二苯基-2-三硝基苯肼为衡量指标,通过双因素试验方案,考察电场强度和电场频率对其活性的影响。经过频率2 400 Hz、电场强度10 kV/cm的PEF处理,抗氧化肽KWFH活性提高了13.92%(P<0.05)。借助傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、核磁共振氢谱(nuclear magnetic resonance, 1H-NMR)、Zeta电位及圆二色谱技术,分析高压脉冲电场技术对其结构的影响。FTIR分析结果显示,经过PEF处理的样品羧酸羰基C=O和苯环吸收峰强度增强;经过 1H-NMR分析,推测羧酸羰基C=O和苯环吸收强度变化引起官能团携带的氢质子变化。同时,经过PEF处理抗氧化肽KWFH的Zeta电位提高了8.70 mV(P<0.05),进一步推测经过PEF处理,抗氧化肽KWFH结构更加无序,致使官能团暴露,吸收峰强度发生变化,引起肽活性改变。研究发现PEF处理对二级结构之间转化没有影响。这些研究为进一步探究PEF技术提高抗氧化肽活性机理提供了理论依据。
关键词:高压脉冲电场;抗氧化肽;傅里叶变换红外光谱;核磁共振
目前,抗氧化剂受到人们的广泛关注,特别是在食品领域 [1]。许多人工合成的抗氧化剂如叔丁基羟基茴香醚 [2]、叔丁基对苯二酚、没食子酸丙酯 [3]也广泛应用于食品中。然而,研究表明人工合成的抗氧化剂具有一定的致癌作用 [4]。因此,越来越多的专家开始关注天然植物中提取的抗氧化肽,特别是含有不同氨基酸残基数量的抗氧化肽。这些氨基酸残基如Pro-Glu-Tyr、Leu-Pro-Asp-Glu [5]、Pro-Asn-Asn [6],往往具有较强的抗氧化性,能够有效地清除自由基。
高压脉冲电场(pulsed electric field,PEF)技术是一种非热加工食品的方法 [7],利用泵将液体材料吸入高强度脉冲电场(>10 kV/cm)并进行短时间的处理。近年来,该技术广泛应用于非热杀菌 [8],加快化学反应以及提高蛋白质、多肽活性等方面 [9]。同时许多学者对此进行了研究,张鸣镝等 [10]研究发现,分子质量在1~3 kD的红松籽多肽经过PEF处理后,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率比未经处理的样品提高了18.77%;Jia Wang等 [11]通过PEF处理将谷胱甘肽的DPPH自由基清除率从81.83%提高到97.40%。目前,对于PEF技术提高抗氧化肽活性的机理研究是一个热点问题。而傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)是可以检测蛋白质官能团种类和含量变化的技术。Yu Pengzhi等 [12]利用FTIR技术分析了血管紧张素转换酶抑制肽的一级和二级结构。此外核磁共振氢谱(nuclear magnetic resonance, 1H-NMR)技术也用来鉴别物质官能团的变化。孟旭 [13]利用 1H-NMR技术探究了大豆蛋白在高温条件下氨基酸残基的变化。
本实验以实验室前期工作中红松籽经过酶解、超滤、纯化等步骤得到的抗氧化肽KWFH为材料,通过PEF技术对其抗氧化活性进行研究,并利用FTIR、 1H-NMR和Zeta电位等方法深入分析了抗氧化活性提高旳机理,为今后红松籽源抗氧化肽产品的开发提供参考。
1.1 材料与试剂
抗氧化肽KWFH(图1,纯度≥98%) 上海强耀生物科技有限公司;DPPH、溴化钾、氘代诱导剂(分析纯) 美国Sigma公司;甲醇、盐酸、氢氧化钠(均为分析纯) 北京化工厂。

图1 抗氧化肽KWFH质谱图
Fig. 1 Mass spectrum of KWFH
1.2 仪器与设备
PEF装置由吉林大学殷涌光教授设计。
PH-070A干燥箱/培养箱 上海一恒科学仪有限公司;单道移液器(200、1 000 μL) 北京东林昌盛生物科技有限公司;BT25S电子分析天平(精度0.01 mg) 北京赛多利斯仪器系统有限公司;Starter-300便携式pH计上海奥豪斯仪器有限公司;RT-6000 酶标仪 美国雷杜有限公司;ZG-2真空冷冻干燥机 杭州创意真空冷冻干燥设备厂;IR Prestige-21 FTIR仪 日本岛津公司;500 MHz液体NMR波谱仪 美国Bruke公司;NanoZS90 Zeta粒度仪 英国Malvern公司;J-810圆二色谱(circular dichroism,CD)仪 日本JASCO公司。
1.3 方法
1.3.1 PEF处理及实验设计
参照文献[14]中的方法,使用的PEF装置由加热装置、处理装置和冷却装置等组成,包括连接正负极的金属管以及绝缘层装置。在加入物料前,将料泵和物料回流管用去离子水及乙醇清洗3 次。在室温25 ℃条件下,利用物料泵将质量浓度为8 mg/mL的抗氧化肽KWFH溶液抽至PEF系统,调节流速,使其达到3.2 mL/min。随后根据实验方案调整相关参数,处理2 min后,收集样液,备用。
以电场强度、电场频率为双因素,考察PEF处理技术对抗氧化肽KWFH的DPPH自由基清除率的影响。电场频率为1 800、 2 400 Hz,电场强度为5、10、15、20 kV/cm。
1.3.2 DPPH自由基清除率测定
根据前期实验方法改进 [15]:在25 ℃条件下,将PEF处理过的抗氧化肽KWFH样品肽液、甲醇和0.6 mmol/L的DPPH-甲醇溶液各100 μL,依次加入96 孔板中,并放置于微量振荡器混合1 min。混合均匀后,避光反应90 min,利用酶标仪在515 nm波长处测定吸光度A S。在相同条件下,将100 μL甲醇代替样品溶液作为空白对照,测其吸光度A B,DPPH自由基清除率按下式计算。
1.3.3 FTIR测定
调节干燥箱温度为130 ℃,将KBr放置于其中干燥8 h。称取200 mg KBr及1 mg抗氧化肽KWFH冻干粉研磨,并进行压片处理。调节仪器测试范围为400~4 000 cm -1,分辨率为4 cm -1,扫描速率为2.8 mm/s,对压片后的处理样进行扫描,扣除200 mg KBr研磨压片扫描的空白背景后获得中红外光谱图 [16]。
1.3.4 1H-NMR测定
参考Muhammad等 [17]的方法,设置仪器的检测条件为5 mm BBFO探头,500 MHz,采样延迟时间6 s,脉冲宽度13 μs,采样次数32 次。将待测样品与D 2O诱导剂按比例混合均匀,放置于5 mm的核磁管中,在上述条件下进行 1H-NMR检测。
1.3.5 Zeta电位测定
Zeta电位既可以反映其蛋白质的表面电荷,可反映其稳定程度。本次实验中,Zeta粒度仪测量时间设定为2 min,溶剂折光指数值设为1.330。将待测的样品倾倒至样品池的2/3处放入其中,在25 ℃条件下进行测定 [18]。
1.3.6 CD测定
根据Komjáti等 [19]所运用的方法改进,CD仪的参数设定为测定波长190~270 nm、样品质量浓度8 mg/mL,扫描速率100 nm/min,同时每个样品重复扫描3 次。测试前将样品池用去离子水润洗3 遍,再用待测样品润洗1 遍。随后将样品倾倒至样品池的2/3处并放入CD仪的样品槽中进行测量。
1.4 数据统计分析
实验数据采用SPSS 17.0统计软件进行单因素方差分析、相关性分析。用独立样品的t检验进行差异显著性检验,结果用
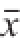 ±s表示,显著性水平为P<0.05。
±s表示,显著性水平为P<0.05。
2.1 不同PEF处理对抗氧化肽KWFH 的DPPH自由基清除率的影响
由图2可知,2 个频率处理下的抗氧化肽活性变化趋势基本相同,同时相同场强处理时2 400 Hz的样品的DPPH自由基清除能力均大于1 800 Hz的样品。当电场频率为1 800 Hz时,抗氧化肽KWFH的DPPH自由基清除率随电场强度变化程度较小,但相比于未处理的肽,其DPPH自由基清除率均有所提高。当电场强度从0 kV/cm提高到10 kV/cm时,DPPH自由基清除率从(37.86±0.69)%提高到(39.34±2.94)%(P<0.05),并且达到该频率时的DPPH自由基清除率最大值。电场频率为2 400 Hz时,抗氧化肽KWFH的DPPH自由基清除率变化较大。其中电场强度为10 kV/cm时,DPPH自由基清除率达到最大值(43.13±1.21)%。当电场强度从10 kV/cm提高至20 kV/cm时,抗氧化肽KWFH清除DPPH自由基的能力不断下降。因此,在后续实验中选用未经PEF处理的样品和经过2 400 Hz、10 kV/cm电场处理(最优条件)的样品进行检测,在此基础上探究PEF技术对抗氧化肽KWFH结构的影响。
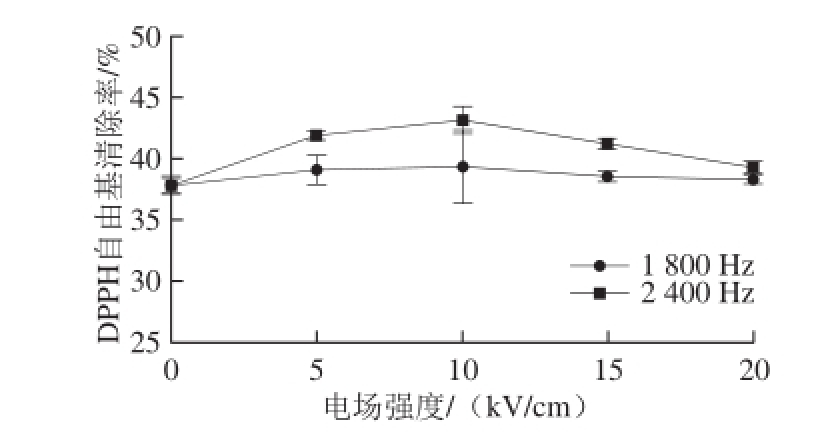
图2 PEF处理对抗氧化肽KWFH的DPPH自由基清除能力的影响
Fig. 2 DPPH radical-scavenging capacity of KWFH treated by PEF
2.2 FTIR分析
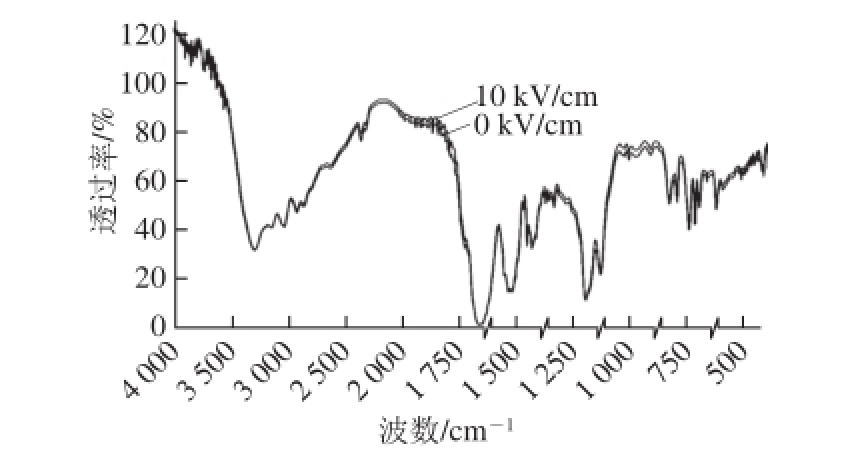
图3 PEF处理抗氧化肽KWFH的FTIR图
Fig. 3 FTIR spectrum of PEF-treated sample
由图3可知,经过电场频率2 400 Hz、电场强度10 kV/cm处理的肽比未经PEF处理的肽部分吸收峰强度增大。在表1中进一步分析其官能团,发现样品均含有—OH(3 645~3 300 cm -1)、芳香族仲胺—NH(3 420~3 300 cm -1)、—NH 2(3 385~3125 cm -1)、仲酰胺—NH(3 300 cm -1)、不饱和C—H(>3 000 cm -1)、饱和C—H(3 000~2 800 cm -1)、酰胺带(1 700~1 600 cm -1)、酮羰基C=O(1 750~1 650 cm -1)、芳香环C=C(1 610~1 370 cm -1)、芳香族C=N(1 610~1 370 cm -1)、羧酸羰基C=O(1 760~1 660 cm -1)和苯环(900~690 cm -1)的特征吸收峰。其中,—OH、—NH(芳香族仲胺)、—NH 2、—NH(仲酰胺)、不饱和C—H、饱和C—H、酰胺带、酮羰基C=O、芳香环C=C、芳香族C=N的特征吸收峰在PEF处理前后强度基本保持不变。而在1 750 cm -1和750 cm -1附近,羧酸羰基C=O和苯环的特征吸收峰在PEF处理后强度都增强。由此推测在经过PEF处理后,样品的DPPH自由基清除率的变化与官能团羧酸羰基C=O和苯环变化有关 [20]。因此研究认为,经过PEF处理后,正负电极强大的电压,致使化学键羧酸羰基C=O和苯环两端的原子电负性差距增大 [21],其振动伸缩引起的KWFH肽结构中羧酸羰基C=O和苯环吸收峰强度增强。同时,电负性差距增大,正负电荷中心相距越远 [22],正电荷中心对自由基的吸引力越大,从而改变了肽与自由基结合的能力,致使其活性发生了变化。
表 1 PEF处理的抗氧化肽KWFH的FTIR分析结果
Table 1 Functional groups of PEF-treated KWFH analyzed by FTIR spectroscopy
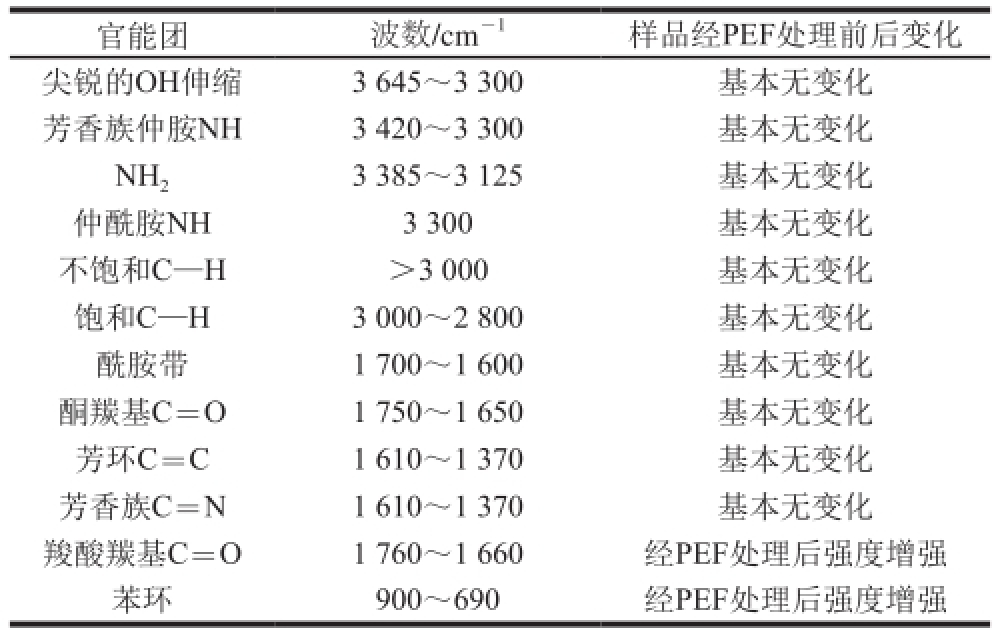
官能团波数/cm -1样品经PEF处理前后变化尖锐的OH伸缩3 645~3 300基本无变化芳香族仲胺NH3 420~3 300基本无变化NH 23 385~3 125基本无变化仲酰胺NH3 300基本无变化不饱和C—H>3 000基本无变化饱和C—H3 000~2 800基本无变化酰胺带1 700~1 600基本无变化酮羰基C=O1 750~1 650基本无变化芳环C=C1 610~1 370基本无变化芳香族C=N1 610~1 370基本无变化羧酸羰基C=O1 760~1 660经PEF处理后强度增强苯环900~690经PEF处理后强度增强
2.3 1H-NMR分析
通过对抗氧化肽KWFH的FTIR光谱进行分析,发现经过PEF处理的样品中羧酸羰基C=O和苯环的吸收峰强度增强,有可能引起抗氧化肽KWFH的氢质子变化,因此本实验对PEF处理前后的抗氧化肽KWFH进行了 1H-NMR分析,从而探究PEF处理对氢质子的影响。由图4可知,两幅图中峰的位移并不完全相同,部分峰的位移发生了改变,峰面积也发生变化。由此,研究认为经过PEF处理,羧酸羰基C=O和苯环吸收峰强度增强,致使抗氧化肽KWFH的氢质子所处的化学环境发生变化,从而引起峰的位移及面积的改变。实验结果进一步了证实了FTIR光谱的实验结论。
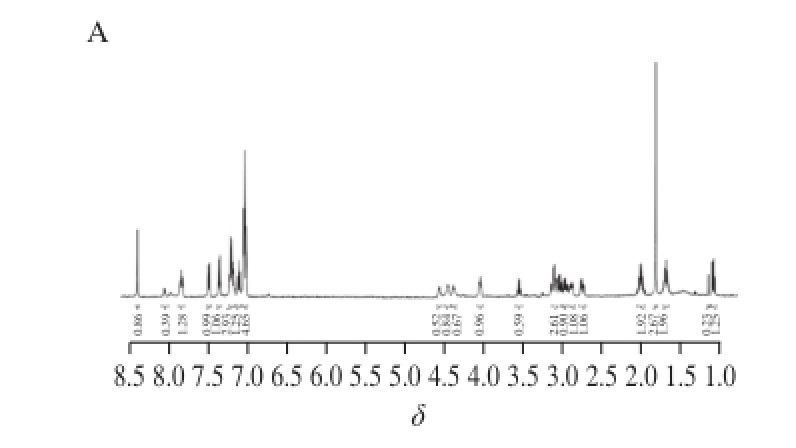
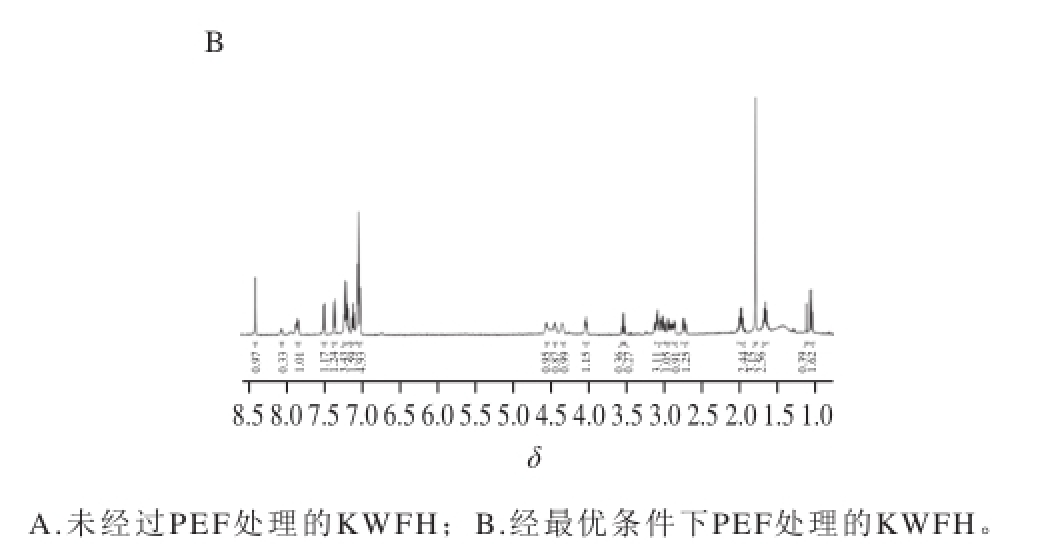
图4 KWFH的
1H-NMR谱图
Fig. 4
1H-NMR spectrum of KWFH
2.4 Zeta电位分析
Zeta电位是指滑移平面电势,反映电荷吸附的能力,同时也是乳化液电特征的良好表征 [23]。一般来说,Zeta电位的绝对值越高,说明同种电荷的粒子排斥力更高,肽分子会变成无规则松散的结构,从而使许多官能团暴露出来,吸收峰的强度增强。一般来说,蛋白质表面的电荷对界面吸附能力非常重要。因此,本实验对经过PEF处理和未经PEF处理的样品进行测量。在电场频率为2 400 Hz、电场强度0 kV/cm时Zeta电位值为(0.006±0.620) mV,呈正电性。这是由于组成抗氧化肽KWFH的赖氨酸和组氨酸为带正电荷的氨基酸。当电场强度提高到10 kV/cm时,Zeta电位值达到(8.71 ±2.08) mV。因此推测,经过PEF处理,正负极产生的电场力改变了组氨酸和赖氨酸官能团的电荷分布,导致抗氧化肽KWFH的正电荷增加,使肽结构更加松散,从而使羧酸羰基C=O和苯环暴露出来,增加了吸收峰强度 [24]。
2.5 CD分析
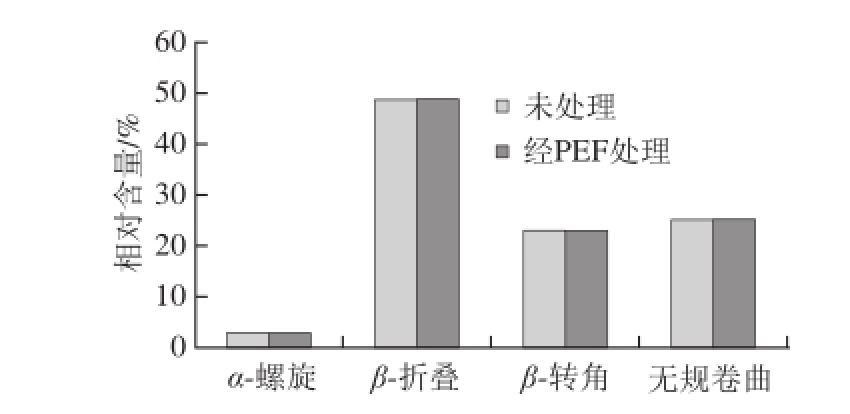
图5 KWFH二级结构变化
Fig. 5 Changes in secondary structure of KWFH after PEF treatment
CD可以用来测定肽的二级结构变化 [25-30]。PEF处理后的KWFH圆二色谱数据如图5所示。经过分析发现,未经PEF处理的样品含有α-螺旋、β-折叠、β-转角、无规卷曲4 种二级结构,所占的比例分别为2.9%、49.0%、22.9%、25.2%。经过PEF处理的样品,其仍含有α-螺旋、β-折叠、β-转角、无规卷曲4 种二级结构,并且与未经PEF处理的比例相同。因此KWFH的活性改变并不是由于其二级结构变化引起的。
本研究运用双因素试验方法,通过对样品进行PEF处理,发现当电场频率为2 400 Hz、电场强度为10 kV/cm时,抗氧化肽KWFH的DPPH自由基清除率达到最高值可达(43.13±1.21)%,与未经处理的抗氧化肽KWFH相比提高了13.92%(P<0.05)。在此基础上,利用FTIR技术,对该条件下KWFH官能团种类及强度变化进行分析。研究发现,经过PEF处理,抗氧化肽KWFH的羧酸羰基C=O和苯环吸收峰强度增加。 1H-NMR分析结果显示,经过PEF处理羧酸羰基C=O和苯环强度增加,引起氢质子所处的化学环境发生变化。同时,KWFH肽经过PEF处理,含有的正电荷增加,说明经过PEF处理,由于同种电荷的排斥力增大,肽的结构更加松散无规则,所含有的官能团暴露出来,在一定程度上使羧酸羰基C=O和苯环吸收峰强度增强,致使其活性发生改变。本研究不仅揭示了PEF技术提高抗氧化肽活性的机理,也为四肽的构象改变提供了新的方法。
参考文献:
[1] SILA A, BOUGATEF A. Antioxidant peptides from marine byproducts: isolation, identifcation and application in food systems. a review[J]. Journal of Functional Foods, 2016, 21: 10-26. DOI:10.1016/ j.jff.2015.11.007.
[2] WATTANASIRITHAM L, THEERAKULKAIT C, WICKRAMASEKARA S, et al. Isolation and identifcation of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J]. Food Chemistry, 2016, 192: 156-162. DOI:10.1016/ j.foodchem.2015.06.057.
[3] 李榕. 食品中多种抗氧化剂的测定方法研究[D]. 南京: 南京农业大学, 2007: 8-12.
[4] ARUOMA O I. Aruoma assessment of potential prooxidant and antioxidant actions[J]. JAOCS, 1996, 73(12): 1617-1625.
[5] 沈勇根, 徐明生, 尹忠平, 等. 卵白蛋白抗氧化肽分离与纯化[J]. 中国食品学报, 2011, 11(8): 16-22.
[6] 余颉. 螺旋藻蛋白酶解工艺的优化及抗氧化肽的分离鉴定[D]. 武汉: 华中农业大学, 2015: 25.
[7] LIU Z W, HAN Z, ZENG X A, et al. Effects of vesicle components on the electro-permeability of lipid bilayers of vesicles induced by pulsed electric felds (PEF) treatment[J]. Journal of Food Engineering, 2016, 179: 88-97. DOI:10.1016/j.jfoodeng.2016.02.003.
[8] TIMMERMANS R A H, NEDERHOFF A L, GROOT M N, et al. Effect of electrical feld strength applied by PEF processing and storage temperature on the outgrowth of yeasts and moulds naturally present in a fresh fruit smoothie[J]. International Journal of Food Microbiology, 2016, 230: 21-30. DOI:10.1016/j.ijfoodmicro.2016.04.014.
[9] ZENG F, GAO Q Y, HAN Z, et al. Structural properties and digestibility of pulsed electric feld treated waxy rice starch[J]. Food Chemistry, 2016, 194: 1313-1319. DOI:10.1016/j.foodchem.2015.08.104.
[10] 张明镝, 姜源, 李雄, 等. 高压脉冲电场技术提高红松籽抗氧化肽活性[J]. 农业工程学报, 2015, 31(14): 272-277. DOI:10.11975/ j.issn.1002-6819.2015.14.037.
[11] JIA W, KE W, YING W, et al. A novel application of pulsed electric feld (PEF) processing for improving glutathione (GSH) antioxidant activity[J]. Food Chemistry, 2014, 161: 361-366. DOI:10.1016/ j.foodchem.2014.04.027.
[12] YU Z, LIU B, ZHAO W, et al. Primary and secondary structure of novel ACE-inhibitory peptides from egg white protein[J]. Food Chemistry, 2012, 133(2): 315-22. DOI:10.1016/j.foodchem.2012.01.032.
[13] 孟旭. 方便豆腐粉微结构及其蛋白质溶解、凝胶机理的研究[D]. 无锡: 江南大学, 2006:16.
[14] 李雄, 郭星, 余佩, 等. 高压脉冲电场技术改变抗氧化活性肽MMCTN的二级结构的实验研究[J]. 食品工业科技, 2016, 37(3): 74-78.
[15] YU Z, LIU B, ZHAO W, et al. Optimized enzymatic hydrolysis and pulsed electric feld treatment for production of antioxidant peptides from egg white protein[J]. African Journal of Biotechnology, 2011, 10(55): 11648-11657.
[16] ROBERTS C A, SAVEREIDE L, CHILDERS D J, et al. In situ FTIR spectroscopy of highly dispersed FeO xcatalysts for NO reduction: role of Na promoter[J]. Catalysis Today, 2016, 267: 56-64.
[17] MUHAMMAD S, PATRICK D, WOLF H, et al. 1H HR-MAS NMR spectroscopy as a simple tool to characterize peptide-functionalized hydrogels as a function of cross linker density[J]. Polymer, 2015, 56: 141-146. DOI:10.1016/j.polymer.2014.11.045.
[18] 李向红, 周小玲, 刘永乐, 等. 蛋白质谷氨酰胺酶对米谷蛋白功能性质的影响[J]. 食品科学, 2010, 31(17): 192-196.
[19] KOMJÁTI B, URAI Á, HOSZTAFI S, et al. Systematic study on the TD-DFT calculated electronic circular dichroism spectra of chiral aromatic nitro compounds: a comparison of B3LYP and CAMB3LYP[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2016, 155(15): 95-102. DOI:10.1016/j.saa.2015.11.002.
[20] 李雪楠, 李雄, 郭星, 等. 基于高压脉冲电场技术提高松子肽的抗氧化活性研究[J]. 食品安全质量检测学报, 2015, 6(6): 2077-2083.
[21] 赵晓坤. 浅谈影响红外吸收光谱强度的因素[J]. 内蒙古石油化工, 2007(12): 179-181.
[22] 刘芳, 胡国海. 红外吸收光谱基团频率影响因素的验证[J]. 景德镇高专学报, 2010, 25(4): 28-30.
[23] 周小玲, 刘永乐, 李向红, 等. 蛋白质谷氨酰胺酶对米谷蛋白的分子结构及功能性质的影响[J]. 中国食品学报, 2010, 10(5): 98-105. DOI:10.16429/j.1009-7848.2010.05.012.
[24] 叶进富. 蛋白质zeta电位与离子交换层析分离的相关性研究[D]. 杭州: 浙江大学, 2006: 6.
[25] GÜLER G, VOROB'EV M M, VOGEL V, et al. Proteolyticallyinduced changes of secondary structural protein conformation of bovine serum albumin monitored by Fourier transform infrared (FTIR) and UV-circular dichroism spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2016, 161: 8-18. DOI:10.1016/j.saa.2016.02.013.
[26] 赵伟, 杨瑞金, 张文斌, 等. 高压脉冲电场作用下蛋清蛋白功能性质和结构的变化[J]. 食品科学, 2011, 32(9): 91-96.
[27] 李迎秋, 陈正行. 高压脉冲电场对大豆分离蛋白疏水性和巯基含量的影响[J]. 食品科学, 2006, 27(5): 40-43.
[28] 吴梨. 高压脉冲电场作用下蛋清蛋白聚集机理与抑制聚集方法研究[D]. 无锡: 江南大学, 2015: 26.
[29] 黄康. 高压脉冲电场处理室内多物理场对微生物灭活作用的研究[D].杭州: 浙江大学, 2013: 10-12.
[30] 董小卫, 宋晓妍, 石梅, 等. Peptaibols类抗菌肽: TrichokoninⅥ在不同溶剂中构象变化的圆二色谱研究[J]. 光谱学与光谱分析, 2010, 30(2): 458-460.
Using FTIR and 1H-NMR to Explore the Structure of Antioxidant Peptide KWFH Treated by Pulsed Electric Field (PEF)
WANG Ying
1,2, XING Jie
2, LI Xingfang
2, YIN Yongguang
1,2,*
(1. College of Biological and Agricultural Engineering, Jilin University, Changchun 130025, China; 2. School of Food Science and Engineering, Jilin University, Changchun 130062, China)
Abstract:This study attempted to explore the mechanism of the effect of pulsed electric field (PEF) on improving the activity of antioxidant peptide. The effect of two PEF factors, electric feld strength and pulse frequency, on the antioxidant activity of KWFH, a commercial antioxidant peptide, was investigated by measuring its DPPH radical scavenging capacity. The results showed that PEF treatment at a pulse frequency of 2 400 Hz and an electric feld strength of 10 kV/cm resulted in a 13.92% increase in the antioxidant activity of KWFH (P < 0.05). Fourier transform infrared spectroscopy (FTIR), nuclear magnetic resonance (NMR), zeta potential and circular dichroism spectroscopy (CD) were used to analyze the structure of the PEF-treated peptide. The FTIR analysis indicated that the absorption peak intensity of C=O and aromatic ring in the sample was enhanced. The 1H-NMR results led to a speculation that functional groups changes resulted in changes in proton absorption intensity. At the same time, the Zeta potential value of the PEF-treated sample was increased by 8.70 mV (P < 0.05). It was further speculated that after PEF treatment, the structure of the antioxidant peptide KWFH became unordered, resulting in exposure of functional groups and an increase of absorption peak intensity, and eventually changes in peptide activity. Moreover, PEF treatment had no effect on the transformation of the secondary structure. This study can provide a theoretical basis for improving the activity of antioxidant peptides by PEF treatment, and for further exploring the underlying mechanism.
Key words:pulsed electric field (PEF); antioxidant peptide; Fourier transform infrared spectroscopy (FTIR); nuclear magnetic resonance (NMR)
DOI:10.7506/spkx1002-6630-201701019
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)01-0116-05
收稿日期:2016-05-09
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102206-5)
作者简介:王莹(1984—),女,博士研究生,研究方向为食源性抗氧化活性肽。E-mail:jinkuang8499@163.com
*通信作者:殷涌光(1949—),男,教授,博士,研究方向为农产品精深加工。E-mail:biofood@jlu.edu.cn
引文格式:
王莹, 邢杰, 李幸芳, 等. 基于FTIR和 1H-NMR方法分析高压脉冲电场技术对抗氧化肽KWFH的结构影响[J]. 食品科学, 2017, 38(1): 116-120. DOI:10.7506/spkx1002-6630-201701019. http://www.spkx.net.cn
WANG Ying, XING Jie, LI Xingfang, et al. Using FTIR and 1H-NMR to explore the structure of antioxidant peptide KWFH treated by pulsed electric feld (PEF)[J]. Food Science, 2017, 38(1): 116-120. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-20170119. http://www.spkx.net.cn