赵 凯 1,李 君 1,谷广烨 2
(1.哈尔滨商业大学 食品科学与工程省级重点实验室,黑龙江 哈尔滨 150076;2.海南省海洋与渔业厅,海南 海口 570204)
摘 要:以玉米原淀粉为原料,研究普鲁兰酶脱支处理糊化后制备缓慢消化淀粉(slowly digestible starch,SDS)过程中各影响因素(温度、pH值、酶用量、贮藏及干燥条件)对SDS形成的影响。结果表明,在57.5 ℃、pH 4.9、酶用量60 U/g的条件下脱支8 h,然后煮沸灭酶30 min,再经4 ℃冷藏、60 ℃干燥后,可得SDS含量为31.09%的产品。原淀粉、酶脱支处理样品及脱支并去除快速消化淀粉样品的X射线衍射图谱表明,脱支处理后,玉米淀粉结晶结构由A型向B型转变。因此,通过酶脱支处理提高SDS含量的可能原因是形成了新的结晶结构,SDS含量与结晶的数量和质量有关。采用酶法制备SDS具有较好的工业化应用前景。
关键词:玉米淀粉;脱支处理;普鲁兰酶;缓慢消化淀粉
淀粉在自然界中分布很广,是高等植物中常见的组分,也是碳水化合物贮藏的主要形式。根据其在人体内的消化特性,可分为快速消化淀粉(readily digestible starch,RDS)、缓慢消化淀粉(slowly digestible starch,SDS)及抗性淀粉(resistant starch,RS)3 种类型 [1]。有关RS的结构、功能、制备及分析方法,已有很多相关报道 [2-5],且市场上已有Novelose ®及Crystalean ®两种商业化产品 [6-7]。相比RS而言,SDS目前尚无商业化产品,研究的深广度也有待提高。国外于2000年以后就开始对其展开研究,并认为它是一种可用于制造低热量食品的功能性配料。其生理功能、营养及加工特征均较为优良,使其在食品及医药领域具有良好的发展前景及应用价值。关于SDS的制备主要有4 种方法,分别为热液处理(韧化处理、湿热处理及压热处理) [8-9]、酶脱支处理 [10-11]、化学改性 [12-13]及复合改性 [14-15]。目前,国内外研究者对食物中SDS形成的影响因素、分析方法及性质已有一定的了解 [16-20],但有关其形成机理及应用还有待进一步研究探讨。
本研究立足于我国玉米加工及其淀粉类食品的工业现状,结合SDS的特性,以我国资源丰富的普通玉米淀粉为原料,研究普鲁兰酶脱支处理制备玉米SDS过程中的影响因素,探讨酶脱支法制备SDS的最佳条件。
1.1 材料与试剂
玉米淀粉 黑龙江龙凤玉米开发有限公司。
猪胰α-淀粉酶(酶活力23 U/mg) 美国Sigma公司;中性蛋白酶(酶活力≥6万 活力单位/g)北京奥博星生物有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、氢氧化钠、苯酚、亚硫酸钠、酒石酸钾钠、麦芽糖、磷酸氢二钠、磷酸二氢钠均为国产分析纯试剂。
1.2 仪器与设备
SP-721E型可见光光度计 上海光谱仪器有限公司;THZ-82A水浴恒温振荡器 江苏荣华仪器制造有限公司;HI-98-128型pH计 北京哈钠科学仪器科技有限公司;HH-4数显恒温水浴锅 国华电器有限公司;XRD6000 X-射线衍射仪 日本岛津公司。
1.3 方法
1.3.1 SDS的制备
将玉米淀粉配制成质量浓度为4 g/100 mL的淀粉乳,密封。沸水浴中加热30 min使淀粉充分糊化,冷却至40 ℃左右。将淀粉糊pH值调至4.9,加入一定量普鲁兰酶,混合均匀,在57.5 ℃的水浴摇床中(150 r/min)进行脱支处理,处理后沸水浴灭酶30 min,冷却至室温贮存10 min,经3 次离心(5 000 r/min,25 ℃)后,取沉淀,60 ℃烘干16 h,粉碎、过筛(160 目),制得SDS [19]。
1.3.2 SDS含量的测定
以Guraya等 [17]方法为参考,在此法的基础上优化测定方法 [21]。准确称取200 mg(底物终质量浓度0.8 g/100 mL)淀粉样品于50 mL试管中,加入15 mL磷酸盐缓冲液(0.5 mol/L,pH 6.9)和4 000 U胰淀粉酶(10 mL,400 U/mL,酶液用质量浓度0.9 g/100 mL的氯化钠溶液配制),在37 ℃条件下水浴振荡(150 r/min)反应,在水解1 h和10 h时取0.5 mL水解液,采用DNS法 [22],在540 nm波长处比色测定麦芽糖含量,再转换成SDS含量,具体计算见公式(1):
式中:G为脱支改性淀粉在某一时间间隔内麦芽糖含量无变化时的质量/mg;H为脱支改性淀粉在时间间隔1 h内产生的麦芽糖质量/mg;I为总淀粉质量/mg(以麦芽糖毫克数计)。
1.3.3 淀粉脱支度的测定
先配制系列麦芽糖标准溶液,采用DNS比色法在540 nm波长处测定吸光度,以麦芽糖质量浓度为横坐标,吸光度为纵坐标,绘制麦芽糖标准曲线。利用Bernfield方法 [23],取2 mL脱支处理后的淀粉液,稀释5 倍,采用DNS比色法在540 nm波长处测定吸光度,根据麦芽糖标准曲线计算出麦芽糖的量,按照式(2)计算淀粉的脱支度。
式中:T n为n h的脱支度/%;R n为脱支n h产生麦芽糖的质量/mg;R 0为脱支0 h产生麦芽糖的质量/mg;R 24为脱支24 h产生麦芽糖的质量/mg。
1.3.4 酶用量对SDS含量的影响
分别采用8、16、40、60、80 U/g的普鲁兰酶用量对淀粉进行脱支处理,处理时间分别为4、8、24 h,pH值为4.9,处理温度为57.5 ℃,反应后于沸水浴中灭酶30 min,冰水浴中迅速冷却,4 ℃条件下贮存2 d,离心、干燥、粉碎,测定SDS含量。
1.3.5 脱支时间对SDS含量的影响
普鲁兰酶用量60 U/g、pH 4.9、处理温度57.5 ℃,分别脱支处理2、4、8、12、16、24 h,反应完成后于沸水浴中灭酶30 min,后续其他处理和条件同1.3.4节。
1.3.6 脱支温度对SDS含量的影响
根据普鲁兰酶最适温度范围(55~65 ℃),普鲁兰酶用量60 U/g、pH 4.9、时间8 h,分析处理温度(52.5、55.0、57.5、60.0、62.5 ℃)对SDS含量的影响,反应后于沸水浴中灭酶30 min,后续其他处理和条件同1.3.4节。
1.3.7 反应pH值对SDS含量的影响
普鲁兰酶用量60 U/g、处理温度57.5 ℃、时间8 h,考察pH 4.5、4.7、4.9、5.1、5.3对SDS含量的影响,脱支处理后于沸水浴中灭酶30 min,后续其他处理和条件同1.3.4节。
1.3.8 X-射线衍射测定结晶结构
将实验样品充分研磨,过160 目筛,在室温及相对湿度为100%的条件下,将实验样品静置24 h后,采用X-射线衍射(X-ray diffraction,XRD)测试样品的结晶结构。特征射线Cu,电压40 kV,电流30 mA,扫描速率6°/min,时间常数1 s,起始角度10°,终止角度80°,读取计算机数据 [24]。
2.1 淀粉脱支度分析
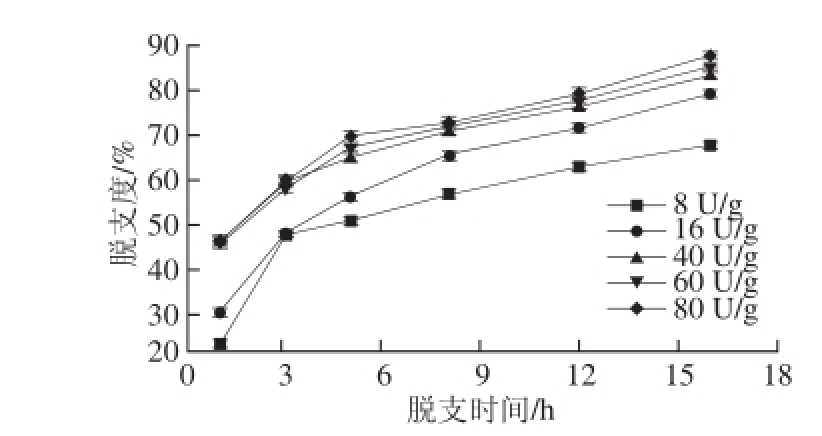
图1 酶脱支时间对淀粉脱支度的影响
Fig. 1 Effect of debranching time on debranching degree
普鲁兰酶能够水解淀粉分子中分支部位的α-1,6糖苷键,使支叉结构断裂,产生一个还原性末端,脱支进行得越彻底,产生的还原性末端就越多。因此,可以通过测定溶液中还原性末端的量(以麦芽糖质量表示)来计算淀粉的脱支度。如图1所示,随着脱支时间的延长,脱支度增大,产生的还原性末端量逐渐增多。采用不同酶用量进行脱支处理,脱支度变化的趋势基本相同。由图1还可以看出,酶用量及脱支时间都对淀粉脱支度有很大影响,从产生的还原性末端量可以看出,相同的脱支时间,酶用量大则产生的还原性末端量多;同一酶用量随着脱支时间的延长,还原性末端量增多即更多的淀粉被脱支。反应刚开始时,酶用量大则脱支度高;然而,随着脱支时间的延长,不同酶用量的脱支度差距逐渐缩小。不同用量的普鲁兰酶脱支处理8 h,脱支度基本可以达到70%左右。这可能是因为酶用量大,溶液中酶用量高,与底物接触机会大,因此,脱支刚开始时的速率较快,短时间内可以得到较高的脱支度。Hizikuri等 [25]报道了异淀粉酶和普鲁兰酶处理马铃薯淀粉,最初脱支迅速,直链淀粉快速凝沉,随着脱支的进行,4 h后速率逐渐降低,但脱支酶解反应却远远没有结束,淀粉中仍然留有大量的支链淀粉,即使酶过量也不能确保完全脱支。Shin等 [11]报道了采用异淀粉酶脱支处理蜡质高粱淀粉,脱支4 h脱支度达到30%以上,脱支12 h脱支度达到了82.7%。脱支不完全可能是因为直链淀粉在脱支过程中的凝沉老化阻碍了脱支反应的进行。
2.2 酶用量对SDS含量的影响
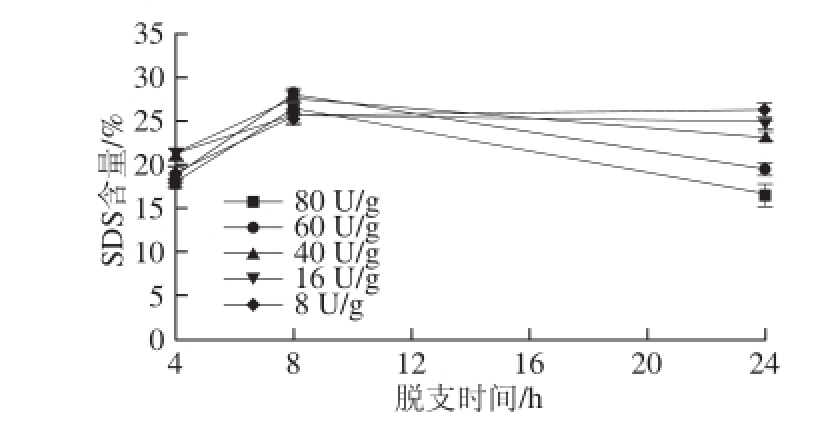
图2 酶用量对SDS含量的影响
Fig. 2 Effect of enzyme dose on the formation of SDS
由图2可以看出,除酶用量8 U/g随脱支时间延长,SDS含量略显增加外,其余各酶用量随着脱支时间的延长SDS含量先增大后减少,在8 h时SDS含量达到最大。脱支4 h后,SDS含量随着酶用量的增大呈现先增大后减少的趋势,其中,当酶用量为60 U/g脱支8 h时,SDS含量达到最高。脱支8~24 h时,SDS含量随着酶用量的增大而减少,且变化明显。这表明在高酶用量短时间脱支处理容易形成SDS。此结果与Guraya等 [16]在酶脱支法制备SDS过程中发现的较高酶液浓度及较短水解时间的条件下,可最大限度得到SDS结论一致。
2.3 脱支时间对SDS含量的影响

图3 脱支时间对SDS含量的影响
Fig. 3 Effect of debranching time on the formation of SDS
由图3可以看出,脱支处理的前8 h,随着脱支时间的延长,SDS含量增加,脱支处理8~24 h,SDS含量逐渐下降,其中脱支处理8 h,SDS含量达到了最大值28.06%。
2.4 反应pH值对SDS含量的影响
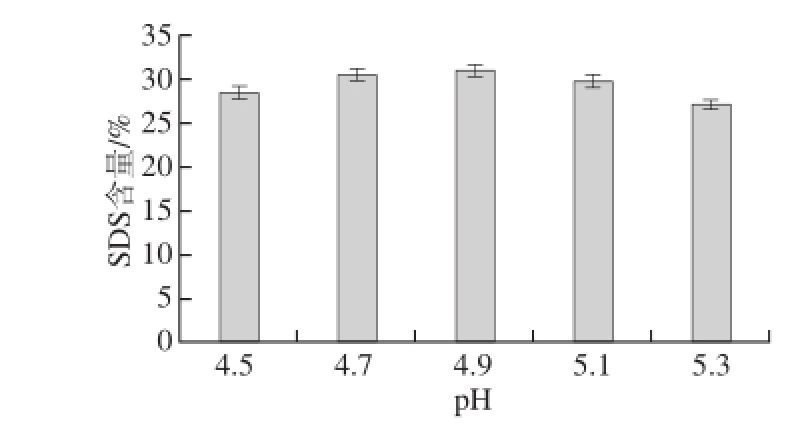
图4 pH值对SDS含量的影响
Fig. 4 Effect of pH on the formation of SDS
从图4可以看出,pH值对SDS含量的影响不显著。当pH值在4.5~4.9时,SDS含量有所增加,pH 4.9时SDS含量最高,当pH值超过4.9时SDS含量开始缓慢下降。所以,采用普鲁兰酶脱支处理淀粉的适宜pH值在4.9左右。
2.5 脱支温度对SDS含量的影响
由图5可以看出,脱支处理温度对SDS含量的影响较显著,随着脱支温度的升高酶促反应速度加快,SDS含量增大,在57.5 ℃时SDS含量达到最高,继续提高脱支温度SDS含量有所下降,但降低不明显。因此,脱支温度选择在57.5 ℃为宜。

图5 脱支温度对SDS含量的影响
Fig. 5 Effect of debranching temperature on the formation of SDS
2.6 贮存及干燥温度对SDS含量的影响
以普鲁兰酶用量60 U/g、脱支处理温度为57.5 ℃、脱支时间8 h、pH4.9为例,研究室温22、4、-18 ℃贮存2 d后对样品中SDS含量的影响,如图6所示。
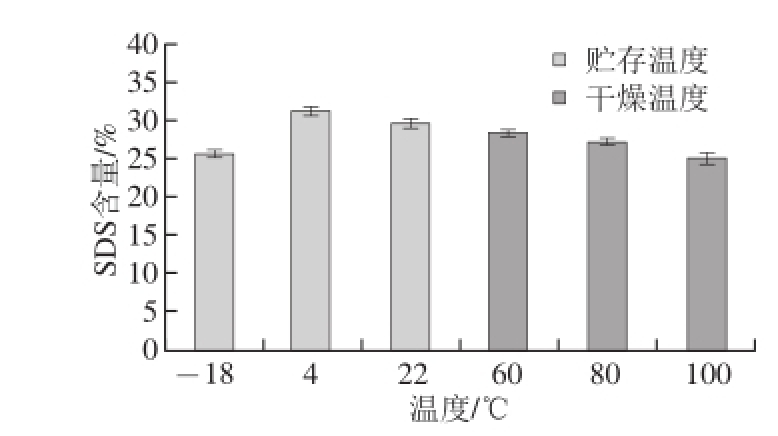
图6 贮存及干燥温度对SDS含量的影响
Fig. 6 Effect of cooling and drying temperature on the formation of SDS
贮存温度不同,样品中SDS含量会有明显的差异,4 ℃条件下贮存的样品中SDS含量高于室温和-18 ℃贮存的样品,达到31.09%,而-18 ℃条件下贮存的样品中SDS含量最低。Slade等 [26]阐述了骤冷温度对部分结晶聚合物中重结晶动力学的影响,晶体的晶核形成率在融化温度(T m)时为0,在玻璃化转变温度(T g)时为最大值,而晶核的繁殖增长率在T g时为0,在T m时为最大值。所以,得出晶体形成率(包括晶核的形成以及晶核的繁殖增长)在T=1/2(T m+T g)时为最大值。脱支淀粉在4 ℃条件下贮存可以促进晶核的形成,该温度接近T g,但不利于晶核的繁殖增长及晶体成熟,易于形成不完美的结晶。在室温时贮存,温度接近T,容易形成完美结晶。实验表明,4 ℃贮存有利于SDS的形成。将脱支处理后的淀粉,用60、80、100 ℃ 3 种温度进行干燥,从不同干燥温度对SDS含量的影响可以看出,在较低干燥温度的条件下,有利于SDS的形成,其中在60 ℃的干燥条件下,SDS的含量最高。
2.7 酶脱支处理对淀粉结晶结构的影响
由图7的X射线衍射图谱可以看出,酶处理样品的图谱上特征峰对应的2θ角度值依次为17.08°、19.68°、22.20°、23.74°,脱支并去除快速消化淀粉样品的图谱上特征峰对应的2θ角度值依次为17.04°、19.74°、22.08°、23.98°,其中2θ角为17.08°时出现最强峰,22.08°、23.98°时出现次强峰,2θ角为15°和18°的特征峰消失,说明淀粉经过脱支处理后,结晶结构发生了改变,由原来的A型结晶结构向B型结晶结构转化。酶处理样品和去除RDS的酶处理样品的相对结晶度分别为15.90%和15.19%,与原淀粉(16.25%)相比下降,这是由于淀粉糊化时颗粒破裂重组,分子间双螺旋结构被破坏,失去结晶结构;再经过脱支处理、冷却和贮存过程后,不同淀粉分子相互靠近,通过氢键结合,形成新的结晶结构。
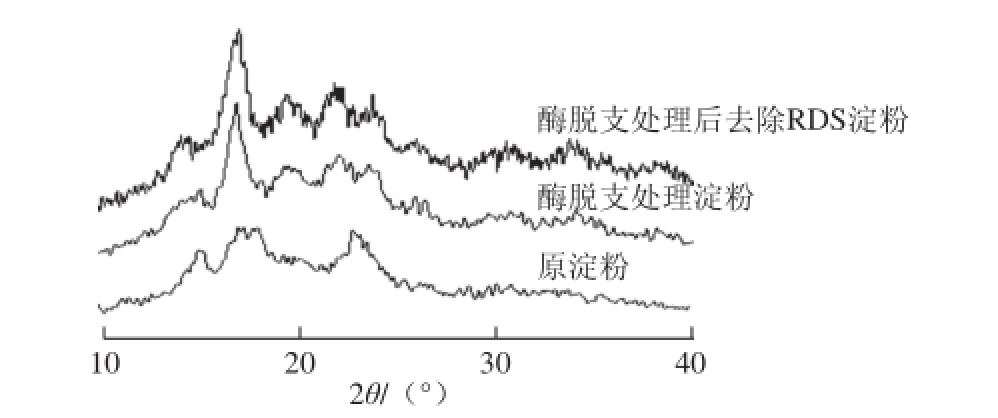
图7 酶脱支处理对淀粉结晶结构的影响
Fig. 7 Effect of debranching treatment on the crystal structure of starch
Gidley等 [27-28]研究表明,淀粉经脱支处理后,大量短直链淀粉形成,在后续缓慢冷却过程中形成有序结晶结构,从而抵抗酶解作用;Eerlingen等 [29]在对蜡质玉米淀粉糊化及老化过程研究表明,蒸煮处理后淀粉呈B型结晶结构,这与本研究结论一致。
从研究分析可以看出,淀粉的结晶度与SDS含量之间无线性关系,虽然玉米淀粉结晶度高于酶脱支处理过的淀粉,但SDS含量反而较低。SDS的形成与结晶的形成方式(数量与质量)有关系,并非单一由数量决定,尽管原淀粉结晶度较高,但SDS含量却低于酶脱支处理过的样品。缪铭 [20]对蜡质玉米淀粉蒸煮及酶脱支处理研究表明,处理后淀粉结晶度较原淀粉降低,但SDS含量提高,且-4 ℃及-20 ℃贮藏后淀粉皆呈B型结晶结构,该结果亦与本研究结论一致。
由以上实验结果可知,采用普鲁兰酶脱支淀粉,脱支度随时间延长而增大,8 h左右即达到70%左右的脱支度。采用高普鲁兰酶用量、短时间脱支处理,并于4 ℃贮存有利于SDS的形成。在普鲁兰酶用量60 U/g、处理温度57.5 ℃、pH 4.9的条件下,脱支处理8 h,然后经灭酶,迅速冷却,在4 ℃贮存及干燥后,SDS含量可达31.09%。酶处理样品和脱支并去除快速消化淀粉样品XRD图谱与原淀粉相比,在2θ角15°和18°处的特征峰消失,结晶结构由A型向B型转化。
参考文献:
[1] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classifcation and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition, 1992, 46(2): 33-50.
[2] SIEVERT D, POMERANZ Y. Enzyme-resistant starch. I. characterization and evaluation by enzymatic, thermo analytical, and microscopic methods[J]. Cereal Chemistry, 1989, 66(4): 342-347.
[3] MARLETT J A, LONGACRE M J. Comparison of in vitro and in vivo measures of resistant starch in selected grain products[J]. Cereal Chemistry, 1996, 73(1): 63-68.
[4] THOMPSON D B. Strategies for the manufacture of resistant starch[J]. Trends in Food Science & Technology, 2000, 11(7): 245-253. DOI:10.1016/S0924-2244(01)00005-X.
[5] FUENTES-ZARAGOZA E, RIQUELME-NAVARRETE M J, et al. Resistant starch as functional ingredient: a review[J]. Food Research International, 2010, 43(2): 931-942. DOI:10.1016/ j.foodres.2010.02.004.
[6] IYENGAR R, ZAKS A, GROSS A. Starch-derived, food grade, insoluble bulking agent. United States patent and trademark office: US07/440585[P/EL]. 1991-09-24. https://www.google.com/patents/ US5051271.
[7] HENLEY M, CHIU C W. Amylase resistant starch product from debranched high amylose starch: United States patent and trademark office: US07/997794[P]. 1995-04-25. https://www.google.com.ar/ patents/US5409542.
[8] ANDERSON A K, GURAYA H S, JAMES C, et al. Digestibility and pasting properties of rice starch heat-moisture treated at the melting temperature (T m)[J]. Starch-Stärke, 2002, 54(9): 401-409. DOI:10.1002/1521-379X(200209)54:9<401::AIDSTAR401>3.0.CO;2-Z.
[9] SHIN S I, KIM H J, HA H J, et al. Effect of hydrothermal treatment on formation and structural characteristics of slowly digestible non-pasted granular sweet potato starch[J]. Starch-Stärke, 2005, 57(9): 421-430. DOI:10.1002/star.200400377.
[10] GURAYA H S, JAMES C, CHAMPAGNE E T. Effect of enzyme concentration and storage temperature on the formation of slowly digestible starch from cooked debranched rice starch[J]. Starch-Stärke, 2001, 53(3/4): 131-139. DOI:10.1002/1521-379X(200104)53:3/4<131::AID-STAR131>3.0.CO;2-M.
[11] SHIN S I, CHOI H J, CHUNG K M, et al. Slowly digestible starch from debranched waxy sorghum starch: preparation and properties[J]. Cereal Chemistry, 2004, 81(3): 404-408. DOI:10.1094/ CCHEM.2004.81.3.404.
[12] WOLF B W, BAYER L L. Effects of chemical modification on in vitro rate and extent of food starch digestion: an attempt to discover a slowly digested starch[J]. Journal Agricltural Food Chemistry, 1999, 47(10): 4178-4183. DOI:10.1021/jf9813900.
[13] SHIN S I, LEE C J, KIM D I, et al. Formation, characterization, and glucose response in mice to rice starch with low digestibility produced by citric acid treatment[J]. Journal of Cereal Science, 2007, 45(1): 24-33. DOI:10.1016/j.jcs.2006.05.001.
[14] ZHONG H X, AO Z H, JANASWAMY S, et al. Development of a low glycemic maize starch: preparation and characterization[J]. Biomacromolecules, 2006, 7(4): 1162-1168. DOI:0.1021/bm050991e.
[15] HAN J A, BEMILLER J N. Preparation and physical characteristics of slowly digesting modifed food starches[J]. Carbohydrate Polymers, 2007, 67(3): 366-374. DOI:10.1016/j.carbpol.2006.06.011.
[16] GURAYA H S, JAMES C, CHAMPAGNE E T. Effect of enzyme concentration and storage temperature on the formation of slowly digestible starch from cooked debranched rice starch[J]. Starch-Stärke, 2001, 53(3/4): 131-139. DOI:10.1002/1521-379X(200104)53:3/4<131::AID-STAR131>3.0.CO;2-M.
[17] GURAYA H S, JAMES C, CHAMPAGNE E T. Effect of cooling and freezing on the digestibility of debranched rice starch and physical properties of the resulting material[J]. Starch-Stärke, 2001, 53(2): 64-74.
[18] LEHMANN U, ROBIN F. Slowly digestible starch-its structure and health implications: a review[J]. Trends in Food Science & Technology, 2007, 18(7): 346-355. DOI:10.1016/j.tifs.2007.02.009.
[19] 谷广烨. 缓慢消化淀粉的制备技术研究[D]. 哈尔滨: 哈尔滨商业大学, 2009: 21-44.
[20] 缪铭. 慢消化淀粉的特性及形成机理研究[D]. 无锡: 江南大学, 2009: 64-76.
[21] 赵凯, 谷广烨. 缓慢消化淀粉测定过程中的影响因素分析[J]. 食品科学, 2009, 30(4): 197-199. DOI:10.7506/spkx1002-6630-200914039.
[22] 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8): 534-536. DOI:124.205.222.100/Jwk_ spkx/CN/.
[23] BERNFIELD P. Enzymes of starch degradation and synthesis[J]. Advances in Enzymology and Related Areas of Molecular Biology, 1951, 12: 379-428. DOI:10.1002/9780470122570.ch7.
[24] CHANG J L, YANG K, SEUNG J C, et al. Slowly digestible starch from heat-moisture treated waxy potato starch: preparation, structural characteristics, and glucose response in mice[J]. Food Chemistry, 2012, 133(4): 1222-1229. DOI:10.1016/j.foodchem.2011.09.098.
[25] HIZUKURI S, TAKEDA Y, YASUDA M. Multibranched nature of amylose and the action of debranching enzymes[J]. Carbohydrate Research, 1981, 94(2): 205-213. DOI:10.1016/S0008-6215(00)80718-1.
[26] SLADE L, LEVINE H. Recent advances in starchretrogradation[M]. New York: Gordon and Breach, 1987: 387-430.
[27] GIDLEY M J, BULPIN P V. Crystallisation of malto-oligosaccharides as models of the crystalline forms of starch minimum chain-length requirement for the formation of double helices[J]. Carbohydrate Research, 1987, 161: 291-300. DOI:10.1016/S0008-6215(00)90086-7.
[28] GIDLEY M J, BULPIN P V. Aggregation of amylose in aqueous systems: the effect of chain length on the phase behavior and aggregation kinetics[J]. Macromolecules, 1989, 22: 341-346. DOI:10.1021/ma00191a062.
[29] EERLINGEN R C, JACOBS H, DELCOUR J A. Enzyme-resistant starch. Ⅴ. effect of retrogradation of waxy maize starch on enzyme susceptibility[J]. Cereal Chemistry, 1994, 71: 351-355.
Effect of Debranching Treatment on the Formation of Slowly Digestible Corn Starch
ZHAO Kai
1, LI Jun
1, GU Guangye
2
(1. Key Laboratory for Food Science and Engineering, Harbin University of Commerce, Harbin 150076, China; 2. Department of Ocean and Fisheries of Hainan Province, Haikou 570204, China)
Abstract:Purpose: To evaluate the effect of temperature, pH, enzyme dose, and cooling and drying conditions on the formation of slowly digestible starch (SDS) from gelatinized native corn starch by pullulanase debranching treatment. Methods: Pullulanase debranching for 8 h at 57.5 ℃ and pH 4.9 with an enzyme dose of 60 U/g, enzyme inactivation by boiling for 30 min, cooling at 4 ℃ and drying at 60 ℃ gave a product containing 31.09% SDS. The X-ray diffraction patterns of native starch, debranched starch, and debranched starch not containing readily digestible starch (RDS) indicated that the crystal structure of native starch changed from type A to B after debranching treatment. Conclusion: The enhanced production of SDS by pullulanase debranching may be due to the formation of a new crystal structure. SDS content is closely connected with the quantity and quality of crystal structures. The proposed conditions have a great potential in the industrial production of SDS.
Key words:corn starch; debranching treatment; pullulanase; slowly digestible starch (SDS)
DOI:10.7506/spkx1002-6630-201701029
中图分类号:TS231
文献标志码:A
文章编号:1002-6630(2017)01-0177-05
引文格式:
赵凯, 李君, 谷广烨. 酶脱支处理对玉米缓慢消化淀粉形成的影响[J]. 食品科学, 2017, 38(1): 177-181. DOI:10.7506/ spkx1002-6630-201701029. http://www.spkx.net.cn
ZHAO Kai, LI Jun, GU Guangye. Effect of debranching treatment on the formation of slowly digestible corn starch[J]. Food Science, 2017, 38(1): 177-181. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201701029. http://www.spkx.net.cn
收稿日期:2016-03-11
基金项目:哈尔滨市科技创新人才项目(2014RFXXJ068)
作者简介:赵凯(1974—),男,教授,博士,研究方向为淀粉化学与加工机理。E-mail:zhaok@hrbcu.edu.cn