添加复合缓冲剂对高精料饲喂泌乳奶山羊乳品质的改善及机制
李 林,曹 洋,权素玉,王换换,张源淑*
(南京农业大学动物医学院,农业部动物生理生化重点开放实验室,江苏 南京 210095)
摘 要:目的:探讨复合缓冲剂对高精料饲喂泌乳期奶山羊乳品质及机体健康状态的影响。方法:选取8 只体质量接近的泌乳中期萨能奶山羊,随机分为高精料组(high concentrate diet group,HG)(精粗质量比60∶40)和缓冲剂组(buffering concentrate group,BG)(高精料中添加复合缓冲剂)。实验共20 周,每周统计奶山羊产乳量,每周检测乳成分含量;至第19周,采集瘤胃液和血液样品,测定瘤胃液pH值及脂多糖(lipopolysaccharides,LPS)含量及血液中相关生化指标。结果:与HG相比,BG的奶山羊平均日产乳量、乳中乳蛋白率、乳脂率及乳糖含量都高于HG,其中乳脂率显著高于HG(P<0.05)。HG奶山羊瘤胃pH值一直低于BG,且出现了亚急性瘤胃酸中毒症状,其中瘤胃液中LPS含量极显著高于BG(P<0.01);生化指标检测结果显示:HG奶山羊血液中碱性磷酸酶、谷丙转氨酶、谷草转氨酶的活性都高于BG,且差异显著(P<0.05)。结论:给泌乳奶山羊高精料饲料中添加复合缓冲剂可以改善泌乳期奶山羊乳品质和产乳量,其机理可能与复合缓冲剂缓解高精料所致的瘤胃pH值下降、减少代谢异常产物的产生,从而改善机体的健康状态有关。
关键词:复合缓冲剂;泌乳奶山羊;亚急性瘤胃酸中毒;乳品质;机体健康
乳蛋白和乳脂肪含量是构成牛奶重要营养品质的主要物质基础,其作为牛乳中的主要营养成分,已成为了乳业核心竞争力的标志。近年来我国乳业得到了迅速发展,但牛乳普遍存在产乳量和乳品质低下的问题,而部分地区乳中蛋白质和脂肪的含量甚至低于国家标准。如何提高乳品质及产乳量,一直是乳业研究中的主要问题。羊乳因其脂肪颗粒为牛乳体积的三分之一,更利于人体吸收,并且长期饮用羊乳不会引起发胖,因此羊乳在国际界有享有“奶中之王”的美名,因此它的营养成分和品质安全也越来越受到人们的关注。
众所周知,目前我国由于耕地缺乏和草场不足,造成粗料缺乏或品质不好,所以生产上通常通过添加高精料饲料来满足泌乳期奶牛或奶山羊对高能量的需要,但其普遍存在的副作用是产乳量短期增加的同时乳品质下降。如Danscher
[1]、Commun
[2]等研究发现当给泌乳期奶牛长期饲喂高精料比例过大的饲料会引起机体健康受损,会造成瘤胃亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)以及脂多糖(lipopolysaccharides,LPS)含量的升高,同时引发许多疾病。SARA作为一种动物摄食后瘤胃液pH值小于5.8且持续4 h以上的代谢紊乱现象
[3],其主要是由于摄入过多的可快速发酵的碳水化合物,而瘤胃不能及时有效地中和产生的有机酸所致
[4-5]。贾媛媛等
[6]的研究同样发现当瘤胃pH值下降时,革兰氏阴性菌溶解,释放大量LPS,并且瘤胃上皮的屏障功能由于瘤胃高酸度及高渗透压导致瘤胃乳头破裂而受到损害,使瘤胃中LPS向外周血液渗透,引起机体健康受损。当通过实验诱导SARA时,瘤胃内的LPS含量会更高
[7-9]。另有研究报道,SARA会导致奶牛产乳量下降,脂代谢和乳蛋白代谢发生变化,最终导致乳脂和乳蛋白含量的变化
[10]。本实验室叶平生
[11]、姜雪元
[12]等的研究发现,当泌乳期奶山羊长期饲喂高精料日粮时,会导致瘤胃处于SARA状态,肝脏中氨基酸、脂肪酸等前体物分配与重分配发生变化,乳蛋白、乳脂肪含量降低,乳品质下降。总的研究结果显示:高精料日粮饲喂会导致奶牛SARA、肝脏处于氧化应激状态、物质代谢变化、乳合成的前体物消耗过多,导致乳蛋白乳脂含量的降低。即瘤胃pH值升高、异常产物LPS等过多释放是导致高精料饲喂致乳产品品质下降的主要原因之一。改善瘤胃酸碱度,可能是缓解高精料饲喂致乳品质下降的途径之一。
缓冲剂是一类能够增强溶液酸碱缓冲能力的物质,近年来已用于防止反刍动物瘤胃酸中毒以及提高反刍动物生产性能等方面的研究。目前,国内外常用于反刍动物的缓冲剂有碳酸氢钠、氧化镁、乙酸钠、丁酸钠、碳酸钙等。其中氧化镁和乙酸钠不仅可以改善反刍动物对饲料的采食量,提高产乳量,同时也可以增加瘤胃中乙酸浓度,提高乙酸/丙酸比例,进而提高乳脂率
[13]。碳酸氢钠可以增加瘤胃的缓冲容量防止瘤胃酸中毒
[14]。而丁酸钠可以增加肠道有益菌的数量,维持胃肠道内有益生物菌群,起到增强免疫的作用的同时也会生成乳脂前体物
[15]。孟军等
[16]以第3或第4胎奶牛为实验对象,当把碳酸氢钠、氧化镁和乙酸钠3 种缓冲剂混合添加到高精饲料中,与对照组相比明显提高了奶牛的产乳量,并且乳脂率提高了16.37%。目前,缓冲剂对反刍动物产乳量及乳成分方面的研究多集中在奶牛方面,而对奶山羊方面的研究报道相对较少。本实验以泌乳中期萨能奶山羊为研究对象,在日粮精粗质量比均为60∶40的饲喂条件下,通过添加缓冲剂(碳酸氢钠、氧化镁、乙酸钠、丁酸钠),比较研究奶山羊产乳量和乳成分、瘤胃pH值、LPS含量以及血液生化指标等的变化,探讨缓冲剂缓解瘤胃酸碱度后对乳品质的改善作用及在乳品质调控方面的作用,为改善我国目前高精料饲喂情况下乳品质下降的研究提供资料。
1 材料与方法
1.1 动物与试剂
泌乳中期萨能奶山羊8 只,体质量为(38±8)kg。2014年3月29日购自西北农林科技大学试验农牧场。
碳酸氢钠、氧化镁、乙酸钠、丁酸钠 南京建成生物科技有限公司。
1.2 仪器与设备
LPS酶联免疫检测试剂盒 上海朗顿生物技术有限公司;Z9全自动牛奶分析仪 德国Scope公司;RT-6000型酶标仪 深圳雷杜生命科学股份有限公司;GHP-9080型隔水式恒温培养箱 上海一恒科学仪器有限公司;Mikro-22R型高速冷冻离心机 德国海蒂斯科学仪器公司;pH计 上海精密科学仪器有限公司;AU5800全自动生化分析仪 美国贝克曼库尔特公司。
1.3 方法
1.3.1 动物分组和饲喂
8 只泌乳中期萨能奶山羊适应1 周后,随机分为缓冲剂组和高精料组。两组动物饲喂同样的实验基础日粮,精粗质量比为60∶40,配方见表1。缓冲剂组在基础日粮的基础上添加复合缓冲剂(碳酸氢钠、氧化镁、乙酸钠、丁酸钠混合)。实验从2014年5月19日—2014年10月8日,周期为20 周。所有动物均饲养于南京农业大学农业部动物生理生化重点实验室实验动物房,单笼饲养,精料、草料分开饲喂,期间自由饮水,每日饲喂2 次同时挤奶(8∶00和18∶00)。并记录每日产乳量。
表 1 实验日粮与其营养组成
Table 1 Experimental diet and its nutritional composition

注:a. 每千克日粮提供VA 6 000 IU、VD 2 500 IU、VE 80 mg、铜6.25 mg、铁62.5 mg、锌62.5 mg、锰50 mg、碘0.125 mg、钼0.125 mg;b. 营养水平均为饲粮计算值。
日粮组成含量/%营养组成
b羊草27.00净能量/(MJ/kg)6.71苜蓿青贮13.00粗蛋白/%16.92玉米 23.24中性洗涤纤维/%31.45麸皮20.77酸性洗涤纤维/%17.56豆粕13.67钙/%0.89石粉1.42磷/% 0.46食盐0.30预混料
a0.60合计100.00
1.3.2 样品采集及指标测定
1.3.2.1 乳样品采集及检测
实验期间每天挤奶2 次,分别于8∶00和18∶00,记录日产乳量。每周按体积比1∶1配制成全天乳样,送至于南京农业大学动物科技学院实验中心进行乳成分的检测。
1.3.2.2 血液样品采集及检测
第20周时,将宰杀之前的奶山羊麻醉后采集其颈静脉血液于肝素钠采血管中,3 500 r/min离心15min,取上清液。将采集的颈静脉血浆样品送至南京市中西医结合医院血液科用全自动生化分析仪检测相关血液学指标,包括葡萄糖、尿酸、尿素、肌酐、总胆红素、甘油三酯、超敏C反应蛋白、白蛋白、球蛋白、总蛋白含量和碱性磷酸酶、谷丙转氨酶、谷草转氨酶、肌酸激酶、乳酸脱氢酶活力等指标。
1.3.2.3 瘤胃液pH值及LPS含量的测定
第16周进行瘤胃瘘手术(手术过程略),并于第19周在饲喂后0、2、4、6、8、10 h分别采集瘤胃液(经孔径为0.15 mm的尼龙绢过滤),同时测定pH值。第19周再次采集瘤胃液。将瘤胃液样品用样品稀释液稀释5 倍后,按LPS酶联免疫检测试剂盒说明书加样,以空白孔调零,450 nm波长处依次测定各孔的光密度值(OD),求出瘤胃液中LPS的含量(EU为内毒素活性单位1EU/mL=0.1ng/mL)。
1.4 数据统计分析
采用SPSS 16.0软件进行单因素方差分析。结果以
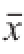 ±s表示,组间差异用t检验,判断有无显著性差异。
±s表示,组间差异用t检验,判断有无显著性差异。
2 结果与分析
2.1 泌乳奶山羊乳品质分析
表 2 泌乳期山羊日产乳量及乳成分分析(n=4)
Table 2 Milk production and milk composition of lactating goats (n= 4)

注:*.组间差异显著(P<0.05)。下同。
组别产乳量/kg乳脂率/%乳蛋白率/%乳糖含量/%缓冲剂组1.10±0.012.95±0.07*4.10±0.10*3.30±0.10高精料组1.07±0.012.77±0.103.80±0.063.02±0.08
由表2可知,缓冲剂组奶山羊在0~14 周的平均日产乳量和乳蛋白率、乳脂率及乳糖含量均高于高精料组,且乳脂率和乳蛋白率显著高于高精料组(P<0.05),可以看出通过添加缓冲剂后,乳中的关键营养成分在不同程度上都高于高精料组。
2.2 泌乳奶山羊瘤胃液的pH值及LPS含量
表 3 不同时间点瘤胃液pH值(n=4)
Table 3 Rumen fluid pH at different postprandial time points (n = 4)
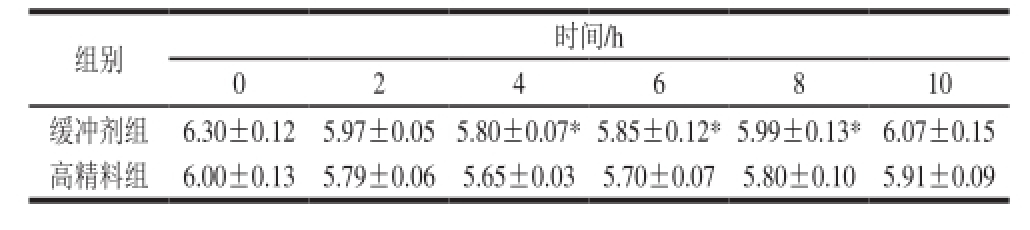
组别时间/h 0246810缓冲剂组6.30±0.125.97±0.055.80±0.07*5.85±0.12*5.99±0.13*6.07±0.15高精料组6.00±0.135.79±0.065.65±0.035.70±0.075.80±0.105.91±0.09
由表3可知,通过检测采食后0、2、4、6、8、10 h瘤胃液的pH值,发现pH值变化的总趋势都是先降低后升高,即采食后,pH值呈下降趋势,0~4 h后pH值下降至最低值,随后由于瘤胃本身具有较强的缓冲能力,pH值又逐渐上升至初始水平。但缓冲剂组奶山羊瘤胃液pH值均高于高精料组,且4~8 h差异显著(P<0.05)。以每日瘤胃pH值低于5.8的时间不少于4 h为SARA来看
[3],高精料组的奶山羊在采食过后瘤胃液的pH值在2 h后开始出现SARA现象。而添加复合缓冲剂后,瘤胃液的pH值明显上升,在4 h的时候瘤胃液pH值最低,但大于5.8。整个测试周期中,高精料组瘤胃pH始终小于缓冲剂组,并且处于pH<5.8的时间段长达6 h。添加缓冲剂缓解了高精料所致的瘤胃pH值的下降。
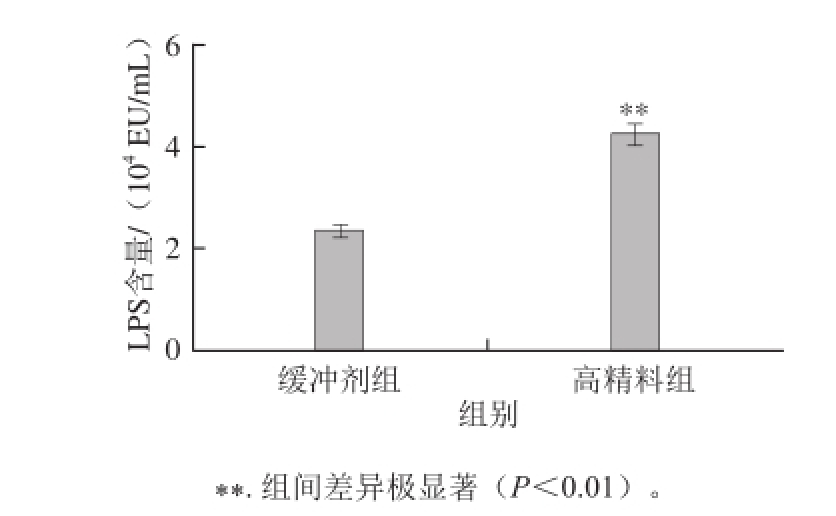
图1 泌乳期奶山羊瘤胃液LPS含量分析(n =4)
Fig. 1 LPS content in the rumen fuid of lactating goats (n = 4)
通过检测2 组奶山羊瘤胃液中LPS的含量,结果由图1可知,高精料组瘤胃液中LPS含量显著高于缓冲剂组,且差异极显著(P<0.01)。
2.3 泌乳奶山羊血液生化指标分析
表 4 血液生化指标(n=4)
Table 4 Serum biochemical indices (n= 4)
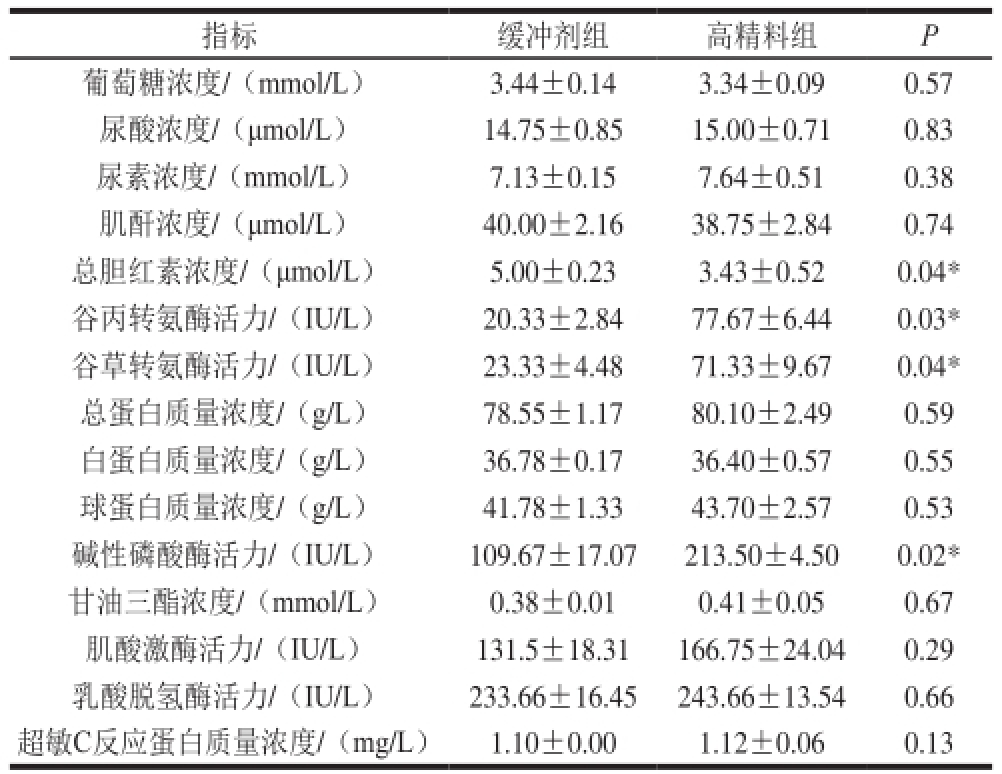
指标缓冲剂组高精料组P葡萄糖浓度/(mmol/L)3.44±0.143.34±0.090.57尿酸浓度/(μmol/L) 14.75±0.8515.00±0.710.83尿素浓度/(mmol/L)7.13±0.157.64±0.510.38肌酐浓度/(μmol/L)40.00±2.1638.75±2.840.74总胆红素浓度/(μmol/L)5.00±0.233.43±0.520.04*谷丙转氨酶活力/(IU/L)20.33±2.8477.67±6.440.03*谷草转氨酶活力/(IU/L)23.33±4.4871.33±9.670.04*总蛋白质量浓度/(g/L)78.55±1.1780.10±2.490.59白蛋白质量浓度/(g/L)36.78±0.1736.40±0.570.55球蛋白质量浓度/(g/L)41.78±1.3343.70±2.570.53碱性磷酸酶活力/(IU/L)109.67±17.07213.50±4.500.02*甘油三酯浓度/(mmol/L)0.38±0.010.41±0.050.67肌酸激酶活力/(IU/L)131.5±18.31166.75±24.040.29乳酸脱氢酶活力/(IU/L)233.66±16.45243.66±13.540.66超敏C反应蛋白质量浓度/(mg/L)1.10±0.001.12±0.060.13
由表4可知,高精料组奶山羊血液中谷丙转氨酶、谷草转氨酶、碱性磷酸酶活力都高于缓冲剂组,且差异显著(P<0.05)。而缓冲剂组颈静脉血液总胆红素浓度显著高于高精料组(P<0.05),其他指标两组间均无明显差异。
3 讨 论
反刍动物具有一套复杂的酸碱平衡调节系统,通过这一系统可将瘤胃pH值维持在5.5~7.0之间,使瘤胃处于一个最佳状态,如果瘤胃pH值不当,饲料干物质进食量下降,酸中毒发生,微生物蛋白产量和能量产生量下降。在饲料中加入缓冲剂可以有效控制瘤胃pH值,有助于提高采食量、增加产乳量和维持正常乳成分。缓冲剂作为一种能够增强溶液酸碱缓冲能力的物质,目前已经在防止反刍动物瘤胃酸中毒以及提高反刍动物生产性能等方面做了相应研究。Oktay等
[17]通过向泌乳期奶牛饲料中添加碳酸氢钠、氧化镁,发现其产乳量有明显提高,但乳成分并没有明显变化。Montano-Gomez等
[18]通过向荷斯坦奶牛饲料中分别添加0.2%和0.4%的氧化镁。通过对比发现,用添加0.4%氧化镁的饲料喂养奶牛,其产乳量以及乳脂肪含量与添加了0.2%氧化镁的奶牛相比,都有显著性提高,但其乳蛋白含量却有下降的趋势。同样,孙涛等
[19]通过向泌乳期荷斯坦奶牛的基础日粮中添加氯化钾、碳酸氢钠、乙酸钠、氧化镁组成的复合缓冲剂,发现产乳量、乳蛋白率、乳脂率以及乳糖含量都有不同程度的提高。本研究发现,高精料组奶山羊由于长期饲喂精粗比过大的日粮,瘤胃pH值下降并且出现了SARA状态,导致其产乳量及乳品质下降,与Khafipour等
[20]的研究结果一致。而通过添加复合缓冲剂,缓冲剂组的产乳量、乳蛋白率、乳脂率以及乳糖含量都在不同程度上高于高精料组,其中乳脂率和乳蛋白率显著高于高精料组,其结果与孙涛等
[19]的结果相符,提示缓冲剂对提高SARA状态的泌乳期奶山羊乳品质具有一定作用。
瘤胃液pH值是反映瘤胃发酵状况的基本指标,也是反映反刍动物瘤胃性能最主要的指标之一,维持正常范围pH值是保证瘤胃正常发酵的前提。一般反刍动物瘤胃pH值受食物组成、胃内分泌物等因素影响,其中饲料精粗比不同影响最为明显。一般而言,当饲料中精料比例过多时,可溶性碳水化合物含量升高,从而被瘤胃内微生物快速降解,产生大量挥发性脂肪酸,可导致瘤胃pH值降低
[21]。此外,也有人研究发现,精料颗粒较小,会导致动物反刍次数以及分泌唾液量减少,也会导致pH值下降
[22]。目前国际上一般认为当瘤胃中pH值小于5.8、且超过4 h时,可判定瘤胃处于SARA状态
[23]。在SARA状态下,瘤胃会产生许多异常代谢产物,其中LPS作为革兰阴性细菌胞壁内毒素的成分,可诱导肿瘤坏死因子等大量内源性细胞因子的释放
[24]。通过损伤瘤胃上皮细胞,进而通过瘤胃壁迁移到血液中,导致全身性免疫反应。所以保持pH值相对稳定状态,维持理想的瘤胃发酵环境,从而使微生物在较适宜的范围之内活动是极其重要的。
本实验研究发现,高精料组奶山羊长期饲喂高精料日粮发生了SARA。其瘤胃液中LPS含量极显著升高,提示高精料组奶山羊在SARA状态下,其瘤胃异常并伴随LPS等异常产物的释放,与Kleen 等
[25]的研究结果一致。添加复合缓冲剂后,未出现SARA,同时释放的LPS明显降低。说明复合缓冲剂可以缓解高精料饲喂导致的pH值降低以及减少了LPS的释放,起到了对瘤胃的保护作用。
通常动物机体在正常情况下,细胞内的酶由于细胞膜的屏障作用而不容易被逸出,仅由于细胞的衰老更新破坏而释放到血液当中,而当细胞受损时,细胞膜的通透性增大进而使酶释放进入血液的速度升高,从而导致血清中酶的含量升高
[26]。谷丙转氨酶、谷草转氨酶作为动物体内最重要的两种转氨酶类,主要分布于肝脏、肾脏等组织中,并且在一定程度上可以反映动物肝脏功能的好坏,在正常血清中含量都较低。当肝脏组织细胞受损时,会使酶活力升高
[27]。碱性磷酸酶可用于判断机体疾病的检测。例如,当肝细胞受到损伤时,会通过过度制造碱性磷酸酶,经淋巴道和肝窦进入血液,同时肝内胆道胆汁排泄障碍,反流入血而引起血清碱性磷酸酶升高
[28]。本研究发现,高精料组中谷丙转氨酶、谷草转氨酶、碱性磷酸酶活性都显著高于缓冲剂组,这可能与SARA导致的LPS释放的增多,使机体免疫应激能力下降,肝脏等组织器官受到损伤有关。而通过添加复合缓冲剂,尤其是当中的丁酸钠可起到对机体免疫保护的作用,并对机体组织器官的一些炎症反应状态起到保护作用,从而增强了机体的抵抗能力,但具体机制有待进一步研究。
综上,本研究结果发现,通过给泌乳期山羊高精料饲喂精料的基础上添加复合缓冲剂,缓解了瘤胃pH值的下降、机体的SARA状态,并减少了瘤胃中LPS的释放,从而使机体肝脏等器官减少异常产物谷丙转氨酶、谷草转氨酶、碱性磷酸酶的释放,提示在改善泌乳动物机体健康状态的同时,对产乳量以及乳中蛋白质含量、脂肪含量和乳糖含量的提高具有一定作用。
参考文献:
[1] DANSCHER A, LI S, ANDERSEN P, et al. Indicators of induced subacute ruminal acidosis (SARA) in Danish Holstein cows[J]. Acta Veterinaria Scandinavica, 2015, 57(1): 39. DOI:10.1186/s13028-015-0128-9.
[2] COMMUN L, MIALON M M, MARTIN C, et al. Risk of subacute ruminal acidosis in sheep with separateaccess to forage and concentrate[J]. Journal of Animal Science, 2009, 87(10): 3372-3379. DOI:10.2527/jas.2009-1968.
[3] BEAUCHEMIN K A, YANG W Z, RODE L M. Effects of particle size of alfalfabaseddairy cow diets on chewing activity, ruminal fermentation, and milkproduction[J]. Journal of Animal Science, 2003, 86(2): 630-643. DOI:10.3168/jds.S0022-0302(03)73641-8.
[4] DONG G, LIU S, WU Y, et al. Diet-induced bacterial immunogens in the gastrointestinal tract of dairy cows: impacts on immunity and metabolism[J]. Acta Veterinaria Scandinavica, 2011, 53: 48. DOI:10.1186/1751-0147-53-48.
[5] RUSTOMO B, AIZAHAL O, ODONGO N E, et al. Effects of rumen acid load from feed and forage particle size on ruminal pH and dry matter intake in the lactating dairy cow[J]. Journal of Dairy Science, 2006, 89(12): 4758-4768. DOI:10.3168/jds.S0022-0302(06)72525-5.
[6] 贾媛媛, 王绍庆, 常广军, 等. 高精料诱导的SARA对泌乳期山羊血液和瘤胃液中皮质醇的影响[J]. 草业学报, 2012, 21(4): 259-266. DOI:10.11686/cyxb20120431.
[7] GOZHO G N, PLAIZIER J C, KRAUSE D O, et al. Subacute ruminal acidosis induces ruminal lipopolysaccharide endotoxin release and triggers an infammatory response[J]. Journal of Dairy Science, 2005, 88(4): 1399-1403. DOI:10.3168/jds.S0022-0302(05)72807-1.
[8] GOZHO G N, KRAUSE D O, PLAIZIER J C. Rumen lipopolysaccharide and inflammation during grain adaptation and subacute ruminal acidosis in steers[J]. Journal of Dairy Science, 2006, 89(11): 4404-4413. DOI:10.3168/jds.S0022-0302(06)72487-0.
[9] NAGARAJA T G, TITGEMEYER E C. Ruminal acidosis in beef cattle: the current microbiological and nutritional outlook[J]. Journal of Dairy Science, 2007, 90(Suppl 1): 17-38. DOI:10.3168/jds.2006-478.
[10] PLAIZER J C, KRAUSE D O, GOZHO G N, et al. Subacute ruminal acidosis in dairy cows: the physiological causers, incidence and consequences[J]. Veterinary Journal, 2008, 176(1): 21-31. DOI:10.1016/j.tvjl.2007.12.016.
[11] 叶平生, 姜雪元, 张树坤, 等. 高精料对泌乳期山羊肝脏氨基酸分配与重分配及乳蛋白的影响[J]. 草业学报, 2013, 22(6): 182-189. DOI:10.11686/cyxb20130623.
[12] 姜雪元, 张树坤, 倪迎冬, 等. 不同精粗饲料对泌乳中期山羊氨基酸的代谢流向及乳蛋白含量的影响[J]. 草业学报, 2012, 21(6): 258-265. DOI:10.11686/cyxb20120333.
[13] 薛玉华. 正确应用缓冲剂奶牛安全高效益[J]. 江西饲料, 2013(5): 23-25. DOI:10.3969/j.issn.1008-6137.2013.05.008.
[14] 钟焰, 王冲. 碳酸氢钠与现代畜禽离子代谢、生产[J]. 中国牛业科学, 2014, 40(4): 53-54. DOI:10.3969/j.issn.1001-9111.2014.04.015.
[15] ZHANG W H, JIANG Y, ZHU Q F, et al. Sodium butyrate maintains growth performance by regulating the immune response in broiler chickens[J]. British Poultry Science, 2011, 52(3): 292-301. DOI:10.1080/00071668.2011.578121.
[16] 孟军, 王焕勤, 曹杰. 营养型复合缓冲剂对奶牛泌乳性能的影响[J].宁夏农林科技, 1999(3): 48-49 .
[17] OKTAY K, SUPHI D, KARSLI M A, et al. Effects of sodium bicarbonate, magnesium oxide and dried sugar beet pulp in diets of dairy cows on milk yield, milk composition and rumen fuid and some blood parameters[J]. Journal of Animal and Veterinary Advances, 2010, 9(11): 1570-1574. DOI:10.3923/javaa.2010.1570.1574
[18] MONTANO-GOMEZ M F, SALINAS-CHAVIRA J, CALDERONCORTES J F, et al. Effect of magnesium oxide (MgO) addition in diets for lactating holstein cows[J]. Revista Científica, 2010, 20(3): 300-305.
[19] 孙涛, 李建国, 赵晓静, 等. 不同预混料及缓冲剂对奶牛泌乳性能的影响[J]. 中国饲料, 2007(1): 22-25. DOI:10.3969/ j.issn.1004-3314.2007.01.010.
[20] KHAFIPOUR E, KRAUSR D O, PLAIZIER J C. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J]. Journal of Dairy Science, 2009, 92(3): 1060-1070.
[21] KRAUSE K M, OETZEL G R. Inducing subancute ruminal acidosis in lacating dairy cows[J]. Journal of Dairy Science, 2005, 88(10): 3633-3639. DOI:10.3168/jds.S0022-0302(05)73048-4.
[22] 吴秋珏, 郝正里, 李发弟, 等. 饲粮结构与非结构性碳水化合物比例对绵羊瘤胃代谢参数的影响[J]. 畜牧兽医学报, 2011, 42(2): 196-202.
[23] YANG W Z, BEAUCHEMIN K A. Effect of physically effective fber on chewing activity and ruminal pH of dairy cows fed diets based on barley silage[J]. Journal of Dairy Science, 2006, 89(1): 217-228. DOI:10.3168/jds.S0022-0302(06)72086-0.
[24] SOHN M J, HUR G M, BYUN H S, et al. Cyclo (dehydrohistidyl-L-tryptophyl) inhibits nitric oxide production by preventing the dimerization of inducible nitric oxide synthase[J]. Biochem Pharmacol, 2008, 75(4): 923-930. DOI:10.1016/j.bcp.2007.10.021.
[25] KLEEN J L, HOOIJER G A, REHAGE J, et al. Subacute ruminal acidosis (SARA): a review[J]. Journal of Veterinary Medicine Series A, 2003, 50(8): 406-414. DOI:10.1046/j.1439-0442.2003.00569.x.
[26] 武秀香, 施雪奎, 吴海涛, 等. 热应激条件下不同黄牛群体血液生化指标变化规律分析[J]. 家畜生态学报, 2011, 32(2): 25-28. DOI:10.3969/j.issn.1673-1182.2011.02.007.
[27] 王俊东, 刘宗平. 兽医临床诊断学[M]. 北京: 中国农业出版社, 2004: 237-239.
[28] FEMANDEZ N J. KIDNEY B A. Alkaline phosphatase: beyond the liver[J]. Veterinary Clinical Pathology, 2007, 34(9): 223-233. DOI:10.1111/j.1939-165X.2007.tb00216.x.
Improvement and Underlying Mechanism of Milk Quality of Lactating Goats Fed High Concentrate Diet by Dietary Supplementation of Composite Buffer
LI Lin, CAO Yang, QUAN Suyu, WANG Huanhuan, ZHANG Yuanshu*
(Key Laboratory of Animal Physiology and Biochemistry, Ministry of Agriculture, College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Objective: To investigate the effect of dietary supplementation of composite buffer on the milk quality and health status of lactating goats fed a high concentrate diet. Methods: Eight mid-lactating Saanen dairy goats with similar body weights were randomly divided into high concentrate diet group (HG, concentr ate:forage ratio = 60:40) and buffering agent group (BG, fed high concentrate diet added with). The experiment lasted for 20 weeks. The milk production and milk composition were measured weekly during the period, and on week 19, rumen fluid and blood samples were collected for the measurement of rumen fuid pH and lipopolysaccharide (lipopolysaccharides, LPS) content as well as blood biochemical indices. Results: The average daily milk yield, and protein, fat and lactose percentages of dairy goats from the BG were higher than those of the HG, especially milk fat percentage (P < 0.05). The rumen fluid pH of dairy goats in the HG was persistently lower than that of the BG and the occurrence of subacute ruminal acidosis was found in the former. Additionally, the LPS content of the rumen fluid of dairy goats in the HG was significantly higher than that in the BG (P < 0.01). Biochemical analysis showed that the activities of alkaline phosphatase and alanine aminotransferase and aspartate transaminase in the blood of HG goats were significantly higher than those in BG goats (P < 0.05). Conclusion: Dietary supplementation of composite buffer could improve the milk quality and yield of lactating goats fed a high concentrate diet. The mechanism involved may be due to decreased rumen fuid pH, reduced production of abnormal metabolites and consequent improved health status in response to dietary composite buffer.
Key words:composite buffer; lactating goats; subacute ruminal acidosis; milk quality; body health
DOI:10.7506/spkx1002-6630-201701031
中图分类号:中图分类号:S827.5 文献标志码:A 文章编号:1002-6630(2017)01-0188-05
收稿日期:2016-01-07
基金项目:国家重点基础研究发展计划(973计划)项目(2011CB100802)
作者简介:李林(1991—),男,硕士研究生,研究方向为动物机能生物化学。E-mail:247118532@qq.com
*通信作者:张源淑(1962—),女,教授,博士,研究方向为动物机能生物化学。E-mail:zhangyuanshu@njau.edu.cn
引文格式:
李林, 曹洋, 权素玉, 等. 添加复合缓冲剂对高精料饲喂泌乳奶山羊乳品质的改善及机制[J]. 食品科学, 2017, 38(1): 188-192. DOI:10.7506/spkx1002-6630-201701031. http://www.spkx.net.cn
LI Lin, CAO Yang, QUAN Suyu, et al. Improvement and underlying mechanism of milk quality of lactating goats fed high concentrate diet by dietary supplementation of composite buffer[J]. Food Science, 2017, 38(1): 188-192. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201701031. http://www.spkx.net.cn

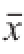 ±s表示,组间差异用t检验,判断有无显著性差异。
±s表示,组间差异用t检验,判断有无显著性差异。



