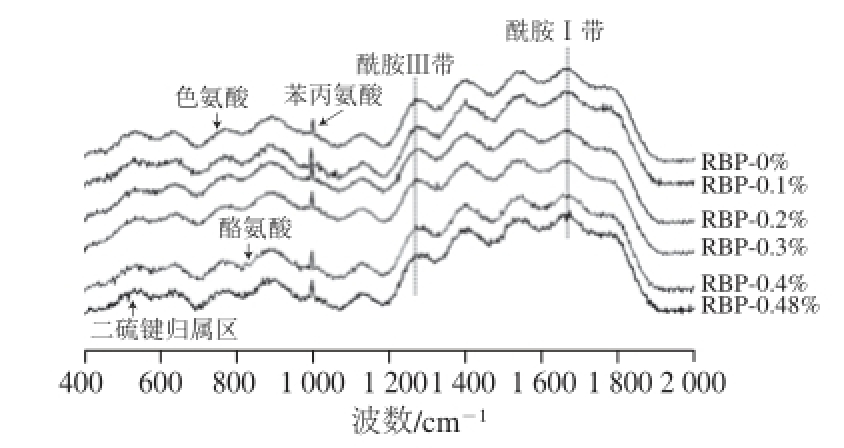
图1 荞麦多酚对米糠结构影响的拉曼光谱分析图
Fig.1 Raman analysis of the effect of buckwheat polyphenols on the structure of rice bran proteins
谢凤英 1,马 岩 2,王晓君 1,张秀玲 1,*,徐 速 1,陈少华 1
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.沈阳师范大学实验教学中心,辽宁 沈阳 110034)
摘 要:利用拉曼光谱研究荞麦多酚对米糠蛋白的影响。结果表明:随着荞麦多酚添加量增加,米糠蛋白结构变化规律为α-螺旋结构含量逐渐降低,β-折叠结构含量呈现先增加后降低的变化趋势,β-转角结构含量呈先降低后增加的变化趋势,而无规则卷曲结构的含量逐渐增大;酪氨酸及色氨酸先趋于“暴露式”而后转为“包埋态”,而荞麦多酚的添加使米糠蛋白二硫键由gauche-gauche-trans构型和trans-gauche-trans构型逐渐转变为gauche-gauche-gauche构型。因此,荞麦多酚与米糠蛋白的交互作用可部分破坏米糠蛋白分子间二硫键,降低米糠蛋白分子间作用,增强米糠蛋白结构的稳定性。
关键词:拉曼光谱;荞麦多酚;米糠蛋白;结构
荞麦作为杂粮作物之一,不仅营养丰富,还含有抗氧化、降血糖、抗肿瘤等多种药理作用的多酚类物质 [1-3]。荞麦中多酚类物质分布于整个籽粒之中,主要为芦丁、山奈酸、槲皮素、槲皮素-3-芸香糖葡萄糖苷等 [4-5]。杂粮多酚提取物抗氧化活性的研究表明,杂粮作物的种子中既含有果蔬中非营养成分——多酚化合物,而且还可以对果蔬中这些成分的不足和缺陷进行补充 [6]。因此,荞麦作为功能性食品开发的重要谷物来源,其提取物抗氧化作用的研究越来越受到重视,并成为研究的热点。
近年来,多酚与植物蛋白之间相互作用的研究发现,多酚可以通过氢键、疏水交互作用与氨基酸侧链形成多酚和蛋白质复合物,致使蛋白空间结构及溶解度、乳化性等功能特性发生改变 [7-9]。例如,茶多酚与酪蛋白形成复合物时,由于茶多酚的存在酪蛋白二级结构中的α-螺旋和β-折叠均会有所减少,进而改变了酪蛋白空间结构。β-乳球蛋白与表没食子儿茶素共存时,由于范德华力、氢键等分子间作用力的存在,β-乳球蛋白天然构象会发生一定程度的扭转变化 [10-12]。
米糠蛋白因受米糠油氧化诱导作用,引起蛋白质部分结构折叠、功能性降低。本研究基于拉曼光谱无损、快速、所需样品量少、无需制备试样、无需消耗化学试剂的特点,探讨荞麦多酚对米糠蛋白结构影响规律,进而探明多酚对蛋白质功能性质的影响,实现谷物多酚提取物在食品体系中的稳态化利用。
1.1 材料与试剂
荞麦 黑龙江牡丹江市深森山珍食品有限公司;米糠蛋白 黑龙江东方粮油集团。两种原材料粉碎后过60 目筛,低温冰箱保存备用;其他试剂均为分析纯。
1.2 仪器与设备
LabRAM XploRA Plus拉曼光谱仪 法国JY公司;FW 400A型高速万能粉碎机 常州市伟嘉仪器制造有限公司;HWJB-2100AT型恒温磁力搅拌器 河南中良科学仪器有限公司;SC-3614型离心机 安徽中科中佳科学仪器有限公司;R-1005旋转蒸发仪 郑州长城科工贸有限公司;FA 2004型电子天平 上海衡平仪器仪表厂。
1.3 方法
1.3.1 荞麦多酚提取物制备
准确称取10.0 g荞麦粉于烧杯中,溶于65%乙醇溶液中,其料液比为1∶12(m/V),在56 ℃条件下浸提6 h,离心,取上清液后浓缩定容至25 mL容量瓶中,即为荞麦多酚提取液 [13]。荞麦多酚含量采用福林-酚法 [14-15]进行测定,其值为0.48%。通过水溶液调配控制提取液中荞麦多酚含量为0.1%、0.2%、0.3%、0.4%。
1.3.2 荞麦多酚与米糠蛋白混合液的制备
取5 种不同含量荞麦多酚提取液与5%的米糠蛋白溶液于烧杯中充分混匀,静置30 min后待测。将添加有不同荞麦多酚含量的米糠蛋白混合液分别命名为RBP-0%(空白样)、RBP-0.1%、RBP-0.2%、RBP-0.3%、RBP-0.4%、RBP-0.48%。
1.3.3 拉曼光谱分析
荞麦多酚-米糠蛋白样品通过拉曼光谱仪进行测定。其光谱条件为:激发波长:785 nm;发射功率:300 mW;光谱测定范围为600~1 800 cm -1。所测样品的拉曼谱图经信号累加计算均值后,绘图输出。其中,拉曼图谱基线校正、各峰归属采用Labspec 4.0软件处理;拉曼峰强度变化以苯丙氨酸的1 004 cm -1(内标)为依据进行归一化处理;利用Origin 8.5软件进行谱图的拟合。1.4 数据处理
每组实验都进行3 次平行实验,并将实验数据进行误差分析。采用统计学软件SPSS 18对实验数据进行显著性分析。
2.1 荞麦多酚对米糠蛋白结构影响的拉曼光谱分析结果

图1 荞麦多酚对米糠结构影响的拉曼光谱分析图
Fig.1 Raman analysis of the effect of buckwheat polyphenols on the structure of rice bran proteins
添加不同含量荞麦多酚的米糠蛋白拉曼光谱图如图1所示,谱图中对应的谱峰及谱峰指认见表1。在拉曼光谱测定中,谱线强度与散射中心(化学键和基团)数目为正比例关系 [16-17]。因此,样品谱线强度变化可作为化学键或基团改变程度判定的依据,谱线强度变小意味着对应的基团或化学键受到损伤,谱线若发生偏移意味着其所对应的化学键或基团在样品处理中发生了改变。
表1 米糠蛋白拉曼光谱的特征峰指认表
Table1 Raman band assignment of rice pran proteins
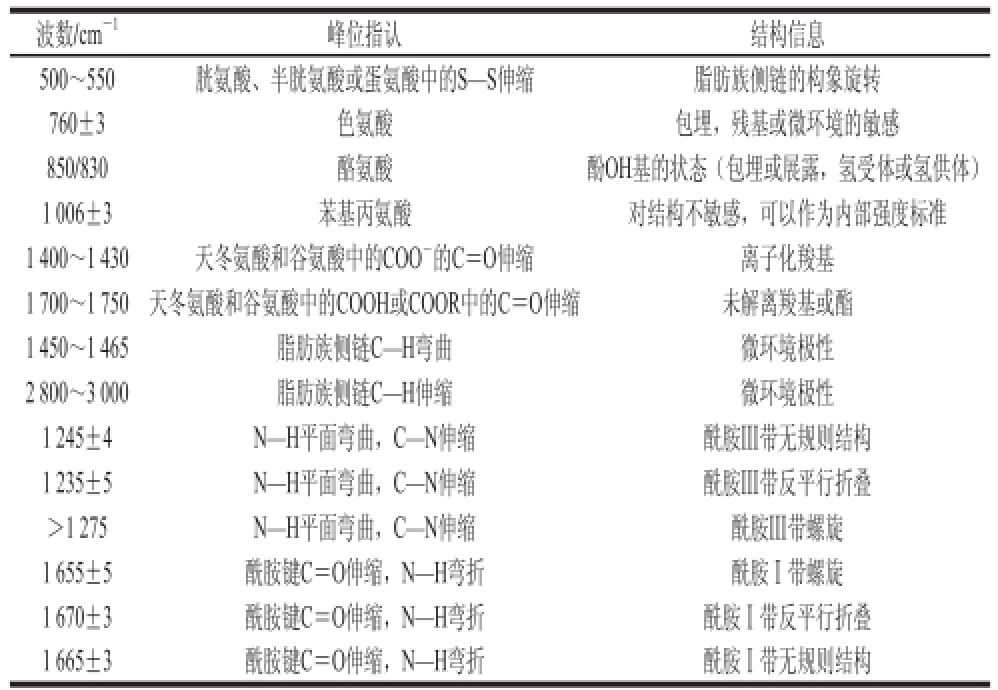
波数/cm -1峰位指认结构信息500~550胱氨酸、半胱氨酸或蛋氨酸中的S—S伸缩脂肪族侧链的构象旋转760±3色氨酸包埋,残基或微环境的敏感850/830酪氨酸酚OH基的状态(包埋或展露,氢受体或氢供体)1 006±3苯基丙氨酸对结构不敏感,可以作为内部强度标准1 400~1 430天冬氨酸和谷氨酸中的COO -的C=O伸缩离子化羧基1 700~1 750天冬氨酸和谷氨酸中的COOH或COOR中的C=O伸缩未解离羧基或酯1 450~1 465脂肪族侧链C—H弯曲微环境极性2 800~3 000脂肪族侧链C—H伸缩微环境极性1 245±4N—H平面弯曲,C—N伸缩酰胺Ⅲ带无规则结构1 235±5N—H平面弯曲,C—N伸缩酰胺Ⅲ带反平行折叠>1 275N—H平面弯曲,C—N伸缩酰胺Ⅲ带螺旋1 655±5酰胺键C=O伸缩,N—H弯折酰胺Ⅰ带螺旋1 670±3酰胺键C=O伸缩,N—H弯折酰胺Ⅰ带反平行折叠1 665±3酰胺键C=O伸缩,N—H弯折酰胺Ⅰ带无规则结构
2.2 添加荞麦多酚对米糠蛋白二级结构影响
米糠蛋白的构象主要由拉曼光谱中酰胺Ⅰ带和酰胺Ⅲ带的特征峰决定,酰胺Ⅰ是C=O与C-N键的伸张,酰胺Ⅲ带是C-N键的伸张和N-H在平面上的转折。其特征峰在酰胺Ⅰ带和酰胺Ⅲ带中分别是:α-螺旋为1 645~1 660 cm -1和1 265~1 300 cm -1,β-折叠为1 665~1 680 cm -1和1 230~1 240 cm -1,β-转角为1 640~1 645 cm -1和1 305 cm -1,无规则卷曲为1 660~1 670 cm -1和1 240~1 260 cm -1。
采用Labspec 4.0软件对多酚-米糠蛋白样品拉曼光谱的酰胺Ⅰ区进行分析,参考文献[18-20],米糠蛋白二级结构拉曼特征峰位置:α-螺旋结构为1 645~1 660 cm -1;β-折叠结构为1 665~1 680 cm -1;β-转角结构为1 680~1 690 cm -1;无规则卷曲结构为1 660~1 670 cm -1,进一步分析得到相应结果如表2所示。
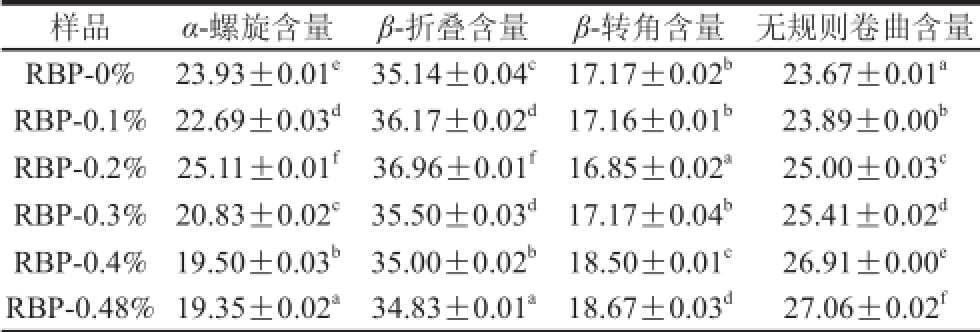
表2 利用酰胺Ⅰ带拟合米糠蛋白二级结构组成结果
Table2 Secondary structure composition of rice bran proteins determined by amideⅠband fi tting %
注:同列肩标字母不同表示差异显著(P<0.05)。下同。
 样品α-螺旋含量β-折叠含量β-转角含量无规则卷曲含量RBP-0%23.93±0.01
e35.14±0.04
c17.17±0.02
b23.67±0.01
aRBP-0.1%22.69±0.03
d36.17±0.02
d17.16±0.01
b23.89±0.00
bRBP-0.2%25.11±0.01
f36.96±0.01
f16.85±0.02
a25.00±0.03
cRBP-0.3%20.83±0.02
c35.50±0.03
d17.17±0.04
b25.41±0.02
dRBP-0.4%19.50±0.03
b35.00±0.02
b18.50±0.01
c26.91±0.00
eRBP-0.48%19.35±0.02
a34.83±0.01
a18.67±0.03
d27.06±0.02
f
样品α-螺旋含量β-折叠含量β-转角含量无规则卷曲含量RBP-0%23.93±0.01
e35.14±0.04
c17.17±0.02
b23.67±0.01
aRBP-0.1%22.69±0.03
d36.17±0.02
d17.16±0.01
b23.89±0.00
bRBP-0.2%25.11±0.01
f36.96±0.01
f16.85±0.02
a25.00±0.03
cRBP-0.3%20.83±0.02
c35.50±0.03
d17.17±0.04
b25.41±0.02
dRBP-0.4%19.50±0.03
b35.00±0.02
b18.50±0.01
c26.91±0.00
eRBP-0.48%19.35±0.02
a34.83±0.01
a18.67±0.03
d27.06±0.02
f
通过对米糠蛋白二级结构的解析可知,米糠蛋白中最主要的二级结构单元为β-折叠,β-转角含量最少。现有研究亦证实了米糠蛋白中含有较多的β-折叠及较少的α-螺旋 [21-23]。对比原始样品,添加荞麦多酚总体减少了α-螺旋含量,而增大了无规则卷曲含量。随着荞麦多酚添加量的提高,米糠蛋白的α-螺旋含量逐渐降低,无规则卷曲含量逐渐增大,β-折叠含量呈现先增大后降低的变化趋势,而β-转角含量呈先降低后增大的变化趋势。多酚化合物对蛋白质二级结构产生的影响已被实验所证实。例如,当蛋白质与茶多酚形成复合物时,全脂乳中蛋白质β-折叠和无规则卷曲含量有所降低,而α-螺旋及β-转角含量有所增加 [24-26];Wu Xuli等 [27]研究了儿茶素和β-乳球蛋白通过疏水作用结合时,发现二者的相互作用可增加β-乳球蛋白的α-螺旋结构含量。Kanakis等 [28]研究发现茶多酚与β-乳球蛋白的交互作用可增加α-螺旋和β-折叠含量,有利于蛋白质结构的稳定。
2.3 添加荞麦多酚对米糠蛋白侧链结构影响
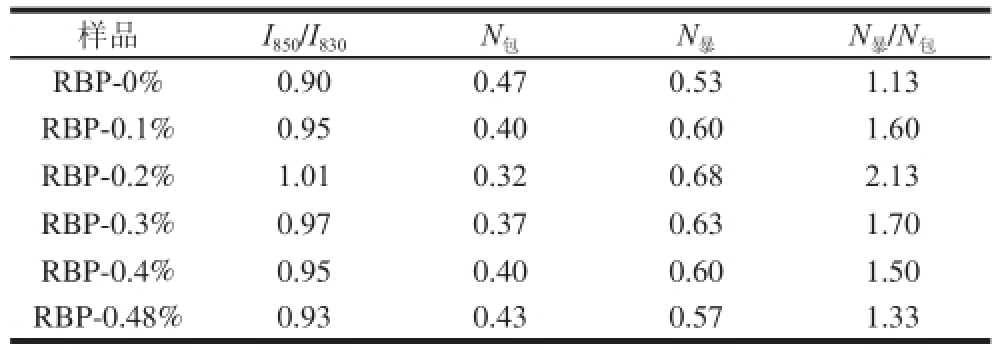
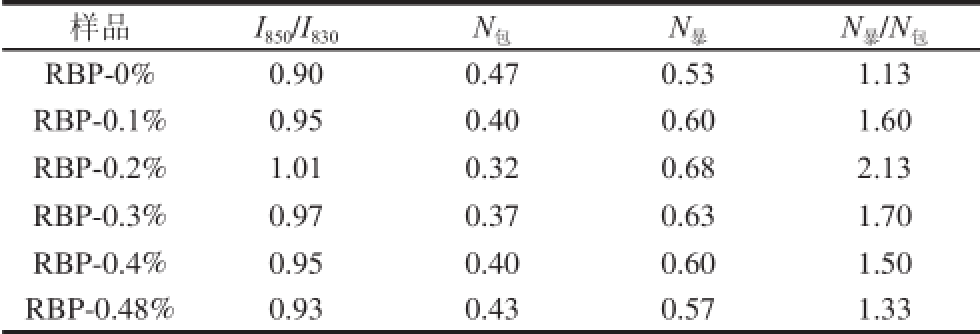
酪氨酸的费米共振会引起850 cm -1和830 cm -1左右处的特征峰随侧链微环境改变,当强度比I 850/I 830≥1时,该酪氨酸是“暴露的”;强度比I 850/I 830<1时,该酪氨酸就是“埋藏的”。本研究中I 850/I 830比值均为0.50~1.25范围内,两种酪氨酸残基的分子数(N)计算结果如表3所示。
表3 酪氨酸费米共振线I
885500/I
883300以及残基暴露/包埋分子数
Table3 Tyrosyl doublet stretching ring at 850/83300 ccmm
--11and thhee number of exposed/buried residues
 样品
I
850
/I
830
N
包
N
暴
N
暴
/N
包RBP-0%0.900.470.531.13 RBP-0.1%0.950.400.601.60 RBP-0.2%1.010.32 0.682.13 RBP-0.3%0.970.370.631.70 RBP-0.4%0.950.400.601.50 RBP-0.48%0.930.430.571.33
样品
I
850
/I
830
N
包
N
暴
N
暴
/N
包RBP-0%0.900.470.531.13 RBP-0.1%0.950.400.601.60 RBP-0.2%1.010.32 0.682.13 RBP-0.3%0.970.370.631.70 RBP-0.4%0.950.400.601.50 RBP-0.48%0.930.430.571.33
由表3可知,从酪氨酸残基暴露/包埋分子数来看,酪氨酸残基多暴露于蛋白分子的表面上,以氢键的供体或受体的形式与水相结合。但在荞麦多酚添加量逐渐增大过程中,酪氨酸I 850/I 830和N 暴/N 包值均呈先增大后降低的变化趋势,即酪氨酸先趋于“暴露式”而后转为“包埋态”。
756 cm -1处附近的拉曼谱带归属为色氨酸侧链,由图1可知,各组样品的米糠蛋白谱线强度分别为0.96(RBP-0%)、0.94(RBP-0.1%)、0.90(RBP-0.2%)、0.93(RBP-0.3%)、0.95(RBP-0.4%)、0.99(RBP-0.48%)。已有研究表明,756 cm -1处附近的色氨酸拉曼归属谱带强度越低,蛋白质的色氨酸趋于“暴露式”,反之则趋于“包埋态” [29-30]。通过比较可知,米糠蛋白的色氨酸谱带强度随着荞麦多酚添加量的增加呈现先降低后增大的变化趋势,表明随着荞麦多酚的添加量增大,米糠蛋白色氨酸更趋于“暴露式”,但荞麦多酚添加量进一步增加却使米糠蛋白色氨酸趋于“包埋态”。
通过比较荞麦多酚添加后米糠蛋白色氨酸及酪氨酸疏水环境的变化规律可以推测,低剂量荞麦多酚通过非共价结合诱导米糠蛋白质二级结构发生改变产生部分折叠,而高剂量的荞麦多酚添加会由于蛋白质含量高于多酚而促使米糠蛋白部分聚集而沉淀。
2.4 二硫键分析
在拉曼光谱中,二硫键的特征谱带为500~550 cm -1。在该区间中拉曼位移与振动模式对应关系为:500~510 cm -1处为gauche-gauche-gauche(g-g-g)模式,515~525 cm -1处为gauche-gauche-trans(g-g-t)模式,535~545 cm -1处为trans-gauche-trans(t-g-t)模式。
为了确定荞麦多酚对米糠蛋白二硫键的影响,运用Peak Analyzer软件进行多峰值Guassina拟合,拟合谱线与实验数据合成的谱线比较接近,验证了拟合结果的准确性。由图2可知,米糠蛋白的二硫键构型主要为t-g-t模式,各组样品的二硫键构型组成含量如表4所示。
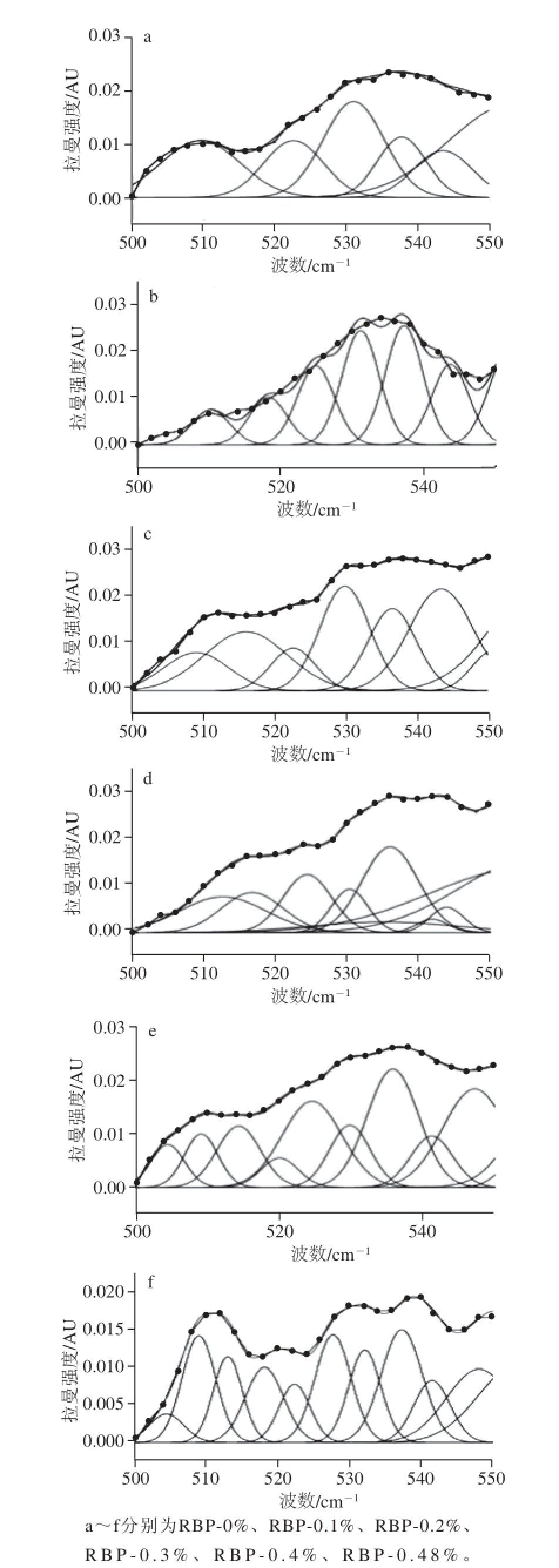
图2 荞麦多酚对米糠蛋白二硫键构型的影响
Fig.2 Effect of buckwheat polyphenols on the conformation of S-S bonds in rice bran proteins
表4 实验样品中二硫键构型组成含量
Table4 Con fi gurational compositions of disul fi de bonds in test samples %
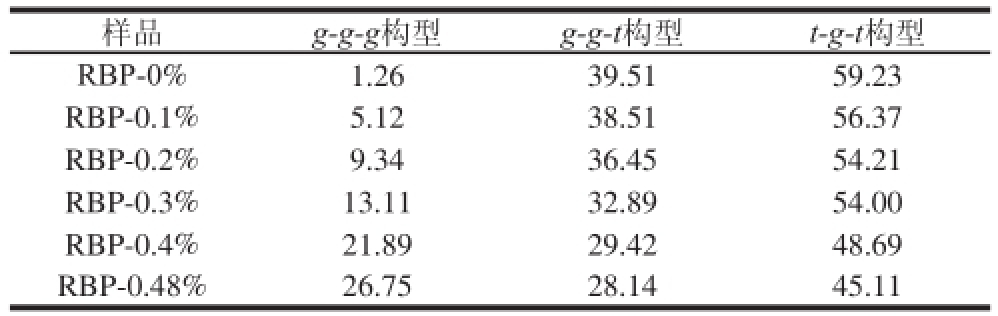
样品g-g-g构型g-g-t构型t-g-t构型RBP-0%1.2639.5159.23 RBP-0.1%5.1238.5156.37 RBP-0.2%9.3436.4554.21 RBP-0.3%13.1132.8954.00 RBP-0.4%21.8929.4248.69 RBP-0.48%26.7528.1445.11
通过比较可知,随着荞麦多酚添加量的增加,米糠蛋白二硫键g-g-t构型及t-g-t构型含量逐渐降低,而g-g-g构型含量有所增加,即荞麦多酚的添加使米糠蛋白二硫键由g-g-t构型和t-g-t构型逐渐转变为g-g-g构型。t-g-t构型是典型的分子间二硫键构型,而g-g-g构型是主要的分子内二硫键构型,故通过上述分析可知,荞麦多酚可部分破坏米糠蛋白分子间二硫键,降低米糠蛋白分子间作用。
通过荞麦多酚和米糠蛋白混合物拉曼光谱分析发现米糠蛋白中最主要的二级结构单元为β-折叠,β-转角含量最少。荞麦多酚添加减少了米糠蛋白α-螺旋含量,而增大其无规则卷曲含量。但米糠蛋白随着荞麦多酚添加量的增加结构的变化为α-螺旋含量逐渐降低,无规则卷曲含量逐渐增大,β-折叠含量呈现先增大后降低的变化趋势,而β-转角含量呈先降低后增大的变化趋势。米糠蛋白的酪氨酸残基随着荞麦多酚添加量的增大由“暴露式”转为“包埋态”。米糠蛋白色氨酸谱带强度随着荞麦多酚添加量增加呈先降低后增大的变化趋势,表明随着荞麦多酚的添加量增大,米糠蛋白色氨酸更趋于“暴露式”,但当荞麦多酚添加量进一步增加时却会使米糠蛋白色氨酸趋于“包埋态”。米糠蛋白的二硫键构型主要为t-g-t模式,在荞麦多酚的添加量逐渐增加时米糠蛋白二硫键由g-g-t构型和t-g-t构型逐渐转变为g-g-g构型。上述结论对于系统地探讨荞麦多酚抗氧化作用及其在米糠蛋白贮藏中应用提供了一定理论支持。
参考文献:
[1] KIM S L, KIM S K, PARK C H. Introduction and nutritional evaluation of buckwheat sprouts as a new vegetable[J]. Food Research International, 2004, 37(4): 319-327. DOI:10.1016/j.foodres.2003.12.008.
[2] BONAFACCIA G, MAROCCHINI M, KREFT I. Composition and technological properties of the fl our and bran from common and tartary buckwheat[J]. Food Chemistry, 2003, 80(1): 9-15. DOI:10.1016/ S0308-8146(02)00228-5.
[3] CHU Y F, WISE M L, GULVADY A A, et al. In vitro antioxidant capacity and anti-inflammatory activity of seven common oats[J]. Food Chemistry, 2013, 139(1/2/3/4): 426-431. DOI:10.1016/ j.foodchem.2013.01.104.
[4] GAWLIK-DZIKI U, DZIKI D, BARANIAK B, et al. The effect of simulated digestion in vitro on bioactivity of wheat bread with Tartary buckwheat fl avones addition[J]. LWT-Food Science and Technology, 2009, 42(1): 137-143. DOI:10.1016/j.lwt.2008.06.009.
[5] TIAN Q G, LI D, PATIL B S. Identification and determination of fl avonoids in buckwheat (Fagopyrum esculentum Moench, Polygonaceae) by high-performance liquid chromatography with electrospray ionisation mass spectrometry and photodiode array ultraviolet detection[J]. Phytochemical Analysis, 2002, 13(5): 251-256. DOI:10.1002/pca.649.
[6] LIN L Y, LIU H M, YU Y W, et al. Quality and antioxidant property of buckwheat enhanced wheat bread[J]. Food Chemistry, 2009, 112(4):987-991. DOI:10.1016/j.foodchem.2008.07.022.
[7] STASZEWSKI M V, JAGUS R J, PILOSOF A M R. Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J]. Food Hydrocolloids, 2011, 25(5): 1077-1084. DOI:10.1016/ j.foodhyd.2010.10.004.
[8] 刘夫国, 马翠翠, 王迪, 等. 蛋白质与多酚相互作用研究进展[J]. 食品与发酵工业, 2016, 42(2): 282-288. DOI:10.13995/jcnki11-1802/ts. 201602048.
[9] 王洁. 多酚-蛋白质相互作用的影响因素及其功能特性研究进展[J].河南工业大学学报(自然科学版), 2012, 33(3): 91-96. DOI:10.16433/ j.cnki.issn1673-2383.2012.03.023.
[10] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk αand β-caseins with tea polyphenols[J]. Progress in Brain Research, 2011, 59(6): 23-27. DOI:10.1016/j.foodchem.2010.11.087.
[11] 张曼, 王岸娜, 吴立根, 等. 蛋白质、多糖和多酚间相互作用及研究方法[J]. 粮食与油脂, 2015(4): 42-46. DOI:10.3969/ j.issn.1008-9578.2015.04.012.
[12] WU X L, WU H, LIU M X, et al. Analysis of binding interaction between (-)-epigallocatechin (EGC) and β-lactoglobulin by multispectroscopic method[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2011, 82(1): 164-168. DOI:10.1016/ j.saa.2011.07.028.
[13] 谢凤英, 张秀玲, 程雪, 等. 荞麦米多酚物质的提取及其抗氧化特性[J]. 食品工业科技, 2014, 35(22): 259-263. DOI:10.13386/ j.issn1002-0306.2014.22.048.
[14] MATTEO B, VITO V, EMANUELE M, et al. Antioxidant phenols in barley (Hordeum vulgare L.) flour: comparative spectrophotometric study among extraction methods of free and bound phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2004, 52(16): 5195-5200. DOI:10.1021/jf040075c.
[15] RYAN L, THONDRE P S, HENRY C J K. Oat-based breakfast cereals are a rich source of polyphenols and high in antioxidant potential[J]. Journal of Food Composition & Analysis, 2011, 24(7): 929-934. DOI:10.1016/j.jfca.2011.02.002.
[16] 柯惟中, 余多慰, 陈婉蓉, 等. 热处理和紫外辐射对DNA影响的拉曼光谱研究[J]. 光学学报, 1997(12): 1681-1686. DOI:10.1088/0256-307X/13/9/013.
[17] 王中江, 江连洲. 大豆分离蛋白在不同pH下的拉曼光谱分析[J]. 食品工业科技, 2012, 33(11): 63-66. DOI:10.13386/j.issn1002-0306.2012.11.007.
[18] 刘燕燕, 曾新安, 韩忠. Raman光谱分析脉冲电场对大豆分离蛋白的影响[J]. 光谱学与光谱分析, 2010, 30(12): 3236-3239. DOI:1013964/ j1issn11000-0593(2010)12-3236-04.
[19] 何秋实. 超声处理对红豆蛋白结构及功能性影响的研究[J]. 中国粮油学报, 2014, 29(7): 49-53.
[20] 许以明. 拉曼光谱及其在结构生物中的应用[M]. 北京: 化学工业出版社, 2005: 11-13.
[21] 郝天舒, 王长远. 微波处理对米糠蛋白结构及功能性的影响[J].天然产物研究与开发, 2015(5): 774-779. DOI:10.16333/j.1001-6880.2015.05.005.
[22] 那治国, 马永强, 韩春然, 等. 米糠谷蛋白干法糖基化改性的研究[J].食品科学, 2013, 34(2): 52-57.
[23] 王长远, 郝天舒, 张敏. 干热处理对米糠蛋白结构与功能特性的影响[J]. 食品科学, 2015, 36(7): 13-18. DOI:10.7506/spkx1002-6630-201507003.
[24] 王长远, 全越, 许凤, 等. pH处理对米糠蛋白理化特性及结构的影响[J]. 中国生物制品学杂志, 2015, 28(5): 483-486. DOI:10.13200/ j.cnki.cjb.000904.
[25] YE J H, FAN F Y, XU X, et al. Interactions of black and green tea polyphenols with whole milk[J]. Food Research International, 2013, 53(1): 449-455. DOI:10.1016/j.foodres.2013.05.033.
[26] 刘爽, 袁芳, 高彦祥. 蛋白质或乳液与茶和咖啡中的多酚相互作用的研究概述[J]. 食品与发酵工业, 2014, 40(12): 130-135. DOI:10.13995/j.cnki.11-1802/ts.201412026.
[27] WU X L, RAJA D, WU H, et al. Studies on the interaction of -epigallocatechin-3-gallate from green tea with bovine β-lactoglobulin by spectroscopic methods and docking[J]. International Journal of Dairy Technology, 2013, 66(1): 7-13. DOI:10.1111/j.1471-0307.2012.00873.x.
[28] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3):1046-55. DOI:10.1016/j.foodchem.2011.01.079.
[29] HOWELL N, LI C E. Elucidation of interactions of lysozyme with whey proteins by Raman spectroscopy[J]. International Journal of Food Science & Technology, 1996, 31(5): 439-451. DOI:10.1046/ j.1365-2621.1996.00364.x.
[30] 源博恩. 亚基解离与重聚集对大豆蛋白结构和功能特性的影响[D].广州: 华南理工大学, 2012: 56-69.
Effect of Buckwheat Polyphenols on the Structure of Rice Bran Proteins Analyzed by Raman Spectroscopy
XIE Fengying
1, MA Yan
2, WANG Xiaojun
1, ZHANG Xiuling
1,*, XU Su
1, CHEN Shaohua
1
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China; 2. Center of Experiment Teaching, Shenyang Normal University, Shenyang 110034, China)
Abstract:The effect of buckwheat polyphenols on the structure of rice bran proteins was studied by Raman spectroscopy in this research. Our results demonstrated that with increasing addition of buckwheat polyphenols, the secondary structures of rice bran proteins revealed a gradual decrease in α-helix content, an initial increase followed by a decrease in β-sheet content, an initial decrease and then an increase in β-turn content, and a gradual increase in random coil content. Furthermore, both tyrosine and tryptophan residues tended to be exposed at fi rst and then transformed to a buried state. The addition of buckwheat polyphenols could lead to a configurational transformation of the disulfide bonds from gauche-gauche-trans and trans-gauche-trans to gauche-gauche-gauche. Therefore, the interaction between buckwheat polyphenols and rice bran proteins could partially damage the disulf i de bonds in rice bran proteins and thereby enhance the structural stability of rice bran proteins.
Key words:Raman spectroscopy; buckwheat polyphenols; rice bran proteins; structure
DOI:10.7506/spkx1002-6630-201703006
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)03-0032-05
引文格式:
谢凤英, 马岩, 王晓君, 等. 拉曼光谱分析荞麦多酚对米糠蛋白结构的影响[J]. 食品科学, 2017, 38(3): 32-36. DOI:10.7506/spkx1002-6630-201703006. http://www.spkx.net.cn
XIE Fengying, MA Yan, WANG Xiaojun, et al. Effect of buckwheat polyphenols on the structure of rice bran proteins analyzed by Raman spectroscopy[J]. Food Science, 2017, 38(3): 32-36. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201703006. http://www.spkx.net.cn
收稿日期:2016-04-12
基金项目:“十二五”国家科技支撑计划项目(2014BAD22B01);黑龙江省科技攻关项目(Gc13B409)
作者简介:谢凤英(1975—),女,讲师,博士,研究方向为粮食、油脂及植物蛋白质工程。E-mail:spxfy@163.com *通信作者:张秀玲(1968—),女,教授,博士,研究方向为农产品贮藏与加工。E-mail:zhangxiuling1118@sina.com