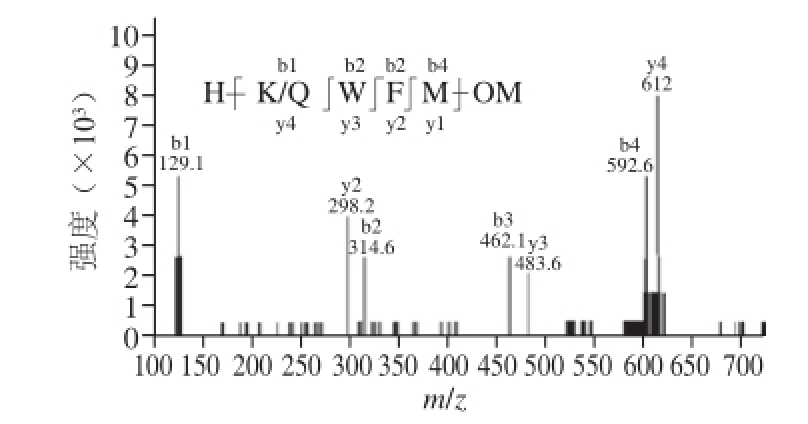
图1 QWFM、KWFM质谱图
Fig.1 Mass spectra of QWFM and KWFM
王 莹 1,刘静波 2,邢 杰 2,李幸芳 2,殷涌光 1,*
(1.吉林大学生物与农业工程学院,吉林 长春 130025;2.吉林大学食品科学与工程学院,吉林 长春 130062)
摘 要:以前期研究所得的Gln-Trp-Phe-Met(QWFM,652.78)和Lys-Trp-Phe-Met(KWFM,610.78)抗氧化四肽为研究对象,探究高压脉冲电场技术(pulsed electric field,PEF)对抗氧化肽荧光特性的改变。研究表明,在PEF作用下QWFM和KWFM的荧光强度发生了不同程度的改变,由于两条结构相似的抗氧化四肽中色氨酸前端所连接的氨基酸不同,在相同的PEF处理条件下,QWFM的荧光强度变化更为显著,在电场频率为1 800 Hz和电场强度为15 kV/cm时,其荧光强度变化最显著。通过监测经PEF处理后2 h抗氧化四肽荧光强度的变化,发现抗氧化四肽荧光强度的变化随着时间的延长而逐渐减弱。通过圆二色谱分析和核磁共振波谱技术分析发现维持QWFM中β-折叠的氢键含量有所改变从而导致了β-折叠结构的含量有所减少。这些变化表明PEF技术可能通过改变抗氧化肽的化学结构而改变其荧光特性,为PEF技术应用于抗氧化肽的研究提供了理论基础。
关键词:高压脉冲电场;抗氧化肽;荧光强度;化学结构
高压脉冲电场(pulsed electric fi eld,PEF)是高电压工程和脉冲功率技术在食品工程和生物学领域的应用。相对于传统的热处理技术,PEF能够避免或者极大地降低食品在处理过程中的感官品质和物理特性的变化,因此可以很大程度地保持食品的原有品质 [1]。目前,关于PEF应用在牛奶和果汁灭菌方面的研究非常多,相对而言,在酶活钝化和酶构象上的研究比较少 [2-6]。
赵伟 [7]以蛋清蛋白和卵白蛋白为研究对象,研究了对蛋白质起泡性、乳化性能和结构特性的影响,采用荧光光谱等技术发现PEF使溶菌酶荧光强度增加。钟葵等 [8]在研究PEF对辣根过氧化物酶的活性及酶构象的影响效果中,通过荧光光谱分析表明脉冲电场处理后辣根过氧化物酶蛋白的荧光强度都有所下降,但下降的幅度随电场强度的增大而减小。李顺子等 [9]在研究蜂毒肽及其类似物的抗菌活性、溶血活性及与磷脂膜的作用时,通过分析蜂毒肽及合成的类似物的荧光特性表明蜂毒肽在磷脂脂质体诱导下,其二级结构发生了变化。然而目前PEF对蛋白类物质结构的作用研究大多停留在描述性的层面,缺乏对其作用机制更深层次的阐述 [10]。故本研究以实验室前期工作中用红松籽经过酶解、超滤、纯化、解谱等步骤,并通过试剂公司进行合成所得QWFM和KWFM抗氧化四肽为对象,探究了PEF对抗氧化肽荧光强度的影响,并借助圆二色谱(circular dichroism,CD),核磁共振(nuclear magnetic resonance,NMR)等技术力求在原子水平上初步揭示PEF对抗氧化肽荧光强度的作用机制。
1.1 材料与试剂
QWFM抗氧化四肽、KWFM抗氧化四肽(纯度均≥98%)(图1) 合肥赛曼诺生物科技有限公司;乙醇、氢氧化钠、D 2O诱导剂和溴化钾等试剂(分析纯)北京化工厂。

图1 QWFM、KWFM质谱图
Fig.1 Mass spectra of QWFM and KWFM
1.2 仪器与设备
PEF装置,吉林大学殷涌光教授设计;PH-070A干燥箱/培养箱 上海一恒科学仪有限公司;BT25S电子分析天平(精度0.01 mg) 瑞士梅特勒-托利多公司;MOS-500圆二色谱仪 法国Bio-Logic公司;ZG-2真空冷冻干燥机 杭州创意真空冷冻干燥设备厂;RF-5301荧光分光光度计 日本岛津公司;500 MHz超导液体核磁共振波谱仪 美国Bruke公司。
1.3 方法
1.3.1 PEF处理技术
PEF处理装置 [11]包含料泵、示波器、加热装置以及其他PEF处理装置。加入样品前,按照去离子水→乙醇→去离子水的顺序对PEF装置的物料回流管进行循环清洗,重复2~3 次 [12]。随后,将两条抗氧化四肽溶解于去离子水中配制成质量浓度为8 mg/mL的溶液,并以3.2 mL/min的流速通入电场中。分别调节电场强度以及电场频率以获得不同PEF处理条件下的抗氧化肽液,收集以备下一步实验。
1.3.2 PEF单因素试验设计
据前期研究基础,选取电场强度和电场频率为试验因素。考察不同电场强度以及电场频率条件下PEF对两条抗氧化四肽的影响。电场频率为1 800、2 400 Hz;电场强度为5、10、15、20 kV/cm。
1.3.3 抗氧化肽荧光光谱分析
将PEF处理后的样品分别用去离子水配制成0.2 mg/mL的抗氧化肽液置于4 ℃冰箱中备用,用荧光分光光度计测定抗氧化肽液的荧光特性,荧光分光度计的激发波长设置为300 nm,发射波长为310 nm,终止波长为900 nm,步长为1 nm,之后用去离子水清洗比色皿2~3 次,并用待测样品润洗2~3 次。将装有待测样品的比色皿置于荧光分光光度计的样品槽中,进行测量 [13]。
1.3.4 抗氧化肽二级结构的测定
抗氧化四肽溶液中二级结构的变化通过CD仪进行测定。参照文献[14]中所描述的方法。起始波长设定为190 nm,终止波长设定为270 nm,步长1 nm,比色杯的光程长为0.1 cm,狭缝宽度2 nm,采集时间设定为1 nm/s。先后用去离子水和待测样品对比色池进行润洗,随后加入250 μL质量浓度为1 mg/mL的待测样品进行测定。
1.3.5 抗氧化肽H质子的测定
抗氧化肽所含H质子的变化通过NMR技术分析。参照Sharma等 [15]的方法,将待测样品放入5 mm核磁管中,按一定的比例加入D 2O诱导剂,设置参数为5 mm核磁共振仪探头,500 MHz共振频率,13 μs脉冲宽度,采样延迟时间为6 s,采样次数为32 次。在此条件测定不同PEF条件处理下的抗氧化四肽 1H-NMR谱图。
1.3.6 数据处理与统计
数据采用SPSS 17.0统计软件进行单因素方差分析、相关性分析。用独立样品的t检验差异显著性检验,结果用
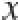 ±s表示,P<0.05。
±s表示,P<0.05。
2.1 PEF处理对抗氧化四肽荧光特性的影响
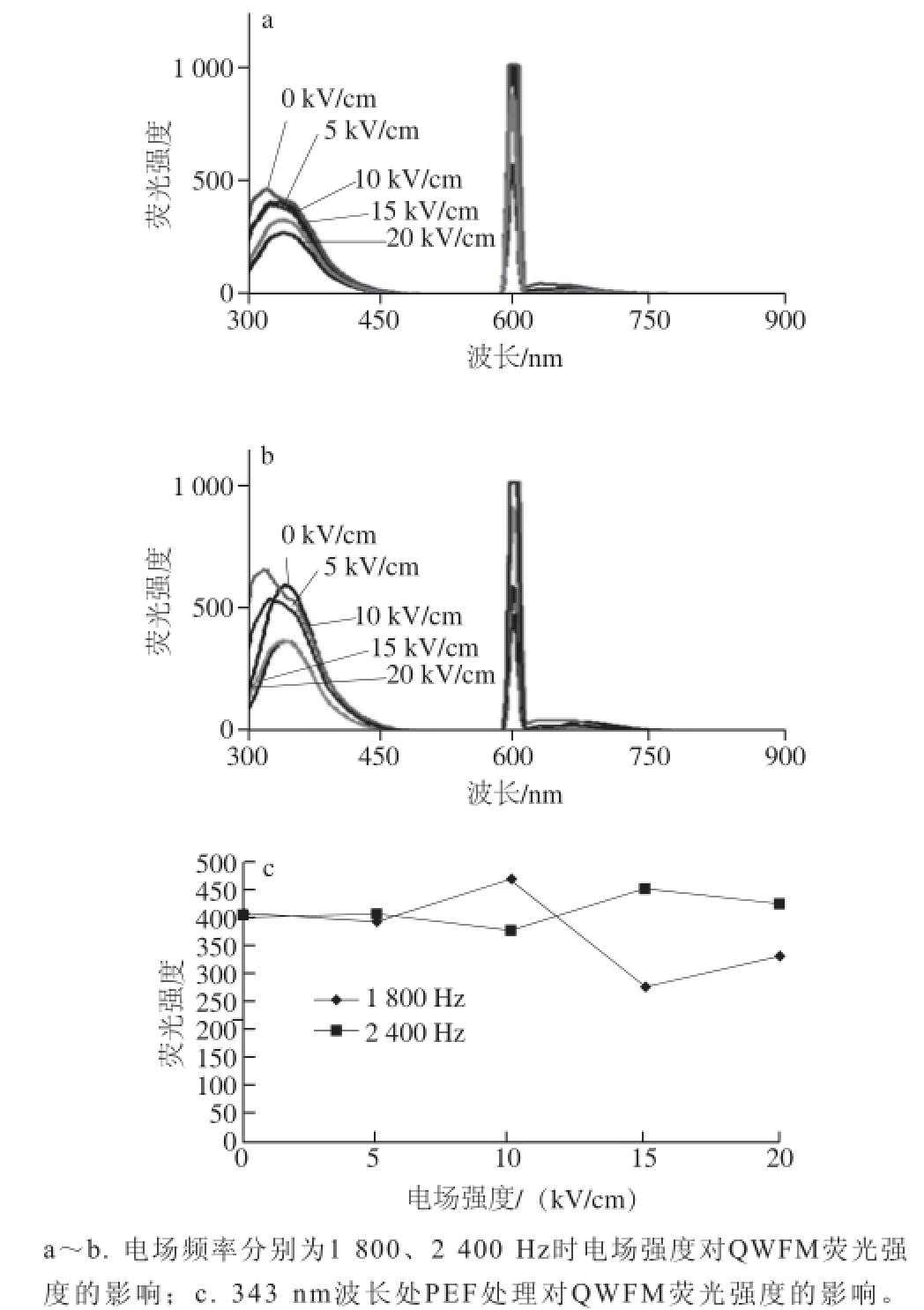
图2 QWFM的荧光图谱及对比分析
Fig.2 Fluorescence spectra of QWFM with and without PEF treatment
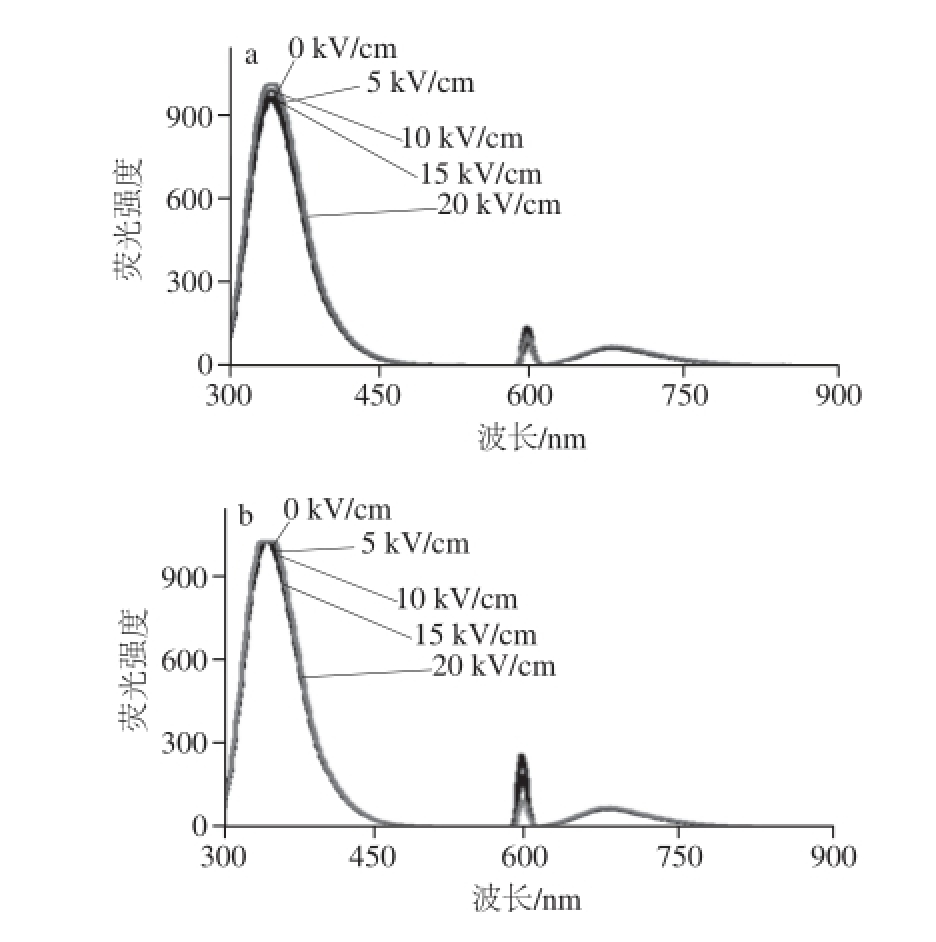
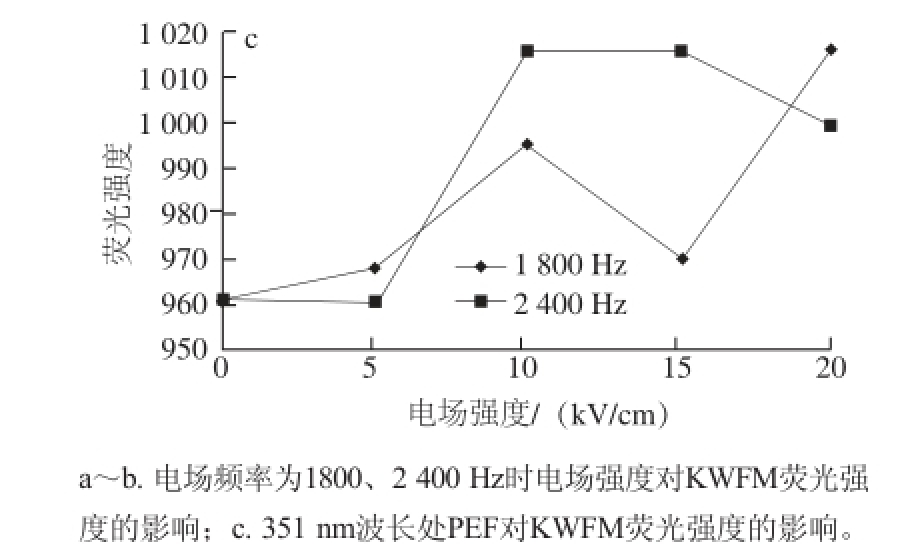
图3 KWFM的荧光图谱及对比分析
Fig.3 Fluorescence spectra of KWFM with and without PEF treatment
根据蛋白质分子的荧光特性,荧光吸收峰的荧光强度可以反应出蛋白质分子结构以及键能的变化等 [16]。由图2a、b可以看出,QWFM分别在343 nm,601 nm出现了吸收峰。可能是由于水在300 nm激发波长时出现了散射而引起了在601 nm处出现水的吸收峰。不同PEF处理条件下,抗氧化四肽的荧光强度不同。如图2c所示,电场频率设置为1 800 Hz时,可以看出在343 nm波长处,电场强度为10 kV/cm时,荧光强度最高,当电场强度增加到15 kV/cm时,荧光强度最低。电场强度为15 kV/cm时,QWFM荧光强度的变化最显著。当电场频率设置为2 400 Hz时,随着电场强度的增加,在343 nm波长处,QWFM荧光强度的改变并不十分显著,在10 kV/cm时,荧光强度降低较为显著。
KWFM在350 nm波长处出现第一个荧光吸收峰(图3a、b)。将电场频率设置为1 800 Hz时,KWFM的荧光强度达到960以上。当电场强度增加到20 kV/cm时,荧光强度提高较为显著。而当电场频率设置为2 400 Hz时,随着电场强度的增加,抗氧化四肽的荧光强度呈先上升后下降的趋势,并在10 kV/cm处达到最大值。表明蛋白质构象发生了比较显著的变化。这可能是由于蛋白分子在PEF的作用下,由于电子的转移导致内部能量发生转移进一步引发了荧光猝灭。由于电子的转移而引发了能量转移,即为内源发色基团发生荧光猝灭的现象 [17]。当一个分子的发射光谱和另一分子的吸收光谱相重叠时,通过分子间偶极-偶极的共振偶合可使能量从给体转移到受体,从而使荧光强度降低 [18]。
蛋白质分子在PEF处理下,可能产生了给电子取代基 [19],可以加强荧光,如—OH、—OR、—CN、—NH 2、—NHR、—NR 2、—OCH 3。由于取代基上的n电子的电子云几乎与芳环上的π轨道平行,因而共享了共轭π电子结构,产生了p-π共轭效应,扩大了共轭双键体系,所以引起了荧光强度的增加 [20]。
2.2 不同氨基酸引起的抗氧化四肽荧光特性的变化
通过观察QWFM和KWFM抗氧化四肽,可以看出两条结构相似的肽其峰位略有不同,这可能是有于色氨酸前端连接的氨基酸基团不同引起的。由图4可知,谷氨酰胺分子式中含有两个C=O双键,赖氨酸分子式中只有一个C=O双键。由于C=O双键的存在,导致了整个分子的不饱和度增加,荧光强度较低。对于QWFM,当PEF处理条件发生改变,荧光强度变化较为显著,这可能是由于两个C=O双键的存在,使整个蛋白质分子处于一个比较不稳定的状态 [21]。相对于KWFM,当电场频率设置在1 800 Hz,电场强度从5 kV/cm增加到15 kV/cm,荧光强度改变并不十分显著。这可能是由于荧光基团色氨酸所连接的赖氨酸分之中只有一个C=O双键,不饱和程度相对较低,所以荧光强度的改变较QWFM相对较小。
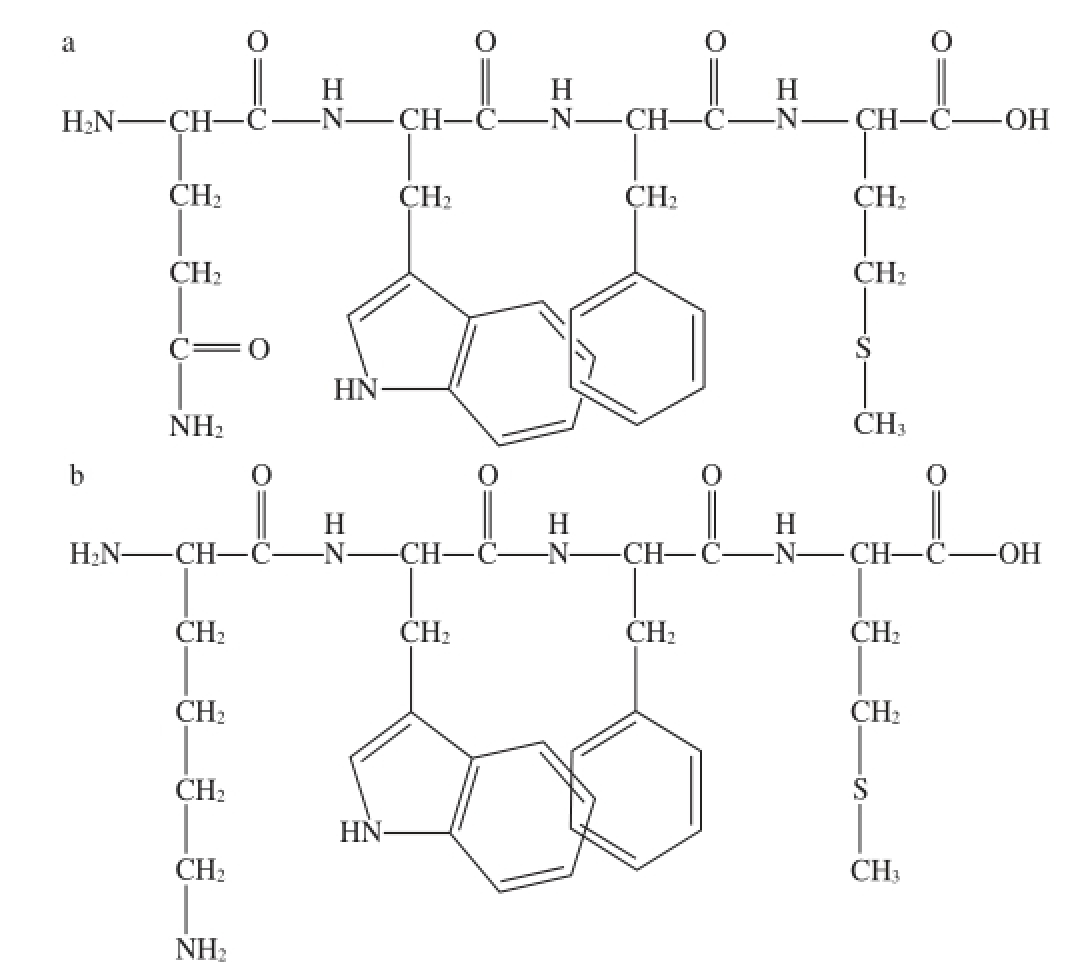
图4 QWFM(a)和KWFM(b)的化学结构
Fig.4 Chemical structures of QWFM (a) and KWFM (b)
2.3 PEF处理后保留时间对抗氧化四肽荧光特性的影响
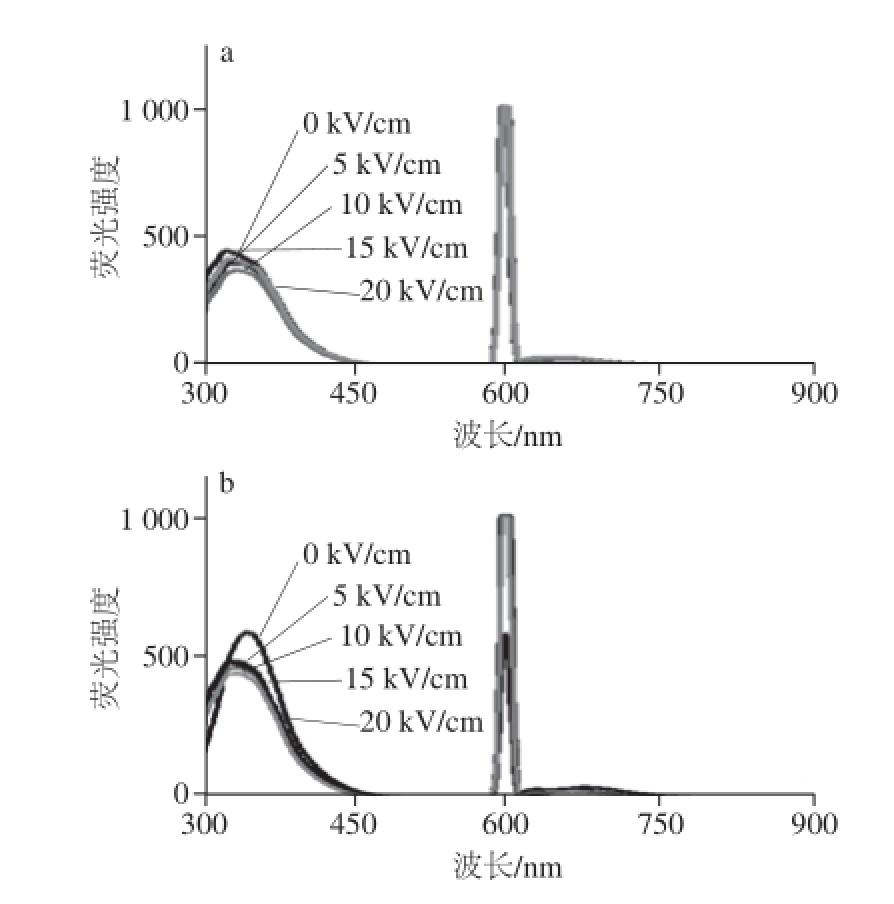
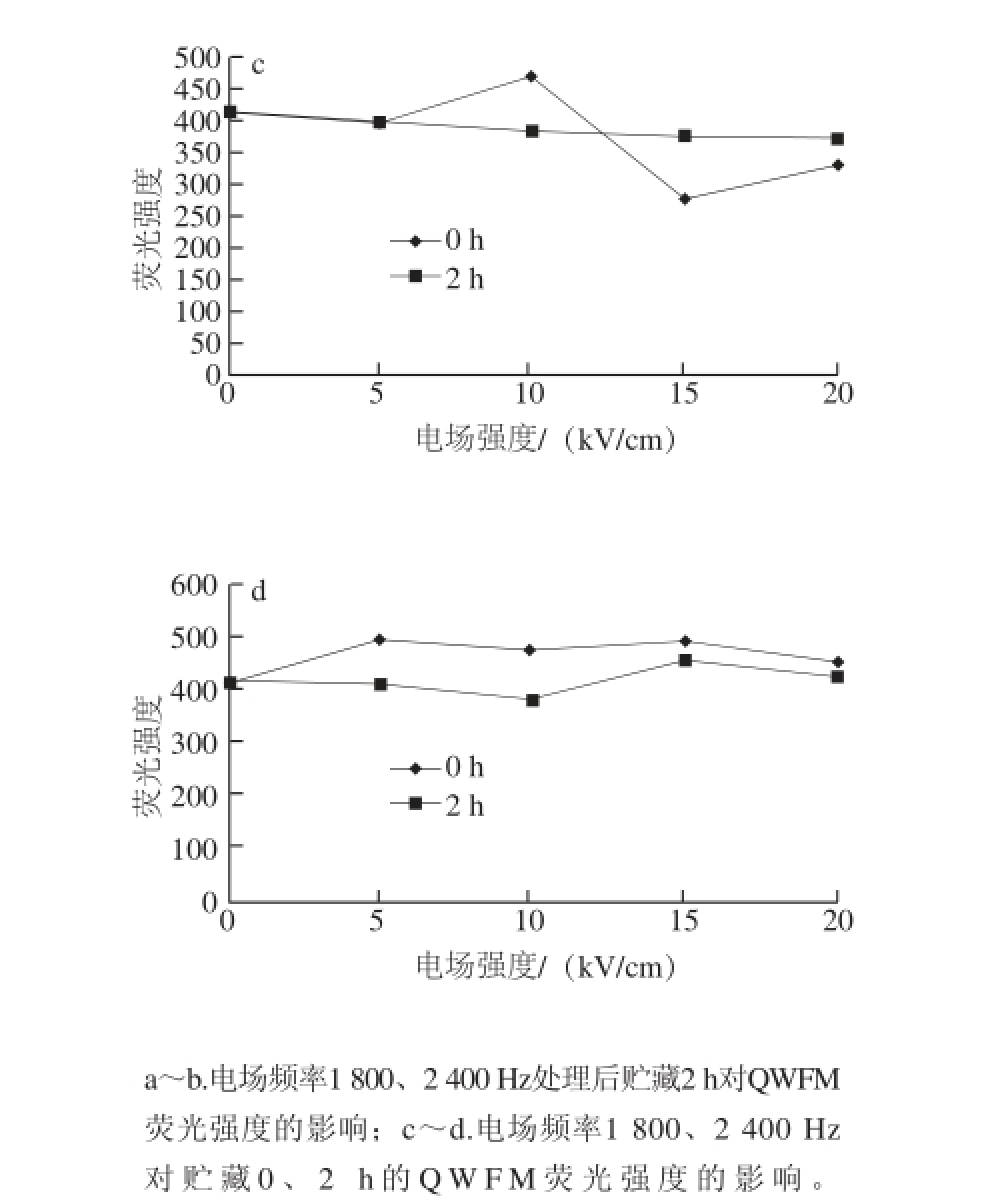
图5 QWFM荧光图谱及对比分析
Fig.5 Fluorescence spectra of QWFM with and without PEF treatment
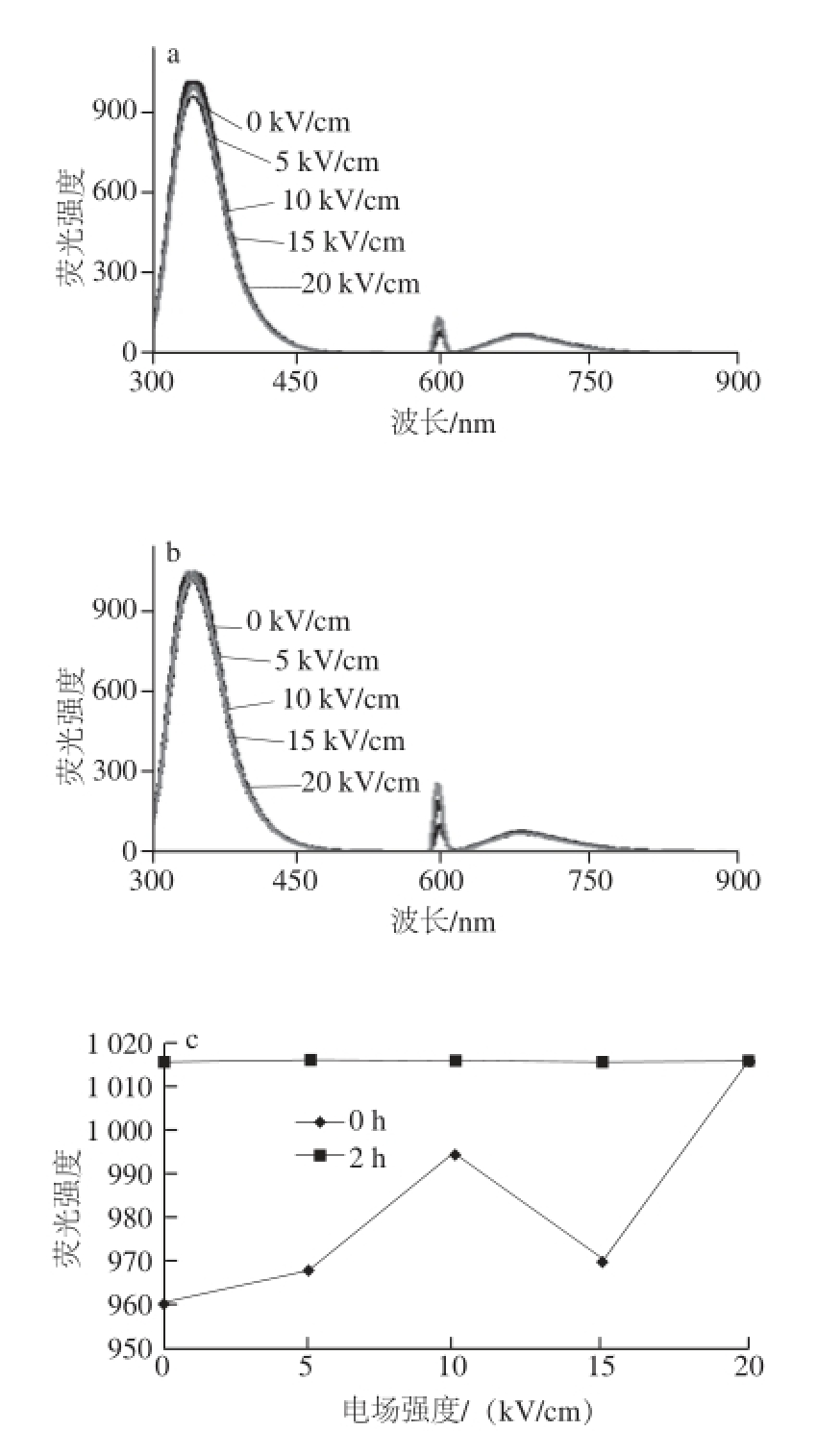
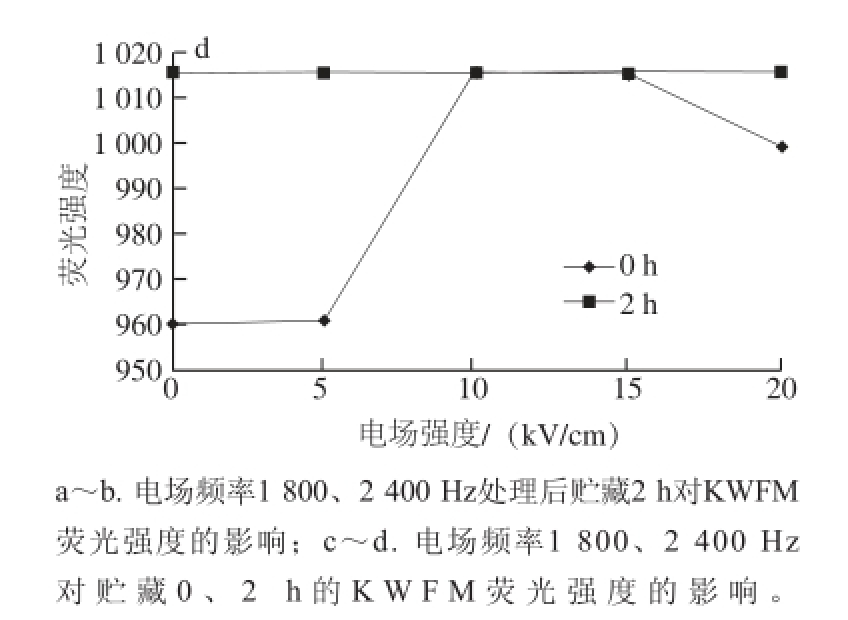
图6 KWFM荧光图谱及对比分析
Fig.6 Fluorescence spectra of KWFM with and without PEF treatment
将电场频率设置为1 800 Hz,对比图2和图5可以看出PEF处理后0 h和2 h QWFM荧光强度的变化,由图5a、b可以看出贮藏2 h后荧光吸收峰峰位发生了左右位移的现象,这可能是由于PEF处理过后,随着时间的延长,荧光强度的变化有下降的趋势 [22],也可能是由于PEF处理效果发生了回弹,色氨酸的侧链显色基团对于这种变化比较敏感,在这种情况下,随着电场强度从5 kV/cm增加到15 kV/cm,峰位在325~350 nm之间发生了变化,荧光强度变化也比较显著。
将电场频率设置为1 800 Hz和2 400 Hz,监测PEF处理后0 h和2 h QWFM荧光强度的变化,由图5c可以看出随着电场强度的增加,荧光强度的变化较小,表明PEF处理效果减小,这可能是由于PEF处理效果发生了回弹,导致了荧光强度的变化趋于平稳。对比图3和图6可以看出,PEF处理后0 h和2 h KWFM荧光强度的变化,在PEF处理后2 h,随着电场强度的增加,荧光强度的变化很小,这说明电场处理效果发生了回弹,而导致了PEF处理后的KWFM的荧光强度基本趋向于未处理的抗氧化四肽荧光强度。
2.4 PEF对抗氧化四肽二级结构的影响
通过荧光图谱分析发现QWFM在电场频率为1 800 Hz和电场强度为15 kV/cm的处理条件下,其荧光强度变化最显著,因此我们选取经该条件处理后与未经PEF处理的QWFM进行CD图谱测定(图7),探究在PEF作用下QWFM二级结构的改变。根据蛋白质的圆二色性,特征吸收峰处的吸收强度可以反映出体系中特征结构含量的变化 [23],采用β-折叠特征峰195 nm波长处的吸收值代表QWFM的折叠程度 [24]并对比PEF处理后β-折叠的变化情况。通过对比可以得知未经过PEF处理和经过PEF处理的QWFM均在195 nm波长处有一个明显且存在数值差异的正吸收峰,表明二者在溶液中主要以β-折叠的结构存在,且PEF处理在一定程度上改变了β-折叠的含量但并未完全的破坏β-折叠结构,从而引起了抗氧化肽荧光强度的降低。
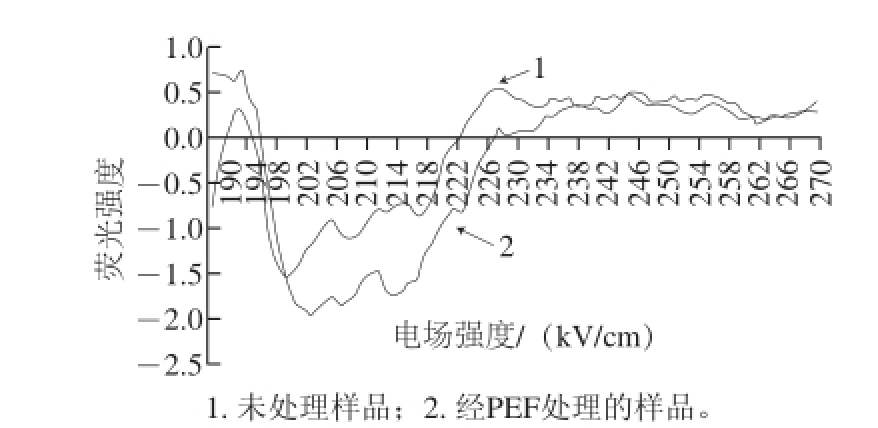
图7 QWFM圆二色谱图
Fig.7 Circular dichroism spectra of QWFM with and without PEF treatment
2.5 QWFM的 1H-NMR分析
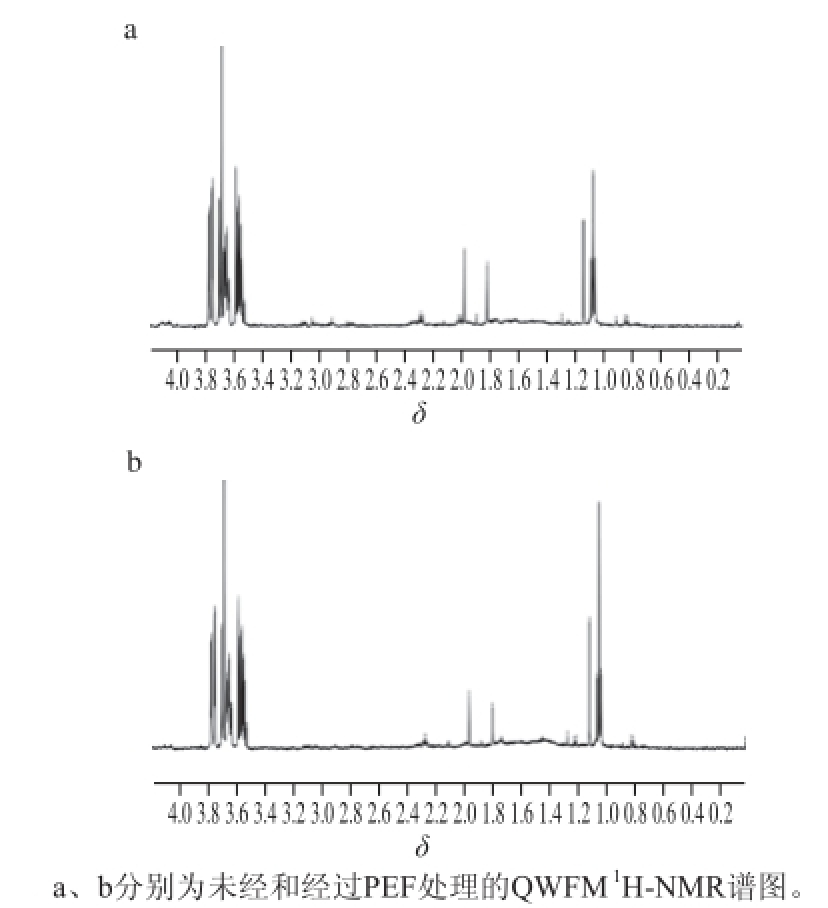
图8 QWFFMM的
1H-NNMMRR谱图
Fig.8
1H-NMR spectra of QWFM with and without PEF treatment
通过荧光图谱分析发现QWFM在电场频率为1 800 Hz和电场强度为15 kV/cm的处理条件下,其荧光强度变化最显著,因此我们选取经该条件处理后与未经PEF处理的QWFM进行 1H-NMR分析(图8),探究其所含的H质子在PEF作用下的变化情况。通过对比经过电场频率为1 800 Hz和电场强度为15 kV/cm处理后的样品与未处理的样品,发现H的化学位移基本相同,表明经过PEF处理后并未有处于新的化学环境的 1H产生;但是在相同化学位移处,其吸收峰的面积却有着较为显著的改变,表明经过PEF处理后该 1H所处的化学环境转变为另一种已经存在的化学环境 [25-30]。因此,推断PEF处理可能破坏色氨酸的氢键从而降低QWFM的荧光强度。
综上所述,本身具有荧光性的QWFM和KWFM抗氧化四肽在经过PEF处理后,其荧光特性会发生变化,并且随着处理后贮藏时间的增加,荧光强度的改变减少。QWFM对微环境的变化比较敏感,当改变高压脉冲电场处理条件时,QWFM的荧光强度变化较为显著,在电场频率为1 800Hz和电场强度为15 kV/cm的处理条件下,其荧光强度变化最显著。相对于QWFM而言,KWFM由于结构较为稳定,改变PEF处理条件,其荧光特性的变化并不显著。通过CD的分析和 1H-NMR技术分析发现QWFM的β-折叠结构含量有所减少,维持β-折叠的氢键也有所变化。对于蛋白而言,PEF处理可以使蛋白质分子二级结构和三级结构发生变化,从而引起食品的抗氧化活性等一系列变化。通过PEF作用于抗氧化肽荧光特性的探究,我们能够更加合理的对抗氧化肽进行改造,不仅为进一步研究抗氧化肽提供新的思路,也为PEF能够更广泛地应用打下基础。
参考文献:
[1] 张若兵, 陈杰, 肖健夫, 等. 高压脉冲电场设备及其在食品非热处理中的应用[J]. 高电压技术, 2011, 37(3): 777-786. DOI:10.13336/ j.1003-6520.hve.2011.03.002.
[2] MERTENS B, KNORR D. Development of nonthermal process for food preservation[J]. Food Technology, 1992, 5(5): 124-133.
[3] CASTRO A J, BARBOSA-CANOVAS G V, SWANSON B G. Inactivation of foods by pulsed electric fields[J]. Journal of Food Processing and Preservation, 1993, 17(1): 47-73. DOI:10.1111/j.1745-4549.1993.tb00225.x.
[4] KNORR D, GEULEN M, GRAHL T, et al. Food application of high electric fi eld pulses[J]. Trends in Food Science and Technology, 1994, 5(3): 71-75. DOI:10.1016/0924-2244(94)90240-2.
[5] JEYAMKONDAN S, JAYAS D S, HOLLEY R A. Pulsed electric field processing of foods: a review[J]. Journal of Food Protection, 1999, 62(9): 1088-1096. DOI: 10.4315/0362-028X-62.9.1088.
[6] YEOM H W, ZHANG Q H, DUNNE C P. Inactivation of papain by pulsed electric fi eld in a continuous system[J]. Food Chemistry, 1999, 67(1): 53-59. DOI:10.1016/S0308-8146(99)00109-0.
[7] 赵伟. 高压脉冲电场在液态蛋杀菌中的应用及其对微生物和蛋白质的作用机制[D]. 无锡: 江南大学, 2009: 9-10.
[8] 钟葵, 孙志健, 廖小军, 等. 高压脉冲电场对辣根过氧化物酶活性及构象的影响效果[J]. 中国食品学报, 2005, 5(1): 31-36. DOI:10.16429/j.1009-7848.2005.01.005.
[9] 李顺子, 孙学军, 阎虎生, 等. 蜂毒肽及其类似物的抗菌活性、溶血活性及与磷脂膜的作用[J]. 高等化学学报, 2005, 26(1): 73-77.
[10] LEONG S Y, OEY I. Effect of pulsed electric field treatment on enzyme kinetics and thermostability of endogenous ascorbic acid oxidase in carrots[J]. Food Chemistry, 2014, 146: 538-547.
[11] LEE D L, MANT C T, HODGES R S. A novel method to measure self-association of small amphipathic molecules-temperature prof i ling in reversed-phase chromatography[J]. Journal of Biological Chemistry, 2003, 278(25): 22918-22927. DOI:10.1074/jbc.M301777200.
[12] 张明镝, 姜源, 李雄, 等. 高压脉冲电场技术提高红松籽抗氧化肽活性[J]. 农业工程学报, 2015, 31(14): 272-277.
[13] 田美玲, 方婷, 杜木英, 等. 高压脉冲电场对葡萄糖淀粉酶活化的研究[J]. 现代食品科技, 2015, 31(8): 247-253 DOI:10.13982/ j.mfst.1673-9078.2015.8.039.
[14] 徐彩娜, 殷涌光, 王二雷, 等. 卵黄高磷蛋白及其磷酸肽稳定性和抗氧化性[J]. 吉林大学学报(工学版), 2013, 43(2): 544-549. DOI:10.13229/j.cnki.jdxbgxb2013.02.011.
[15] SHARMA S C, ARMAND T, BALL K A, et al. A Facile method for expression and purif i cation of 15N isotope-labeled human Alzheimer’s β-amyloid peptides from E. coli for NMR-based structural analysis[J]. Protein Expression & Purif i cation, 2015, 116: 82-89.
[16] 王守业, 徐小龙, 刘清亮, 等. 荧光光谱在蛋白质分子构象研究中的应用[J]. 化学进展, 2001, 13(4): 257-260.
[17] GRAHL T, MARKL H. Killing of micro-organisms by pulsed electric fi elds[J]. Applied Microbiology and Biotechnology, 1996, 45(1): 148-157.
[18] 胡勇, 扶雄, 陈旭东, 等. 聚乙二醇与蛋白质相互作用的荧光和共振散射光谱研究[J]. 现代食品科技, 2009, 25(4): 353-357. DOI:10.13982/j.mfst.1673-9078.2009.04.004.
[19] YAN X J, WU G Q, XU X D, et al. Novel peptide targeting MDAMB-231 breast cancer by fluorescence imaging[J]. Phamaceutical Biotechnology, 2014, 21(6): 498-505.
[20] 王守业, 余华明, 陈真龙, 等. 生物化学与生物物理学报, 1998, 30(3): 303-306.
[21] JAFARI-AGHDAM J, KHAJEH K, RANJBAR B, et al. Deglycosylation of glucoamylase from Aspergillus niger: effects on structure, activity andstability[J]. Biochimica et Biophysica Acta-Proteins and Proteomics, 2005, 1750(1): 61-68. DOI:10.1016/j.bbapap.2005.03.011.
[22] 殷涌光, 张铁华, 刘静波, 等. 高压脉冲电场(PEF)对溶菌酶抑菌活性的影响[J]. 吉林大学学报(工学版), 2008, 38(6): 1485-1488. DOI:10.13229/j.cnki.jdxbgxb2008.06.009.
[23] ZHAO W, YANG R. Effect of high-intensity pulsed electric fields on the activity, conformation and self-aggregation of pepsin[J]. Food Chemistry, 2009, 114(3): 777-781. DOI:10.1016/ j.foodchem.2008.10.016.
[24] HUANG Y B, WANG X F, WANG H Y, et al. Studies on mechanism of action of anticancer peptides by modulation of hydrophobicity within a def i ned structural framework[J]. Molecular Cancer Therapeutics, 2011, 10(3): 416-426. DOI:10.1158/1535-7163.MCT-10-0811.
[25] TAMBURRO A M, BRIGIDA B, ANTONIETTA P. Dissection of human tropoelastin: exon-by-exon chemical synthesis and related conformational studies[J]. Biochemistry, 2003, 42(45): 13347-13362. DOI:10.1021/bi034837t.
[26] NAGAO T, MISHIMA D, JAVKHLANTUGS N, et al. Structure and orientation of antibiotic peptide alamethicin in phospholipid bilayers as revealed by chemical shift oscillation analysis of solid state nuclear magnetic resonance and molecular dynamics[J]. Nature Communication, 2015, 1848(11): 2789-2798. DOI:10.1016/ j.bbamem.2015.07.019.
[27] LIU P Y, COOKS R G, CHEN H. Nuclear magnetic resonance structure elucidation of peptide b(2) ions[J]. Angewandt Chemie-Internationale Edition, 2015, 54(5): 1547-1550. DOI:10.1002/anie.201410250.
[28] EDDY M T, YU T Y. Membranes, peptides, and disease: unraveling the mechanisms of viral proteins with solid state nuclear magnetic resonance spectroscopy[J]. Solid State Nuclear Magnetic Resonance, 2014, 61/62: 1-7. DOI:10.1016/j.ssnmr.2014.04.002.
[29] HOWARD M J. Sample preparation procedures for high-resolution nuclear magnetic resonance studies of aqueous and stabilized solutions of therapeutic peptides[J]. Methods in Molecular Biology, 2005, 308:461-469.
[30] GALANAKIS P, BAZOTI F, BERGQUIST J, et al. Study of the Interaction between the amyloid beta peptide (1-40) and antioxidant compounds by nuclear magnetic resonance spectroscopy[J]. Biopolymers, 2011, 96(3): 316-327. DOI:10.1002/bip.21558.
Effect of Pulsed Electric Field (PEF) on Fluorescence Characteristics of Antioxidant Peptides
WANG Ying
1, LIU Jingbo
2, XING Jie
2, LI Xingfang
2, Yin Yongguang
1,*
(1. College of Biological and Agricultural Engineering, Jilin University, Changchun 130025, China; 2. College of Food Science and Engineering, Jilin University, Changchun 130062, China)
Abstract:Two antioxidant peptides obtained in our previous work, Gln-Trp-Phe-Met (QWFM, 652.78) and Lys-Trp-Phe-Met (KWFM, 610.78), were used to explore the effect of pulsed electric fi eld (PEF) on their fl uorescence intensity. The results showed that the fl uorescence intensity of both antioxidant peptides, which differed by N-terminal amino acid residues, especially QWFM, was changed after PEF treatment. The most signif i cant change in fl uorescence intensity of QWFM was observed at electric pulse frequency of 1 800 Hz and fi eld intensity of 15 kV/cm. The fl uorescence intensity of antioxidant peptides decreased as time elapsed after PEF treatment. The circular dichroism (CD) and nuclear magnetic resonance (NMR) spectra showed changed hydrogen bonds maintaining the β-sheet in QWFM and thus reduced β-sheet content. These results suggested that the chemical structure of antioxidant peptides and consequently their properties could be changed by PEF, which will provide a theoretical foundation for further exploitation and utilization of antioxidant peptides.
Key words:pulsed electric fi eld (PEF); antioxidant peptide; fl uorescence intensity; chemical structure
DOI:10.7506/spkx1002-6630-201703009
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)03-0053-06
引文格式:
王莹, 刘静波, 邢杰, 等. 基于高压脉冲电场技术对抗氧化肽荧光特性的研究[J]. 食品科学, 2017, 38(3): 53-58. DOI:10.7506/spkx1002-6630-201703009. http://www.spkx.net.cn
WANG Ying, LIU Jingbo, XING Jie, et al. Effect of pulsed electric fi eld (PEF) on fl uorescence characteristics of antioxidant peptides[J]. Food Science, 2017, 38(3): 53-58. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703009. http://www.spkx.net.cn
收稿日期:2016-05-09
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102206-5)
作者简介:王莹(1984—),女,博士研究生,研究方向为食源性抗氧化活性肽。E-mail:jinkuang8499@163.com
*通信作者:殷涌光(1949—),男,教授,博士,研究方向为农产品精深加工。E-mail:biofood@jlu.edu.cn