 ±s表示,组间差异比较采用t检验。
±s表示,组间差异比较采用t检验。
毛 晶,王 鹏,王祖浩,方 丽,王 辑,闵伟红*
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
摘 要:利用碱性蛋白酶酶解制备松仁谷蛋白水解物,采用超滤、Sephadex G-25、Sephadex G-15及反相高效液相色谱对酶解物进行分离纯化,并利用质谱进行结构鉴定。对质谱结果进行从头测序,筛选得到两种抗氧化肽肽段Glu-Leu-Leu-Lys-Leu-His(ELLKLH)、Glu-Lys-Asp-Phe-His-Leu(EKDFHL)。经固相合成后得到纯度分别为99.67%和95.15%的肽段,对其进行抗氧化活性测定。结果表明,在浓度为1 000 μmol/mL时,ELLKLH和EKDFHL的1,1-二苯基-2-三硝基苯肼自由基清除率分别为38.26%和29.54%,铁离子螯合率分别为56.44%和48.66%。
关键词:松仁谷蛋白;分离纯化;结构鉴定
松子(Semen Pini Koraiensis)为松科植物油松、红松等球果 [1-2]。松仁是其可食用部分,富含不饱和脂肪酸、蛋白质、维生素、矿物质等,营养价值高。一直以来开发利用仅限于直接食用和榨油,对于榨油的副产品蛋白资源的利用较少,因此对松仁蛋白进行高效利用具有重要意义 [3]。
自由基在人体内由正常的生理活动产生,过多会引发一系列慢性疾病如衰老、癌症和心血管疾病等。近年来,从动物或植物中得到的蛋白水解物,表现出很强的抗氧化活性,如清除自由基、螯合金属离子等 [4-6]。肽类物质的分离纯化常用方法主要有以下几种:超滤法、凝胶过滤色谱法、离子交换色谱法以及高效液相色谱法等。通常采用单一的分离纯化手段不能达到理想的分离效果,普遍采用多种分离技术联用的手段 [7]。随着质谱技术的发展,越来越多的肽段被鉴定出来。生物活性肽通常含有3~20 个氨基酸残基,它们的活性都是基于它们的分子大小、氨基酸组成和序列 [8-9]。通常认为具有供氢或供电子能力的氨基酸残基如酪氨酸(Tyr)、色氨酸(Trp)、半胱氨酸(Cys)、蛋氨酸(Met)及组氨酸(His)等具有清除自由基的能力,疏水性的氨基酸残基如亮氨酸(Leu)、苯丙氨酸(Phe)能够增强肽抑制脂质过氧化的能力,而酸性氨基酸残基如谷氨酸(Glu)、天冬氨酸(Asp)及碱性氨基酸残基如组氨酸(His)、赖氨酸(Lys)具有螯合金属离子的能力。此外,甘氨酸(Gly)及脯氨酸(Pro)等也被报道对肽的抗氧化活性具有一定的贡献 [10-11]。
本实验通过酶解松仁谷蛋白得到具有抗氧化活性的多肽,对其进行分离纯化和结构分析,得到具有高抗氧化活性的序列,并验证其活性,为长白山松子资源的深度开发和综合利用提供基础数据和科学参考。
1.1 材料与试剂
松子来源于长白山地区红松;松仁谷蛋白(蛋白含量77.54%)为实验室自制。
碱性蛋白酶Alcalase 2.4 L 丹麦诺维信公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、菲洛嗪、Sephadex G-25、Sephadex G-15 美国Sigma公司;其他均为国产分析纯。
1.2 仪器与设备
UV-1700型紫外-可见分光光度计 日本岛津公司;ZY-1000切向流超滤系统 上海紫裕生物科技有限公司;HD-21-88紫外检测器 上海琪特分析仪器有限公司;DBS全自动部分收集器 上海嘉鹏科技有限公司;BSA224S型分析天平 北京赛多利斯科学仪器仪器有限公司;FD-1B-50型冷冻干燥机 北京博医康实验仪器有限公司;1200系列高效液相色谱仪 美国Agilent公司;SPECTRA-MAX190型酶标仪 美国Molecular Devices公司;Q Exactive四极杆-轨道阱高分辨质谱仪 美国Thermo Fisher Scientif i c公司。
1.3 方法
1.3.1 松仁谷蛋白的提取
松仁分离蛋白通过碱溶酸沉法制备。脱脂松子→碱提(1 mol/L NaOH,等电点9.8)→离心(5 000 r/min,10 min)→取上清液→酸沉(调至pH 4.8)→沉淀→离心(5 000 r/min,10 min)→取沉淀→水洗3 次→调pH 7.0→冷冻干燥→松子分离蛋白。
根据Osborne法 [12-15]提取谷蛋白。
1.3.2 松仁谷蛋白酶解物的制备
采用优化后得出的最优酶解条件,配制底物质量分数4%的蛋白悬液,以加酶量7 100 U/g(以底物计)加入碱性蛋白酶,酶解时间180 min,酶解温度50.5 ℃,酶解pH 9.5,制备具有抗氧化活性的酶解产物 [16-17]。
1.3.3 超滤处理
将蛋白水解产物用切向流超滤系统及Biomax改良聚醚砜复合膜包进行超滤处理,分别采用膜分子截流分子质量为10 kD和3 kD的超滤膜进行分离,得到大于10 kD、3~10 kD、小于3 kD 3种分子质量的水解产物,分别收集,冻干,测定活性。
1.3.4 抗氧化活性测定
铁离子螯合能力的测定:参照Lee等 [18]的方法;DPPH自由基清除能力测定:参照Xie Zhengjun等 [19]的方法;ABTS +·清除能力的测定:参照Kong Baohua等 [20]方法;蛋白含量的测定:采用福林-酚法 [21-24]。
1.3.5 Sephadex G-25凝胶层析
将超滤得到的抗氧化活性最强组分,配成30 mg/mL溶液,过0.22 μm滤膜。采用Sephadex G-25葡聚糖凝胶柱(1.6 cm×80 cm)进行分离,上样量3 mL,洗脱液为蒸馏水,洗脱流速0.5 mL/min,于280 nm波长处检测,并收集组分。将分离得到的组分收集冻干,测定抗氧化活性。
1.3.6 Sephadex G-15凝胶层析
将1.3.5节抗氧化活性最强组分,配成30 mg/mL溶液,过0.22 μm滤膜。采用Sephadex G-15葡聚糖凝胶柱(1.6 cm×80 cm)进行分离,上样量3 mL,以蒸馏水为洗脱液,洗脱流速0.5 mL/min,于280 nm波长处检测,收集组分,将其冻干,测定抗氧化活性。
1.3.7 反相高效液相色谱分析
取1.3.6节抗氧化活性较强的冻干样品,配成10 mg/mL溶液,过0.22 μm滤膜。于1200液相色谱仪进一步分离纯化,色谱柱:Diamonsil C 18(250 mm×4.6 mm,5 μm);流动相A:双蒸水+0.1%三氟乙酸,流动相B:乙腈+0.1%三氟乙酸),上样量40 μL。洗脱流速0.5 mL/min,检测波长220 nm,柱温30 ℃。洗脱条件:0~30 min,95%~72% A;30~50 min,72% A;50~60 min,72%~95% A。按图谱上的峰收集各组分,多次上样、收集后冻干、验证,测定各组分抗氧化活性。
1.3.8 质谱鉴定
冻干的样品用50 μL A相(5%乙腈+0.1%三氟乙酸溶液)重溶,15 000×g离心15 min后,取上清液置入进样瓶,进行在线液相色谱-质谱联用分析。色谱系统为nano ACQUITYUPLC,与色谱相连的质谱为Q Exactive四极杆-轨道阱高分辨质谱仪。样品先以10 μL/min的流速将其结合在trap柱上(PepMap C 18柱,100 μm×2 cm,3 μm),然后再在分析柱(Acclaim PepMap C 18柱,75 μm×15 cm)上进行分离。B相为(100%乙腈+0.1%三氟乙酸),流速为300 nL/min。梯度分离条件为:0~40 min B相溶液体积分数由5%升高至45%,40~45 min由45%线性增加至80%,45~50 min保持80%不变,50~60 min由80%降至5%。质谱采用正离子模式扫描,扫描范围m/z 400~1 800(质谱检测由上海易算生物科技有限公司完成)。
1.3.9 松仁谷蛋白抗氧化肽的合成
纯度为99.67%和95.15%的2种抗氧化肽由北京中科亚光生物科技有限公司合成。
1.4 数据分析
采用SPSS 16.0软件进行数据统计处理,数据以
 ±s表示,组间差异比较采用t检验。
±s表示,组间差异比较采用t检验。
2.1 超滤各组分抗氧化性活性比较
表1 超滤组分抗氧化活性
Table1 Antioxidant activity of the ultra fi ltration fractions
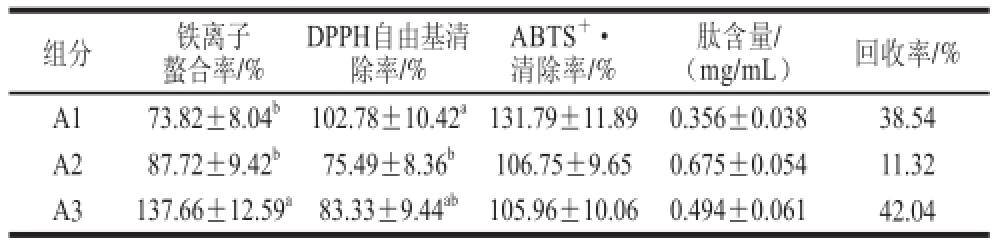
注:同列肩标小写字母不同表示不同分离组分的样品间具有显著性差异(P<0.05)。下同。
肽含量/(mg/mL)回收率/%组分铁离子螯合率/% DPPH自由基清除率/% ABTS +·清除率/% A173.82±8.04 b102.78±10.42 a131.79±11.890.356±0.03838.54 A287.72±9.42 b75.49±8.36 b106.75±9.650.675±0.05411.32 A3137.66±12.59 a83.33±9.44 ab105.96±10.060.494±0.06142.04
松仁谷蛋白水解物经超滤分离得到3 个组分,分别为A1(<3 kD)、A2(3~10 kD)、A3(>10 kD),测定其肽含量。冻干后配成质量浓度为4 mg/mL溶液测定抗氧化活性。由表1可知,A1组分DPPH自由基清除率为102.78%,ABTS +·清除率为131.79%,均高于另外两个组分。A3铁离子螯合率高于A1和A2。综合考虑选择A1组分进行下一步纯化。
2.2 Sephadex G-25分离
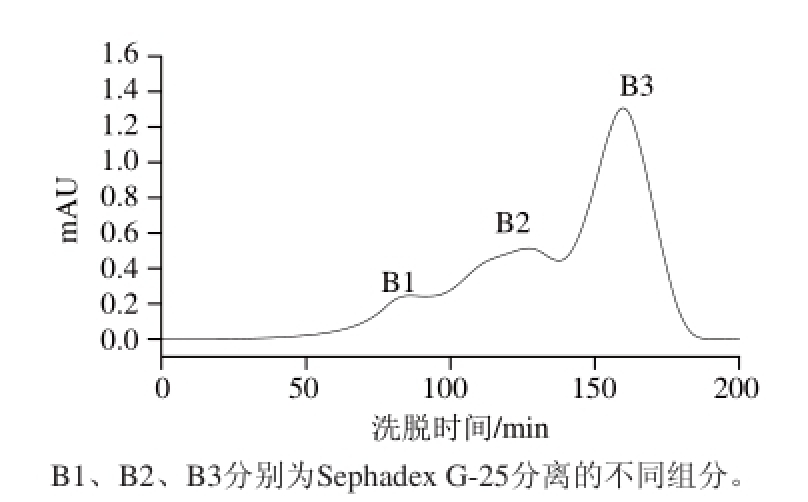
图1 Sephadex G-25凝胶层析图谱
Fig.1 Sephadex G-25 chromatogram
由图1可知,A1组分经Sephadex G-25葡聚糖凝胶层析分离后得到3 个组分,分别为B1、B2、B3。将其配制成质量浓度为5 mg/mL的溶液,并比较3 个组分的抗氧化活性,见表2。
表2 Sephadex G-25分离抗氧化活性肽组分抗氧化活性
Table2 Antioxidant activity of peptides isolated on Sephadex G-25 column

组分铁离子螯合率/% DPPH自由基清除率/% ABTS +·清除率/%肽含量/(mg/mL)回收率/% B161.65±6.48 b65.50±6.45260.53±20.05 0.356±0.04221.43 B247.69±5.02 b59.20±6.03233.01±19.56 0.382±0.03132.64 B384.03±8.46 a69.87±7.11244.75±19.63 0.406±0.04520.13
由表2可见,B3组分的铁离子螯合率为84.03%,DPPH自由基清除率为69.87%,均高于另外两组。B1组分的ABTS +·清除率最高。综合考虑选择B3组分进行下一步纯化。
2.3 Sephadex G-15分离

图2 Sephadex G-15葡聚糖凝胶层析图谱
Fig.2 Sephadex G-15 chromatogram
由图2可知,B3组分经Sephdex G-15分离后得到两个组分,分别收集冻干,配制成质量浓度为5 mg/mL的溶液,并比较2 个组分的抗氧化活性,见表3。
表3 Sephadex G-15分离抗氧化活性肽组分抗氧化活性
Table3 Antioxidant activity of peptides isolated on Sephadex G-15 column

组分铁离子螯合率/% DPPH自由基清除率/% ABTS +·清除率/%肽含量/(mg/mL)回收率/% C1108.43±9.8544.47±4.43127.56±11.360.721±0.08628.45 C2153.68±14.6988.12±9.02176.64±16.360.56±0.06432.86
C2组分的铁离子螯合率为153.68%,DPPH自由基清除率为88.12%,ABTS +·清除率为176.64%,均高于C1组分,所以选择C2组分进行下一步纯化。
2.4 反相高效液相色谱分离
图3为C2组分的反相高效液相色谱图谱,C2组分经液相色谱分离后,选取了其中响应值较高、分离度较好的5 个组分进行收集,分别为F1、F2、F3、F4、F5。对以上5 个组分进行收集冻干,并配制成0.5 mg/mL的溶液进行抗氧化性质测定。
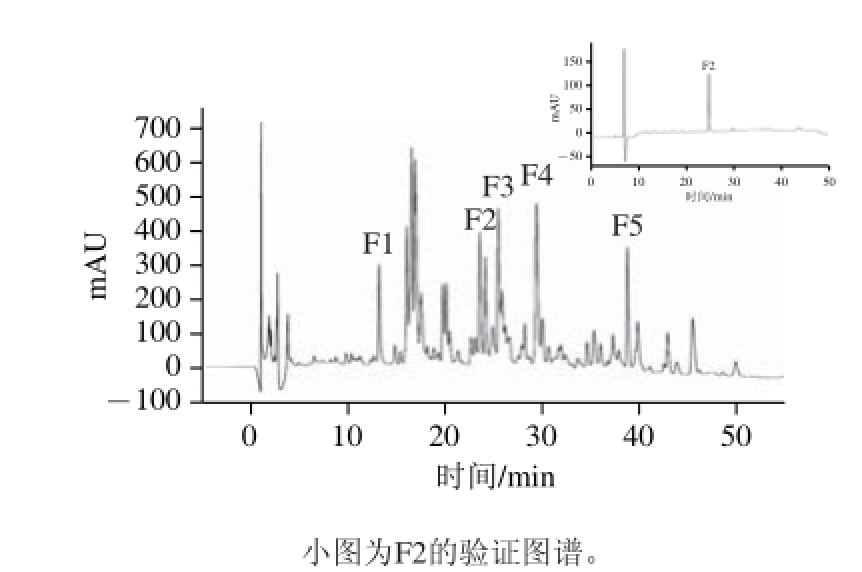
图3 C2组分反相高效液相色谱 分析图谱
Fig.3 RP-HPLC analysis of fraction C2
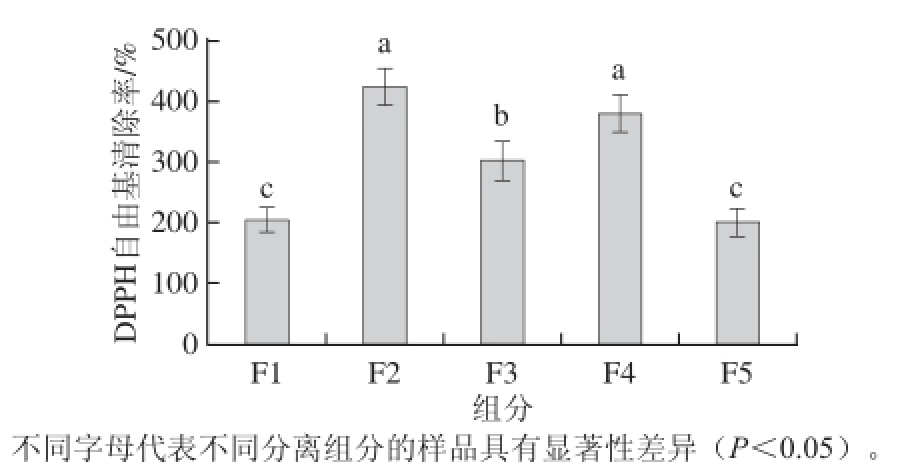
图4 液相色谱组分DPPH自由基清除率比较
Fig.4 Comparison of DPPH radical scavenging rates of the fractions isolated by RP-HPLC
对液相色谱分离后得到的5 个组分进行DPPH自由基清除率测定,结果见图4,F2组分的DPPH自由基清除率达424.86%,高于其他各组分,所以选择F2组分进行下一步纯化(F2组分的肽含量为0.003 mg/mL,回收率为0.26%)。
2.5 质谱鉴定结果

图5 F2组分的一级质谱
Fig.5 Mass spectrum of fraction F2
经过一级质谱(图5)和二级质谱,获得片段的质荷比(m/z),通过从头测序(de novo sequence)的方法对F2组分进行分析 [25-32],以质谱的可信度及抗氧化肽的构效关系为标准对得到的肽段序列进行筛选。结果得到2 种多肽,氨基酸序列分别为Glu-Leu-Leu-Lys-Leu-His(ELLKLH)、Glu-Lys-Asp-Phe-His-Leu(EKDFHL),见图6。
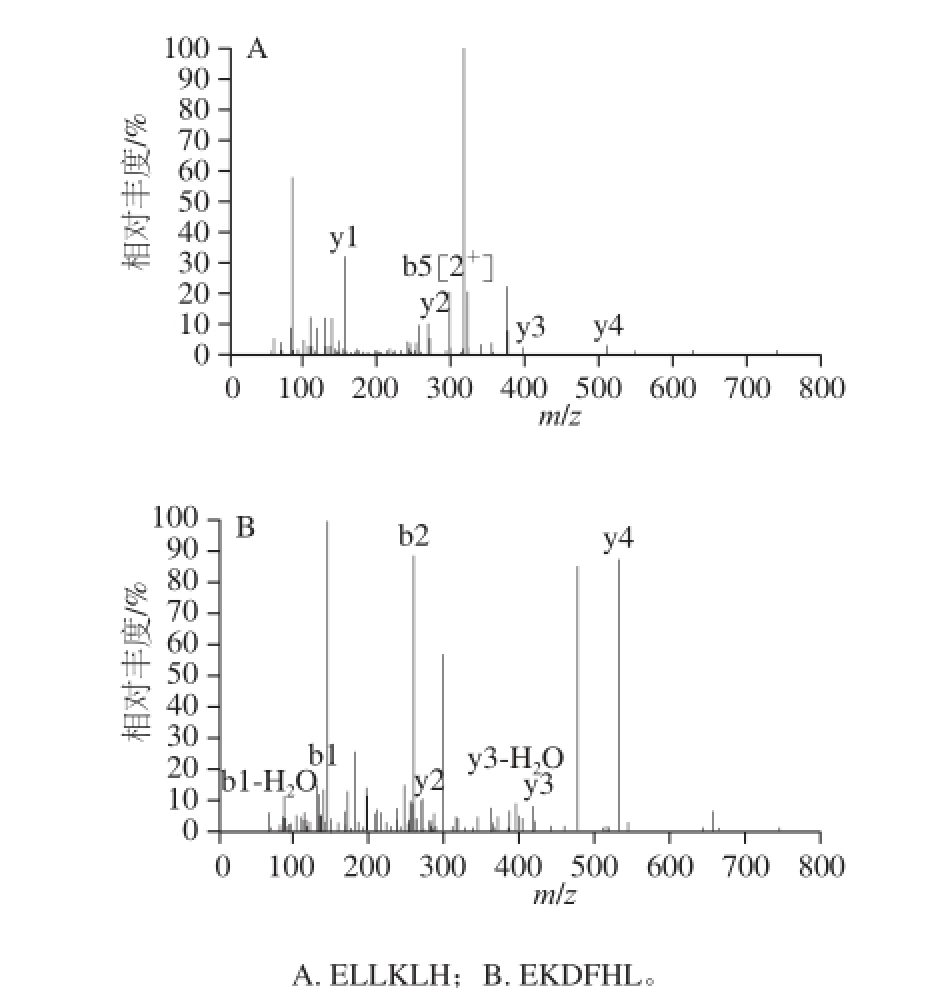
图6 ELLKLH和EKDFHL的二级质谱图
Fig.6 Tandem mass spectrum of ELLKLH and EKDFHL
2.6 合成肽的活性
ELLKLH和EKDFHL两种多肽由北京中科亚光生物科技有限公司合成,分子质量分别为751.93 D和787.88 D,纯度为99.67%和95.15%。并对合成后的肽进行DPPH自由基清除率及铁离子螯合率的测定,见图7。
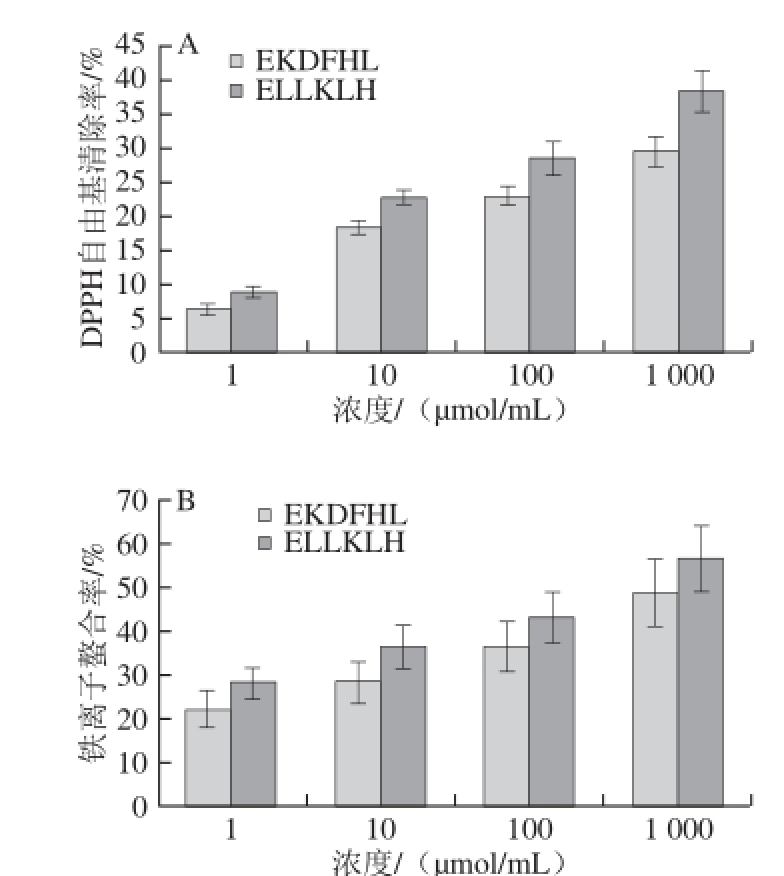
图7 EKDFHL和ELLKLH的DPPH自由基清除率(A)和铁离子螯合率(BB)
Fig.7 DPPH radical scavenging rates (A) and iron ion chelating rates (B) of EKDFHL and ELLKLH
由图7可知,两种多肽都具有DPPH自由基清除能力及铁离子螯合能力,且随着浓度上升抗氧化能力增强。ELLKLH的DPPH自由基清除能力和铁离子螯合能力具均高于EKDFHL。
本研究通过酶解松仁谷蛋白获得高抗氧化活性的酶解产物。利用超滤系统、Sephadex G-25、Sephadex G-15和反相高效液相色谱分离纯化得到液相组分F2,该组分DPPH自由基清除率达到424.86%。应用Q Exactive四极杆-轨道阱高分辨质谱仪对组分F2进行结构鉴定。最终鉴定出2 种多肽氨基酸序列为Glu-Leu-Leu-Lys-Leu-His(ELLKLH)和Glu-Lys-Asp-Phe-His-Leu(EKDFHL),分子质量分别为751.93 D和787.88 D。经固相合成2 种多肽,纯度达到99.67%和95.15%。结果显示:在浓度为1 000 μmol/mL时,ELLKLH和EKDFHL的DPPH自由基清除率分别为38.26%和29.54%,铁离子螯合率分别为56.44%和48.66%。
参考文献:
[1] 陈宝. 松子的开发与利用[J]. 现代农业科技, 2010, 26(20): 160. DOI:10.3969/j.issn.1007-5739.2010.20.101.
[2] 徐鑫, 毛文东, 刘国艳, 等. 松仁营养成分及松子油理化性质和活性成分分析[J]. 营养学报, 2014, 36(10): 99-101.
[3] 冷帅辰. 长白山松仁抗氧化肽的制备、分离纯化及鉴定[D]. 长春:吉林农业大学, 2015: 2-3.
[4] PAN X, ZHAO Y Q, HU F Y, et al, Preparation and identif i cation of antioxidant peptides from protein hydrolysate of skate (Raja porosa) cartilage[J]. Journal of Functional Foods, 2016, 25(1): 220-230. DOI:10.1016/j.jff.2016.06.008.
[5] JAISWAL A, KUMAR S, ENJAMOORI R, et al. Peripheral benzodiazepine receptor ligand Ro5-4864 inhibits isoprenaline-induced cardiac hypertrophy in rats[J]. European Journal of Pharmacology, 2010, 644(1/2/3): 146-153. DOI:10.1016/j.ejphar.2010.06.058.
[6] UMAYAPARVATHI S, MEENAKSHI S, VIMALRAJ V, et al, Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata)[J]. Biomedicine & Preventive Nutrition, 2014, 4(3): 343-353. DOI:10.1016/j.bionut.2014.04.006.
[7] 李娇娇. 鹅骨抗氧化肽的酶解工艺优化及其分离纯化的研究[D]. 雅安: 四川农业大学, 2013: 1-11.
[8] 于志鹏. 蛋清源活性肽的结构鉴定及生物活性研究[D]. 长春: 吉林大学, 2014: 20-24.
[9] 张昊, 任发政. 天然抗氧化肽的研究进展[J]. 食品科学, 2008, 29(4):443-447. DOI:10.3321/j.issn:1002-6630.2008.04.100.
[10] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D]. 广州: 华南理工大学, 2015: 11-17.
[11] 张晖. 抗氧化肽的构效关系研究进展[J]. 食品与生物技术学报, 2013, 32(7): 673-679. DOI:10.3969/j.issn.1673-1689.2013.07.001.
[12] 吴丹. 长白山松子蛋白质功能性质研究和降血压活性肽制备纯化及结构鉴定[D]. 长春: 吉林农业大学, 2015: 8-10.
[13] 王艳玲. 米糠中四种蛋白的提取工艺及特性研究[D]. 哈尔滨: 东北农业大学, 2013: 9-35.
[14] 孙媛, 蔡迪, 向琴, 等. 麦麸中四种蛋白的Osborne法提取分离及性能研究[J]. 食品工业科技, 2015, 36(9): 136-139.
[15] 孙媛. 改良Osborne法分级分离四种小麦蛋白的研究[D]. 广州: 华南理工大学, 2015: 18-37.
[16] 王胜男, 江连洲, 李杨, 等. 响应面法优化水酶法提取松子蛋白的研究[J]. 食品工业科技, 2012, 33(6): 356-359.
[17] 冷帅辰. 长白山松子抗氧化肽制备及活性研究[J]. 食品研究与开发, 2014, 35(13): 9-12. DOI:10.3969/j.issn.1005-6521.2014.13.003.
[18] LEE Y L, YEN M T, MAU J L. Antioxidant properties of various extracts from Hypsizigus marmoreus[J]. Food Chemistry, 2007, 104(1): 1-9. DOI:10.1016/j.foodchem.2006.10.063.
[19] XIE Zhengjun, HUANG Junrong, XU Xueming, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry, 2008, 111(2): 370-376. DOI:10.1016/ j.foodchem.2008.03.078.
[20] KONG Baohua, XIONG Youling L.. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 6059-6068. DOI:10.1021/jf060632q.
[21] 邱学伟, 杨培民, 代龙, 等. 福林酚比色法测定水蛭仿生酶解小肽的含量[J]. 医学信息, 2011, 24(5): 2557-2558.
[22] LOWRY O H. 福林酚试剂法测定蛋白质[J]. 食品与药品, 2011, 13(2): 147-151. DOI:10.3969/j.issn.1672-979X.2011.02.022.
[23] 林玉珍. 透明质酸钠中蛋白质含量测定方法的比较[J]. 生物技术世界, 2013, 5(6): 6.
[24] 李焰. 银杏叶复方对脾虚证小鼠细胞因子、免疫球蛋白和血浆内几种神经肽含量的影响[J]. 东北农业大学学报, 2012, 43(6): 82-87. DOI:10.3969/j.issn.1005-9369.2012.06.018.
[25] 孙汉昌. 蛋白质组质谱数据处理关键问题与技术研究[D]. 长沙: 国防科学技术大学, 2011: 1-32.
[26] 谢寒冰, 周明莹, 赵海峰, 等. 高效液相色谱-四极杆飞行时间质谱法同时检测豆芽中的3 种外源植物激素残留[J]. 色谱, 2014, 32(5):493-498. DOI:10.3724/SP.J.1123.2013.12029.
[27] 池玉梅, 李瑶, 张瑜, 等. 超高效液相色谱-四极杆串联飞行时间质谱分析黄酮类化合物及小毛茛茎叶的成分[J]. 色谱, 2013, 32(9): 838-844. DOI:10.3724/SP.J.1123.2013.01009.
[28] 甄艳, 施季森. 质谱技术在蛋白质组学研究中的应用[J]. 南京林业大学学报(自然科学版), 2011, 35(1): 103-108. DOI:10.3969/ j.issn.1000-2006.2011.01.024.
[29] 孔宏伟, 戴伟东, 许国旺. 基于液相色谱-质谱联用的代谢组学研究中代谢物的结构鉴定进展[J]. 色谱, 2014, 32(10): 1052-1057. DOI:10.3724/SP.J.1123.2014.05017.
[30] 赵妍, 邵兵, 张晶. 超高效液相色谱-四极杆-飞行时间质谱法快速筛查牛奶中的农药和兽药残留[J]. 色谱, 2012, 30(6): 560-567. DOI:10.3724/SP.J.1123.2012.02021.
[31] EVARISTO G P C, PINKSE M W H, CHEN T B, et, al. De novo sequencing of two novel peptides homologous to calcitoninlike peptides, from skin secretion of the Chinese Frog, Odorrana schmackeri[J]. EuPA Open Proteomics, 2015, 8(59): 157-166. DOI:10.1016/j.euprot.2015.07.008.
[32] MANZOOR A, ULABDIN Z, WEBB B A, et al. De novo sequencing and transcriptome analysis of female venom glands of ectoparasitoid Bracon hebetor (Say.) (Hymenoptera: Braconidae)[J]. Comparative Biochemistry and Physiology: Part D: Genomics and Proteomics, 2016, 20: 101-110. DOI:10.1016/j.cbd.2016.08.002.
Isolation, Purif i cation and Structural Analysis of Antioxidant Peptides Derived from Gluten in Pinus koraiensis Sieb.et Zucc Nut Kernels
MAO Jing, WANG Peng, WANG Zuhao, FANG Li, WANG Ji, MIN Weihong*
(National Engineering Laboratory on Wheat and Corn Further Processing, College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:In this work, the enzymatic hydrolysate of pine nut gluten produced with alkaline protease was isolated and purified by ultrafiltration, Sephadex G-25, Sephadex G-15 and reversed-phase high-performance liquid chromatography (RP-HPLC). The structural characteristics of the purif i ed fractions were identif i ed by Q Exactive hybrid quadrupole-Orbitrap mass spectrometry, and de novo sequencing was performed based on the mass spectral data. Two antioxidant peptides were obtained with amino acid sequence of Glu-Leu-Leu-Lys-Leu-His (ELLKLH) and Glu-Lys-Asp-Phe-His-Leu (EKDFHL), respectively. After solid-phase synthesis, the purity of the peptides was 99.67% and 95.15%, respectively. The results of antioxidant activities showed that the DPPH free radical scavenging rates of ELLKLH and EKDFHL at a concentration of 1 000 μmol/mL were 38.26% and 29.54%, respectively, and the iron ion chelating rates were 56.44% and 48.66%, respectively.
Key words:pine nut glutenin; isolation and purif i cation; structural identif i cation
DOI:10.7506/spkx1002-6630-201703010
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2017)03-0059-05
引文格式:
毛晶, 王鹏, 王祖浩, 等. 松仁谷蛋白抗氧化肽的分离纯化及一级结构鉴定[J]. 食品科学, 2017, 38(3): 59-63. DOI:10.7506/spkx1002-6630-201703010. http://www.spkx.net.cn
MAO Jing, WANG Peng, WANG Zuhao, et al. Isolation, purif i cation and structural analysis of antioxidant peptides derived from gluten in Pinus koraiensis Sieb.et Zucc nut kernels[J]. Food Science, 2017, 38(3): 59-63. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703010. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102206)
作者简介:毛晶(1990—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:980243889@qq.com
*通信作者:闵伟红(1971—),女,教授,博士,研究方向为发酵工程、粮油科学与深加工技术。E-mail:minwh2000@163.com