
胡兴鹏,周 华*,杜阳敏,欧仕益,晏日安
(暨南大学理工学院食品科学与工程系,广东 广州 510632)
摘 要:为明确蒜氨酸在水溶液中的热稳定性,研究了蒜氨酸水溶液的热分解动力学过程,拟合得到动力学参数:活化能为80.5 kJ/mol,指前因子为1.27×10 7。采用气相色谱-质谱联用方法检测蒜氨酸水溶液在不同反应温度条件下的热分解产物,发现随着反应温度的升高,二烯丙基二硫醚的含量由91.59%持续降低至53.62%,而二烯丙基三硫醚的含量则先增加后减少,二烯丙基四硫醚的含量始终呈增加趋势,说明高温可促进硫醚类化合物的断裂和重排。采用质谱和2,4-二硝基苯肼法分析液相产物,证实产物中含有S-烯丙基-L-半胱氨酸钠盐和丙酮酸。采用B 3LYP方法,在3-21+G(d,p)基组条件下,优化反应物与产物的结构,对蒜氨酸的分解过渡态进行理论计算,结合蒜氨酸的分解动力学以及热分解产物分析后初步推断出:蒜氨酸分解过程中会形成一个五元环的过渡中间体,而后发生Cope消除生成次硫酸与丙酮酸,次硫酸进一步反应,形成二烯丙基二硫醚与二烯丙基三硫醚等一系列产物。
关键词:蒜氨酸;动力学;大蒜;活化能
大蒜为百合科葱属(Allium sativum L.)的药食两用植物,具有丰富的营养成分以及重要的药用和食用价值 [1]。大蒜中的含硫化合物是大蒜风味与生物活性的重要来源 [2-4]。这些化合物包括烯丙基硫醚、阿霍烯、二噻烯等类型 [5],它们具有广泛的生物活性,如降血脂 [6-7]、抗糖尿病 [8-9]、抗菌 [10-11]、抗癌 [12-13]、免疫活性 [14-15]等。
从化学的角度说,大蒜挥发性含硫化合物的产生通常有两条途径:即蒜氨酸的酶催化 [16]和热分解 [17]。酶催化是指以蒜氨酸为底物,在蒜氨酸酶催化作用下转化生成大蒜素,大蒜素不稳定而分解生成挥发性含硫化合物,这一途径已有大量的研究 [16]。除酶催化外,蒜氨酸还可以通过热分解产生挥发性含硫化合物,这种方式不需要蒜氨酸酶参与。蒜氨酸在大于100 ℃的条件下,会直接发生水解或自由基重排反应,转化生成一系列的挥发性含硫物质。Freeman等 [18]通过向蒜氨酸的水溶液中充入NO气体(自由基),检测到了大蒜素的存在,间接证实自由基是引发蒜氨酸分解反应的重要因素。另外据Zhang Min等 [17]报道,蒜氨酸加热后,可能会产生抗氧化活性更强的含硫化学成分,如S-烯丙基-L-半胱氨酸(S-allylcysteine,SAC)、S-烯丙基巯基-L-半胱氨酸(S-allylmercaptocysteine,SAMC)等。如果蒜氨酸与葡萄糖混合加热,甚至可以产生含有牛奶气味的物质 [19]。
黑蒜是一种用新鲜的生蒜,带皮放在高温高湿的发酵箱里发酵后形成的新型食品。在黑蒜的加工过程中 [20-23],蒜氨酸不可避免地受到热和湿的双重影响。而对蒜氨酸在该发酵过程的变化探讨得不多,蒜氨酸的分解过程及机理更鲜有文献报道。本研究通过研究蒜氨酸分解动力学并结合理论计算,探讨蒜氨酸的分解机制,为大蒜的烹饪以及黑蒜加工提供理论依据。
1.1 材料与试剂
烯丙基溴(色谱纯)、L-半胱氨酸盐酸盐(98%)阿拉丁试剂(上海)有限公司;所有有机溶剂均为国产分析纯。
1.2 仪器与设备
7890/5975C气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪、高效液相色谱仪 美国安捷伦公司;Acculab ALC210电子天平 德国Sartorius公司;核磁共振仪 德国Bruker DRX-400公司。
1.3 方法
1.3.1 蒜氨酸的合成与检测
1.3.1.1 蒜氨酸的合成
蒜氨酸参考文献[24-25]方法合成。L-半胱氨酸盐酸盐7.9 g溶于200 mL水中,在0 ℃条件下不断搅拌并加入10 mL 30%的浓氨水。然后滴加10 mL烯丙基溴,搅拌24 h,浓缩溶液,用乙醇重结晶得到白色固体SAC。而后将上述物质溶于100 mL水中,在0 ℃条件下加入10 mL 30%的双氧水,反应24 h,浓缩溶液,重结晶即可得到蒜氨酸。
1.3.1.2 蒜氨酸的含量检测与分析
蒜氨酸用去离子水配成2 mol/L的水溶液,添加到装有冷凝管的两口烧瓶里,其中冷凝管顶端出口、烧瓶的出口盖上玻璃塞。然后,分别在120、140、160 ℃的油浴中加热,每1 h取样分析溶液中的蒜氨酸含量。蒜氨酸含量的分析见参考文献[26-29]。样品中的蒜氨酸含量采用高效液相色谱(high performance liquid chromatography,HPLC)分析,色谱条件为:流动相为甲醇-H 2O(80∶20,V/V)溶液;流速为0.8 mL/min;C 18色谱柱(4.6 mm×250 mm,5 μm);紫外检测波长254 nm;进样量10 μL。
1.3.2 蒜氨酸热分解产物分析
按1.3.1.2节中方法,使样品分别在120、140、160 ℃油浴反应5 h,而后用正己烷萃取样品。采用GC-MS分析其挥发性分解产物的组成,GC分析条件为:色谱柱DB-1701(30 mm×0.25 mm,0.25 μm);进样量1.0 μL;扫描时间3.89 s;氦气流速0.8 mL/min;柱温箱升温程序为:初始温度45 ℃,保持5 min;以6 ℃/min升温到90 ℃,以10 ℃/min升温到180 ℃,以10 ℃/min升温到220 ℃,保持20 min。MS分析条件:电子能量:70 eV;质谱扫描范围30~350 u。
萃取完的水溶液,经过滤后,用NaOH、HCl调节pH值至中性,之后向溶液中加入0.1 mL质量分数为1‰的2,4-二硝基苯肼溶液,采用分光光度计在520 nm波长处测定吸光度,检验液相产物丙酮酸是否存在 [22]。
1.3.3 蒜氨酸热分解的动力学分析
以蒜氨酸水溶液浓度与初始浓度比值的自然对数为纵坐标,以时间为横坐标作图,获得动力学常数,由公式(1)计算。将动力学常数k,代入公式(2)计算活化能与指前因子等参数。

式中:C 0为蒜氨酸水溶液的初始浓度/(mol/L);C a为蒜氨酸水溶液的测量浓度/(mol/L);t为反应时间/min;k为动力学常数/min -1;E a为活化能/(kJ/mol);A为指前因子;R为阿伏伽德罗常数;T为温度/K。
1.3.4 计算方法
采用B 3LYP方法,在3-21+G(d,p)基组条件下,用能量梯度法分别对反应途径势能面上各驻点物种(反应物、过渡态、产物)的几何构型进行了全参数优化,同时在此水平上计算了振动频率,确认所得到的构型为无虚频的能量稳定点或具有一个虚频的过渡态,并通过内禀反应坐标(intrinsic reaction coordinate,IRC)计算确认各过渡态所连接的反应通道,相对能量以最稳定反应物作为能量基点,采用298 K时的吉布斯自由能变化,单位kJ/mol。所有单点能在3-21+G(d,p)基组条件下计算得到。全部计算在Gaussian 03程序包上完成。
1.4 数据分析
用Excel软件对数据进行统计、分析,所有数据取3 次重复的平均值。用Origin 8.0软件对数据进行拟合以及图形化处理。
2.1 蒜氨酸的化学结构确证

图1 化学合成蒜氨酸的氢谱(A)和碳谱(BB)
Fig.1
1H (A) and
13C-NMR (B) spectra of synthetic alliin
经两步合成的蒜氨酸,采用核磁确定其结构(图1),氢谱和碳谱数据为 1H-NMR (400 MHz,D 2O)δ 3.23~3.45(2H,m)、3.60~3.90(2H,m)、4.22 (1H,m)、5.50~5.56 (2H,m)、5.90 (1H,m); 13C-NMR(75 MHz,D 2O)δ 174.2、127.2、125.8、57.0、53.1、52.0。与文献[24]数据一致。
2.2 蒜氨酸水溶液的分解动力学分析

图2 蒜氨酸在不同温度条件下的分解曲线
Fig.2 Degradation curves of alliin at different temperatures

图3 蒜氨酸在不同温度条件下的动力学常数拟合
Fig.3 Determination of the kinetic parameters of alliin degradation
表1 蒜氨酸分解反应的动力学参数
Table1 Kinetic parameters for the degradation reaction of alliin

物质温度/K动力学常数k/min -1n活化能/(kJ/mol)指前因子蒜氨酸3932.98×10 -41.0 4131.11×10 -31.080.51.27×10 74332.91×10 -31.0
蒜氨酸水溶液的分解曲线(时间-浓度)如图2所示。蒜氨酸水溶液在不同温度条件下的分解动力学常数拟合结果如图3。从图2可以看出,蒜氨酸在120 ℃时,相对比较稳定,反应360 min时,蒜氨酸仍有90%的剩余量;而在160 ℃时,同样反应360 min,蒜氨酸仅剩余不到40%,说明蒜氨酸对高温比较敏感。蒜氨酸在120、140、160 ℃条件下分解,以蒜氨酸浓度与初始浓度比值的自然对数与反应时间作图,3 个温度条件下均可拟合得到直线(R值接近0.99),说明其为一级动力学反应(图3)。从表1可以看出,以水为溶剂,蒜氨酸的分解活化能为80.5 kJ/mol,指前因子为1.27×10 7。显然,随着温度升高,动力学常数k增大,温度较低时,蒜氨酸的分解更慢、更趋于稳定。
2.3 蒜氨酸水溶液的热分解产物分布
2.3.1 挥发性含硫化合物的GC-MS分析
蒜氨酸水溶液在不同温度条件下加热5 h后,萃取样品,采用GC-MS分析其分解产物的组成。从表2可以看出,在不同温度条件下,蒜氨酸的分解产物以二烯丙基二硫醚为主。但随着温度升高,二烯丙基二硫醚的含量有所降低,二烯丙基三硫醚含量则先增加后减少,而二烯丙基四硫醚始终有增加的趋势,说明高温可促进硫醚类化合物的断裂和重排,其分解产物的组成与大蒜素分解产物非常类似。
表2 挥发性含硫化合物含量
Table2 Distribution of volatile sulfur compounds %
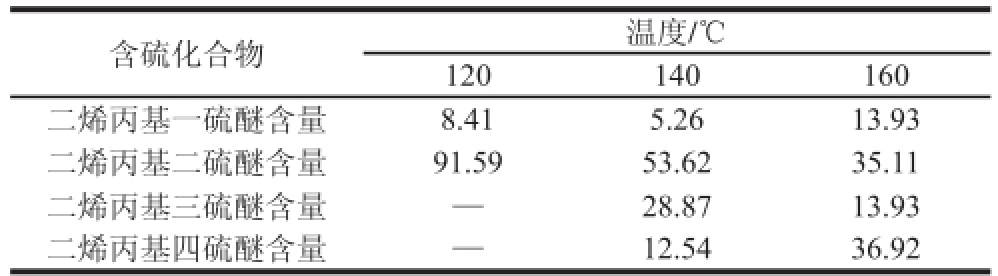
注:—.未检出。
 含硫化合物
温度/℃120 140 160二烯丙基一硫醚含量8.415.2613.93二烯丙基二硫醚含量91.5953.6235.11二烯丙基三硫醚含量—28.8713.93二烯丙基四硫醚含量—12.5436.92
含硫化合物
温度/℃120 140 160二烯丙基一硫醚含量8.415.2613.93二烯丙基二硫醚含量91.5953.6235.11二烯丙基三硫醚含量—28.8713.93二烯丙基四硫醚含量—12.5436.92
2.3.2 液相产物分析
蒜氨酸水溶液加热2 h后,液相可以看到明显的固体沉淀,收集固体进行质谱分析,出现两个特征的质谱峰,分别为193.2和215.3(图4),说明体系中生成了SAMC钠盐;采用2,4-二硝基苯肼法可以检测到水溶液中有丙酮酸生成 [22],说明蒜氨酸的热分解过程生成的产物与酶催化过程类似 [16],结果为蒜氨酸热分解的机理推导提供了实验基础。

图4 液相产物的质谱图
Fig.4 Mass spectra of the liquid phase products
2.4 蒜氨酸的分解过渡态计算
虽然获得蒜氨酸的热分解动力学常数以及分解产物,但其热分解机理并不明确。采用B 3LYP方法,在3-21+G(d,p)基组条件下,优化反应物与产物的结构,并搜索蒜氨酸热分解的过渡态Ts1。为了确保过渡态和中间体的真实性,对所计算的反应物、产物、过渡态均做频率分析,结果表明:反应物与产物的的振动频率均为正值,而过渡态的虚振动频率为-787.18,均有且只有一个振动模式所对应的频率为虚频率,说明过渡态是真实的;IRC计算确认了反应物、过渡态、产物的相关性,说明过渡态位于正确的反应途径上。振动分析表明过渡态的虚振动模式的位移向量正向指向产物,其反向指向反应物,这些表明均位于正确的反应途径上。

图5 优化的蒜氨酸反应物R(A)与过渡态Ts1(B)结构
Fig.5 Optimized geometries of reactant (A) and transition (B) state at B3LYP/3-21+G(d, p) level
从图5可以看出,蒜氨酸经过渡态后,S—C键逐渐拉长,从1.555 6 Å拉长到1.617 7 Å,而O—H的距离缩短,从2.672 3 Å变化为1.326 5 Å。在3-21+G(d,p)水平上计算反应物、过渡态和产物的总能量、零点能,为了比较反应的能量变化特征,以反应物能量作为参照,计算出各物种的相对能量,结果如图6所示,蒜氨酸的热分解能垒为123.48 kJ/mol,此结果与动力学研究获得的结果不完全一致,可能是因为计算采用气态,而实际是水溶液状态。
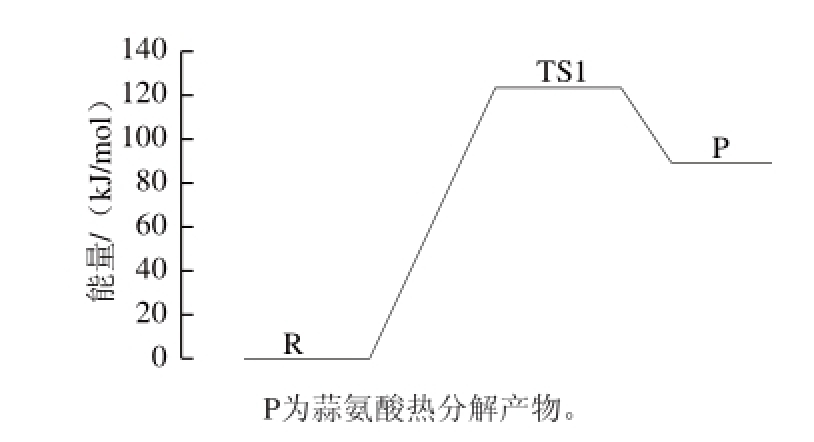
图6 计算蒜氨酸的相对能量
Fig.6 Calculation of the relative energy of alliin
2.5 蒜氨酸水溶液的分解过程推导
结合蒜氨酸的分解动力学、产物分析以及理论计算的结果进行推断,蒜氨酸的分解类似于大蒜素的分解过程,同样会形成一个五元环的过渡中间体,经Cope消除后,生成次硫酸(化合物2)与丙酮酸氨(化合物5),次硫酸进一步反应,形成二烯丙基二硫醚与二烯丙基三硫醚等一系列产物(图7)。

图7 蒜氨酸水溶液的分解过程推导
Fig.7 Deduced decomposition process of alliin solution
绘制蒜氨酸水溶液在不同温度条件下的分解曲线图,并拟合得到对应的动力学方程,获得以水为溶剂时,蒜氨酸的热分解动力学活化能为80.5 kJ/mol,指前因子为1.27×10 7。
通过GC-MS分析热分解产物,发现随着温度升高,二烯丙基二硫醚的含量有所降低,二烯丙基三硫醚含量先增加后减少,而二烯丙基四硫醚含量有增加的趋势,说明高温可促进硫醚类化合物的断裂和重排;通过对液相产物分析,检测到了SAMC钠盐和丙酮酸。
采用B 3LYP方法,在3-21+G(d,p)基组条件下,对蒜氨酸的分解过渡态进行理论计算,结合分解动力学和产物分析,初步推断蒜氨酸的分解过程会形成一个五元环的过渡中间体,而后形成次硫酸与丙酮酸,次硫酸进一步反应形成二烯丙基二硫醚与二烯丙基三硫醚等一系列产物。
总之,蒜氨酸水溶液的热稳定性较弱,容易在加热条件下生成二烯丙基二硫醚、二烯丙基三硫醚等挥发性含硫化物,说明即使在蒜氨酸酶不存在或者完全失活的状态下,蒜氨酸的分解转化依然可以进行,该结果可为黑蒜的非酶发酵加工提供一定的理论依据。
参考文献:
[1] 张东峰, 邓毛程. 大蒜功能性食品的开发与应用[J]. 食品工程, 2015, 22(3): 1-3. DOI:10.3969/j.issn.1673-6044.2015.03.001.
[2] 熊海燕. 药食两用珍品—大蒜[J]. 食品工程, 2010, 17(2): 40-42. DOI:10.3969/j.issn.1673-6044.2010.02.013.
[3] 马丽娜, 李峰杰, 李贻奎. 大蒜主要活性成分及药理作用研究进展[J]. 中国药理学通报, 2014, 30(6): 760-763. DOI:10.3969/ j.issn.1001-1978.2014.06.006.
[4] 乔旭光, 张振华, 韩雅珊, 等. 提高大蒜精油提取得率的酶调控技术[J]. 食品科学, 2001, 22(5): 31-34. DOI:10.3969/ j.issn.1002-0306.2001.03.012.
[5] 周广勇, 缪冶炼, 许小辨, 等. 大蒜加工中阿霍烯产生过程的研究[J]. 中国食品学报, 2011, 12(2): 67-72. DOI:10.3969/ j.issn.1009-7848.2012.02.011.
[6] SHER A, FAKHAR-UL-MAHMOOD M, SHAH S N H, et al. Effect of garlic extract on blood glucose level and lipid prof i le in normal and alloxan diabetic rabbits[J]. Advances in Clinical and Experimental Medicine, 2013, 21(6): 705-711.
[7] 赵立, 苟萍, 王霞. 大蒜活性物质对高脂小鼠血脂代谢的影响[J]. 中成药, 2013, 35(1): 28-32.
[8] PADIYA R, BANERJEE S K. Garlic as an anti-diabetic agent: recent progress and patent reviews[J]. Recent Patents on Food, Nutrition and Agriculture, 2013, 5(2): 105-127. DOI:10.2174/18761429113059990002.
[9] 李莉华, 吕慧, 孙桂菊, 等. 大蒜油和洋葱油对四氧嘧啶致糖尿病小鼠的降血糖作用[J]. 食品科学, 2010, 31(23): 344-348.
[10] MARQUES A, ENCARNACAO S, PEDRO S, et al. In vitro antimicrobial activity of garlic, oregano and chitosan against Salmonella enteric[J]. World Journal of Microbiology and Biotechnology, 2008, 24(10): 2357-2360. DOI:10.1007/s11274-008-9721-7.
[11] 代腊, 袁超, 邹晓庭, 等. 大蒜素抗菌特性及其作用机理[J]. 中国饲料, 2012, 23(6): 9-12. DOI:10.3969/j.issn.1004-3314.2012.06.004.
[12] MODEM S, DICARLO S E, REDDY T R. Fresh garlic extract induces growth arrest and morphological differentiation of MCF7 breast cancer cells[J]. Genes Cancer, 2012, 3(2): 177-186. DOI:10.1177/1947601912458581.
[13] 尹春晖, 霍诗然. 大蒜素抗癌作用及其机制研究进展[J]. 食品科学, 2009, 30(7): 270-272. DOI:10.3321/j.issn:1002-6630.2009.07.062.
[14] SCHAFER G, KASCHULA C H. The immunomodulation and antiinflammatory effects of garlic organosulfur compounds in cancer chemoprevention[J]. Anti-cancer Agents in Medicinal Chemistry, 2014, 14: 233-240. DOI:10.2174/18715206113136660370.
[15] 郑昱, 郑建芳. 大蒜油对小鼠免疫功能影响的研究[J]. 河南医学研究, 2016, 26(1): 15-17. DOI:10.3969/j.issn.1004-437X.2016.01.003.
[16] WANG J, CAO Y P, WANG C T, et al. Low-frequency and lowintensity ultrasound accelerates alliinase-catalyzed synthesis of allicin in freshly crushed garlic[J]. Journal of the Science of Food and Agriculture, 2011, 91(10): 1766-1772. DOI:10.1002/jsfa.4377.
[17] ZHANG M, LEI N, ZHU T Z, et al. Thermal processing effects on the chemical constituent and antioxidant activity of S-alk(en)ylcysteine S-oxides (alliin) extract[J]. LWT-food Science and Technology, 2012, 51(1): 309-313. DOI:10.1016/j.lwt.2012.09.024
[18] FREEMAN F, HUANG B G, LIN R I S. Garlic chemistry. nitric oxide oxidation of S-(2-propenyl)cysteine and (+)-S-(2-propenyl)-L-cystein sulfoxide[J]. Journal of Organic Chemistry, 1994, 59(11): 3227-3229. DOI:10.1021/jo00090a048.
[19] YU T H, WU C M, HO C T. Meat-like flavor generated from thermal interactions of glucose and alliin or deoxyalliin[J]. Journal of Agricultural and Food Chemistry, 1994, 42(4): 1005-1009. DOI:10.1021/jf00040a032.
[20] 雷逢超, 郝果, 朱黎, 等. 黑蒜的营养价值及保健作用的研究进展[J]. 食品工业科技, 2012, 33(13): 429-432. DOI:10.13386/ j.issn1002-0306.2012.13.054.
[21] 王海粟, 吴昊, 杨绍兰, 等. 不同工艺黑蒜的品质比较分析[J]. 现代食品科技, 2014, 30(7): 230-236. DOI:10.13982/ j.mfst.1673-9078.2014.07.043.
[22] 孙艳, 王振, 葛朝晖, 等. 黑蒜加工过程中总酚和可溶性糖的含量变化[J]. 食品科技, 2016, 41(1): 44-47. DOI:10.13684/j.cnki. spkj.2016.01.009.
[23] 罗海青, 吴磊, 朱翠玲, 等. 黑蒜加工过程中营养组分及挥发性风味物质变化研究[J]. 食品科技, 2016, 41(7): 104-108. DOI:10.13684/ j.cnki.spkj.2016.07.020.
[24] ABBEHAUSEN C, SUCENA S F, LANCELLOTTI M, et al. Synthesis, spectroscopic characterization, DFT studies, and antibacterial and antitumor activities of a novel water soluble Pd (Ⅱ) complex with L-alliin[J]. Journal of Molecular Structure, 2013, 1035:421-426. DOI:10.1016/j.molstruc.2012.11.065.
[25] 张建, 刘文营. 大蒜中三种主要蒜氨酸的合成及表征[J]. 中国调味品, 2011, 36(9): 37-40.
[26] LI W Q, ZHOU H, ZHOU M Y, et al. Characterization of phenolic constituents inhibiting the formation of sulfur-containing volatiles produced during garlic processing[J]. Journal of Agricultural and Food Chemistry, 2015, 63(3): 787-794. DOI:10.1021/jf505982f.
[27] 张海波, 李新霞, 孟磊, 等. 蒜氨酸标准物质的定值研究[J]. 食品科学, 2014, 35(12): 80-83. DOI:10.7506/spkx1002-6630-201412015.
[28] 王伟, 乔旭光, 李福伟, 等. 高效液相色谱法测定大蒜中蒜氨酸含量[J]. 食品与发酵工业, 2006, 32(4), 115-117. DOI:10.13995/ j.cnki.11-1802/ts.2006.04.031.
[29] 黄雪松, 温丽儿, 宴日安. 反相高压液相色谱法测定鲜蒜中的蒜氨酸[J]. 食品科学, 2005, 31(5), 106-109. DOI:10.13995/j.cnki.11-1802/ ts.2005.05.027.
[30] 胡晓冰, 林标声, 杨生玉. 测定丙酮酸发酵生产产量的几种化学方法的比较[J]. 粮油加工, 2010(12): 165-168.
Thermal Decomposition of Alliin and Mechanism Analysis
HU Xingpeng, ZHOU Hua*, DU Yangmin, OU Shiyi, YAN Rian
(Department of Food Science and Engineering, College of Science and Engineering, Jinan University, Guangzhou 510632, China)
Abstract:The kinetic parameters for thermal decomposition of alliin in aqueous solution were determined in order to explore its thermal stability. The activation energy and pre-exponential factor were separately determined as 80.5 kJ/mol and 1.27 × 10 7. By analysis of the thermal decomposition products using gas chromatography-mass spectrometry (GC-MS), it was found that as the temperature rose, the content of diallyl disulf i de kept decreasing from 91.59% to 53.62%, the content of diallyl trisulf i de fi rstly increased and then decreased and the content of diallyl thioether kept increasing, illustrating that high temperature could promote the fracture and rearrangement of sulfur and ether compounds. By mass spectrometry (GC) and the 2,4-dinitrophenylhydrazine method, the presence of S-allyl-L-cysteine sodium and pyruvic acid was detected in the liquid phase products. At the B 3LYP/3-21+G(d,p) level, the structures of the reactants and products were optimized, and the transition state during alliin decomposition was calculated theoretically. By also investigating the decomposition kinetics and thermal decomposition products, it was inferred that alliin could form a fi ve-membered ring intermediate during the decomposition process. Afterwards, hyposulfurous acid and pyruvic acid were generated via Cope elimination reaction. Diallyl disulf i de and diallyl trisulf i de were formed from hyposulfurous acid through further reaction.
Key words:alliin; kinetics; garlic; activation energy
DOI:10.7506/spkx1002-6630-201703011
中图分类号:O643.1
文献标志码:A
文章编号:1002-6630(2017)03-0064-05
引文格式:
胡兴鹏, 周华, 杜阳敏, 等. 蒜氨酸的热分解及其机理分析[J]. 食品科学, 2017, 38(3): 64-68. DOI:10.7506/spkx1002-6630-201703011. http://www.spkx.net.cn
HU Xingpeng, ZHOU Hua, DU Yangmin, et al. Thermal decomposition of alliin and mechanism analysis[J]. Food Science, 2017, 38(3): 64-68. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703011. http://www.spkx.net.cn
收稿日期:2016-03-27
基金项目:国家自然科学基金青年科学基金项目(3167100631;31101323)
作者简介:胡兴鹏(1991—),男,硕士研究生,研究方向为天然产物化学。E-mail:a300297@163.com
*通信作者:周华(1976—)男,副教授,博士,研究方向天然产物化学。E-mail:zhhua-1@163.com