许安琪 1,吴宁宁 1,吴雪春 1,刘 平 1,姚小军 2,陈光英 3,何文英 1,*
(1.海南师范大学化学与化工学院,海南 海口 571158;2.兰州大学化学与化工学院,甘肃 兰州 730000;3.海南师范大学 热带药用植物化学教育部重点实验室,海南 海口 571158)
摘 要:利用多种荧光光谱法、紫外光谱法并结合分子模拟等方法,表征模拟生理条件下草豆蔻中的主要活性组分山姜素(alpinetin,Alp)影响牛血红蛋白(bovine hemoglobin,BHG)的结构信息,探讨Alp与BHG的作用机制。重叠光谱数据证实,Alp与BHG的相互作用符合Förster非辐射能量转移,据此依据不同的作用机理,获得3 种温度(299、309、319 K)条件下的键合常数(猝灭机理为5.880×10 4、4.337×10 4L/mol及4.935×10 4L/mol;增敏机理为3.239×10 3、5.225×10 3L/mol及7.692×10 3L/mol)及热力学常数(ΔS:182.073 J/(mol·K),ΔH:34.320 kJ/mol,ΔG:-20.119(299 K)、-21.940 kJ/mol(309 K)及-23.760 kJ/mol(319 K));分子模拟表明,Alp键合位点于BHG分子的疏水腔内,并与BHG的键合模式主要是疏水作用;荧光偏振显示,Alp与BHG结合后生成的配合物弛豫时间较短,结合的较松;同步荧光及紫外光谱证实,Alp的存在影响了BHG的微环境;二维及三维荧光光谱表明,Alp可以猝灭BHG的内源荧光,使其构象发生变化。结论表明,BHG对Alp有较强的结合能力,提示BHG对Alp在一定程度上可起到贮存和转运的作用。另外,考察了几种共存金属离子对Alp与BHG相互作用的影响,表明加入共存离子后的键合常数均有较大增加。
关键词:山姜素;血红蛋白;能量转移;相互作用
草豆蔻为姜科植物草豆蔻的成熟的种子团,含挥发油,其主要成分为山姜素(aipinetin,Alp)、小豆蔻明、桉叶素和金合欢醇,食用有祛寒燥湿、健脾消食的作用,常用作调味品,可去除异味,增加香味。其中Alp为草豆蔻中主要的一种黄酮类成分,其药理活性主要表现在抗炎抑菌、抑制肿瘤形成及血小板聚集,且毒性很低,安全性好 [1]。近几年,国内外虽已有较多关于Alp新的药理活性的研究报道 [2-3],也有其与模型蛋白(人血清白蛋白(human serum albumin,HSA)或牛血清白蛋白(bovine serum albumin,BSA))相互作用的研究报道 [4-6],但其与血红蛋白的相互作用却鲜见报道。血红蛋白是高等生物体内的一种重要的生物大分子,主要存在于某些无脊椎动物、脊椎动物血液和豆科植物根瘤中,其主要功能是运输氧、维持血液酸碱平衡 [7]。通过研究Alp与血红蛋白的相互作用,与文献中报道的与其他模型蛋白作用的结果相比较,可为Alp分子结构与药效之间关系提供更加有用的信息,比如结合的紧密程度、结合力、作用模式、结合数、结合部位等参数,不仅有助于从分子层次上阐明Alp与血红蛋白的作用机理及其对相关蛋白结构与功能的影响,并且能深入认识Alp药效作用的药理、毒物毒性作用的毒理之微观机制,对指导合理用药也具有一定实际应用意义。
本实验利用紫外光谱、多种荧光光谱及分子模拟等技术探讨Alp与牛血红蛋白(bovine hemoglobin,BHG)的键合作用,基于Alp特殊的分子结构及能量转移原理获得详细的键合参数,从分子水平揭示它们的相互作用机理,并探讨几种常见的金属离子共存时的影响,研究结果为揭示Alp作为一种药食同源植物草豆蔻的重要组分在体内的运输、吸收和代谢提供重要信息。
1.1 材料与试剂
BHG(相对分子质量64 500) 美国Worthington Biochemical公司;三羟甲基氨基甲烷(tris(hydroxymethyl) metyl aminomethane,Tris)-盐酸(Tris-HCl)缓冲溶液国药集团化学试剂有限公司;Alp 中国食品药品检定研究院。
1 000 mg/L金属离子(Zn 2+、Fe 3+、Na +、Mn 2+、Al 3+、Ca 2+) 国家钢铁材料测试中心钢铁研究总院。根据不同金属离子的分子质量,从1 000 mg/L标准金属离子中移取不同体积的金属离子,用超纯水配制成1.0×10 -3mol/L。
所有实验用水为二次蒸馏水;试剂均为分析纯。3.0×10 -5mol/L BHG溶液用Tris-HCl缓冲溶液(pH 7.40)配制,于 4 ℃保存于暗处;0.05 mol/L Tris-HCl缓冲液、1 000 mg/L金属离子用蒸馏水配制;1.0×10 -3mol/L Alp用无水甲醇配制。
1.2 仪器与设备
RF-5301PC荧光光度计 日本岛津公司;F-7000荧光光度计 日本日立公司;BS124S电子天平德国赛多利斯公司;PHSJ-3F pH计 上海精密仪器厂;SB-1000型水浴锅 上海爱朗仪器有限公司;TU-1901型紫外-可见光光度计 北京普析通用仪器有限责任公司;pHs-10A型酸度计 萧山市科学仪器厂。实验所需温度用超级恒温槽控制。
1.3 方法
1.3.1 能量转移的测定
在RF-5301PC荧光光谱仪上进行发射光谱的测定(1 cm石英池),BHG浓度为3.0×10 -5mol/L,选激发与发射波长的狭缝宽均为5 nm,激发波长为280 nm;在TU-1901型紫外-可见光光度计进行吸收光谱的测定(1 cm石英池),配制同浓度的Alp溶液,相应的试剂的空白作参比溶液,扫描Alp在波长200~350 nm范围内的紫外吸收光谱,依据文献[8]计算并确定能量转移。
1.3.2 键合常数及热力学常数的测定
在RF-5301PC荧光光谱仪上进行测定(1 cm石英池),采用荧光滴定法,选择激发波长为280 nm,发射波长为348 nm,在299、309 K和319 K 3 种不同温度条件下测定Alp-BHG体系的荧光强度,再依据文献[9]计算键合常数。
1.3.3 同步荧光及荧光偏振度的测定
均在RF-5301PC荧光光谱仪上进行测定(1 cm石英池),荧光偏振选激发与发射波长的狭缝宽均为5 nm,激发波长为280 nm,发射波长为348 nm [10];同步荧光(Δλ=60 nm)以230 nm为激发波长,290 nm为发射波长进行测定。
1.3.4 三维荧光光谱的测定
在F-7000荧光光谱仪上进行(1 cm石英池),选激发和发射狭缝宽度均为5 nm,测定激发波长230~325 nm、发射波长230~480 nm范围的三维荧光谱图。
1.3.5 紫外吸收光谱的测定
在TU-1901型号紫外-可见光光度计上进行(1 cm石英池),依次移取一定量的Alp和BHG储备液,用pH 7.40的Tris-HCl缓冲溶液定容为3 mL,以相应试剂的空白为参比,测定Alp-BHG体系在200~350 nm范围内的紫外吸收光谱。
1.3.6 分子模拟
首先应用SYBYL 7.3软件得到Alp的三维结构,再对各种最合理分子的初步构象进行Tripos力场的能量优化,以生成热(能量)最低者为药效构象;进一步用共轭梯度法优化Alp的分子结构。BHG的晶体结构(编号为4M4B)从Brookhaven蛋白质数据库中获得,通过kollman-all-atom电荷测出BHG蛋白三维结构的势能;最终用Surf l ex程序模拟出Alp和BHG分子相互作用的模式。1.3.7 金属离子共存时键合常数的测定
竞争实验:依次向1 mL比色皿中加入一定量的BHG储备液(3.0×10 -6mol/L)、分别不同离子的溶液(Zn 2+、Fe 3+、Na +、Mn 2+、Al 3+、Ca 2+,浓度均配制成为1.0×10 -3mol/L),以pH 7.40的Tris-HCl缓冲溶液定容,逐步加入Alp,激发波长278 nm,发射波长445 nm,反应时间3 min,测定299 K条件下的荧光强度,所得结果用来计算键合常数。
2.1 Alp与BHG相互作用的能量转移
根据Förster非辐射能量转移理论,若能量转移受体吸收谱和给体的荧光发射谱之间有一定的光谱重叠,且供能体与受能体足够接近,最大距离不超过7 nm,则可以确定在荧光能量的受体和给体分子之间发生了基于电子激发能的非辐射转移,其转移是通过分子间偶极-偶极耦合作用发生的 [5]。
蛋白质的内源荧光主要是色氨酸残基产生的,通过测定BHG在荧光激发波长280 nm的发射光谱与Alp的吸收光谱,得到其重叠光谱图(图1),依据公式(1)~(3)计算出Alp在BHG上的结合位置与色氨酸残基之间的距离r [4-5]:
式中:E为能量转移效率;R 0为转移效率为50%时的临界距离/nm;r为荧光体与淬灭体之间的真实距离/nm;F和F 0分别为存在和不存在能量受体时,能量给体的荧光发射强度。
式中:K 2为偶极空间取向因子(K取2/3);n为介质的折射指数(n取1.336);Φ为荧光给体的荧光量子产率(Φ取0.118) [5];J为给体的荧光发射光谱与受体的吸收光谱之间的光谱重迭积分。
式中:F(λ)为荧光给体在波长为l时的荧光强度;ε(λ)为受体在波长λ时的摩尔消光系数/(L/mol)。计算得到重叠积分(J)的数值为4.0 0 3×1 0 -1 4(cm 3·L)/mol,临界距离R 0为4.25 nm,BHG中色氨酸残基与已结合的Alp分子间的距离r值为6.02 nm。结果表明:Alp在BHG的结合位置与Trp残基之间的距离小于7 nm,同时也证明了在Alp和BHG分子之间发生了基于电子激发能的非辐射转移(图1)。
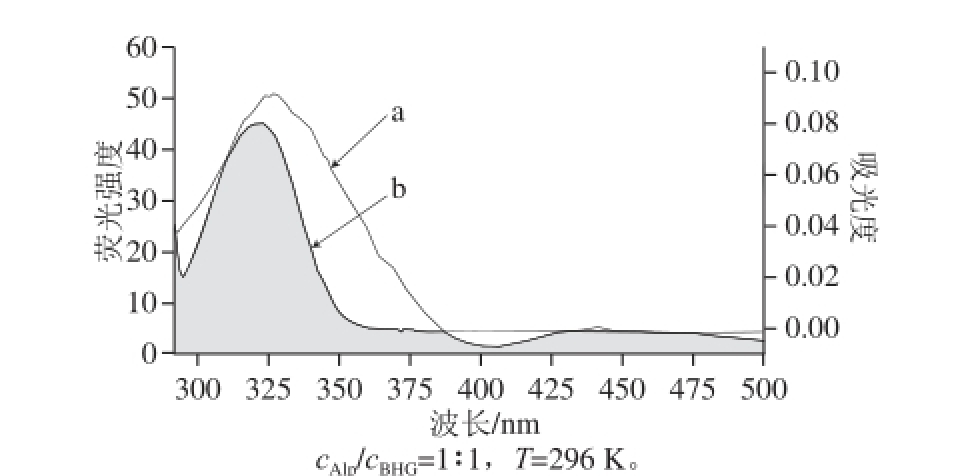
图1 BHG的荧光光谱(a)与Alp的吸收光谱(b)重叠图
Fig.1 Overlapping between the fl uorescence emission spectrum of BHG (a) (λ
ex= 278 nm) and the UV spectrum of Alp (b)
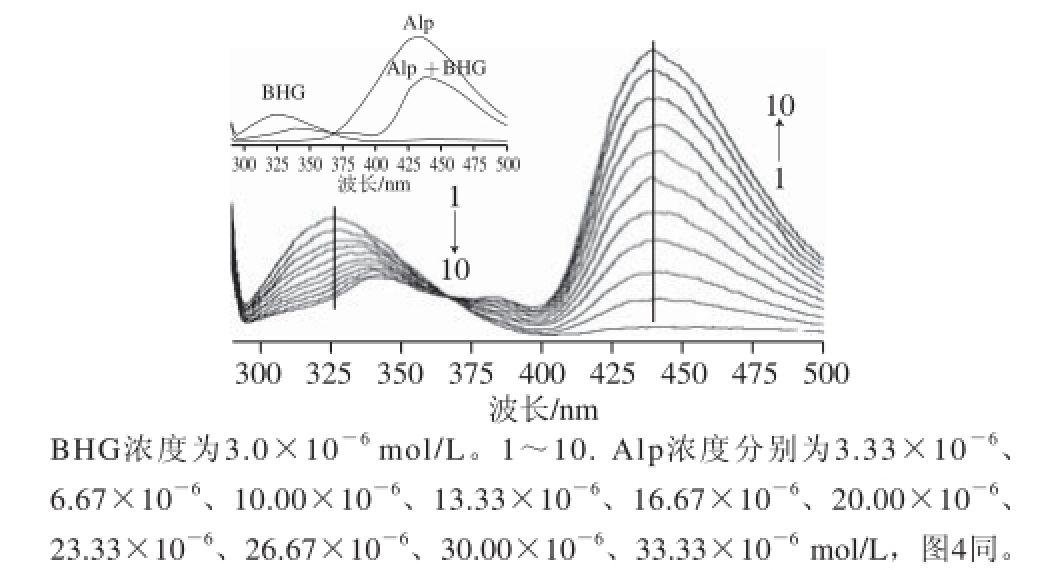
图2 Alp-BHG体系的荧光发射光谱图
Fig.2 Fluorescence spectra of Alp-BHG system
为进一步证实Alp与BHG的相互作用存在能量转移,进行了荧光光谱表征。图2附图中的曲线分别为BHG、
2.2 Alp与BHG的键合机理及热力学参数Alp及BHG-Alp体系的荧光发射光谱图(E x=278 nm)。可看出,BHG的最大发射波长位于327 nm,加入Alp后,其红移至341 nm左右;而Alp的最大发射波长位于438 nm,加入BHG后,在438 nm的强度有较大的增加。由图2可知,随着Alp浓度的增加,BHG-Alp体系的荧光发射光谱图(λ ex=278 nm)可以更加明显地看出在368 nm波长处存在一个共发射点,对应在BHG的特征最大发射波长325 nm处,Alp猝灭了BHG的内源荧光;而在Alp的特征最大发射波长432 nm处BHG增敏了Alp的荧光,且都有红移效应。结果说明:Alp与BHG发生了较强的相互作用;且Alp的存在,发生了能量转移给体BHG与受体Alp分子间偶极-偶极耦合作用,使得BHG的荧光减弱而Alp的荧光增强。
应用荧光滴定法测定3 个不同温度(299、309、319 K)的荧光强度。选BHG的最大发射波长327 nm处的荧光强度,制作Stern-Volmer图(图3)及猝灭机理K SV值(表1),可看出温度的变化对Alp-BHG体系的荧光强度影响较大;通过线性模拟获得猝灭曲线的斜率即猝灭机理K SV值(均为10 4数量级),并计算得到猝灭速率常数(均大于2.0×10 10L/(mol·s)),再结合Alp-BHG体系的吸收光谱(图4),证明Alp对BHG的荧光猝灭机理为静态猝灭 [11]。
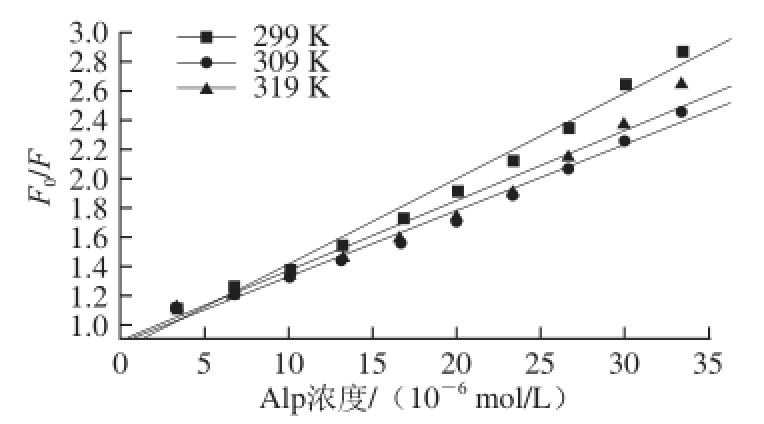
图3 Alp-BHG体系的猝灭机理Stern-Volmer图
Fig.3 Stern-Volmer plots of Alp-BHG systems
表1 不同温度条件下Alp与BHG的键合常数值
Table1 Binding parameters between Alp and BHG under different temperatures

注:K SV值得计算按照公式F 0/F=1+K qτ 0[Q]=1+K SV[Q];K值的计算按照公式1/ΔF=1/ΔF max+(1/K[Q])/(1/ΔF max)。
(L/mol)R SV增敏机理K值/(L/mol)R 2995.880×10 40.997 73.239×10 30.999 0 3094.337×10 40.999 75.225×10 30.999 2 3194.935×10 40.997 37.692×10 30.999 2温度/K猝灭机理K SV值/
在Alp的荧光发射峰438 nm波长处,应用荧光加强效应及相关的公式 [12]求得不同温度条件下的键合常数K值(表1、图5),可看出随温度的升高,K值呈增大的趋势。结果表明,Alp与BHG以一对一的位点相互作用,且K值受温度的影响较大。
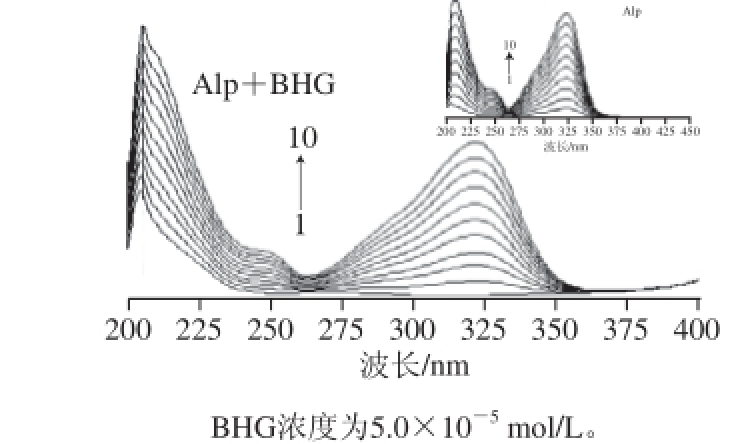
图4 Alp-BHG体系及Alp的紫外光谱图
Fig.4 UV absorption spectra of Alp-BHG and Alp (inset) in Tris buffer solution (at 299 K)
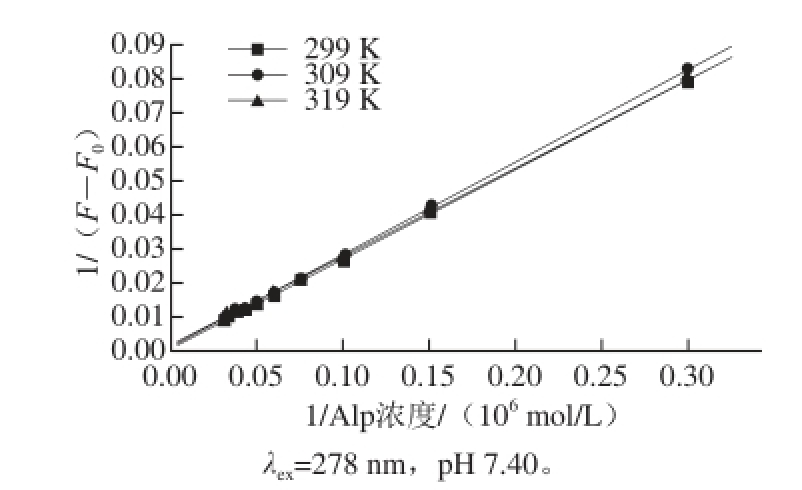
图5 Alp-BHG体系的增敏机理图
Fig.5 Plots for sensitivity enhancement mechanisms of Alp-BHG systems
利用Van’t Hoff方程可求得Alp与BHG作用的热力学常数 [13],根据不同温度条件下K值(表1)求得ΔS值为182.073 J/(mol·K),ΔH值为34.320 kJ/mol,ΔG值分别为:-20.119(299 K)、-21.940 kJ/mol(309 K)及-23.760 kJ/mol(319 K),表明Alp与BHG的键合过程是自发进行的;ΔH值及ΔS值表明它们之间为典型的疏水作用力,这与后面有关分子模拟的结果相一致。
2.3 Alp与BHG相互作用的分子模拟
BHG结构上是具有4 个亚单元的聚合体,每个亚单元由一条蛋白链和一个血红素分子组成。血红素与肽链的连接是通过血红素中铁原子的第5配位点与肽链分子中的组氨酸咪唑基的氮原子相连而成,在铁原子的第6配位点可与氧或其他小分子结合 [14]。
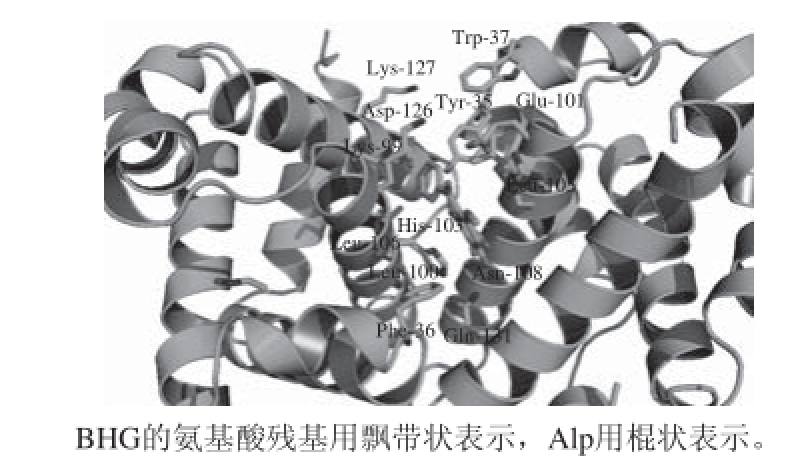
图6 Alp键合BHG的分子模拟对接图
Fig.6 Binding mode between Alp and BHG with only residues around 8 Å in Alp being displayed
从图6可以看出,BHG分子的部分区域有相应的空间接纳Alp分子,Alp分子嵌合在BHG分子的疏水腔内,且整个Alp分子表现为非平面结构,与BHG分子的酪氨酸Tyr-35、苯丙氨酸Phe-36和色氨酸Trp-37很靠近,这一方面说明Alp与BHG通过疏水作用键合,另一方面表明Alp确实能猝灭BHG的内源荧光,与本研究前面的有关荧光光谱法的测定结果一致。分子模拟结果说明Alp键合BHG的作用力的模式主要是疏水作用,且是自发进行的,与本研究后面有关热力学参数的计算结果一致。
2.4 Alp影响BHG二级结构的光谱表征

图7 BHG的各向异性值
Fig.7 Variation in the fl uorescence anisotropy of BHG with increasing Alp concentration. Inset: Variation with increasing BHG concentration
荧光偏振法通过测定荧光偏振值或各向异性值的变化,能确定溶液中药物小分子与生物大分子结合的一些参数,是一种研究分子间相互作用的灵敏而高效的方法 [15]。图7为温度为299 K条件下,Alp的浓度为4.0×10 -5mol/L时测得不同浓度BHG的各向异性值,可看出,Alp的存在,使得BHG的各向异性值呈增大趋势(0.000 9~0.201 0);而其中的附图为改变Alp的浓度而测得的BHG(5.0×10 -6mol/L)的各向异性值,随着Alp与BHG浓度比的增大(0.0~4.0×10 -5mol/L),各向异性值均在0.13左右。以上两个体系的各向异性值均小于0.4,说明Alp与BHG结合的程度较小,其生成的配合物有较短的弛豫时间;从蛋白的角度看,是由于Alp的存在,使得BHG的二级结构从螺旋伸展到无规卷曲时挠性增大,因而偏振值较小 [16]。
蛋白质肽键的紫外最强吸收峰约在210 nm波长处,反映蛋白质的α-螺旋结构的光谱信息 [17]。图4中的曲线1为纯BHG在Tris水溶液中的紫外吸收图谱,在205 nm波长处有最大吸收,随Alp浓度的增大,在322 nm波长处出现双峰谱图,对比附图中曲线,得知322 nm波长处为Alp的特征吸收峰。附图曲线显示了Alp的紫外吸收为典型的双峰谱图,在208、322 nm波长处有最大吸收。正图中的紫外光谱图显示:随Alp浓度的增加,相应Alp-BHG体系的吸收强度也增大,与附图中Alp的最大吸收波长位置相比未发生明显变化,但Alp-BHG体系的峰形与Alp的吸收峰形差异较明显,以上结果表明:Alp与BHG的相互作用影响了BHG的α-螺旋结构。
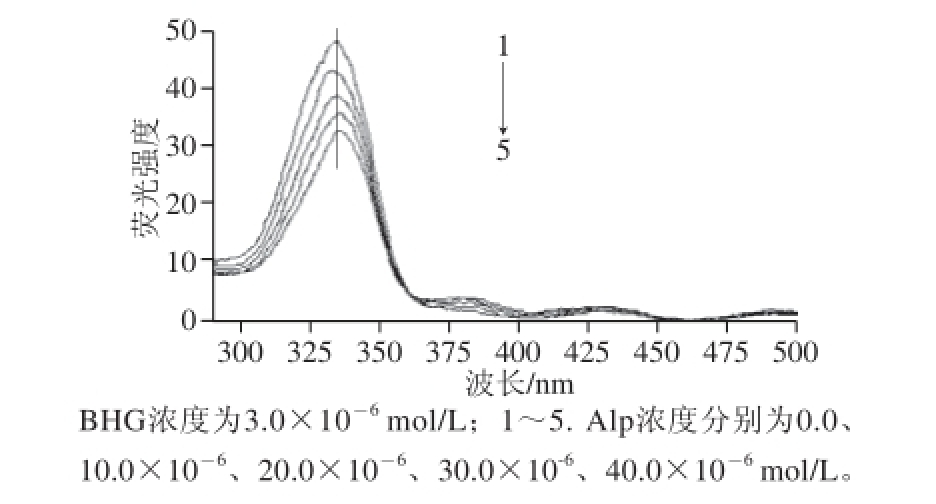
图8 Alp-BHG体系的同步荧光光谱图
Fig.8 Synchronous fl uorescence spectra
同步荧光分析法具有简化谱图、提高选择性及减少光散射干扰等特点 [16],通过测定蛋白质Δλ为60 nm的恒波长同步荧光光谱可以反映色氨酸残基的变化,从而确定药物小分子对蛋白质构象的影响信息 [18]。图8为Alp-BHG体系的恒波长同步荧光光谱图(Δλ为60 nm),显示随着Alp浓度的增大,Alp能猝灭BHG的色氨酸残基的荧光,并使得其最大荧光发射峰有轻微红移(334~337 nm左右),同时有能量转移发生,使得Alp在380 nm 波长处左右的荧光光谱强度增大,这些结果说明BHG的色氨酸残基减少了位于疏水性介质的部分,使得BHG的构象发生了一些变化。


图9 BHG和Alp-BHG体系的三维荧光光谱图
Fig.9 3D Fluorescence spectra of BHG and Alp-BHG system
另外,三维荧光光谱反映测定体系荧光强度同时随激发波长和发射波长变化的情况,可以提供具有荧光性质的物质的特定光谱的指纹信息 [16]。图9A为BHG的三维等高线荧光光谱,可看出,BHG的最大发射波长位于327 nm;图9B为Alp-BHG体系的三维等高线荧光光谱,显示了明显的双峰图形,最大发射波长位于327 nm及438 nm处,这与用二维荧光光谱测得的结果一致。比较图9A及图9B,能清楚地看出加入Alp前后,三维等高线荧光光谱和发射图谱的图形形状均发生了明显的变化,均说明Alp猝灭了BHG的内源色氨酸残基的荧光,并且有能量转移的发生,再次证实了前面关于能量转移的结论。
2.5 金属离子对Alp-BHG体系的影响
大多的金属离子可以结合不同蛋白质,金属离子对生物分子有一定的折叠和交联作用,表现在能使某些蛋白质极性表面脱水,从而增加蛋白质分子间的引力,并且可以降低蛋白质分子间负电荷的排斥作用,因而改变大分子构象稳定,促进蛋白质分子发生疏水聚集等,尤其对蛋白质的结构稳定性或催化功能方面,这也有助于修饰和控制蛋白质的一些性能 [19-22]。
表2 共存离子存在时对Alp-BHG体系键合常数K的影响
Table2 Binding constantss K ((LL/mol) between Alp and BHG at 296 K in the presence of common ions

金属离子1/ΔF=1/ΔF max+(1/K[Q])/(1/ΔF max)RK/(L/mol)未加离子Y=0.000 848+0.262X0.999 93.239×10 3Zn 2+Y=0.001 81+0.002 35X0.999 8 7.702×10 5Fe 3+Y=0.002 27+0.002 4X0.999 9 9.458×10 5Na +Y=0.002 03+0.002 93X0.999 9 6.928×10 5Mn 2+Y=0.001 37+0.001 96X0.999 76.990×10 5Al 3+Y=0.003 03+0.002 18X0.999 91.390×10 6Ca 2+Y=0.002 69+0.001 92X 0.998 11.401×10 6
选定6 种常见的金属离子,探讨其对Alp-BHG体系的竞争影响作用,结果见表2,与不加这些金属离子时的键合常数相比,加入共存离子后的键合常数值均有较大幅度的增大,尤其是Al 3+和Ca 2+的加入。这表明,几种金属离子的存在起协同作用,增大了Alp与BHG的键合,有可能改变了BHG的构象。
2.6 比较Alp与BHG、HSA、BSA或其他蛋白的相互作用
利用多种光谱方法(比如荧光光谱法、紫外光谱、红外光谱、圆二色谱、共振散射及核磁共振等)并结合分子模拟研究药物小分子与蛋白质相互作用已有很多报道 [23-28],Alp与不同蛋白的相互作用也已有一些报道,主要包括的蛋白为:HSA [4]、BSA [5-6]、人免疫球蛋白(human gammaglobulin,HG) [29]及溶菌酶(lysozyme,LYSO) [30]。比较其共同点是:都在模拟生理条件下(pH 7.40)进行的实验;Alp与这些蛋白的相互作用力的模式均有疏水作用;Alp均可以猝灭这些蛋白的内源荧光,猝灭机理均为静态猝灭;荧光发射光谱都出现双峰图形,且都在380 nm波长处有共发射点;键合常数均大于10 4,说明Alp与这些蛋白均有较强的相互作用;Alp的加入均可以不同程度地定性定量影响蛋白的二级结构。比较它们的不同点在于:由于Alp与不同所选蛋白进行实验,其数据及结果不同;不同研究者所使用的仪器型号不同,所选的体系浓度范围各异,造成键合常数、热力学常数等定性的数据会有差别 [5-6]。总而言之,以上结果表明:不同蛋白(BHG、HSA、BSA、HG 及LYSO)均对Alp有较强的结合能力,不仅提示这些蛋白对Alp在一定程度上可起到贮存和转运的作用,也暗示Alp与这些蛋白的键合有可能是竞争机制。
本研究采用光谱法及相关计算机化学的方法,基于Alp的特殊结构及其光谱性质,与BHG键合时能发生Förster非辐射能量转移,计算得到不同温度条件下的键合常数说明Alp与BHG的键合作用较强。计算机分子模拟确定了Alp键合在BHG的疏水腔内,这与荧光滴定实验得到的热力学常数的计算结果(主要是疏水作用)相一致。紫外光谱法及多种荧光光谱法表征了Alp的存在对BHG的构象有一定影响。所有实验结果均从分子水平上了解了Alp与模型蛋白的键合反应及作用机制,并将实验结果与Alp和其他蛋白的相互作用进行了比较。
参考文献:
[1] 乔春峰, 徐珞珊, 王峥涛, 等. 山姜素和豆蔻明的研究概况[J].中国野生植物资源, 2001, 20(6): 11-13. DOI:10.3969/ j.issn.1006-9690.2001.06.004.
[2] BARBARA G, OLAF K, FRANZ B. Compounds of Alpinia katsumadai as potential efflux inhibitors in Mycobacterium smegmatis[J]. Bioorganic and Medicinal Chemistry, 2012, 20(8):2701-2706. DOI:10.1016/j.bmc.2012.02.039.
[3] 聂容荣, 袁晟光, 刘杰, 等. 山姜素对急性重症胰腺炎大鼠肺损伤中水通道蛋白-1表达的影响[J]. 中国老年学杂志, 2015(18): 5062-5064. DOI:10.3969/j.issn.1005-9202.2015.18.007.
[4] WENYING H, YING L, CHUNXIA X, et al. Effect of Chinese medicine alpinetin on the structure of human serum albumin[J]. Bioorganic and Medicinal Chemistry, 2005, 13(5): 1837-1845. DOI:10.1016/j.bmc.2004.11.038.
[5] YONGNIAN N, SHUANGSHUANG W, SERGE K. Spectrometric study of the interaction between alpinetin and bovine serum albumin using chemometrics approaches[J]. Analytica Chimica Acta, 2010, 663(2): 139-146. DOI:10.1016/j.aca.2010.01.053.
[6] GUOWEN Z, NAN Z, XING H, et al. Interaction of alpinetin with bovine serum albumin: probing of the mechanism and binding site by spectroscopic methods[J]. Spectrochimica Acta Part A, 2010, 76(3/4):410-417. DOI:10.1016/j.saa.2010.04.009.
[7] 杨频, 高飞. 生物无机化学原理[M]. 北京: 科学出版社, 2002: 226-227.
[8] FORSTER T. Modern quantum chemistry[M]. New York: Academic Press, 1965: 93-137.
[9] 张蕊, 吴超仪, 刘宇, 等. 分子对接和荧光光谱法研究麦角甾醇与牛血清白蛋白的相互作用[J]. 食品科学, 2015, 36(23): 38-42. DOI:10.7506/spkx1002-6630-201523008.
[10] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. New York: Plenum, 1983: 341-379.
[11] 杨频, 高飞. 生物无机化学原理[M]. 北京: 科学出版社, 2002: 322.
[12] BHATTACHARYA J, BHATTACHARYA M, CHAKRABORTY, et al. Interaction of chlorpromazine with mioglobin and hemoglobin. a comparative study[J]. Biochemical Pharmacology, 1994, 47(11): 2049-2053. DOI:10.1016/0006-2952(94)90080-9.
[13] TIMASEFF S N. Thermodynamics of protein interactions[M]// PEETERS H. Proteins of biological fl uids. Oxford: Pergamon Press, 1972: 511-519.
[14] 古练权, 许家喜, 段玉峰. 生物化学[M]. 北京: 高等教育出版社, 2000: 160-227.
[15] KIDO C, MURANO S, TSURUOKA M. Rapid and simple detection of PCR product DNA: a comparison between Southern hybridization and fl uorescence polarization analysis[J]. Gene, 2000, 259(1/2): 123-127. DOI:10.1016/S0378-1119(00)00457-1.
[16] 许金钩, 王尊本. 荧光分析法[M]. 3版. 北京: 科学出版社, 2006:154-186.
[17] 王亚俐, 王海芳. 光谱法研究苯甲酸钠与牛血清白蛋白的作用[J].北京大学学报(自然科学版), 2002, 38: 159-163. DOI:10.3321/ j.issn:0479-8023.2002.02.003.
[18] 徐冬兰, 周莉, 胡冰, 等. 苦丁冬青苦丁茶中咖啡酰奎尼酸类物质与牛血清白蛋白的相互作用[J]. 食品科学, 2015, 36(11): 6-12. DOI:10.7506/spkx1002-6630-201511002.
[19] WSZELAKA-RYLIK M, ZIELENKIEWICZ W J. Enthalpy change of salting processes of hen egg white lysozyme in various electrolyte solutions[J]. Journal of Thermal Analysis and Calorimetry, 2006, 83(3): 607-610. DOI:10.1007/s10973-005-7414-0.
[20] 李淑英, 董诗浩, 苏亚丽, 等. 金属胁迫培养对微生物蛋白质含量的影响[J]. 安徽农业科学, 2011, 39(31): 19051-19053. DOI:10.3969/ j.issn.0517-6611.2011.31.008.
[21] YAOYU Z, LIN T, GUANGMING Z, et al. Current progress in biosensors for heavy metal ions based on DNAzymes/DNA molecules functionalized nanostructures[J]. Sensors and Actuators B: Chemical, 2016, 223: 280-294. DOI:10.1016/j.snb.2015.09.090.
[22] WEI F, YONGQIANG Z, HONGHUA D, et al. Interaction of divalent metal ions with human translocase of inner membrane of mitochondria Tim23[J]. Biochemical and Biophysical Research Communications, 2016, 475(1): 76-80. DOI:10.1016/j.bbrc.2016.05.039.
[23] 曹洪玉, 张莹莹, 唐乾, 等. 不同类型表面活性剂与蛋白质作用研究进展[J]. 大连大学学报, 2014(6): 62-68. DOI:10.3969/ j.issn.1008-2395.2014.06.015.
[24] 张丽娟, 张欣. 吖啶类荧光探针与蛋白质相互作用的研究[J]. 化学工程师, 2014(8): 75-78. DOI:10.3969/j.issn.1002-1124.2014.08.026.
[25] 施蕴渝, 吴季辉. 应用核磁共振波谱技术研究蛋白质相互作用[J].科学通报, 2009(8): 1017-1022.
[26] 唐江宏, 连宁, 张国华, 等. 小分子物质与蛋白质相互作用研究方法的现状与进展[J]. 江苏技术师范学院学报, 2010, 16(12): 1-7. DOI:10.3969/j.issn.1674-8522.2010.12.001.
[27] 覃思, 吴卫国, 刘焱, 等. 茶多酚与蛋白质的相互作用对蛋白质功能特性的影响研究进展[J]. 食品工业科技, 2008, 29(6):310-312; 316.
[28] WENYING H, XIAOJUN Y, XIULI W, et al. Characterization of the binding of shikonin to human immunoglobulin using scanning electron microscope, molecular modeling and multi-spectroscopic methods[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 150: 514-522. DOI:10.1016/j.saa.2015.04.085.
[29] 何文英, 胡之德, 姚小军, 等. 比较研究山姜素和豆蔻明与人-γ球蛋白的相互作用[J]. 化学学报, 2010, 68(7): 679-688.
[30] WENYING H, YING L, JIANGHONG T, et al. Comparison of the characterization on binding of alpinetin and cardamonin to lysozyme by spectroscopic methods[J]. International Journal of Biological Macromolecules, 2006, 39(4/5): 165-173. DOI:10.1016/ j.ijbiomac.2005.11.003.
Interaction of Alpinetin from Alpinia katsumadai with Hemoglobin
XU Anqi
1, WU Ningning
1, WU Xuechun
1, LIU Ping
1, YAO Xiaojun
2, CHEN Guangying
3, HE Wenying
1,*
(1. College of Chemistry and Chemical Engineering, Hainan Normal University, Haikou 571158, China; 2. College of Chemistry and Chemical Engineering, Lanzhou University, Lanzhou 730000, China; 3. Key Laboratory of Tropical Medicinal Plant Chemistry, Ministry of Education, Hainan Normal University, Haikou 571158, China)
Abstract:Alpinetin (Alp), a main active component of Alpinia katsumadai, was used to study the mechanism underlying its interaction with hemoglobin (BHG) by fl uorescence polarization, synchronous fl uorescence, 3D fl uorescence and absorption spectroscopy combined with molecular modeling technique under physiological conditions. The data from the overlapping spectra conf i rmed that the interaction between Alp and BHG could be matched with the non-radioactive energy transfer theory. Various binding constants (5.880 × 10 4, 4.337 × 10 4and 4.935 × 10 4L/mol for quenching mechanism; 3.239 × 10 3, 5.225 × 10 3and 7.692 × 10 3L/mol for sensitization effect) and thermodynamic parameters (ΔS: 182.073 J/(mol·K), ΔH: 34.320 kJ/mol, ΔG: -20.119 (299 K), -21.940 (309 K) and -23.760 kJ/mol (319 K)) for Alp-BHG systems were hereby obtained under different temperatures (299, 309 and 319 K) based on different action mechanisms. Molecular docking was performed to reveal the binding of Alp moiety to the hydrophobic cavity of BHG and the acting force was mainly a hydrophobic interaction. The low anisotropy values suggested that there was shorter relaxation time and Alp molecules were observed in a motionally unrestricted environment introduced by BHG. The synchronous fl uorescence and absorption spectra showed that the addition of Alp impacted the microenvironment around BHG in aqueous solution. The 2D and 3D fl uorescence spectroscopy of Alp-BHG system indicated that Alp strongly quenched the intrinsic fl uorescence of BHG causing a conformational change of the protein. The results indicated that the interaction between Alp and BHG was strong, implying that Alp may be stored and transferred by BHG in some degree. In addition, the effects of common ions on the constants of alpinetin-BHG complex were also discussed, indicating an increasing trend for binding constants in the present of different metal ions.
DOI:10.7506/spkx1002-6630-201703014
中图分类号:O625
文献标志码:A
文章编号:1002-6630(2017)03-0081-07
收稿日期:2016-04-04
基金项目:国家自然科学基金地区科学基金项目(31360069);海南省大学生创新项目(003010151064);海南省中药现代化项目(ZY201330);海南省自然科学基金创新研究团队项目(2016CXTD007)
作者简介:许安琪(1994—),女,学士,研究方向为小分子与生物大分子的相互作用。E-mail:749808786@qq.com
*通信作者:何文英(1969—),女,教授,博士,研究方向为小分子与生物大分子的相互作用。E-mail:hewenying@hainnu.edu.cn
引文格式:
许安琪, 吴宁宁, 吴雪春, 等. 草豆蔻中的山姜素与血红蛋白的相互作用[J]. 食品科学, 2017, 38(3): 81-87. DOI:10.7506/ spkx1002-6630-201703014. http://www.spkx.net.cn
XU Anqi, WU Ningning, WU Xuechun, et al. Interaction of alpinetin from Alpinia katsumadai with hemoglobin[J]. Food Science, 2017, 38(3): 81-87. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703014. http://www.spkx.net.cn
Key words:alpinetin; bovine hemoglobin; energy transfer; interaction