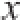 ±s表示,组间比较采用t检验。
±s表示,组间比较采用t检验。
孙婷婷 1,李妍妍 2,周 君 1,张迪骏 1,李 晔 1,张春丹 1,何 珊 1,黄忠白 1,苏秀榕 1,⋆
(1.宁波大学海洋学院,浙江 宁波 315211;2.康奈尔大学农业与生命科学学院,美国 纽约州 伊萨卡 14850)
摘 要:目的:研究金枪鱼胰脏酶解多肽对db/db糖尿病小鼠体质量、血清胰岛素、糖化血红蛋白、血脂的影响,为进一步开发金枪鱼胰脏、研制新型保健型食品提供理论依据。方法:雄性Db/m小鼠为空白对照组,雄性db/db小鼠30 只,分为模型对照组、阳性药组(甲基巴多索隆9.75 mg/(kg·d))、实验组,实验组灌胃金枪鱼胰脏酶解多肽(50 mg/(kg·d))。10 周后测定各组小鼠体质量、血清胰岛素、糖化血红蛋白、血脂水平等指标。利用基因芯片技术,比较不同组间肾脏基因的表达水平。结果:与模型对照组相比,实验组能显著降低糖尿病小鼠的体质量、血清胰岛素、糖基化血红蛋白水平;降低总胆固醇、甘油三酯、低密度脂蛋白胆固醇水平,升高高密度脂蛋白胆固醇水平。并且,与模型对照组的差异表达比较,实验组基因表达水平有显著改变,获得差异基因678 个,其中161 个上调,517 个下调。结论:金枪鱼胰脏酶解多肽可以改善db/db糖尿病小鼠的体质量、血清胰岛素、糖化血红蛋白、血脂水平,其作用效应可能与其下调醛固酮合成相关基因CYP11B1的表达水平有关。
关键词:金枪鱼胰脏;酶解多肽;糖尿病;db/db小鼠;CYP11B1
金枪鱼(Thunnus thynnus),属脊索动物门(Chordata),硬骨鱼纲(Osteichthyes),鲈形目(Perciformes),鲭科(Scombridae),鱼类中具有胸甲(指胸区和侧线前部明显扩大的鳞片)的几个属鱼类的总称 [1]。金枪鱼肉质鲜嫩,富含蛋白质、脂肪、维生素和微量元素,是国际健康学会推荐的健康美食。金枪鱼一般制成冷冻鱼肉、寿司或罐装食品,附加值非常高,但在加工过程中产生大量废弃物,如鱼头、鱼骨、内脏等 [2]。金枪鱼的腮肌已退化,若停止游泳会因为缺氧窒息而死。因此金枪鱼必须不停地游动,使新鲜水流流过腮部获得氧气。为了补充不断游动及旺盛的新陈代谢所消耗的能量金枪鱼不断进食,其胰腺十分发达,以加快糖在体内的分解速率,从而满足其在突发性运动时对化学能量的需求。胰脏作为金枪鱼主要的消化腺,约占内脏比例的27% [3]。胰脏是高等动物体内具有分泌功能的实体性腺体,含有蛋白质、胰酶、激素、多肽、氨基酸、核苷酸、脂类、多糖等活性物质 [4-6]。
糖尿病是一组由于胰岛素分泌不足或(和)胰岛素作用低下而引起的代谢性疾病,高血糖是其特征,而长期的高血糖将导致多种器官的损害、功能紊乱和衰竭,尤其是糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常见的慢性并发症之一,在糖尿病患者中20%~40%会发生。在欧美,DN是引发终末期肾病的首要原因。其发病机制虽未完全阐明,但糖代谢紊乱引起多元醇通路、蛋白激酶C、晚期糖基化产物、己糖胺4 种途径的激活、肾脏血流动力学改变、氧化应激、多种细胞因子以及遗传背景均起重要作用 [7-8]。
本实验以高血糖、高胰岛素、高脂血症为特点的自发性Ⅱ型糖尿病db/db小鼠为模型,探究金枪鱼胰脏酶解多肽对糖尿病的治疗作用。
1.1 材料、小鼠与试剂
金枪鱼胰脏取自宁波今日食品有限公司。
db/db小鼠(36±2.0)g,雄性,30 只;Db/m小鼠(25±1.0)g,雄性,10 只,均购自上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2007-0005(编号:2007000528007)。
小鼠8*60K表达谱芯片、基因芯片杂交试剂 美国Agilent公司;总RNA提取的Trizol试剂 美国Invitrogen公司;mRNA纯化试剂盒 美国Promega公司;小鼠胰岛素酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海依科赛生物制品有限公司;小鼠体质量、胰岛素、糖化血红蛋白试剂盒南京建成生物工程研究所;总胆固醇(total cholesterol,TC)、总甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterin,LDL-C)及高密度脂蛋白胆固醇(high-density lipoprotein cholesterin,HDL-C)试剂盒 宁波溢美生物科技有限公司。
1.2 仪器与设备
H1650型高速台式离心机 长沙湘仪离心机仪器有限公司;7020全自动生化分析仪 日本日立仪器公司;DNA微阵列扫描仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 动物分组与饲养
10 只雄性Db/m小鼠为空白对照组;雄性db/db小鼠30只,按体质量随机分成模型对照组、阳性药组(9.75 mg/(kg·d))、实验组(50 mg/(kg·d)),每组10 只。阳性药为甲基巴多索隆(CDDO-Me),已用于Ⅱ型糖尿病4期的治疗 [9]。实验组灌胃金枪鱼胰脏酶解多肽 [6]。空白对照组与模型对照组灌以等量去离子水。实验期间,各组自由进食水,室温保持25 ℃左右,光照昼夜间隔12 h,给药时间为10 周。每天观察动物的精神状态、反应、行为活动、排便情况、眼睛及孔道分泌物、毛色及清洁度等。摄食量、体质量变化情况每隔3 d测定1 次,以调整灌胃剂量。
1.3.2 血液生理生化指标检测
第69天末次给药后,禁食、禁水24 h,第70天处死,测定体质量后取样。各组小鼠用质量分数2%戊巴比妥钠(25 mL/kg)麻醉,腹主动脉采血,其中800 μL全血用乙二胺四乙酸抗凝,3 500 r/min离心15 min,制得血浆,用于检测糖化血红蛋白含量。剩余全血,3 000 r/min离心10 min,制得血清,采用全自动生化分析仪测定血清中TC、TG、HDL-C、LDL-C含量。采用ELISA测定小鼠血清胰岛素。
1.3.3 表达谱基因芯片筛选差异基因
1.3.3.1 RNA的提取和cDNA的制备
取小鼠肾脏100 mg,液氮研磨后用Trizol一步法提取总RNA,定量及质量检测后纯化RNA。反转录成cDNA、荧光标记cDNA后纯化、检测浓度和荧光标记量。
1.3.3.2 杂交和芯片扫描
标记的DNA溶于杂交液中,于65 ℃、10 r/min滚动杂交17 h。芯片洗涤、干燥后利用DNA微阵列扫描仪,在分辨率为5 μm,扫描仪自动以100%和10% PMT各扫描1 次,两次结果利用软件合并。以特征提取软件读取原始数据,并进行背景值修正和分位数标准化处理,将标准化后的数据导入GeneSpring GX v11.5.1软件,比较两组样品间标准化值,计算差异倍数,并对其取对数。筛选差异倍数≥2的基因作为显著差异基因,即log 2(Cy3强度)≥2.0者为表达显著上调基因,log 2(Cy3强度)≤-2.0者为表达显著下调基因。
1.4 统计分析
数据用SPSS 19.0软件进行单因素方差分析,结果以
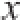 ±s表示,组间比较采用t检验。
±s表示,组间比较采用t检验。
2.1 金枪鱼胰脏酶解多肽对动物生活状态的影响
空白对照组小鼠状态良好,活动灵活,反应敏捷,被毛有光泽,饮水量和进食量均正常,体质量逐渐增加。与空白对照组比较,模型对照组小鼠活动量明显减少,体质量减轻,多尿症状明显,被毛发黄蓬松稀疏。与模型对照组比较,实验组小鼠活动量有所增加,体质量减轻缓慢,尿量减少,糖尿病症状得到缓解。
2.2 金枪鱼胰脏酶解多肽对小鼠体质量、血清胰岛素和糖化血红蛋白的影响
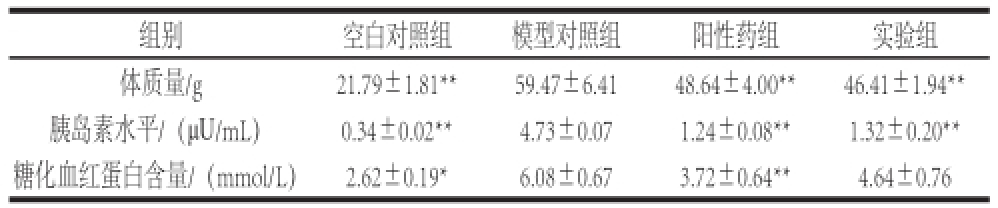
表1 胰脏酶解液对小鼠体质量、血清胰岛素及糖化血红蛋白的作用
Table1 Effect of enzymatic hydrolysate derived from tuna pancreas on BW, FINS and HbAlc in mice
注:⋆.与模型对照组比较,有显著性差异(P<0.05);⋆⋆.与模型对照组比较,有极显著性差异(P<0.01)。下同。
组别空白对照组模型对照组阳性药组实验组体质量/g21.79±1.81⋆⋆59.47±6.4148.64±4.00⋆⋆46.41±1.94⋆⋆胰岛素水平/(μU/mL)0.34±0.02⋆⋆4.73±0.071.24±0.08⋆⋆1.32±0.20⋆⋆糖化血红蛋白含量/(mmol/L)2.62±0.19⋆6.08±0.673.72±0.64⋆⋆ 4.64±0.76
由表1可见,与空白对照组比较,模型对照组小鼠体质量显著上升(P<0.01),阳性药组和实验组小鼠体质量与模型对照组差异极其显著(P<0.01),其中阳性药组小鼠体质量大于实验组而小于模型对照组。模型对照组血清胰岛素水平显著高于空白对照组(P<0.01),阳性药组和实验组分别与模型对照组差异极其显著(P<0.01)。模型对照组糖化血红蛋白水平高于空白对照组(P<0.05),阳性药组与模型对照组差异极其显著(P<0.01),实验组与模型对照组差异不显著(P>0.05),原因可能是胰脏多肽对糖化血红蛋白的作用不明显。
2.3 金枪鱼胰脏酶解多肽对小鼠血脂的影响
表2 胰脏酶解液对小鼠血脂的影响
Table2 Effect of enzymatic hydrolysate derived from tuna pancreas on serum lipid levels in mice
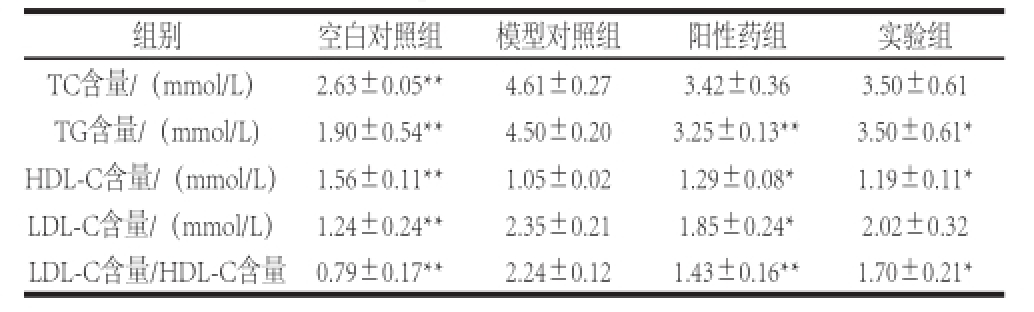
组别空白对照组模型对照组阳性药组实验组TC含量/(mmol/L)2.63±0.05⋆⋆4.61±0.273.42±0.363.50±0.61 TG含量/(mmol/L)1.90±0.54⋆⋆4.50±0.203.25±0.13⋆⋆3.50±0.61⋆HDL-C含量/(mmol/L)1.56±0.11⋆⋆1.05±0.021.29±0.08⋆1.19±0.11⋆LDL-C含量/(mmol/L)1.24±0.24⋆⋆2.35±0.211.85±0.24⋆2.02±0.32 LDL-C含量/HDL-C含量0.79±0.17⋆⋆2.24±0.121.43±0.16⋆⋆1.70±0.21⋆
如表2所示,与空白对照组相比,模型对照组血清TC、TG、LDL-C水平极显著升高(P<0.01),HDL-C含量极显著降低(P<0.01)。相比模型对照组,阳性药组和实验组血清中TC含量降低(P>0.05);阳性药组和实验组血清中TG含量显著降低(P<0.01,P<0.05);阳性药组和实验组血清中LDL-C含量降低(P<0.05,P>0.05),其中实验组对LDL-C的作用效果不明显;阳性药组和实验组血清中HDL-C含量显著升高(P<0.05)。阳性药组和实验组均能显著降低LDL-C含量与HDL-C含量比值(P<0.01,P<0.05)。
2.4 小鼠基因表达的差异
2.4.1 RNA的质量
在琼脂糖凝胶电泳中的28S是18S的2 倍,且未出现核糖体RNA带的弥散,无降解现象,比值范围在1.8~2.1,说明其质量已经能满足实验要求,见图1。
图1 小鼠肾总RNA电泳图
Fig.1 Electrophoresis of total RNA derivded from mouse kidney
2.4.2 芯片杂交体系验证及基因表达谱
利用非监督聚类的等阶聚类方法做比较分析后,用基因分布的火山图展示了实验组小鼠和模型对照组小鼠的RNA表达差异。A区域为上调基因,B区域为下调基因,其他区域为相同基因(表3、图2)。表3为实验组和模型对照组部分差异基因。
表3 实验组和模型对照组部分差异表达基因
Table3 Partial differentially expressed genes in the mice from the model control and experimental groups

差异蛋白基因差异倍数假定同源盒转录因子2Phtf23.9钙调磷酸酶结合蛋白1Cabin13.6锌指蛋白143Zfp1433.4血红素加氧酶1Hmox13.2谷氨酸受体相互作用蛋白2Grip23.2转录调节Sin3b3.2蛋白激酶Prkar1a3.2信号调节蛋白β1A Sirpb1a3.0载脂蛋白A pold13.0骨肉瘤癌基因BFosb2.8囊泡运输蛋白Sec22a2.7激活转录因子3Atf32.6突出结合蛋白5Stxbp5l2.6尿蛋白9Mup92.4核糖核蛋白Raver12.3白细胞免疫球蛋白受体Lilra62.2胰凝乳蛋白酶原B1Ctrb10.49磷酸腺苷1BAbcb1b0.49血纤维蛋白溶酶原Plg0.49大麻素受体1Cnr10.45缓激肽受体β1Bdkrb10.44苯乙醇胺-N-甲基Pnmt0.44胃泌素释放肽受体Grpr0.38丝氨酸肽酶1Masp10.38羟肽酶A2Cpa20.35降脂蛋白Cfd0.30溶质载体7Slc22a70.29弹性蛋白酶3BCela3b0.28褪黑激素受体1AMtnr1a0.28神经介素B受体Nmbr0.28丝氨酸肽酶抑制剂Serpind10.28胶原蛋白α-3Col5a30.25清道夫受体B1Scarb10.22 ATP酶α-4Atp1a40.14乙醇脱氢酶7Adh70.14 ATP酶α-3Atp1a30.13蛋白酶Prss20.13胰脂肪酶Pnlip0.11醛酮还原酶18Akr1c180.11黑皮素2受体Mc2r0.10淀粉酶2A5Amy2a50.10速激肽受体2Tacr20.09羧肽酶A1Cpa10.09 T-细胞特异性GTP酶2Tgtp20.07羧肽酶B1Cpb10.06羟基-δ-5-类固 醇脱氢酶Hsd3b10.03
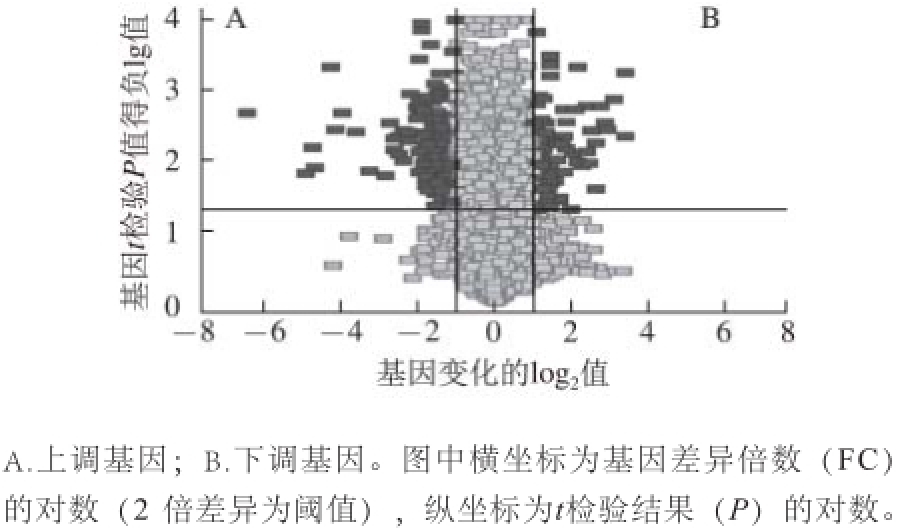
图2 小鼠肾基因分布的火山图
Fig.2 Volcano plots of gene distribution in mouse kidney
利用SAM进行分析,模型对照组和实验组区分度高,存在显著的差异。芯片结果显示,模型组和实验组比较,获得差异基因678 个,其中161 个上调,517 个下调。通过基因倍数变化的log 2值,可以看出上调基因中有145 个变化值:2>log 2的变化值>1,即4>基因上调倍数>2;下调基因中有357 个变化值:-1>log 2的变化值>-2,即4>基因下调倍数>2(图3)。
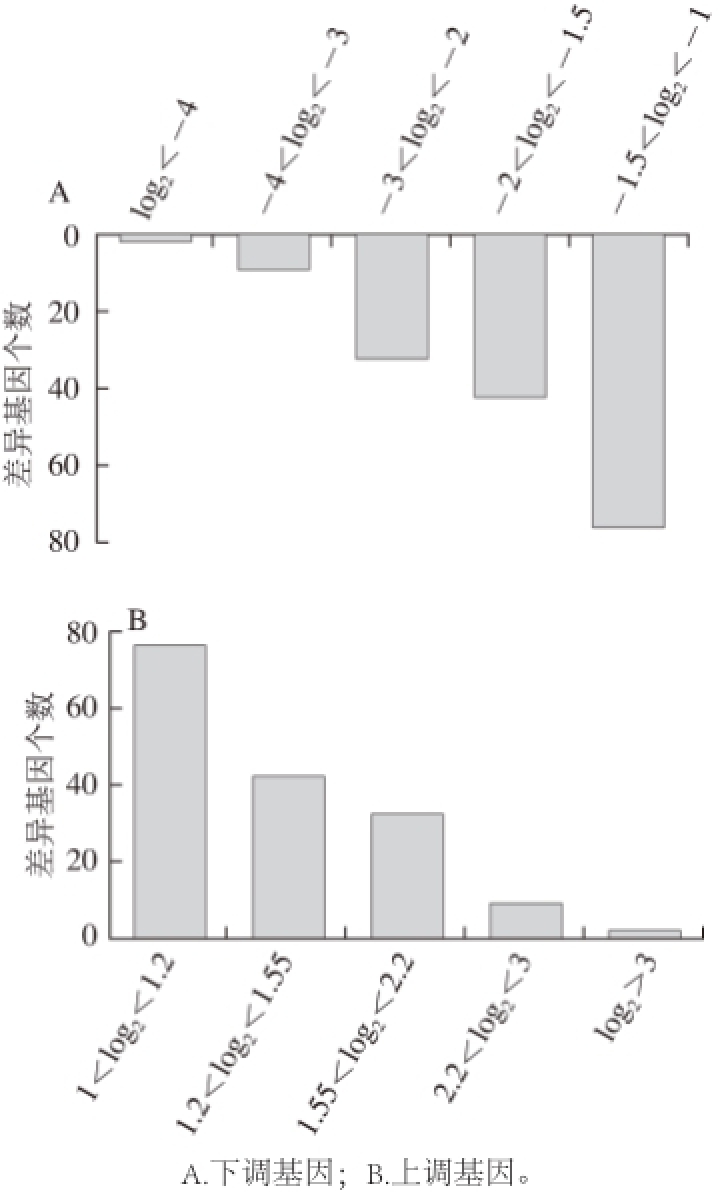
图3 差异基因分布情况
Fig.3 Distribution of differentially expressed genes
2.4.3 差异基因的功能注释和代谢通路分析
差异基因的GO分析显示,在生物学过程分析中,实验组与调控相关的基因31%,与新陈代谢相关的基因17.8%,与信号传递有关的基因6.9%;下调基因与调控相关的基因16.2%,与类固醇相关的基因9.9%,与离子运输有关的基因11.7%。细胞组分分析中,实验组上调与细胞器相关的基因39.3%,蛋白质等其他大分子复合物为12.1%;下调与细胞器相关的基因40.8%,细胞外基质为51.3%。分子功能过程分析中,实验组上调有催化活性的基因为44.8%,蛋白质等其他大分子复合物为24.1%;下调有催化活性的基因63.4%,离子运输相关4%。db/db糖尿病与许多基因表达之间存在广泛的作用,而这些基因中含有某些关键代谢酶的密码,往往可以控制新陈代谢途径中关键酶的表达,从而对整个新陈代谢产生影响。食用金枪鱼胰脏酶解液后,小鼠与催化功能相关的基因变化非常明显,与调控相关的基因次之(图4)。
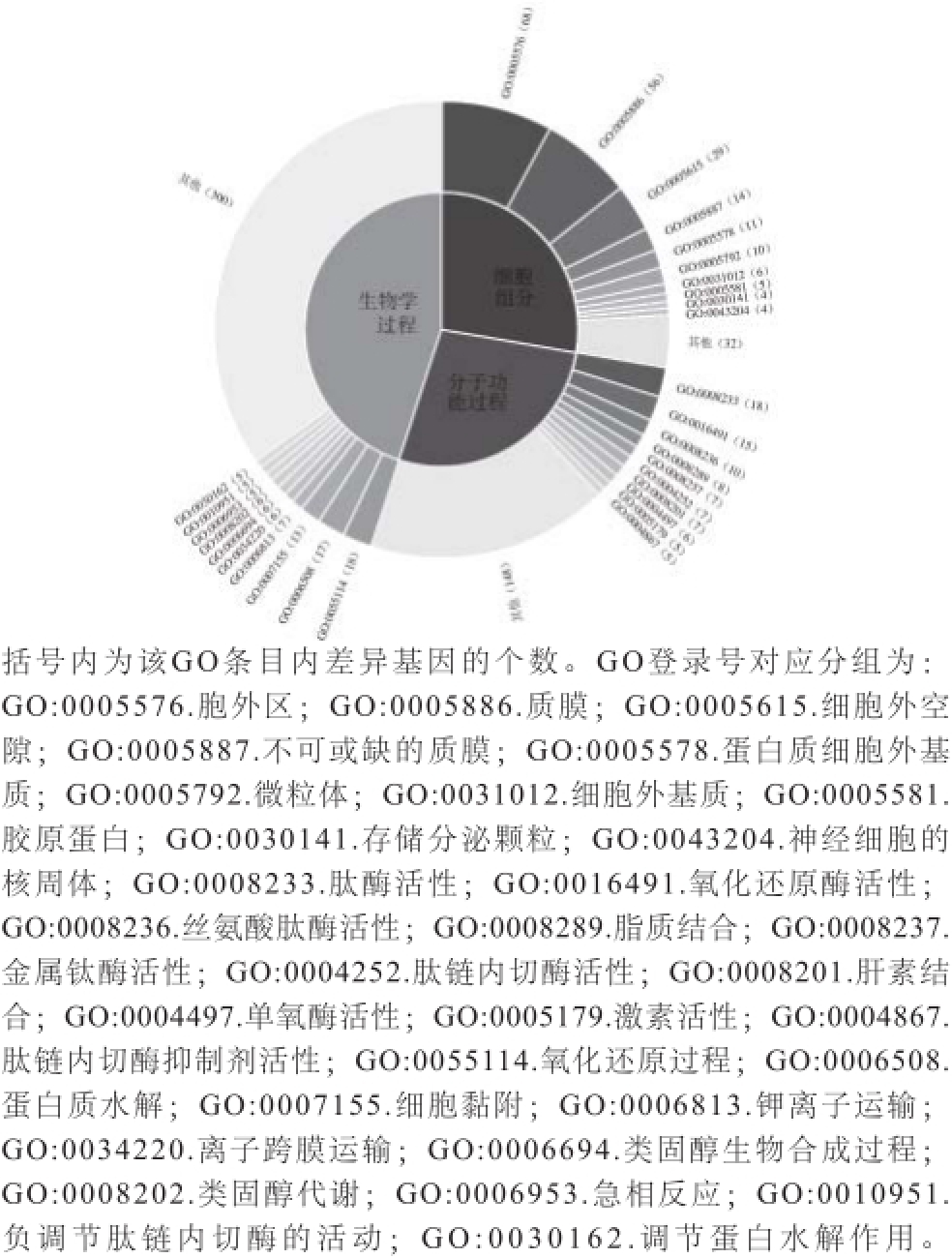
图4 差异基因GO分析
Fig.4 Gene ontology of differentially expressed genes
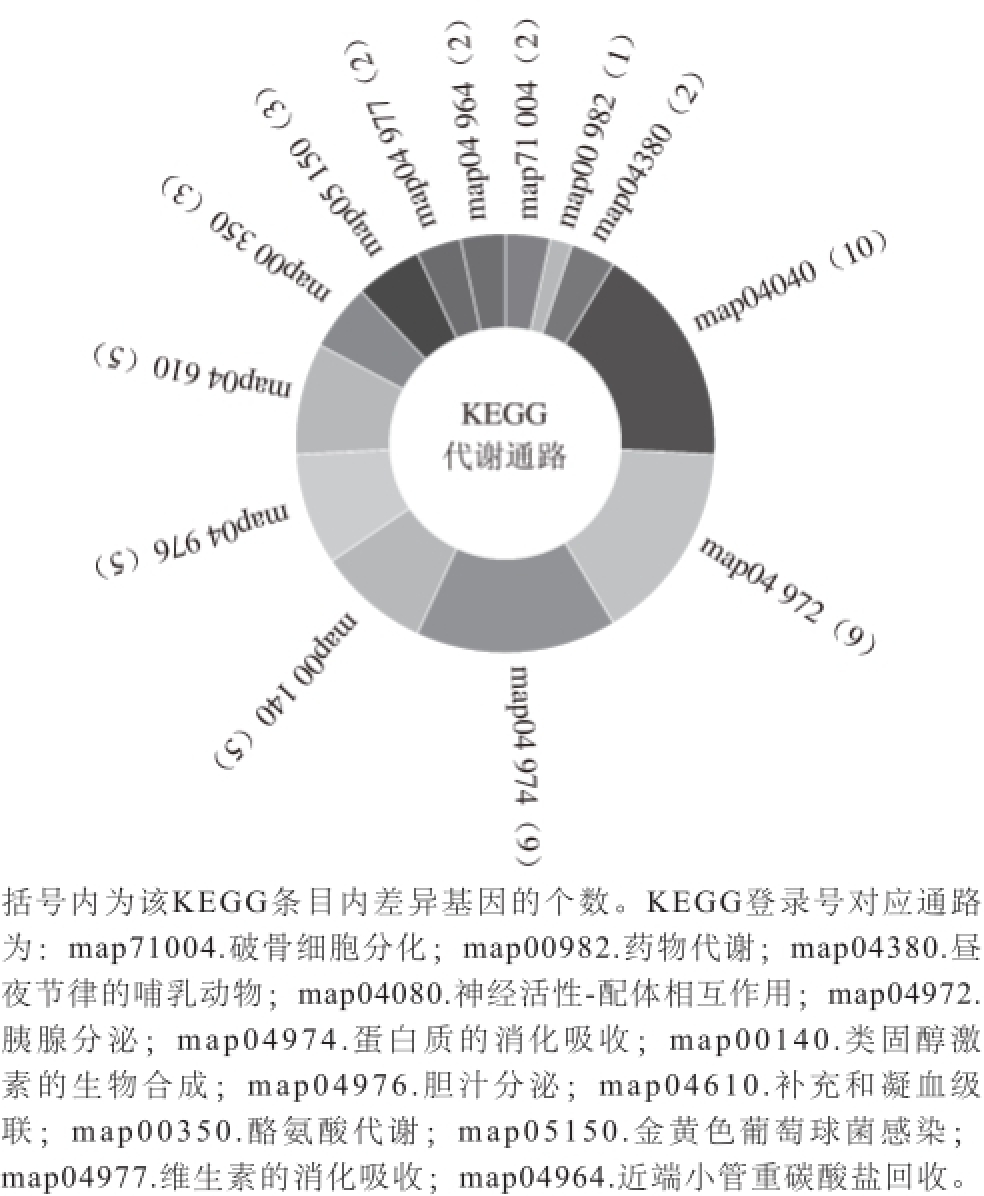
图5 差异基因的KEGG代谢通路分析
Fig.5 KEGG pathway analysis of differentially expressed genes
KEGG代谢通路分析显示,差异基因一共参与了13 个代谢通路,主要涉及了相关蛋白合成相关的通路,包括胰腺分泌、蛋白质的消化吸收、酪氨酸代谢,以及相关大分子物质分泌合成的一系列通路,包括类固醇激素的生物合成、胆汁分泌、维生素的消化吸收(图5)。
实践证明生物体内代谢酶的活性和浓度会因为不同的营养条件而存在较大的差异,这主要是由于食物中的营养物质影响了基因的表达 [10]。当某种营养素缺失或过多时,在分子水平上表现为某个或某些基因的开放、关闭或表达量的变化,虽然动物的遗传特征不会因为营养素而改变,但它可以通过启动或终止一些基因的表达而改变遗传特征出现的时间框架。胰脏含有蛋白质、胰岛素、胰酶、激素、多肽、氨基酸、多糖等多种活性物质,因酶的选择性作用,在酶解过程中保留部分活性,且便于生命体吸收 [11-12]。
3.1 对糖尿病小鼠体质量、胰岛素和糖化血红蛋白的影响
目前认为2型糖尿病(type 2 diabetes,T2DM)是遗传因素与环境因素共同作用的结果,而环境因素中由生活方式导致的肥胖对T2DM的发生和发展有很大影响 [13-14]。我国糖尿病发病率连年攀升,与近几年我国肥胖发病率连年上升密不可分,T2DM病人中,80%有肥胖史 [15]。本实验以db/db小鼠为模型,给药10 周后测体质量,探讨金枪鱼胰脏多肽对糖尿病小鼠体质量的影响,结果发现胰脏多肽对db/db小鼠体质量有显著降低作用。
胰岛素抵抗(insulin resistance,IR)是2型糖尿病的主要特征之一,为了调节血糖在正常水平,机体分泌过多胰岛素,即高胰岛素血症,从而导致机体一系列病理变化 [16-17]。目前治疗IR的药物多为西药 [18]。本实验模型对照组出现明显的胰岛素抵抗,血清胰岛素水平明显高于空白对照组。相比模型对照组,实验组血清胰岛素水平显著降低。可见,金枪鱼胰脏多肽可明显缓解db/db小鼠胰岛素抵抗。
血液中红细胞内的血红蛋白与血糖结合的产物是糖化血红蛋白,其结合生成糖化血红蛋白是不可逆过程,并与血糖浓度成正比 [19]。2010年1月国际专家委员会发表声明将糖化血红蛋白作为糖尿病诊断指标,确定糖化血红蛋白水平≥6.5%为诊断切点,这也进一步确定了糖化血红蛋白在糖尿病诊断史上的地位 [20-21]。空腹血糖水平与糖化血红蛋白水平呈正相关,糖化血红蛋白是糖尿病诊断良好的补充,空腹血糖结果易浮动,糖化血红蛋白结果较稳定 [22]。本实验模型组糖化血红蛋白水平显著升高,相比模型对照组,实验组糖化血红蛋白水平降低(不显著)。可见,金枪鱼胰脏酶解肽可降低db/db小鼠糖化血红蛋白。
3.2 对糖尿病小鼠血脂的影响
糖尿病一般伴随脂代谢异常,即血清TG、LDL-C含量升高,HDL-C含量降低。本实验模型对照组出现明显的脂代谢异常,TC、TG、LDL-C含量均明显高于空白对照组(P<0.01),HDL-C含量极显著降低(P<0.01)。相比模型对照组,实验组T G含量均显著降低(P<0.05),HDL-C含量升高(P<0.05)。此外,实验组可有效降低动脉硬化指数(LDL-C含量/HDL-C含量),说明金枪鱼胰脏酶解肽有调节糖尿病小鼠血脂紊乱的作用。3.3 基因表达
喂食金枪鱼胰脏肽的db/db小鼠基因表达出现了明显的变化,实验组相对于模型对照组下调的基因数量明显多于上调基因的数量,差异基因包括能量代谢相关、糖代谢、细胞生长、合成及分解代谢、信号传递因 子等。
醛固酮是体内最重要、作用最强的盐皮质激素,以往一直认为醛固酮仅由肾上腺皮质球状带分泌,主要作用于肾,起滞钠排钾的作用,这是醛固酮的经典效应。最近越来越多的研究发现醛固酮水平除受血管紧张素Ⅱ、促肾上腺皮质激素、血钾、体位、生物节律等因素影响外,更与醛固酮合成酶的活性相关 [23-24]。醛固酮是维持心血管结构与功能重要的神经体液因子,能够调节肾脏血液流量和肾小球滤过率,动物实验发现醛固酮有促进肾脏纤维化的作用 [25-26]。现有的资料分析认为,除了低钾血症导致的胰岛素分泌受损和胰岛素敏感性下降外,体内过高的醛固酮对胰岛素作用所产生的直接效应可能是导致糖尿病更主要的因素 [27-28]。体内醛固酮是由胆固醇在一系列酶的催化作用下,经过孕烯醇酮、黄体酮等中间产物最终生成。该过程涉及两个重要基因:CYP11B1(醛固酮合酶1)和CYP11B2(醛固酮合酶2)。过去认为,CYP11B1基因只能编码类固醇11β-羟化酶,调控皮质类固醇的生物合成。但研究表明 [29-30],CYP11B1基因也编码21-羟化酶,参与调控醛固酮合成的早期阶段。本实验基因芯片结果显示喂食金枪鱼胰脏酶解多肽的db/db糖尿病小鼠CYP11B1基因下调明显(10 倍),故可推断醛固酮合成早起阶段的关键酶21-羟化酶合成减少,故醛固酮合成受到抑制,进而缓解小鼠糖尿病病症。
参考文献:
[1] SONAWANE R D, VISHWAKARMA S L, LAKSHMI S, et al. Amelioration of STZ-induced type 1 diabetic nephropathy by aqueous extract of Enicostemma littorale Blume and swertiamarin in rats[J]. Molecular and Cellular Biochemistry, 2010, 340(1/2): 1-6. DOI:10.1007/s11010-010-0393-x.
[2] 罗殷, 王锡昌, 刘源. 金枪鱼加工及其综合利用现状与展望[J]. 安徽农业科学, 2008, 36(27): 11997-11998. DOI:10.3969/j.issn.0517-6611.2008.27.150.
[3] 苗振清, 黄锡昌. 远洋金枪鱼渔业[M]. 上海: 科学技术文献出版社, 2003: 85-92.
[4] 杨金生, 霍健聪, 夏松养. 不同品种金枪鱼营养成分的研究与分析[J].浙江海洋学院学报(自然科学版), 2013(5): 393-397. DOI:10.3969/ j.issn.1008-830X.2013.05.003.
[5] WOO J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowf i n tuna (Thunnus albacares) dorsal skin[J]. Food Hydrocolloids, 2008, 22(5): 879-887. DOI:10.1016/j.foodhyd.2007.04.015.
[6] 王霞, 苏秀榕, 丁进锋, 等. 响应面法优化双酶水解黄鳍金枪鱼胰脏的工艺研究[J]. 现代食品科技, 2010, 26(11): 1229-1233. DOI:10.3969/ j.issn.1673-9078.2010.11.016.
[7] 王鑫蕾, 崔世维. 2型糖尿病患者糖尿病防治知识认知程度与控制现状分析[J]. 交通医学, 2012, 26(6): 587-589. DOI:10.3969/ j.issn.1006-2440.2012.06.021.
[8] 方京徽, 向红丁. 脂代谢变化与糖尿病阶梯状演变的相关研究[J]. 中国医药导刊, 2008, 10(6): 830-831. DOI:10.3969/ j.issn.1009-0959.2008.06.011.
[9] 王建中. 甲基巴多索隆治疗2型糖尿病和慢性肾脏病4期[J]. 中华肾病研究电子杂志, 2014, 3(1): 49.
[10] 苏秀榕, 金春华, 李妍妍, 等. 利用微阵列基因芯片研究东海海参(Acaudina leucoprocta)的生理功能[J]. 海洋与湖沼, 2011, 42(1): 75-80.
[11] 王霞, 李妍妍, 王奇, 等. 金枪鱼胰脏酶解液对糖尿病大鼠血糖和血脂的作用[J]. 中国食品学报, 2012, 12(7): 24-28. DOI:10.3969/ j.issn.1009-7848.2012.07.004.
[12] 钱琴莲, 李晔, 王求娟, 等. 基于GC-MS和电子鼻技术的金枪鱼胰脏酶解气味解析[J]. 食品科学, 2016, 37(8): 121-126. DOI:10.7506/spkx1002-6630-201608021.
[13] GARCÍA-ESTÉVEZ D A, ARAÚJO-VILAR D, SAAVEDRA-GONZÁLEZ Á, et al. Analysis of the relationship between body mass index, insulin resistance, and beta-cell function: a cross-sectional study using the minimal model[J]. Metabolism, 2004, 53(11): 1462-1466. DOI:/10.1016/j.metabol.2004.06.014.
[14] AVOGARO A, FADINI G P, GALLO A, et al. Endothelial dysfunction in type 2 diabetes mellitus[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2016, 16(Suppl 4): 39-45. DOI:10.1016/j.numecd.2005.10.015.
[15] 李强, 潘红艳. 糖尿病治疗过程中的临床难题-长期有效控制体质量[J]. 中国实用内科杂志, 2009, 29(3): 215-217.
[16] ECKEL R H, GRUNDY S M, ZIMMET P Z. The metabolic syndrome[J]. The Lancet, 2005, 365: 1415-1428.
[17] 杨秀颖, 张莉, 陈熙, 等. 2型糖尿病周围神经病变机制研究进展[J]. 中国药理学通报, 2016, 32(5): 598-602. DOI:10.3969/ j.issn.1001-1978.2016.05.002.
[18] 孙志云, 茅彩萍, 顾振纶. 药物对胰岛素抵抗、PPARγ影响的研究进展[J]. 中国血液流变学杂志, 2005, 15(2): 332-336. DOI:10.3969/ j.issn.1009-881X.2005.02.069.
[19] 胡志坚, 江永青, 虞建新, 等. 2型糖尿病患者Hcy、HbAlc、MAU与肾脏微血管病变的关系探讨[J]. 分子诊断与治疗杂志, 2011, 3(1): 25-28. DOI:10.3969/j.issn.1674-6929.2011.01.007.
[20] 彭湘杭, 杨锐, 艾雅琴, 等. 糖化血红蛋白与空腹血糖诊断糖尿病效 果比较[J]. 广东医学, 2011, 32(7): 863-865. DOI:10.3969/ j.issn.1001-9448.2011.07.018.
[21] 陈妍, 刘建国, 徐磊, 等. 空腹血糖、餐后2 h血糖及糖化血红蛋白对糖尿病的诊断价值[J]. 郑州大学学报医学版, 2012, 47(4): 534-537. DOI:10.3969/j.issn.1671-6825.2012.04.035.
[22] 陆祖谦, 许樟荣. 糖化血红蛋白在糖尿病诊断中的作用[J]. 中国糖尿病杂志, 2009, 17(8): 579-582. DOI: 10.3969/j.issn.1006-6187.2009.08.005.
[23] SILVESTRE J S, ROBERT V, HEYMES C, et al. Myocardial production of aldosterone and corticosterone in the rat physiological regulation[J]. Journal of Biological Chemistry, 1998, 273(9): 4883-4891. DOI:10.1074/ jbc.273.9.4883.
[24] 吴平生, 梁欣伟, 戴云. 肝脏和肺脏醛固酮合成酶基因CYP11B2 mRNA的表达[J]. 中华医学杂志, 1998, 78(8): 620.
[25] 赖凌云, 顾勇, 陈靖, 等. 大鼠系膜细胞醛固酮的合成及 其对细胞外基质生成的影响[J]. 中华医学杂志, 2003, 83(21): 1900-1905. DOI:10.3760/ j:issn:0376-2491.2003.21.016.
[26] 付文成, 彭文, 王浩, 等. 姜黄素对醛固酮诱导肾间质纤维化的保护作用[J]. 现代中西医结合杂志, 2013, 22(2): 133-138. DOI:10.3969/ j.issn.1008-8849.2013.02.008.
[27] KLEIN J. Aldosterone inhibits uncoupling protein-1, induces insulin resistance, and stimulates proinflammatory adipokines in adipocytes[J]. Hormone and Metabolic Res earch, 2005, 37(7): 455-459. DOI:10.1055/ s-2005-870240.
[28] 王霞娟, 卜瑞芳, 邓振霞. 醛固酮与糖尿病及其慢性并发症的关系[J]. 医学研究生学报, 2007, 20(5): 548-552. DOI:10.3969/ j.issn. 1008-8199.2007.05.028.
[29] HATAKEYAMA H, MIYAMORI I, FUJITA T, et al. Vascular aldosterone. Biosynthesis and a link to angiotensin II-induce d hypertrophy of vascular smooth muscle cells[J]. Journal of Biological Chemistry, 1994, 269(39):24316-24320. DOI:10.1007/bf03349773.
[30] BRAND E, CHATELAIN N, MULATERO P, et al. Structural analysis and evaluation of the aldosterone synthase gene in hypertension[J]. Hypertension, 1998, 32(2): 198-204. DOI:10.1161/01.hyp.32.2.198.
Protective Effect of Enzymatic Hydrolysate of Tuna Pancreatic Proteins on Kidney in db/db Diabetic Mice
SUN Tingting
1, LI Yanyan
2, ZHOU Jun
1, ZHANG Dijun
1, LI Ye
1, ZHANG Chundan
1, HE Shan
1, HUANG Zhongbai
1, SU Xiurong
1,⋆
(1. School of Marine Sciences, Ningbo University, Ningbo 315211, China; 2. College of Agriculture and Life Sciences, Cornell University, Ithaca 14850, USA)
Abstract:The present study aimed to evaluate the effect of peptides produced by enzymatic hydrolysis of tuna pancreatic proteins on body weight, fasting serum insulin (FINS), glycated hemoglobin (HbA1c), and serum lipid levels of db/db diabetic mice for the purpose of providing theoretic evidence for the development of new healthy foods from tuna pancreas. Methods: Ten male Db/m mice were used as blank control group. A total of 30 male leptin gene knockout db/db mice were divided into model control group, positive drug control group and experimental group. The mice in the experimental group were gavaged with the peptides derived from tuna pancreatic proteins. After 10 weeks, the body weight, FINS, HbA1c, and serum lipid biochemical indexes in all groups of mice were examined. The gene expression levels in the kidney were evaluated using gene chip technology. Results: In comparison with the control group, the experimental group demonstrated a significant decrease in body weight, FINS, HbA1c, serum total cholesterol, triglyceride and low-density lipoprotein cholesterol levels and an obvious increase in high-density lipoproteincholesterol. The gene expression levels in experimental group were also significantly different from those in the control group. A total of 678 differentially expressed genes were found, 161 of which were up-regulated and 517 of which were down-regulated. Conclusion: The peptides derived from tuna pancreatic proteins by enzymatic hydrolysis can effectively control body weight, FINS, HbA1c and serum lipid levels in db/db diabetic mice, likely by decreasing the expression of aldosterone synthase gene (CYP11B1).
Key words:tuna pancreas; enzymatic hydrolysate; diabetes; db/db mice; CYP11B1
DOI:10.7506/spkx1002-6630-201703030
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)03-0182-06
收稿日期:2016-04-04
基金项目:海洋经济创新发展区域示范项目(2013710);宁波市科技局农业与社发重大科技项目(2010C10040);宁波市教育局重点学科资助项目
作者简介:孙婷婷(1990—),女,硕士研究生,研究方向为食品功能。E-mail:suntingting0320@126.com
⋆通信作者:苏秀榕(1956—),女,教授,博士,研究方向为食品安全、生物与分子生物学。E-mail:suxiurong@nbu.edu.cn
引文格式:
引文格式:
孙婷婷, 李妍妍, 周君, 等. 金枪鱼胰脏酶解多肽对db/db糖尿病小鼠肾脏的保护作用[J]. 食品科学, 2017, 38(3):182-187. DOI:10.7506/spkx1002-6630-201703030. http://www.spkx.net.cn
SUN Tingting, LI Yanyan, ZHOU Jun, et al. Protective effect of enzymatic hydrolysate of tuna pancreatic proteins on kidney in db/db diabetic mice[J]. Food Science, 2017, 38(3): 182-187. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703030. http://www.spkx.net.cn