
图1 PPAR的结构和调控靶基因表达的作用机理
[6][6]
Fig.1 Structures of PPARs and their mechanism in regulating the expression of the target gene
[6]
杨谷良,潘敏雄*,向 福,叶 辉,吴 鹏,王书珍,李士明*
(黄冈师范学院 经济林木种质改良与资源综合利用湖北省重点实验室,湖北 黄冈 438000)
摘 要:随着人们生活水平的提高,长期摄取高热量的饮食,加上运动量不足,会造成身体能量过度累积,能量以脂肪的形式贮存,从而导致肥胖。早在1997年,世界卫生组织已经正式将肥胖列为一种慢性疾病。过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)通过与靶基因启动子区调控序列结合,调控脂肪的代谢和脂肪细胞的增殖与分化。了解PPARs的结构特征、表达特性和作用机理等,对于控制肥胖及其引起的一系列疾病,具有重要的理论意义和实用价值。本文从PPARγ的结构特征和表达特点、配体对PPARγ的活化、PPARs间的相互作用、PPARγ在脂类代谢中的作用和天然配体对脂肪细胞的分化等进行综述,并从PPARγ调控脂肪细胞增殖的角度,提出了预防肥胖的对策。
关键词:肥胖;转录因子;脂肪细胞;表达调控
当人们日常摄取的能量超过了组织器官生长发育的需要时,多余的能量便以脂肪的形式贮存起来,在需要的时候,脂肪可以为机体提供能量或调控血脂的动态平衡。但是,过多的脂肪积累会导致心血管疾病、炎症、糖尿病等一系列疾病的发生。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)属于类固醇、甲状腺、维甲酸受体超家族,是核激素受体家族中受配体激活的核内转录因子。与配体结合后,激活的PPARs与视黄醇类X受体(9-cis-retinoic acid retinoid X receptors,RXRs)形成异二聚体,与靶基因启动子区的过氧化物酶体增殖物反应元件(peroxisome proliferator response element,PPRE)结合,调控目的基因的转录 [1]。在脂肪合成、脂质代谢和胰岛素敏感等生理过程中,尤其是参与脂肪酸β-氧化作用的一些重要酶类表达调控过程中,PPARs发挥着重要的调控作用 [2]。根据蛋白结构和功能上的差异,可以将PPARs分为3 种不同的亚型:PPARα、PPARβ/δ和PPARγ。根据启动子结构和mRNA在拼接方式上的差异,PPARγ基因又可以分为PPARγ1、PPARγ2、PPARγ3、PPARγ4基因,其中,PPARγ1、PPARγ3和PPARγ4基因编码相同的蛋白质。在调节脂肪酸氧化和能量代谢网络中,PPARα和PPARβ能够加速脂肪的燃烧 [3]。和其他类型的PPARs相比,PPARγ是PPARs家族中最具有脂肪专一性,它在脂肪组织和脂肪细胞系中具有较高的表达水平,而在其他组织和细胞系中的表达水平较低。甘油三酯的含量升高、高密度脂蛋白的含量降低、低密度脂蛋白的含量增加等,将导致机体血脂异常。活化的PPARγ通过调控脂肪细胞相关基因的表达,促进脂肪细胞的分化、增加脂肪细胞的数量,对脂肪的生成、转运、脂肪的贮存和氧化等都起着重要作用,是脂肪细胞形成和代谢的关键调节因子 [4]。Kersten等 [5]的研究发现,PPARs能够降低甘油三酯、调节高密度脂蛋白和低密度脂蛋白的含量,使机体内的血脂含量和脂肪代谢维持在正常水平。
Issemann等 [7]首次从大鼠的肝脏组织中鉴定了PPARα基因,后来陆续从非洲爪蟾、大鼠、天竺鼠与人类中鉴定出相同的基因;同时从非洲爪蟾和人类中鉴定出PPARβ基因,随后在小鼠中发现了PPARδ基因;而在PPARs的成员中,PPARγ的研究最为广泛,且在包括小鼠、仓鼠、蛙类、猪、猴和人类等许多物种中都有发现 [8]。人类的PPARγ含有479 个氨基酸残基,可以分为A~F 6 个区,具有4 个功能结构域(图1A)。包括:1)非配体依赖的N端,该结构域包含A区和B区,是非配体依赖的转录活化区,对靶基因的表达起调节作用,当该结构域的ser 273残基被有丝裂原激活蛋白激酶(mitogenactivated protein kinases,MAPK)磷酸化后,PPARγ与配体的结合会受到抑制,PPARγ与靶基因启动子区的结合能力降低,对靶基因表达调控水平下降;2)DNA结合结构域(C区),由70 多个氨基酸残基组成,DNA结合结构域的核酸序列具有高度保守性,可以形成2 个锌指结构,能够与视黄酸受体α(retinoic acid receptor,RARα)结合,当异二聚体与PPARγ配体结合后,便能够识别并结合目的基因启动子区序列为AGGACAAAGGTCA的PPRE,调节靶基因的转录;3)第3个功能结构域又称为D区,它的主要功能是连接DNA结合结构域和配体结合区,部分核内小分子与D区结合后,PPARγ的活性将受到影响;4)第4个结构域为与配体结合的E区和F区,这个区域位于PPARγ的羧基端,与配体结合后,可以激活编码肝脏脂肪酸结合蛋白、脂蛋白脂肪酶、解偶联蛋白等基因的表达。由于不同PPARs的配体结合结构域在氨基酸组成上存在差异,PPARα、β的配体结合结构域具有亲脂性,和饱和脂肪酸结合能力较强,所以,饱和脂肪酸容易与PPARα、β结合;组成PPARγ的配体结合结构域主要由亲水性的氨基酸组成,容易与具有亲水性的不饱和脂肪酸结合 [9]。

图1 PPAR的结构和调控靶基因表达的作用机理
[6][6]
Fig.1 Structures of PPARs and their mechanism in regulating the expression of the target gene
[6]
表1 PPARs的组织表达特性和功能
[[66]]
Table1 The expression and functions of PPARs in different tissues
[[66]]

 调控脂质代谢;抗炎和心脏保护作用;维持巨噬细胞脂质平衡PPARβ/δ大多组织和细胞类型中广泛表达调节脂质代谢;抑制细胞增殖;抗炎症反应亚型分布的组织或细胞类型功能PPARα肝脏、骨骼肌、棕色脂肪组织、心脏、血管、内皮细胞、平滑肌细胞、淋巴细胞和单核细胞、巨噬细胞PPARγ棕色和白色脂肪组织、结肠、脾、视网膜血管、单核细胞、巨噬细胞、内皮细胞、平滑肌细胞、淋巴细胞、树突细胞、血小板、巨核细胞调控前脂肪细胞向脂肪细胞分化;促进脂质代谢;降低胰岛素抵抗;减少巨噬细胞中脂质积累;预防血栓形成和抗炎活性
调控脂质代谢;抗炎和心脏保护作用;维持巨噬细胞脂质平衡PPARβ/δ大多组织和细胞类型中广泛表达调节脂质代谢;抑制细胞增殖;抗炎症反应亚型分布的组织或细胞类型功能PPARα肝脏、骨骼肌、棕色脂肪组织、心脏、血管、内皮细胞、平滑肌细胞、淋巴细胞和单核细胞、巨噬细胞PPARγ棕色和白色脂肪组织、结肠、脾、视网膜血管、单核细胞、巨噬细胞、内皮细胞、平滑肌细胞、淋巴细胞、树突细胞、血小板、巨核细胞调控前脂肪细胞向脂肪细胞分化;促进脂质代谢;降低胰岛素抵抗;减少巨噬细胞中脂质积累;预防血栓形成和抗炎活性
在表达特性方面,樊月圆 [10]发现在肉牛的脂肪组织中,PPARγ具有较高水平的表达,脾脏和睾丸中也有一定量的表达,在心、肺、肾、胰、肝、胃、肠和肌肉等组织和器官中的表达水平较低。王丽等 [11]通过Western blotting研究了肉鸡PPARγ基因的表达情况。同时发现PPARγ基因在肉鸡脂肪组织中的表达水平较高,在脾、肾、胃等器官中有一定水平的表达,而肝、十二指肠和部分肌肉组织中不表达。为了研究PPARγ基因在不同群体中的表达水平,王丽等 [11]检测了高脂系肉鸡和低脂系肉鸡脂肪细胞中PPARγ的含量,发现高脂系肉鸡脂肪细胞中PPARγ基因的表达水平显著高于低脂系,同时,高脂系肉鸡脂肪细胞的体积也要大于低脂系。Guo Lin等 [12]也发现脂肪细胞的大小与PPARγ基因的表达水平具有相关性,认为PPARγ基因的表达水平与脂肪细胞的大小及脂肪细胞的分化程度呈正相关。为深入研究前体脂肪细胞的分化机理,Petrovic等 [13]发现,通过诱导白色脂肪细胞中PPARγ基因的表达,能够使共培养的棕色脂肪细胞中解耦联蛋白1(uncoupling protein 1,UCP1)的表达水平提高。Choi等 [14]发现前脂肪细胞能够促进与之共培养的肌卫星细胞中PPARγ基因和C/EBPβ基因的表达水平。Sander等 [15]发现,在小鼠的脂肪组织、结肠、脾脏、视网膜和造血细胞中,PPARγ1基因都有较高水平的表达,在棕色和白色脂肪组织中,PPARγ2基因的表达水平较高。上述研究结果表明,PPARγ与不同组织中脂肪的形成具有密切关系,但其具体机制还有待深入探讨(表1)。
PPARs与另一个核受体RXR结合,形成一个异源二聚体,结合到靶基因启动子区序列为AGGTCANAGGTCA的PPRE上,调控参与能量和脂质代谢,胰岛素敏感性及炎症调控等基因的转录。PPARs对靶基因的表达调控可分为配体依赖激活型和非配体依赖抑制型两种。PPARs带有可与特异性配体结合的配体结合结构域,和PPRE结合的DNA结合结构域;当配体与PPARs结合后,会改变PPARs的构型,而与另一个核内的接受器RXRs形成异源二聚体,结合至启动子的PPRE区域,开始调控基因的转录 [16],辅助抑制因子会发生泛素化并被降解。PPARs激活基因转录时,需要先被配体活化,通过细胞质膜进入细胞内,与RXR结合,形成异源二聚体,此时,与RXR结合的抑制性蛋白被释放,激活蛋白结合到异源二聚体上,调控基因的转录(图1B)。能够结合到异二聚体上的激活蛋白主要有:SRC-1、PBP、p300、TATA框结合蛋白和RNA聚合酶Ⅱ等。抑制蛋白主要有:HDAC、NCo-R、SMRT等 [17]。
在构建的PPARα基因缺失小鼠中,PPARγ等基因仍可表达,进而调控脂肪酸结合蛋白、脂酰CoA氧化酶等目的基因,表明PPARs家族不同亚型之间可能在功能上有一定的互补性。Costet等 [18]认为这是由于PPARγ2基因在肝脏中超量表达导致的。但Deluca等 [19]敲除了小鼠的PPARα基因后,并没有发现PPARγ或PPARβ基因的表达水平与正常对照组存在差异。Brun等 [20]发现,和其他类型的PPARs相比,PPARγ有着更强的与调控序列结合的能力,虽然PPARγ和PPARα显示出了共同调控脂肪细胞分化的特性,但是它们在响应机制上存在着差别。
CCAAT/增强子结合蛋白β(CCAAT/enhancer binding proteinβ,C/EBPβ)和C/EBPα能够诱导PPARγ基因的表达,被激活的PPARγ又可以增强C/EBPα基因的表达。当缺乏C/EBPα时,细胞只能低水平的表达PPARγ,不能形成脂肪细胞 [21]。二者还可以协同性的反式激活有关基因,如脂肪酸结合蛋白ap2(p2 adipocyte,Ap2)基因和磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)基因(二者都具有PPAR和C/EBP的结合位点) [22]。C/EBPα和PPARγ都能活化脂肪合成相关的专一性基因,研究表明C/EBPα和PPARγ基因的共同表达具有协同作用,在NIH-3T3小鼠胚胎成纤维细胞中,C/EBPα或PPARγ基因的表达都能促进部分细胞分化,而二者的共同表达能引发大部分细胞发生分化 [23]。C/EBPα和PPARγ基因在其他脂肪细胞基因的转录活化中也具有协同作用。经安妥明、WY-14643和5,8,11,14-二十碳四炔酸等诱导后,小鼠3T3-L1前脂肪细胞中C/EBPβ和/EBPδ基因随即得以表达,而C/EBPβ的产生又能诱导C/EBPα和PPARγ基因的表达 [24]。在细胞分化过程中,C/EBPβ基因在C/EBPα基因之前表达,因此,C/EBPβ有可能是一个胞内初始诱导因子。此外,活化表达的C/EBPβ和PPARγ被认为是C/EBPα基因的反式激活蛋白。一旦C/EBPα基因转录开始,它将通过转录的自身激活而增强转录作用,这一激活机制至少部分维持了由C/EBPα激活的脂肪细胞基因转录的反式激活作用 [25]。上述研究结果表明,在诱导脂肪细胞分化的过程中,C/EBP家族和PPARs家族存在着相互协调的作用。二者可以各自独立参与脂肪细胞的代谢调控,也能共同刺激脂肪细胞的分化。
脂肪细胞的发育包括脂肪细胞的分化和肥大两个过程。由于成熟脂肪细胞不能够通过细胞分裂产生新的脂肪细胞,为了贮存体内产生的多余能量,机体必须通过前体脂肪细胞的增殖,产生新的脂肪细胞。在转化生长因子(transforming growth factor,TGFs)、胰岛素生长因子(insulin-like growth factor,IGFs)、成纤维细胞生长因子(fibroblast growth factor,FGFs)的调控下,骨髓间充质干细胞可以分化形成骨、肌肉或脂肪细胞的前体细胞。在转录因子PPARγ和C/EBPs的调控下,白色脂肪细胞前体会进一步分化,形成白色脂肪细胞;而棕色脂肪细胞前体的分化相对较复杂,在PPARγ和含PR结构域的蛋白16(PRD1-BF1-RIZ1 homologous domaincontaining 16,PRDM16)的调控下,会分化形成棕色脂肪细胞;在成肌素和Myo D的作用下,棕色脂肪细胞前体将分化成肌细胞;受到Runt相关转录因子2(Runtrelated transcription factor 2,RunX2)和成骨细胞特异性转录因子(osterix,Osx)的影响,成骨细胞能够分化形成骨细胞(图2) [26]。
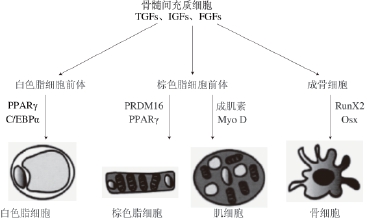
图2 脂肪细胞发育模型
[[2266]]
Fig.2 Schematic illustration of adipocyte development
[26]
4.1 PPARγ介导脂肪细胞分化
Siersbaek等 [27]通过对己公布的PPARγ和C/EBPα结合位点进行分析,发现PPARγ和C/EBPα调控了大多数与脂肪发育相关基因的表达。而且,在对基因表达调控时,在很多位点都出现了PPARγ和C/EBPα结合位点的重叠。在C/EBPα基因沉默的细胞中,PPARγ可以单独作用,促进脂肪形成;而当PPARγ基因沉默后,C/EBPα不能够单独启动脂肪合成相关基因的转录 [28]。这些研究结果表明,PPARγ是脂肪合成的基本转录因子,C/EBPα能够促进脂肪细胞的分化。为了证实PPARβ也参与了脂肪细胞的分化,Matsusue等 [29]构建了PPARβ基因缺失型小鼠脂肪细胞,在分化培养基中,PPARβ基因缺失型小鼠脂肪细胞不能够发生分化,说明在脂肪细胞分化过程中,PPARβ与PPARγ相互之间可能存在某种联系,共同调控脂肪的生物合成。Choi等 [30]发现,高热量饲喂的肥胖小鼠脂肪细胞中,细胞周期蛋白依赖蛋白激酶5(cyclindependent kinase 5,CDK5)的含量较高,CDK5能够使PPARγ的ser 273磷酸化,Nco-R能够促进CDK5的这种磷酸化作用,使胰岛素敏感的脂联素等的表达水平降低,而抗糖尿病的PPARγ配体,如罗格列酮和MRL24,能够抑制CDK5介导的磷酸化。Li Pingping等 [31]研究了Nco-R敲除小鼠中相关基因的表达情况,发现在Nco-R敲除小鼠的脂肪组织中PPARγ表达水平增高,CDK5介导的PPARγ在ser 273位点的磷酸化程度降低,证实了Nco-R和CDK5调控PPARγ对脂肪形成的作用。
Kawai等 [32]发现,nocturnin基因敲除小鼠表现出PPARγ异常的昼夜节律性表达和骨质量增加,证实了Nocturnin具有增强PPARγ活性的特征。Ahmed等 [33]研究证实,白细胞介素-17(interleukin-17,IL-17)是一种调节脂肪细胞分化的转录因子,具有抑制包括PPARγ和C/EBPα等基因表达的生物活性,IL-17基因缺失的小鼠出现超重肥胖。上述研究结果表明,在脂肪合成的调控网络中,不同转录因子的共同调控,构成了基因复杂的调控网络。在这个网络中,PPARγ起着重要的作用,现在已有不少研究结果证实PPARγ通过与其它转录因子相互作用,共同调节脂肪的合成。
4.2 miRNA介导PPARγ调控脂肪细胞分化
在脂肪细胞的分化过程中,部分miRNA能够对PPARγ基因的mRNA发生作用,影响前脂肪细胞的分化。Kim等 [34]通过生物信息学分析,发现mir-27b能同时作用于PPARγ和C/EBPα基因的3’非编码区(3’untranslated regions,3’UTR),为了验证miR-27b对前脂肪细胞分化的影响,该研究团队通过构建荧光素酶报告基因系统,证实了miR-27b是通过靶作用于PPARγ基因的3’UTR作用位点来调控脂肪细胞的分化,通过干扰miR-27b,触发脂肪细胞的自发分化。吴宗松 [35]研究发现,miR-27b在PPARγ和C/EBPα的调控区都存在作用位点,通过脂质体转染,将miR-27b抑制物转入3T3-L1前脂肪细胞后,3T3-L1前脂肪细胞发生自发分化。Meerson等 [36]研究发现,过表达miR-221将提高PPARγ活性。Park等 [37]研究发现,在脂肪细胞培养时,在培养基中添加神经前体细胞表达发育下调因子8(neural precursor cellexpressed developmentally downregulated 8,NEDD8)抑制剂氨基磺酸 [(1S,2S,4R)-4-[4-[[(1S)-2,3-二氢-1H-茚-1-基]氨基]-7H-吡咯并[2,3-D]嘧啶-7-基]-2-羟基环戊基]甲基酯(sulfamic acid [(1S,2S,4R)-4-[4-[[(1S)-2,3-dihydro-1H-inden-1-yl]amino]-7H-pyrrolo[2,3-d]pyrimidin-7-yl]-2-hydroxycyclopentyl]methyl ester,MLN4924)后,脂肪细胞的分化和脂肪组织形成受到影响,表明NEDD8对脂肪细胞PPARγ是必不可少的。
作为转录因子,PPARγ在调控目的基因表达时,需要先与配体结合,才能被活化,调节脂肪细胞的分化(图1B)。PPARγ可以通过以下方式激活:配体与PPARγ的配体结合结构域结合,激活PPARγ;配体与热休克蛋白结合后,再与PPARs结合 [38]。因此,开展PPARγ配体的分离鉴定和生物活性分析,是解决肥胖及其相关疾病的有效途径。目前,PPARγ配体的来源主要有化学合成的合成类和从生物有机体中分离的天然类配体(表2)。噻唑烷二酮(thiazolidinedione,TZD)类化合物是合成类配体中研究比较深入的一种,TZD能够有效活化PPARγ,提高脂肪合成相关因子的表达水平,促进脂肪细胞的分化。但是,动物实验表明,TZD会造成肝毒性、心脏肥大、体质量增加等一系列的毒副作用,从而限制了它的进一步应用。
白藜芦醇可促进PPARγ基因的表达,进而抑制Cyclin D1基因的表达,细胞周期停留在G 1期,脂肪细胞的增殖受到抑制 [39]。Zheng Weili等 [40]发现伊屋诺霉素通过阻断PPARγ蛋白非配体依赖N端ser 273的磷酸化,降低PPARγ配体结合域结合配体的能力,从而减少脂肪的合成,改善糖尿病模型小鼠的高血糖症和胰岛素耐受性。Feng Li等 [41]从补骨脂果实中分离的补骨脂二氢黄酮甲醚,是一种PPARγ激动剂,通过调节PPARγ的转录活性,降低小鼠体内血糖的水平和甘油三酯的含量。叶瓜参长链碱(longchain base from the sea cucumber Cucumaria frondosa,Cf-LCB)能够显著抑制3T3-L1前脂肪细胞的分化,其作用机制与激活WNT/β-catenin通路有关 [42]。异甘草素可抑制3T3-L1前脂肪细胞向脂肪细胞分化,其机制可能与活化AMPK信号通路相关 [43]。细胞周期的运转,与Cyclin D1的表达水平相关,Cyclin D1能够结合并激活周期蛋白激酶,使G 1期周期抑制蛋白发生磷酸化,细胞周期顺利通过G l期检测点,是细胞周期正常运转的重要调节因子。PPARγ对Cyclin D1基因的表达调控,限制了前脂肪细胞的分化与增殖,从而起到预防肥胖的作用。过氧化物酶体增殖活化受体γ辅助活化因子(peroxisome proliferator-activated receptor actibator,PGC)-1α能够活化PPARα或γ,启动与脂质代谢和运输相关功能蛋白的表达,调节生物体脂类的代谢与平衡 [44]。另外,通过饮食,获取PPARγ的天然配体,也是调节体内脂肪合成与代谢的重要途径。García-Rojas等 [45]研究发现,不饱和脂肪酸和类胡萝卜素可以增加PPARγ基因的转录水平。Taxvig等 [46]发现丙二酚A、邻苯二甲酸单乙基乙基酯、对羟基苯甲酸丁酯、多氯联苯153都可以活化PPARγ,使前脂肪细胞3T3-L1发生分化。在分子机制方面,Diezko等 [47]研究发现,PPARγ的活性发挥与翻译后的小泛素样修饰蛋白(small ubiquitin-related modifier,SUMO)和磷酸化修饰密切相关,lys 33和lys 77的SUMO化修饰将降低PPARγ的活性。配体与PPARγ C端的配体结合域结合,活化N端的转录活化区,影响了PPARγ翻译后lys 33和lys 77的SUMO化修饰,使PPARγ的生物活性发生变化。
表2 植物提取物对脂肪生成和代谢的影响
Table2 Effects of plant extracts on lipid biosynthesis and metabolism

提取物生物活性植物来源参考文献白藜芦醇活化PPARγ,抑制Cyclin D1基因的表达,细胞周期停滞在G1期;促进能量消耗,抑制肥胖并显著延长寿命。花生、葡萄(红葡萄酒)、桑椹[48]染料木黄酮PPARγ的激活物,浓度>1 μmol/L时,脂肪生成上调而成骨作用被下调;<1 μmol/L时,刺激成骨作用和抑制脂肪生成。增加脂质代谢相关基因的表达,降低体质量、肝脏胆固醇和甘油三酯浓度,改善葡萄糖耐受性。大豆[49]法呢醇PPARα/γ双重激动剂。活化脂肪、肝细胞中PPARα/γ,上调脂代谢的靶基因表达。香茅、仙客来、柠檬草、玫瑰[50]香叶醇PPARα/γ双重激动剂。活化脂肪、肝细胞中PPARα/γ,上调脂代谢的靶基因表达。九里香、大蒜、芸香草、玫瑰[51]人参皂苷RblPPARγ的配体。通过上调PPARγ2、C/EBPα的表达,促进脂肪细胞的形成与分化、提高胰岛素敏感性。人参、三七[52] 20S-PPT增加PPARγ的转录活性,促进脂肪细胞分化;上调GLUT4的表达,提高胰岛素敏感性。人参皂苷代谢物[53]大黄素与PPARγ有高度结合力,能促进甘油-3磷酸脱氢酶基因、GLUTl、GLUT4的转录从而增强葡萄糖摄取能力,促葡萄糖转运能力虎杖[54]姜黄素刺激肝星形细胞内PPARγ基因的表达,增强PPARγ活性,抑制生长因子(plateletderived growth factor,PDGF)和表皮生长因子(epidermal growth factor,EGF)受体的基因表达及PDGF和EGF的磷酸化水平,从而阻断PDGF和EGF信号传导;郁金、姜黄、菖蒲[55]丹参酮ⅡAPPARγ的天然拮抗剂,降低PPARγ的转录活性、抑制前脂肪细胞分化丹参、陇西鼠尾草[56]黄连素PPARs配体,增加PPAR靶基因的表达,改善细胞的胰岛素敏感性黄连、黄柏[57]黄芪多糖、石榴花提取物、蒲黄总黄酮PPARs配体,增加PPAR靶基因的表达,改善细胞的胰岛素敏感性黄芪、石榴、蒲黄[58-60]
各种生理、生化、遗传和行为因素都可引起肥胖,要控制肥胖的发生,首先需要合理控制饮食、适度运动,从而减少机体内部剩余能量的贮存,预防肥胖的发生。另外,需要控制脂肪细胞的过度增殖与分化。脂肪细胞的增殖与分化受到PPARs的诱导,充分了解脂肪细胞分化转录的调控机制,对于治疗肥胖及由肥胖引起的一系列疾病具有非常重要的意义。作为核受体超家族中的一员,因其在脂类代谢过程中所起到的重要作用,PPARs已经被广泛应用于肥胖及其相关疾病的预防与治疗。近年来,由于研究的深入,对PPARγ的结构、功能、组织差异性表达等特性都有了进一步的了解,并通过化学合成或从天然物质中分离等方法,获得了一些PPARγ的配体。由于在脂肪细胞的增殖与分化过程中,不同PPARs、C/EBPs等具有网络调控作用,很多调控机制目前仍不清楚。所以,利用相关转录因子的超表达、基因沉默和转录组分析等分子生物学手段,探索PPARγ及其相关基因与脂肪合成代谢的一一对应关系,将为我们对脂肪细胞增殖与分化带来更加深入的了解;另外,挖掘更多的天然配体,用于肥胖的预防及治疗,能够使PPARγ更好地服务于我们的生产与生活。
参考文献:
[1] DUVAL C, CHINETTI G, TROTTEIN F, et al. The role of PPARs in atherosclerosis[J]. Trends in Molecular Medicine, 2002, 8(9): 422-430.
[2] GUAN Y. Targeting peroxisome proliferator-activated receptors (PPARs) in kidney and urologic disease[J]. Minerva Urologica e Nefrologica, 2002, 54(2): 65-79.
[3] CHINETTI G, FRUCHART J C, STAELS B. Peroxisome proliferatoractivated receptors (PPARs): nuclear receptors at the crossroads between lipid metabolism and inflammation[J]. Inflammation Research, 2000, 49(10): 497-505.
[4] REDDY J K. Peroxisome proliferators and peroxisome proliferatoractivated receptor α[J]. The American Journal of Pathology, 2004, 164(6): 2305-2321.
[5] KERSTEN S, DESVERGNE B, WAHLI W. Roles of PPARs in health and disease[J]. Nature, 2000, 405: 421-424. DOI:10.1038/35013000.
[6] MORAES L A, PIQUERAS L, BSSHOP-BAILEY D. Peroxisome proliferator-activated receptors and inflammation[J]. Pharmacology & Therapeutics, 2006, 110(3): 371-385. DOI:10.1016/ j.pharmthera.2005.08.007.
[7] ISSEMANN I, GREEN S. Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J]. Nature, 1990, 347: 1155-1208. DOI:10.1038/347645a0.
[8] ABBOTT B D. Review of the expression of peroxisome proliferatoractivated receptors alpha (PPARα), beta (PPARβ), and gamma (PPARγ) in rodent and human development[J]. Reproductive Toxicology, 2009, 27(3/4): 246-257. DOI:10.1016/j.reprotox.2008.10.001.
[9] HSU M H, PALMER C N, SONG W, et al. A carboxyl terminal extension of the zinc fi nger domain contributes to the specif i city and polarity of peroxisome proliferator-activated receptor DNA binding[J]. Journal of Biological Chemistry, 1998, 273(43): 27988-27997. DOI:10.1074/jbc.273.43.279.
[10] 樊月圆. 肉牛PPARs家族和PLIN基因遗传变异及其与秦川牛胴体、肉质性状相关分析[D]. 杨凌: 西北农林科技大学, 2010: 54-55. [11] 王丽, 那威, 王宇祥, 等. 鸡PPARγ基因的表达特性及其对脂肪细胞增殖分化的影响[J]. 遗传, 2012(4): 454-464. DOI:10.3724/ SP.J.1005.2012.00454.
[12] GUO L, SUN B, SHANG Z, et al. Comparison of adipose tissue cellularity in chicken lines divergently selected for fatness[J]. Poultry Science, 2011, 90(9): 2024-2034. DOI:10.3382/ps.2010-00863.
[13] PETROVIC N, WALDEN T B, SHALINA I G et al. Chronic peroxisome proliferator-activated receptor gamma (PPARgamma) activation of epididymally derived whiteadipocyte cultures reveals a population of thermogenically competent, UCP1-containing adipocytes molecularly distinct from classic brown adipocytes[J]. Journal of Biological Chemistry, 2010, 285(10): 7153-7164. DOI:10.1074/jbc. M109.053942.
[14] CHOI S H, CHUNG K Y, JOHNSON B J, et al. Co-culture of bovine muscle satellite cells with preadipocytes increases PPARγ and C/EBPβ gene expression in differentiated myoblasts and increases GPR43 gene expression in adipocytes[J]. Journal of Nutritional Biochemistry, 2013, 24(3): 539-543. DOI:10.1016/j.jnutbio.2012.01.015.
[15] SANDER K, BÉATRICE D, WALTER W. Peroxisome proliferatoractivated receptor α mediates the adaptive response to fasting[J]. Journal of Clinical Investigation, 1999, 103(11): 1489-1498. DOI:10.1172/JCI6223.
[16] MANDARD S, MULLER M, KERSTEN S. Peroxisome proliferatoractivated receptor alpha target genes[J]. Cellular and Molecular Life Sciences, 2004, 61(4): 393-416. DOI:10.1155/2010/612089.
[17] AHMED W, ZIOZENKOVA O, BROWN J, et al. PPARs and their metabolic modulation: new mechanisms for transcriptional regulation[J]. International Medicine Journal, 2007, 262(2): 184-198. DOI:10.1111/j.1365-2796.2007.01825.x.
[18] COSTET P, LEGENDRE C, MORÉ J, et al. Peroxisome proliferator-activated receptor alpha-isoform deficiency leads to progressive dyslipidemia with sexually dimorphic obesity and steatosis[J]. Journal of Biological Chemistry, 1998, 273(45): 29577-29585. DOI:10.1074/jbc.273.45.295.
[19] DELUCA J G, DOEBBER T W, KELLY L J, et al. Evidence for peroxisome proliferator-activated receptor (PPAR)alpha-independent peroxisome proliferation: effects of PPARgamma/delta-specific agonists in PPARalpha-null mice[J]. Molecular Pharmacology, 2000, 58(3): 470-476.
[20] BRUN R P, TONTONOZ P, FORMAN B M, et al. Differential activation of adipogenesis by multiple PPAR isoforms[J]. Genes & Development, 1996, 10(8): 974-984. DOI:10.1101/gad.10.8.974.
[21] WU Z, ROSEN E D, BRUN R, et al. Cross-regulation of C/EBP alpha and PPAR gamma controls the transcriptional pathway of adipogenesis and insulin sensitivity[J]. Molcular Cell, 1999, 3(2): 151-158. DOI:10.1016/S1097-2765(00)80306-8.
[22] SPIEGELMAN B M, FLIER J S. Adipogenesis and obesity: rounding out the big picture[J]. Cell, 1996, 87(3): 377-389. DOI:10.1016/S0092-8674(00)81359-8.
[23] MANDRUP S, LANE M D. Regulating adipogenesis[J]. Journal of Biological Chemistry, 1997, 272(9): 5367-5370.
[24] CHAWLA A, LAZAR M A. Peroxisome proliferator and retinoid signaling pathways co-regulate preadipocyte phenotype and survival[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(5): 1786-1790. DOI:10.1073/ pnas.91.5.1786.
[25] AILHAUD G. Molecular mechanisms of adipocyte differentiation[J]. Journal of Endocrinology, 1997, 155(2): 201-202.
[26] PARK K W, HALPERIN D S, TONTONOZ P. Before they were fat: adipocyte progenitors[J]. Cell Metabolism. 2008, 8(6): 454-457. DOI:10.1016/j.cmet.2008.11.001.
[27] SIERSBAEK R, NIELSEN R, MANDRUP S. PPARgamma in adipocyte differentiation and metabolism-novel insights from genome-wide studies[J]. FEBS Letters, 2010, 584(15): 3242-3249. DOI:10.1016/j.febslet.2010.06.010.
[28] ROSEN E D, HSU C H, WANG X, et al. C/EBPalpha induces adipogenesis through PPARgamma: a unified pathway[J]. Genes & Development, 2002, 16(1): 22-26.
[29] MATSUSUE K, PETERS J M, GONZALEZ F J. PPARβ/δ potentiates PPARγ-stimulated adipocyte differentiation[J]. Faseb Journal, 2004, 18(12): 1477-1479.
[30] CHOI J H, BANKS A S, ESTALL J L, et al. Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5[J]. Nature, 2010, 466: 451-456. DOI:10.1038/nature09291.
[31] LI Pingping, FAN Wuqian, XU Jianfeng, et al. Adipocyte NCoR knockout decreases PPARγ phosphorylation and enhances PPARγ activity and insulin sensitivity[J]. Cell, 2011, 147(4): 815-826. DOI:10.1016/j.cell.2011.09.050.
[32] KAWAI M, ROSEN C J. PPARγ: a circadian transcription factor in adipogenesis and osteogenesis[J]. Nature Reviews Endocrinology, 2010, 6(11): 629-636. DOI:10.1038/nrendo.2010.155.
[33] AHMED M, GAFFEN S L. IL-17 inhibits adipogenesis in part via C/ EBPα, PPARγ and Krüppel-like factors[J]. Cytokine, 2013, 61(3): 898-905. DOI:10.1016/j.cyto.2012.12.007.
[34] KIM S Y, KIM A Y, LEE H W, et al. miR-27a is a negative regulator of adipocyte differentiation via suppressing PPARgamma expression[J]. Biochemical and Biophysical Research Communications, 2010, 392(3): 323-328. DOI:10.1016/j.bbrc.2010.01.012.
[35] 吴宗松. miR-27b通过靶向于PPARγ触发脂肪细胞分化[D]. 杨凌: 西北农林科技大学, 2009: 40-41.
[36] MEERSON A, TRAURIG M, OSSOWSKI V, et al. Human adipose microRNA-221 is upregulated in obesity and affects fat metabolism downstream of leptin and TNF-α[J]. Diabetologia, 2013, 56(9): 1971-1979. DOI:10.1007/s00125-013-2950-9.
[37] PARK H S, JU U I, PARK J W, et al. PPARγ neddylation essential for adipogenesis is a potential target for treating obesity[J]. Cell Death and Differentiation, 2016, 23(8): 1296-1311. DOI:10.1038/cdd.2016.6.
[38] BURNS K A, VANDEN H J P. Modulation of PPAR activity via phosphorylation[J]. Biochimica et Biophysica Acta-Biomembranes, 2007, 1771(8): 952-960.
[39] YU Y H, CHANG Y C, SU T H, et al. Prostaglandin reductase-3 negatively modulates adipogenesis through regulation of PPARγ activity[J]. Journal of Lipid Research, 2013, 54(9): 2391-2399. DOI:10.1194/jlr.M037556.
[40] ZHENG W L, FENG X, QIU L, et al. Identif i cation of the antibiotic ionomycin as an unexpected peroxisome proliferator-activated receptor γ (PPARγ) ligand with a unique binding mode and effective glucoselowering activity in a mouse model of diabetes[J]. Diabetologia, 2013, 56(2): 401-411. DOI:20.1007/s00125-012-2777-9.
[41] FENG L, LUO H, XU Z, et al. Bavachinin, as a novel natural pan-PPAR agonist, exhibits unique synergistic effects with synthetic PPAR-γ and PPAR-α agonists on carbohydrate and lipid metabolism in db/db and diet-induced obese mice[J]. Diabetologia, 2016, 59(6):1276-1286. DOI:10.1007/s00125-016-3912-9.
[42] 毛磊, 徐慧, 田迎樱, 等. 叶瓜参长链碱抑制3T3-L1前脂肪细胞分化及其作用机制研究[J]. 食品科学, 2015, 36(23): 241-246. DOI:10.7506/spkx1002-6630-201523044.
[43] 王振华, 邱理红, 王占洋, 等. 异甘草素对3T3-L1前脂肪细胞分化的抑制作用[J]. 食品科学, 2016, 37(1): 157-162. DOI:10.7506/ spkx1002-6630-201601028.
[44] 金凤, 康凯夫, 陈坚平. p53、MDM2、eyelin G在星形细胞瘤中的表达及与肿瘤分化和预后的关系[J]. 实用医学杂志, 2007, 23(11):1635-1637.
[45] GARCÍA-ROJAS P, ANTARAMIAN A, GONZÁLEZ-DÁVALOS L, et al. Induction of peroxisomal proliferator-activated receptor gamma and peroxisomal proliferator-activated receptor gamma coactivator 1 by unsaturated fatty acids, retinoic acid, and carotenoids in preadipocytes obtained from bovine white adipose tissue[J]. Journal of Animal Science, 2010, 88(5): 1801-1808. DOI:10.2527/jas.2009-2579.
[46] TAXVIG C, DREISIG K, BOBERG J, et al. Differential effects of environmental chemicals and food contaminants on adipogenesis, biomarker release and PPARγ activation[J]. Molecular and Cellular Endocrinology, 2012, 361(1/2): 106-115. DOI:10.1016/ j.mce.2012.03.021.
[47] DIEZKO R, SUSKE G. Ligand binding reduces SUMOylation of the peroxisome proliferator-activated receptor γ (PPARγ) activation function 1 (AF1) domain[J]. PLoS ONE, 2013, 8(6): 264-272. DOI:10.1371/journal.pone.0066947.
[48] TSUKAMOTO T, NAKATA R, TAMURA U, et al. Vaticanol C, a resveratrol tetramer, activates PPARα and PPARβ/δ in vitro and in vivo[J]. Nutrition & Metabolism, 2010, 7(1): 1-8. DOI:10.1186/1743-7075-7-46.
[49] SONG M, TIAN X, LU M, et al. Genistein exerts growth inhibition on human osteosarcoma MG-63 cells via PPARγ pathway[J]. International Journal of Radiation Oncology Biology Physics, 2015, 46(3): 1131-1140. DOI:10.3892/ijo.2015.2829.
[50] GOTO T, KIM Y I, FUNAKOSHI K, et al. Farnesol, an isoprenoid, improves metabolic abnormalities in mice via both PPARαdependent and -independent pathways[J]. American Journal of Physiology-endocrinology and Metabolism, 2011, 301(5): 1022-1032. DOI:10.1152/ajpendo.00061.2011.
[51] SOUBH A A, AADALLAH D M, El-ABBAR H S. Geraniol ameliorates TNBS-induced colitis: involvement of Wnt/β-catenin, p38MAPK, NFκB, and PPARγ signaling pathways[J]. Life Science, 2015, 136: 142-150. DOI:10.1016/j.lfs.2015.07.004.
[52] SHANG W, YANG Y, JIANG B, et al. Ginsenoside Rb1 promotes adipogenesis in 3T3-L1 cells by enhancing PPARgamma2 and C/ EBPalpha gene expression[J]. Life Science, 2007, 23, 80(7): 618-625. DOI:10.1016/j.lfs.2006.10.021.
[53] HAN K L, JUNG M H, SOHN J H, et al. Ginsenoside 20S-protopanaxatriol (PPT) activates peroxisome proliferator-activated receptor gamma (PPARgamma) in 3T3-L1 adipocytes[J]. Biological & Pharmaceutical Bulletin, 2006, 29(1): 110-113. DOI:10.1248/ bpb.29.110.
[54] YANG Y, SHANG W, ZHOU L, et al. Emodin with PPARgamma ligand-binding activity promotes adipocyte differentiation and increases glucose uptake in 3T3-Ll cells[J]. Biochemical and Biophysical Research Communications, 2007, 353(2): 225-230. DOI:10.1016/j.bbrc.2006.11.134.
[55] ZHOU Y, ZHENG S, LIN J, et al. The interruption of the PDGF and EGF signaling pathways by curcumin stimulates gene expression of PPARgamma in rat activated hepatic stellate cell in vitro[J]. Laboratory Investigation, 2007, 87(5): 488-498. DOI:10.1038/labinvest.3700532.
[56] GONG Z, HUANG C, SHENG X, et al. The role of tanshinone IIA in the treatment of obesity through PPARgamma antagonism[J]. Endocrinology, 2008, 150(1): 104-113. DOI:10.1210/en.2008-0322.
[57] HUANG C, ZHANG Y, GONG Z, et al. Berberine inhibits 3T3-L1 adipocyte differentiation through the PPARgamma pathway[J]. Biochemical and Biophysical Research Communications, 2006, 348(2): 571-578. DOI:10.1016/j.bbrc.2006.07.095.
[58] 刘毅, 王文健, 陈伟华, 等. 黄芪多糖对3T3-L1前脂肪细胞增殖和分化的影响[J]. 中西医结合杂志, 2007, 5(4): 421-426.
[59] 窦勤, 魏媛媛, 李郁, 等. 石榴花多酚对糖尿病大鼠IL-6、TXB2及PPAR-γ mRNA基因表达的影响[J]. 中国药理学通报, 2010, 26(6):794-797.
[60] 傅晓东, 何燕铭, 陈伟华, 等. 蒲黄总黄酮对3T3-L1前脂肪细胞增殖分化及相关基因表达的影响[J]. 医学研究生学报, 2010, 23(5): 456-459. DOI:10.3969/j.issn.1008-8199.2010.05.003.
Progress in the Knowledge of the Mechanism of PPAR Gamma Regulation of Adipocyte Proliferation and Differentiation
YANG Guliang, PAN Minxiong*, XIANG Fu, YE Hui, WU Peng, WANG Shuzhen, LI Shiming*
(Hubei Key Laboratory of Economic Forest Germplasm Improvement and Resources Comprehensive Utilization, Huanggang Normal University, Huanggang 438000, China)
Abstract:With the improvement of living standards, long-term consumption of high calorie diet and physical inactivity result in storage of excess energy in the body in the form of fat, leading to obesity. Obesity has been off i cially listed as a chronic disease by the World Health Organization (WTO) in 1997. Peroxisome proliferator-activated receptors (PPARs) regulate the proliferation and differentiation of adipocytes by binding themselves with the trans-acting element of the target gene. Understanding the structural features, expression characteristics and mechanism of PPARs is of important theoretical signif i cance and practical value for the control of obesity and related diseases. This article reviews the protein structure, gene expression and ligand activation of PPARγ, the interaction between different types of PPARs, and the role of PPARγ in lipid metabolism and the differentiation of adipocytes by natural ligands. Strategies for the prevention of obesity are put forward based on adipocyte proliferation regulation by PPARγ.
Key words:obesity; trans-acting elements; adipocyte; expression regulation
DOI:10.7506/spkx1002-6630-201703041
中图分类号:Q753
文献标志码:A
文章编号:1002-6630(2017)03-0254-07
引文格式:
杨谷良, 潘敏雄, 向福, 等. PPARγ调控脂肪细胞增殖和分化机理研究进展[J]. 食品科学, 2017, 38(3): 254-260. DOI:10.7506/spkx1002-6630-201703041. http://www.spkx.net.cn
YANG Guliang, PAN Minxiong, XIANG Fu, et al. Progress in the knowledge of the mechanism of PPAR gamma regulation of adipocyte proliferation and differentiation[J]. Food Science, 2017, 38(3): 254-260. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703041. http://www.spkx.net.cn
收稿日期:2016-03-28
基金项目:国家自然科学基金面上项目(31571832);湖北省自然科学基金面上项目(06bm138);湖北省教育厅自然科学基金青年项目(07bq013)
作者简介:杨谷良(1974—),男,副教授,博士,研究方向为经济林木遗传育种。E-mail:469436773@qq.com
*通信作者:潘敏雄(1968—),男,教授,博士,研究方向为天然产物与疾病预防。E-mail:minhsiungpan@gmail.com李士明(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:shiming@rutgers.edu