
图1 磁性固相萃取技术流程图
[[22]]
Fig.1 Flow diagram of magnetic solid-phase extraction
[2]
刘晓星,谢书宇,陈冬梅,潘源虎,朱愈斐,王 旭,彭大鹏,黄玲利,王玉莲,陶燕飞*,袁宗辉
(华中农业大学 国家兽药残留基准实验室,农业部食品安全评价重点开放实验室,湖北 武汉 430070)
摘 要:磁性固相萃取是近年来不断发展的一种样品前处理技术,而磁性功能材料作为磁性固相萃取的吸附剂,由于其独特的物理和化学特性引起广泛关注。本文总结分析了2010年以来磁性功能材料在食品中农药、兽药、合成色素、及其他有毒有害物质检测应用方面的研究进展,以期为食品安全检测新技术的推广应用提供参考。
关键词:磁性功能材料;磁性固相萃取;农药残留;兽药残留;色素残留
样品前处理是分析过程中最基本的步骤,也是影响分析灵敏度、准确性、可靠性的直接因素。不充分的样品前处理会导致目标化合物丢失、样品污染等各种问题,从而影响分析结果。而且,分析过程中,样品处理引起的误差是无法通过分析仪器来校正的,因此样品前处理是保证分析结果准确性的关键步骤之一。
固相萃取是从复杂样品中分离目标化合物最常用的样品前处理方法,它的优势在于具有较高的样品处理通量、良好的回收率和重现性、少量的有机溶剂消耗、多种分离模式以及易于实现自动化 [1]。但传统固相萃取存在必需固相萃取柱、耗时长、吸附剂吸附性能较差、容量低和重复使用率低等问题。因此,在过去的5 年里新型的固相萃取方法,如固相微萃取(solid-phase microextraction,SPME)、分散固相萃取(dispersive solid-phase extraction,DSPE)、磁性固相萃取(magnetic solid-phase extraction,MSPE)、分子印迹固相萃取(molecularly imprinted solid-phase microextraction,MISPME)等,都被用于克服这些缺点。在这些方法中,MSPE作为一种绿色、高效、快速、操作简便的样品前处理技术脱颖而出,它最主要的优势是不需要萃取柱,并且目标化合物能从固定相上简单、快速地分离,省略了过滤或和离心分离的步骤 [2]。除了合适的样品处理技术,寻找新型、高效的固相吸附剂也是一项挑战。近年来,在MSPE中,很多磁性吸附剂被不断合成,也在应用中取得了很好的效果。作为MSPE的吸附剂的磁性功能化材料的研制是研究的热点。本文总结分析了2010年以来磁性功能材料作为吸附剂在食品中农药、兽药、合成色素、及其他有毒有害物质检测的应用研究进展,期望对食品安全检测新技术的推广应用提供参考。

图1 磁性固相萃取技术流程图
[[22]]
Fig.1 Flow diagram of magnetic solid-phase extraction
[2]
MSPE是将磁性纳米颗粒分散于样品溶液或悬浮液中,经过一定时间的吸附,然后在外部磁场的作用下,将带有待测物的磁性纳米颗粒从样品溶液或悬浮液中分离出来,最后用适当的溶剂将待测物洗脱,从而将待测物从基质中分离出来的方法 [2](图1)。相比于传统的固相萃取方法,MSPE有以下五方面的优势:1)该方法消耗的有机溶剂相对较少,磁性功能吸附剂经适当处理后可以重复利用 [3-4],绿色环保;2)少量的吸附剂能在较短的时间内将待测物从样品中分离富集,不需要固相萃取柱,避免了耗时的过柱过程以及过柱堵塞等问题,简化了萃取的程序 [5];3)由于自身的磁响应性,吸附着待测物的磁性吸附剂可在外部磁场作用下,快速地从样品溶液或悬浮液中分离,省去了离心和过滤步骤;4)由于其纳米量级、高比表面积、高吸附容积及可修饰性,磁性吸附剂对待测物有较高的选择性 [6-7];5)整个过程的自动化是较易通过相关技术实现的 [8]。基于以上优点,MSPE已经越来越多地用于样品分析的预处理,并取得了良好的效果。
磁性功能材料是MSPE技术的核心 [8]。在MSPE中,1~100 nm的磁性功能纳米材料由于其超顺磁性、高度的分散性、高比表面积和高吸附容积 [5]得到了广泛的应用。
磁性功能材料,即人工合成磁性材料,包括磁性和非磁性成分两部分,其中磁性成分包括金属(Fe、Co、Ni及其氧化物(MFe 2O 4,M=Fe、Co、Cu、Mn等)和合金(Fe-Co、Ni-Fe等),非磁性成分可以是不同的无机物(二氧化硅、氧化铝等)或有机物(纤维素、壳聚糖、藻酸盐、聚丙烯酰胺等) [9]。
由于Co、Ni、Cr等金属会对人体和环境产生危害,因此常用的MSPE吸附剂一般都由铁矿物或磁性铁氧化物纳米颗粒组成,如Fe 3O 4、γ-Fe 2O 3等。这些磁性纳米颗粒制备简单,有良好的超顺磁性、较高的比表面积和易修饰性 [10]。但若仅以Fe 3O 4、γ-Fe 2O 3作为吸附剂,则磁性颗粒容易发生团聚现象,导致吸附选择性差、富集效果降低,不宜用于复杂样品基质的前处理 [11-12]。因此,常常需要以磁性颗粒为核,在其表面包覆特定的活性官能团,形成核-壳结构来消除以上限制 [5]。这种包覆可以提高磁性颗粒的化学稳定性,防止氧化的发生,并给予其特殊的功能,比如对离子的选择性 [13]。
目前,被报道的作为MSPE吸附剂的磁性功能材料不断增多,其中,多种磁性功能材料被应用于食品有毒有害物质残留检测中。
3.1 食品中农药残留检测的应用
农药残留问题是危害食品安全、人类健康及生态环镜因素之一。目前,国内外一方面不断的扩大农药残留标准的覆盖范围 [14],一方面对准确、灵敏、快速和高通量的农药残留检测技术提出了迫切的需求。磁性功能材料由于其独特的物理和化学性质在食品中农药残留检测中的应用逐渐增多。巫远招等 [15]采用了自制Fe 3O 4@ZrO 2磁性吸附剂分离富集结合电感耦合等离子发射光谱(inductively coupled plasma-atomic emissionspectrometry,ICP-AES)法来测定蔬菜表面有机磷农药的残留,该方法的精密度和灵敏度与标准的气相色谱法(gas chromatography,GC)法基本一致,测得检测限为4.4×10 3ng/L。该材料可重复利用10 次以上,其非磁性部分ZrO 2为疏水化合物,对脂溶性的有机磷吸附能力较亲水性无机磷酸根强,从而减少了无机磷的干扰。Zheng Haobo等 [16]用磁性石墨炭黑与乙二胺复合物(graphitized carbon black/primary secondary amine/Fe 3O 4magnetite nano particles,GCB/PSA/MNPs)作吸附剂来萃取蔬菜中的10 种农药,测得检出限为0.39~8.60 ng/g。Gao Lei等 [17]通过化学沉积法将Fe 3O 4纳米颗粒与碳纳米管(carbon nanotubes,CNTs)复合形成磁性碳纳米管(magnetic carbon nanotubes,MCNTs)作为吸附剂来萃取茶叶里的3 种拟除虫菊酯,再用高效液相色谱紫外检测(high performance liquid chromatography ultra violet detection,HPLC-UV)法进行检测,测得3 种杀虫剂的检测限分别为0.017、0.010、0.018 μg/g。MCNTs具有管状结构,其内腔有较大的比表面积,具有较大的吸附性,且MCNTs对疏水分子有较强的亲和力,适用于弱极性小分子的分离和富集 [18]。Jiang Chunzhu等 [13]建立了将液固萃取和磁性固相萃取结合的样品前处理方法,来萃取蔬菜中的拟除虫菊酯类农药残留,再用快速液相色谱(ultrafast liquid chromatography,UFLC)法进行检测,测得检测限为0.63~1.20 ng/g。该方法中用的磁性吸附剂为功能化C 18-二氧化硅纳米颗粒(C 18-functional ultrafine magnetic silica nano particles,C 18-UMS-NPs),是通过化学共沉淀、硅烷化和烷基化反应合成的。实验结果表明,该方法简单、准确、高效。Wang Lu等 [19]制备了石墨烯基磁性纳米复合物作为吸附剂来萃取黄瓜、卷心菜和番茄中的7 种苯三唑类杀真菌剂,然后用气相色谱-质谱(GC-mass spectrometry,GC-MS)法来检测其残留量,最后测得检测限为0.01~0.10 ng/g。该实验结果表明,各种因素都会影响吸附剂的萃取效率,如吸附剂的用量、萃取时间、pH值、溶液的盐浓度和洗脱条件等。石墨烯是一种新型的碳纳米材料,具有较高的比表面积、较强的化学稳定性和疏水性,且制备成本低、原料易得,但其质量超轻,很难通过离心从样品悬浮液中完全分离 [20]。而石墨烯与Fe 3O 4磁性纳米颗粒形成的复合材料兼具了石墨烯的吸附性能和磁性分离能力,解决了上述问题。王璐 [20]制备了具有核壳结构的磁性纳米复合材料(Fe 3O 4@SiO 2-G)作吸附剂,来萃取油菜和西红柿中的14 种农药残留,再用GC-MS法进行检测,测得检测限为0.005~0.030 ng/g。实验结果表明,这种纳米材料不仅具有高吸附容量,而且硅壳的保护使得磁性纳米离子不易氧化从而更加稳定。Li Na等 [21]利用石墨烯基磁性纳米颗粒来萃取西红柿中的氨基甲酸类农药,富集因子为364~434,然后用HPLC法检测,测得检出限为0.58~2.06 ng/g。实验结果表明,这个方法具有高效的预处理和浓缩能力,可以成功地用于复杂基质中痕量氨基甲酸类农药的检测。张咏等 [4]利用以甲基丙烯酸为功能体,乙二醇二甲基丙烯酸酯为交联剂,对Fe 3O 4磁性纳米粒子进行改性合成了Fe 3O 4@MAED磁性纳米颗粒作吸附剂,对环境水样和果汁样品中的4 种苯甲酰脲类杀虫剂(benzoylurea pesticides,BUs)进行富集,再用HPLC进行检测,结果表明,Fe 3O 4@MAED可通过疏水作用力和离子交换来实现对BUs的有效富集,所合成的Fe 3O 4@MAED吸附剂不仅具有良好的萃取性能,而且可连续使用50 次以上。磁性功能材料在食品中农药残留检测的应用见表1。
表1 磁性功能材料在食品中农药残留检测的应用
Table1 Applications of magnetic function materials for the detection of pesticide residues in foods
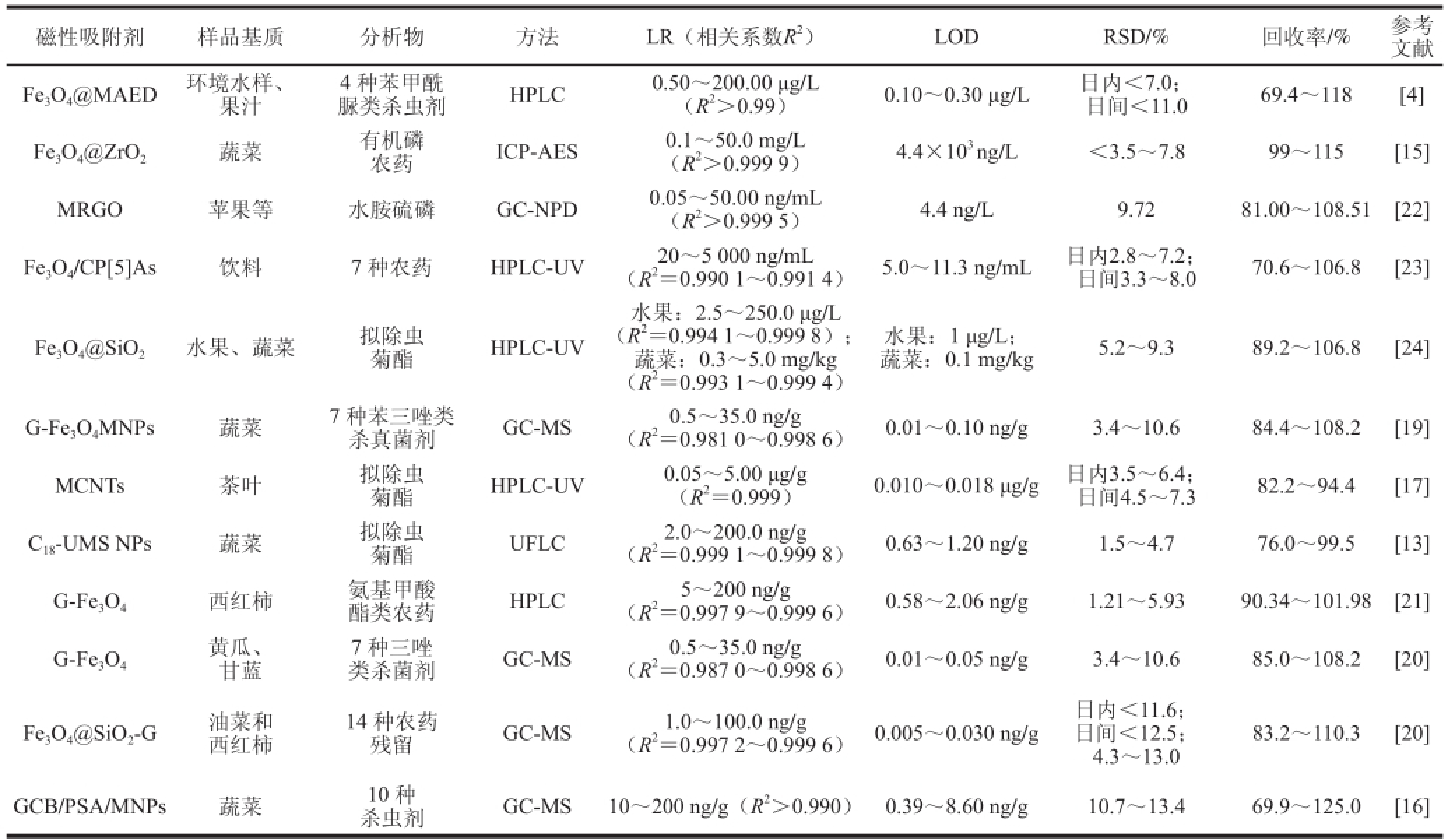
注:LR.线性关系(linear relation);LOD.检测限(limit of detection);RSD.相对标准偏差(relative standard deviation);MRGO.磁性还原氧化石墨烯(magnetic reduced graphene oxide);GC-NPD.气相色谱-氮磷检测器检测(gas chromatography-nitrogen-phosphorous detector)。下同。
磁性吸附剂样品基质分析物方法LR(相关系数R 2)LODRSD/%回收率/%参考文献Fe 3O 4@MAED环境水样、果汁农药ICP-AES0.1~50.0 mg/L(R 2>0.999 9)4.4×10 3ng/L<3.5~7.899~115[15] MRGO苹果等水胺硫磷GC-NPD0.05~50.00 ng/mL(R 2>0.999 5)4.4 ng/L9.7281.00~108.51[22] Fe 3O 4/CP[5]As饮料7 种农药HPLC-UV20~5 000 ng/mL脲类杀虫剂HPLC0.50~200.00 μg/L(R 2>0.99)0.10~0.30 μg/L日内<7.0;日间<11.069.4~118[4] Fe 3O 4@ZrO 2蔬菜有机磷4 种苯甲酰(R 2=0.990 1~0.991 4)5.0~11.3 ng/mL日内2.8~7.2;日间3.3~8.070.6~106.8[23] Fe 3O 4@SiO 2水果、蔬菜拟除虫菊酯HPLC-UV水果:2.5~250.0 μg/L(R 2=0.994 1~0.999 8);蔬菜:0.3~5.0 mg/kg(R 2=0.993 1~0.999 4)水果:1 μg/L;蔬菜:0.1 mg/kg5.2~9.389.2~106.8[24] G-Fe 3O 4MNPs蔬菜7 种苯三唑类菊酯HPLC-UV0.05~5.00 μg/g(R 2=0.999)0.010~0.018 μg/g日内3.5~6.4;日间4.5~7.382.2~94.4[17] C 18-UMS NPs蔬菜拟除虫杀真菌剂GC-MS0.5~35.0 ng/g(R 2=0.981 0~0.998 6)0.01~0.10 ng/g3.4~10.684.4~108.2[19] MCNTs茶叶拟除虫菊酯UFLC2.0~200.0 ng/g(R 2=0.999 1~0.999 8)0.63~1.20 ng/g1.5~4.776.0~99.5[13] G-Fe 3O 4西红柿氨基甲酸酯类农药HPLC5~200 ng/g(R 2=0.997 9~0.999 6)0.58~2.06 ng/g1.21~5.9390.34~101.98[21] G-Fe 3O 4黄瓜、甘蓝类杀菌剂GC-MS0.5~35.0 ng/g(R 2=0.987 0~0.998 6)0.01~0.05 ng/g3.4~10.685.0~108.2[20] 7 种三唑Fe 3O 4@SiO 2-G油菜和西红柿14 种农药残留GC-MS1.0~100.0 ng/g(R 2=0.997 2~0.999 6)0.005~0.030 ng/g日内<11.6;日间<12.5;4.3~13.0 83.2~110.3[20] GCB/PSA/MNPs蔬菜10 种杀虫剂GC-MS10~200 ng/g(R 2>0.990)0.39~8.60 ng/g10.7~13.469.9~125.0[16]
3.2 食品中兽药残留检测的应用
随着我国畜牧业现代化、集约化和规模化的发展,兽药被广泛地用于防治动物疾病、促生长、提高饲料转化率、控制生殖周期及繁殖性能等。大量兽药,尤其是饲料药物添加剂的使用在保障畜牧业发展的同时,残留于畜产品中对人类的健康、生存环境以及经济发展带来了潜在的危害。各个国家都规定了兽药在动物性食品中的最大残留限量,也不断制定严格的残留标准和监测方法。MSPE在食品中兽药检测的应用也有报道。Rodriguez等 [25]硅基磁性纳米颗粒作吸附剂来萃取牛奶中的四环素类抗生素,再用荧光免疫分析(fluoroimmunossay,FIA)法进行检测,测得检测限为0.10~0.60 mg/L,且同时与SPE-HPLC检测牛奶中四环素类抗生素残留进行对比,结果表明两种方法并没有表现出很大的差异,但是MSPE-FIA法更快速、节省溶剂,有很大的潜力。王雅群等 [26]利用化学共沉淀方法制备了超顺磁性Fe 3O 4纳米颗粒,再借助超声辅助和沉淀聚合法合成Fe 3O 4@SiO 2@MIP分子印记聚合物,然后用HPLC法测定了肉和牛奶中3 种四环素的残留。该方法在15 min内同时检测了样品中多种抗生素的残留,且方法重现性良好,测得土霉素、四环素、金霉素3 种药物的检出限分别为7.84、9.61、11.93 ng/mL。Guo Liang等 [27]用油酸包覆磁性纳米珠(oleic acid coated magnetic nanobeads,OA-MNBs)作吸附剂来萃取鱼肉样品中的隐性孔雀石绿,再用LC-MS/MS法进行检测,测得检出限为0.1 ng/g。Guo Liang等将MSPE方法与传统的液液萃取(liquidliquid extraction,LLE)方法进行对比,结果显示MSPE方法有更高的灵敏度,而且耗时较短。Zhao Yonggang等 [28]利用超声辅助悬浮聚合法合成了核-壳结构的氨基功能化磁性分子印迹聚合物(core-shell nanoring aminofunctionalized magnetic non-imprinted polymer,CS-NRMag-MIP)作为磁性吸附剂对样品进行前处理,再用UFLC-MS/MS检测了鸡肉中22 种磺胺类药物的残留。分子印迹技术的应用增加了磁性功能材料对目标分析物的选择性。实验结果表明,将磁性吸附剂直接加入样品溶液中可以代替萃取和富集两个步骤,省时又方便;而且在外加磁场作用下,CS-NR-Mag-MIP可以很快的从样品基质中分离出来。该方法的定量限为0.013~0.099 ng/g。徐阳 [9]制备了磁性多壁碳纳米管用于萃取鸡蛋中的磺胺类药物,然后有HPLC-MS/MS法进行检测,测得7 种磺胺类药物磺胺嘧啶、磺胺甲基嘧啶、磺胺对甲氧嘧啶、磺胺间甲氧嘧啶、磺胺甲恶唑、磺胺二甲氧嘧啶、磺胺喹噁啉的检出限分别为2.6、1.8、2.5、2.0、2.4、1.4、2.8 ng/g,定量限分别为8.5、6.1、8.2、6.7、7.9、4.7、9.2 ng/g。实验结果表明,MSPE避免了传统萃取中复杂的操作步骤,提高了测定的灵敏度,吸附效率高,分析速率快,吸附剂可重复利用,有效地节约了分析成本。Hu Xizhou等 [29]建立了猪肉、猪肝中10 种苯并咪唑类药物残留检测方法,制备了磁性甲基丙烯酸-乙二醇二甲基丙烯酸酯复合微球(Fe 3O 4/SiO 2/poly(methacrylic acid-coethylene glycol dimethacrylate,MAA-co-EGDMA)为吸附剂,用场放大样品堆积法电动进样来提高方法的敏感性,最后测得猪肉和猪肝的检测限分别为1.05~10.42、1.06~12.61 ng/g。硅基修饰是较为常见的磁性材料修饰方法。硅基的包覆增加了磁性材料的稳定性和亲水性。成熟的硅烷化反应技术也为二氧化硅层的表面修饰及其应用提供了重要保障 [30]。磁性功能材料在食品中兽药残留检测的应用见表2。
表2 磁性功能材料在食品中兽药残留检测的应用
Table2 Applications of magnetic function materials for the detection of veterinary drug residues in foods
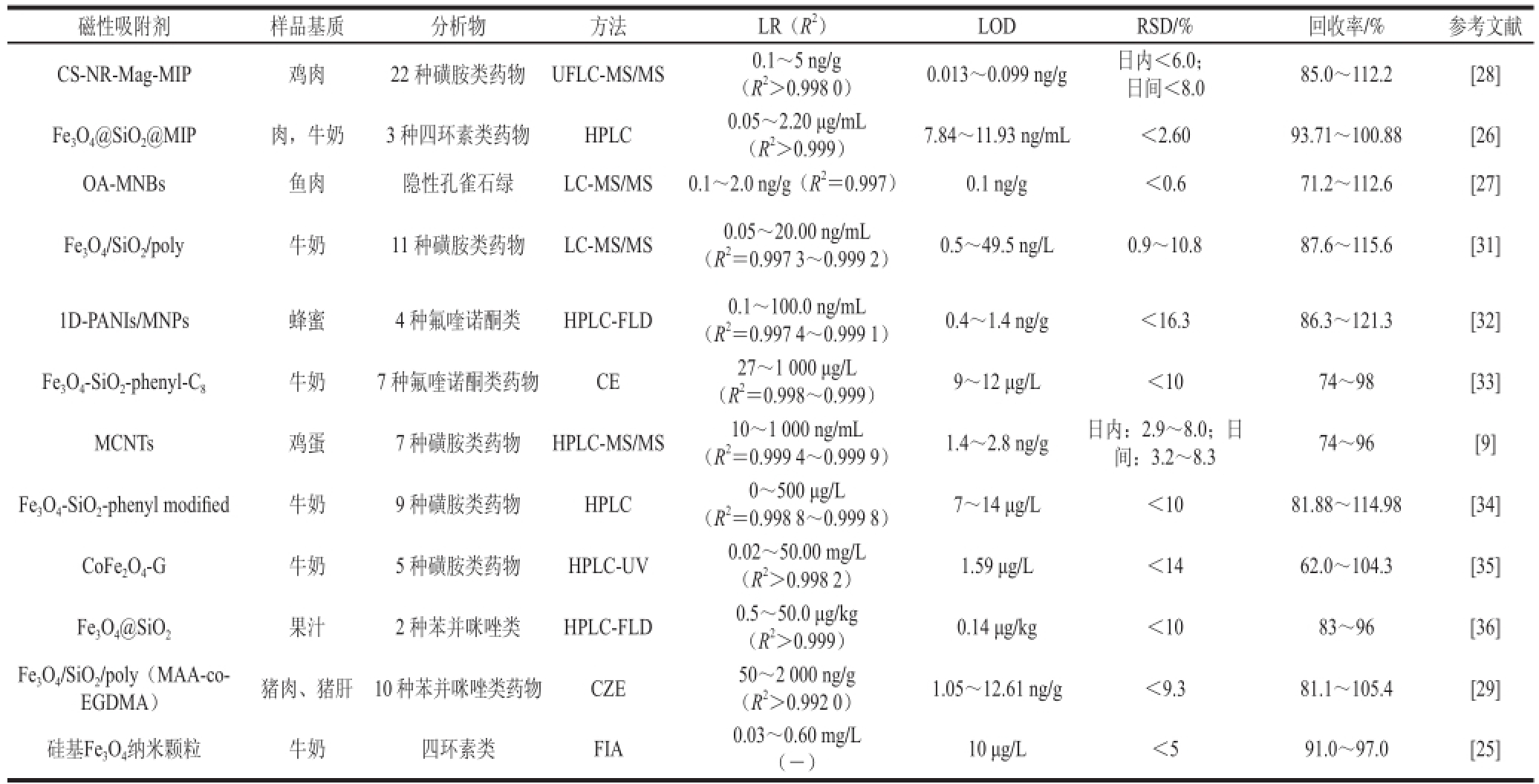
注:1D-PANIs/MNPs.一维聚苯胺磁性纳米颗粒(one-dimensional polyaniline/magnetic nanoparticles);CE.毛细管电泳(capillary electrophoresis);CZE.毛细管区带电泳(capillary zone electrophoresis);-.文献无此数值。下同。
磁性吸附剂样品基质分析物方法LR(R 2)LODRSD/%回收率/%参考文献CS-NR-Mag-MIP鸡肉22 种磺胺类药物UFLC-MS/MS0.1~5 ng/g(R 2>0.998 0)0.013~0.099 ng/g日内<6.0;日间<8.085.0~112.2[28] Fe 3O 4@SiO 2@MIP肉,牛奶3 种四环素类药物HPLC0.05~2.20 μg/mL(R 2>0.999)7.84~11.93 ng/mL<2.6093.71~100.88[26] OA-MNBs鱼肉隐性孔雀石绿LC-MS/MS0.1~2.0 ng/g(R 2=0.997)0.1 ng/g<0.671.2~112.6[27] Fe 3O 4/SiO 2/poly牛奶11 种磺胺类药物LC-MS/MS0.05~20.00 ng/mL(R 2=0.997 3~0.999 2)0.5~49.5 ng/L0.9~10.887.6~115.6[31] 1D-PANIs/MNPs蜂蜜4 种氟喹诺酮类HPLC-FLD0.1~100.0 ng/mL(R 2=0.997 4~0.999 1)0.4~1.4 ng/g<16.386.3~121.3[32] Fe 3O 4-SiO 2-phenyl-C 8牛奶7 种氟喹诺酮类药物CE27~1 000 μg/L(R 2=0.998~0.999)9~12 μg/L<1074~98[33] MCNTs鸡蛋7 种磺胺类药物HPLC-MS/MS10~1 000 ng/mL(R 2=0.999 4~0.999 9)1.4~2.8 ng/g日内:2.9~8.0;日间:3.2~8.374~96[9] Fe 3O 4-SiO 2-phenyl modif i ed牛奶9 种磺胺类药物HPLC0~500 μg/L(R 2=0.998 8~0.999 8)7~14 μg/L<1081.88~114.98[34] CoFe 2O 4-G牛奶5 种磺胺类药物HPLC-UV0.02~50.00 mg/L(R 2>0.998 2)1.59 μg/L<1462.0~104.3[35] Fe 3O 4@SiO 2果汁2 种苯并咪唑类HPLC-FLD0.5~50.0 μg/kg(R 2>0.999)0.14 μg/kg<1083~96[36] Fe 3O 4/SiO 2/poly(MAA-co-EGDMA)猪肉、猪肝10 种苯并咪唑类药物CZE50~2 000 ng/g(R 2>0.992 0)1.05~12.61 ng/g<9.381.1~105.4[29]硅基Fe 3O 4纳米颗粒牛奶四环素类FIA0.03~0.60 mg/L(-)10 μg/L<591.0~97.0[25]
表3 磁性功能材料在食品中合成色素残留检测的应用
Table3 Applications of magnetic function materials for the detection of synthetic pigment residues in foods
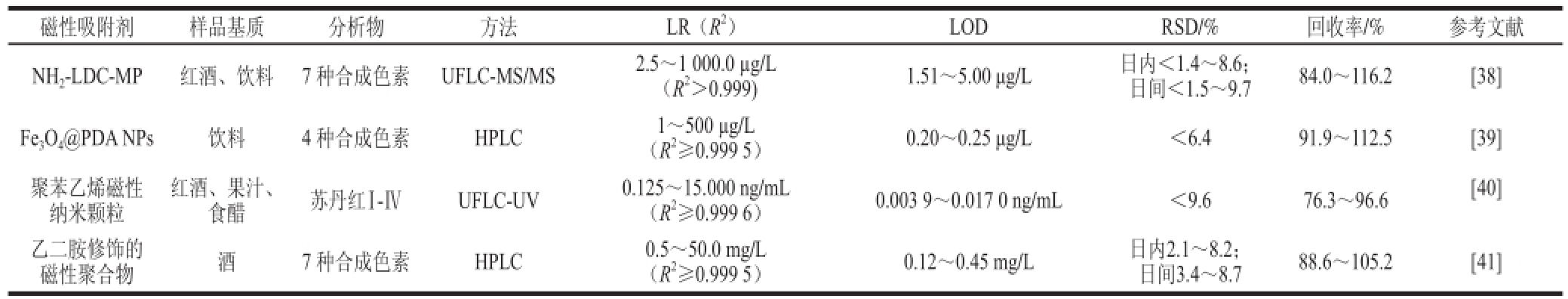
磁性吸附剂样品基质分析物方法LR(R 2)LODRSD/%回收率/%参考文献NH 2-LDC-MP红酒、饮料7 种合成色素UFLC-MS/MS2.5~1 000.0 μg/L(R 2>0.999)1.51~5.00 μg/L日内<1.4~8.6;日间<1.5~9.784.0~116.2[38] Fe 3O 4@PDA NPs饮料4 种合成色素HPLC1~500 μg/L(R 2≥0.999 5)0.20~0.25 μg/L<6.491.9~112.5[39]聚苯乙烯磁性纳米颗粒红酒、果汁、食醋苏丹红Ⅰ-ⅣUFLC-UV0.125~15.000 ng/mL(R 2≥0.999 6)0.003 9~0.017 0 ng/mL<9.676.3~96.6[40]乙二胺修饰的磁性聚合物酒7 种合成色素HPLC0.5~50.0 mg/L(R 2≥0.999 5)0.12~0.45 mg/L日内2.1~8.2;日间3.4~8.788.6~105.2[41]
3.3 食品中合成色素残留检测的应用
合成色素是被广泛应用的食品添加剂之一,我国GB 2760—2011《食品添加剂使用标准》 [37]规定了允许添加的合成色素的种类、使用范围和限量,但合成色素滥用的现象仍然存在。Chen Xiaohong等 [38]合成氨基功能化低交联度磁性聚合物,然后采用UFLC-MS/MS对红酒和饮料中的7 种色素进行残留检测,检测定量限在1.51~5.00 μg/L范围内。实验结果表明,交联剂的应用可以影响聚合物交联的程度,而氨基化低交联度磁性聚合物(amino-functionalized low degrees of cross-linking magnetic polymer,NH 2-LDC-MP)有磁响应性,但没有永久的磁性,因此可以更快的从基质中分离。Chai Weibo等 [39]制备聚乙烯多巴胺包覆Fe 3O 4纳米颗粒用于饮料中4 种合成色素的萃取,并从吸附条件、聚合时间、pH值、吸附剂用量、萃取时间、吸附剂的重复利用性等方面进行考察,选择了最适的实验条件,并用于实际样品中测得检测限为0.20~0.25 μg/L。与其他检测方法比较而言,该实验方法有更宽的线性范围,更低的检测限,而且操作简便,耗时少。磁性功能材料在食品中合成色素残留检测的应用见表3。
3.4 有毒有害物质
除了农药、兽药、合成色素外,食品中还可能残留有很多其他有毒有害物质。雌激素是人体内重要的调节激素,它在人的生长发育过程中起着重要的调节作用,同时也对某些疾病有预防和治疗效果。但是过量或使用不当的雌激素会对人体产生一定的副作用,如内分泌失调等。田苗苗 [23]合成了Fe 3O 4@TiO 2/氧化石墨烯磁性微球作吸附剂,通过微流控芯片进行分离富集再用HPLC-UV对牛奶和奶粉中雌激素含量进行检测,测得雌激素E1、E2、E3的检出限分别为7.5、4.3、4.9 ng/mL,同时该实验也有令人满意的精密度、重现性、回收率和萃取效率,而且简便快速。Moazzen等 [42]用MCNTs作吸附剂萃取烤肉(牛肉、羊肉、鸡肉)中的多环芳烃,再用GC-MS法进行检测,测得检测限为0.035~0.100 μg/kg,定量限为0.075~0.200 μg/kg。Moazzen等 [42]通过MCNTs的应用,分析方法的性能有所提高。Mashhadizadeh等 [43]制备了3-(硅烷)-1-丙硫醇包覆的磁性Fe 3O 4颗粒作为吸附剂,来萃取水稻、小麦和玉米中的赭曲霉素A,再用HPLC法进行检测,测得检测限分别为0.06、0.03、0.05 ng/mL,定量限分别为0.19、0.11、0.15 ng/mL。Mashhadizadeh [43]等用透射电子显微镜、X射线衍射和傅里叶变换红外线光谱对所制备的吸附剂进行了表征。Zhang Shengxiao等 [44]用磷脂酰胆碱包覆磁性纳米颗粒作吸附剂来富集环境水样和牛奶中的多环芳烃族化合物(polycyclic aromatic hydrocarbons,PAHs),测得检测限为0.2~0.6 ng/L,该研究团队利用脂质薄膜水化法在磁性Fe 3O 4纳米颗粒表面形成了脂质双分子层,使其对有机污染物有了优秀的吸附性能:0.1 g的吸附剂足以将PAHs从500 mL的水溶液中萃取出来,再用6 mL的乙腈将PAHs洗脱,而且耗时较短。虽然该实验的回收率相对较低,但表现了磁性纳米吸附剂在生物样品分析中的潜力。Zhao Qin等 [45]建立了液相微萃取和磁性固相萃取结合的新型分散微萃取方法,首先让Fe 3O 4颗粒吸附痕量的水形成水包覆型Fe 3O 4磁性颗粒(water-coated Fe 3O 4,W-Fe 3O 4),将W-Fe 3O 4分散于样品溶液中便可以实现快速萃取。Zhao Qin等 [45]用这种方法来萃取食用油中的3-氯-1,2-丙二醇,再用GC-MS法来进行检测,测得检出限为1.1 ng/g。这个方法为复杂油脂样品中亲水性物质的分析奠定了基础。Hashemi等 [46]用硅烷包覆,2-氨基-5-巯基-1,3,4-噻二唑修饰的磁性纳米颗粒来萃取牛奶中的黄曲霉毒素M,测得检测限为0.010 μg/L。实验结果表明,MSPE方法简单、廉价、准确,受干扰影响小。Manafi等 [47]制备了双巯基乙酸乙二醇酯修饰的原硅酸四乙酯包覆Fe 3O 4磁性颗粒(ethylene glycol bis-mercaptoacetate modified tetraethyl orthosilicate coated Fe 3O 4,EGBMA-TEOS-MNPs)来萃取谷物中的总黄曲霉毒素,然后用荧光光度法进行检测,测得检出限为0.07 μg/kg。Manafi等发现MSPE的使用节省了时间,提供了高效快速的萃取效率,结果显示了良好的精密度、较低的检测限、较好的回收率和较广的线性范围。邻苯二甲酯是塑料包装材料的增塑剂之一,它可能会迁移到食品中,从而危害人类的健康。Makkliang等 [48]制备了磁性乙烯醇多壁碳纳米管复合材料(multiwalled carbon nanotubes-poly (vinyl alcohol) cryogel,MWCNTs-PVA)来萃取邻苯二甲酸酯,测得邻苯二甲酸二异辛酯(di-2-(ethylhexyl) phthalate,DEHP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)检测限分别为为(26.3±0.3)、(36.4±2.0)ng/mL。磁性功能材料在食品中有毒有害物质残留检测的应用见表4。
表4 磁性功能材料在食品中有毒有害物质残留检测的应用
Table4 Applications of magnetic function materials for the detection of hazardous substance residues in foods
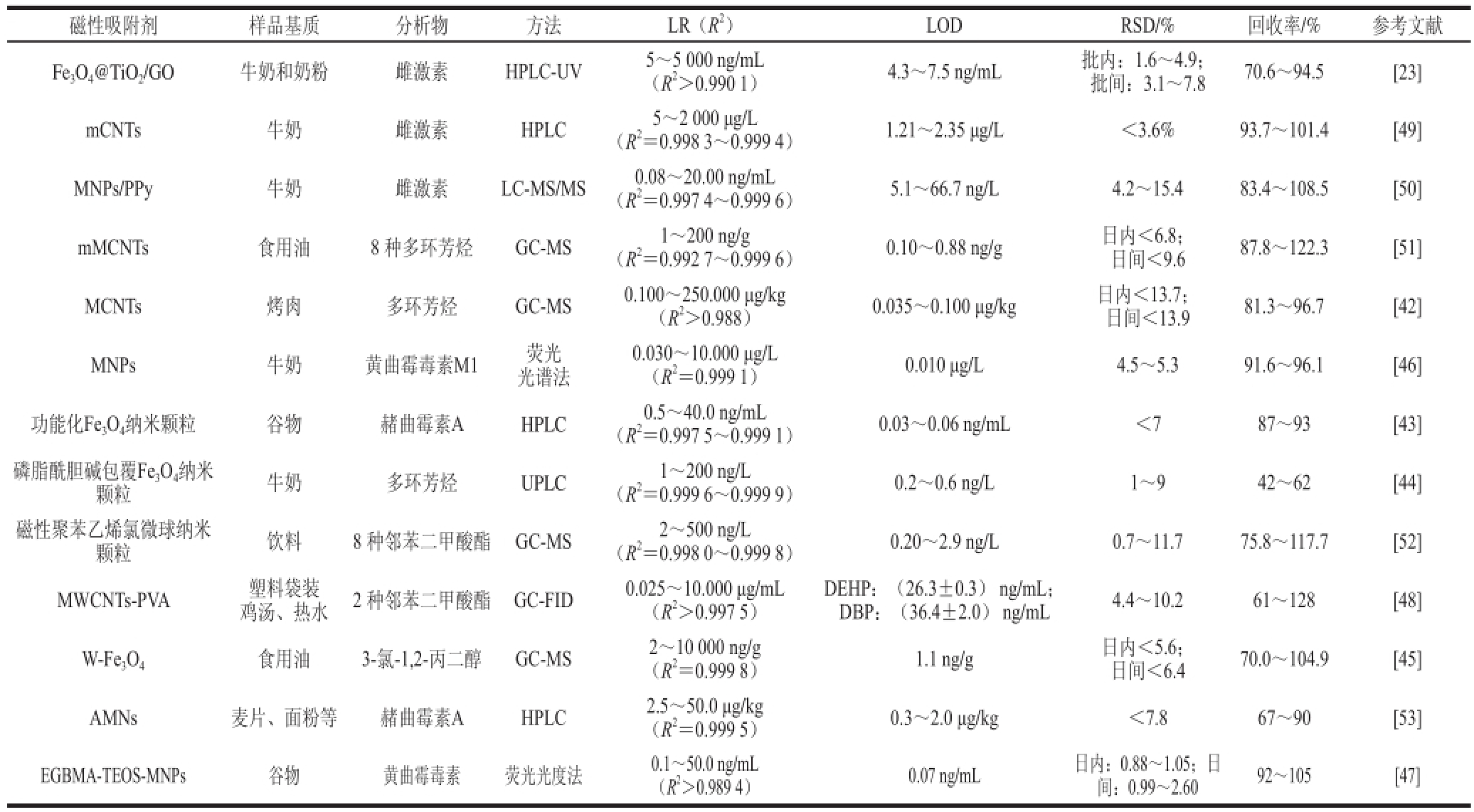
磁性吸附剂样品基质分析物方法LR(R 2)LODRSD/%回收率/%参考文献Fe 3O 4@TiO 2/GO牛奶和奶粉雌激素HPLC-UV5~5 000 ng/mL(R 2>0.990 1)4.3~7.5 ng/mL批内:1.6~4.9;批间:3.1~7.870.6~94.5[23] mCNTs牛奶雌激素HPLC5~2 000 μg/L(R 2=0.998 3~0.999 4)1.21~2.35 μg/L<3.6%93.7~101.4[49] MNPs/PPy牛奶雌激素LC-MS/MS0.08~20.00 ng/mL(R 2=0.997 4~0.999 6)5.1~66.7 ng/L4.2~15.483.4~108.5[50] mMCNTs食用油8 种多环芳烃GC-MS1~200 ng/g(R 2=0.992 7~0.999 6)0.10~0.88 ng/g日内<6.8;日间<9.687.8~122.3[51] MCNTs烤肉多环芳烃GC-MS0.100~250.000 μg/kg(R 2>0.988)0.035~0.100 μg/kg日内<13.7;日间<13.981.3~96.7[42] MNPs牛奶黄曲霉毒素M1荧光光谱法0.030~10.000 μg/L(R 2=0.999 1)0.010 μg/L4.5~5.391.6~96.1[46]功能化Fe 3O 4纳米颗粒谷物赭曲霉素AHPLC0.5~40.0 ng/mL(R 2=0.997 5~0.999 1)0.03~0.06 ng/mL<787~93[43]磷脂酰胆碱包覆Fe 3O 4纳米颗粒牛奶多环芳烃UPLC1~200 ng/L(R 2=0.999 6~0.999 9)0.2~0.6 ng/L1~942~62[44]磁性聚苯乙烯氯微球纳米颗粒饮料8 种邻苯二甲酸酯GC-MS2~500 ng/L(R 2=0.998 0~0.999 8)0.20~2.9 ng/L0.7~11.775.8~117.7[52] MWCNTs-PVA塑料袋装鸡汤、热水2 种邻苯二甲酸酯GC-FID0.025~10.000 μg/mL(R 2>0.997 5)DEHP:(26.3±0.3) ng/mL;DBP:(36.4±2.0) ng/mL4.4~10.261~128[48] W-Fe 3O 4食用油3-氯-1,2-丙二醇GC-MS2~10 000 ng/g(R 2=0.999 8)1.1 ng/g日内<5.6;日间<6.470.0~104.9[45] AMNs麦片、面粉等赭曲霉素AHPLC2.5~50.0 μg/kg(R 2=0.999 5)0.3~2.0 μg/kg<7.867~90[53] EGBMA-TEOS-MNPs谷物黄曲霉毒素荧光光度法0.1~50.0 ng/mL(R 2>0.989 4)0.07 ng/mL日内:0.88~1.05;日间:0.99~2.6092~105[47]
近年来,磁性功能材料越来越多的应用于MSPE中,大大提高了样品前处理的效率,简化了处理过程,并具有绿色环保的特点。但由于其发展时间较短、起步较晚,还有以下几个方面需要做出改进:磁性功能材料在环境水样等简单基质中的应用最为广泛 [54-55],而在复杂基质如食品中的应用相对较少。因此,MSPE在扩大样品范围方面还有很大的发展空间;磁性功能材料的制备过程较为繁琐,吸附剂的选择性、重现性还有待提高;影响MSPE效果的因素较多,如吸附剂的种类和用量、样品pH值、离子强度、萃取时间、洗脱条件等,往往需要经过繁琐的条件优化过程;更多高吸附效率,综合性能更优越的磁性功能材料有待研发;高通量和自动化的在线MSPE技术是当前的发展方向之一。
参考文献:
[1] 林星辰, 余彬彬, 叶丹霞. 固相萃取技术新发展及其在环境分析中的应用[J]. 化工时刊, 2014, 28(9): 28-34. DOI:10.3969/j.issn.100-154X.014.09.009.
[2] LATORRE C H, GARCÍA J B, MARTÍN S G, et al. Magnetic solidphase extraction using carbon nanotubes as sorbents[J]. Analytica Chimica Acta, 2015, 892: 10-16. DOI:10.1016/j.aca.2015.07.046.
[3] 曹慧, 陈小珍, 朱岩, 等. 磁性多壁碳纳米管对磺胺类药物的吸附行为[J]. 新型碳材料, 2015, 30(6): 572-579.
[4] 张咏, 陈蕾, 黄晓佳, 等. 磁分散固相微萃取-高效液相色谱联用测定水样和果汁中苯甲酰脲类杀虫剂[J]. 分析化学, 2015(9): 1335-1341. DOI:10.11895/j.issn.053-380.150193.
[5] GIAKISIKLI G, ANTHEMIDIS A N. Magnetic materials as sorbents for metal/metalloid preconcentration and/or separation[J]. Analytica Chimica Acta, 2013, 789(14): 1-16. DOI:10.1016/j.aca.2013.04.021.
[6] WIERUCKA M, BIZIUK M. Application of magnetic nanoparticles for magnetic solid-phase extraction in preparing biological, environmental and food samples[J]. Trends in Analytical Chemistry, 2014, 59(2): 50-58. DOI:10.1016/j.trac.2014.04.007.
[7] JIANG H M, YAN Z P, ZHAO Y, et al. Zincon-immobilized silicacoated magnetic Fe 3O 4nanoparticles for solid-phase extraction and determination of trace lead in natural and drinking waters by graphite furnace atomic absorption spectrometry[J]. Talanta, 2012, 94(6): 251-256. DOI:10.1016/j.talanta.2012.03.035.
[8] 潘胜东, 叶美君, 金米聪. 磁性固相萃取在食品安全检测中的应用进展[J]. 理化检验(化学分册), 2015, 51(3): 416-424.
[9] 徐阳. 磁性功能材料的制备及其在复杂样品预处理中的应用研究[D].长春: 吉林大学, 2014: 1.
[10] 叶娟娟. 新型磁性萃取剂的制备以及在分离预富集的应用[D]. 长春: 吉林大学, 2014: 7.
[11] YANG H H, ZHANG S Q, CHEN X L, et al. Magnetite-containing spherical silica nanoparticles for biocatalysis and bioseparations[J]. Analytical Chemistry, 2004, 76(5): 1316-1321. DOI:10.1021/ ac034920m.
[12] PU X L, JIANG Z C, HU B, et al. γ-MPTMS modified nanometersized alumina micro-column separation and preconcentration of trace amounts of Hg, Cu, Au and Pd in biological, environmental and geological samples and their determination by inductively coupled plasma mass spectrometry[J]. Journal of Analytical Atomic Spectrometry, 2004, 19(8): 984-989. DOI:10.1039/B403389B.
[13] JIANG C Z, SUN Y, YU X, et al. Liquid-solid extraction coupled with magnetic solid-phase extraction for determination of pyrethroid residues in vegetable samples by ultra fast liquid chromatography[J]. Talanta, 2013, 114(10): 167-175. DOI:10.1016/j.talanta.2013.04.004.
[14] 宋稳成, 单炜力, 叶纪明, 等. 国内外农药最大残留限量标准现状与发展趋势[J]. 农药学学报, 2009, 11(4): 414-420. DOI:10.3969/ j.issn.1008-7303.2009.04.03.
[15] 巫远招, 徐维莲, 侯建国, 等. 基于Fe 3O 4@ZrO 2磁性纳米颗粒选择性富集电感耦合等离子体发射光谱法检测蔬菜中痕量有机磷研究[J]. 农药学学报, 2010, 12(2): 178-184. DOI:10.3969/ j.issn.1008-7303.2010.02.11.
[16] ZHENG H B, ZHAO Q, MO J Z, et al. Quick, easy, cheap, effective, rugged and safe method with magnetic graphitized carbon black and primary secondary amine as adsorbent and its application in pesticide residue analysis[J]. Journal of Chromatography A, 2013, 1300: 127-133. DOI:10.1016/j.chroma.2013.04.040.
[17] GAO L, CHEN L G. Preparation of magnetic carbon nanotubes for separation of pyrethroids from tea samples[J]. Microchimica Acta, 2013, 180(5): 423-430. DOI:10.1007/s00604-013-0947-1.
[18] 豆小文, 褚先峰, 杨银慧, 等. 纳米材料在农药残留分离富集和检测中的应用进展[J]. 药物分析杂志, 2015, 35(9): 1509-1519. DOI:10.16155/j.0254-1793.2015.09.01.
[19] WANG L, ZANG X H, CHANG Q Y, et al. Determination of triazole fungicides in vegetable samples by magnetic solid-phase extraction with graphene-coated magnetic nanocomposite as adsorbent followed by gas chromatography-mass spectrometry detection[J]. Food Analytical Methods, 2014, 7(2): 318-325. DOI:10.1007/s12161-013-9629-1.
[20] 王璐. 基于石墨烯的样品前处理新技术与气相色谱质谱法相结合在几种农药和防腐剂残留分析中的应用[D]. 保定: 河北农业大学, 2014: 20-32.
[21] LI N, CHEN J, SHI Y P. Magnetic graphene solid-phase extraction for the determination of carbamate pesticides in tomatoes coupled with high performance liquid chromatography[J]. Talanta, 2015, 141(14):212-219. DOI:10.1016/j.talanta.2015.04.018.
[22] YAN S, QI T T, CHEN D W, et al. Magnetic solid phase extraction based on magnetite/reduced graphene oxide nanoparticles for determination of trace isocarbophos residues in different matrices[J]. Journal of Chromatography A, 2014, 1347: 30-38. DOI:10.1016/ j.chroma.2014.04.073.
[23] 田苗苗. 新型样品前处理方法在食品分析中的应用[D]. 长春: 吉林大学, 2014: 47-86.
[24] BAGHERI H, YAMINI Y, SAFARI M, et al. Simultaneous determination of pyrethroids residues in fruit andvegetable samples via supercritical fluid extraction coupled with magnetic solid phase extraction followed by HPLC-UV[J]. Journal of Supercritical Fluids, 2016, 107: 571-580. DOI:10.1016/j.supf l u.2015.07.017.
[25] RODRIGUEZ J A, ESPINOSA J, ARTEAGA K A, et al. Determination of tetracyclines in milk samples by magnetic solid phase extraction fl ow injection analysis[J]. Microchimica Acta, 2010, 171(3): 407-413. DOI:10.1007/s00604-010-0428-8.
[26] 王雅群, 潘道东. 磁性分子印迹固相萃取食品中四环素类抗生素残留[J]. 食品工业科技, 2015, 36(18): 53-58. DOI:10.13386/ j.issn1002-0306.2015.18.002.
[27] GUO L, ZHANG J W, WEI H, et al. Nanobeads-based rapid magnetic solid phase extraction of trace amounts of leuco-malachite green in Chinese major carps[J]. Talanta, 2012, 97(16): 336-342. DOI:10.1016/ j.talanta.2012.04.042.
[28] ZHAO Y G, ZHOU L X, PAN S D, et al. Fast determination of 22 sulfonamides from chicken breast muscleusing core-shell nanoring amino-functionalized superparamagneticmolecularly imprinted polymer followed by liquidchromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2014, 1345: 17-28. DOI:10.1016/j.chroma.2014.04.028.
[29] HU X Z, CHEN M L, GAO Q, et al. Determination of benzimidazole residues in animal tissue samples by combination of magnetic solidphase extraction with capillary zone electrophoresis[J]. Talanta, 2012, 89(2): 335-341. DOI:10.1016/j.talanta.2011.12.038.
[30] 邓小娟. 基于磁性纳米颗粒的功能化复合材料的制备及其吸附性能研究[D]. 天津: 天津大学, 2014: 12.
[31] GAO Q, LUO D, DING J, et al. Rapid magnetic solid-phase extraction based on magnetite/silica/poly(methacrylic acid-co-ethylene glycol dimethacrylate) composite microspheres for the determination of sulfonamide in milk samples[J]. Journal of Chromatography A, 2010, 1217(35): 5602-5609. DOI:10.1016/j.chroma.2010.06.067.
[32] GAO Q, ZHENG H B, LUO D, et al. Facile synthesis of magnetic one-dimensional polyaniline and its application in magnetic solid phase extraction for fl uoroquinolones in honey samples[J]. Analytica Chimica Acta, 2012, 720(1): 57-62. DOI:10.1016/j.aca.2011.12.067.
[33] IBARRA I S, RODRIGUEZ J A, PÁEZ-HERNÁNDEZ M E, et al. Determination of quinolones in milk samples using a combination of magnetic solid-phase extraction and capillary electrophoresis[J]. Electrophoresis, 2012, 33(13): 2041-2048. DOI:10.1002/ elps.201100559.
[34] IBARRA I S, MIRANDA J M, RODRIGUEZ J A, et al. Magnetic solid phase extraction followed by high-performance liquid chromatography for the determination of sulphonamides in milk samples[J]. Food Chemistry, 2014, 157(10): 511-517. DOI:10.1039/C1AY05102D.
[35] LI Y Z, WU X W, LI Z Q, et al. Fabrication of CoFe 2O 4-graphene nanocomposite and its application in the magnetic solid phase extraction of sulfonamides from milk samples[J]. Talanta, 2015, 144(6): 1279-1286. DOI:10.1016/j.talanta.2015.08.006.
[36] DENG X J, CHEN X P, LIN K, et al. Rapid and selective determination of trace benzimidazole fungicides in fruit juices by magnetic solid-phase extraction fungicides in fruit juices by magnetic solid-phase extraction fluorescence detection[J]. Food Analytical Methods, 2013, 6(6): 1576-1582. DOI:10.1007/s12161-013-9572-1.
[37] 卫生部. 食品安全国家标准 食品添加剂使用标准: GB 2760—2011[S]. 北京: 中国标准出版社, 2011: 1.
[38] CHEN X H, ZHAO Y G, SHEN H Y, et al. Fast determination of seven synthetic pigments from wine and soft drinks using magnetic dispersive solid-phase extraction followed by liquid chromatographytandem mass spectrometry[J]. Journal of Chromatography A, 2014, 1346: 123-128. DOI:10.1016/j.chroma.2014.04.060.
[39] CHAI W B, WANG H J, ZHANG Y, et al. Preparation of polydopamine-coated magnetic nanoparticles for dispersive solidphase extraction of water-soluble synthetic colorants in beverage samples with HPLC analysis[J]. Talanta, 2016, 149: 13-20. DOI:10.1016/j.talanta.2015.11.026.
[40] YU X, SUN Y, JIANGC Z, et al. Magnetic solid-phase extraction and ultrafast liquid chromatographic detection of Sudan dyes in red wines, juices, and mature vinegars[J]. Journal of Separation Science, 2012, 35(23): 3403-3411. DOI:10.1002/jssc.201200555.
[41] ZHANG Y, ZHOU H L, WANG Y G, et al. Simultaneous determination of seven synthetic colorants in wine by dispersive microsolid-phase extraction coupled with reversed-phase high-performance liquid chromatography[J]. Journal of Chromatographic Science, 2014, 53(2): 210-218. DOI:10.1093/chromsci/bmu042.
[42] MOAZZEN M, AHMADKHANIBA R, GORJI M E, et al. Magnetic solid-phase extraction based on magnetic multi-walled carbon nan0tubes for the determination of poly cyclic aromatic hydrocarbons in grilled meat samples[J]. Talanta, 2013, 115(17): 957-965. DOI:10.1021/jf203973s.
[43] MASHHADIZADEH M H, DIVA M A, POURGHAZI K. Magnetic nanoparticles solid phase extraction for determination of ochratoxin A in cereals using high-performance liquid chromatography with fl uorescence detection[J]. Journal of Chromatography A, 2013, 1320:17-26. DOI:10.1016/j.chroma.2013.10.062.
[44] ZHANG S X, NIU H Y, ZHANG Y Y, et al. Biocompatible phosphatidylcholine bilayer coated on magnetic nanoparticles and their application in the extraction of several polycyclic aromatic hydrocarbons from environmental water and milk samples[J]. Journal of Chromatography A, 2012, 1238: 38-45. DOI:10.1016/ j.chroma.2012.03.056.
[45] ZHAO Q, WEI F, XIAO N, et al. Dispersive microextraction based on water-coated Fe 3O 4followed by gas chromatography-mass spectrometry for determination of 3-monochloropropane-1,2-diol in edible oils[J]. Journal of Chromatography A, 2012, 1240: 45-51. DOI:10.1016/j.chroma.2012.03.090.
[46] HASHEMI M, TAHERIMASLAK Z, RASHIDI S. Enhanced spectrofluorimetric determination of aflatoxin M1 in liquid milk after magnetic solid phase extraction[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2014, 128(14): 583-590. DOI:10.1016/j.saa.2014.02.108.
[47] MANAFI M H, ALLAHYARI M, POURGHAZI K, et al. Surfactantenhanced spectrofluorimetric determination of total aflatoxins from wheat samples after magnetic solid-phase extraction using modified Fe 3O 4nanoparticles[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 146: 43-49. DOI:10.1016/ j.saa.2015.03.050.
[48] MAKKLIANG F, KANATHARANA P, THAVARUNGKUL P, et al. Development of magnetic micro-solid phase extraction for analysis of phthalate esters in packaged food[J]. Food Chemistry, 2015, 166: 275-282. DOI:10.1016/j.foodchem.2014.06.036.
[49] DING J, GAO Q, LI X S, et al. Magnetic solid-phase extraction based on magnetic carbon nanotube for the determination of estrogens in milk[J]. Journal of Separation Science, 2011, 34(18): 2498-2504. DOI:10.1002/jssc.201100323.
[50] GAO Q, LUO D, BAI M, et al. Rapid determination of estrogens in milk samples based on magnetite nanoparticles/polypyrrole magnetic solid-phase extraction coupled with liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8543-8549. DOI:10.1021/jf201372r.
[51] ZHAO Q, WEI F, LUO Y B, et al. Rapid magnetic solid-phase extraction based on magnetic multiwalled carbon nanotubes for the determination of polycyclic aromatic hydrocarbons in edible oils[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 12794-12800. DOI:10.1021/jf203973s.
[52] 陈娇瑜. 碳基功能材料在复杂基体样品前处理中的应用研究[D]. 杭州: 浙江工业大学, 2014: 27-44.
[53] WU X M, HU J, ZHU B H, et al. Aptamer-targeted magnetic nanospheres as a solid-phase extraction sorbent for determination of ochratoxin A in food samples[J]. Journal of Chromatography A, 2011, 1218(41): 7341-7346. DOI:10.1016/j.chroma.2011.08.045.
[54] WU Q H, ZHAO G Y, FENG C, et al. Preparation of a graphene-based magnetic nanocomposite for the extraction of carbamate pesticides from environmental water samples[J]. Journal of Chromatography A, 2011, 1218(44): 7936-7942. DOI:10.1016/j.chroma.2011.09.027.
[55] YAO X P, FU Z J, ZHAO Y G, et al. Use of tetraethylenepentaminefunctional Fe 3O 4magnetic polymers for matrix solid phase dispersion extraction and preconcentration of Cr(VI) in water samples at ultratrace levels[J]. Talanta, 2012, 97(16): 124-130. DOI:10.1016/ j.talanta.2012.04.006.
A Review of the Applications of Magnetic Functional Materials for the Detection of Toxic and Hazardous Substances in Foods
LIU Xiaoxing, XIE Shuyu, CHEN Dongmei, PAN Yuanhu, ZHU Yufei, WANG Xu, PENG Dapeng, HUANG Lingli, WANG Yulian, TAO Yanfei*, YUAN Zonghui
(National Reference Laboratory of Veterinary Drug Residues (HZAU), Key Laboratory of Food Safety Evaluation, Ministry of Agriculture, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:Magnetic solid-phase extraction (MSPE) is a new sample pretreatment method, which has been continuously developed in recent years. The use of magnetic functional materials as MSPE adsorbent has gained extensive attention because of their unique physical and chemical properties. This article summarizes the applications of magnetic functional materials in the detection of pesticides, veterinary drugs, synthetic dyestuffs, and other toxic and harmful substance residues in foods since 2010, with the aim of providing references for the popularization and application of new food safety detection techniques.
Key words:magnetic functional material; magnetic solid-phase extraction (MSPE); pesticide residue; veterinary drug residue; pigment residue
DOI:10.7506/spkx1002-6630-201703045
中图分类号:O658.2;TS201.6
文献标志码:A
文章编号:1002-6630(2017)03-0284-08
引文格式:
刘晓星, 谢书宇, 陈冬梅, 等. 磁性功能材料在食品中有毒有害物质检测的应用进展[J]. 食品科学, 2017, 38(3): 284-291. DOI:10.7506/spkx1002-6630-201703045. http://www.spkx.net.cn
LIU Xiaoxing, XIE Shuyu, CHEN Dongmei, et al. A review of the applications of magnetic functional materials for the detection of toxic and hazardous substances in foods[J]. Food Science, 2017, 38(3): 284-291. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201703045. http://www.spkx.net.cn
收稿日期:2015-12-10
基金项目:湖北省自然科学基金面上项目(2016CF553)
作者简介:刘晓星(1991—),女,硕士研究生,研究方向为兽药及食品安全。Email:1095338343@qq.com
*通信作者:陶燕飞(1977—),女,副教授,博士,研究方向为兽药及食品安全。Email:tyf@mail.hzau.edu.cn