
图 1 槲皮素(A)和矢车菊素-3-O-葡萄糖苷(B)结构图
Fig. 1 Chemical structures of quercetin (A) and cyanidin-3-glucoside (B)
刘建垒,邢效娟,周 瑞,景 浩 *
(中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:实验比较了牛血清白蛋白(bovine serum albumin,BSA)与脂溶性小分子槲皮素(quercetin,QUE)和水溶性花青素(anthocyanin,ACN)相互作用方式及其纳米颗粒的特征。QUE对BSA荧光猝灭作用为静态猝灭方式(低浓度),但在较高浓度时为静态与动态并存的复合猝灭方式,两者的相互作用力为疏水作用力;ACN对BSA的荧光猝灭程度小于QUE对BSA的,为静态猝灭方式,相互作用力为静电作用力。BSA与QUE的结合常数大于BSA与ACN的结合常数。BSA与QUE或ACN相互作用可形成纳米颗粒,其大小分别为42.5 nm和53.7 nm,ζ-电势分别为-25.64 mV和-21.50 mV。1 mol BSA分子可分别与8 mol QUE和10 mol ACN结合。BSA与QUE形成的纳米颗粒(BSA-QUE)粒径较BSA与ACN(BSA-ACN)的小,且稳定性较高。BSA-QUE对DPPH自由基和ABTS +·清除率均高于BSA-ACN。
关键词:牛血清白蛋白;槲皮素;花青素;相互作用;纳米颗粒
牛血清白蛋白(bovine serum albumin,BSA)是牛血清中最主要的蛋白质,其来源丰富,价格便宜,在水中溶解性较好,容易纯化,具有较好的小分子物质结合特性 [1]。BSA是单链蛋白质,由583 个氨基酸残基组成,含3 个结构相似的结构域(domain Ⅰ、Ⅱ、Ⅲ),每个结构域包含2个亚结构域(ⅠA、ⅠB,ⅡA、ⅡB,ⅢA、ⅢB),它们聚集在一起形成了一个不对称的心形结构,心形结构的内部集中了所有的疏水性氨基酸,构成了疏水性内核和亲水性外壳,这使BSA与亲水性和疏水性小分子物质均可发生相互作用 [2-3]。
槲皮素(quercetin,QUE)和花青素(anthocyanin,ACN)广泛存在于水果、蔬菜和谷物中。QUE又称五羟基黄酮,在A、B和C 3 个芳香环骨架上的3、5、7、3’位和4’位上的氢原子被羟基取代(图1A)。由于槲皮素为平面型分子,分子堆砌较紧密,分子间引力较大,不易被溶剂或溶质分散,所以槲皮素的水溶性较差,在水中的溶解度约1 μg/mL,在模拟胃液中的溶解度为5.5 μg/mL,在模拟肠液中的溶解度为28.9 μg/mL [4-5];也不溶于乙醚、苯、氯仿、石油醚等;但可溶于冰醋酸、甲醇、乙醇、乙酸乙酯、吡啶、丙酮等溶剂 [6]。ACN属于水溶性多酚类化合物,它的基本结构为2-苯基苯并吡喃阳离子,根据3’位及5’位的取代基不同,可将ACN分为6 种:锦葵素类、牵牛素类、芍药素类、天竺葵素类、飞燕草素类和矢车菊素类 [7],其中矢车菊素-3-O-葡萄糖苷最常见 [8](图1B)。不同性质的小分子化合物与BSA的相互作用方式不同 [9]。如,在10%二甲基亚砜溶液中脂溶性的QUE对BSA的荧光有较强的猝灭作用,猝灭方式为静态与动态并存的复合方式,两者的相互作用力为疏水作用力和氢键;而在10%二甲基亚砜溶液中水溶性的莱菔硫烷对BSA的荧光也有较强的猝灭作用,猝灭方式为静态猝灭,两者的相互作用力为氢键、范德华力和疏水作用力 [10]。目前报道的BSA与小分子化合物相互作用的研究多为单一小分子或同性质的小分子进行比较;而对BSA与不同性质的小分子化合物相互作用的比较缺乏研究。因此,本研究以QUE(脂溶性)和ACN(水溶性)为代表,采用荧光光谱法,比较研究BSA与生物活性小分子相互作用方式;采用动态光散射法分析BSA与QUE及ACN纳米颗粒的颗粒特性,并比较了相互作用后形成的纳米颗粒的抗氧化活性。

图 1 槲皮素(A)和矢车菊素-3-O-葡萄糖苷(B)结构图
Fig. 1 Chemical structures of quercetin (A) and cyanidin-3-glucoside (B)
1.1 材料与试剂
BSA(fraction V,纯度≥98%,分子质量66.43 ku)美国Amresco公司;QUE(色谱级,纯度≥95%,相对分子质量302.24) 美国Sigma公司;笃斯越橘花青素提取物(以多酚为主要成分,约占提取物的65%~66%,提取物还含有糖11.7%、水分12.2%、蛋白质3.2%、灰分0.9%及油脂0.6%) 大兴安岭华野生物工程有限公司。笃斯越橘花青素提取物进一步经过XAD-7树脂柱分离纯化,得到纯化的ACN,其中80.94%为矢车菊素-3-O-葡萄糖苷。
二甲基亚砜(dimethyl sulfoxide,DMSO)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氨-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid),ABTS)二铵盐(均为分析纯)美国Sigma公司;去离子水(deionized water,dH 2O)北京科丰正业有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-1800型紫外-可见分光光度计 上海美普达仪器有限公司;F-7000型荧光分光光度计 日本Hitachi公司;Nano-ZS90型纳米粒度仪 英国Malvern Instruments公司;XB 220A型电子天平 瑞士Precisa Gravimetrics AG公司;QL-901型旋涡混合器 海门市其林贝尔仪器制造有限公司;PHS-3C +型酸度计 成都世纪方舟科技有限公司。
1.3 方法
1.3.1 BSA-QUE和BSA-ACN溶液的制备
用磷酸盐缓冲溶液(phosphate buffer saline,PBS,pH 7.4)配制浓度为1.5×10 -4mol/L的BSA储备液。用DMSO配制浓度为18×10 -3mol/L的QUE母液,再用DMSO稀释分别得到浓度为1.5×10 -3、3.0×10 -3、6.0×10 -3、9.0×10 -3、12.0×10 -3、15.0×10 -3mol/L的QUE储备液。用dH 2O配制浓度为18×10 -3mol/L的ACN母液(此处为了计算方便,统一使用笃斯越橘中含量最高的矢车菊素-3-O-葡萄糖苷的相对分子质量449.2作为ACN的近似相对分子质量进行处理),用dH 2O稀释分别得到浓度为1.5×10 -3、3.0×10 -3、6.0×10 -3、9.0×10 -3、12.0×10 -3、15.0×10 -3mol/L的ACN储备液。
BSA-QUE和BSA-ACN复合物溶液的制备:在15 mL离心管中先加入8.9 mL PBS(pH 7.4),其次加入1 mL BSA储备溶液,用旋涡混合器混1 min,最后分别加入0.1 mL不同浓度的QUE或ACN储备液,用旋涡混合器混5 min,室温条件下静置待测。其中BSA的终浓度为1.5× 10 -5mol/L;QUE或ACN的终浓度分别为0.0、1.5×10 -5、3.0×10 -5、6.0×10 -5、9.0×10 -5、12.0×10 -5、15.0×10 -5、18.0×10 -5mol/L;QUE或ACN与BSA浓度比分别为0、1∶1、2∶1、4∶1、6∶1、8∶1、10∶1和12∶1。
1.3.2 荧光光谱测定
按照1.3.1节方法分别配制BSA-QUE和BSA-ACN复合物溶液并测定其荧光光谱,其中BSA的终浓度是1.5× 10 -5mol/L,QUE及ACN的终浓度分别为0.0、1.5×10 -5、3.0×10 -5、6.0×10 -5、9.0×10 -5、12.0×10 -5、15.0×10 -5、18.0×10 -5mol/L。准确移取3.0 mL上述溶液于石英荧光池中(1 cm×1 cm),测定发射荧光光谱。激发波长为280 nm,发射波长为343 nm,狭缝分别为2 nm(激发)和5 nm(发射);控制溶液温度分别为25(298 K)、30(303 K)、35 ℃(308 K)。将荧光强度分别带入Stern-Volmer方程(1)和对数方程(2)计算猝灭常数K SV、结合常数K和结合位点数n [11-12]。
式中:F 0和F分别为QUE或ACN加入前后BSA的荧光强度;C为QUE或ACN的浓度/(mol/L);K SV为动态猝灭常数/(L/mol)。
根据热力学参数之间的关系式(3)和(4)计算BSA与QUE或ACN相互作用过程中的吉布斯自由能ΔG/(kJ/mol)、焓变ΔH/(kJ/mol)和熵变ΔS/(J/(mol·K)) [13]。

式中:K 1和K 2分别为对应温度条件下的结合常数/(L/mol);T 1和T 2分别为不同温度/K;R为理想气体常数8.314 J/(mol•K)。
1.3.3 结合量的测定
BSA与QUE及ACN的结合量的测定采用Fang Ru等 [14]的方法,通过盐析法使体系中BSA纳米颗粒沉淀析出,从而将结合在纳米颗粒中的 QUE及ACN和未结合的 QUE及ACN分开。制备BSA与QUE及ACN复合物,使QUE及ACN与BSA浓度比为0、2∶1、4∶1、6∶1、8∶1、10∶1、12∶1、14∶1、16∶1、18∶1、20∶1、22∶1、24∶1;BSA的终浓度为1.5×10 -5mol/L;QUE及ACN的终浓度分别是0、3×10 -5、6×10 -5、9×10 -5、12×10 -5、15×10 -5、18×10 -5、21×10 -5、24×10 -5、27×10 -5、30×10 -5、33×10 -5mol/L和36×10 -5mol/L。在配制的纳米颗粒溶液(10 mL)中,缓慢加入硫酸铵粉末并不断搅拌,直至体系中有未溶解的硫酸铵;静置20 min,然后取出上清液,4 ℃条件下,10 000×g离心30 min。取上清液,用紫外-可见分光光度法测定其吸光度,然后根据QUE及ACN的浓度与吸光度标准曲线计算出游离QUE及ACN的浓度。用总的QUE及ACN的浓度减去游离QUE及ACN的浓度可计算得到每摩尔BSA结合QUE或ACN的物质的量(mol QUE/mol BSA或mol ACN/mol BSA)。
1.3.4 粒径及ζ-电势测定
按照1.3.1节方法分别配制复合物BSA-QUE和BSAACN,其中BSA的终浓度是1.5×10 -5mol/L,QUE及ACN的终浓度为1.5×10 -4mol/L。测量温度25 ℃,平衡时间120 s,散射角90°,每个样品测3 次。实验数据通过马尔文仪器自带软件Zetasizer软件进行分析,得到粒径、多分散系数(polydispersity index,PdI)和ζ-电势。
1.3.5 自由基清除率的测定
在BSA的浓度为1.5×10 -5mol/L,QUE及ACN的浓度均为1.5×10 -4mol/L条件下,比较BSA、QUE、ACN、BSA-QUE及BSA-ACN对DPPH自由基和ABTS +·的清除率大小。
1.3.5.1 DPPH自由基清除率的测定
DPPH自由基清除率的检测参照Dong Xueyan等 [15]的方法。配制2.5 mmol/L DPPH的无水乙醇储备液,4 ℃避光保存备用。使用时再用无水乙醇稀释,制备0.15 mmol/L的DPPH工作液。取96 孔测试板,每孔依次加入样品溶液(15 μL)和0.05 mmol/L Tris-HCl (pH 7.4,60 μL)以及DPPH工作液(150 μL)(A sample)。以PBS加DPPH工作液为空白对照(A blank),同时用样品加无水乙醇溶液作为样品颜色参比(A control)。振荡混合均匀,避光室温条件下放置30 min后,用酶标仪测定520 nm波长处的吸光度。依据公式(5)计算DPPH自由基清除率。1.3.5.2 ABTS +·清除率的测定
ABTS +·的检测参照Dong Xueyan等 [15]的方法。配制140 mmol/L ABTS储存液,放在-20 ℃避光保存备用。使用时,再用dH 2O稀释,制备14 mmol/L的ABTS工作液。将ABTS工作液与4.9 mmol/L的过硫酸钾溶液充分混匀,使ABTS和过硫酸钾终浓度分别为7 mmol/L和2.45 mmol/L。避光室温条件下放置13 h。然后将其用dH 2O稀释至吸光度(630 nm波长处)为0.50左右。取96 孔测试板,每孔依次加入样品溶液(10 μL)和ABTS稀释液(90 μL)(A sample)。以PBS加ABTS工作液为空白对照(A blank),同时用样品加dH 2O作为样品颜色参比(A control)。振荡混合均匀,室温放置4 min后,用酶标仪测定630 nm波长处的吸光度。ABTS +·清除率也按照公式(5)进行。
1.4 数据统计分析
所有实验结果均为重复3 次平均所得,结果以
 表示。采用Minitab 17.1.0软件对实验数据进行单因素方差分析(One Way analysis of variance,One-WayANOVA),并进一步用Tukey多重比较确定各均数间的显著性差异,显著性差异水平设定为P<0.05。
表示。采用Minitab 17.1.0软件对实验数据进行单因素方差分析(One Way analysis of variance,One-WayANOVA),并进一步用Tukey多重比较确定各均数间的显著性差异,显著性差异水平设定为P<0.05。
2.1 BSA-QUE及BSA-ACN的荧光猝灭光谱

图 2 BSA-QUE(A)和BSA-ACN(B)的荧光光谱
Fig. 2 Effect of QUE (A) and ACN (B) on the fl uorescence emission spectrum of BSA
随着QUE浓度的增加,复合物溶液荧光强度逐渐降低,且荧光峰从343 nm移动到340 nm(图2A)。随着ACN浓度的增加,BSA的荧光强度也逐渐降低,且荧光峰的位置(343 nm)没有发生变化(图2B)。当QUE和ACN与BSA浓度比为12∶1时,QUE可以几乎完全猝灭复合物溶液的荧光,而ACN对复合物溶液的荧光猝灭程度小。复合物溶液荧光强度减少,表明QUE和ACN与BSA之间存在相互作用。BSA的荧光主要由其中的色氨酸和酪氨酸残基产生,酪氨酸和色氨酸的最大荧光发射波长分别为304 nm和340 nm。因为在304 nm处未见荧光峰,只在343 nm处测定到荧光发射波峰,故此处的荧光变化主要反映BSA中色氨酸残基的荧光变化 [16]。Xiao Jianbo等 [17]研究表明,小分子物质(槲皮素、槲皮苷、山柰酚、杨梅黄酮及高良姜素)对BSA荧光猝灭的程度越大,小分子越接近BSA的色氨酸残基。QUE较ACN对复合物溶液的荧光猝灭的程度较大,表明QUE较ACN更接近于BSA的色氨酸残基。
前期实验中发现DMSO溶剂含量为10%时,对BSA的荧光峰没有明显影响 [14]。本实验所有样品中DMSO的含量均为1%,对QUE与BSA相互作用的影响亦可以忽略。在激发波长为280 nm时,QUE和ACN在发射波长
290~420 nm范围内的荧光强度几乎为0 [18-19]。因此,采用BSA的激发波长280 nm作为体系的荧光激发波长。
2.2 BSA与QUE及ACN相互作用的荧光猝灭机理与结合常数

图 3 QUE(A)和ACN(B)对BSA的荧光猝灭曲线
Fig. 3 Fluorescence quenching curves of BSA by QUE (A) and ACN (B) based on Stern-Volmer equation
表 1 不同温度BSA-QUE和BSA-ACN的猝灭常数K
SV
Table 1 Quenching constants of BSA-QUE and BSA-ACN at different temperatures
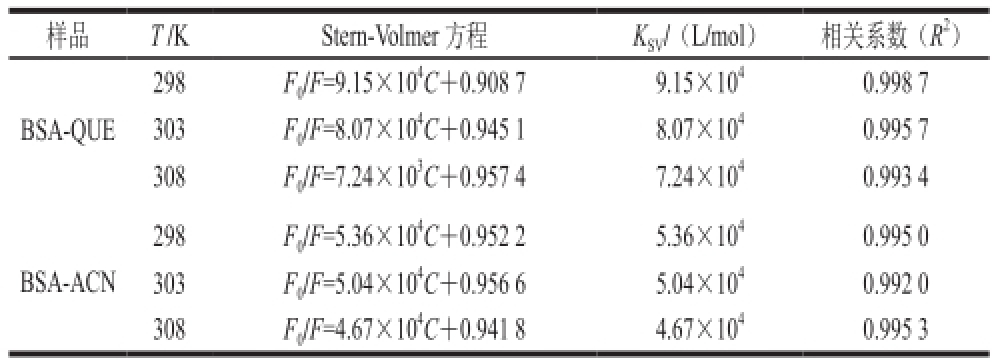
注:QUE与BSA的浓度比为0~6∶1;ACN与BSA的浓度比为0~12∶1。表2同。
样品T /KStern-Volmer 方程K SV/(L/mol)相关系数(R 2)BSA-QUE 298F 0/F=9.15×10 4C+0.908 79.15×10 40.998 7 303F 0/F=8.07×10 4C+0.945 18.07×10 40.995 7 308F 0/F=7.24×10 3C+0.957 47.24×10 40.993 4 298F 0/F=5.36×10 4C+0.952 25.36×10 40.995 0 303F 0/F=5.04×10 4C+0.956 65.04×10 40.992 0 308F 0/F=4.67×10 4C+0.941 84.67×10 40.995 3 BSA-ACN
根据QUE及ACN对BSA的荧光猝灭光谱,绘制猝灭曲线(图3)。选取猝灭曲线中呈线性相关部分的QUE和ACN的浓度计算得出猝灭常数(K SV)(表1)。由图3A可知,随着QUE浓度的增加(0.0~9.0×10 -5mol/L),F 0/F逐渐变大,且呈线性关系;当QUE浓度继续增加(9.0×10 -5~18.0×10 -5mol/L)时,F 0/F增加速率变快,猝灭曲线逐渐向Y轴倾斜。由图3B可知,随着ACN浓度的增加(0.0~18.0×10 -5mol/L),F 0/F逐渐变大,且呈线性关系。当QUE和ACN的浓度分别为0.0~9.0×10 -5mol/L和0.0~18.0×10 -5mol/L时,猝灭常数K SV随温度的升高而减小,且BSA-QUE的猝灭常数大于BSA-ACN的猝灭常数。
静态猝灭和动态猝灭是BSA和小分子相互作用常见的荧光猝灭方式。小分子导致BSA由激发态返回到基态,不发射光子,为动态猝灭过程。随着体系温度升高,动态猝灭效应增强 [20]。小分子与BSA在基态时生成不发光的配合物,从而导致荧光强度降低的过程为静态猝灭过程。猝灭常数K SV表示成双分子猝灭和与单分子衰变的速率常数,其大小反映了猝灭剂对荧光分子的接触程度和反应速率 [21]。通过不同温度条件下的猝灭常数变化,可以区分出动态和静态猝灭方式。动态猝灭与扩散系数有关,随着温度升高扩散系数增大,荧光猝灭程度增大,猝灭常数增大。静态猝灭源于相对稳定的复合物,温度升高可能引起复合物的稳定性下降,使荧光猝灭程度降低,猝灭常数减小。结果表明,当QUE和ACN的浓度分别为0.0~9.0×10 -5mol/L和0.0~18.0× 10 -5mol/L时,QUE及ACN对BSA的荧光猝灭属于静态猝灭,即分别形成了BSA-QUE和BSA-ACN复合物,且随着温度的升高(298~308 K),BSA-QUE比BSA-ACN更稳定。当QUE的浓度大于9.0×10 -5mol/L时,QUE对BSA的荧光猝灭方式是静态和动态猝灭并存,而不是单一的静态猝灭方式。总之,QUE与BSA相互作用在低浓度时主要是通过静态猝灭的方式,而随着浓度的增加,出现动态猝灭的方式;而ACN与BSA相互作用主要是通过静态猝灭的方式,且不随着ACN浓度的增加而改变。
表 2 不同温度BSA-QUE和BSA-ACN的结合常数K及结合位点数n
Table 2 Binding constants (K) and binding sites (n)of BSA-QUE and BSA-ACN at different temperatures
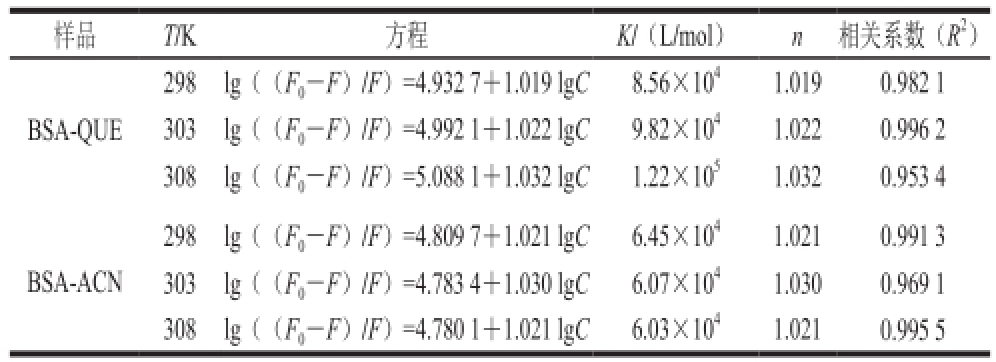
样品T/K方程K/(L/mol)n相关系数(R 2)BSA-QUE 298lg((F 0-F)/F)=4.932 7+1.019 lgC8.56×10 41.0190.982 1 303lg((F 0-F)/F)=4.992 1+1.022 lgC9.82×10 41.0220.996 2 308lg((F 0-F)/F)=5.088 1+1.032 lgC1.22×10 51.0320.953 4 BSA-ACN 298lg((F 0-F)/F)=4.809 7+1.021 lgC6.45×10 41.0210.991 3 303lg((F 0-F)/F)=4.783 4+1.030 lgC6.07×10 41.0300.969 1 308lg((F 0-F)/F)=4.780 1+1.021 lgC6.03×10 41.0210.995 5
对于静态猝灭方式,不同温度条件下的结合常数K和结合位点数n都可以根据lg((F 0-F)/F)-lgC计算出来,结果见表2。在温度为298、303 K和308 K时,BSA与QUE的结合常数分别为8.56×10 4、9.82×10 4L/mol和1.22×10 5L/mol,结合位点数均接近于1;BSA与ACN的结合常数分别为6.45×10 4,6.07×10 4L/mol和6.03× 10 4L/mol,结合位点数均接近于1。随着温度的升高,BSA与QUE的结合常数随着温度的升高而增大,而BSA与ACN的结合常数随着温度的升高而减小,且BSA与QUE之间的结合常数大于BSA-ACN之间的结合常数。BSA与QUE及ACN的结合位点数几乎是不受温度变化的影响。结果表明BSA和QUE及ACN之间有很强的结合力,形成了一个结合位点,且BSA与QUE之间的结合力大于BSA与ACN之间的结合力。Tang Lin等 [18]报道,在Tris-HCl(pH 7.4)中,BSA和ACN相互作用的结合位点为BSA亚结构域ⅡA中的第一个结合位点。此外,由于结合常数及结合位点数只能在静态猝灭的前提下计算,需要选取猝灭曲线中呈线性相关部分的QUE和ACN的浓度进行计算,所以采用的QUE和ACN的浓度比不一致。
2.3 BSA与QUE及ACN相互作用的热力学参数和作用力
表 3 不同温度BSA-QUE和BSA-ACN结合的热力学参数
Table 3 Thermodynamic constants of BSA-QUE and BSA-ACN at different temperatures

样品T/KΔH /(kJ/mol)ΔS/(J/(mol·K))ΔG/(kJ/mol)298 BSA-QUE 186.31-28.14 303185.93-28.95 308186.30-30.00 27.38 298 BSA-ACN 74.76-27.44 30374.55-27.75 30874.76-28.18-5.16
根据热力学参数之间的关系式可以计算得到相互作用的焓变ΔH、熵变ΔS和吉布斯自由能变ΔG,结果见表3。BSA与QUE相互作用的ΔH>0,而BSA与ACN的ΔH<0。QUE和ACN与BSA相互作用,它们的热力学参数均为ΔS>0和ΔG<0。蛋白质与小分子间的相互作用可能是通过范德华力、疏水力、静电吸引力或氢键等 [22]。根据ΔH和ΔS可以推断出小分子与蛋白质之间相互作用的方式:当ΔS和ΔH都大于0时,为疏水作用力;当ΔS和ΔH都小于0时,为氢键和范德华力;当ΔS>0,ΔH<0时,主要为静电作用 [23]。由此可以推知,BSA与QUE间疏水作用力起主要作用力,而BSA与ACN间静电作用力起主要作用。
BSA与小分子(QUE或ACN)的结合是一个自由能降低的自发过程(ΔG<0)。ΔG绝对值越大,结合作用越强 [24],即BSA与QUE的结合作用强于BSA与ACN的结合作用,该结果与结合常数所得结论一致。前期研究报道,在10% DMSO溶液中,BSA与QUE的相互作用力为疏水作用力 [25];在0.1 mol/L的NaCl缓冲液(pH 7.4)中,BSA与ACN的相互作用力主要是静电引力 [26],都与本实验结果一致。但也有实验表明,在dH 2O、NaCl和PBS 3 种溶液中,BSA与ACN分子间的相互作用力为氢键和范德华力 [27]。这与本实验结果不一致,可能是由于荧光测定方法和计算不同所致。
2.4 BSA与QUE及ACN相互作用结合量

图 4 BSA对QUE及ACN的结合量
Fig. 4 Binding capacity of BSA with QUE or ACN
随着QUE与BSA的浓度比由0增加到10∶1,与BSA结合的QUE也逐渐增加;当QUE与BSA的浓度比达到10∶1时,即体系中QUE的浓度达到1.5×10 -4mol/L时,BSA对QUE的结合达到了饱和。1 mol BSA可结合8 mol QUE。随着ACN与BSA的浓度比由0增加到20∶1,与BSA结合的ACN也逐渐增加;当ACN与BSA的浓度比达到20∶1时,即体系中ACN的浓度达到3.0×10 -4mol/L时,BSA对ACN的结合达到了饱和。1 mol BSA可结合10 mol ACN(图4)。BSA与ACN的结合量高于BSA与QUE的结合量。
董学艳 [10]报道,在dH 2O和10% DMSO中,当QUE与BSA的浓度比分别达到20∶1和14∶1时,即体系中QUE的浓度分别达到3.0×10 -4mol/L和2.1×10 -4mol/L时,BSA对QUE的结合达到了饱和。在dH 2O体系中,1 mol BSA分子上结合的QUE量为17 mol;在10% DMSO体系中,1 mol BSA分子上结合的QUE量为6 mol。DMSO中的S=O基团具有较强的氧化性,可能会破坏BSA的二级结构α-螺旋中的氢键,使得内部的疏水基团暴露,导致BSA分子疏水聚集,结果使得BSA结合QUE的面积减少、结合QUE的量相应减少。为了更直观地比较BSA-QUE和BSA-ACN相互作用及形成纳米颗粒的特征,在后面的实验中QUE及ACN与BSA的浓度比设置为10∶1。
虽然通过计算得到的BSA与QUE及ACN的结合位点数均接近于1,但实际测得1 mol BSA可分别结合8 mol QUE或10 mol ACN。这是可能是由于通过模型计算,只能得到高亲结合力的结合位点数 [28],因此有一定的局限性。理论计算得到的位点可能反映的只是主要结合区域,故可以有多个小分子聚集。
2.5 BSA-QUE和BSA-ACN粒径和ζ-电势的比较
表 4 BSA-QUE和BSA-ACN纳米颗粒的粒径、多分散系数和ζ-电势
Table 4 Particle sizes, polydispersity index and ζ-potential of BSA-QUE and BSA-ACN nanoparticles

注:同列肩标小写字母不同表示差异显著(P<0.5)。下同。
样品粒径/nmPdIζ-电势/mV BSA24.7±1.3 a0.174±0.012 a-22.57±0.56 aBSA-QUE42.5±2.3 b0.107±0.010 b-25.64±0.18 bBSA-ACN53.7±0.7 c0.185±0.007 ac-21.50±0.31 ac
由表4可知,BSA、BSA-QUE和BSA-ACN的平均粒径分别为24.7、42.5 nm和53.7 nm。BSA、BSA-QUE和BSA-ACN的多分散系数(PdI)分别为0.174、0.107和0.185。粒径大小不一可能是由于BSA和QUE及ACN的相互作用力大小不同,当温度为25 ℃时,BSA和QUE的相互作用力大于和ACN的相互作用力,所以BSA-QUE粒径较小。
在PBS(pH 7.4)中,BSA、BSA-QUE和BSA-ACN的ζ-电势分别为-22.57、-25.64 mV和-21.50 mV。BSA-QUE较BSA的ζ-电势减小,BSA-ACN较BSA的ζ-电势变大。颗粒的ζ-电势对于颗粒的稳定性非常重要,当颗粒的ζ-电势绝对值大于30 mV时,表明颗粒很稳定,当颗粒的ζ-电势绝对值小于20 mV时,表明颗粒更易聚集 [29]。BSA-QUE的ζ-电势比BSA-ACN的更接近于-30 mV,因此BSA-QUE纳米颗粒更稳定,该结果和相互作用力及粒径结果相一致。
2.6 BSA对QUE及ACN抗氧化活性的影响
表 5 BSA-QUE和BSA-ACN纳米颗粒的DPPH自由基和ABTS
+·清除率
Table 5 DPPH and ABTS radical scavenging rates of BSA-QUE and BSA-ACN nanoparticles
%

样品DPPH自由基清除率ABTS +·清除率BSA12.4±1.4 a31.0±0.6 aQUE45.8±0.4 b78.6±0.5 bBSA-QUE53.1±0.8 c85.0±2.4 bcACN22.5±0.3 d45.4±0.2 dBSA-ACN25.0±0.2 de58.5±0.2 e
当QUE的浓度为1.5×10 -4mol/L时,QUE和BSAQUE的DPPH自由基清除率分别为45.8%和53.1%;ABTS +·清除率分别为78.6%和85.0%。当ACN的浓度为1.5×10 -4mol/L时,ACN和BSA-ACN的DPPH自由基的清除率分别为22.5%和25.0%,ABTS +·的清除率分别为45.4%和58.5%(表5)。BSA-QUE及BSA-ACN的自由基清除率均小于单独QUE及ACN的自由基清除率与BSA的自由基清除率的理论加和计算值,且QUE和BSA-QUE的自由基清除率均高于ACN和BSA-ACN的自由基清除率。
QUE和ACN均具有较好DPPH自由基和ABTS +·清除作用。它们的抗氧化作用主要与其结构中的酚羟基有关。QUE的抗氧化作用主要来自其A环上的5-OH和7-OH以及B环上的3’-OH和5’-OH的贡献;ACN的抗氧化作用主要来自其A环上的5-OH的贡献 [30-31]。早期研究表明,BSA可以与QUE的A环上5-OH形成分子间氢键 [14]。BSA与QUE或ACN的酚羟基形成氢键,会导致抗氧化基团的屏蔽,从而不同程度减弱QUE及ACN的自由基清除能力。
QUE和ACN对BSA均有较强的荧光猝灭作用,但两者的猝灭程度和猝灭方式有所不同。QUE对BSA的荧光猝灭程度大于ACN对BSA的。QUE对BSA的荧光猝灭在低浓度时为静态猝灭方式,在高浓度时为静态与动态并存的复合猝灭方式;而ACN对BSA的荧光猝灭为静态猝灭方式。BSA与QUE的相互作用力为疏水作用力,而与ACN的相互作用力则为静电作用力;且BSA与QUE的结合力大于BSA与ACN的;QUE与BSA的结合量小于ACN与BSA的。BSA与QUE形成的纳米颗粒粒径较BSA与ACN的小,且稳定性较高。BSA-QUE对DPPH自由基和ABTS +·的清除率均高于BSA-ACN。
参考文献:
[1] ELZOGHBY A O, SAMY W M, ELGINDY N A. Albumin-based nanoparticles as potential controlled release drug delivery systems[J]. Journal of Controlled Release, 2012, 157(2): 168-182. DOI:10.1016/ j.jconrel.2011.07.031.
[2] PETERS T. All about albumin: biochemistry, genetics, and medical applications[M]. San Diego: Academic Press, 1996: 9-34.
[3] CARTER D C, HO J X. Structure of serum albumin[J]. Advances in Protein Chemistry, 1994, 45: 153-203. DOI:10.1016/S0065-3233(08)60640-3.
[4] CAI X, FANG Z, DOU J, et al. Bioavailability of quercetin: problems and promises[J]. Current Medicinal Chemistry, 2013, 20(20): 2572-2582. DOI:10.2174/09298673113209990120.
[5] MANACH C, WILLIAMSON G, MORAND C, et al. Bioavailability and bioefficacy of polyphenols in humans. I. review of 97 bioavailability studies[J]. The American Journal of Clinical Nutrition, 2005, 81(Suppl 1): 230-242.
[6] 李素云, 李峥, 李敬来, 等. 槲皮素及其糖苷衍生物的研究进展[J]. 解放军药学学报, 2011, 27(6): 540-543. DOI:10.3969/ j.issn.1008-9926.2011.06.024.
[7] FENNEMA O R. Food chemistry[M]. 王璋, 许时婴, 江波, 等译. 3版.北京: 中国轻工业出版社, 2003: 569-570.
[8] ZHENG N, BUCHELI P, JING H. Effects of casein- and whey protein-dextran conjugates on the stability of bog bilberry anthocyanin extract[J]. International Journal of Food Science and Technology, 2009, 44(7): 1452-1458. DOI:10.1111/j.1365-2621.2009.01979.x.
[9] PAPADOPOULOU A, GREEN R J, FRAZIER R A. Interaction of flavonoids with bovine serum albumin: a fluorescence quenching study[J]. Journal of Agricultural and Food Chemistry, 2005, 53(1): 158-163. DOI:10.1021/jf048693g.
[10] 董学艳. 牛血清白蛋白与槲皮素和莱菔硫烷相互作用模式及纳米颗粒形成的比较研究[D]. 北京: 中国农业大学, 2014: 56-57.
[11] van de WEERT M. Fluorescence quenching to study protein-ligand binding: common errors[J]. Journal of Fluorescence, 2010, 20(2): 625-629. DOI:10.1007/s10895-009-0572-x.
[12] GONG A, ZHU X, HU Y, et al. A f l uorescence spectroscopic study of the interaction between epristeride and bovin serum albumine and its analytical application[J]. Talanta, 2007, 73(4): 668-673. DOI:10.1016/ j.talanta.2007.04.041.
[13] YE J, FAN F, XU X, et al. Interactions of black and green tea polyphenols with whole milk[J]. Food Research International, 2013, 53(1): 449-455. DOI:10.1016/j.foodres.2013.05.033.
[14] FANG R, JING H, CHAI Z, et al. Design and characterization of protein-quercetin bioactive nanoparticles[J]. Journal of Nanobiotechnology, 2011, 9: 19. DOI:10.1186/1477-3155-9-19.
[15] DONG X, ZHOU R, JING H. Characterization and antioxidant activity of bovine serum albumin and sulforaphane complex in different solvent systems[J]. Journal of Luminescence, 2014, 146: 351-357. DOI:10.1016/j.jlumin.2013.09.078.
[16] 肖建波. 多酚类化合物与血清白蛋白相互作用的结构—结合力关系、理论模型和应用研究[D]. 长沙: 中南大学, 2009: 82.
[17] XIAO J, SUZUKI M, JIANG X, et al. Influence of B-ring hydroxylation on interactions of flavonols with bovine serum albumin[J]. Journal of Agricultural and Food Chemistry, 2008, 56(7): 2350-2356. DOI:10.1021/jf7037295.
[18] TANG L, ZHANG D, XU S, et al. Different spectroscopic and molecular modeling studies on the interaction between cyanidin-3-O-glucoside and bovine serum albumin[J]. Luminescence, 2014, 29(2): 168-175. DOI:10.1002/bio.2524.
[19] PINTO M D C, DUQUE A L, MACÍAS P. Fluorescence quenching study on the interaction between quercetin and lipoxygenase[J]. Journal of Fluorescence, 2011, 21(3): 1311-1318. DOI:10.1007/ s10895-010-0816-9.
[20] CHEN C, MA M, ZHANG J, et al. Spectroscopic investigation of the interaction of bovine serum albumin with a novel cardiac agent V-09[J]. Journal of Spectroscopy, 2008, 22(1): 43-50. DOI:10.3233/SPE-2008-0341.
[21] QIN K, LIU C. Investigation of the interaction between baicalin and human serum albumin by a spectroscopic method and molecular modeling[J]. Journal of Chemical and Pharmaceutical Research, 2014, 6(7): 24-30.
[22] SHAHABADI N, MAGHSUDI M, ROUHANI S. Study on the interaction of food colourant quinoline yellow with bovine serum albumin by spectroscopic techniques[J]. Food Chemistry, 2012, 135(3): 1836-1841. DOI:10.1016/j.foodchem.2012.06.095.
[23] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102. DOI:10.1021/bi00514a017.
[24] BOLEL P, MAHAPATRA N, HALDER M. Optical spectroscopic exploration of binding of cochineal red A with two homologous serum albumins[J]. Journal of Agricultural and Food Chemistry, 2012, 60(14): 3727-3734. DOI:10.1021/jf205219w.
[25] FANG R, JING H, CHAI Z, et al. Study of the physicochemical properties of the BSA: flavonoid nanoparticle[J]. European Food Research and Technology, 2011, 233(2): 275-283. DOI:10.1007/ s00217-011-1522-9.
[26] 姚惠芳, 景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学, 2013, 34(23): 6-10. DOI:10.7506/spkx1002-6630-201323002. [27] 周瑞, 董学艳, 景浩. 不同溶液中牛血清白蛋白与花青素相互作用特征及抗氧化性[J]. 食品科学, 2013, 34(15): 11-16. DOI:10.7506/ spkx1002-6630-201315003.
[28] 姚惠芳. 牛血清白蛋白与花青素相互作用机理及其自组装形成纳米颗粒的特性研究[D]. 北京: 中国农业大学, 2013: 29.
[29] WU L, ZHANG J, WATANABE W. Physical and chemical stability of drug nanoparticles[J]. Advanced Drug Delivery Reviews, 2011, 63(6): 456-469. DOI:10.1016/j.addr.2011.02.001.
[30] TSUDA T. Dietary anthocyanin-rich plants: biochemical basis and recent progress in health benefits studies[J]. Molecular Nutrition & Food Research, 2012, 56(1): 159-170. DOI:10.1002/mnfr.201100526.
[31] MUSIALIK M, KUZMICZ R, PAWLOWSKI T S, et al. Acidity of hydroxyl groups: an overlooked in fl uence on antiradical properties of fl avonoids[J]. Journal of Organic Chemistry, 2009, 74(7): 2699-2709. DOI:10.1021/jo802716v.
Interaction Modes and Nanoparticle Characteristics of Bovine Serum Albumin with Quercetin and Anthocyanin
LIU Jianlei, XING Xiaojuan, ZHOU Rui, JING Hao
*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:The interaction modes and nanoparticle characteristics of bovine serum albumin (BSA) with quercetin (QUE) and anthocyanin (ACN) were comparatively investigated. The f l uorescence of BSA was greatly quenched by QUE in both static (at low concentration) and dynamic (at high concentration) modes, while f l uorescence quenching of BSA by ACN was just in a static mode. The binding constant of BSA with QUE was higher than that with ACN. BSA interacted with QUE and ACN by hydrophobic force and electrostatic force, respectively, to form BSA-QUE and BSA-ACN nanoparticles. The average diameters of BSA-QUE and BSA-ACN were 42.5 nm and 53.7 nm, respectively. The ζ-potentials of BSA-QUE and BSA-ACN were −25.64 and −21.50 mV, respectively. One mole of BSA could combine 8 moles of QUE or 10 moles of ACN. BSA-QUE nanoparticles were smaller and more stable than BSA-ACN nanoparticles. The DPPH and ABTS radical scavenging rates of BSA-QUE were higher than those of BSA-ACN.
Key words:bovine serum albumin (BSA); quercetin (QUE); anthocyanin (ACN); interaction; nanoparticle
DOI:10.7506/spkx1002-6630-201705002
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)05-0007-07
引文格式:
刘建垒, 邢效娟, 周瑞, 等. 牛血清白蛋白与槲皮素及花青素相互作用方式及其纳米颗粒特征的比较[J]. 食品科学, 2017, 38(5): 7-13. DOI:10.7506/spkx1002-6630-201705002. http://www.spkx.net.cn
LIU Jianlei, XING Xiaojuan, ZHOU Rui, et al. Interaction modes and nanoparticle characteristics of bovine serum albumin with quercetin and anthocyanin[J]. Food Science, 2017, 38(5): 7-13. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201705002. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:国家自然科学基金面上项目(31171676)
作者简介:刘建垒(1987—),男,博士研究生,研究方向为蛋白与小分子相互作用。E-mail:liujianlei@cau.edu.cn
*通信作者:景浩(1957—),男,教授,博士,研究方向为蛋白与小分子相互作用。E-mail:haojing@cau.edu.cn