
图 1 不同成熟度甘蓝照片
Fig. 1 Pictures of cabbage at different maturity stages
阚茗铭 1,叶发银 1,赵国华 1,2,*,
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400175)
摘 要:研究成熟度(成熟度A~D分别为最早成熟期采摘样品及每隔5 d采摘的样品)对甘蓝膳食纤维含量、单糖组成及抗氧化活性的影响。结果表明,随着甘蓝的成熟,可溶性膳食纤维(soluble dietary fi ber,SDF)含量逐渐降低,非水溶性膳食纤维(insoluble dietary fi ber,IDF)和总膳食纤维(total dietary fi ber,TDF)含量则先增加后降低。不同成熟度甘蓝膳食纤维单糖组成均为葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、鼠李糖、阿拉伯糖,但各单糖的相对含量对成熟度差异显著。随着成熟度增加,组成甘蓝SDF的单糖中,葡萄糖醛酸含量持续降低;葡萄糖与半乳糖含量显著增加;半乳糖醛酸、鼠李糖和阿拉伯糖含量变化呈抛物线,且在成熟度B时达到最高。随着甘蓝的成熟,甘蓝IDF的葡萄糖醛酸和半乳糖醛酸含量显著增加;葡萄糖和半乳糖含量在前期无变化,从成熟度D开始显著降低;阿拉伯糖含量变化呈抛物线,并在成熟度D达到最高;而鼠李糖含量始终保持恒定。随着甘蓝的成熟,其SDF与IDF的1,1-二苯基-2-三硝基苯肼自由基清除能力和三价铁还原抗氧化能力增强,而2,2’-联氮-二(3-乙基苯并噻唑啉-6-磺酸)自由基清除能力在成熟度C达到最强。
关键词:甘蓝;成熟度;膳食纤维;组分分析;抗氧化活性
甘蓝(Brassica oleracea L.),为十字花科芸苔属的一年生或两年生草本植物,是我国重要蔬菜之一,是世界卫生组织推荐的最佳蔬菜之一,被誉为天然“胃菜”。甘蓝含有大量的膳食纤维,包括可溶性膳食纤维(soluble dietary fiber,SDF)和非水溶性膳食纤维(insoluble dietary fiber,IDF),是膳食纤维的重要来源 [1-3]。有研究报道,可溶性膳食纤维可以降低血液中的脂质和葡萄糖含量,可预防糖尿病 [4-5];而IDF能增加粪便膨胀性,降低便秘的可能性 [6]。将白菜膳食纤维添加到志愿者的饮食中3 周后,志愿者的排便量平均增加了69%,消化时间则缩短了20%,更易产生饱腹感,有利于防治肥胖 [7-8]。非水溶性膳食纤维中还含有植酸、阿魏酸等其他生物活性物质,其对有害物质有较强的清除和吸附能力,能降低结肠癌的发病率 [9-10]。研究表明,甘蓝膳食纤维能发挥抗氧化 [1]、抗癌 [11]等功能活性。然而品种、成熟度、生长环境、贮存条件、研究方法等的不同,对膳食纤维的物理化学性质有很大的影响。前期研究表明,成熟度对甘蓝色泽、VC、多酚、氧化酶活性等理化性质均有显著的影响 [12-13]。但有关于不同成熟度的甘蓝中膳食纤维组成及其抗氧化活性变化的研究鲜见报道。合适的成熟度对甘蓝的质量控制与合理采收提供参考依据,对赋予甘蓝产品良好的品质、增加经济效益具有重要意义。本研究对不同成熟度甘蓝膳食纤维的含量、单糖组成及抗氧化活性进行了详细地研究,以期揭示不同成熟度甘蓝膳食纤维的含量、单糖组成及抗氧化活性的变化趋势,为甘蓝的开发利用提供理论依据和数据支持,为甘蓝膳食纤维类物质的形成、积累和转化及其动态变化跟踪研究提供基础参考。
1.1 材料与试剂
甘蓝(品种:京丰一号),采自重庆市北碚区歇马镇。甘蓝播种期为2013年10月20日,定植期为2013年12月2日,成熟期为2014年4月21日,每隔5 d采一次样,采样时间为早上7:00—8:00,田间随机采样,以不同采收期代表样品的成熟度(A~E),如图1所示。

图 1 不同成熟度甘蓝照片
Fig. 1 Pictures of cabbage at different maturity stages
样品采摘后马上用液氮冷冻,并冷冻干燥、粉碎、过30 目筛,即得到样品粉末,置于装有除氧剂的干燥器中,在室温避光条件下保存备用。
胃蛋白酶(>250 U/mg)、胰酶(8×USP)、α-淀粉酶、葡萄糖醛酸(标准品)、半乳糖醛酸(标准品)、葡萄糖(标准品)、半乳糖(标准品)、鼠李糖(标准品)、阿拉伯糖(标准品)、抗氧化标准物6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox,试剂级)、2,2’-联氮-二(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS,试剂级)、2,4,6-三(2’-吡啶基)-1,3,5-三嗪(2,4,6-tris(2’-pyridyl)-1,3,5-triazine,TPTZ,试剂级) 美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH,试剂级)日本WAKO公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JP-500B型高速粉碎机 浙江久品商贸有限公司;HWS-26恒温水浴锅 上海齐欣科学仪器有限公司;ALPHA1-4 LSC冷冻干燥机 河南兄弟仪器设备有限公司;PB-10标准型电化学分析仪/PH计(酸度计)德国赛多利斯公司;RE-5296旋转蒸发器 上海亚荣生化仪器厂;722可见分光光度计 北京金科利达电子科技有限公司;LC-20A高效液相色谱仪(紫外/荧光检测器) 日本岛津公司;5810型台式高速离心机德国Eppendorf公司。
1.3 方法
1.3.1 膳食纤维含量与组成的测定
具体操作参考Asp等 [14]的方法,使用快速酶法提取SDF、IDF,并测定SDF、IDF和总膳食纤维(total dietary fi ber,TDF)含量。
1.3.2 膳食纤维单糖组成的测定
参考Qi Jing等 [15]的方法,准确称取5 mg 1.3.1节中提取的SDF与IDF粉末,置于安培瓶中,加入0.125 mL 72%的浓硫酸,再加入1.35 mL超纯水,将安培瓶密封,于105 ℃烘箱中水解3~5 h,水解液按一定比例稀释后即可进行高效液相色谱仪(荧光检测器)分析。色谱条件:色谱柱(Aminex HPX-87H Column 300×7.8 mm,9 μm),柱温65 ℃,0.05 mmol/L稀硫酸洗脱,洗脱流速0.6 mL/min,进样量10 μL。通过样品与标准品物质进行比对进行定性分析,采用外标法进行定量分析。
1.3.3 抗氧化活性的测定
1.3.3.1 DPPH自由基清除率测定
参照von Gadow等 [16]的方法,准确称取20.0 mg膳食纤维粉末放入10 mL的试管中,然后加入3.5 mL DPPH-甲醇溶液(6×10 -5mol/L)。混合物在室温条件下避光反应25 min,且分别在0、10、20 min时漩涡振荡3 min,然后以8 000 r/min离心5 min,取上清液于517 nm波长处测定吸光度A s。同时,测定空白样吸光度A b。以DPPH自由基的清除率为纵坐标,不同浓度的标准Trolox溶液(μmol/L)为横坐标绘制标准曲线,DPPH自由基的清除率能力结果表示为:μmol TE/100 g(以干基计,后同),其值越大抗氧化活性越强。DPPH自由基的清除率按式(1)计算。
1.3.3.2 三价铁还原抗氧化能力测定
参照Benzie等 [17]的方法,将2.5 mL FeCl 3·6H 2O溶液(20 mmol/L)、2.5 mL TPTZ溶液(10 mmol/L,用40 mmol/L盐酸配制)和25 mL醋酸缓冲液(300 mmol/L、pH 3.6)混合均匀,得到三价铁还原抗氧化能力(ferricreducing antioxidant power,FRAP)工作液。准确称取20.0 mg用微晶纤维素粉进行固体稀释后的甘蓝膳食纤维粉末,加入10 mL的试管中,再加入3.5 mL FRAP工作液,混合均匀后在37 ℃水浴反应5 min。取出后8 000 r/min离心5 min,取上清液于593 nm波长处测定吸光度A s。同时测定空白样品吸光度A b,按1.3.3.1节中式(1)计算样品FRAP值。所有溶液必须现配现用。以不同浓度的FeSO 4·7H 2O-盐酸水溶液重复以上操作,以FRAP值为纵坐标,以标准FeSO 4·7H 2O溶液浓度(μmol/L)为横坐标,绘制标准曲线,结果表示为:μmol FE/100 g。
1.3.3.3 ABTS法测定
参照Nenadis等 [18]的方法,将5 mL 7 mmol/L的ABTS水溶液和88 μL 140 mmol/L K 2S 2O 8溶液按比例加入棕色容量瓶中,混匀。将混合液在室温条件下避光保存16 h,反应生成ABTS +·。将该ABTS +·溶液用pH 7.4的磷酸盐缓冲液进一步稀释,使其在30 ℃条件下,734 nm波长处的吸光度保持在0.70±0.05,以此溶液为ABTS +·工作液。准确称取20.0 mg用微晶纤维素粉进行固体稀释后的甘蓝膳食纤维混合粉末放入10 mL试管中,再加入3.5 mL ABTS +·工作液,混合均匀后在30 ℃水浴反应3 min,于8 000 r/min离心3 min。收集上清液,于734 nm波长处测定其吸光度A s,同时测定空白样品的吸光度A b,按1.3.3.1节中式(1)计算样品对ABTS +·清除率。以不同浓度的标准Trolox溶液重复以上操作,以ABTS +·的清除率(%)为纵坐标,以标准Trolox溶液浓度(μmol/L)为横坐标,绘制标准曲线,结果表示为:μmol TE/100 g。
1.4 数据处理
所有实验进行3 次重复测定,测定结果以
 表示,显著性差异用多重比较法中的标记字母法表示,用SPSS 19.0.0软件进行数据分析,显著性水平为P<0.05。
表示,显著性差异用多重比较法中的标记字母法表示,用SPSS 19.0.0软件进行数据分析,显著性水平为P<0.05。
2.1 成熟度对甘蓝膳食纤维组成的影响
表 1 不同成熟度甘蓝膳食纤维的组成
Table 1 Dietary fi ber composition of cabbage at different maturity stages g/100 g

注:同列肩标小写字母不同代表差异显著(P<0.05)。A~E分别代表与图1对应的成熟度,下同。
成熟度SDF含量IDF含量TDF含量A25.76±0.82 a29.20±0.85 b54.96±1.61 bB25.26±1.00 a33.87±1.01 a59.13±1.95 aC22.89±0.67 b29.60±0.61 c52.48±1.15 cD20.35±1.14 c27.29±0.73 d47.64±1.60 dE18.31±0.98 d27.09±0.53 d45.40±0.85 e
表1显示了不同成熟度甘蓝中膳食纤维组分含量的变化。可以看出,甘蓝中TDF约占其干物质含量的一半,是膳食纤维的重要来源。甘蓝SDF含量约为18~26 g/100 g,IDF含量约为27~34 g/100 g,且不同成熟度甘蓝IDF含量均高于SDF含量。从表1还可以看出,随着成熟度的增加,甘蓝SDF含量在前两个成熟度没有显著变化(P>0.05),从成熟度C开始SDF含量显著降低(P<0.05),这与Dikeman等 [19]的研究成果一致。SDF主要为植物细胞内的贮存物和分泌物,其在生长过程中会转化为其他功能性物质,可能导致甘蓝SDF含量降低 [20]。而随着甘蓝生长,IDF含量呈现先增加后降低,到成熟度B时甘蓝IDF含量达到最高,但从成熟度D开始IDF含量没有显著变化(P>0.05)。因此,对甘蓝生长初期的良好管理,有利于IDF含量的增加 [21]。IDF主要是由植物细胞壁中的成分组成,其在成熟度B时含量达到最大,可能是此时甘蓝细胞壁已完全形成,新生成的细胞壁状态最好,细胞酶活性也达到最大 [22]。甘蓝TDF随着成熟度的增加变化趋势跟IDF变化趋势一样,这与Zhang Xian等 [23]的研究成果一致。在生产中可根据具体需要选择对应成熟度的甘蓝,例如开发高膳食纤维含量甘蓝汁,则可选择成熟度B的甘蓝,不需要等甘蓝完全成熟。
2.2 成熟度对甘蓝膳食纤维单糖组成的影响
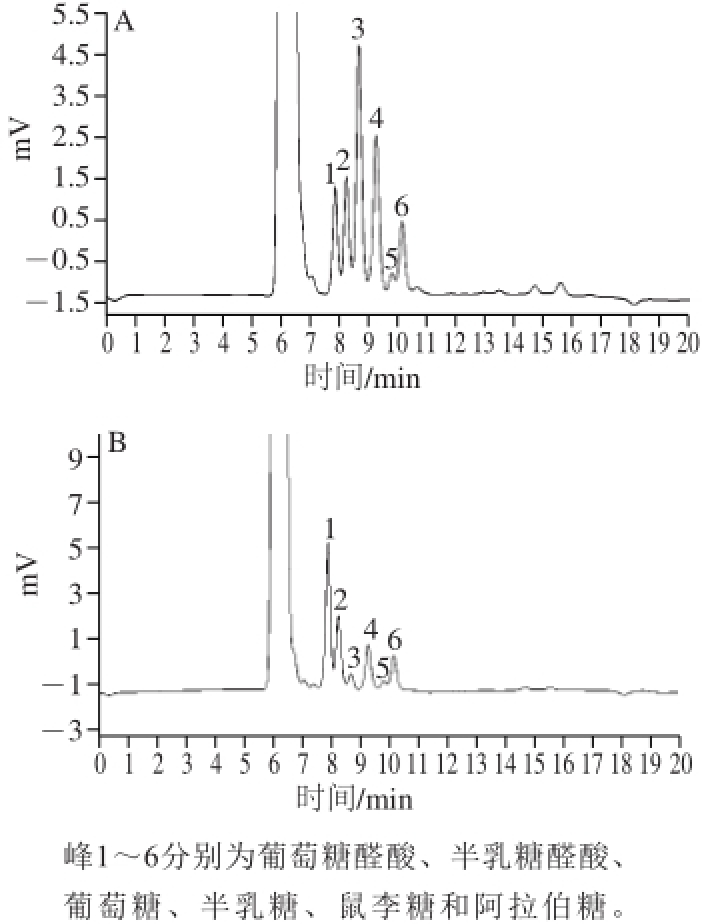
图 2 成熟度C甘蓝SDF(A)和IDF(B)单糖组成的高效液相色谱图
Fig. 2 High performance liquid chromatograms of monosaccharides in SDF (A) and IDF (B) of cabbage at maturity C
由图2可知,甘蓝SDF和IDF中均含有6 种单糖组分,分别为葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、鼠李糖、阿拉伯糖。表2给出了成熟度对甘蓝膳食纤维中各单糖组成及含量的影响,以每种单糖所占百分比表示。可以看出,成熟度对甘蓝膳食纤维中单糖含量有显著影响。甘蓝SDF和IDF中都以葡萄糖醛酸为主,尤其是在成熟度A的甘蓝SDF中,占62.94%;甘蓝膳食纤维中鼠李糖含量最低,不同成熟度甘蓝SDF中鼠李糖所占百分比均低于5%,而IDF中的鼠李糖仅占5%左右。就甘蓝SDF而言,随着成熟度增加,葡萄糖醛酸含量呈下降趋势,由成熟度A的62.94%降至成熟度E的15.25%;葡萄糖含量在成熟度E时显著增加,达到30.31%;半乳糖含量从最初的11.42%增加至23.85%;半乳糖醛酸、鼠李糖与阿拉伯糖含量则呈现先增加后减少,均在成熟度B时达到最高,分别为26.62%、4.74%和14.10%。这与Wennberg等 [24]报道的结果基本一致。就IDF而言,葡萄糖醛酸、半乳糖醛酸、葡萄糖和半乳糖含量均是在前3个成熟度没有显著差异,从成熟度D开始葡萄糖醛酸和半乳糖醛酸含量显著增加,葡萄糖和半乳糖含量显著降低;鼠李糖含量不受成熟度的影响;阿拉伯糖含量呈先增加后下降,且在成熟度D时达到最高。有研究表明,蔬菜膳食纤维单糖组分与植物早期细胞壁生长时间有关,并且随着生长的进行,生长循环系统容易被打乱,从而导致单糖组分及含量有所影响 [25]。从表2还可以看出,随着生长的进行,IDF中葡萄糖与半乳糖含量减少而SDF中增多,这说明细胞壁中纤维素含量在逐渐减少;较甘蓝SDF而言,IDF中半乳糖醛酸含量整体偏低,估计是一些残留在细胞壁中与半纤维素等成分结合的果胶 [26]。总之,不同成熟度甘蓝膳食纤维单糖组成及含量的动态变化规律研究,不仅反映了这些甘蓝细胞壁结构变化情况,也从多糖结构的角度为揭示甘蓝膳食纤维的保健功能特征以及活性物质资源的开发利用提供新的重要信息。
表 2 不同成熟度甘蓝膳食纤维的单糖组成及含量
Table 2 Monosaccharide composition of dietary fi ber of cabbage at different maturity stages %

注:同行肩标小写字母不同表示差异显著(P<0.05)。
纤维单糖组成成熟度膳食A B C D E SDF葡萄糖醛酸62.94±5.33 a34.18±1.39 c37.73±3.03 bc41.72±3.07 b15.25±2.24 d半乳糖醛酸12.54±1.04 d26.62±1.01 a22.99±0.18 b12.61±1.62 d14.81±0.96 c葡萄糖2.53±0.67 d1.99±0.13 d5.22±1.11 c8.65±1.25 b30.31±0.32 a半乳糖11.42±1.36 c18.37±0.46 b17.04±0.41 b24.31±1.93 a23.85±2.23 a鼠李糖2.32±0.98 b4.74±1.33 a4.12±0.81 ab3.45±1.36 ab3.80±0.48 ab阿拉伯糖8.24±1.28 c14.10±0.47 a12.89±0.88 ab9.27±0.78 c11.98±0.79 b葡萄糖醛酸30.73±3.10 c30.41±1.85 c26.55±0.23 c39.55±3.66 b44.76±1.51 a半乳糖醛酸11.15±0.79 c14.10±0.24 b11.77±0.47 c19.76±1.29 a20.28±1.96 a葡萄糖22.63±0.81 a20.54±1.34 a22.32±1.61 a4.05±2.18 b3.85±2.39 b半乳糖21.21±0.82 a21.41±0.48 a23.28±1.37 a17.04±0.94 b15.48±3.04 b鼠李糖5.45±2.31 a4.49±2.36 a5.23±1.67 a5.31±1.96 a6.00±2.83 a阿拉伯糖8.82±1.63 b9.04±1.08 b10.85±0.61 b14.29±0.12 a9.64±1.28 bIDF
2.3 成熟度对甘蓝膳食纤维抗氧化活性的影响
DPPH自由基是一种稳定的自由基,可以接受氢原子和电子,从而形成一种稳定的反磁性分子。因此,抗氧化剂对DPPH自由基清除效果代表了它的供氢能力,即其抗氧化能力 [27]。图3表示不同成熟度甘蓝膳食纤维DPPH自由基清除能力。可以看出,随着成熟度的增加,甘蓝SDF与IDF的DPPH自由基清除能力在成熟度A、B时没有显著差异,而到成熟度C开始有显著的增加,但随着生长的进行,其DPPH自由基的清除能力变化不显著。TDF总体下降的前提下,甘蓝膳食纤维DPPH自由基清除能力在成熟后期则增强,这可能由于甘蓝膳食纤维中半乳糖与鼠李糖两种单糖比例上升引起的。
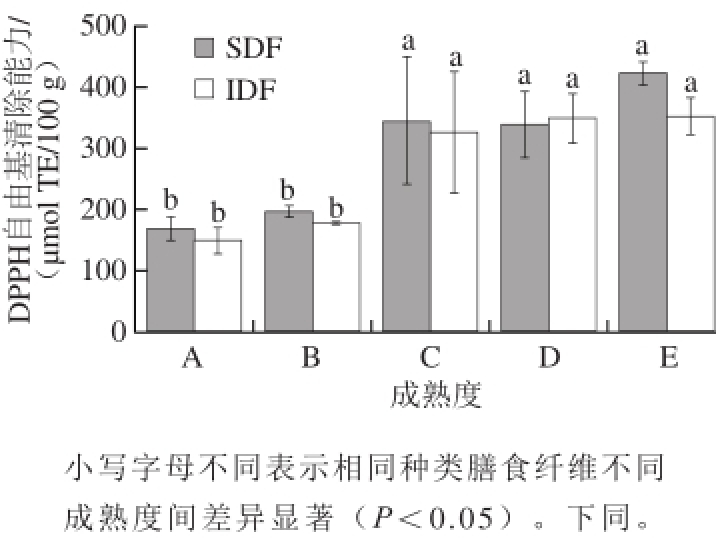
图 3 不同成熟度甘蓝膳食纤维的DPPH自由基清除能力
Fig. 3 DPPH radical scavenging capacity of dietary fi ber in cabbage at different maturity stages
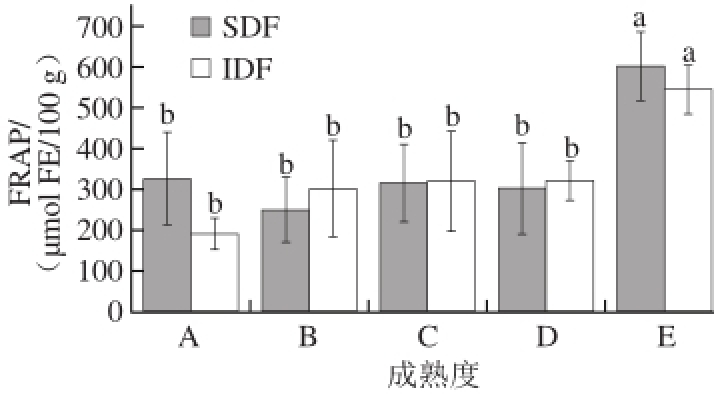
图 4 不同成熟度甘蓝膳食纤维的FRAP
Fig. 4 FRAP of dietary fi ber in cabbage at different maturity stages
FRAP法是基于抗氧化基质将TPTZ-Fe 3+复合物还原为TPTZ-Fe 2+复合物的能力而评价其抗氧化能力 [17]。如图4所示,与DPPH法评价结果一样,成熟度增加能显著提升甘蓝膳食纤维抗氧化能力。甘蓝SDF与IDF粉末对TPTZ-Fe 3+复合物的还原能力在前4 个成熟度没有显著变化,而到成熟度E时增强近1 倍,这与SDF中葡萄糖相对含量变化趋势相同,均是在成熟度E时显著增加。然而,因对抗氧化能力的评价原理不同,DDPH法与FRAP法所测定的甘蓝膳食纤维的抗氧化力在数值上有所差异。
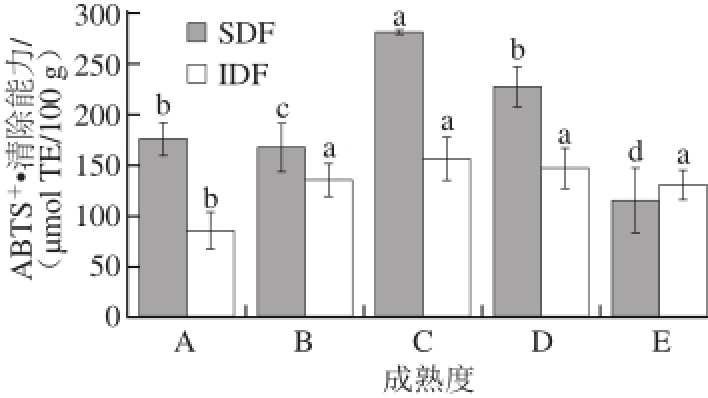
图 5 不同成熟度甘蓝膳食纤维对ABTS
+·的清除能力
Fig. 5 ABTS radical scavenging capacity of dietary fi ber in cabbage at different maturity stages
ABTS +·溶液呈蓝绿色,当具有供氢能力的物质与其接触后,可使自由基阳离子还原为ABTS,并根据溶液反应前后的吸光度变化,来测定样品的抗氧化能力 [28],其原理与DPPH法相似。不同成熟度甘蓝膳食纤维粉体对ABTS +·的清除能力见图5。随着成熟度的增加,甘蓝中SDF粉末的ABTS +·清除能力呈现先增加后降低的趋势,其清除能力在成熟度C时达到最大;甘蓝中IDF粉末ABTS +·清除能力从成熟度B时开始有显著的增强,但绝对变化量较小。这可能与膳食纤维的含量呈一定程度的正相关,还可能与膳食纤维中有一定量的结合酚类物质有关 [29-30]。
综合3 个测试指标可知,不同成熟度甘蓝SDF与IDF均具有抗氧化活性。随着成熟度增加,甘蓝SDF与IDF的DPPH自由基清除能力和FRAP均增强,而ABTS +·的清除能力在成熟度C时达到最强。总的来说,甘蓝在成熟中后期具有较强的抗氧化能力,对甘蓝的合理采收,可将其应用于功能性食品或作为营养强化剂添加到食品中。
甘蓝是膳食纤维的主要来源。膳食纤维组成及含量、膳食纤维单糖组分、膳食纤维抗氧化活性等在甘蓝成熟过程中有显著变化,这些变化主要是甘蓝新陈代谢的结果。甘蓝SDF含量在成熟过程中快速下降,IDF与TDF含量呈现先增后降趋势。随着成熟度的增加,甘蓝膳食纤维中的单糖组分组成模式无差异,但相对含量变化显著,尤其是SDF中葡萄糖含量显著增加,IDF中葡萄糖含量明显降低。伴随着成熟,甘蓝SDF与IDF的DPPH自由基清除能力和FRAP能力均增强,而ABTS +·清除能力在成熟度C时达到最强。不同成熟度甘蓝中膳食纤维含量、单糖组成及其抗氧化活性不一样,针对不同甘蓝产品,可以根据具体需要,确定适宜的采收时期,对赋予甘蓝产品良好的品质、增加经济效益有重要意义。
参考文献:
[1] NILNAKARA S, CHIEWCHAN N, DEVAHASTIN S. Production of antioxidant dietary fi bre powder from cabbage outer leaves[J]. Food and Bioproducts Processing, 2009, 87(4): 301-307. DOI:10.1016/ j.fbp.2008.12.004.
[2] WENNBERG M, NYMAN M. On the possibility of using high pressure treatment to modify physico-chemical properties of dietary fi bre in white cabbage (Brassica oleracea var. capitata)[J]. Innovative Food Science & Emerging Technologies, 2004, 5(2): 171-177. DOI:10.1016/j.ifset.2004.02.002.
[3] TANONGKANKIT Y, CHIEWCHAN N, DEVAHASTIN S. Physicochemical property changes of cabbage outer leaves upon preparation into functional dietary fiber powder[J]. Food and Bioproducts Processing, 2012, 90(3): 541-548. DOI:10.1016/ j.fbp.2011.09.001.
[4] CHO S S, DREHER M L. Handbook of dietary fi ber[M]. New York: CRC Press, 2001: 31-124. DOI:10.1201/9780203904220.ch33.
[5] BROWNLEE I A. The physiological roles of dietary fibre[J]. Food Hydrocolloids, 2011, 25(2): 238-250. DOI:10.1016/ j.foodhyd.2009.11.013.
[6] MCPHERSON-KAY R. Fiber, stool bulk, and bile acid output: implications for colon cancer risk[J]. Preventive Medicine, 1987, 16(4): 540-544. DOI:10.1016/0091-7435(87)90069-7.
[7] SELVENDRAN R R. The plant cell wall as a source of dietary fi ber: chemistry and structure[J]. American Journal of Clinical Nutrition, 1984, 39(2): 320-337.
[8] NYMAN M, ASP N G, CUMMINGS J, et al. Fermentation of dietary fibre in the intestinal tract: comparison between man and rat[J]. British Journal of Nutrition, 1986, 55(3): 487-496. DOI:10.1079/ BJN19860056.
[9] NOMURA A M Y, HANKIN J H, HENDERSON B E, et al. Dietary fi ber and colorectal cancer risk: the multiethnic cohort study[J]. Cancer Causes and Control, 2007, 18(7): 753-764. DOI:10.1007/s10552-007-9018-4.
[10] TAKAHASHI T, NAKADE Y, FUKUDA H, et al. Daily intake of high dietary fi ber slows accelerated colonic transit induced by restrain stress in rats[J]. Digestive Diseases and Sciences, 2008, 53(5): 1271-1277. DOI:10.1007/s10620-008-0228-8.
[11] TANONGKANKIT Y, CHIEWCHAN N, DEVAHASTIN S. Evolution of anticarcinogenic substance in dietary fi bre powder from cabbage outer leaves during drying[J]. Food Chemistry, 2011, 127(1): 67-73. DOI:10.1016/j.foodchem.2010.12.088.
[12] ARMESTO J, CARBALLO J, MARTÍNEZ S. Physicochemical and phytochemical properties of two phenotypes of galega kale (Brassica oleracea L. var. acephala cv. Galega)[J]. Journal of Food Biochemistry, 2015, 39(4): 439-448. DOI:10.1111/jfbc.12151.
[13] CATALANO A E, SPINALE S, PELUSO O, et al. Effect of harvest age and processing on some of the biochemical degradations of ready to eat Chinese cabbage (Brassica campestris L. ssp. pekinensis Lour.) during chilled storage[C]//International Conference on Quality Management of Fresh Cut Produce. Paris: International Society for Horticultural Science, 2007: 281-289. DOI:10.17660/ ActaHortic.2007.746.31.
[14] ASP N G, JOHANSSON C G, HALLMER H, et al. Rapid enzymic assay of insoluble and soluble dietary fi ber[J]. Journal of Agricultural and Food Chemistry, 1983, 31(3): 476-482. DOI:10.1021/jf00117a003.
[15] QI J, LI Y, MASAMBA K G, et al. The effect of chemical treatment on the in vitro hypoglycemic properties of rice bran insoluble dietary fiber[J]. Food Hydrocolloids, 2016, 52: 699-706. DOI:10.1016/ j.foodhyd.2015.08.008.
[16] von GADOW A, JOUBERT E, HANSMANN C F. Comparison of the antioxidant activity of aspalathin with that of other plant phenols of rooibos tea (Aspalathus linearis), α-tocopherol, BHT, and BHA[J]. Journal of Agricultural and Food Chemistry, 1997, 45(3): 632-638. DOI:10.1021/jf960281n.
[17] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/ abio.1996.0292.
[18] NENADIS N, WANG L F, TSIMIDOU M, et al. Estimation of scavenging activity of phenolic compounds using the ABTS +assay[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4669-4674. DOI:10.1021/jf0400056.
[19] DIKEMAN C L, BAUER L L, FLICKINGER E A, et al. Effects of stage of maturity and cooking on the chemical composition of select mushroom varieties[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 1130-1138. DOI:10.1021/jf048541l.
[20] COSGROVE D J. Expansive growth of plant cell walls[J]. Plant Physiology and Biochemistry, 2000, 38(1): 109-124. DOI:10.1016/ S0981-9428(00)00164-9.
[21] XIULI Z, GUANLUN Z. The studying on dietary fiber change of navel orange (Citrus sinesis (L.) Osb.) during fruit development and maturation[J]. Agricultural Journal, 2007, 2(6): 676-680.
[22] 任庆, 孙波, 于敬鑫, 等. 白菜渣可溶性膳食纤维酸法提取工艺优化及理化性质测定[J]. 食品科学, 2015, 36(10): 70-75. DOI:10.7506/ spkx1002-6630-201510014.
[23] ZHANG X, NA C S, KIM J S, et al. Changes in dietary fi ber content of fl esh and peel in three cultivars of Asian pears during growth[J]. Food Science and Biotechnology, 2003, 12(4): 358-364.
[24] WENNBERG M, ENGQVIST G, NYMAN M. Effects of harvest time and storage on dietary fibre components in various cultivars of white cabbage (Brassica oleracea var capitata)[J]. Journal of the Science of Food and Agriculture, 2002, 82(12): 1405-1411. DOI:10.1002/jsfa.1201.
[25] BRUNSGAARD G, KIDMOSE U, SØRENSEN L, et al. The inf l uence of variety and growth conditions on the nutritive value of carrots[J]. Journal of the Science of Food and Agriculture, 1994, 65(2): 163-170. DOI:10.1002/jsfa.2740650207.
[26] 吕明霞, 李媛, 张飞, 等. 气相色谱法分析北方水果中膳食纤维的单糖组成[J]. 中国食品学报, 2012, 12(2): 213-218. DOI:10.3969/ j.issn.1009-7848.2012.02.033.
[27] BLOIS M S. Antioxidant determinations by the use of a stable free radical[J]. Nature, 1958, 181: 1199-1200. DOI:10.1038/1811199a0.
[28] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9): 1231-1237. DOI:10.1016/S0891-5849(98)00315-3.
[29] PAN Z, MENG J, WANG Y. Effect of alkalis on deacetylation of konjac glucomannan in mechano-chemical treatment[J]. Particuology, 2011, 9(3): 265-269. DOI:10.1016/J.PARTIC.2010.11.003.
[30] FULGENCIO S C. Dietary fi ber as a carrier of dietary antioxidants: an essential physiological function[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1): 43-49. DOI:10.1021/jf1036596.
Effect of Maturity on Monosaccharide Composition and Antioxidant Activity of Cabbage Dietary Fiber
KAN Mingming
1, YE Fayin
1, ZHAO Guohua
1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Engineering Research Centre of Regional Foods, Chongqing 400715, China)
Abstract:The effect of cabbage maturity on the monosaccharide composition and antioxidant activity of cabbage dietary fi ber was studied. The data obtained suggested that, with cabbage maturation, the content of soluble dietary fi ber (SDF) kept decreasing, whereas insoluble dietary fi ber (IDF) and total dietary fi ber (TDF) tended to fi rstly increase and then drop. The constituent monosaccharides of cabbage dietary fi ber at different maturity stages were identical, namely galacturonic acid, glucuronic acid, glucose, galactose, rhamnose and arabinose, despite a signif i cant difference in their percentages. In the case of cabbage SDF, with the increase in maturity, the percentage of glucuronic acid decreased, glucose and galactose increased significantly, and galacturonic acid, rhamnose and arabinose showed a parabola, reaching its peak at maturity B. As for cabbage IDF, with increasing maturity, the percentages of glucuronic acid and galacturonic acid increased significantly, glucose and galactose had no change at fi rst and then decreased signif i cantly starting from maturity D, arabinose showed a parabola reaching the highest level at maturity D, and rhamnose had no signif i cant difference. The antioxidant activity of cabbage dietary fi ber was evaluated by 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid (ABTS) radical scavenging capacity, and ferric reducing antioxidant power (FRAP). Our results showed that the DPPH radical scavenging capacity and FRAP of cabbage SDF and IDF signif i cantly increased with cabbage maturation, and the ABTS radical scavenging capacity at maturity C was at the highest level.
Key words:cabbage maturity; dietary fi ber; composition analysis; antioxidant activity
DOI:10.7506/spkx1002-6630-201705010
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)05-0060-06
引文格式:
引文格式:
阚茗铭, 叶发银, 赵国华. 成熟度对甘蓝膳食纤维单糖组成及抗氧化活性的影响[J]. 食品科学, 2017, 38(5): 60-65.
DOI:10.7506/spkx1002-6630-201705010. http://www.spkx.net.cn
KAN Mingming, YE Fayin, ZHAO Guohua. Effect of maturity on monosaccharide composition and antioxidant activity of cabbage dietary fi ber[J]. Food Science, 2017, 38(5): 60-65. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705010. http://www.spkx.net.cn
收稿日期:2016-03-09
基金项目:“十三五”国家重点研发计划项目(2016YFD0400204-2);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
作者简介:阚茗铭(1990—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:kmm1212@yeah.net
*通信作者:赵国华(1971—),男,教授,博士,研究方向为食品化学与营养学。E-mail:zhaoguohua1971@163.com