楼宵玮,蒋娅婷,潘道东,孙杨赢,曹锦轩 *
(宁波大学海洋学院,浙江省动物蛋白精深加工重点实验室,浙江 宁波 315211)
摘 要:为了阐明氯化钠浓度对肌肉蛋白风味吸附特性的影响和相关原理,选取17 种典型性醇类、醛类、酮类和酯类化合物,研究0.0~1.0 mol/L氯化钠浓度对肌原纤维蛋白与上述物质的吸附关系,以及对蛋白结构的影响。结果表明,肌原纤维蛋白的表面疏水性在氯化钠浓度0.0~0.4 mol/L时显著升高,在0.4~1.0 mol/L时显著下降;氯化钠浓度在0.0~0.4 mol/L时α-螺旋和β-折叠转化为β-转角,之后无显著变化;肌原纤维蛋白对醇类吸附很弱,随氯化钠浓度升高,醇类、酮类和醛类吸附性总体降低;酯类吸附性在氯化钠浓度0.0~0.4 mol/L时趋于下降,在0.4~1.0 mol/L时趋于升高。蛋白对醛、酮吸附的下降,前期可能是由于二级结构改变导致席夫碱结合位点被屏蔽,后期可能是由于疏水作用力下降;对酯类的吸附作用变化趋势与疏水性相反,是由于静电相互作用为主要结合力。
关键词:肌原纤维蛋白;挥发性风味物质;氯化钠;蛋白结构;吸附
风味是影响消费者选购肉品的重要因素之一 [1]。肉品的风味物质由挥发性风味化合物和非挥发性风味化合物组成,其中醇、酮、醛、酯是比较重要的4 类挥发性风味化合物。目前,肉品风味研究主要集中于加工中特征风味物质的积累,而对食品基质与风味化合物的相互作用研究较少 [2]。
蛋白质作为食品的主要成分,是吸附挥发性风味化合物的重要基质。有研究者推测,蛋白与醛类和酮类等物质的结合位点在蛋白质疏水区 [3],随后的研究也证明了疏水相互作用力是蛋白-风味物质相互作用的主要可逆结合力 [4]。蛋白质构象是影响其吸附能力的重要因素,Pérez-Juan等 [5]证明了冷冻引起的肌球蛋白变性会增强其对醛和酮的吸附。Yang Jian等 [6]的结果表明,超高压处理对β-乳球蛋白的吸附能力有显著影响。蛋白结构变化可能通过改变结合位点从而影响其对风味物质的吸附。
蛋白质结构受动物品种、肌纤维类型、pH值、温度及盐类等多种因素影响 [7]。氯化钠是食品生产中的重要添加成分,其不仅影响了食品滋味,而且对食品顶空气味物质的浓度有调控作用。Flores等 [8]研究了腌制剂中的不同成分对干腌肉制品风味物质释放的影响,指出氯化钠是对其影响最大的物质。Niimi等 [9]建立奶酪溶液模型,证明了盐的加入增强了奶酪风味强度。Ventanas等 [10]以牛肉汤为分析对象,证明氯化钠产生了风味增效剂的效果。Guichard等 [11]发现添加氯化钠后,β-乳球蛋白对苯甲醛的吸附作用减弱,并解释产生这种现象的原因,可能是盐的加入改变了蛋白表面的极性。肌原纤维蛋白作为肌肉中的主要蛋白质,其对风味物质的吸附已有报道 [5,12],但仍缺乏系统的研究。目前,氯化钠浓度对禽肉肌原纤维蛋白风味吸附能力的影响仍未阐明,蛋白结构改变是否对风味吸附能力起到关键调控作用仍不清楚。阐明上述机制,对改善我国传统禽肉制品风味品质,生产具有良好风味结合与释放特性的产品有极大指导意义。
因此,本研究以鸭肉肌原纤维蛋白为对象,选择了醇类、醛类、酮类和酯类17 种肉品典型风味化合物,建立了肌原纤维蛋白-风味化合物作用复合体系,测定了肌原纤维蛋白的表面疏水性和二级结构,旨在阐明氯化钠通过作用于肌原纤维蛋白结构,从而改变蛋白吸附能力的作用机制。
1.1 材料与试剂
选取日龄为6 0 d左右的麻鸭6 只(体质量为(1 618±136) g) 浙江宁波市镇海区江南家禽育种有限责任公司。宰后2 h内快速摘取鸭胸肉,去除脂肪及结缔组织后真空包装,贮存于-20 ℃备用,所有实验在5 周内完成。
挥发性化合物:2-甲基丁醛、戊醛、己醛、辛醛、癸醛、1-戊醇、1-辛烯-3-醇、1-己醇、1-辛醇、2-丁酮、2-庚酮、2-辛酮、2-壬酮、乙酸乙酯、丁酸乙酯、己酸乙酯、乙酸辛酯均为色谱纯(纯度>98%) 国药集团化学试剂有限公司。
1.2 仪器与设备
SpectraMax 190全波长酶标仪 美国MD公司;inVia-Ref l ex拉曼光谱仪 法国Renishaw公司;固相微萃取装置美国Supelco公司;QP2010气相色谱-质谱联用(gas chromatograph-mass spectrometer,GC-MS)仪日本岛津公司。
1.3 方法
1.3.1 肌原纤维蛋白提取和质量浓度的测定
肌原纤维蛋白提取参照曹锦轩等 [13]的方法。所得的肌原纤维蛋白沉淀,用15 mmol/L Tris-HCl缓冲液(pH 7.0)洗涤3 次,置于4 ℃条件下保存。肌原纤维蛋白质量浓度采用双缩脲法测定。
1.3.2 肌原纤维蛋白表面疏水性测定
用不同氯化钠浓度(0.0、0.2、0.4、0.6、0.8、1.0 mol/L)的20 mmol/L磷酸盐缓冲溶液调整蛋白质量浓度为5 mg/mL。肌原纤维蛋白表面疏水性测定参考Chelh等 [14]的方法。
1.3.3 肌原纤维蛋白拉曼光谱分析
用不同氯化钠浓度(0.0、0.2、0.4、0.6、0.8、1.0 mol/L)的15 mmol/L Tris-HCl缓冲溶液(pH 7.0)调整蛋白质量浓度为40 mg/mL。将肌原纤维蛋白样品均匀涂抹于洁净载玻片上,选用20 倍长聚焦镜头聚焦测试。具体条件:532 nm氩离子激光器,功率12 mW,扫描范围500~2 100 cm -1,分辨率1 cm -1,每个样品扫描30 次。数据处理采用Labspec软件对结果谱图进行基线校正及平滑处理,以苯丙氨酸的单基取代苯基环在1 003 cm -1伸缩振动强度作为内标进行归一化 [15]。蛋白质二级结构(α-螺旋、β-折叠、β-转角及无规则卷曲)含量计算参考Susi等 [16]的方法,利用PeakFit 4.12软件结合傅里叶去卷积处理进行曲线拟合定量分析蛋白质酰胺Ⅰ带。每组进行3 次重复。
1.3.4 风味化合物储备液制备
将4 类17 种风味化合物各用1,2-丙二醇溶解,用超纯水调整溶液中化合物质量浓度为800 mg/L,密封,置于-4 ℃冰箱保存。
1.3.5 蛋白质对风味化合物吸附能力的测定
肌原纤维蛋白吸附能力测定参考Flores等 [17]的方法,略做改动。用不同氯化钠浓度(0.0、0.2、0.4、0.6、0.8、1.0 mol/L)的15 mmol/L Tris-HCl缓冲溶液(pH 7.0)调整蛋白质量浓度为4.0 mg/mL。取5 mL上述溶液加入15 mL顶空样品瓶中,添加风味化合物储备液调整至设定质量浓度,聚四氟乙烯隔膜密封摇匀30 s,置于4 ℃条件下冷藏吸附12 h。各化合物在溶液中的终质量浓度分别为:2-丁酮、1-戊醇、1-辛烯-3-醇、1-己醇、1-辛醇、乙酸乙酯、乙酸辛酯为1 mg/L;2-甲基丁醛、戊醛、己醛、辛醛、癸醛、2-庚酮、2-辛酮、2-壬酮、丁酸乙酯、己酸乙酯为0.5 mg/L。空白组用相同体积的Tris-HCl缓冲溶液代替蛋白液。将冷藏后的样品置于25 ℃条件下,继续振动平衡2 h。在25 ℃条件下,采用75 μm CAR/ PDMS萃取头顶空吸附30 min。萃取头第一次使用前应在280 ℃条件下老化2 h。
挥发性风味化合物顶空浓度及化合物种类检测采用GC-MS法,参考Wang Ying等 [18]方法。化合物自由比例及肌原纤维蛋白吸附能力计算方法如公式(1)、(2)所示:
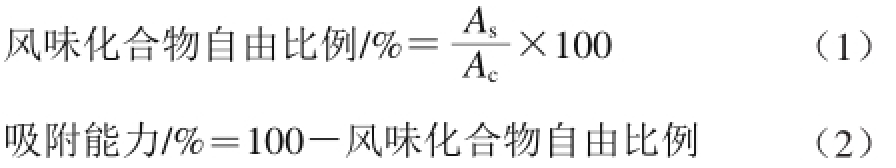
式中:化合物自由比例100%表示空白溶液中风味化合物顶空浓度;A c为空白溶液中风味化合物的峰面积;A s为蛋白样品溶液中风味化合物的峰面积。每组进行3 次重复。
1.4 数据处理与分析
不同氯化钠浓度的蛋白质表面疏水性及二级结构含量变化及其对各风味化合物吸附作用显著差异,采用SAS 8.0中one-way ANOVA的Duncan’s Multiple Range Test模型分析,差异显著性水平(P<0.05)。
2.1 氯化钠浓度对肌原纤维蛋白表面疏水性的影响
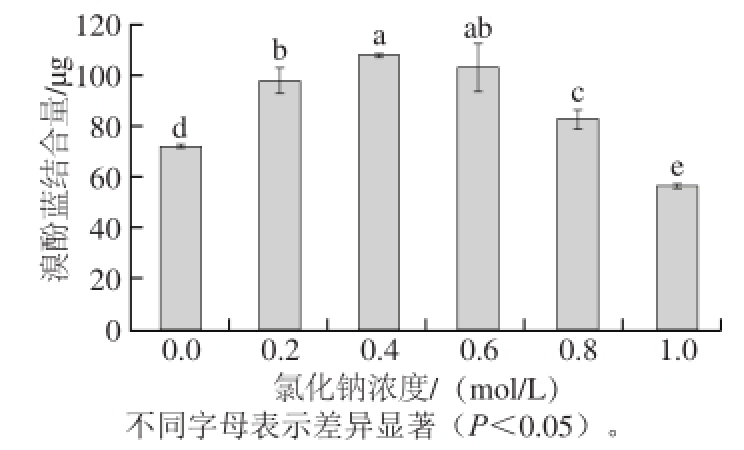
图 1 氯化钠浓度对肌原纤维蛋白表面疏水性的影响
Fig. 1 Effect of sodium chloride concentration on the surface hydrophobicity of myof i brillar proteins
蛋白表面疏水性用溴酚蓝结合量来表示,二者呈正相关。如图1所示,随着氯化钠浓度不断增加,肌原纤维蛋白的表面疏水性呈现先升高后降低的趋势。氯化钠浓度0.0 ~0.4 mol/L时,蛋白表面疏水性显著升高,在0.4 mol/L时达到最高值;氯化钠浓度0.6~1.0 mol/L时,蛋白表面疏水性显著下降,并且在1.0 mol/L处显著低于空白组(P<0.05)。这说明在氯化钠浓度0.2~0.6 mol/L范围内,肌原纤维蛋白暴露出更多的疏水性基团;而当氯化钠浓度过高时,疏水性基团被包埋进蛋白内部。
2.2 氯化钠浓度对肌原纤维蛋白二级结构的影响
表 1 不同氯化钠浓度下肌原纤维蛋白二级结构相对含量变化
Table 1 Secondary structural fractions estimated of myof i brillar proteins at different concentrations of sodium chloride
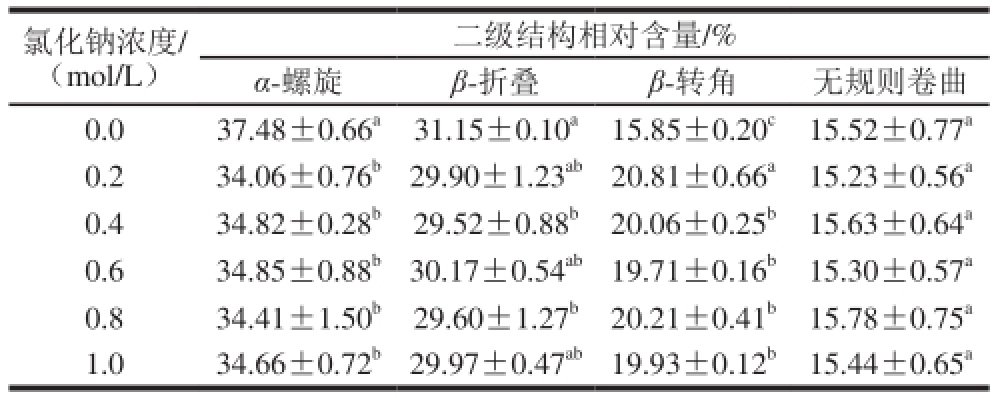
注:同列肩标不同字母表示差异显著(P<0.05)。
二级结构相对含量/% α-螺旋β-折叠β-转角无规则卷曲0.0 37.48±0.66 a31.15±0.10 a15.85±0.20 c15.52±0.77 a0.2 34.06±0.76 b29.90±1.23 ab20.81±0.66 a15.23±0.56 a0.4 34.82±0.28 b29.52±0.88 b20.06±0.25 b15.63±0.64 a0.6 34.85±0.88 b30.17±0.54 ab19.71±0.16 b15.30±0.57 a0.8 34.41±1.50 b29.60±1.27 b20.21±0.41 b15.78±0.75 a1.0 34.66±0.72 b29.97±0.47 ab19.93±0.12 b15.44±0.65 a氯化钠浓度/(mol/L)
肌原纤维蛋白在不同氯化钠浓度下的二级结构相对含量变化如表1所示。当氯化钠浓度由0.0 mol/L增加至0.2 mol/L时,肌原纤维蛋白中α-螺旋结构相对含量由37.48%显著降低至34.06%(P<0.05),之后增加盐浓度无显著变化;氯化钠浓度由0.0 mol/L增加至0.4 mol/L时,肌原纤维蛋白的β-折叠结构相对含量由31.15%显著降低至29.52%(P<0.05),但当氯化钠浓度超过0.4 mol/L后则无显著变化;盐浓度由0.0 mol/L增加至0.2 mol/L时,蛋白质β-转角结构由15.85%显著增加至20.81%,在0.4 mol/L时显著降低至20.06%(P<0.05),之后增加氯化钠浓度,β-转角相对含量无显著变化;随着氯化钠浓度增大,肌原纤维蛋白的无规则卷曲相对含量并无显著差异。
2.3 氯化钠浓度对肌原纤维蛋白吸附作用的影响
图2~5为肌原纤维蛋白在不同氯化钠浓度下对各类风味化合物的作用变化。随着氯化钠浓度不断增大,除了酯类化合物外,其余各风味化合物的自由比例都有一定程度上升。这些化合物的释放增加,说明肌原纤维蛋白对它们的吸附作用有所减弱。挥发性化合物的自由比例超过100%,表明肌原纤维蛋白在该体系条件下对该化合物无吸附作用。Kühn等 [19]认为这种解吸附现象是由于蛋白质与水分子之间形成大量氢键,竞争性排斥了风味化合物与水之间的氢键结合力,促使其释放至顶空。
如图2所示,随着氯化钠浓度的增大,戊醇和己醇的自由比例不断升高并超过100%,分别在氯化钠浓度0.4~0.8 mol/L和0.0~0.2、0.6~0.8 mol/L时释放显著升高,这说明肌原纤维蛋白对戊醇和己醇不存在吸附,且氯化钠促进了溶液中这两种化合物的释放;1-辛烯-3-醇和辛醇的自由比例分别在氯化钠浓度0.0~0.2、0.4~0.8 mol/L和0.0~0.2、0.6~0.8 mol/L范围内显著增大,说明添加氯化钠后,肌原纤维蛋白对两者的吸附作用有明显的减弱。

图 2 氯化钠浓度对肌原纤维蛋白对醇类化合物吸附作用的影响
Fig. 2 Effect of sodium chloride concentration on the binding ability of myof i brillar protein to alcohols
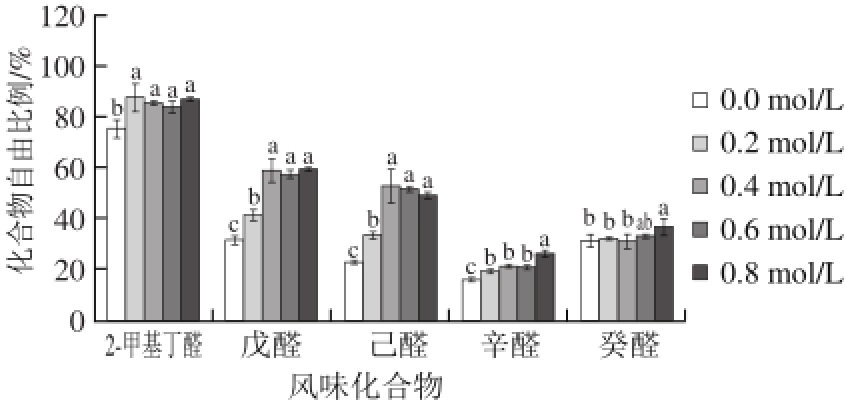
图 3 氯化钠浓度对肌原纤维蛋白对醛类化合物吸附作用的影响
Fig. 3 Effect of sodium chloride concentration on the binding ability of myof i brillar proteins to aldehydes
如图3所示,添加氯化钠后,醛类风味化合物自由比例上升,肌原纤维蛋白吸附能力减弱:2-甲基丁醛(0.0~0.2 mol/L,P<0.05),以及戊醛(0.0~0.4 mol/L,P<0.01)和己醛(0.0~0.4 mol/L,P<0.01)在低浓度范围随着氯化钠浓度升高,自由比例显著升高,之后均无显著变化;辛醛的自由比例在氯化钠浓度0.0~0.2、0.6~0.8 mol/L范围内显著升高(P<0.05);癸醛的自由比例随氯化钠浓度升高无显著变化。以上变化说明,添加0.2~0.4 mol/L的氯化钠,肌原纤维蛋白对醛类化合物的吸附作用存在不同程度的减弱,其中对2-甲基丁醛、戊醛和己醛的作用减弱最为明显。
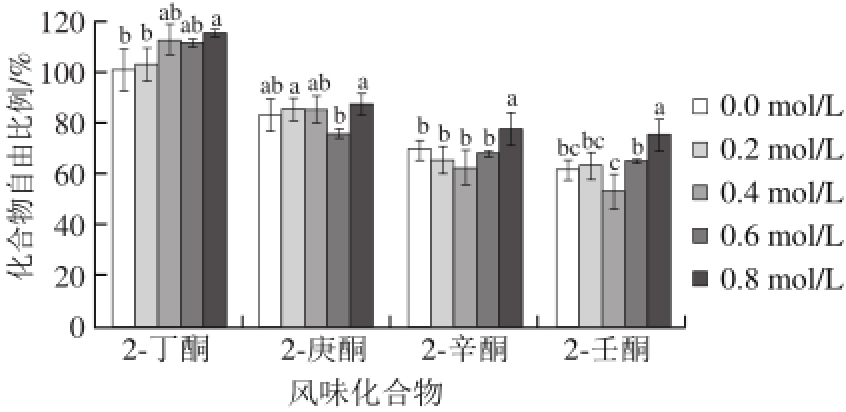
图 4 氯化钠浓度对肌原纤维蛋白对酮类化合物吸附作用的影响
Fig. 4 Effect of sodium chloride concentration on the binding ability of myof i brillar proteins to ketones
如图4所示,肌原纤维蛋白对2-丁酮不存在吸附;2-庚酮、2-辛酮的自由比例在0.6~0.8 mol/L范围内,随着氯化钠浓度升高显著增大(P<0.05),说明氯化钠浓度升高导致吸附作用减弱;2-壬酮在氯化钠浓度0.4 ~0.8 mol/L时,自由比例显著升高(P<0.05),吸附作用减弱。
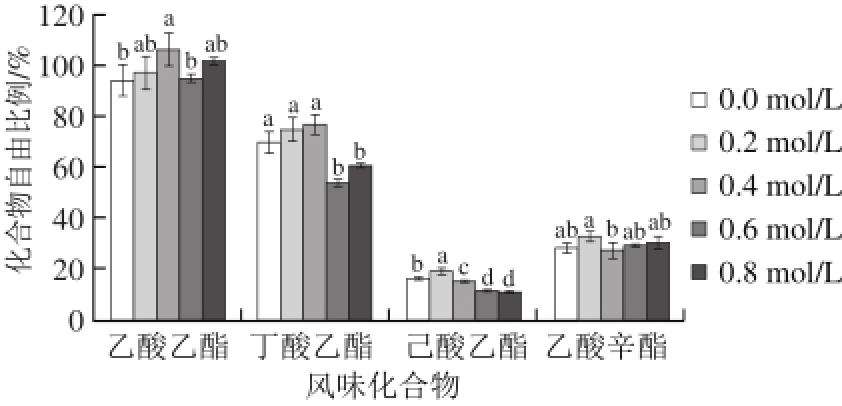
图 5 氯化钠浓度对肌原纤维蛋白对酯类化合物吸附作用的影响
Fig. 5 Effect of sodium chloride concentration on the binding ability of myof i brillar proteins to esters
如图5所示,添加0.2 mol/L氯化钠后,乙酸乙酯、丁酸乙酯、乙酸辛酯的自由比例有轻微上升但并不显著,己酸乙酯有显著升高(P<0.05);当氯化钠浓度增加至0.4~0.6 mol/L时,乙酸乙酯、丁酸乙酯(P<0.01)和己酸乙酯(P<0.05)的自由比例出现了显著降低,乙酸辛酯则无显著变化(P>0.05)。以上变化说明添加较高浓度的氯化钠,肌原纤维蛋白对乙酸乙酯、丁酸乙酯和己酸乙酯的吸附作用增强,对乙酸辛酯的作用没有影响。
大量研究表明,肌原纤维蛋白对挥发性风味化合物吸附作用受到蛋白构象和浓度、风味化合物性质以及介质条件的影响 [2]。氯化钠作为常用调味品的添加,能通过改变食品介质的离子强度,从而影响食品的滋味和气味。本实验结果表明,肌原纤维蛋白表面疏水性呈现先升高后降低的趋势,并在氯化钠浓度为0.4 mol/L时达到最高。李庆云 [20]研究发现,氯化钠浓度很低时,鸡肉肌原纤维蛋白为球状聚集物;增加氯化钠浓度,蛋白溶解度增加;氯化钠浓度较高时,蛋白形成凝胶网络。周茹等 [21]研究发现,低离子强度(0.0~0.3 mol/L)条件下,肌原纤维蛋白溶解度随盐离子浓度增加而变大,主要是副肌球蛋白溶出;离子强度大于0.8 mol/L,随盐浓度升高蛋白溶解度略有下降。蛋白质溶解度的改变,反映了其表面亲水性与疏水环境的变化,这可能与其二级结构的变化存在较大的关联度。对于本实验中的结果,在氯化钠浓度增加至0.4 mol/L的过程中,蛋白逐渐溶解且解折叠,暴露了非极性氨基酸;盐浓度较高时,蛋白聚集且产生交联,表面疏水基团被掩埋。肌原纤维蛋白中加入一定浓度氯化钠后,其二级结构有一定变化,主要表现为蛋白的α-螺旋和β-折叠转变为β-转角。有研究表明,蛋白质的二级结构变化与其表面疏水性相关 [22]。氯化钠浓度低于0.4 mol/L时,随着浓度的增加,悬浮的蛋白质逐渐溶解于缓冲液中,α-螺旋和β-折叠含量下降,蛋白结构趋于无序,疏水性升高;氯化钠浓度高于0.4 mol/L时,蛋白聚集但不改变其二级结构。
添加氯化钠会削弱各类蛋白质对风味化合物的吸附作用,促进风味物质的释放,这种“盐析现象”已经被确定及广泛报道 [10]。本研究结果中,醇类、醛类及酮类化合物的自由比例随着氯化钠浓度增加而有一定程度上升,说明肌原纤维蛋白对这3 类化合物的吸附能力降低,且对于不同化合物的变化程度存在差异。Gianelli等 [23]的报道显示,氯化钠的添加减弱了骨骼肌中的肌肽对2-甲基丁醛、3-甲基丁醛及己醛的吸附,鹅肌肽与己醛、辛醛、甲硫基丙醛的相互作用也有所减弱。Ventanas等 [24]在研究熟化的博洛尼亚香肠风味时发现,盐的加入会促进1-辛烯-3-醇的释放。
Pérez-Juan等 [25]研究了不同盐类对猪肉肌浆蛋白风味吸附能力的影响,发现添加氯化钠和氯化钾能产生相似的“盐析现象”,醛酮类风味成分顶空浓度提高5~10 倍。本研究的结果与多篇报道一致,说明不同种类的肌肉蛋白风味吸附机制具有相似性。肌原纤维蛋白对醛类及酮类的吸附整体上大于醇类,这是因为蛋白的α-氨基能与活性羰基缩合生成席夫碱 [26]。醛类和酮类在氯化钠浓度小于0.4 mol/L时,蛋白吸附能力减弱,可能是由于氯化钠作用改变了蛋白结构和溶液环境,平衡左移,破坏了已生成的席夫碱;浓度大于0.4 mol/L后,疏水相互作用力的减弱则是导致蛋白吸附能力下降的原因之一 [27]。蛋白对醇类的吸附作用随着氯化钠浓度的增加而减少的原因,除了疏水相互作用力之外还可能与氢键有关。
蛋白对酯类的吸附与静电相互作用有关 [27]。本研究中,肌原纤维蛋白对乙酸乙酯、丁酸乙酯、己酸乙酯的吸附作用结果与疏水性先上升后下降的趋势相反。亲水性的增加意味着更多极性基团的暴露,从而提高静电相互作用。因此,在氯化钠浓度0.0~0.4 mol/L时,吸附作用有一定减弱,可能是由于亲水性的下降;氯化钠浓度为0.6~0.8 mol/L时吸附作用的增强,可能是由于静电相互作用增强以及蛋白溶解度增加或蛋白质构象发生轻微变化,蛋白质与酯类化合物的一些作用位点暴露出来导致。肌原纤维蛋白对乙酸辛酯的吸附不随氯化钠浓度变化而变化,可能是由于空间位阻效应。肌原纤维蛋白对己酸乙酯和乙酸辛酯的整体吸附强度明显大于乙酸乙酯和丁酸乙酯,与酯类化合物的碳原子数差异有关 [28]。长碳链酯类化合物比短碳链疏水结合位点多,吸附能力强。Guichard等 [29]提及盐对醇类的影响大于醛类,且对酯类影响较小。Xiong Youling L. [30]研究发现,氯化钠浓度大于0.5 mol/L时,肌原纤维蛋白会产生膨胀,结合水的能力提高,并认为这是由于肌丝之间的静电排斥增强以及肌凝蛋白细丝解聚导致的,本研究结果在0.4 mol/L后肌原纤维蛋白吸附风味化合物的能力减弱也有可能出于这个原因,肌原纤维蛋白与风味物质的结合位点被掩埋或失去结合能力。Pérez-Juan等 [25]报道显示,猪肉肌浆蛋白中添加氯化镁和氯化钙时,虽然溶液中具有更强的离子强度,但其对风味吸附的影响更小。本研究的结果中,氯化钠浓度低于0.4 mol/L时,蛋白对所有的风味化合物的吸附作用都降低,这个现象是由溶液介质中的氢键还是离子键变化导致的仍需进一步的研究。
氯化钠浓度0.0~0.4 mol/L范围内增加时,肌原纤维蛋白表面疏水性显著升高,α-螺旋和β-折叠转化为
β-转角,在0.4~1.0 mol/L范围内由于蛋白分子相互靠拢,表面疏水性显著降低。肌原纤维蛋白对醇类、醛类、酮类的吸附作用,在氯化钠浓度0.0~1.0 mol/L范围内增加时显著减弱,这种明显的“盐析”作用,前期(0.0~0.4 mol/L)可能是由于氢键减弱以及二级结构改变导致席夫碱结合位点被屏蔽,后期(0.4~1.0 mol/L)可能是由于疏水作用力下降。肌原纤维蛋白对酯类的吸附力主要是静电相互作用,其随氯化钠浓度的变化趋势与疏水性正好相反。
参考文献:
[1] SITZ B M, CALKINS C R, FEUZ D M, et al. Consumer sensory acceptance and value of domestic, Canadian, and Australian grass-fed beef steaks[J]. Journal of Animal Science, 2005, 83(12): 2863-2868. DOI:10.2527/2005.83122863x.
[2] 蒋娅婷, 曹锦轩, 张玉林, 等. 蛋白质与挥发性风味成分相互作用研究进展[J]. 核农学报, 2014, 28(2): 285-291. DOI:10.11869/ j.issn.100-8551.2014.02.0285.
[3] WU S Y, PÉREZ M D, PUYOL P, et al. β-Lactoglobulin binds palmitate within its central cavity[J]. Journal of Biological Chemistry, 1999, 274(1): 170-174. DOI:10.1074/jbc.274.1.170.
[4] GUICHARD E. Flavour retention and release from protein solutions[J]. Biotechnology Advances, 2006, 24(2): 226-229. DOI:10.1016/j.biotechadv.2005.11.003.
[5] PÉREZ-JUAN M, FLORES M, TOLDRÁ F. Binding of aroma compounds by isolated myofibrillar proteins: effect of protein concentration and conformation[J]. Food Chemistry, 2007, 105(3): 932-939. DOI:10.1016/j.foodchem.2007.04.051.
[6] YANG J, POWERS J, CLARK S, et al. Ligand and flavor binding functional properties of β-lactoglobulin in the molten globule state induced by high pressure[J]. Journal of Food Science, 2003, 68(2): 444-452. DOI:10.1111/j.1365-2621.2003.tb05692.x.
[7] PÉREZ-JUAN M, FLORES M, TOLDRÁ F. Effect of pork meat proteins on the binding of volatile compounds[J]. Food Chemistry, 2008, 108(4): 1226-1233. DOI:10.1016/j.foodchem.2007.04.037.
[8] FLORES M, GIANELLI M, PÉREZ-JUAN M, et al. Headspace concentration of selected dry-cured aroma compounds in model systems as affected by curing agents[J]. Food Chemistry, 2007, 102(2): 488-493. DOI:10.1016/j.foodchem.2006.04.011.
[9] NIIMI J, EDDY A I, OVERINGTON A R, et al. Aroma-taste interactions between a model cheese aroma and five basic tastes in solution[J]. Food Quality and Preference, 2014, 31: 1-9. DOI:10.1016/ j.foodqual.2013.05.017.
[10] VENTANAS S, MUSTONEN S, PUOLANNE E, et al. Odour and flavour perception in flavoured model systems: influence of sodium chloride, umami compounds and serving temperature[J]. Food Quality and Preference, 2010, 21(5): 453-462. DOI:10.1016/ j.foodqual.2009.11.003.
[11] GUICHARD E, LANGOURIEUX S. Interactions between β-lactoglobulin and flavour compounds[J]. Food Chemistry, 2000, 71(3): 301-308. DOI:10.1016/S0308-8146(00)00181-3.
[12] ZHOU F B, ZHAO M M, SU G W, et al. Binding of aroma compounds with myofibrillar proteins modified by a hydroxyl-radical-induced oxidative system[J]. Journal of Agricultural and Food Chemistry, 2014, 62(39): 9544-9552. DOI:10.1021/jf502540p.
[13] 曹锦轩, 张玉林, 韩敏义, 等. 腊肉加工过程中肌原纤维蛋白结构的变化[J]. 中国农业科学, 2013, 46(18): 3871-3877. DOI:10.3864/ j.issn.0578-1752.2013.18.017.
[14] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/ j.meatsci.2006.05.019.
[15] HARADA I, TAKAMATSU T, TASUMI M, et al. Raman spectroscopic study of the interaction between sulfate anion and an imidazolium ring in ribonuclease A[J]. Biochemistry, 1982, 21(15): 3674-3677. DOI:10.1021/bi00258a023.
[16] SUSI H, BYLER D M. Fourier deconvolution of the amide I Raman band of proteins as related to conformation[J]. Applied Spectroscopy, 1988, 42(5): 819-826. DOI:10.1366/0003702884428905.
[17] FLORES M, OLIVARES A. Release of aroma compounds from dryfermented sausages as affected by antioxidant and saliva addition[J]. European Food Research and Technology, 2008, 228(2): 283-290. DOI:10.1007/s00217-008-0933-8.
[18] WANG Y, JIANG Y T, CAO J X, et al. Study on lipolysis-oxidation and volatile flavour compounds of dry-cured goose with different curing salt content during production[J]. Food Chemistry, 2016, 190: 33-40. DOI:10.1016/j.foodchem.2015.05.048.
[19] KÜHN J, CONSIDINE T, SINGH H. Interactions of milk proteins and volatile flavor compounds: implications in the development of protein foods[J]. Journal of Food Science, 2006, 71(5): R72-R82. DOI:10.1111/j.1750-3841.2006.00051.x.
[20] 李庆云. 氯化钾、海藻粉和柠檬酸钠部分替代氯化钠对鸡胸肉肌原纤维蛋白热诱导凝胶特性的影响[D]. 南京: 南京农业大学, 2013: 20-28.
[21] 周茹, 倪渠峰, 林伟伟, 等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3): 32-39. DOI:10.16429/j.1009-7848.2015.03.005.
[22] SUN W Z, ZHAO Q Z, ZHAO M M, et al. Structural evaluation of myofibrillar proteins during processing of Cantonese sausage by Raman spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11070-11077. DOI:10.1021/jf202560s.
[23] GIANELLI M P, FLORES M, TOLDRÁ F. Interaction of soluble peptides and proteins from skeletal muscle with volatile compounds in model systems as affected by curing agents[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1670-1677. DOI:10.1021/jf040357c. [24] VENTANAS S, PUOLANNE E, TUORILA H. Temporal changes of fl avour and texture in cooked bologna type sausages as affected by fat and salt content[J]. Meat Science, 2010, 85(3): 410-419. DOI:10.1016/ j.meatsci.2010.02.009.
[25] PÉREZ-JUAN M, FLORES M, TOLDRÁ F. Effect of ionic strength of different salts on the binding of volatile compounds to porcine soluble protein extracts in model systems[J]. Food Research International, 2007, 40(6): 687-693. DOI:10.1016/j.foodres.2006.11.013.
[26] KÜHN J, CONSIDINE T, SINGH H. Binding of flavor compounds and whey protein isolate as affected by heat and high pressure treatments[J].Journal of Agricultural and Food Chemistry, 2008, 56(21): 10218-10224. DOI:10.1021/jf801810b.
[27] JOUENNE E, CROUZET J. Effect of pH on retention of aroma compounds by β-lactoglobulin[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1273-1277. DOI:10.1021/jf990215w.
[28] TAN Y, SIEBERT K J. Modeling bovine serum albumin binding of flavor compounds (alcohols, aldehydes, esters, and ketones) as a function of molecular properties[J]. Journal of Food Science, 2007, 73(Suppl 1): 56-63. DOI:10.1111/j.1750-3841.2007.00591.x.
[29] GUICHARD E. Interactions between flavor compounds and food ingredients and their inf l uence on fl avor perception[J]. Food Reviews International, 2002, 18(1): 49-70. DOI:10.1081/FRI-120003417.
[30] XIONG Youling L.. Role of myof i brillar proteins in water-binding in brine-enhanced meats[J]. Food Research International, 2005, 38(3): 281-287. DOI:10.1016/j.foodres.2004.03.013.
Effect of NaCl on the Interaction of Flavor Compounds with Myof i brillar Proteins
LOU Xiaowei, JIANG Yating, PAN Daodong, SUN Yangying, CAO Jinxuan
*
(Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province, School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:s: The aim of the present work was to illustrate the effect and mechanism of action of NaCl concentration on the adsorption capacity of myof i brillar proteins (MPs) to fl avor compounds. We selected 17 typical fl avor compounds including alcohols, aldehydes, ketones and esters as fl avor compounds for investigation of their adsorption properties onto MPs in the NaCl concentration range of 0.0‒1.0 mol/L, and we also researched the effect of NaCl concentration on the structure of MPs. Our results showed that the hydrophobicity of MPs signif i cantly increased in the NaCl concentration range of 0.0‒0.4 mol/L but remarkably decreased as NaCl concentration rose further to 1.0 mol/L. The α-helix and β-sheet turned into β-turn at NaCl concentration of 0.0‒0.4 mol/L and the secondary structure of MPs did not signif i cantly change at higher NaCl concentration. MPs exhibited low adsorption eff i ciency for alcohols. The adsorptivity for alcohols, aldehydes and ketones in general decreased with increasing NaCl concentration, and the adsorptivity for esters tended to decrease at NaCl levels of 0.0‒0.4 mol/L and increase with increasing NaCl level up to 1.0 mol/L. The decreased adsorption to aldehydes and ketones was attributed to the shielding of Schiff sites caused by the unfolding of secondary structure at low salt concentration, and the decrease of hydrophobicity at high salt concentration. The adsorption capacity to esters was negatively related to hydrophobicity, since the binding depended on electrostatic interaction.
Key words:myof i brillar proteins (MPs); volatile compounds; sodium chloride; protein structure; adsorption
DOI:10.7506/spkx1002-6630-201705012
中图分类号:TS251.55
文献标志码:A
文章编号:1002-6630(2017)05-0074-06
引文格式:
楼宵玮, 蒋娅婷, 潘道东, 等. 氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J]. 食品科学, 2017, 38(5): 74-79.
DOI:10.7506/spkx1002-6630-201705012. http://www.spkx.net.cn
LOU Xiaowei, JIANG Yating, PAN Daodong, et al. Effect of NaCl on the interaction of fl avor compounds with myof i brillar proteins[J]. Food Science, 2017, 38(5): 74-79. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705012. http://www.spkx.net.cn
收稿日期:2016-04-13
基金项目:国家自然科学基金面上项目(31471681);“十三五”国家重点研发计划重点专项(2016YFD0401500);
浙江省重大科技专项重大农业项目(2014C02020);宁波大学人才工程项目(ZX2013000783)
作者简介:楼宵玮(1993—),女,硕士研究生,研究方向为畜产品加工与质量控制。E-mail:mengsuizhenzhu@163.com
*通信作者:曹锦轩(1982—),男,副研究员,博士,研究方向为畜产品加工与质量控制。E-mail:caojinxuan@nbu.edu.cn