
刘婷婷,吴玉莹,秦宇婷,张艳荣 *
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:对绿豆淀粉工艺废水中蛋白质的功能性质进行研究。结果表明:绿豆淀粉工艺废水蛋白在40 ℃、pH 9时溶解性最好;持水性在40 ℃条件下最好,达到362.63%;持油性随温度变化在150%~170%之间变化不明显;起泡性和泡沫稳定性及乳化性和乳化稳定性随蛋白质量浓度增加而上升;电泳测定结果表明:蛋白分子质量分别为62.5、46.1、27.0、20.9、16.2 kD;氨基酸分析结果表明:蛋白总氨基酸含量为616.802 mg/g,必需氨基酸含量为233.960 mg/g,蛋氨酸为第一限制性氨基酸;蛋白二级结构中α-螺旋含量为39.68%,β-折叠含量为20.13%,β-转角含量为16.56%,无规则卷曲含量为23.71%;特征分解温度区间为220~360 ℃。
关键词:绿豆淀粉;工艺废水;蛋白质;性质
绿豆(Vigna radiata),是豆科、蝶形花亚科豇豆属的一种被子植物,别名青小豆 [1]。在我国已有两千多年的种植历史,种植面积达到80万 hm 2,年总产量近100万 t [2-3],约占世界总产量的30%左右,东北地区为我国绿豆的主要种植地,年产量占全国的60%以上。绿豆营养丰富,其籽粒中淀粉含量为50%,蛋白质含量为19.5%~33.1%之间。绿豆的功效比值为1.87,远高于小麦、稻谷、玉米等粮食作物;绿豆的氨基酸种类齐全、配比均衡,特别是赖氨酸的含量较为丰富,接近鸡蛋蛋白质 [4-5]。此外,绿豆蛋白具有良好的溶解性、持水性、乳化性、起泡性及泡沫稳定性等功能特性,在面制品、肉制品、乳制品和饮料等食品工业中有广泛的应用前景 [6-7]。
目前,国内对绿豆的加工利用主要是以淀粉利用为主,而忽略了蛋白质资源的开发 [8]。绿豆淀粉生产方法主要有酸浆法、机械分离法和土法3 种方法,其中酸浆法最为常用,利用酸浆法生产绿豆淀粉,每生产1 t淀粉将产生10 t左右的工艺废水,每吨工艺废水可提取20 kg粗蛋白 [9],如能加以充分利用,既可解决绿豆蛋白资源浪费和绿豆淀粉废水污染环境等问题,还可大幅度提高绿豆加工企业的经济附加值。本研究回收提取绿豆淀粉工艺废水中的蛋白质,并对其持水性、持油性、乳化性、起泡性等功能特性和结构进行研究,为充分利用绿豆淀粉工艺废水中的蛋白质提供理论参考。
1.1 材料与试剂
绿豆 购于吉林农业大学农贸市场;丙烯酰胺、四甲基乙二胺(tetramethylethylenediamine,TEMED)、双丙烯酰胺、考马斯亮蓝、Tris、2-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)均为分析纯 北京化工厂;Rainbow Marker 北京索莱宝科技有限公司;17 种氨基酸标品、衍生剂、乙腈、纯水、磷酸盐缓冲液等(均为色谱纯) 美国Waters公司。
1.2 仪器与设备
HR2168型搅拌器 飞利浦(中国)投资有限公司;AR1502CN电子天平 奥豪斯仪器(上海)有限公司;CT15RT台式高速冷冻离心机 上海天美科学仪器有限公司;UV-2300紫外分光光度计 北京普析通用仪器有限公司;DYC2-24D垂直电泳槽 北京君意东方电泳设备有限公司;DYY-10C微电脑控制电泳仪 北京市六一仪器厂;Acquity UPLCH-Class超高效液相色谱系统美国Waters公司;冷冻干燥机 德国Ghrist公司;MOS-450型圆二色光谱(circular dichroism,CD)仪法国Bio-Logic公司;HCT-3型微机差热天平 北京恒久科学仪器厂。
1.3 方法
1.3.1 绿豆淀粉工艺废水中蛋白质的提取
1.3.1.1 酸浆的制备
绿豆按照1∶2(m/V)加水浸泡24 h,再加入10 倍体积水搅拌匀浆,过滤,滤液置于洁净的三角锥瓶中密封,40 ℃培养箱内培养24 h,得成熟酸浆 [10]。
1.3.1.2 绿豆淀粉工艺废水获取
准确称取绿豆100.00 g,浸泡后按1∶8(m/V)磨浆,豆浆通过100 目滤布进行过滤,收集滤液,豆渣加入200 mL水进行二次磨浆、过滤;豆渣弃去不用,合并两次滤液,经3 800 r/min离心15 min,得上清液1和沉淀1;沉淀1中加入同体积酸浆水搅拌,静置5 h,得上清液2和沉淀2;沉淀2加水洗涤3 次,得上清液3和粗淀粉;合并上清液1、2、3即为工艺废水。其工艺流程如下 [11]:

1.3.1.3 绿豆淀粉工艺废水中蛋白质的提取
调节废水pH值至4.5,静置30 min,3 800 r/min离心15 min,沉淀冻干即为绿豆淀粉工艺废水蛋白(mung bean starch wastewater protein,MWP) [12]。
1.3.2 绿豆中蛋白质的提取
称取10.00 g过100 目筛的未经任何处理的绿豆粉于洁净的烧杯中,加200 mL温水搅拌浸泡,离心,上清液调节pH值至4.5,静置30 min,3 800 r/min离心15 min;沉淀冻干即为绿豆蛋白(mung bean protein,MP) [13]。
1.3.3 功能特性的测定
1.3.3.1 等电点的测定
准确称取2.00 g MWP样品,加入200 mL蒸馏水溶解,取10 mL上清液,分别调节pH值到3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,静置30 min,3 800 r/min离心30 min,用双缩脲法测定上清液中蛋白质含量 [14]。
1.3.3.2 溶解性的测定
配制5.0 mg/mL样品溶液5 份;调节至不同pH值(3.0、5.0、7.0、9.0、11.0),室温条件下搅拌30 min,离心测上清液中蛋白质含量 [15]。
配制5.0 mg/mL中性样品溶液5 份,分别于20、40、60、80、100 ℃条件下水浴搅拌30 min,离心测上清液中蛋白质含量。
溶解度表示为上清液蛋白质质量浓度占总蛋白质质量浓度的比例。
1.3.3.3 持水性和持油性的测定
准确称取0.50 g蛋白质样品于离心管中,加入20 mL蒸馏水,分别在20、30、40、50、60 ℃条件下水浴振荡1 h,静置20 min,离心,倾倒上清液,测残留物的质量 [16-17],持水性计算见公式(1)。
准确称取0.50 g蛋白质样品和5 mL大豆油于离心管中混匀,于20、30、40、50、60 ℃条件下水浴振荡1 h,静置20 min后8 000 r/min离心30 min,测定残留物质量 [18],持油性计算见公式(2)。
1.3.3.4 乳化性和乳化稳定性的测定
配制5.0、10.0、15.0、20.0、25.0、30.0 mg/mL的中性蛋白液各50 mL,加入50 mL玉米油,高速匀浆2 min,3 000 r/min离心5 min,测乳化层体积,所得混合液于80 ℃条件下保温30 min,冷却至室温后再次离心,测乳化层体积 [19-20],乳化性及乳化稳定性计算见公式(3)、(4)。1.3.3.5 起泡性和泡沫稳定性的测定

配制5.0、10.0、15.0、20.0、25.0、30.0 mg/mL的中性蛋白液各50 mL,高速搅打1 min,倒入量筒中记录泡沫体积及液体体积。室温条件下静置30 min后记录泡沫体积 [21-22],起泡性及泡沫稳定性计算见公式(5)、(6)。

1.3.4 基本性质的测定
1.3.4.1 分子质量的测定
采用不连续S D S-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE),浓缩胶质量浓度3 g/100 mL,120 V电压;分离胶质量浓度10 g/100 mL,80 V电压;上样量20 μL;常温固定、染色、脱色。以标准蛋白分子质量对数(lgM)为纵座标,蛋白质迁移率为横坐标,绘制标准曲线,计算分子质量 [23],相对迁移率计算见公式(7)。
1.3.4.2 氨基酸含量测定
准确称取MWP样品50.0 mg于110 ℃条件下水解24 h,1 mL水解液蒸干、洗涤、定容至10 mL备用。标品进行梯度稀释,备用。取样品10 μL,与硼酸盐缓冲溶液70 μL漩涡混合,再移入衍生剂20 μL充分混合,放置1 min,封口,移入55 ℃烘箱中加热10 min;测定条件:BEH C 18色谱柱,紫外波长266 nm,柱温49 ℃,样品温度20 ℃,洗脱液A为醋酸盐缓冲溶液pH 5.2;B为6%乙腈;C为水;D为60%的乙腈。梯度洗脱见表1 [24-25]。
表 1 梯度洗脱
Table 1 Gradient elution program

步骤时间/min流速/(mL/min)流动相体积分数/%曲线ABCD 10.000.72.00.09.80.0 20.290.72.00.09.80.011 35.490.79.080.011.00.07 47.100.78.015.657.918.56 57.300.78.015.657.918.56 67.690.77.80.070.921.36 77.990.74.00.036.359.76 88.590.74.00.036.359.76 98.680.72.00.09.80.06 1010.200.72.00.09.80.06
色氨酸含量测定:准确称取MWP样品50.0 mg加入5 mol/L氢氧化锂4 mL,于110 ℃条件下水解24 h,中和,用乙酸缓冲液定容至50 mL,离心,取上清液,过0.45 μm滤膜备用。测定条件:BEH C 18色谱柱,紫外波长280 nm,柱温32 ℃,流动相A(甲醇)与流动相B(乙酸-乙酸钠缓冲液)体积比为10∶90 [26]。
1.3.4.3 氨基酸评分
氨基酸评分(amino acid scoed,AAS)是用化学方法测定待评价蛋白质的必需氨基酸含量,再分别与FAO/ WHO模式氨基酸含量进行比较,其中不足的一种被认为该蛋白质的限制性氨基酸。计算见公式(8)。
1.3.4.4 氨基酸化学评分
化学评分(chemical score,CS)是将待测蛋白质的某种必需氨基酸含量与鸡蛋中该必需氨基酸含量进行比较。计算见公式(9)。
1.3.4.5 二级结构测定
配制6 mg/mL MWP溶液,选择远紫外光区,波长范围:190~250 nm,记录CD图谱;比色池为0.1 cm;光谱带宽:1 nm;分辨率0.2 nm;响应时间:0.25 s;扫描速率:10 nm/min;CD分辨率20 mdeg;室温条件下测定蛋白质二级结构并计算相对百分含量 [27-28]。
1.3.4.6 差示扫描量热测试
取冻干MWP样品10 mg置于洁净坩埚中,压实,以空白为对照,扫描温度范围12~700 ℃,升温速率10 ℃/min,分别得到热重(thermal gravimetric,TG)和差热(differential thermal analysis,DTA)图谱 [29]。
2.1 绿豆淀粉工艺废水中蛋白质功能特性
2.1.1 等电点
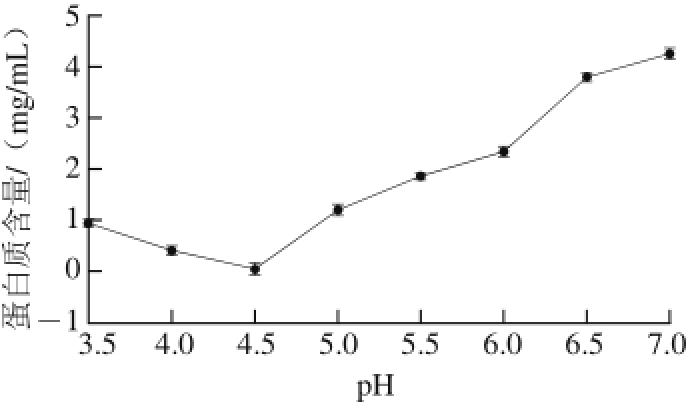
图 1 等电点示意图
Fig. 1 Determination of the isoelectric point
由图1可以看出,pH值在3~7范围内,MWP溶液中蛋白质含量呈先下降后上升趋势;pH值为4.5时样品溶液上清液吸光度最低,蛋白含量最少,此pH值为MWP的等电点。2.1.2 溶解性

图 2 温度对蛋白质溶解度的影响
Fig. 2 Effect of temperature on the solubility of the protein
由图2可知,中性条件下,MP和MWP两种蛋白的溶解度随温度的升高呈先增加后降低的趋势。产生这种现象的原因可能是由于适当的升温有助于蛋白质分子的溶解,而温度过高则会导致蛋白质变性,导致溶解度降低,两种蛋白质在40 ℃条件下溶解度最高,分别为73.8%和75.7%。

图 3 pH值对蛋白质溶解度的影响
Fig. 3 Effect of pH on the solubility of the protein
由图3可知,当pH值在等电点附近时,溶解性降低,当pH值偏离等电点时,蛋白质溶解性增加,当pH值达到9时,两种蛋白质溶解度最高,分别为94.5%和94.3%。
2.1.3 绿豆淀粉工艺废水中蛋白质的持水性和持油性
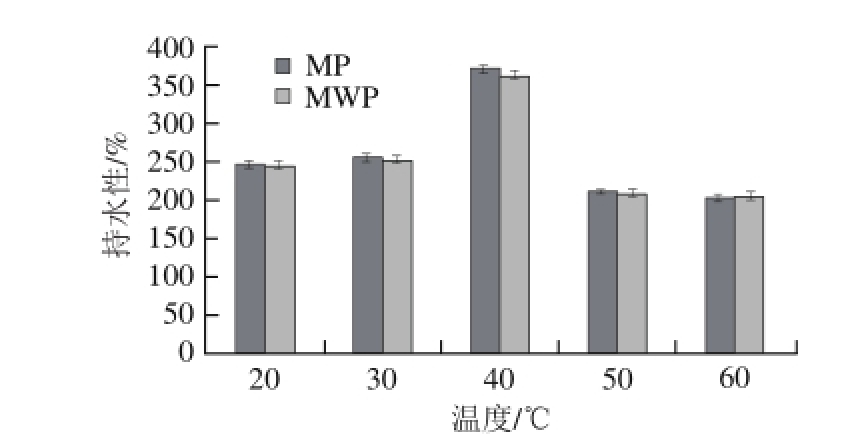
图 4 温度对持水性的影响
Fig. 4 Effect of temperature on the water-holding capacity of the protein
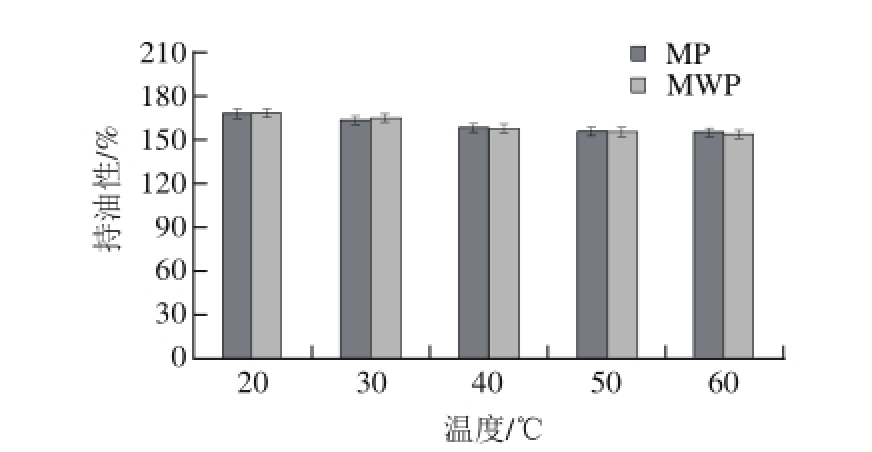
图 5 温度对持油性的影响
Fig. 5 Effect of temperature on the oil-holding capacity of the protein
由图4可知,MP和MWP两种蛋白在40 ℃条件下持水性最好,分别达到371.01%和362.63%。由图5可知,随温度升高,两种蛋白质样品的持油性在150%~170%之间逐渐降低,文献报道,红小豆和大豆蛋白质的吸油率分别为202%和231% [30],绿豆蛋白的持油性低于红小豆和大豆等豆类蛋白。MWP与MP的持水性、持油性无明显差异。
2.1.4 绿豆淀粉工艺废水中蛋白质的乳化性及乳化稳定性

图 6 蛋白质量浓度对乳化性的影响
Fig. 6 Effect of protein concentration on the foaming capacity of the protein
蛋白质是表面活性物质,通过降低溶液界面表面张力可使水和油发生乳化,且在乳化后的油滴表面形成保护层,防止油滴再次发生凝聚,保持乳化液稳定。由图6、7可知,随蛋白质溶液质量浓度的增加,MP和MWP乳化性及乳化稳定性均呈上升趋势,当蛋白质量浓度大于20 mg/mL时,其乳化性及乳化稳定性上升趋势减缓。MWP与MP的乳化性及乳化稳定性无明显差异。
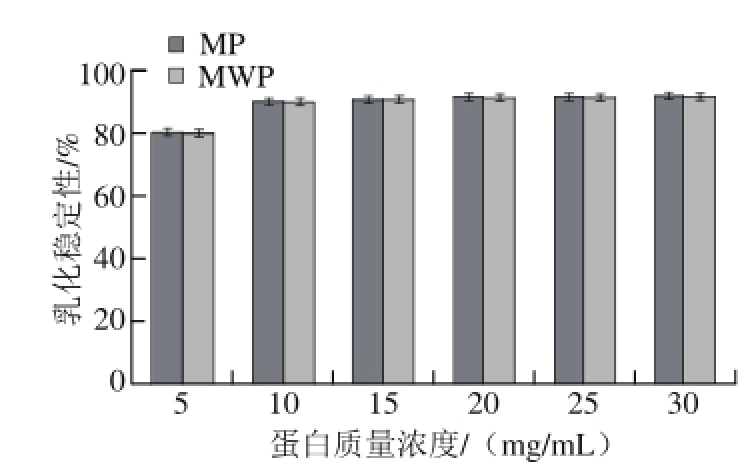
图 7 蛋白质量浓度对乳化稳定性的影响
Fig. 7 Effect of protein concentration on the foam stability of the protein
2.1.5 绿豆淀粉工艺废水中蛋白质起泡性和泡沫稳定性
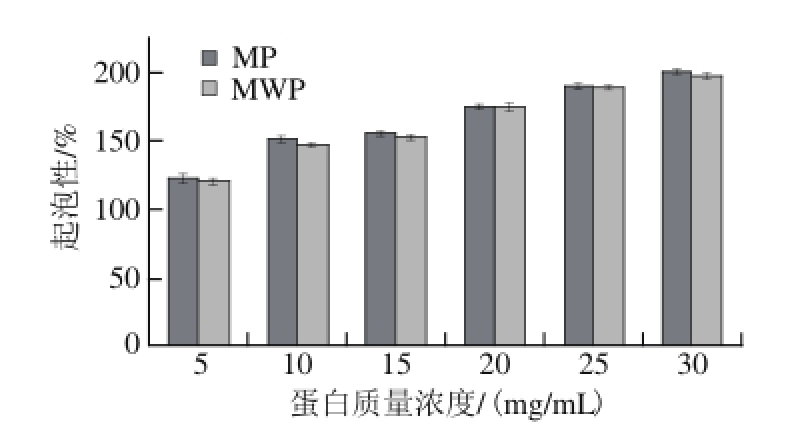
图 8 蛋白质量浓度对起泡性的影响
Fig. 8 Effect of protein concentration on the foaming capacity of the protein
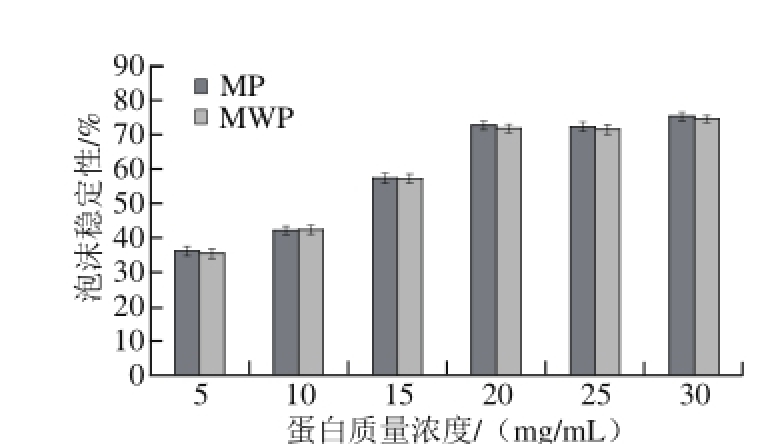
图 9 蛋白质量浓度对泡沫稳定性的影响
Fig. 9 Effect of protein concentration on the foam stability of the protein
起泡性是指蛋白质分子受搅打后形成泡沫的能力,而泡沫稳定性是衡量泡沫稳定能力的重要指标。蛋白质能够降低气-液界面张力,促进气体与液体相结合而形成泡沫,并形成保护膜来使泡沫得以稳定存在。利用蛋白的起泡性和泡沫稳定性可以赋予食品疏松的结构和松软的口感。由图8、9可知,随蛋白质溶液质量浓度的增加,MP和MWP的起泡性和泡沫稳定性都有不同程度增加;说明随着蛋白质量浓度的增加,参与搅打成膜的蛋白质分子增多,蛋白质分子间的作用增强,更易互相结合形成稳定的泡沫,且能维持较长时间。MWP与MP的起泡性及泡沫稳定性无明显差异。
2.2 绿豆废水中蛋白质的基本性质
2.2.1 分子质量
由图10标准蛋白的迁移距离计算出标准蛋白的相对迁移率,以标准蛋白分子质量的对数为纵坐标,相对迁移率为横坐标,绘制标准曲线,得到回归方程为:y=-0.608 7x+2.205 6,R 2=0.984 6。由图10可以看出,MWP和MP均在48~63、35~48、25~35、20~25 kD以及11~20 kD之间有条带,在35~48 kD之间条带颜色较深,根据标准曲线方程计算出MWP和MP的分子质量共分为为62.5、46.1、27.0、20.9、16.2 kD 5 个组分。

图 10 绿豆蛋白分子质量SDS-PAGE图
Fig. 10 SDS-PAGE of the recovered protein
2.2.2 氨基酸组成的测定结果
表 2 MWP和MP的氨基酸组分
Table 2 Amino acid compositions of MWP and MP
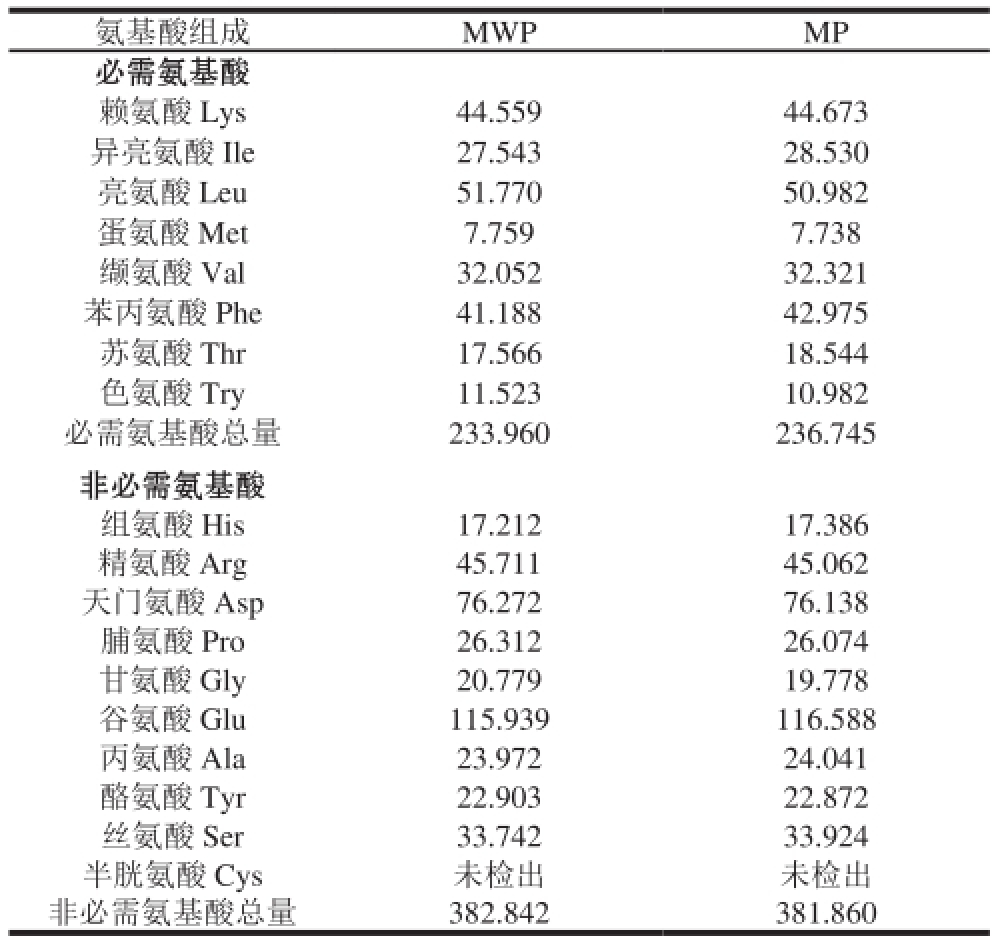
氨基酸组成MWPMP必需氨基酸赖氨酸 Lys44.55944.673异亮氨酸 Ile27.54328.530亮氨酸 Leu51.77050.982蛋氨酸 Met7.7597.738缬氨酸 Val32.05232.321苯丙氨酸 Phe41.18842.975苏氨酸 Thr17.56618.544色氨酸 Try11.52310.982必需氨基酸总量233.960236.745非必需氨基酸组氨酸 His17.21217.386精氨酸 Arg45.71145.062天门氨酸 Asp76.27276.138脯氨酸 Pro26.31226.074甘氨酸 Gly20.77919.778谷氨酸 Glu115.939116.588丙氨酸 Ala23.97224.041酪氨酸 Tyr22.90322.872丝氨酸 Ser33.74233.924半胱氨酸 Cys未检出未检出非必需氨基酸总量382.842381.860
由表2可以看出,MWP和MP各含有17 种氨基酸,其中MWP必需氨基酸含量为233.960 mg/g,非必需氨基酸含量为382.842 mg/g,必需氨基酸占总氨基酸的比例为37.93%,必需氨基酸和非必需氨基酸的比值为0.611;而MP的必需氨基酸含量为236.745 mg/g,非必需氨基酸含量为381.860 mg/g,必需氨基酸占总氨基酸的比例为38.27%,必需氨基酸和非必需氨基酸的比值为0.620。两者几乎无差异,且其必需氨基酸和非必需氨基酸比值接近WHO/FAO标准规定值,表明氨基酸组成较为合理。另外,赖氨酸含量较高,可作为补充剂弥补其他谷物蛋白赖氨酸含量低的缺陷。
表 3 氨基酸评分
Table 3 Amino acid scores

FAO/WHO模式异亮氨酸Ile68.8971.3310240亮氨酸Leu73.9672.839770赖氨酸Lys81.0281.228755苯丙氨酸Phe+酪氨酸Tyr 111.82109.7517860苏氨酸Thr43.9246.367540色氨酸Try115.23109.8210110缬氨酸Val64.1064.648550必需氨基酸MWP氨基酸评分MP氨基酸评分大豆蛋白氨基酸评分
由表3可知,MWP和MP的赖氨酸与色氨酸评分与大豆蛋白这两种氨基酸的氨基酸评分接近,其他氨基酸评分低于大豆蛋白。苯丙氨酸+酪氨酸及色氨酸的氨基酸评分均接近100,表明其含量与人体需要量接近,色氨酸评分最高,可作为色氨酸缺乏的食物补充来源。
表 4 化学评分
Table 4 Chemical scores
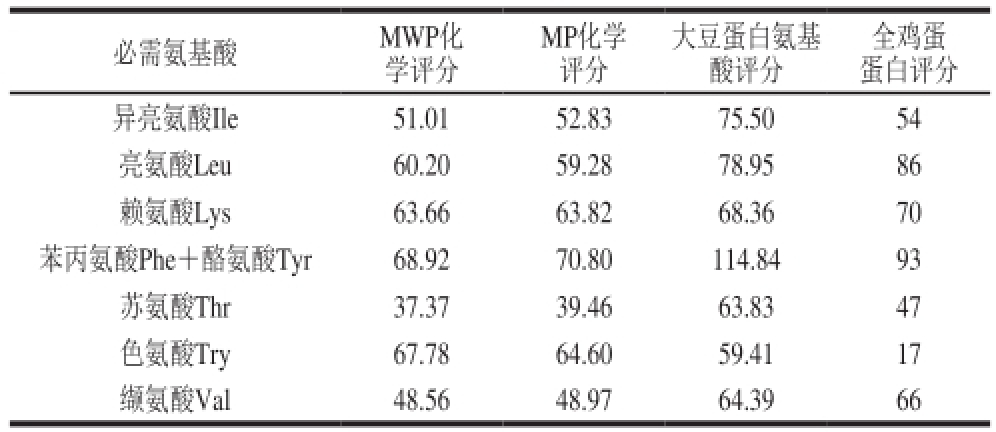
MP化学评分必需氨基酸MWP化学评分大豆蛋白氨基酸评分全鸡蛋蛋白评分异亮氨酸Ile51.0152.8375.5054亮氨酸Leu60.2059.2878.9586赖氨酸Lys63.6663.8268.3670苯丙氨酸Phe+酪氨酸Tyr 68.9270.80114.8493苏氨酸Thr37.3739.4663.8347色氨酸Try67.7864.6059.4117缬氨酸Val48.5648.9764.3966
由表4可知,MWP和MP的氨基酸化学评分与大豆、鸡蛋等蛋白存在差距,除赖氨酸和色氨酸化学评分与大豆蛋白接近外,其他必需氨基酸化学评分均低于大豆蛋白。说明MWP的营养价值不高。
2.2.3 二级结构
表 5 蛋白质二级结构主要CD特征吸收峰
Table 5 The major CD characteristic absorption peaks of secondary structures in the protein
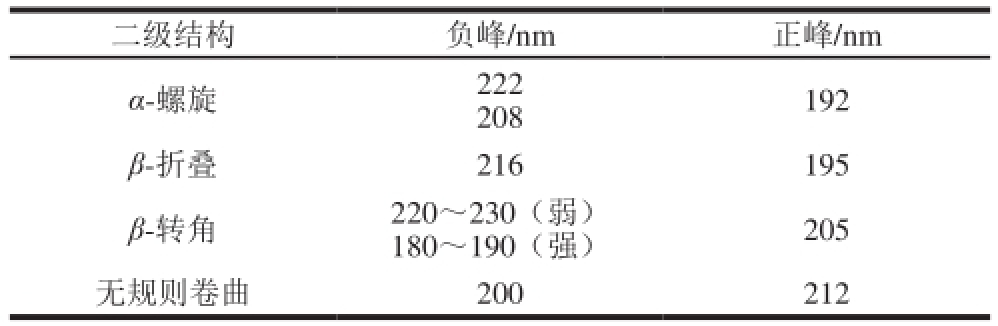
二级结构负峰/nm正峰/nm α-螺旋222 208192 β-折叠216195 β-转角220~230(弱)180~190(强)205无规则卷曲200212
肽键是圆二色谱远紫外区的主要生色基团,其在蛋白质二级结构中有规律排列,排列的方向性决定了肽键能级跃迁的分裂情况,不同二级结构的蛋白质产生的谱带位置和吸收峰强弱都不相同。MWP二级结构见表5和图11,通过CD-Pro软件计算得到MWP二级结构中主要为α-螺旋,其次为无规则卷曲,再次为β-折叠,最后为β-转角,其中α-螺旋占39.68%,β-折叠为20.13%,β-转角为16.56%,无规则卷曲为23.71%。而MP中α-螺旋占37.24%,β-折叠为21.38%,β-转角为18.19%,无规则卷曲为23.19%。

图 11 MWP和MP的CD图谱
Fig. 11 Far-UV CD spectra of MWP and MP
2.2.4 DSC测试
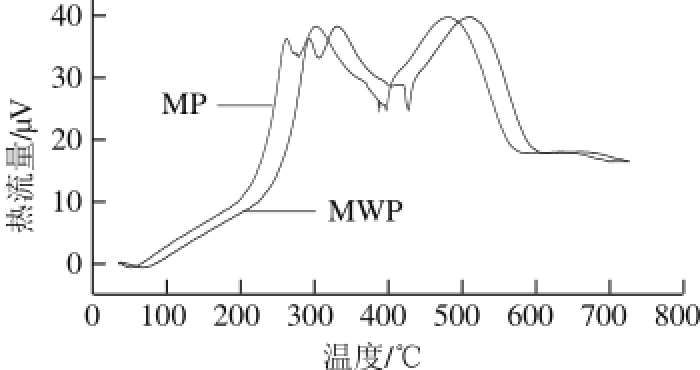
图 12 MWP和MP的TG-DTG曲线
Fig. 12 TG-DTG curves of MWP and MP

图 13 MWP和MP的DTA曲线
Fig. 13 DTA curves of MWP and MP
由图12可知,MWP在逐渐升温中样品热流量变化总共分为3 个阶段。第1阶段温度范围为:12~120 ℃,此时主要是MWP中的水分及其他微量挥发性物质的挥发。第2阶段温度范围为:220~360 ℃,此时主要是蛋白质分子分解,肽链快速断裂脱水,C=O、C—O、C—N键等发生断裂。第3阶段温度范围为420~580 ℃,此时蛋白碳原子全部被氧化,生成气体CO和CO 2逸出。而MP与之相对应的3 个阶段分别为:12~115、215~355 ℃和415~575℃。MWP和MP有两个明显的放热峰,温度与TG-DTA曲线相对应,图13说明MWP的特征分解温度区间为220~360 ℃,而MP的特征分解温度为215~355 ℃,与MWP相差不大。
经测得MWP等电点为pH 4.5。温度和pH值均对MWP溶解度有较大影响,当温度为40 ℃、pH值为9时,MWP溶解性最好。温度对MWP持水性有显著影响,温度为40 ℃时持水率最高,达到363.63%。温度对MWP持油性影响并不显著,且持油率较其他豆类蛋白偏低。MWP乳化性和乳化稳定性随样品质量浓度增加呈现上升趋势,当质量浓度大于20 mg/mL时,上升趋势减缓。起泡性和泡沫稳定性随样品质量浓度增加均有不同程度的增加。
经电泳测得MWP与MP分子共5 个组分,分别为62.5、46.1、27.0、20.9、16.2 kD。MWP总氨基酸含量为616.802 mg/g。必需氨基酸含量为233.960 mg/g,蛋氨酸为第一限制性氨基酸。通过圆二色谱扫描表明:MWP中α-螺旋含量为39.68%,β-折叠为20.13%,β-转角为16.56%,无规则卷曲为23.71%。MWP的特征分解温度区间为220~360 ℃。
参考文献:
[1] 李永武. 绿豆清蛋白的提取及功能特性和理化性质的研究[D]. 大庆: 黑龙江八一农垦大学, 2014: 1-2.
[2] 曾志红, 王强, 林伟静, 等. 绿豆蛋白营养及功能特性分析[J]. 中国粮油学报, 2012, 27(6): 51-52. DOI:10.3969/ j.issn.1003-0174.2012.06.011.
[3] 柴岩, 万富世. 中国小杂粮产业发展报告[M]. 北京: 中国农业科学技术出版社, 2007: 91-98.
[4] JONG A D, PLAT J, MENSINK R P. Metabolic effects of plantsterols and stanols[J]. Journal of Nutritional Biochemistry, 2003, 14: 362-369. [5] WESTER I. Cholesterol-lowering effect of plant sterols[J]. European Journal of Lipid Science and Technology, 2000, 102: 37-44.
[6] 易建华, 朱振宝. 绿豆分离蛋白界面特性影响因素研究[J]. 食品科技, 2009, 34(8): 114-118.
[7] 张玉霞, 雍国新, 黎渊珠. 超声波协助提取绿豆分离蛋白的研究[J]. 食品研究与开发, 2014, 35(20): 13-17. DOI:10.3369/ j.issn.1005-6521.2014.20.004.
[8] 潘妍. 酶法提取绿豆蛋白及其功效的初步研究[J]. 食品工业科技. 2010, 31(9): 238-241.
[9] 韩丽华, 刘国琴, 刘永霞, 等. 酸浆发酵法生产豆类淀粉废水中蛋白质及氨基酸的制取[J]. 郑州粮食学院学报, 2009, 21(3): 60-62. DOI:10.3969/j.issn.1673-2383.2000.03.015.
[10] 杜连起, 刘绍军. 酸浆作用菌对甘薯淀粉沉淀效果的研究[J]. 现代商贸工业, 1998(8): 39-41.
[11] 刘文菊, 刘杰. 酸浆法生产淀粉机理研究初探[J]. 食品科学, 2006, 27(1): 79-82. DOI:10.3321/j.issn:1002-6630.2006.01.015.
[12] WANG M, JIANG L Z. Optimization of extraction process of protein isolate from mung bean[J]. Procedia Engineering, 2011, 15(1): 5250-5258.
[13] 周丽卿, 杜双奎, 赵佳. 响应面法优化鹰嘴豆蛋白提取工艺[J]. 食品科学, 2012, 33(8): 66-70.
[14] 张立娟. 双缩脲法检测大豆分离蛋白中蛋白质的研究[J]. 食品工业科技, 2008, 29(7): 241-242.
[15] 刘邻渭, 陶健, 毕磊. 双缩脲法测定荞麦蛋白质[J]. 食品科学, 2004, 25(10): 258-261.
[16] RAWDKUEN S, SAI-UT S, KHAMSORN S, et al. Biochemical and gelling properties of tilapia surimi and protein recovered using an acid-alkaline process[J]. Food Chemistry, 2009, 112(1): 112-119. DOI:10.1016/j.foodchem.2008.05.047.
[17] WASSWA J, TANG J, GU X H, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin [J]. Food Chemistry, 2007, 104(4): 1698-1704. DOI:10.1016/ j.foodchem.2007.03.044.
[18] VIOQUE J, SANCHEZ-VIOQUE R, CLEMENTE A, et al. Partially hydrolyzed rapeseed protein isolates with improved functional properties[J]. Journal of the American Oil Chemists’ Society, 2000, 77(4): 447-450.
[19] 马勇, 张丽娜, 齐凤元, 等. 榛子蛋白质提取及功能特性研究[J]. 食品科学, 2008, 29(8): 318-322.
[20] 刘冬儿, 吕天喜. 绿豆分离蛋白的制备及其功能特性的研究[J]. 粮食与食品工业, 2007, 14(2): 27-30. DOI:10.3969/ j.issn.1672-5026.2007.02.008.
[21] 沈敏江, 刘红之, 刘丽, 等. 核桃蛋白质的组成、制备及功能特性研究进展[J]. 中国粮油学报, 2014, 29(1): 123-128.
[22] 李维瑶, 何志勇, 熊幼翎, 等. 温度对于大豆分离蛋白起泡性的影响研究[J]. 食品工业科技, 2010, 31(2): 86-88.
[23] 李莹莹, 吴彩娥, 杨剑婷, 等. 白果蛋白质提取及SDS-PAGE分析[J].食品科学, 2010, 31(22): 36-40.
[24] 许宪祝, 孙言春, 徐衍岭, 等. 柱前衍生-超高效液相色谱法测定鱼卵中的17 种氨基酸[J]. 色谱, 2013, 31(3): 275-280.
[25] 杨俊, 王文辉. 柱前衍生超高效液相色谱法测定核桃仁中的氨基酸含量[J]. 食品与发酵工业, 2011, 32 (2): 182-185.
[26] 李成成, 尤晓蒙, 锁然, 等. 高效液相色谱测定饲料中色氨酸含量方法的研究[J]. 食品工业科技, 2016, 37(9): 308-316. DOI:10.13386/ j.issn.1002-0306.2016.09.051.
[27] 胡熠凡, 赵亚周, 田文礼, 等. 蜂王浆中主蛋白成分(MRJP2)的分离纯化及圆二色谱分析[J]. 食品科学, 2013, 34(23): 57-61. DOI:10.7506/spkx.1002-6630.201323013.
[28] 赵南明, 周海梦, 蔡国平. 生物物理学[M]. 北京: 高等敎育出版社, 2000: 3-12.
[29] 白静. 用差热分析法测定小麦和玉米的粗纤维及水分含量[D]. 郑州: 河南工业大学, 2012: 20-23.
[30] 张波, 黄英. 红小豆分离蛋白功能特性的研究[J]. 食品科学, 2012, 33(19): 71-74.
Characteristics of Protein from Mung Bean Starch Processing Wastewater
LIU Tingting, WU Yuying, QIN Yuting, ZHANG Yanrong
*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:The functional characteristics of the protein from mung bean starch processing wastewater were studied. The results showed that the protein was most soluble at 40 ℃ and pH 9. The highest water-holding capacity (up to 362.63%) was observed at 40 ℃ and the oil-holding capacity did not change signif i cantly between 150% and 170% with temperature. The emulsifying capacity, emulsion stability, foaming capacity and foam stability of the protein increased by increasing its concentration. Electrophoresis results showed that the protein consisted of fi ve fractions of 62.5, 46.1, 27.0, 20.9 and 16.2 kD, respectively. The amino acid analysis showed that the contents of total amino acids and essential amino acids were 616.802 mg/g and 233.960 mg/g, respectively. Methionine was the first limiting amino acid. In addition, the secondary structure contained 39.68% α-helix, 20.13% β-sheet, 16.56% β-turn and 23.71% random coil. The range of characteristic decomposition temperatures was determined as 220‒360 ℃.
Key words:mung bean starch; industrial wastewater; protein; characteristics
DOI:10.7506/spkx1002-6630-201705017
中图分类号:TS214.9
文献标志码:A
文章编号:1002-6630(2017)05-0104-07
引文格式:
刘婷婷, 吴玉莹, 秦宇婷, 等. 绿豆淀粉工艺废水中蛋白质的功能性质[J]. 食品科学, 2017, 38(5): 104-110. DOI:10.7506/ spkx1002-6630-201705017. http://www.spkx.net.cn
LIU Tingting, WU Yuying, QIN Yuting, et al. Characteristics of protein from mung bean starch processing wastewater[J]. Food Science, 2017, 38(5): 104-110. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705017. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:“十二五”国家科技支撑计划项目(2013BAD16B08);吉林省科研基金项目(20140520181JH)
作者简介:刘婷婷(1984—),女,副教授,博士,研究方向为谷物食品科学与副产物高值化利用。E-mail:xcpyfzx@163.com
*通信作者:张艳荣(1965—),女,教授,博士,研究方向为粮油植物蛋白工程与功能食品。E-mail:xcpyfzx@163.com