 利用Metastats软件进行统计学分析,通过对比两组条件下的多个样品,找出两组中具有显著差异的微生物类型,默认阈值是0.05。
利用Metastats软件进行统计学分析,通过对比两组条件下的多个样品,找出两组中具有显著差异的微生物类型,默认阈值是0.05。
赵睿秋 1,马高兴 2,杨文建 1,裴 斐 1,赵立艳 2,胡秋辉 1,*
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.南京农业大学食品科技学院,江苏 南京 210095)
摘 要:以金针菇、香菇、黑木耳、平菇、双孢菇、杏鲍菇6 种常见的市售食用菌子实体为研究对象,利用
Illumina MiSeq PE250二代测序平台对肠道微生物V4区进行富集测序,分析6 种食用菌子实体水提物对粪便悬液中
肠道菌群的菌群种类和菌群结构的影响。测序结果显示经过不同实验组培养后,不同种类的食用菌子实体对肠道微
生物的影响各不相同,金针菇组的厚壁菌门水平较高;香菇组的拟杆菌门、变形菌门、厚壁菌门、双歧杆菌和乳杆
菌水平较高;黑木耳组的拟杆菌门、放线菌门、厚壁菌门、双歧杆菌和乳杆菌水平较高;平菇组的拟杆菌门、放线
菌门、厚壁菌门和乳杆菌水平较高;双孢菇组的拟杆菌门、放线菌门水平较高;杏鲍菇组的放线菌门水平较高。
关键词:食用菌子实体;肠道微生物;厌氧培养;高通量测序技术
人类的皮肤和身体黏膜表面寄生着很多微生物,它们组成了多个复杂的生态系统,而在这其中人体肠道是最庞大最复杂的生态系统。一个健康成年人的肠道内居住着400~500 种具有代谢活性的肠道菌,它们的数量在粪便中高达10 11~10 12CFU/g [1]。在宿主生活早期,微生物群诱导肠道免疫系统识别无害与有害细菌,建立两者间的平衡,维护肠道健康,肠道菌群结构的变化直接影响和决定着机体的健康状况 [2]。研究发现肠道微生物基因组中富含参与碳水化合物、氨基酸、维生素等营养物质代谢的基因,其中大部分都是人体自身所不具备的 [3]。早期生活因素很大程度地影响了人肠道微生物群的构成,这些因素也可能是肠道发育和疾病的诱因。有研究比较了美国、委内瑞拉和马拉维人的肠道细菌种属和全部功能基因的重要不同点,这些不同点在3 岁之后变得明显 [4]。
肠道菌群包括益生菌和潜在致病菌,正常情况下两类菌保持平衡,当平衡被打破的时候,身体可能会产生比腹泻更微小的变化以警示我们,如生长速率变慢、皮肤变差、炎症加重、易受感染以及健康难以维持。双歧杆菌和乳酸杆菌是最具代表性的两种益生菌,它们在保持人的肠道正常微生物菌群平衡方面发挥重要作用 [5]。双歧杆菌和乳酸杆菌通过与其他肠道菌共同占据肠膜表面形成一个生物学屏障,构成肠道定植的阻力,从而阻止致病菌和条件致病菌的入侵 [6-7]。潜在致病菌是正常菌群的一部分,在平衡状态下不会对人体的健康造成损害,但是一旦肠道菌群失去平衡,就会导致它们大量增殖或者转移到肠道以外的其他部位,进而引起感染,诱发疾病,严重的甚至会引起死亡 [8]。拟杆菌、肠球菌、肠杆菌和梭状芽孢杆菌都属于潜在致病菌。肠道菌群的变化可以反映出个体的饮食变化、病理状态(如肠道感染)、接受抗生素治疗的情况和免疫抑制 [9-10]。研究表明,食用添加了某些功能性成分的食物或服用药物均可明显改善肠道微生物的种类及数量,如全谷物对肠道菌群具有益生作用,体外发酵24 h后,全谷物样品(燕麦、大麦、全麦、糙米、黑米)发酵液中的双歧杆菌数量有显著性增加 [11];利用外源酶处理薏仁后制成口服类药物,人体摄入该药物可改善肠道中拟杆菌门细菌的数量,拟杆菌门的数量改变进而导致了人体的皮肤状况的改善 [12];人为摄入嗜酸乳杆菌活菌片剂,发现嗜酸乳杆菌可以减少产气荚膜梭菌(一种条件致病菌)的数量 [13];车前子多糖在小鼠结肠中的发酵可以显著增加总短链脂肪酸的含量,增加小鼠粪便持水力,降低结肠pH值,有利于结肠的健康 [14]。
食用菌子实体是人类可食用的大型真菌的统称,营养丰富,含有多种生理活性物质 [15]。其中食用菌子实体多糖在调节生理功能和抗病、治病方面受到了举世瞩目的关注,并得到广泛的应用 [16]。研究表明,来自食用菌子实体的多糖具有与功能性低聚糖类似的可以调节肠道微生物的作用,主要通过促进有益菌群的增殖和产酸,同时抑制肠道病原菌群来发挥作用 [17-18]。富硒猴头菇冻干粉可使小鼠肠道中双歧杆菌和乳杆菌数量显著增多并且大肠埃希氏菌数量明显减少,证明富硒猴头菇冻干粉对小鼠肠道菌群具有调节作用 [19]。香菇酶解物可以提高小鼠的免疫功能,改善肠道菌群环境,提高以乳酸菌为主体的有益菌的数量,降低大肠杆菌的数量,对肠道功能有一定的调节作用 [20]。灵芝多糖可以通过调节小鼠肠道微生物的群落结构来改善和降低小鼠的肥胖率 [21]。但是关于系统地比较多种食用菌子实体之间对肠道微生物的作用差异鲜见报道。因此,本实验对6 种常见的市售食用菌子实体对肠道微生物群落结构和丰度的影响进行了研究,系统地比较了6 种食用菌子实体之间的作用差异。
1.1 材料与试剂
新鲜双孢菇、黑木耳、平菇、香菇、金针菇、杏鲍菇采购于南京众彩农贸市场。
基础培养基 [22]:NaCl 0.1 g/L、KH 2PO 40.04 g/L、K 2HPO 40.04 g/L、MgSO 4·7H 2O 0.01 g/L、CaCl 2·2H 2O 0.01 g/L、NaHCO 32 g/L、氯化血红素0.05 g/L、半胱氨酸0.5 g/L、胆汁酸盐0.5 g/L、吐温-80 2 mL/L、树脂天青0.001 g/L、VK 10 μL/L。
细菌DNA提取试剂盒D3350-1 美国Omega试剂公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
DS-1高速组织绞碎机 上海标本模型厂;EYELA N-1000D-WD旋转蒸发仪 广州艾欣科学仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海右一仪器有限公司;5-2A数显测速恒温磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;YQX-1型厌氧手套箱 上海跃进医疗器械厂;llegra TM 64R Centrifuge离心机 美国Beckman公司;HH系列数显恒温水浴锅 上海江星仪器有限公司;电子万用炉 铭阳电热电器厂。
1.3 方法
1.3.1 食用菌子实体水提物的制备
取新鲜食用菌子实体原料清水洗净,绞碎,加入两倍体积的蒸馏水,55 ℃水浴加热2 h后,过滤并收集滤液。将滤液低温浓缩、冷冻干燥,得到食用菌子实体水提物。
1.3.2 食用菌子实体水提物成分测定
蛋白质含量测定采用GB 5009.5—2010《食品中蛋白质的测定》自动凯氏定氮仪法;总糖含量测定采用GB/T 15672—2009《食品中总糖含量的测定》;水分含量测定采用GB 5009.3—2010《食品中水分的测定》。
1.3.3 厌氧培养基的配制
首先分别称取0.24 g黑木耳、平菇、香菇、金针菇、杏鲍菇、双孢菇水提物至6 个三角瓶中,各加入0.18 g菊糖;阳性对照选择牛肉膏和鱼粉,分别称取0.12 g牛肉膏粉、鱼粉至两个三角瓶中,各加入0.3 g菊糖;最后在每个三角瓶中添加30 mL基础培养基,121 ℃、高压灭菌2 h备用。
1.3.4 肠道微生物培养液的配制
选择1 位22 岁男性受试者,身体状况良好、健康,且2 个月内未服用过抗生素。收集受试对象的新鲜全便,混合均匀后称取3 g并加入30 mL经脱氧处理的磷酸盐缓冲液(phosphate buffered saline,PBS),放入离心机中离心(550 r/min;5 min)制成粪便悬液后立即放入厌氧手套箱。
1.3.5 肠道微生物的培养
在厌氧手套箱中接种粪便悬液:在4 mL离心管中加入0.3 mL粪便悬液和2.7 mL厌氧培养基(实验组和阳性对照组均为2.7 mL),充分摇匀。放入厌氧手套箱中的恒温室进行培养。每12 h上下颠倒摇匀一次。培养48 h后开箱取样 [23-24]。
1.3.6 肠道微生物DNA的提取与分离
参照Omega细菌DNA提取试剂盒说明书对肠道微生物DNA进行提取分离。提取后的样品放置-20 ℃保存 [25]。
1.3.7 样品的测序分析
将引物接头连接到DNA片段上,经聚合酶链式反应扩增后制成基因组文库,随后在含有接头(单链引物)的芯片(flowcell)上将已加入接头的DNA片段变成单链后通过与单链引物互补配对绑定在芯片上,另一端和附近的另外一个引物互补也被固定。经30 轮扩增反应,形成单克隆DNA簇。加入改造过的DNA聚合酶和带有4 种荧光标记的dNTP。用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类。之后,将这些基团化学切割,恢复3’端黏性,继续聚合第二个核苷酸,直到每条模板序列都完全被聚合为双链。统计每轮收集到的荧光信号结果,检测出每个模板DNA片段的序列 [26]。
1.4 统计学分析
数据均表示为
 利用Metastats软件进行统计学分析,通过对比两组条件下的多个样品,找出两组中具有显著差异的微生物类型,默认阈值是0.05。
利用Metastats软件进行统计学分析,通过对比两组条件下的多个样品,找出两组中具有显著差异的微生物类型,默认阈值是0.05。
2.1 食用菌子实体水提物的得率
食用菌子实体水提物的得率如下:金针菇:3.37%;黑木耳:1.71%;平菇:2.22%;双孢菇:2.34%;香菇:2.67%;杏鲍菇:3.67%。
2.2 食用菌子实体水提物成分测定结果
表 1 水提物成分及含量
Table 1 Composition of mushroom water extracts

成分金针菇黑木耳平菇双孢菇香菇杏鲍菇粗蛋白含量20.32±0.18 18.90±0.37 26.30±0.34 24.23±0.20 31.67±0.45 25.89±0.26总糖含量33.34±0.25 49.13±0.56 41.31±0.13 26.72±0.37 41.56±2.36 39.75±4.27水分含量11.07±0.05 15.20±0.02 14.70±0.05 10.78±0.29 13.10±0.14 11.68±0.08
从表1可以看出,不同种类的食用菌子实体水提物中粗蛋白和总糖的含量各不相同,香菇中粗蛋白含量最多,黑木耳中粗蛋白含量最少;黑木耳中总糖含量最多,双孢菇中总糖含量最少。水提物中粗蛋白含量在18%~31%之间,总糖含量在26%~49%之间。水提物中总糖和粗蛋白含量之和占总量的50%~70%。此外水提物中还含有10%~15%的水分。
2.3 总序列数及各样品序列数据统计
在测序实验中,通常采用多个样品平行测序的方法,即多个样品混合测序。为了能区分样品,各样品中的序列均引入了一段标示其样本来源信息的barcode标签序列。若所测序列中不含有barcode标签序列,则无法确定其样本来源。因此,仅当原始序列中含有完整的barcode标签序列时,该条序列才被认可为该样品的序列。由于MiSeq采用双末端测序,需要对数据进行合并,使用Fastx软件去掉序列末尾质量低于Q15的碱基并使用Flash软件对数据进行合并;在实验过程中,测序产物可能含有非特异性扩增片段,利用特异性引物信息可以将其去除。本次分析将barcode序列去除,并对处理后的有效序列进行数据及长度分布统计。本次测序共有8 个样品,总序列数为334 231,总碱基对数为152 570 723 bp,平均碱基对数为456.5 bp。而有效序列大多分布在441~460 bp和461~480 bp,少量分布在1~440 bp和481~520 bp。
通常情况下,有效序列可以直接用于后续生物信息学分析。但如果需要得到更高质量及更精准的生物信息分析结果,则应对有效序列进行去杂。为了进一步保证序列准确性,对后引物也按不超过2 个碱基错配进行过滤;序列中可能含有长度过短的序列,将这些序列纳入分析范围会降低分析质量,因此修剪、去除此部分序列,可得到供精准分析的优化序列;最后需要剔除总碱基错误率高于1的序列。金针菇组的有效序列为29 281 bp;黑木耳组的有效序列为47 332 bp;平菇组的有效序列为44 266 bp;双孢菇组的有效序列为37 576 bp;香菇组的有效序列为47 502 bp;杏鲍菇组的有效序列为44 971 bp;牛肉膏组的有效序列为42 037 bp;鱼粉组的有效序列为41 266 bp。
2.4 各样品群落结构分析

图 1 群落结构分析柱状图
Fig. 1 Histogram analysis of the microbial community structure
表 2 组间显著性差异分析表
Table 2 Signif i cant difference analysis between different groups

注:*.差异不显著(P>0.05)。
微生物门类金针菇黑木耳平菇双孢菇香菇杏鲍菇牛肉膏鱼粉放线菌门 28.740±0.003 36.251±0.002 33.042±0.002 41.192±0.003 16.219±0.002 40.972±0.002 51.924±0.002 57.864±0.002拟杆菌门 20.345±0.002 20.986±0.002 24.791±0.002 33.909±0.001 31.643±0.002 23.747±0.002 18.017±0.002 14.647±0.002厚壁菌门 45.360±0.003 38.364±0.002 36.382±0.002 19.142±0.002 39.310±0.002 29.070±0.002 25.090±0.002 23.720±0.002变形菌门 5.559±0.001 *4.399±0.001 5.784±0.001 *5.756±0.002 *12.828±0.002 6.212±0.001 4.970±0.001 3.769±0.001
从图1和表2可以看出,就肠道菌群相对含量而言(以4 种门类肠道微生物总数为100%),8 个样品中的2 个阳性对照组(牛肉膏和鱼粉)培养出的肠道菌群群落结构基本相似,而6 种食用菌子实体水提物样品处理组所培养出的肠道菌群的群落结构组成与对照有明显差异。牛肉膏和鱼粉组中放线菌门细菌所占比例明显高于食用菌子实体水提物;变形菌门、厚壁菌门、拟杆菌门细菌所占比例明显低于食用菌子实体水提物,说明食用菌子实体水提物较常用氮源来说,明显改变了肠道微生物的群落结构。
P值即为假阳性概率值,当P<0.05时可认为差异显著;q值是假发现率评估值,代表本次计算的可信度。由表2可以看出,除了金针菇、平菇组与双孢菇组变形菌门微生物无显著性差异外,其余各组食用菌子实体在4大门类微生物水平上均有显著性差异。
2.5 菌群分类学分析

图 2 全样品相似度树形图
Fig. 2 Dendrogram showing the similarity of intestinal microbial communities from different groups
根据JEST(Jaccard coefficient using richness estimators)算法计算样品的相似性并以树图形式展示。在树图中距离越近的样品,其对肠道微生物的群落种类影响结果越相似。从图2可以看出,添加了黑木耳和杏鲍菇水提物的实验组在肠道微生物群落结构上最为相近;其次是平菇组,与黑木耳和杏鲍菇组的作用结果较为接近,双孢菇和香菇组的作用结果较为接近,而金针菇组与其余各组中的肠道微生物群落结构差异最大,在对肠道微生物的作用结果上与其余各组相比差距较大。
表 3 主要细菌组成及丰度统计表
Table 3 Major species and abundance of intestinal microorganisms
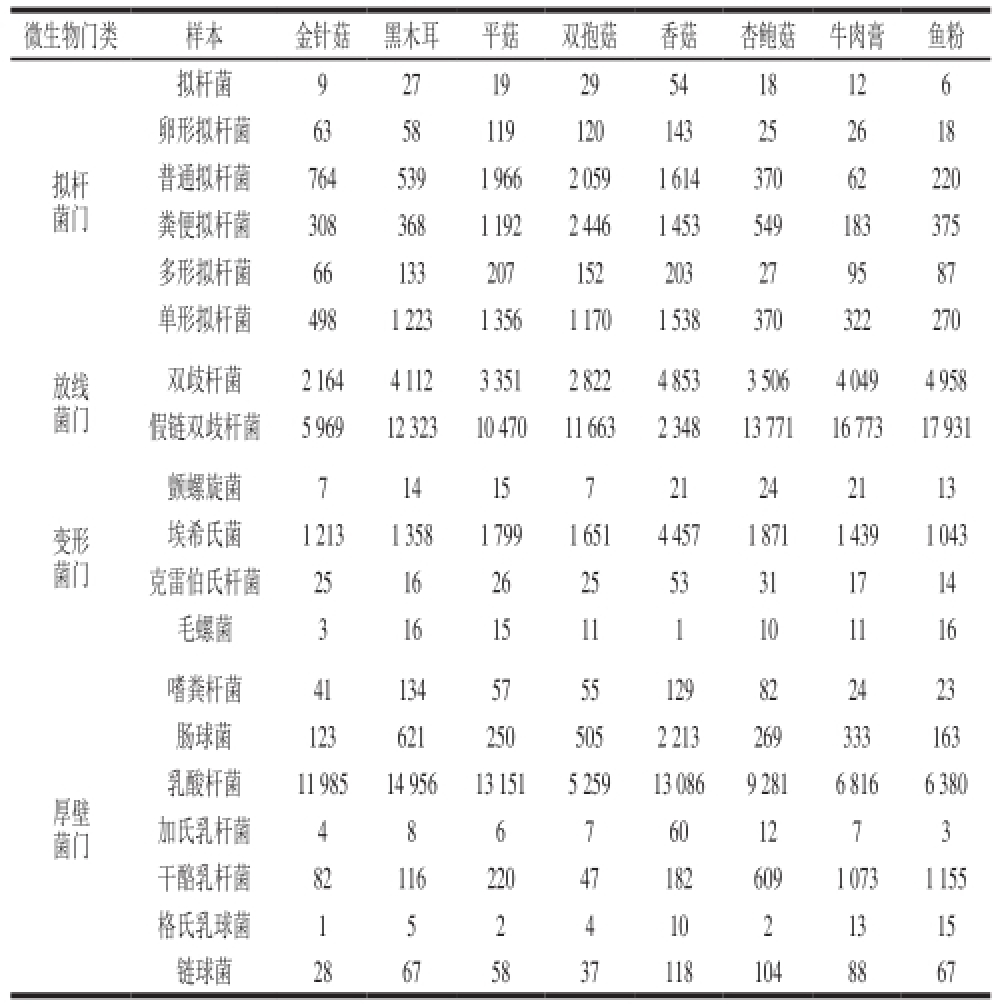
微生物门类样本金针菇黑木耳平菇双孢菇香菇杏鲍菇牛肉膏鱼粉拟杆菌门拟杆菌92719295418126卵形拟杆菌6358119120143252618普通拟杆菌7645391 9662 0591 61437062220粪便拟杆菌3083681 1922 4461 453549183375多形拟杆菌66133207152203279587单形拟杆菌4981 2231 3561 1701 538370322270放线菌门双歧杆菌2 1644 1123 3512 8224 8533 5064 0494 958假链双歧杆菌5 96912 32310 47011 6632 34813 77116 77317 931变形菌门颤螺旋菌71415721242113埃希氏菌1 2131 3581 7991 6514 4571 8711 4391 043克雷伯氏杆菌2516262553311714毛螺菌31615111101116厚壁菌门嗜粪杆菌411345755129822423肠球菌1236212505052 213269333163乳酸杆菌11 98514 95613 1515 25913 0869 2816 8166 380加氏乳杆菌4867601273干酪乳杆菌82116220471826091 0731 155格氏乳球菌15241021315链球菌286758371181048867
放线菌门的大多数细菌为有益菌,如双歧杆菌,可产生抗生素、各种酶(蛋白酶、淀粉酶和纤维素酶等)、VB 12和有机酸等活性物质。双歧杆菌分布在胃肠的数量随年龄阶段的增长而减少。已经发现,双歧杆菌有32 个亚型。婴儿肠道中双歧杆菌占总肠道菌的60%,60 岁以上老人双歧杆菌只占7.9%。已有研究发现双歧杆菌有如下药理作用:维护肠道正常细菌菌群平衡,抑制病原菌的生长,防止便秘和胃肠障碍,同时双歧杆菌可在肠道内合成维生素、氨基酸,提高机体对钙离子的吸收 [27]。从表3可以看出,实验组的双歧杆菌数量总体较对照组低,在实验组中,香菇组的双歧杆菌数量最多,其次是黑木耳组。推测香菇、黑木耳中含有可以促进双歧杆菌增殖的活性物质,进而对人体健康产生有益的影响。
乳酸菌是一类人体肠道中常见的益生菌。在乳酸菌中,乳酸杆菌是最大的一个属。乳酸杆菌属是动物和人类肠道中占优势的菌群之一。乳酸杆菌的生理功能主要表现为:阻止病原菌对肠道的入侵和定植,维持肠道的微生态平衡,预防和抑制肿瘤的发生,增强机体免疫力,促进消化,合成氨基酸和维生素,降低胆固醇,抑制内毒素的生产,延缓衰老和抗辐射等 [28]。大量事实证明,只要肠道中乳酸杆菌的数量减少或消失,出现菌群失调,就可能导致某种疾病的发生;只要肠道中乳酸杆菌的数量增加,区系得到平衡,就可以促进机体健康和治疗某种疾病 [29]。从表3可以看出,金针菇、黑木耳、平菇、香菇组中乳酸杆菌水平较高,杏鲍菇相对较少,双孢菇最少,可推测金针菇、黑木耳、平菇、香菇中含有促进乳酸杆菌增殖的活性物质,多食该类食用菌子实体可促进乳酸杆菌在肠道中的增殖,预防和减少疾病的发生。
肠内厚壁菌门总数多于拟杆菌门总数将促使人体更有效吸收食物中的热量从而导致肥胖 [30]。从图1可知,只有双孢菇所培养出的产物中厚壁菌总数明显少于拟杆菌总数,因此多食用双孢菇能有利于人体控制热量的吸收进而达到减肥的目的。
变形菌能引起尿道感染和机体其他部位的腐败性损伤,大肠杆菌、埃希氏菌和克雷伯氏杆菌均属于变形菌。从表3可知,只有香菇组中埃希氏菌和克雷伯氏杆菌水平较高,而其余几组食用菌子实体培养的产物中,变形菌总数所占比例则较低,说明食用菌子实体可能对抑制炎症的产生具有一定的效果。
综合表3及上文分析可知,金针菇组的厚壁菌门水平较高;香菇组的拟杆菌门、变形菌门、厚壁菌门、双歧杆菌和乳杆菌水平较高;黑木耳组的拟杆菌门、放线菌门、厚壁菌门、双歧杆菌和乳杆菌水平较高;平菇组的拟杆菌门、放线菌门、厚壁菌门和乳杆菌水平较高;双孢菇组的拟杆菌门、放线菌门水平较高;杏鲍菇组的放线菌门水平较高。
本研究用金针菇、黑木耳、平菇、双孢菇、香菇、杏鲍菇提取物培养肠道微生物,6 种食用菌子实体所培养出的肠道微生物中,菌落种类无明显差异,但是菌落结构发生了明显的变化。统计学结果显示不同种类微生物对肠道微生物的影响结果差异显著。黑木耳与杏鲍菇群落结构组成最为相似,其次是平菇,三者较为接近;双孢菇和香菇群落组成相似。不同种类的食用菌子实体水提物粗蛋白、还原糖含量均不相同,对肠道微生物的影响也各不相同。其中实验组双歧杆菌和假链双歧杆菌总体水平较阳性对照组低,香菇和黑木耳组中的双歧杆菌水平较高,说明香菇和黑木耳可以促进双歧杆菌的增殖;金针菇、黑木耳、平菇、香菇组的乳酸杆菌水平较高,长期食用金针菇、黑木耳、平菇、香菇可以增加肠内乳杆菌的数量,预防和减少疾病的发生;双孢菇组中的拟杆菌数目普遍较多,且明显多于厚壁菌,可降低肥胖的发生率,拟杆菌大多属于正常寄生菌,对健康无不良影响;香菇组中埃希氏菌和克雷伯氏杆菌数目明显较多,肠球菌数目最多,这类细菌都是条件致病菌,一定条件下可诱发炎症及感染,而黑木耳组中的克雷伯氏杆菌数目及变形菌总数相对较少,黑木耳具有抗炎症和抗感染的效果。
参考文献:
[1] KEDIA G, VAZQUEZ J A, CHARALAMPOPOULOS D, et al. In vitro fermentation of oat bran obtained by debranning with a mixed culture of human fecal bacteria[J]. Current Microbiology, 2009, 58(4): 338-342. DOI:10.1007/s00284-008-9335-1.
[2] 朱莹莹, 李春保, 周光宏. 饮食、肠道微生物与健康的关系研究进展[J]. 食品科学, 2015, 36(15): 234-239. DOI:10.7506/spkx1002-6630-201515043.
[3] HARALD B. Microbiota and the human nature: know thyself[J]. Environmental Microbiology, 2015, 17(1): 10-15. DOI:10.1111/1462-2920.12693.
[4] YATSUNENKO T, REY F E, MANARY M J, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486: 222-227. DOI:10.1038/nature11053.
[5] 郝维善. 人类肠道中的重要生理性细菌: 双歧杆菌[J]. 中国微生态学杂志, 1989(1): 116-123.
[6] 吴彦彬, 李亚丹, 李小俊, 等. 拟杆菌的研究及应用[J]. 生物技术通报, 2007(1): 66-69. DOI:10.3969/j.issn.1002-5464.2007.01.015.
[7] 郭本恒. 益生菌[M]. 北京: 化学工业出版社, 2004: 460.
[8] 薛超辉. 拮抗腹泻致病菌乳酸菌的筛选及其作用机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2014: 23-28.
[9] BLAUT M, CLAVEL T. Metabolic diversity of the intestinal microbiota: implications for health and disease[J]. Journal of Nutrition, 2007, 137(Suppl 2): 751-755.
[10] DAVIS C D, MILNER J A. Gastrointestinal microflora, food components and colon cancer prevention[J]. Journal of Nutritional Biochemistry, 2009, 20(10): 743-752. DOI:10.1016/ jnutbio.2009.06.001.
[111] 赵兰涛. 全谷物对肠道菌群益生作用的研究[D]. 无锡: 江南大学, 2013: 20-26.
[12] NISHIMURA M, OHKAWARA T, KAGAMI-KATSUYAMA H, et al. Alteration of intestinal fl ora by the intake of enzymatic degradation products of adlay (Coix lachryma-jobi L. var. ma-yuen Stapf) with improvement of skin condition[J]. Journal of Functional Foods, 2014, 7(2): 487-494. DOI:10.1016/j.jff.2014.01.007.
[13] SHIEH M J, SHANG H F, LIAO F H, et al. Lactobacillus fermentum, improved intestinal bacteria flora by reducing Clostridium perfringens[J]. e-SPEN the European e-Journal of Clinical Nutrition and Metabolism, 2011, 6(2): 907-910. DOI:10.1016/ J.eclnm.2011.01.001.
[14] 胡婕伦. 大粒车前子多糖体内外消化与酵解特征体系构建及其促进肠道健康的作用[D]. 南昌: 南昌大学, 2014: 77-88.
[15] 李月梅. 食用菌的功能成分与保健功效[J]. 食品科学, 2005, 26(8): 517-521. DOI:10.3321/j.issn:1002-6630.2005.08.134.
[16] 王丽霞, 杜德清. 食用菌多糖研究进展[J]. 浙江林业科技, 2005, 25(5): 49-53. DOI:10.3969/j.issn.1001-3776.2005.05.015.
[17] GAO S, LAI C K M. Nondigestible carbohydrates isolated from medicinal mushroom sclerotia as novel prebiotics[J]. International Journal of Medicinal Mushrooms, 2009, 11(1): 1-8. DOI:10.1615/ IntJMedMushr.v11.i1.10.
[18] 周蓓莉, 梁强, 邹妍, 等. 食用菌的益生元效应研究进展[J]. 食品科学, 2011, 32(15): 303-307.
[19] 李好, 于世军, 王伟, 等. 富硒猴头菇对小鼠肠道菌群的调节作用[J].中国微生态学杂志, 2010, 22(8): 697-700.
[20] 王春晖, 陈海强, 胡汝晓, 等. 香菇酶解物对小鼠免疫及肠道菌群的影响研究[J]. 微生物学通报, 2012, 39(6): 820-826.
[21] CHANG C J, LIN C S, LU C C, et al. Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J]. Nature Communications, 2015, 6: 7489. DOI:10.1038/ncomms8489.
[22] OLANOMARTIN E, MOUNTZOURIS K C, GIBSON G R, et al. In vitro fermentability of dextran, oligodextran and maltodextrin by human gut bacteria[J]. British Journal of Nutrition, 2000, 83(3): 247-255. DOI:10.1017/S0007114500000325.
[23] BIANCHI F, DALLASTA M, RIO D D, et al. Development of a headspace solid-phase microextraction gas chromatography-mass spectrometric method for the determination of short-chain fatty acids from intestinal fermentation[J]. Food Chemistry, 2011, 129(1): 200-205. DOI:10.1016/j.foodchem.2011.04.022.
[24] 雷芳. 利用肠道微生物的体外培养装置比较研究人和鸡肠道肠道菌群的多样性以及其代谢和免疫功能[D]. 北京: 中国科学院研究生院, 2012: 36-48.
[25] 钱雪琴, 张军, 沈芳. Chelex-100法和碱性裂解法提取细菌DNA的比较[J]. 中国卫生检验杂志, 2008, 18(8): 1565-1566. DOI:10.3969/ j.issn.1004-8685.2008.08.045.
[26] 许宇静, 张煜坤, 沈雪梅, 等. 采用Illumina MiSeq测序技术分析断奶幼兔盲肠微生物群落的多样性[J]. 动物营养学报, 2015, 27(9): 2793-2802.
[27] SU B L, LIU H X, LI J, et al. Acarbose treatment affects the serum levels of inf l ammatory cytokines and the gut content of bif i dobacteria in Chinese patients with type 2 diabetes mellitus[J]. Journal of Diabetes, 2015, 7(5): 729-739. DOI:10.1111/1753-0407.12232.
[28] 王友湘, 陈庆森. 瑞士乳杆菌对小鼠肠道微生物区系的影响[J]. 食品科学, 2008, 29(9): 542-546. DOI:10.3321/j.issn:1002-6630.2008.09.129.
[29] COUSIN F J, MATER D D G, FOLIGNE B, et al. Dairy propionibacteria as human probiotics: a review of recent evidence[J]. Dairy Science & Technology, 2011, 91(1): 1-26. DOI:10.1051/dst/2010032.
[30] 郭秀兰. 猪肠道硬壁菌门和拟杆菌门数量的检测及其相对丰度与脂肪沉积的相关性研究[D]. 雅安: 四川农业大学, 2009: 25-26.
Effects of Water Extracts from Six Different Species of Edible Mushroom on Intestinal Microorganisms in Humans
ZHAO Ruiqiu
1, MA Gaoxing
2, YANG Wenjian
1, PEI Fei
1, ZHAO Liyan
2, HU Qiuhui
1,*
(1. Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:This study researched the effects of water extracts from six different species of edible mushroom, Flammulina velutipes, Lentinus edodes, Auricularia auricula, Pleurotus ostreatus, Agaricus bisporus and Pleurotus eryngii, on the microbial community composition and structure in the human intestine. Towards this goal, MiSeq PE250 Illumina nextgeneration sequencing platform was used to identify the sequence of the 16S rDNA V4 region from the bacterial cells. Sequencing results showed that different species of edible mushrooms had different impacts on the intestinal mictrobiota. Higher populations of Firmicutes were found in the Flammulina velutipes group, Bacteroidetes, Proteobacteria, Firmicutes, Bif i dobacterium and Lactobacillus in the Lentinus edodes group, Bacteroidetes, Actinomycetes, Firmicutes, Bif i dobacterium and Lactobacillus in the Auricularia auricular group, Bacteroidetes, Actinomycetes, Firmicutes and Lactobacillus in the Pleurotus ostreatus group, Bacteroidetes and Actinomycetes in the Agaricus bisporus group, and Actinomycetes in the Pleurotus eryngii group.
Key words:edible mushroom; intestinal microorganism; anaerobic culture; high throughput sequencing technology (HTS)
DOI:10.7506/spkx1002-6630-201705019
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)05-0116-06
引文格式:
赵睿秋, 马高兴, 杨文建, 等. 6 种食用菌子实体水提物对肠道菌群的影响[J]. 食品科学, 2017, 38(5): 116-121. DOI:10.7506/spkx1002-6630-201705019. http://www.spkx.net.cn
ZHAO Ruiqiu, MA Gaoxing, YANG Wenjian, et al. Effects of water extracts from six different species of edible mushroom on intestinal microorganisms in humans[J]. Food Science, 2017, 38(5): 116-121. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705019. http://www.spkx.net.cn
收稿日期:2016-07-30
基金项目:国家现代农业产业技术体系建设专项(CARS-24)
作者简介:赵睿秋(1992—),男,硕士研究生,研究方向为食品科学。E-mail:1037486623@qq.com
*通信作者:胡秋辉(1962—),男,教授,博士,研究方向为农产品加工与营养。E-mail:qiuhuihu@njue.edu.cn