苗欣宇,王祖浩,王 鹏,方 丽,王 辑,闵伟红 *
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
摘 要:为研究酶解红松仁清蛋白中具有血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制活性短肽的组分及其序列,采用超滤、Sephadex G-25、Sephadex G-15及反相高效液相色谱对松仁清蛋白酶解液进行分离纯化,对纯化后样品(组分D2)进行质谱结构鉴定。质谱结果进行从头测序,筛选得到ACE抑制肽Tyr-Leu-Leu-Lys(YLLK),分子质量为535.34 D。该肽经固相合成纯度为99.80%,其半数抑制浓度测定值为0.282 5 μmol/L。
关键词:红松仁清蛋白;ACE抑制肽;分离纯化;氨基酸序列
红松(Pinus konaiensis Sieb.et Zucc.)的果实称为红松仁,有“长寿果”之称。主要分布于我国的东北长白山和小兴安岭林区,其中以长白山的产量最为丰富。长白山野生红松需生长50 a后方开始结籽 [1]。因地理位置因素,红松仁生长周期长达2 a,长时间的生长成熟期使其含有丰富的营养物质,因此极为珍贵 [2]。松仁油中包含许多具有生物活性和促进健康的物质 [3],同时松仁蛋白中含有18 种氨基酸 [4],其中8 种必需氨基酸满足了联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)和世界卫生组织(World Health Organization,WHO)规定的成人推荐值 [5-6]。由此可见,红松仁可作为促进人体健康和营养需要的较为理想的食物来源,具有很好的开发应用前景 [7]。
2015年,我国高血压患者超过3亿人,长期服用降压药物会带来多种副作用 [8]。因此,寻求更为安全有效的降压药物具有现实意义。Wu Dan等 [9]采用Osborne法对松子蛋白进行分级提取,并探索各组分的理化性质,发现清蛋白暴露巯基和总巯基含量最高。吴丹等 [10]采用碱性蛋白酶对长白山松子分离蛋白进行酶解,通过响应面(Box-Benhnken)组合优化试验,确定血管紧张素转化酶(angiotensin-converting enzyme,ACE)抑制率最佳的条件。降血压肽(antihypertension peptide),又称ACE抑制肽,是由植物蛋白质、小分子肽酶解后释放的具有抑制ACE活性的多肽物质 [11]。从食源蛋白质中得到的降血压肽既能使动物体血压适当降低 [12-13],又能保证其安全性,对血压正常的动物体没有降压作用,弥补了常见降压药物使血压过度下降易诱发心脏病突发提高死亡率的不足 [14]。目前,有关食品蛋白来源的降压功能性产品的开发已成为国内外学者研究的热点 [15]。
本研究首先通过酶解红松仁分离蛋白得到具有降血压活性的多肽,接着对其进行超滤、Sephadex G-25和Sephadex G-15凝胶层析分离纯化各酶解组分,并利用反相高效液相色谱(reversed-phase high-performance liquid chromatography,RP-HPLC)进一步纯化。最后采用电喷雾串联质谱仪(electrospray tandem mass spectrometer,ESI-MS/MS)对松仁蛋白降血压肽进行结构分析,得到具有高ACE抑制活性肽的序列,同时按照该序列合成ACE抑制肽并验证其活性,为长白山红松资源的深度开发和综合利用提供基础数据和科学参考。
1.1 材料与试剂
长白山红松仁分离蛋白(蛋白含量91.62%),碱溶酸沉法制备 [16]。
马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、ACE(0.25 U)、Sephadex G-25、Sephadex G-15美国Sigma公司;碱性蛋白酶(Alcalase 2.4 L FG) 丹麦Novozymes公司;其余试剂均为国产分析纯。
1.2 仪器与设备
FD-1B-50型冷冻干燥机 北京博医康仪器有限公司;UV-1700型紫外-可见分光光度计 日本岛津公司;RSA224S型电子天平 赛多利斯科学仪器北京有限公司;ZY-1000切向流超滤系统 上海紫裕生物科技有限公司;Pellicon ®2 迷你膜盒 美国Millipore公司;HD-3型紫外检测器、BSZ-100型自动部份收集、HL-2型恒流泵 上海沪西分析仪器厂;1200型快速分离液相色谱系统、6520四极杆飞行时间串联质谱仪(quadrupole tandem mass spectrometry,Q-TOF) 美国Agilent公司。
1.3 方法
1.3.1 红松仁清蛋白的提取
精确称取红松仁分离蛋白100 g,加入1 000 mL蒸馏水,pH 7、室温条件下用磁力搅拌器搅拌1 h,5 000 r/min室温条件下离心10 min,取上清液。用HCl调整pH值至4.1,室温条件下静置2 h,5 000 r/min离心10 min,弃上清液得到乳白色蛋白质沉淀。用蒸馏水轻轻漂洗蛋白质沉淀3 次后,将pH值调至7.0,冷冻干燥,得到松仁清蛋白 [17]。
1.3.2 红松仁清蛋白的酶解
采用碱性蛋白酶酶解松仁清蛋白,制备具有ACE抑制活性的酶解产物。酶解条件:底物质量浓度2 g/100 mL,酶解时间150 min,酶解温度55 ℃,酶解pH 9,加酶量10 000 U/g(以底物质量计)。
1.3.3 红松仁ACE抑制肽的分离纯化
1.3.3.1 超滤分离
依次采用截留分子质量为10、3 kD超滤膜盒对酶解液进行分级分离,得到3 个组分分别为:A1(<3 kD),A2(3~10 kD)和A3(>10 kD)。对所得组分进行冷冻干燥后测其ACE抑制活性。恒流泵对使用Pellicon膜包的压力条件:进口压力1.7 bar,回流压力0.3 bar [18]。
1.3.3.2 凝胶渗透层析分离纯化
将超滤分离后的松仁清蛋白酶解液用Sephadex G-25进行分离,分别收集各峰组分,将其冷冻干燥,测定各组分ACE抑制率。分离条件:洗脱液为蒸馏水,流速为1 mL/min,并用自动分步收集器收集洗脱液(3 mL/管),样品质量浓度为45 mg/mL,上样量4 mL,检测波长280 nm [19]。
将Sephadex G-25分离所得的ACE抑制活性最强的组分,利用Sephadex G-15凝胶色谱柱进一步纯化。收集各峰组分,冻干后测其ACE抑制率。分离条件:洗脱液为蒸馏水,流速为1 mL/min,样品质量浓度为30 mg/mL,上样体积为3 mL,并用自动分步收集器收集洗脱液(3 mL/管),检测波长280 nm。
1.3.3.3 RP-HPLC分析
将酶解液经Sephadex G-15分离获得的活性最强组分利用RP-HPLC分离纯化,收集各洗脱峰,经旋转蒸发浓缩后,冷冻干燥得到各分离组分,测定其A C E抑制活性。色谱条件:色谱柱:C 1 8(150 mm×2.0 mm,3 μm)柱;检测波长:220 nm;柱温:40 ℃;流速:0.5 mL/min,进样量:10 μL;流动相A:水(含0.1%的三氟乙酸);B:乙腈(含0.1%的三氟乙酸),C:蒸馏水,D:纯乙腈。梯度洗脱条件 [20-21]:0~30 min,95% C(线性梯度);30~50 min,65%~95% C(线性梯度);50~60 min,65% C(线性梯度)。
1.3.3.4 ESI-MS/MS鉴定
采用电喷雾正离子扫描模式(ESI +);质量扫描范围m/z 100~2 000;干燥气(N 2)流速为9 L/min,干燥器温度300 ℃,雾化气压35 psi,毛细管电压为3.5 kV,碎裂电压175 V,锥孔电压65 V,八极杆射频电压250 V,二级质谱碰撞电压12~15 eV [22]。
1.3.3.5 松仁ACE抑制肽合成
采用Fmoc固相合成法,纯度为99.8%,由北京中科亚光生物科技有限公司合成。
1.3.4 ACE抑制活性测定
运用紫外分光光度计测定 [23]。ACE抑制活性用抑制率表示,根据下式计算:
式中:A是添加抑制剂的样品管的吸光度;B是添加缓冲液的样品管的吸光度;C是反应前灭酶的样品管的吸光度。
1.3.5 肽含量的测定
采用福林-酚法测定肽含量 [24]。
1.3.6 IC 50值的测定
按照Balti法测定半数抑制浓度(half maximal inhibitory concentration,IC 50)值 [25]。当抑制率为50%时,抑制肽的浓度即为IC 50,其数值由GraphPad Prism 5统计软件计算。
1.4 数据分析
采用SPSS 16.0软件进行数据统计处理,数据以
 表示,组间差异比较采用t检验,P>0.05表示无显著性差异,P<0.05表示差异显著,P<0.01表示差异极显著。
表示,组间差异比较采用t检验,P>0.05表示无显著性差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 红松仁ACE抑制肽的超滤分离
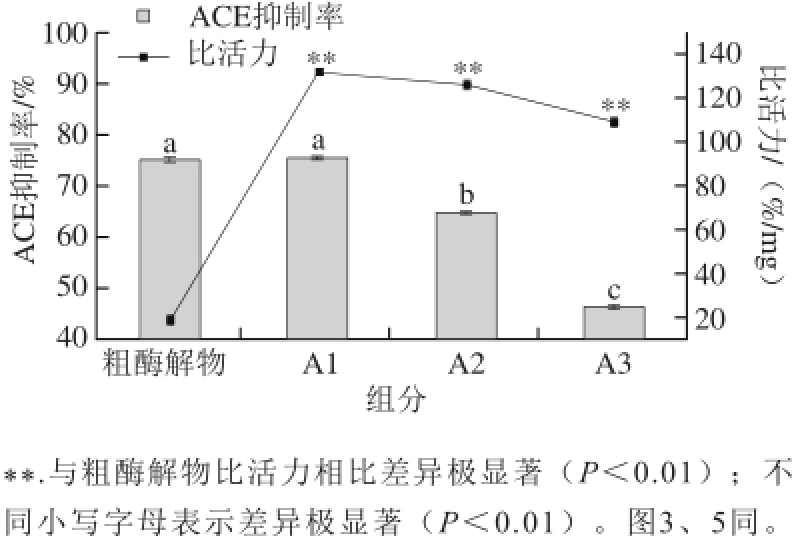
图 1 不同分子质量酶解物的ACE抑制活性
Fig. 1 ACE inhibitory activities of the hydrolysates and its fractions of different molecular weights
松仁清蛋白蛋白酶解液经超滤分离得到3个组分(A1:<3 kD、A2:3~10 kD和A3:>10 kD),它们的ACE抑制活性如图1所示。A1组分的ACE抑制率和比活力均高于其他组分,其中,A1组分的ACE抑制率为75.5%,比活力为132.0 %/mg,比活力极显著高于粗酶解物(P<0.01),因此,选择A1组分进行下一步分离纯化。
2.2 红松仁ACE抑制肽的Sephadex G-25分离纯化
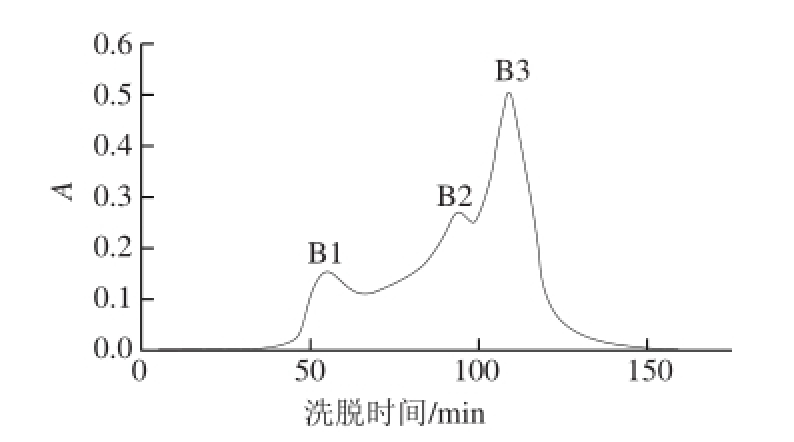
图 2 Sephadex G-25分离红松松仁清蛋白酶解物图谱
Fig. 2 Chromatograms of the albumin hydrolysate separated on Sephadex G-25
经超滤后的组分A1在Sephadex G-25凝胶过滤层析色谱上分离得到3 个峰,分别标记为B1、B2和B3(图2),其中组分B3峰面积大、分子质量小。将各组分收集并冷冻干燥后,用相同浓质量度溶液测定ACE抑制活性。如图3所示,B3组分的ACE抑制率极显著高于其他组分(P<0.01),ACE抑制率为76.7%,比活力为319.6 %/mg,因此,选择B3组分进行下一步分离纯化。

图 3 Sephadex G-25分离组分的ACE抑制活性
Fig. 3 ACE-inhibitory activity of each fraction separated on Sephadex G-25
2.3 红松仁ACE抑制肽的Sephadex G-15分离纯化
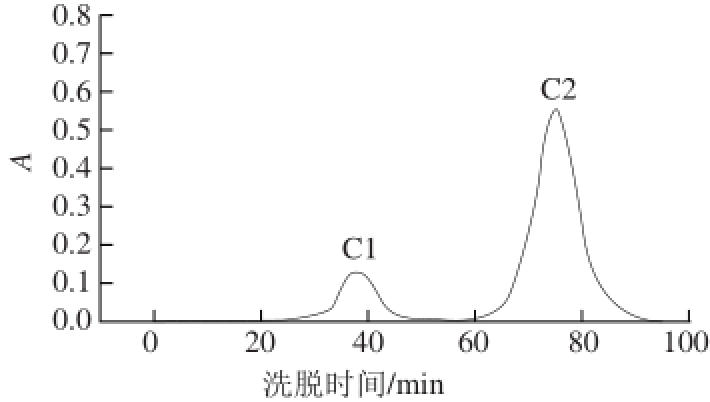
图 4 Sephadex G-15对组分B3的分离图谱
Fig. 4 Chromatogram of B3 separated on Sephadex G-15
利用Sephadex G-15进一步分离组分B3,得到2 个组分C1和C2(图4)。由图5可知,C2的ACE抑制率显著高于其他组分(P<0.01),可能是因为C2的分子质量比C1小,因此含有更多的具有抑制活性的肽。经过Sephadex G-15分离纯化后,ACE抑制肽的抑制活性得到大幅度提升。组分C2的抑制率达到91.6%,比活力高达352.3 %/mg。因此,选择组分C2进行下一步纯化。

图 5 Sephadex G-15分离组分活性比较
Fig. 5 ACE-inhibitory activity of each fraction separated on Sephadex G-15
2.4 红松仁ACE抑制肽的RP-HPLC分离
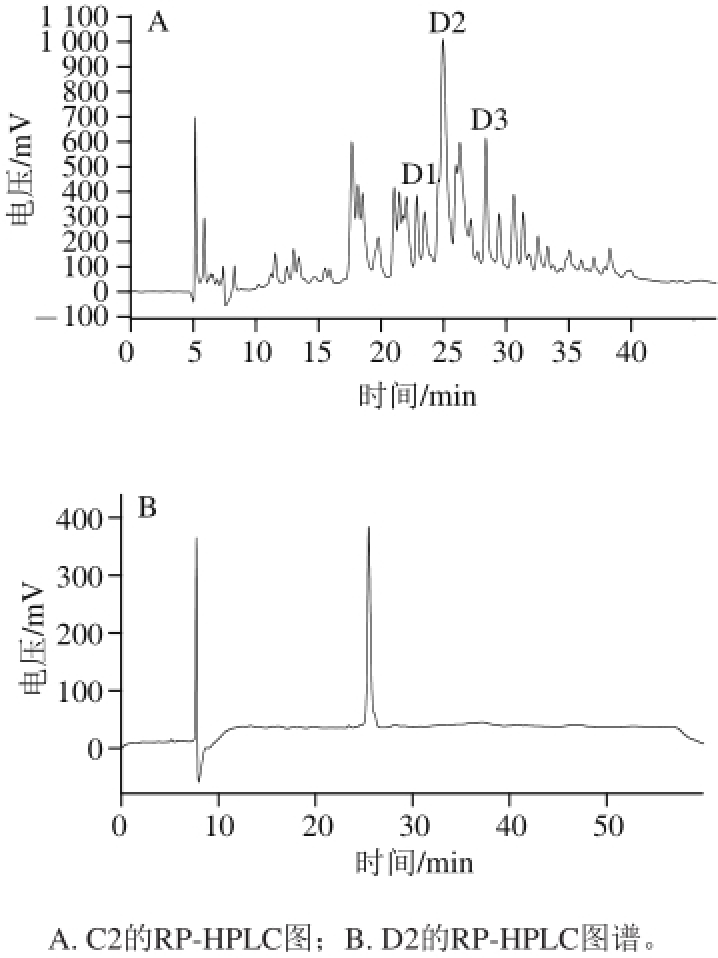
图 6 组分C2和D2的RP-HPLC
Fig. 6 Reverse-phase high performance liquid chromatography of fraction C2 and D2
组分C2经RP-HPLC分离后得到的色谱图如图6A所示。C2仍非单一组分,重复收集3 个主要组分峰,分别命名为D1、D2和D3,浓缩并冷冻干燥。对峰D2进行RP-HPLC验证(图6B),可知D2组分为单一纯品。
2.5 红松仁ACE抑制肽的质谱鉴定和分析
组分D2进行ESI-MS/MS分析。经过一级MS和二级MS(图7),获得片段的质荷比(m/z),通过从头测序(de novo sequence)的方法 [26],对D2进行分析,结果得到一个具有很高ACE抑制活性的多肽,氨基酸序列为Tyr-Leu-Leu-Lys(YLLK),分子质量为535.34 D。
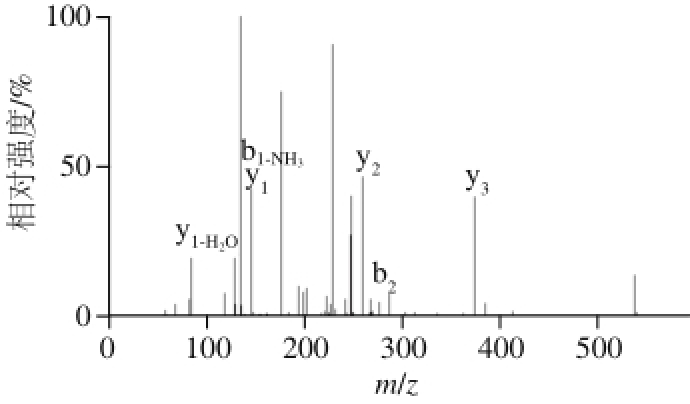
图 7 YLLK的二级质谱图
Fig. 7 Tandem mass spectrum of YLLK
2.6 红松仁ACE抑制肽的活性验证
在得到松仁ACE抑制肽的氨基酸序列后,通过合成得到大量的松仁ACE抑制肽,其纯度达到99.80%。YLLK的IC 50值测定结果为0.282 5 μmol/L。
本研究从长白山红松仁中得到的ACE抑制肽序列Tyr-Leu-Leu-Lys(YLLK)与以前报道的已知氨基酸序列的活性多肽进行比较分析,可推断其潜在ACE抑制活性 [27]。大多数鉴定出的多肽序列中均包含了潜在的ACE抑制肽。YLLK含有4 个氨基酸,分子质量为535.34 D,这与目前已报道的ACE抑制肽的分子质量的范围在300~1 600 D相符,分子质量较大的多肽可能是由于其分子结构决定了它不能和ACE的活性位点有效结合。迄今为止,ACE抑制肽的活性与结构之间的关系尚不明确。不同的ACE抑制肽的结构,如三肽序列的C-末端能与ACE产生强烈的结合 [28];ACE抑制肽支链的N-末端可以有效增强对ACE的抑制活性 [29]。研究发现,在具有较强的ACE抑制活性的肽中C-末端氨基酸残基多为Pro、Tyr、Phe、Leu和Trp,C-末端氨基酸比N-末端氨基酸对ACE抑制活性的影响更大 [30]。多肽YLLK的C-末端氨基酸均为Tyr,因此其ACE抑制活性很高,IC 50值为0.282 5 μmol/L。本研究可为松仁蛋白的开发和高附加值利用提供实验依据,同时也可为安全有效无副作用降血压肽的开发提供研究基础。
本研究通过酶解松仁清蛋白获得高ACE抑制率的酶解产物,接着利用超滤系统、Sephadex G-25、Sephadex G-15和RT-HPLC分离纯化得到组分D1、D2、D3。组分D2进行结构鉴定,最终鉴定出氨基酸序列为Tyr-Leu-Leu-Lys的ACE抑制肽,分子质量535.34 kD。该肽经固相合成纯度为99.80%,IC 50值测定结果为0.282 5 μmol/L。本研究可为长白山红松资源的深度开发和综合利用提供基础数据和科学参考。
参考文献:
[1] 冷帅辰, 闵伟红, 吴丹. 长白山松子抗氧化肽制备及活性研究[J]. 食品研究与开发, 2014, 35(13): 9-12. DOI:10.3969/ j.issn.1005-6521.2014.13.003
[2] 王延群. 果中仙品话松子[J]. 开卷有益: 求医问药, 2016(2): 65-66. DOI:10.3969/j.issn.1007-2950.2016.02.050.
[3] 李景彤. 红松松仁油微胶囊的制备及生理功能研究[D]. 哈尔滨: 哈尔滨工业大学, 2015: 1-3.
[4] PRAKASH A, ZHU X M. Scaled-up production of zero-trans margarine fat using pine nut oil and palm stearin[J]. Food Chemistry, 2010, 119: 1332-1338. DOI:10.1016/j.foodchem.2009.09.009.
[5] KIM Y M, KIM S, HAN T U, et al. Pyrolysis reaction characteristics of Korean pine (Pinus koraiensis) nut shell[J]. Journal of Analytical and Applied Pyrolysis, 2014, 110(1): 435-441. DOI:10.1016/ j.jaap.2014.10.013.
[6] BYUNG H K, CASIMIR C A. Recent research trends on the enzymatic synthesis of structured lipids[J]. Journal of Food Science, 2015, 80(8): C1713-C1714. DOI:10.1111/1750-3841.12953.
[7] 肖丽, 应铁进, 蔡路昀, 等. 巴西松子中蛋白酶的分离纯化及酶学性质[J]. 食品科学, 2013, 34(1): 239-240.
[8] 王新蕾. 常用降压药的不良反应[J]. 中西医结合心血管病电子杂志, 2014, 2(13): 197-198. DOI:10.16282/j.cnki.cn11-9336/r.2014.13.073.
[9] WU D, MIN W H, LIU J S, et al. Functional properties of the protein isolate and major fractions of pine nut proteins prepared from the Changbai Mountain in China[J]. Advanced Materials Research, 2014, 881/882/883: 766-775. DOI:10.4028/www.scientific.net/AMR.881-883.766.
[10] 吴丹, 刘春雷, 闵伟红. 长白山松子降血压肽制备工艺优化[J]. 食品研究与开发, 2015, 36(16): 97-100. DOI:10.3969/j.issn.1005-6521.2015.16.024.
[11] CÁRCEL L M , BON J, ACUÑA L, et al. Moisture dependence on mechanical properties of pine nuts from Pinus pinea L.[J]. Journal of Food Engineering, 2012, 110(2): 294-297. DOI:10.1016/ j.jfoodeng.2011.04.018.
[12] PAN D D, CAO J X, GUO H Q. Studies on purification and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J]. Food Chemistry, 2012, 130: 121-126. DOI:10.1016/j.foodchem.2011.07.011.
[13] ALEMÁN A, GÓMEZ-GUILlÉN M C, MONTERO P. Identif i cation of Ace-inhibitory peptides from squid skin collagen after in vitro gastrointestinal digestion[J]. Food Research International, 2013, 54: 790-795. DOI:10.1016/j.foodres.2013.08.027.
[14] 段练. 常用降压药物的不良反应研究进展[J]. 世界中西医结合杂志, 2014, 9(11): 1247-1251. DOI:10.13935/j.cnki.sjzx.141135.
[15] RAO S Q, SUN J, LIU Y T, et al. ACE inhibitory peptides and antioxidant peptides derived from in vitro digestion hydrolysate of hen egg white lysozyme[J]. Food Chemistry, 2012, 135: 1245-1252. DOI:10.1016/j.foodchem.2012.05.059.
[16] LIU Y, ZHAO G L, REN J Y, et al. Effect of denaturation during extraction on the conformational and functional properties of peanut protein isolate[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 375-380. DOI:10.1016/j.ifset.2011.01.012.
[17] 吴琼英, 杜金娟, 徐金玲, 等. 蚕蛹源ACE抑制肽的分离纯化与结构研究[J]. 食品科学, 2013, 34(23): 119-120. DOI:10.7506/spkx1002-6630-201323025.
[18] 杨冬, 杨秋萍, 黄艳玲, 等. 大豆乳清废水超滤条件研究[J]. 大豆科技, 2012(6): 38-41.
[19] 赵春燕, 康素花, 荣向华, 等. 凝胶层析分离纯化乳酸菌菌体蛋白条件的优化[J]. 食品研究与开发, 2016, 37(22): 47-50.
[20] ALEMÁN A, GÓMEZ-GUILLÉN M C, MONTERO P, et al. Identif i cation of Ace-inhibitory peptides from squid skin collagen after in vitro gastrointestinal digestion[J]. Food Research International, 2013, 54: 790-795. DOI:10.1016/j.foodres.2013.08.027.
[21] CHEN N, YANG H M, SUN Y, et al. Purif i cation and identif i cation of antioxidant peptides from walnut (Juglans regia L.) protein hydrolysates[J]. Peptides, 2012, 38: 344-349. DOI:10.1016/ j.peptides.2012.09.017.
[22] JIA J Q, WU Q Y, YAN H, et al. Purif i cation and molecular docking study of a novel angiotensin-I converting enzyme (ACE) inhibitory peptide from alcalase hydrolysate of ultrasonic-pretreated silkworm pupa (Bombyx mori) protein[J]. Process Biochemistry, 2015, 50: 876-883. DOI:10.1016/j.procbio.2014.12.030.
[23] RAFIK B, ALI B, ASSAÂD S, et al. Nine novel angiotensin I-converting enzyme (ACE) inhibitory peptides from cuttlef i sh (Sepia off i cinalis) muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J]. Food Chemistry, 2015, 170: 519-525. DOI:10.1016/j.foodchem.2013.03.091.
[24] de SOUZA E C, COIMBRA J S D R, de OLIVEIRA E B, et al. Recovery of casein-derived peptides with in vitro inhibitory activity of andiotensin converting enzyme (ACE) using aqueous twophase systems[J]. Journal of Chromatography B, 2014, 973: 84-88. DOI:10.1016/j.jchromb.2014.10.014.
[25] ASTAFIEVA A A, ENYENIHI A A, ROGOZHIN E A, et al. Novel proline-hydroxyproline glycopeptides from the dandelion (Taraxacum officinale Wigg.) flowers: de novo sequencing and biological activity[J]. Plant Science, 2015, 238: 328-329. DOI:10.1016/ j.plantsci.2015.07.002.
[26] SHARMA S, SINGH R, RANA S. Bioactive peptides: a review[J]. International Journal Bioautomation, 2011, 15(4): 223-250.
[27] LIANG R, ZHANG M S, LIN S Y. Recombinant expression of bioactive peptides: a review[J]. Advanced Materials Research, 2014, 881/882/883: 331-334.
[28] KIM S R, BYUN H G. The novel angiotensin I converting enzyme inhibitory peptide from rainbow trout muscle hydrolysate[J]. Fisheries and Aquatic Sciences, 2012, 15(3): 183-190. DOI:10.5657/ FAS.2012.0183.
[29] 杨湘华, 李江. 食源性降血压肽构效关系与制备研究进展[J]. 食品研究与开发, 2016, 37(3): 217-220. DOI:10.3969/j.issn.1005-6521.2016.03.054.
[30] TOOPCHAM T, ROYTRAKUL S, YONGSAWATDIGUL J. Characterization and identif i cation of angiotensin I-converting enzyme (ACE) inhibitory peptides derived from tilapia using Virgibacillus halodenitrif i cans SK1-3-7 proteinases[J]. Journal of Functional Food, 2015, 14: 441-443. DOI:10.1016/j.jff.2015.01.050.
Isolation, Purif i cation and Structural Analysis of ACE Inhibitory Peptides Derived from Red Pine (Pinus koraiensis Sieb. et Zucc.) Nuts Albumin
MIAO Xinyu, WANG Zuhao, WANG Peng, FANG Li, WANG Ji, MIN Weihong
*
(National Engineering Laboratory on Wheat and Corn Further Processing, College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:In this study, the composition and structural characteristics of angiotensin converting enzyme (ACE) inhibitory peptides derived from albumin extracted from red pine nuts were evaluated. The hydrolysate of albumin was separated by ultrafiltration, Sephadex G-25, Sephadex G-15 and reversed-phase high-performance liquid chromatography (RPHPLC). The structural characteristics of the purif i ed fraction (D2) were identif i ed by electrospray ionization tandem mass spectrometry (ESI-MS/MS), and one ACE inhibitory peptide was obtained with amino acid sequence of Tyr-Leu-Leu-Lys (YLLK) and molecular mass of 535.34 D. According to the amino acid sequence, an ACE inhibitory peptide was synthesized with a purity of 99.8%. The half maximal inhibitory concentration value of YLLK was 0.282 5 μmol/L.
Key words:red pine nut albumin; ACE inhibitory peptide; isolation and purif i cation; amino acid sequence
DOI:10.7506/spkx1002-6630-201705021
中图分类号:TS255.6
文献标志码:A
文章编号:1002-6630(2017)05-0129-05
引文格式:
苗欣宇, 王祖浩, 王鹏, 等. 红松仁清蛋白ACE抑制肽的分离纯化与结构鉴定[J]. 食品科学, 2017, 38(5): 129-133.
DOI:10.7506/spkx1002-6630-201705021. http://www.spkx.net.cn
MIAO Xinyu, WANG Zuhao, WANG Peng, et al. Isolation, purif i cation and structural analysis of ace inhibitory peptides derived from red pine (Pinus koraiensis Sieb. et Zucc.) nuts albumin[J]. Food Science, 2017, 38(5): 129-133. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705021. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102206)
作者简介:苗欣宇(1991—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:miaoxinyu911204@qq.com
*通信作者:闵伟红(1971—),女,教授,博士,研究方向为发酵工程、粮油科学与深加工技术。E-mail:minwh2000@162.com