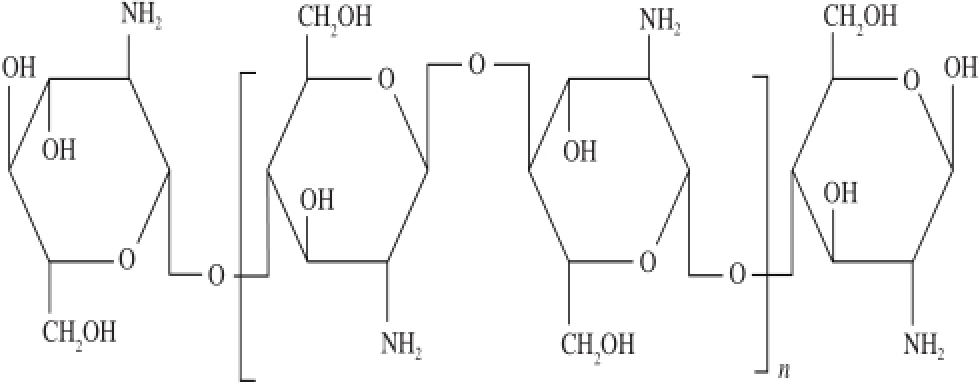
图 1 壳聚糖的结构式
Fig. 1 Structural formula of chitosan
崔文慧,郭 芹,李庆鹏,靳 婧,哈益明 *
(中国农业科学院农产品加工研究所,农业部农产品加工与质量控制重点实验室,北京 100193)
摘 要:将壳聚糖进行酰化改性制得壳聚糖-柠檬酸,测定其重均分子质量及水溶性,然后利用傅里叶变换红外光谱仪、扫描电子显微镜、热重分析仪、X-射线衍射仪及核磁共振仪对其进行结构表征,确证酰化反应的发生,并且探讨壳聚糖和壳聚糖-柠檬酸对重金属镉离子的吸附效果及对羟自由基和1,1-二苯基-2-三硝基苯肼自由基的清除效果。结果表明,与壳聚糖相比,壳聚糖-柠檬酸的重均分子质量和水溶性都明显增加;结构表征直接或间接证明壳聚糖与柠檬酸发生酰化反应,结构差异导致性质差异;壳聚糖-柠檬酸对重金属镉离子的吸附效果及对自由基的清除能力均优于壳聚糖。该研究为壳聚糖及其衍生物在实际中的进一步应用提供了一定的研究依据。
关键词:壳聚糖;壳聚糖-柠檬酸;结构性质;功能性质
工业化进程的加快虽推动了经济和社会的发展,但同时也带来了环境污染,尤其是重金属污染。重金属污染指由重金属及其化合物造成的污染 [1]。常见的重金属主要有铅、镉、汞、砷和铬等,其中镉在工业中应用较为广泛,主要用于电池、冶炼、采矿、化工、电镀和染料,这些过程中会产生大量含镉污染物 [2-3]。一般条件下,它们的性质比较稳定,不易分解 [4]。当这些含镉污染物排放到环境中会污染土壤及地表水,进而通过食物链进入人体,长期蓄积至一定量,可导致人的肾脏及肝脏等器官发生病变,还可能引发骨痛病,甚至影响下一代的健康 [3-4]。1955年日本富士山发生的骨痛病事件就是由于人们长期饮用被镉污染的水及食用被镉污染的粮食所致 [5]。目前,国内外常见的重金属污染物处理方法主要包括化学法(化学还原法、化学沉淀法和电解法等)、生物化学法(植物修复法和生物絮凝法)和物理化学法(膜分离法、离子交换法和吸附法等) [6-11]。化学还原法常用于预处理阶段;化学沉淀法处理过程中会使用大量的化学试剂,易形成二次污染;电解法操作方便、无二次污染,但成本较高。植物修复法目前技术条件还不成熟;生物絮凝法处理效果较差。膜分离法分离效率高,但膜易被污染使得处理费用增加;离子交换法高效方便,但选择一个交换性能好的离子交换树脂较难;吸附法因其易于操作、处理效果好、成本低、二次污染小而应用广泛 [6-11]。常用的吸附剂有活性炭、壳聚糖(chitosan,CTS)和纤维素等,壳聚糖因其良好的生物可降解性、资源丰富和吸附性好等特点,常用于重金属离子的吸附 [12]。

图 1 壳聚糖的结构式
Fig. 1 Structural formula of chitosan
壳聚糖是由单体2-氨基-2-脱氧-β-D-葡萄糖通过β-1,4糖苷键连接而成,由结构式(图1)看出,分子中含有大量的氨基和羟基,这些基团中存在孤对电子,与重金属离子可形成稳定的螯合物 [13-14]。但壳聚糖仅溶于稀酸溶液,在酸性条件下,壳聚糖C 2位上的—NH 2易形成—NH 3
+,不利于对重金属离子的吸附,使得吸附效果差,限制了它的应用 [15]。但壳聚糖分子中的氨基和羟基具有一定的活性,可通过化学改性方法引入新的基团改善壳聚糖本身的不足 [16-18]。目前,已有很多壳聚糖改性产物应用于重金属离子的吸附研究,但有关壳聚糖-柠檬酸(chitosan-citric acid,CTS-CA)对重金属镉离子的吸附研究鲜有报道。本实验主要研究本实验室制备的壳聚糖-柠檬酸对重金属镉离子的吸附效果,并与壳聚糖比较,探讨对重金属镉离子的吸附机理。同时初步研究壳聚糖及壳聚糖-柠檬酸对羟自由基和1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基的清除效果,为壳聚糖及其衍生物在实际中的应用提供了一定的研究依据。
1.1 材料与试剂
壳聚糖(食品级,线性电位滴定法测定其脱乙酰度为84.40%,十八角度激光光散色仪测定其重均分子质量为261 000 D) 上海西宝生物科技有限公司;柠檬酸、次亚磷酸钠和冰乙酸(优级纯) 国药集团化学试剂有限公司;无水乙酸钠、叠氮化钠(均为优级纯)上海Aladdin试剂有限公司;葡聚糖(优级纯,其相对分子质量为40 000)、DPPH 德国Sigma公司;无水乙醇、溴化钾、硫酸亚铁、水杨酸、70%浓硝酸和30%双氧水北京化工厂;重金属镉片 上海金山亭新化工试剂厂;70%浓硝酸(BV-Ⅲ级)、30%过氧化氢(BV-Ⅲ级)北京化学试剂研究所;实验室用水为超纯水;试剂除特殊说明外均为分析纯。
1.2 仪器与设备
YP1407033电子天平 上海佑科仪器仪表有限公司;CP 213电子天平 奥豪斯仪器上海有限公司;DGG-9140A电热恒温鼓风干燥箱 武汉利辉环境检测设备有限公司;SHZ-D(Ⅲ)循环水式真空泵 河南省巩义市予华仪器有限责任公司;SHB-Ⅲ 循环水式真空泵 郑州长城科工贸有限公司;FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;DAWN HELEOS Ⅱ 激光光散色仪 美国Wyatt技术公司;769YP-15A粉末压片机 天津市科器高新技术公司;Tensor 37傅里叶变换红外光谱仪、400核磁共振谱仪 德国Bruker仪器公司;Quanta 200-FEG场发射环境扫描电子显微镜 美国FEI仪器公司;Pyris-115热重分析仪 美国Perkin Elmer仪器公司;Dmax/2400 X-衍射仪 日本Rigaku仪器公司;Neofuge 15R台式高速冷冻离心机 上海力申科学仪器有限公司;MARS 240/50 CEM密闭微波消解系统美国Matthews公司;7700电感耦合等离子质谱仪 美国Agilent公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 壳聚糖-柠檬酸的制备
称取一定量的柠檬酸和次亚磷酸钠(柠檬酸与次亚磷酸钠的摩尔质量比为10∶1)置于50 mL耐压瓶中,向其中加入30 g蒸馏水,待它们完全溶解后摇匀;再称取1.50 g壳聚糖,少量多次加入耐压瓶中,完全溶解后混匀;将其置于110 ℃条件下反应3 h后,冷却至室温;用85%乙醇沉淀、洗涤并抽滤,收集滤饼于培养皿中;将滤饼于-50 ℃条件下真空冷冻干燥36 h,取出后称质量、研磨粉碎,得到壳聚糖-柠檬酸产物于干燥器中保存备用。
1.3.2 壳聚糖-柠檬酸重均分子质量测定及水溶性定性分析
使用十八角度激光光散色仪对壳聚糖-柠檬酸重均分子质量进行测定 [19],将样品用流动相(pH 4.50的0.10 mol/L的醋酸和醋酸钠缓冲溶液,其中含0.20‰的叠氮化钠)溶解,配制成质量浓度为1 mg/mL的溶液。进样前,样品溶液用0.45 μm滤膜过滤,进样量为200 μL,流速为0.50 mL/min。葡聚糖为重均分子质量测定的标准品,其相对分子质量为40 000,壳聚糖-柠檬酸的重均分子质量以葡聚糖的相对分子质量为基准计算得出。
分别称取0.10 g的壳聚糖及壳聚糖-柠檬酸置于试管中,向其中加入10 mL蒸馏水,振荡后静置片刻,观察溶液的透明度及试管底部沉积物质的量,据此定性判断物质的水溶性。若溶液呈现透明状,且试管底部无沉积物质,说明该物质水溶性好;反之,水溶性差。
1.3.3 结构表征
红外分析采用Tensor 37红外光谱仪,KBr压片法测定 [20],扫描范围400~4 000 cm -1;电子显微镜分析采用Quanta 200-FEG场发射环境扫描电子显微镜测定 [20],测定电压6 kV;热重(thermogravimetric,TG)分析采用Pyris-115热重分析仪测定 [19],测定条件:试样量1.5~2.0 mg,N 2流速50 mL/min,升温速率10 ℃/min,扫描温度范围40~550 ℃;X-射线衍射分析采用Dmax/2400 X-衍射仪测定 [21],测定条件:Cu-Kα辐射源,滤波物质Ni,管压40 kV,管流100 mA,扫描速率6°/min,扫描2θ范围5°~60°; 13C核磁谱图使用400固体核磁共振图谱仪于室温条件下进行测定 [21],共振频率为100 MHz。
1.3.4 重金属镉离子吸附实验
分别对样品做不同的处理:称取0.10 g壳聚糖和壳聚糖-柠檬酸置于50 mL质量浓度为25 μg/L镉离子溶液中,搅拌均匀,分别用盐酸或NaOH调至pH值为3~10,振荡8 h;称取0.10~0.60 g壳聚糖和壳聚糖-柠檬酸置于50 mL质量浓度为25 μg/L镉离子溶液中,搅拌均匀,用NaOH调至pH值为7,振荡8 h;称取0.10 g壳聚糖和壳聚糖-柠檬酸置于50 mL质量浓度为25 μg/L镉离子溶液中,搅拌均匀,用NaOH调至pH值为7,振荡2~12 h。然后将处理后的样品溶液在4 ℃、4 000 r/min离心10 min。分别取1 mL上清液于消解管中,加入6 mL浓硝酸(体积分数70%)预消解1 h,再加2 mL过氧化氢(30%)反应30 min,排气,然后混匀置于微波消解炉中消解,冷却至室温,用超纯水定容至100 g,最后用电感耦合离子体-质谱仪测定溶液中剩余的镉离子浓度。电感耦合离子体-质谱测定条件如下:高频入射功率1550 W,雾化室温度2 ℃,载气流速1.07 L/min,蠕动泵速率0.10 r/s,透镜电压10.20 V,积分时间0.10 s,采样周期0.31 s,扫描次数3 次。
1.3.5 羟自由基清除率的测定
测定壳聚糖和壳聚糖-柠檬酸的羟自由基清除率,参考Liu Jun等 [22]的方法并稍做修改。壳聚糖及壳聚糖-柠檬酸样液用1%醋酸溶液配制,取1 mL样液(0.20~1.60 mg/mL)于试管中,分别加入9 mmol的硫酸亚铁1 mL、9 mmol的水杨酸-乙醇溶液0.50 mL和0.15%的过氧化氢1 mL,混合均匀,置于37 ℃水浴中保温30 min,未加硫酸亚铁和未加样品作为空白对照组,紫外分光光度计于510 nm波长处测定吸光度,根据公式(1)计算羟自由基清除率。
式中:A 1为加有硫酸亚铁未加样品组的吸光度;A 2为加有硫酸亚铁且加有样品组的吸光度。
1.3.6 DPPH自由基清除率的测定
测定壳聚糖和壳聚糖-柠檬酸的DPPH自由基清除率,参考Shimada等 [23]的方法并稍做修改。壳聚糖及壳聚糖-柠檬酸样液用1%醋酸溶液配制,2 mL的0.10 mmol的DPPH乙醇溶液与1~6 mL样液(1.80 mg/mL)于试管中混匀,置于25 ℃水浴中保温30 min,未加DPPH和未加样品作为空白对照组,紫外分光光度计于517 nm波长处测定吸光度,根据公式(2)计算DPPH自由基清除率。
式中:A 3为加DPPH未加样品组的溶液吸光度;A 4为加DPPH且加有样品组的溶液吸光度。
2.1 壳聚糖-柠檬酸重均分子质量及水溶性定性分析
通过测定得知,壳聚糖-柠檬酸的重均分子质量(M W)为529 000 D(图2a)。壳聚糖与壳聚糖-柠檬酸在水中的溶解性见图2b,可明显看出,壳聚糖在试管底部的沉积量很多,溶液呈现非均匀透明状,说明它在水中几乎不溶解;而壳聚糖-柠檬酸在水中形成均匀透明溶液,试管底部无沉积物出现,说明壳聚糖-柠檬酸在水中的溶解性远远好于壳聚糖在水中的溶解性。初步判定是因为壳聚糖与柠檬酸发生酰化反应后,一方面壳聚糖分子中引入了亲水基团羧基,另一方面破坏了壳聚糖分子中原有的分子间及分子内氢键,所以壳聚糖-柠檬酸产物的水溶性优于壳聚糖的水溶性。
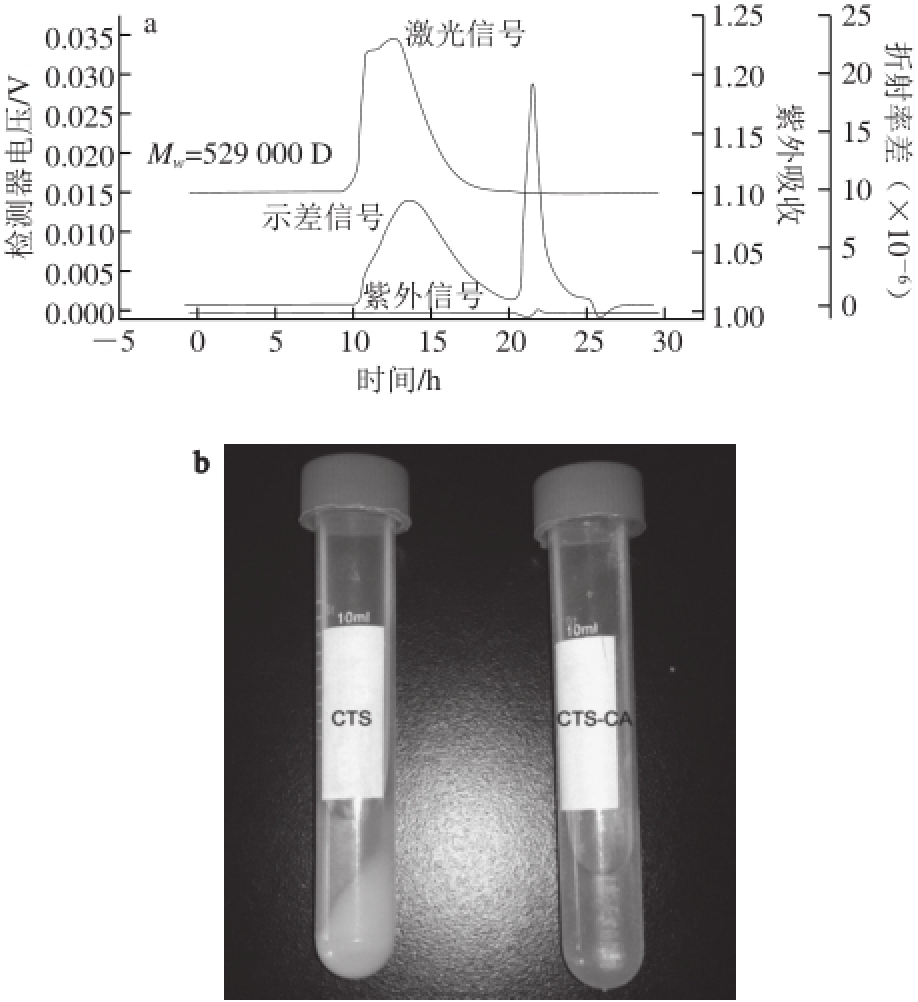
图 2 壳聚糖-柠檬酸的重均分子质量(a)及水溶性(b)图
Fig. 2 Weight-average molar mass and water solubility of chitosan-citric acid complex
2.2 壳聚糖和壳聚糖-柠檬酸的红外光谱分析
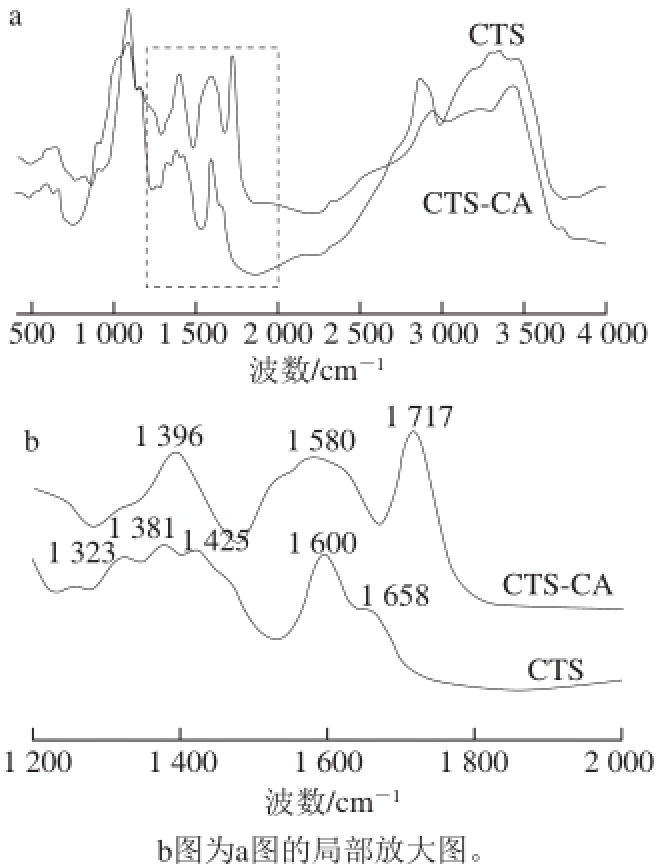
图 3 壳聚糖和壳聚糖-柠檬酸红外光谱图
Fig. 3 Infrared spectra of chitosan and chitosan-citric acid complex
从图3分析可知,壳聚糖红外谱图中1 323 cm -1为N—H对称伸缩振动,1 381 cm -1为N—H面内弯曲振动,1 425 cm -1为C—N伸缩振动,1 600 cm -1为氨基中N—H弯曲振动,1 658 cm -1为NH 2变角振动 [17]。而壳聚糖-柠檬酸红外谱图中1 717 cm -1处出现一个新的吸收峰,该吸收峰为柠檬酸羧基中C=O的吸收峰,壳聚糖在1 600 cm -1处的吸收峰在壳聚糖-柠檬酸中峰形展宽至1 473~1 673 cm -1,为新形成的酰胺键(1 650~ 1 635 cm -1仲酰胺C=O伸缩振动,1 535~1 560 cm -1为仲酰胺N—H面内弯曲振动)的吸收峰,而1 396 cm -1处吸收峰为羧酸中C—OH面内弯曲振动 [24]。据上述分析判定壳聚糖和柠檬酸发生了酰化反应,壳聚糖中C 2位氨基转化为酰胺键,分子中引入了羧基(—COOH)基团,分子间及分子内氢键被破坏。
2.3 壳聚糖和壳聚糖-柠檬酸的电子扫描电子显微镜分析由图4可知,壳聚糖与壳聚糖-柠檬酸分子表面结构形态存在显著差异,壳聚糖分子粒径较大,结构平滑紧密;而壳聚糖-柠檬酸分子粒径较小,结构疏松多孔。也正是由于壳聚糖-柠檬酸这种疏松多孔的结构,更利于水分子地进入,增大它的水溶性,从分子水平解释了2.1节结论,即壳聚糖在水中形成单一均匀透明的溶液,水溶性较好。同时也间接证明壳聚糖与柠檬酸确实发生了酰化反应。

2.4 壳聚糖和壳聚糖-柠檬酸的热重分析
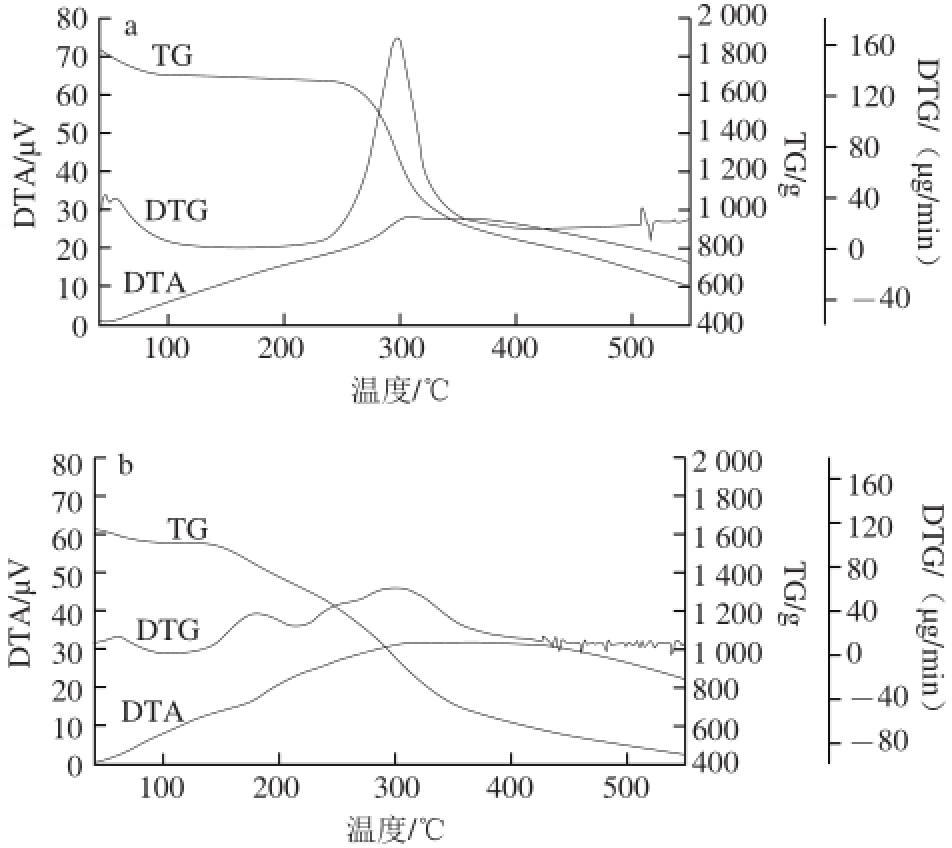
图 5 壳聚糖(a)和壳聚糖-柠檬酸(b)热重分析图
Fig. 5 Thermogravimetric analysis of chitosan (a) and chitosan-citric acid complex (b)
壳聚糖和壳聚糖-柠檬酸的热重分析结果如图5所示。壳聚糖(图5a)与壳聚糖-柠檬酸(图5b)的差热分析(differential thermal analysis,DTA)曲线表明,二者在300 ℃左右有一个放热过程,分析可能是由于物质晶形的转变(物理变化)或者是物质的分解(化学变化)造成的。TG和TG微分(derivative thermogravimetric,DTG)曲线用于说明壳聚糖及壳聚糖-柠檬酸的热稳定性,其中TG曲线表明物质质量随温度的变化,而DTG曲线是TG曲线的一阶导数,表示物质质量损失共有几个阶段(一个峰代表一个质量损失阶段)。壳聚糖DTG曲线表明(图5a)其主要质量损失只有一个阶段,初始分解温度为239.50 ℃,主要为壳聚糖主链糖苷键的断裂,在这一阶段当温度为297.10 ℃时最大质量损失速率为165 μg/min;而壳聚糖-柠檬酸DTG曲线表明(图5b)其主要质量损失分为3 个阶段,初始分解温度为129.80 ℃,其热稳定性不如壳聚糖,第1阶段温度为177.60 ℃时最大质量损失速率为39.10 μg/min,主要为改性后产物侧链柠檬酸的断裂,因为柠檬酸的沸点为175 ℃;第2阶段温度为250.10 ℃时最大质量损失速率为48.10 μg/min,主要为壳聚糖与柠檬酸形成的酰胺键的断裂,这也正好说明壳聚糖与柠檬酸发生了酰化反应;第3阶段温度为297.40 ℃时最大质量损失速率为61.60 μg/min,主要为壳聚糖主链糖苷键的断裂。
2.5 壳聚糖和壳聚糖-柠檬酸的X-射线衍射分析
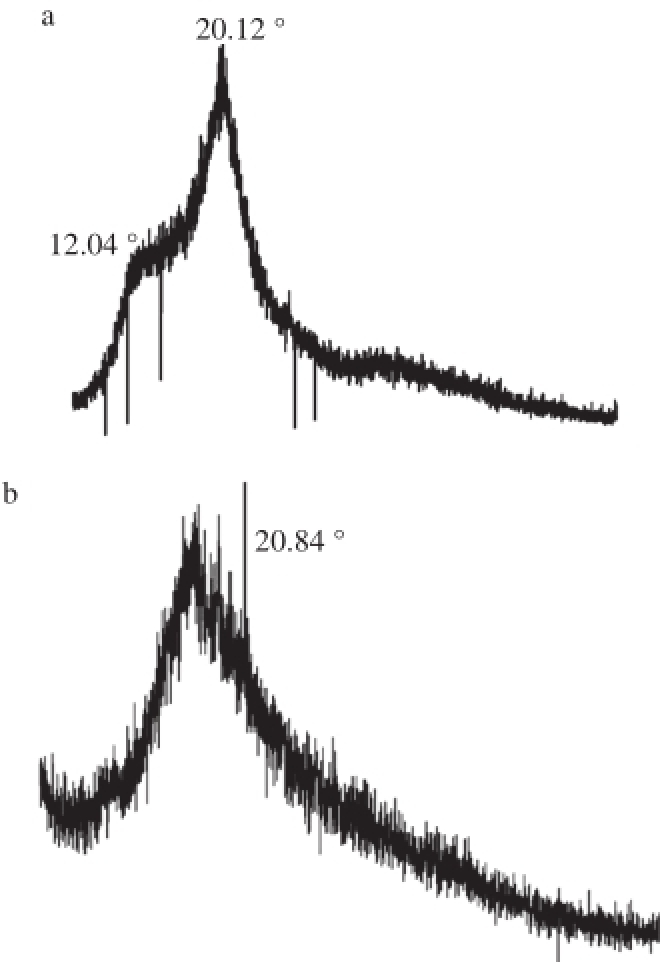
图 6 壳聚糖(a)和壳聚糖-柠檬酸(b)X-射线衍射图
Fig. 6 X-ray diffraction patterns of chitosan (a) and chitosan-citric acid complex (b)
由图6可知,壳聚糖的粉末X-射线衍射图谱表明壳聚糖有2 种不同的晶体形态,在2θ=12.04°处有一个小的衍射吸收峰和2θ=20.12°处有一个主要衍射吸收峰,它们分别为壳聚糖的Form Ⅰ和Form Ⅱ晶形(图6a),这与Krishnapriya等 [12]的研究结果一致。而壳聚糖-柠檬酸仅在2θ=20.84°处有一个明显的展宽的衍射吸收峰,相比于壳聚糖,它在2θ=12.04°处的衍射吸收峰消失(图6b),说明改性后壳聚糖的分子结构发生了变化。原因是改性后的壳聚糖分子C 2位置的氨基转化为酰胺基,破坏了原有分子间及分子内氢键,即晶相被破坏而非晶相相对占大部分,结晶度降低。所以也就解释了壳聚糖-柠檬酸的水溶性优于壳聚糖,因为一般情况下,结晶度越高越不易溶于水。再次间接证明了壳聚糖与柠檬酸发生了酰化反应。
2.6 壳聚糖和壳聚糖-柠檬酸的 13C固体核磁分析
核磁共振是有机物质结构鉴定的一种重要手段,主要是根据物质化学位移δ的吸收峰强度及位置鉴定有机物质的骨架结构,根据一定的化学基础推断出物质分子之间的连接方式。从壳聚糖(图7a)及壳聚糖-柠檬酸(图7b)的固体 13C核磁谱图中可以看出,二者最大的不同在于壳聚糖-柠檬酸(图7b)在化学位移δ=178.48处出现了一个新的吸收峰,分析该吸收峰为壳聚糖-柠檬酸中酰胺键及侧链羧酸中碳的吸收峰,再一次证明了壳聚糖与柠檬酸发生了酰化反应,δ≤100的核磁吸收峰为壳聚糖主链及侧链柠檬酸中碳原子吸收峰。
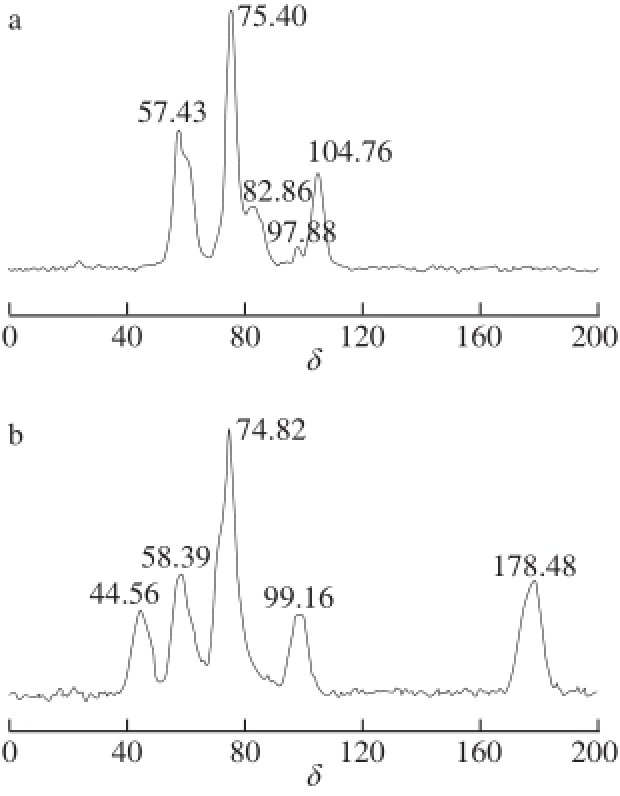
图 7 壳聚糖(a)和壳聚糖-柠檬酸(b)
13C固体核磁谱图
Fig. 7
13C solid nuclear magnetic resonance spectra of chitosan (a) and chitosan-citric acid complex (b)
2.7 壳聚糖和壳聚糖-柠檬酸对镉离子吸附效果分析
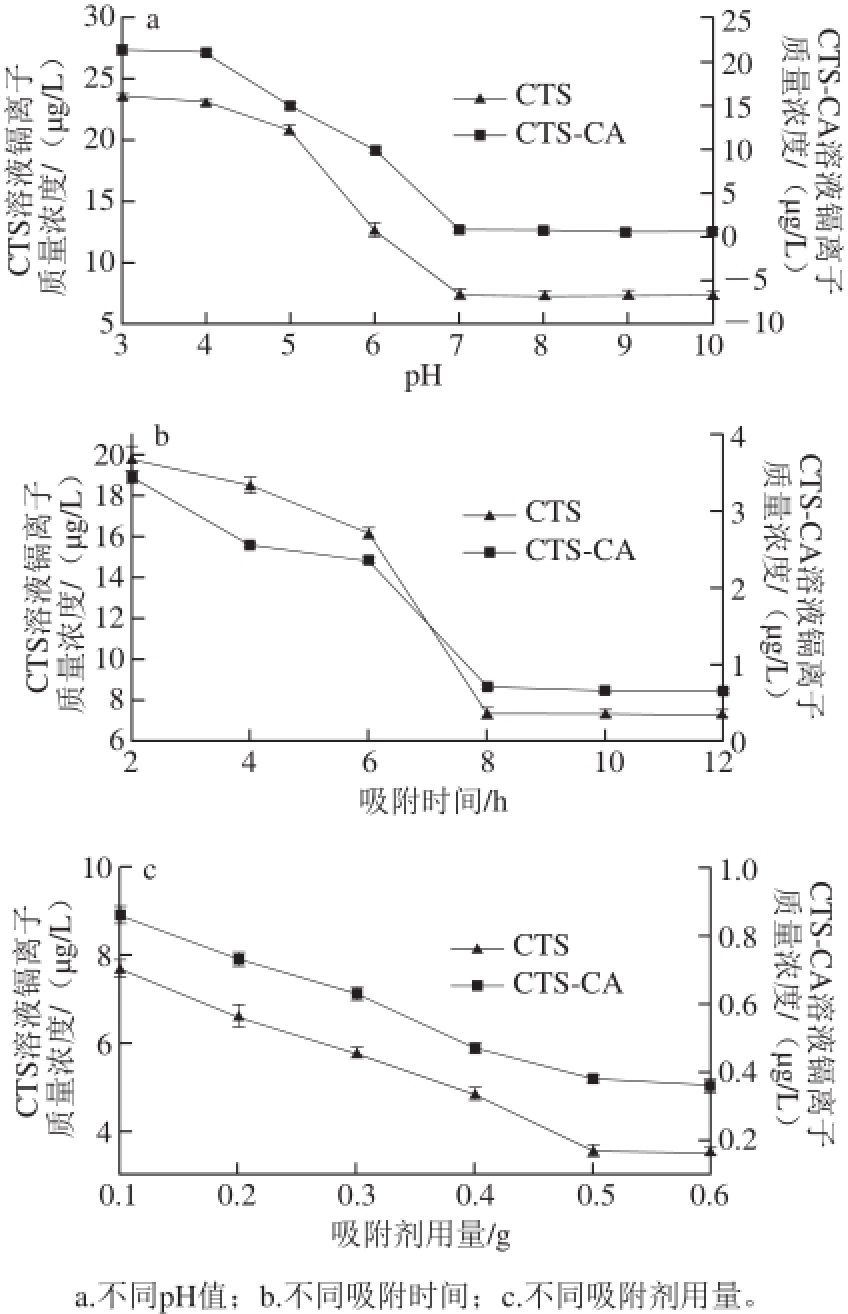
图 8 不同pH值、吸附时间和吸附剂用量条件下壳聚糖和壳聚糖-柠檬酸对镉离子吸附效果图
Fig. 8 Adsorption ef fi ciency of chitosan and chitosan-citric acid complex to cadmium ions under different conditions of pH, time and dose
由图8a可知,壳聚糖和壳聚糖-柠檬酸对重金属镉离子的吸附量都随着pH值的增加先逐渐增大最后基本保持不变,中性及碱性条件下吸附效果较好,且壳聚糖-柠檬酸对重金属镉离子的吸附效果好于壳聚糖。壳聚糖在碱性条件下吸附效果较好,是因为在碱性条件下,C 2位氨基(—NH 2)难于形成NH 3 +质子,易于与镉离子形成稳定的螯合物 [24-27]。壳聚糖-柠檬酸在碱性条件下吸附效果较好于壳聚糖,一方面是因为壳聚糖C 2位氨基(—NH 2)与柠檬酸形成酰胺键(图3、5和7),自然也就无质子化这一说法;另一方面是因为分子中引入了羧基基团(图3、5和7),碱性条件下,羧基中的氢离子被中和形成羧基负离子(—COO -),利于与重金属镉离子结合成稳定的物质(异性电荷相互吸引)。它们的电子扫描电子显微镜图(图4)也很好地解释了这一现象,一般情况下,分子粒径越小,比表面积就越大,且壳聚糖-柠檬酸疏松多孔,所以更有利于对重金属镉离子的吸附。
不同吸附时间条件下壳聚糖及壳聚糖-柠檬酸重金属镉离子的吸附效果如图8b所示,可以看出,随着吸附时间的延长,壳聚糖-柠檬酸和壳聚糖对重金属镉离子的吸附量呈现先增大,吸附时间达到8 h后吸附量基本不变,且壳聚糖-柠檬酸优于壳聚糖对重金属镉离子的吸附。因为初始阶段,溶液中重金属镉离子浓度较大,同时吸附剂表面的吸附位点较多,随着时间的推移,吸附位点已经达到饱和,所以呈现先增加后不变的趋势。
图8c显示的是不同吸附剂用量条件下壳聚糖和壳聚糖-柠檬酸对重金属镉离子的吸附效果,可以看出,壳聚糖-柠檬酸和壳聚糖的用量越大,对重金属镉离子的吸附效果越好,且前者优于后者。因为溶液中重金属镉离子的浓度是一定的,吸附剂用量越大(0.10~0.50 g),说明存在的吸附位点就越多,吸附量自然就大。当用量大于等于0.50 g时基本保持不变,可能是因为吸附位点达到饱和。
2.8 壳聚糖和壳聚糖-柠檬酸的抗氧化性能分析
图9a表明壳聚糖和壳聚糖-柠檬酸对羟自由基都有一定的清除能力,同质量浓度条件下前者的清除能力远比后者差,且二者的清除能力都随着溶液质量浓度的增加而增大。壳聚糖及其衍生物对羟自由基的清除效果主要与其活性基团、分子中氢键及空间位阻等有关 [28-29]。壳聚糖-柠檬酸对羟自由基清除效果优于壳聚糖,是因为前者不仅破坏了壳聚糖分子中原有分子间及分子内氢键,而且引入了活性基团羧基,其中的氢原子能与自由基结合成稳定物质,从而清除羟自由基。
由图9b可知,相同质量浓度条件下,随着壳聚糖和壳聚糖-柠檬酸用量的增加,二者对DPPH自由基的清除能力逐渐增大,后者清除效果略好于前者。壳聚糖及其衍生物对DPPH自由基的清除效果与其活性基团、分子中氢键及空间位阻等有关 [28-29]。当样品用量为4 mL时,壳聚糖-柠檬酸对DPPH自由基的清除率比壳聚糖对DPPH自由基的清除率高5.97%,当样品用量为7 mL时,二者清除DPPH自由基的清除率分别为82.40%和82.68%,仅相差0.28%。
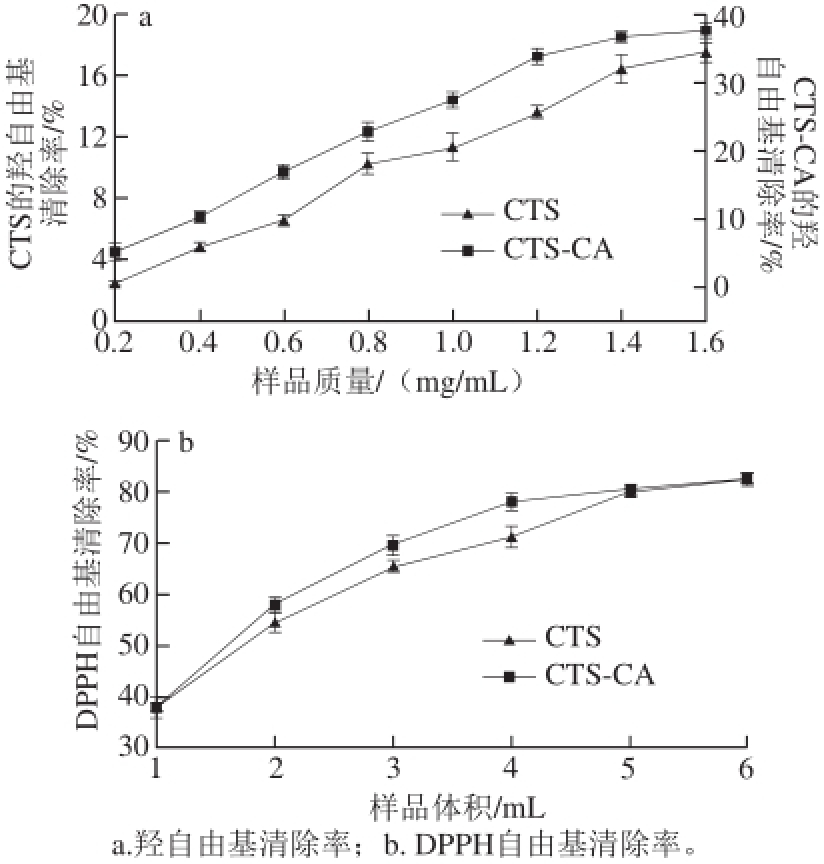
图 9 壳聚糖和壳聚糖-柠檬酸的羟自由基和DPPH自由基清除能力
Fig. 9 Hydroxyl radical scavenging capacity of chitosan and chitosan-citric acid complex
壳聚糖-柠檬酸对DPPH自由基清除效果优于壳聚糖,是因为前者不仅破坏了原有分子间及分子内氢键,而且引入了活性基团羧基,其中的氢原子能与自由基结合成稳定物质,从而清除DPPH自由基,作用机理如图10所示 [30]。
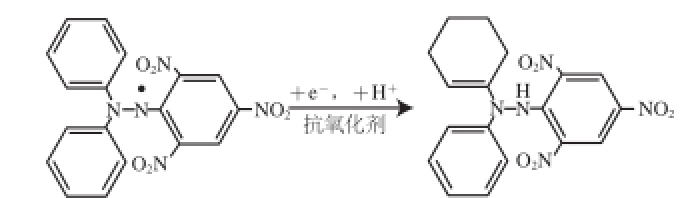
图 10 壳聚糖和壳聚糖-柠檬酸对DPPH自由清除机理图
Fig. 10 DPPH radical scavenging mechanism of chitosan and chitosan-citric acid complex
红外光谱、热重分析及固体核磁图证明壳聚糖与柠檬酸发生酰化反应,形成仲酰胺产物,引入羧基基团;电子扫描电子显微镜图表明壳聚糖-柠檬酸疏松多孔结构比壳聚糖平滑紧密结构更有利于水分子的进入;X-射线衍射图表明壳聚糖-柠檬酸结晶度降低;这些结构表征方法都直接或间接证明壳聚糖发生酰化反应成功制备出壳聚糖-柠檬酸,且结构差异导致水溶性的差异。
壳聚糖及壳聚糖-柠檬酸在不同的pH值、吸附时间及吸附剂用量条件下对重金属镉离子的吸附效果不同,且在相同的条件下,前者对重金属镉离子的吸附效果不如后者,这与壳聚糖改性后结构的变化有密切的关系。二者均在pH值为碱性、吸附时间为8 h及吸附剂用量为0.50 g时对重金属镉离子的吸附效果较好。相同条件下,壳聚糖-柠檬酸对羟自由基和DPPH自由基的清除率好于壳聚糖,这与壳聚糖改性前后结构变化有密切关系。
综上所述,壳聚糖和壳聚糖-柠檬酸性质和结构存在差异,且结构差异导致了性质差异。研究表明改性后的结构差异能够改变壳聚糖对重金属镉离子的吸附效果及清除自由基的能力。因此,可以通过化学改性的方法来改善壳聚糖的性质,扩大其应用的领域和范围,为壳聚糖及其衍生在实际中的应用提供一定的研究参考。
参考文献:
[1] 张方娥. 纤维素-NVP辐射接枝共聚及对重金属、苯酚的吸附研究[D].北京: 中国农业科学院, 2012: 1-3.
[2] 杜丽娜, 余若祯, 王海燕, 等. 重金属污染及其毒性研究进展[J]. 环境与健康杂志, 2013, 30(2): 167-173.
[3] 李桂琴. 工业含镉废水的来源、危害与回收处理[J]. 环境保护科学, 1976(2): 45-47.
[4] 熊佰炼, 崔译霖, 张进忠, 等. 改性甘蔗渣吸附废水中低浓度Cd 2+和Cr 3+的研究[J]. 西南大学学报(自然科学版), 2010, 32(1): 118-123.
[5] 谢黎虹, 许梓荣. 重金属镉对动物及人类的毒性研究进展[J]. 浙江农业学报, 2003, 15(6): 376-381. DOI:10.3696/ j.issn.1004-1524.2003.06.012.
[6] 郭轶琼, 宋丽. 重金属废水污染及其质量技术进展[J]. 广州化工, 2010, 38(4): 18-20.
[7] 付丰连. 物理化学法处理重金属废水的研究进展[J]. 广东化工, 2010, 37(4): 115-117. DOI:10.3696/j.issn.1007-1865.2010.04.056.
[8] 胡海洋. 重金属废水治理技术概括及发展方向[J]. 中国资源综合利用, 2008, 26(2): 22-25.
[9] 程树培, 崔益斌, 杨柳燕. 高絮凝性微生物育种生物技术研究与应用进展[J]. 环境科学进展, 1995, 12(1): 65-69.
[10] 崔亦华, 崔英德, 郭建维, 等. NVP共聚物水凝胶中吸附水的性能研究[J]. 高分子材料科学与工程, 2007, 23(4): 152-154.
[11] 马前, 张小龙. 国内外重金属废水处理新技术的研究进展[J]. 环境工程学报, 2007, 1(7): 10-14.
[12] 李琳, 杨旭. 重金属废水处理技术及其发展方向[J]. 农业与技术, 2010, 30(2): 61-63. DOI:10.3696/j.issn.1671-962X.2010.02.019.
[13] AYTEKIN A O, MORIMURA S, KIDA K. Synthesis of chitosancaffeic acid derivatives and evaluation of their antioxidant activities[J]. Journal of Bioscience and Bioengineering, 2011, 111(2): 212-216. DOI:10.1016/j.jbiosc.2010.09.018.
[14] ZONG Z, KIMURA Y, TAKAHASHI M, et al. Characterization of chemical and solid state structures of acylated chitosans[J]. Polymer, 2000, 41(3): 899-906. DOI:10.1016/S0032-3861(99)00270-0.
[15] KRISHNAPRIYA K R, KANDASWAMY M. A new chitosan biopolymer derivative as metal-complexing agent: synthesis, characterization, and metal(Ⅱ) ion adsorption studies[J]. Carbohydrate Research, 2013, 345(14): 2013-2022. DOI:10.1016/ j.carres.2010.06.005.
[16] CHAKRABORTY S P, SAHU S K, PRAMANIK P, et al. Biocompatibility of Folate-modif i ed chitosan nanoparticles[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(3): 215-219. DOI:10.1016/S2221-1691(12)60044-6.
[17] DUAN W G, SHEN C M, FANG H X, et al. Synthesis of dehydroabietic-modified chitosan and its drug release behavior[J]. Carbohydrate Research, 2009, 344(1): 9-13. DOI:10.1016/ j.carres.2008.08.007.
[18] 林静雯, 高丹, 王小军. 壳聚糖及其衍生物在废水处理中的研究进展[J]. 环境保护科学, 2004, 30(3): 17-19. DOI:10.3696/ j.issn.1004-6216.2004.03.006.
[19] 李咏富. β-环糊精高分子聚合物的制备及其应用[D]. 北京: 中国农业科学院, 2015: 19-21.
[20] 耿乙文. 过氧化氢法制备改性苹果渣膳食纤维及其降脂功能的研究[D]. 北京: 中国农业科学院, 2015: 28-30.
[21] HUANG Xiaoyi, MAO Xiaoyun, BU Huaitian, et al. Chemical modif i cation of chitosan by tetraethylenepentamine and sorption study for anionic dye removal[J]. Carbohydrate Research, 2011, 346(10): 1232-1240.
[22] LIU Jun, JIA Liang, KAN Juan, et al. In vitro and in vivo antioxidant activity of ethanolic extract of white button mushroom (Agaricus biporus)[J]. Food and Chemical Toxicology, 2013, 51: 310-316. DOI:10.1016/j.fct.2012.10.014.
[23] SHIMADA K, FUJIKAWA K, YAHARA K, et al. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 945-948. DOI:10.1021/jf00018a005.
[24] 宋永成. 有机化合物结构鉴定与有机波普学[M]. 2版. 北京: 科学出版社, 2000: 329-332.
[25] SUN S, WANG Q, WANG A. Adsorption properties of Cu(Ⅱ)ions onto N-succinyl-chitosan and crosslinked N-succinyl-chitosan template resin[J]. Biochemical Engineering Journal, 2007, 36(2): 131-138.
[26] TAKU S, HIROSHI K, MIKA N, et al. 6-Amino-6-deoxy-chitosan. Sequential chemical modif i cations at the C-6 positions of N-phthaloylchitosan and evaluaion as a gene carrier[J]. Carbohydrate Research, 2006, 341(14): 2406-2413.
[27] 鲁道荣. 壳聚糖吸附重金属离子Cu(Ⅱ)机理研究[J]. 安徽化工, 1998, 24(4): 29-30.
[28] 吴飞鹏, 龚超群, 蔡继业, 等. 壳聚糖对羟基自由基的清除作用[J]. 激光生物学报, 2009, 18(5): 609-613. DOI:10.3969/ j.issn.1007-7146.2009.05.009.
[29] 张敬晗, 金黎明, 张盼, 等. 壳聚糖及其衍生物清除羟基的能力[J].食品与药品, 2008, 10(7): 23-24.
[30] 银旭红, 孙涛, 姚倩, 等. 低聚壳聚糖Zn(Ⅱ)配合物清除DPPH活性的研究[J]. 食品与生物技术学报, 2009, 28(3): 329-331. DOI:10.3321/ j.issn:1673-1689.2009.03.009.
Comparison of Structural and Functional Properties of Chitosan and Chitosan-Citric Acid Complex
CUI Wenhui, GUO Qin, LI Qingpeng, JIN Jing, HA Yiming
*
(Key Laboratory of Agro-products Processing and Quality Control, Ministry of Agriculture, Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract:Chitosan-citric acid complex was prepared by acylation reaction between chitosan and citric acid, and its weightaverage molar mass and water solubility were determined. Then, the structural characterization was investigated by Fourier transform infrared spectroscopy (FTIR), scanning electron microscopy (SEM), thermogravimetric analysis (TGA), X-ray diffraction (XRD) and nuclear magnetic resonance (NMR) to validate the occurrence of acylation reaction. In addition, we explored the adsorption eff i ciency of chitosan and its complex for cadmium ions and their scavenging capacity against hydroxyl and 2,2-diphenyl-1-picrylhydrazyl (DPPH) free radicals. Results indicated that compared with chitosan, the weightaverage molar mass and water solubility of chitosan-citric acid complex signif i cantly increased. At the same time, structural characterization directly or indirectly proved that citric acid was successfully introduced into chitosan via acylation reaction and the structure differences resulted in differences in the properties of chitosan and its complex. In addition, the adsorption eff i ciency for cadmium ions and free radical scavenging capacity of chitosan-citric acid complex were better than those of chitosan. This research can provide some evidence for the practical application of chitosan and its derivatives.
Key words:chitosan; chitosan-citric acid complex; structural properties; functional properties
DOI:10.7506/spkx1002-6630-201705022
中图分类号:TS201.7
文献标志码:A
文章编号:1002-6630(2017)05-0134-08
引文格式:
崔文慧, 郭芹, 李庆鹏, 等. 壳聚糖及壳聚糖-柠檬酸结构性质和功能性质的比较[J]. 食品科学, 2017, 38(5): 134-141.
DOI:10.7506/spkx1002-6630-201705022. http://www.spkx.net.cn
CUI Wenhui, GUO Qin, LI Qingpeng, et al. Comparison of structural and functional properties of chitosan and chitosancitric acid complex[J]. Food Science, 2017, 38(5): 134-141. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705022. http://www.spkx.net.cn
收稿日期:2016-04-07
基金项目:农业部公益性行业科研专项(201303076;201503142-01)
作者简介:崔文慧(1989—),女,硕士,研究方向为农产品加工与贮藏工程。E-mail:cuiwenhui07@163.com
*通信作者:哈益明(1957—),男,教授,硕士,研究方向为农产品贮藏保鲜与质量安全。E-mail:hayiming@sina.com