毕 爽,李 杨,隋晓楠,王中江,齐宝坤,江连洲 *
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:以大豆蛋白-磷脂复合体系为研究对象,采用圆二色谱表征复合体系构象变化,采用乳化性及乳化稳定性测定、表面疏水性及粒度分析等解析高压均质对复合体系中大豆蛋白二级结构的变化与理化/功能性质表达的影响。结果显示:高压均质会显著改善复合体系的功能性质如乳化性和乳化稳定性。随着均质压力升高,体系中大豆蛋白表面疏水性显著提高,说明疏水基团暴露明显,蛋白质与磷脂间的相互作用程度增加。复合体系的体积平均粒径由未均质时的33.21 μm降至3.61 μm,粒径分布均匀,整体向小粒径方向移动。圆二色谱结果显示高压均质改变了蛋白质-磷脂复合体系的构象,说明蛋白质和磷脂间发生相互作用,但当均质压力进一步增加,和未经处理的样品相比,样品中的α-螺旋含量略有下降,同时功能性质稍有提高。
关键词:高压均质;大豆蛋白;卵磷脂;结构性质;功能性质
大豆蛋白是一种良好的植物蛋白来源,营养价值较高,被广泛地应用在食品加工与制造中 [1],但是天然大豆蛋白的各种功能性质很难同时满足加工的需要,因此常对蛋白进行适当的改性。大豆磷脂是食品中重要的营养成分,具有改善食品风味和质地的作用。作为一种两性离子表面活性剂,它可以通过疏水结合的方式使蛋白质的表面活性发生改变,且他们之间的交互作用会影响大豆蛋白的功能性质 [2]。
至今,已有部分学者对大豆蛋白-磷脂交互作用方式进行了部分研究,但未能清晰地解释高压均质等物理加工方式对蛋白质-磷脂交互作用的影响,更缺少复合体系结构及功能性质随高压均质强度变化规律的研究。Beckwith [3]、Mantovani [4]等通过研究预测大豆蛋白与卵磷脂之间存在交互作用,Scuriatti等 [5]研究发现磷脂可以与蛋白通过静电作用和疏水作用结合形成复合物,复合物的产生对大豆蛋白的功能性质具有重要的影响。van Nieuwenhuyzen等 [6]曾研究表明蛋白质的疏水区域可以与磷脂的疏水基团相结合。高压均质在液体介质中的高速剪切和动态搅拌等作用,可以改变大豆蛋白的柔性空间结构,诱导磷脂结构变化,促进大豆蛋白与磷脂间的融合与交互 [7]。Puppo [8]、姜梅 [9]等研究发现高压均质会导致大豆蛋白的二级结构发生重要的变化。Fernandez等 [10]研究发现经过高压均质处理形成的蛋白质乳液粒径更小。但高压均质对蛋白质磷脂相互作用、复合体系功能性质及复合体系结构和功能表达之间的构效关系等方面研究仍鲜见报道,限制了高营养价值大豆蛋白-磷脂产品的开发与利用。
针对此问题,本实验利用高压均质的空化及剪切撞击作用调控大豆蛋白-磷脂复合体系的构建,解析高压均质对大豆蛋白-磷脂交互作用的影响。对不同高压均质条件下(0、50、100、150、200、250 MPa)复合体系的构象变化进行解析,对乳化性、乳化稳定性、表面疏水性、粒径和ζ-电位进行分析和表征,明确高压均质对蛋白质-磷脂间的相互作用、复合体系结构与功能之间构效关系的影响,以期为高压均质技术运用生产高乳化性和稳定性的大豆蛋白-磷脂复合产品提供理论依据。
1.1 材料与试剂
大豆分离蛋白 东北农业大学粮食、油脂及植物蛋白工程实验室自制;大豆卵磷脂 美国Sigma公司;葵花籽油 九三粮油工业集团有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠 北京新光化工试剂厂;国产试剂均为分析纯。
1.2 仪器与设备
ULTRA-TURRAX UTL2000乳化机 德国IKA公司;超高压均质机FB-110T上海励途机械设备工程有限公司;722型可见分光光度计 上海光谱仪器有限公司;J-810圆二色谱仪 日本Jasco公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司;ZetaPALS-Zeta电位仪 美国布鲁克海文仪器公司;F-4500荧光分光光度计 日本Hitachi公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
参考Wolf [11]提取分离蛋白的方法。用2 mol/L的NaOH调节溶液的pH值至8.5,搅拌后在4 ℃条件下10 000×g离心20 min,取上清液再用2 mol/L HCl溶液调节pH值至4.5。静置后在4 ℃条件下6 000×g离心20 min,沉淀水洗2 次后分散于水中并用2 mol/L NaOH溶液调节pH值至7.0。冷冻干燥后粉碎得大豆分离蛋白。
1.3.2 高压均质制备大豆蛋白-磷脂复合体系
将10 mg/mL的大豆分离蛋白溶液置于烧杯中,以蛋白质-磷脂10∶1(m/m)的比例添加磷脂,搅拌1 h使蛋白质和磷脂充分溶解并产生交互作用。采用高压均质机处理大豆蛋白-磷脂复合溶液,均质压力分别选择为0、50、100、150、200、250 MPa。
1.3.3 乳化性及乳化稳定性的测定
乳化性及乳化稳定性的测定参考Li Chen等 [12]的方法。从高压均质后的溶液样品中取9 mL加入3 mL葵花籽油,室温条件下组织分散1 min后从底部取样:均质之后立即抽出乳状液50 μL和均质之后乳液静置10 min的乳状液50 μL,再用0.1 g/100 mL的SDS溶液稀释200 倍,漩涡振荡混匀后用分光光度计在500 nm波长处测其吸光度A,以SDS溶液作为空白对照。乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)分别按式(1)和(2)计算。
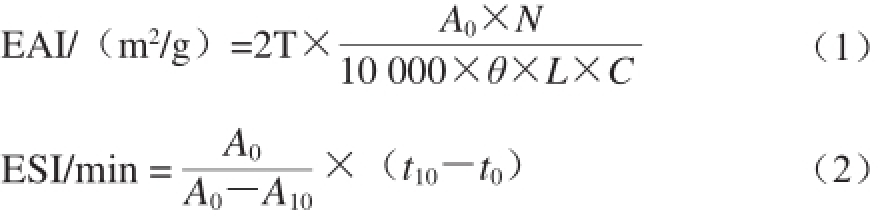
式中:T为常数2.303;N为稀释倍数200;θ为油相体积分数(25%);L为比色杯厚度1 cm;C为乳化液形成前蛋白质水溶液中蛋白质质量浓度,10 mg/mL;A 0、A 10分别为乳状液在0、10 min的吸光度;t 10-t 0:时间差,10 min。
1.3.4 表面疏水性的测定
蛋白质-磷脂复合物的表面疏水性测定参考Nakai [13]的测定方法,将不同高压均质处理的大豆分离蛋白与磷脂溶液以10 000×g离心30 min,取上清液测定蛋白质量浓度,用0.01 mol/L的磷酸盐缓冲液依次将蛋白样品稀释,使溶液质量浓度在0.05~0.40 mg/mL之间。实验中激发波长λ ex=390 nm,发射波长λ em=468 nm,夹缝为5 nm,扫描速率为10 nm/s。取溶液4 mL,分别加入40 μL浓度为8 mmol/L的8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)溶液,经振荡快速混合后静置3 min后测定样品荧光强度。以荧光强度与蛋白质质量浓度作图,表面疏水性为蛋白质分子的初始段斜率。
1.3.5 粒径分布的测定
利用Mastersizer 2000激光粒度仪进行粒径分布测定。对不同高压均质条件形成的大豆蛋白-磷脂溶液样品进行测定,颗粒折射率1.46,分散剂折射率1.33,吸收参数0.001 [14]。
1.3.6 ζ-电位的测定
采用电位仪测定样品的ζ-电位,大豆蛋白-磷脂溶液适度稀释,上样体积为1 mL,测定温度为25 ℃,温度平衡时间为2 min [15]。重复3 次测定最终得到的平均值即为最终结果。
1.3.7 圆二色谱分析
利用圆二色谱在远紫外区(260~180 nm)测定高压均质对样品中蛋白质二级结构的影响。取样品在20 ℃条件下10 000×g离心后稀释至蛋白质质量浓度为0.1 mg/mL。测定条件:扫描速率为100 nm/min,扫描波长范围为250~200 nm,样品池光程为0.1 nm,灵敏度为100 mdeg/cm,每个样品重复3 次测定。数据通过CDPro软件进行分析。
1.4 数据统计分析
所有数据均重复实验3 次,结果表示为
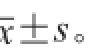 数据统计分析采用SPSS 18.5软件对数据进行方差分析(analysis of variance,ANOVA)差异显著性分析,P<0.05为显著性差异。采用Origin 9.1软件进行绘图。
数据统计分析采用SPSS 18.5软件对数据进行方差分析(analysis of variance,ANOVA)差异显著性分析,P<0.05为显著性差异。采用Origin 9.1软件进行绘图。
2.1 高压均质对大豆蛋白-磷脂复合体系乳化性和乳化稳定性的影响

图 1 高压均质对大豆蛋白-磷脂复合体系乳化性及乳化稳定性的影响
Fig. 1 Effect of homogenization pressure on emulsion activity and stability index of soybean protein-lecithin system
由图1可知,大豆蛋白-磷脂复合体系的乳化性随着均质压力的增加而加强,压力从0 MPa增加到250 MPa的过程中,乳化性由28.3 m 2/g增加到115.4 m 2/g。但当均质压力从200 MPa升高到250 MPa时,乳化性增加率较小。复合体系乳化性的高低受诸多因素影响,如蛋白质与磷脂的结合程度、溶解性或蛋白质分子质量分布等。同时,这些因素都决定于高压均质的强度 [16]。大豆蛋白-磷脂复合体系的乳化稳定性变化趋势与乳化性相似。沈兰等 [17]研究发现均质压力的升高可使大豆分离蛋白的乳化性显著增加,但当均质压力达到160 MPa后,变化并不显著。随着均质压力的增加,蛋白质分子结构变得松散,暴露出更多的疏水基团与磷脂的疏水尾部相互作用得到加强,复合体系的亲水亲油程度同时增加,且两者达到较好的平衡 [18],提高了复合体系的乳化性和乳化稳定性。另一方面,蛋白质-磷脂复合体系的乳化性也同时表征大豆蛋白溶于水相溶液的能力和磷脂吸附到界面层上的能力。因此,大豆蛋白的溶解性提高也导致复合体系向油-水界面的扩散能力提高,乳化和乳化稳定能力上升。但当均质压力进一步增大后,体系乳化性增加速率降低。可能是由于蛋白质-蛋白质分子间疏水相互作用产生,磷脂与蛋白质间的作用受到竞争抑制而减弱,因此乳化性增加不再明显 [19]。
2.2 高压均质对大豆蛋白-磷脂复合体系表面疏水性的影响
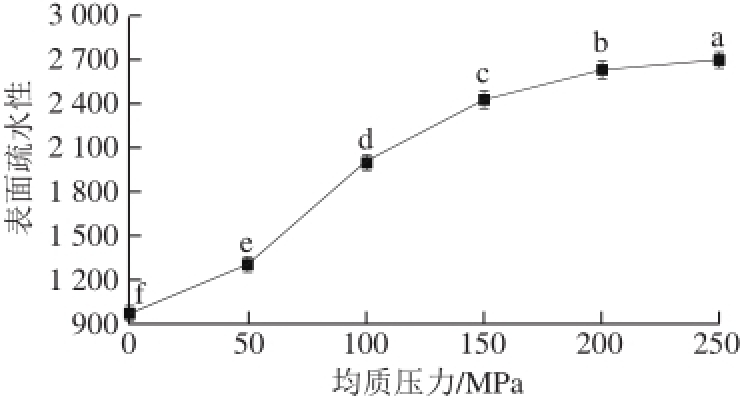
图 2 高压均质对大豆蛋白-磷脂复合体系表面疏水性的影响
Fig. 2 Effect of homogenization pressure on surface hydrophobicity of soybean protein-lecithin system
如图2所示,未处理的样品表面疏水性最低,经过高压均质处理后,所有样品中蛋白质的表面疏水性均有所升高。且在均质压力为250 MPa条件下,表面疏水性最高。这与Hayakawa等 [20]的研究结果一致,未经高压均质处理的大豆蛋白中大多数疏水基团被紧密包埋在球状区域内,疏水基团和荧光探针之间的接触受到抑制。高压均质处理后大豆分离蛋白与磷脂改变了自身的空间结构,同时两者间的疏水相互作用也影响着磷脂分子的排列形式 [21],高压均质作用使两者之间的结合更为紧密。大豆蛋白以疏水作用固定在磷脂膜上,因此表面疏水性进一步提高。然而,当均质压力增加到200 MPa后,大豆蛋白-磷脂复合体系的表面疏水性增加趋于缓慢、平稳的状态,可能由于大豆蛋白出现一定程度的聚集,这种蛋白质聚集阻止了疏水基团的暴露 [22]。
2.3 高压均质对大豆蛋白-磷脂复合体系粒径分布的影响

图 3 高压均质对大豆蛋白-磷脂乳液体积平均粒径D
[4,3](A)和粒径分布(B)的影响
Fig. 3 Effect of homogenization pressure on emulsion D
[4,3](A) and droplet size distribution (B) of soybean protein-lecithin system
体积平均粒径D [4,3]可衡量体系液滴的平均大小。大豆蛋白-磷脂复合体系溶液经高压均质处理前后,D [4,3]如图3A所示。未经均质处理时体系的D [4,3]为33.21 μm,高压均质处理后复合体系的D [4,3]普遍降低。可能是样品溶液经过高压均质机后在狭小的空间内被撞击,造成复合体系颗粒的解聚、破碎,所以体系的粒径较小。
由图3B可知,未经高压均质时溶液呈双峰粒径分布,且大峰主要分布在10~100 μm之间。经过高压均质处理后粒度分布明显向小粒径方向移动,尤其是当均质压力为200 MPa和250 MPa时,溶液粒径主要分布在1~10 μm之间,且在0.3~1.0 μm之间也有小峰分布。说明此时溶液中液滴具有相似的直径,故稳定性较强。与本文中ζ-电位结果一致。Fernandez等 [10]研究发现高压均质导致蛋白质解折叠,疏水基团暴露。磷脂由于具有亲水亲油特性,故与大豆蛋白间的疏水相互作用增强。同时磷脂也会诱导大豆蛋白结构进一步展开 [23],使疏水基团以更容易的方式暴露后增加与磷脂间的相互作用,从而降低粒径。然而,当均质压力从200 MPa升高至250 MPa后,体积平均粒径D [4,3]虽仍然降低但变化不再显著,粒径分布移动差异也随之减小,可能由于均质压力过高导致能量输入过大,体系中颗粒有重新聚合的趋势 [24],所以平均粒径不再降低。
2.4 高压均质对大豆蛋白-磷脂复合体系ζ-电位的影响

图 4 高压均质大豆蛋白-磷脂复合体系溶液ζ-电位的影响
Fig. 4 Effect of homogenization pressure on ζ-potential of soybean protein-lecithin system
不同高压均质条件下,样品的ζ-电位变化如图4所示。在中性条件下,未经高压均质处理的样品粒滴表面呈现出较低的负电性,约为-8.71 mV。随着均质压力的升高,溶液的ζ-电位绝对值均增大。但当均质压力超过150 MPa后,ζ-电位绝对值增加率降低,均质压力由200 MPa提升至250 MPa的过程中,溶液的电位绝对值略有增加。ζ-电位可衡量颗粒之间相互吸引或吸引力强度 [25]。其绝对值代表溶液的稳定性,绝对值越高,分散粒子间的排斥力越大,越不易发生相互碰撞而聚集。反之,绝对值越低,粒子间越倾向于相互吸引而发生聚集。Karlis等 [26]研究发现高压均质导致颗粒表面负电荷增加的原因是蛋白质分子结构发生了重排。Mantovani等 [4]研究发现高压均质提高了蛋白质表面的离子化基团数目和蛋白质水合能力,乳清蛋白-磷脂复合体系的稳定性在25~60 MPa范围逐渐升高。而本实验当均质压力增加到200 MPa时,大豆蛋白-磷脂复合体系的ζ-电位绝对值增加率显著降低。说明均质压力达到200 MPa利于大豆蛋白与磷脂发生相互作用而提高体系稳定性。但过高的均质压力可能会导致蛋白质的重聚集,液滴间的静电排斥力不再增加,因而溶液稳定性维持在一定水平上,抑制复合体系溶液在贮存期间的扰动。该结果也可支持2.1节中样品乳化稳定性较好的结果。
2.5 高压均质后大豆蛋白-磷脂复合物中大豆蛋白的构象分析
圆二色谱是一种测量蛋白二级结构快速、准确且灵敏的技术,可以在水溶性蛋白溶液中直接测量计算出蛋白质各类型二级结构的含量 [27]。研究选择能反映肽键圆二色性的远紫外区200~240 nm光谱条件,测定不同高压均质条件处理后复合物中蛋白质的圆二色谱吸收,测定结果计算后见表1。
表 1 圆二色谱测定不同高压均质处理后复合物中大豆蛋白的二级结构含量
Table 1 Secondary structural contents of homogenization pressuretreated soybean protein-lecithin complex estimated from circular dichroism spectra

注:同列肩标字母不同表示差异显著(P<0.05)。
无规卷曲含量/% 019.3±0.1 a28.2±0.2 f21.1±0.1 d31.3±0.0 c5016.3±0.2 b31.7±0.1 e21.1±0.0 d30.9±0.1 d10013.4±0.1 c33.5±0.1 d21.3±0.1 c31.7±0.0 a15010.7±0.1 d36.2±0.2 c21.4±0.1 b31.7±0.2 a2008.5±0.1 e39.6±0.0 b21.5±0.0 a31.4±0.0 b2507.6±0.2 f40.7±0.2 a21.5±0.0 a30.9±0.2 d均质压力/MPa α-螺旋含量/% β-折叠含量/% β-转角含量/%
经过不同条件高压均质处理后,蛋白质中二级结构含量均发生了明显的变化。如表1所示,所有样品均表现出α-螺旋含量降低,β-折叠和β-转角含量升高的现象,样品中蛋白质二级结构以β-结构为主。与Li Chen等 [12]的研究一致,可能是大豆卵磷脂结合到大豆蛋白α-螺旋结构中的疏水性氨基酸区域,从而使蛋白质分子展开改变其空间构象。且该现象在均质压力增大后更加明显。这归因于高压均质产生的压力作用、高频振荡和对流撞击等机械力诱导蛋白质结构发生改变,从而影响了大豆蛋白-磷脂复合体系的功能性质。但是当高强度均质作用于复合体系后,α-螺旋结构的含量增加缓慢,蛋白质发生不溶性聚集,与磷脂间的相互作用减弱。复合体系的结构特征和功能特性是高度相关的,蛋白质二级结构的改变使复合体系更具有均匀性和柔性的特点,在油-水界面上吸附得更完全,与本研究中复合体系乳化性的测定结果一致。
本实验采用不同均质压力处理大豆蛋白与磷脂形成的复合体系溶液,以探究外界条件对复合体系结构和功能性质的影响,主要结论:1)高压均质能够显著提高大豆蛋白与磷脂的相互作用程度,同时改善大豆蛋白-磷脂复合乳化体系的乳化特性、表面疏水性等性质。随着均质压力的提高,复合体系的粒径减小、整体粒径分布向小粒径区域移动,溶液体系外观均一;2)复合体系的ζ-电位及乳化稳定性分析表明,高压均质通过增加颗粒表面的净电荷含量提高蛋白质-磷脂复合体系和水包油型乳状液的稳定性。高压均质处理可使大豆蛋白分子展开,通过与磷脂发生疏水相互作用而保持乳化层致密、完整。但均质压力超过200 MPa后,复合体系趋于稳定;3)圆二色谱结果表明,高压均质会改变大豆蛋白-磷脂复合体系的构象。随着均质压力的升高,大豆蛋白二级结构中的α-螺旋含量降低,β-折叠和β-转角含量上升,这说明大豆蛋白与磷脂产生了相互作用。适宜高压均质条件下大豆蛋白与磷脂间的交互作用加强,从而提高了复合体系的功能性质。
参考文献:
[1] GRAHAM D E, PHILLIPS M C. Proteins at liquid interfaces: Ⅲ. molecular structures of adsorbed f i lms[J]. Journal of Colloid Interface Science, 1979, 70(3): 427-439. DOI:10.1016/0021-9797(79)90050-X.
[2] 董美华. 大豆卵磷脂的制备工艺及其在食品工业中的应用[J]. 食品与药品, 2007, 10(4): 174-178.
[3] BECKWITH A C. Interaction of phosphatidylcholine vesicles with soybean 7S and 11S globulin proteins[J]. Journal of Agricultural and Food Chemistry, 1984, 32(6): 1397-1402. DOI:10.1021/jf00126a045.
[4] MANTOVANI R A, CAVALLIERI Â L F, NETTO F M, et al. Stability and in vitro digestibility of emulsions containing lecithin and whey proteins[J]. Food & Function, 2013, 4(9): 1322-1331. DOI:10.1039/ C3FO60156K.
[5] SCURIATTI M, TOMAS M, WANGNER J. Influence of soybean protein isolates-phosphatidycholine interaction on the stability on oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society, 2003, 80(11): 1093-1100. DOI:10.1007/s11746-003-0825-7.
[6] van NIEUWENHUYZEN W, SZUHAJ B F. Effects of lecithins and proteins on the stability of emulsions[J]. Lipid/Fett, 1998, 100(7): 282-291.
[7] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science & Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003.
[8] PUPPO M C, CHAPLEAU N, SPERONI F, et al. Physicochemical modifications of high-pressure-treated soybean protein isolates[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6): 1564-1571. DOI:10.1021/jf034813t.
[9] 姜梅, 董明盛, 芮昕, 等. 高压均质和热处理对豆乳蛋白质溶解性的影响[J]. 食品科学, 2013, 34(21): 125-130. DOI:10.7506/spkx1002-6630-201321026.
[10] FERNANDEZ C, ESCRIU R, TRUJILLO A J. Ultra-high pressure homogenization enhances physicochemical properties of soy protein isolate-stabilized emulsions[J]. Food Research International, 2015, 75: 357-366. DOI:10.1016/j.foodres.2015.05.026.
[11] WOLF W J. Soybean proteins. their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976. DOI:10.1021/jf60172a025.
[12] LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[13] NAKAI S. Hydrophobicity determined by a f l uorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1): 13-20. DOI:10.1016/0005-2795(80)90220-2.
[14] TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104. DOI:10.1016/ j.ijbiomac.2006.06.013.
[15] XU D X, ZHANG J J, CAO Y P, et al. Inf l uence of microcrystalline cellulose on the microrheological property and freeze-thaw stability of soybean protein hydrolysate stabilized curcumin emulsion[J]. LWTFood Science and Technology, 2016, 66: 590-597. DOI:10.1016/ j.lwt.2015.11.002.
[16] LIU H H, KUO M I. Ultra high pressure homogenization effect on the proteins in soy f l our[J]. Food Hydrocolloids, 2016, 52: 741-748. DOI:10.1016/j.foodhyd.2015.08.018.
[17] 沈兰, 王昌盛, 唐传核. 高压微射流处理对大豆分离蛋白构象及功能特性的影响[J]. 食品科学, 2012, 33(3): 72-76.
[18] PUPPO M C, SPERONI F, CHAPLEAU N, et al. Effect of high pressure treatment on emulsifying properties of soybean proteins[J]. Food Hydrocolloids, 2005, 19(2): 289-296. DOI:10.1016/ j.foodhyd.2004.07.001.
[19] WANG X S, TANG C H, LI B S, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567. DOI:10.1016/j.foodhyd.2007.01.027.
[20] HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science, 1985, 50: 486-491.
[21] 吴富根. 两亲性分子自组装聚集体的相变及其区域协同性[D]. 北京: 清华大学, 2011: 47-50.
[22] CHANDRAPALA J, ZISU B, PALMER M, et al. Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J]. Ultrasonics Sonochemistry, 2011, 18(5): 951-957. DOI:10.1016/j.ultsonch.2010.12.016.
[23] LI J F, LI Y T, GUO S T, et al. The binding mechanism of lecithin to soybean 11S and 7S globulins using f l uorescence spectroscopy[J]. Food Science and Biotechnology, 2014, 23(6): 1785-1791. DOI:10.1007/s10068-014-0244-8.
[24] YUAN B E, REN J Y, ZHAO M M, et al. Effects of limited enzymatic hydrolysis with pepsin and high-pressure homogenization on the functional properties of soybean protein isolate[J]. LWT-Food Science and Technology, 2012, 46(2): 453-459. DOI:10.1016/ j.lwt.2011.12.001.
[25] 李向红. 大豆蛋白聚集体-多糖混合体系相行为及微观结构的研究[D].无锡: 江南大学, 2008: 21-24.
[26] KARLIS B, VOLKER G, ELKE W, et al. Ultra high pressure homogenization of almond milk: physico-chemical and physiological effects[J]. Food Chemistry, 2016, 192: 82-89. DOI:10.1016/j.foodchem.2015.06.063.
[27] 罗东辉. 均质改性大豆蛋白功能特性研究[D]. 广州: 华南理工大学, 2010: 55-58.
Effect of High Pressure Homogenization on Structural, Physicochemical and Functional Properties of Soybean Protein-Lecithin Composite System
BI Shuang, LI Yang, SUI Xiaonan, WANG Zhongjiang, QI Baokun, JIANG Lianzhou
*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:The objective of this research was to reveal the effect of high pressure homogenization on the change in protein secondary structure and physicochemical and functional properties of soybean protein isolate (SPI)-lecithin system through characterizing conformational changes by circular dichroism spectroscopy and through measuring emulsifying capacity, emulsion stability, surface hydrophobicity and droplet size distribution. The results showed that high pressure homogenization improved emulsion activity index and emulsion stability index of the complex system signif i cantly. The surface hydrophobicity of SPI significantly increased at higher pressure of homogenization, implicating considerable exposure of surface hydrophobic groups and increased interaction between soybean protein and phospholipid. After the homogenization treatment, the average droplet diameter of the composite system decreased from 33.21 to 3.61 μm, and the droplet size distribution was uniform with a slight shift towards smaller droplet sizes. Circular dichroism spectral results showed that high pressure homogenization resulted in conformational changes of the composite system, implying the occurrence of interaction between protein and lecithin. However, with further increasing homogenization pressure, only a little reduction in α-helix content was observed compared with untreated samples.
Key words:high pressure homogenization; soybean protein; lecithin; structural properties; functional properties
DOI:10.7506/spkx1002-6630-201705024
中图分类号:TS214.9
文献标志码:A
文章编号:1002-6630(2017)05-0148-06
引文格式:
毕爽, 李杨, 隋晓楠, 等. 高压均质对大豆蛋白-磷脂复合体系结构及理化/功能性质的影响[J]. 食品科学, 2017, 38(5): 148-153. DOI:10.7506/spkx1002-6630-201705024. http://www.spkx.net.cn
BI Shuang, LI Yang, SUI Xiaonan, et al. Effect of high pressure homogenization on structural, physicochemical and functional properties of soybean protein-lecithin composite system[J]. Food Science, 2017, 38(5): 148-153. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705024. http://www.spkx.net.cn
收稿日期:2016-02-29
基金项目:“十二五”国家科技支撑计划项目(2014BAD22B00);
国家高技术研究发展计划(863计划)项目(2013AA102104);黑龙江省自然科学基金重点项目(ZD201302);高等学校博士生学科点专项科研基金博导类资助项目(20132325110013)
作者简介:毕爽(1992—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:13163436989@163.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@163.com