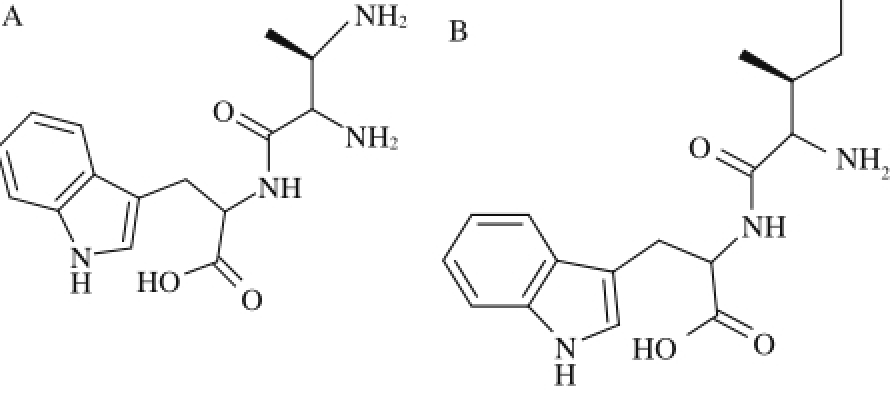
图 1 VW(A)、IW(B)的分子结构
Fig. 1 Chemical structural formula of VW (A) and IW (B)
管 骁 1,洪延涵 1,刘 静 2,李景军 3,孙 注 4,韩 飞 5
(1.上海理工大学医疗器械与食品学院,上海 200093;2.上海海事大学信息工程学院,上海 201306;3.江苏长寿集团有限公司,江苏 无锡 226500;4.内蒙古燕谷坊生态农业发展(集团)有限公司,内蒙古 呼和浩特 201106;5.国家粮食局科学研究院,北京 100037)
摘 要:IW(Ile-Trp)、VW(Val-Trp)是两种对人体体细胞ACE(somatic ACE,sACE)中的C-结构域(C-domain)具有选择抑制性活性的食源性二肽,但其与ACE两个结构域(包括C-domain和N-domain)的结合模式与分子机制尚不明确。本实验采用分子柔性对接技术分别对上述两种肽与靶标的作用位点、结合能及作用力类型等进行研究。对接结果表明,IW、VW与ACE C-domain的活性位点存在氢键、亲水、疏水相互作用力及配位键,与N-domain作用模式相似,但生成氢键数目较少,且与Zn 2+不产生静电相互作用。通过比较IW、VW分别与两个结构域结合的能量差异,证明IW、VW针对两个结构域有不同的抑制强度,可为指导开发ACE C-domain选择性抑制肽提供理论参考。
关键词:ACE;C-domain 选择性抑制肽;柔性对接;结合模式
血管紧张素转化酶(angiotensin-converting enzyme,ACE)是一种含锌的二肽羧肽酶,可催化无活性的血管紧张素(angiotensin,Ang)Ⅰ转化为强烈收缩血管的血管紧张素Ang Ⅱ,同时可水解具有舒张血管作用的舒缓激肽 [1-2],导致人体血压升高。人体内的ACE以两种形式存在:体细胞ACE(somatic ACE,sACE)和睾丸ACE(testic ACE,tACE)。特别是sACE在各种组织中普遍存在,由两个高度同源的蛋白结构域N、C-domain组成,各包含一个活性序列His-Glu-X-X-His(HEXXH)和Zn 2+[3-4]。两个结构域拥有60%的序列相似性,但在底物和抑制剂的特异性及氯离子激活等方面存在较大差异 [5-7]。前人研究表明,将无活性的Ang Ⅰ水解为具有强烈收缩血管作用的Ang Ⅱ是专一通过sACE的C-domain完成的,N-domain无此功能;而对具有舒张血管作用的舒缓激肽的水解则可通过两个结构域同时完成 [8]。
当前所认识的绝大多数ACE抑制肽都属结构域混合型抑制肽(同时抑制两个结构域活性),在抑制ACE活性的同时也导致了舒缓激肽的积累,过量的舒缓激肽易导致干咳、呕吐、皮疹等副作用 [9]。从理论上讲,ACE C-domain选择性抑制肽既可有效抑制Ang Ⅱ的生成,又保留了ACE N-domain水解舒缓激肽的活性,是副作用更小、安全性更高的预防与控制心血管疾病的药物 [10-11]。最新的研究发现IW(Ile-Trp)、VW(Val-Trp)两种二肽对ACE C-domain有特异性抑制作用 [12-14],但它们对ACE两个结构域作用的分子机制尚未明确。本实验以这两种选择性抑制肽为研究对象,通过与ACE两个结构域柔性对接结果的分析阐明其结合模式与选择性抑制作用机制,为针对性设计ACE C-结构域选择性抑制肽提供理论依据。
1.1 初始结构的获得及处理
从Protein Data Bank数据库中下载ACE的C-domain与N-domain的X衍射三维结构数据,编号分别为1O86和2C6N [15-18]。结晶结构中还存在某些氨基酸残基和原子的缺失,采用Discovery Studio2.5软件(Accelrys公司)处理该蛋白质,删除模拟过程中不需要的水分子和抑制剂小分子Lisinopril,保留Zn 2+和Cl -并优化蛋白质的结构。
1.2 小分子的生成及结构优化
以IW、VW为抑制剂研究对象,用MDL ISISDraw v2.5软件(创腾科技有限公司)画出IW、VW的结构式(图1),加氢后纠正其结构并用Discovery Studio中的CHARMm [17-19]力场进行结构优化,得到最低能量结构。并利用DS 2.5中的Prepare Ligands处理该配体,使其产生三维结构及异构体。最终得到的结构保存为mol格式,用于分子对接。

图 1 VW(A)、IW(B)的分子结构
Fig. 1 Chemical structural formula of VW (A) and IW (B)
1.3 分子对接参数设置
所有计算工作均在HP Z620计算机工作站上完成。采用Discovery Studio2.5以分子柔性对接方法分别建立ACE的C-domain和N-domain与底物及抑制肽的分子对接模型,利用柔性对接可以较好模拟活性肽与ACE之间的诱导契合效应,使对接结果接近二者的真实构象 [20]。C-domain中需补全的残基为Ser435、Glu436、Gly437、Gly438,均位于蛋白酶的活性位点外。N-domain中没有需补全的残基。
依据DS对接程序,将ACE定义为受体,二肽设置为配体,C-domain的对接运行参数为:Radius(半径)12 Å,三维坐标为X:40.90;Y:37.22;Z:46.13。活性位点的选择基于文献、软件中的Define Site及复合物的结构数据。选用C-domain的His353、Ala354、Ser355、Ala356、Val380、His383、Glu384、His387、Phe391、Pro407、His410、Glu411、Asp415、Lys511、Phe512、His513、Ser516、Ser517、Val518、Tyr520、Arg522、Tyr523为活性位点残基 [16-17,21-23]。N-domain的对接运行参数为:Radius 12 Å,三维坐标为X:-26.39;Y:-20.78;Z:-35.88,对接区域残基为:His331、Ser333、Ala332、Ala334、Val358、His361、Glu362、His365、Phe369、His388、Glu389、Asp393、Lys489、Phe490、His491、Val496、Arg500、Tyr501、Phe505 [24-25]。用Flexible Docking 工具包将IW、VW分别对接到两个结构域中,得到一系列结合配体构象。综合考虑LibDockScore的高低、配体-受体复合物的CDocker Energy、CDocker Interaction Energy得分、软件中打分函数(Ligscore 1、Ligscore 2、PLP1、PLP2、Jain、PMF、PMFO4)打分值的高低选取最优构象 [26-28]。
2.1 VW与ACE的对接结果
2.1.1 VW与ACE C-domain对接结果分析
表 1 VW与ACE C-domain形成的最佳结合构象的氢键参数
Table 1 Hydrogen bonds observed between the C-domain and the best pose of VW

氢键受体原子氢键供体原子键长/Å键角/(°)VW:H35Ala354:O1.85112.05 VW:H35Glu384:OE21.59118.51 VW:H36Ala354:O2.19150.20 VW:H37Glu384:OE21.92115.08 A:His383:HD1VW:O152.37109.79
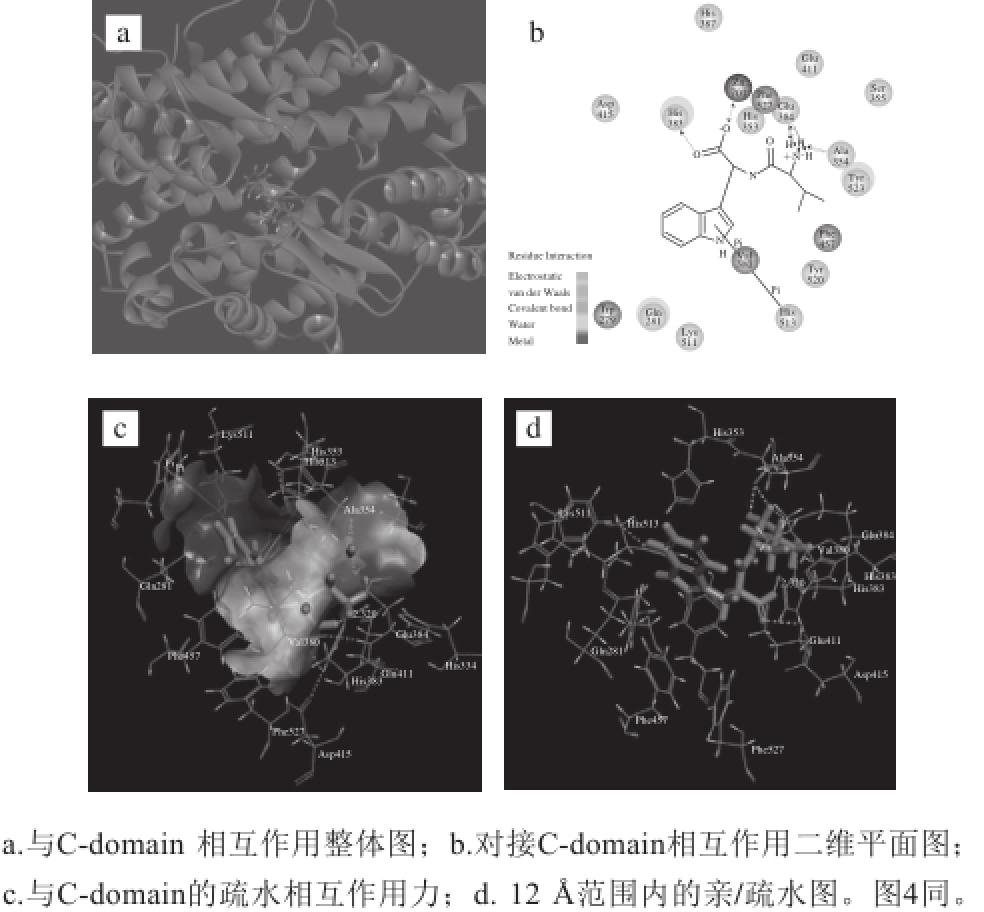
图 2 VW与ACE C-domain的相互作用图
Fig. 2 Interaction schemes between VW and the ACE C-domain
分析VW与ACE C-domain的分子对接结果,可以看到VW呈现一种蜷曲的构象深埋于C-domain的活性中心裂缝中,形成5个氢键(图2a、b),最佳结合构象的氢键参数如表1所示。Ala354、Glu384各与VW形成两个较强的氢键,为二者相互作用的关键氨基酸残基,VW的N端氨基产生4 个氢键为舵手基团。VW的C端羧基与His383形成一个相对较弱的氢键,His383是ACE C-domain维持活性、调控血压的主导性位点的重要氨基酸残基,VW与His383的结合可抑制ACE与Zn 2+的结合。同时,VW与His513形成较强Pi键,键长5.40 Å;VW的N端氨基的氢原子与Glu384之间有静电相互作用力产生;VW的O16与ACE的Zn 2+形成配位键,产生电荷相互作用。图2c中围绕在VW外面的不同浓度的灰度图表示VW与蛋白之间的疏水相互作用力,疏水作用力的大小由颜色深浅度区分,颜色越浅表明疏水作用力越大。可以看到VW和C-domain的结合产生疏水作用,尤其在C-domain活性位点疏水区有疏水相互作用力。疏水作用由Ala354、Phe457、 Phe527和Val380等残基形成。产生亲水作用的氨基酸残基有9 个:Gln281、His353、His383、Glu384、His387、Glu411、Asp415、Lys511、His513(图2d)。VW中的吲哚芳环等疏水基团与C-domain的疏水氨基酸残基形成了较强疏水作用,亲水基团如羧基、氨基等参与了分子间亲水作用的形成。
2.1.2 VW与ACE N-domain对接结果分析
表 2 VW与ACE N-domain形成的最佳结合构象的氢键信息
Table 2 Hydrogen bonds observed between the N-domain and the best pose of VW
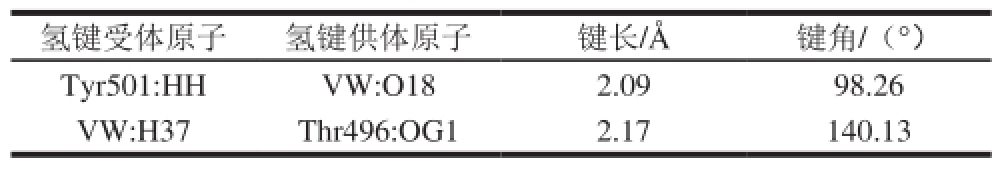
氢键受体原子氢键供体原子键长/ Å键角/(°)T y r 5 0 1 : H H V W : O 1 8 2 . 0 9 9 8 . 2 6 V W : H 3 7 T h r 4 9 6 : O G 1 2 . 1 7 1 4 0 . 1 3

图 3 VW与N-domain的相互作用图
Fig. 3 Interaction schemes between VW and the ACE N-domain
将VW对接到ACE的N-domain上,筛选出最佳对接构象(图3a、b)。由图中可以清晰看出VW结合于空腔内,与N-domain之间形成2 个氢键。Thr496与VW的氮端氨基形成一个较强氢键,Tyr501和肽键上的羟基形成一个弱氢键。Thr496、Tyr501为产生氢键的关键氨基酸残基。与C-domain不同,VW与ACE N-domain之间的氢键作用相对较弱,产生氢键数目较少。具体氢键参数如表2所示。同时Tyr501与VW形成两个较强Pi键,键长分别为4.38 Å和6.68 Å;His491与VW的氮端N20形成键长3.86 Å的Pi键。Lys489与VW形成强Pi键,键长2.31 Å 。ACE抑制剂的活性形态要求与ACE的Zn 2+结合的基团必须为—SH、COO—两类,而VW中羧基中的氧原子与Zn 2+的距离为2.43 Å,大于氧原子(1.40 Å)与Zn 2+(0.74 Å)的共价半径总和,意味着未形成配位键。图3c中VW外围的密布图呈深灰表明VW与ACE的N-domain形成的疏水作用力较小。其中,Ala332、Ala334、Phe490、Phe435和Phe505是通过疏水作用力稳定复合物的构象;His491、Asn494、His331、Glu389、His361、Glu362、His365、Asp393通过亲水作用影响两者之间的关系(图3d)。
2.2 IW与ACE的对接结果
2.2.1 IW与ACE C-domain对接结果分析
表 3 IW与ACE C-domain形成的最佳结合构象的氢键参数
Table 3 Hydrogen bonds observed between the ACE C-domain and the best pose of IW

氢键受体原子氢键供体原子键长/Å键角/(°)His513:HE2IW:O12.14161.56 IW:H24Ala354:O2.40142.15 IW:H25Glu384:OE21.26174.24 IW:H26Ala354:O1.72158.00 IW:H26Glu384:OE22.17134.97 IW:H27Glu384:OE21.84119.18
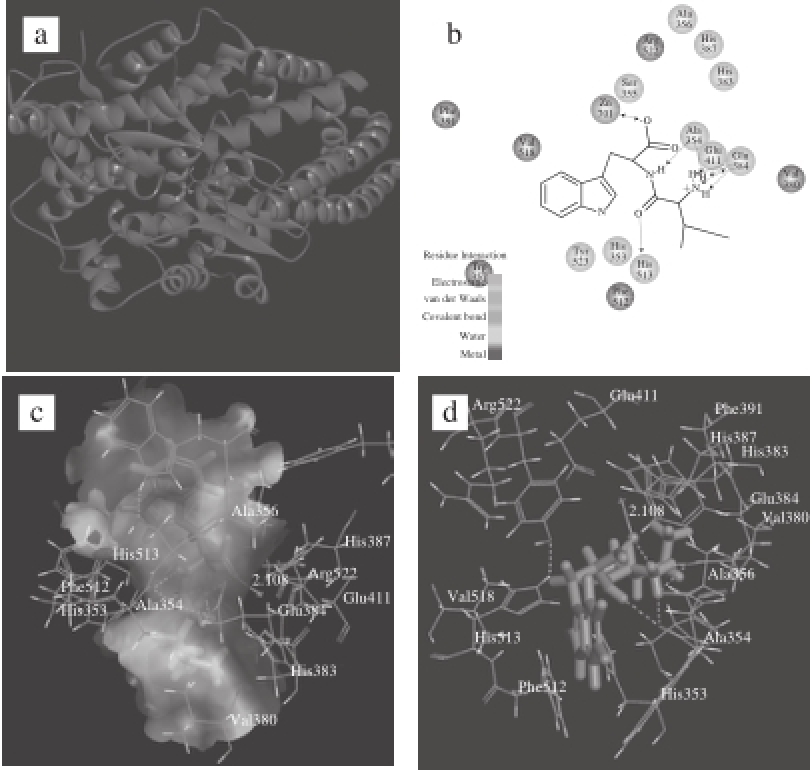
图 4 IW与ACE C-domain的相互作用图
Fig. 4 Interaction schemes of IW with the ACE C-domain
将IW对接到ACE的C-domain中,最佳结合构象的结构图如图4a所示。图中可以清晰看到IW位于疏水空腔中,与C-domain形成6 个氢键。由表3可看出,IW氮端氨基的H原子,在两者相互作用中贡献较大,为舵手基团,作为氢键供体与Ala354和Glu384形成4 个氢键,Ala354参与形成一个较强氢键,Glu384参与形成3 个强氢键,IW的肽键分别与Ala354和His513各形成一个氢键,故Ala354、His513和Glu384为产生氢键的关键氨基酸残基。图4b显示Glu384与IW氮端氨基的氢原子形成静电相互作用情况。IW通过C端羧基与酶活性位点处Zn 2+螯合,产生电荷相互作用,且Zn 2+与VW中羧基中的O原子距离为2.10 Å,表明形成配位作用。图4d所示为IW周围亲水氨基酸及疏水氨基酸残基分布图。其中,与IW产生亲水作用的ACE氨基酸残基有7 个:His353、His383、Glu384、His387、Glu411、His513、His353、Arg522。产生疏水作用的ACE氨基酸残基有6 个,由弱到强排序为Ala354、Ala356、Phe391、Phe512、Val380、Val518(疏水值1.8~4.2)。这些疏水性氨基酸产生了较强的疏水相互作用力(图4c),形成的作用力将IW固定在C-domain的活性中心,对复合物的稳定起主要作用。
2.2.2 IW与ACE N-domain对接结果分析
表 4 IW与ACE N-domain形成的最佳结合构象的氢键信息
Table 4 Hydrogen bonds observed between N-domain and the best pose of IW
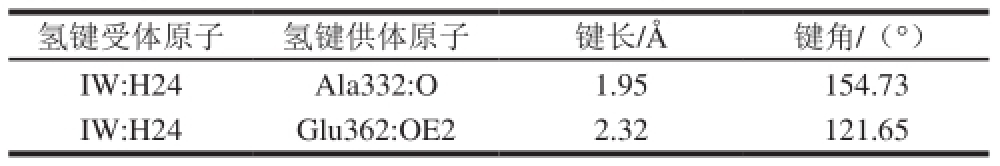
氢键受体原子氢键供体原子键长/ Å键角/(°)I W : H 2 4 A l a 3 3 2 : O 1 . 9 5 1 5 4 . 7 3 I W : H 2 4 G l u 3 6 2 : O E 2 2 . 3 2 1 2 1 . 6 5

图 5 IW与ACE N-domain的相互作用图
Fig. 5 Interaction schemes of IW with the ACE N-domain
IW对接到ACE的N-domain中,按LibDockScore 降序排列,再综合比较各个打分函数的打分值,最佳构象见图5a。最佳结合构象的氢键参数如表4所示。IW的肽键上的氢原子与Ala332和Glu362分别产生两个强氢键,且Glu362与IW氮端氨基的氢原子有静电相互作用产生。His365作为与Zn 2+产生配位键的氨基酸残基与IW的氮端氨基形成较强Pi键,键长4.29 Å。Lys489的NZ与IW形成键长4.51 Å的Pi键。Zn 2+与IW中羧基中的O原子距离为2.07 Å,表明有配位键产生。通过图5c中围绕在IW外的灰度图看出IW与ACE N-domain之间形成较弱的疏水相互作用力,与IW产生疏水作用的氨基酸残基由弱至强依次为Ala332、Ala334、Phe505、Phe490(疏水值1.8~2.8);与IW产生亲水作用的氨基酸残基为:His491、His331、Arg500、Asp393、Glu389、His361、Glu362、His365。
综合以上分析结果可知,IW、VW与ACE的C-domain作用机制相似,包括氢键、亲水、疏水相互作用等方面,但在与N-domain的对接方式有所不同。通过比较可知IW、VW与C-domain结合产生氢键数目均多于各自与N-domain结合的氢键数,且氢键作用力均较强。在抑制剂与酶的结合过程中,氢键起稳定对接复合物的作用,氢键的数目决定了抑制剂对酶的亲和力。因此IW、VW与C-domain具有更高的亲和力,是IW、VW对ACE C-domain具有选择性抑制的重要原因之一。Zn 2+在一定程度上也可促进酶与抑制剂的结合,IW、VW均能在C-domain与Zn 2+螯合以稳定构象,且产生静电相互作用,静电作用能分别为-79.45、-129.84 kJ/mol。IW在N-domain上虽然与Zn 2+螯合但没有静电相互作用,表现为较低的抑制活性,与体外活性实验结果相符。另外,对两种二肽而言,与C-domain、N-domain两个结构域对接生成氢键的舵手基团基本相同,即二肽的N端氨基与肽键参与形成氢键,但二肽的N端氨基在ACE的C-domain上参与形成氢键数量较N-domain更多,可推测,二肽的氮端氨基酸在与C-domain结合比在N-domain中作用大。
2.3 二肽分别与C-domain和N-domain氨基酸残基间的作用能分析
表 5 VW、IW与C-domain活性位点氨基酸残基间的相互作用能
Table 5 Electrostatic energy, van der Waals energy and total potential energy between the best poses of bioactive peptides obtained from docking results and the C-domain

氨基酸残基VWIW范德华力静电力总电势能范德华力静电力总电势能Gln281-0.081.881.79-0.020.340.32 His353-3.312.84-0.47-4.263.74-0.52 Ala354-2.09-16.50-18.59-0.29-28.46-28.75 Ser355-3.73-6.13-9.860.223.253.47 Ala356-2.12-3.15-5.27-3.12-4.44-7.56 Trp357-1.21-3.25-4.46-0.03-2.22-2.25 Val380-1.92-1.90-3.820.030.340.37 His383-0.41-17.94-18.350.94-11.22-10.28 Glu38411.35-54.99-43.6412.99-48.21-35.22 His3872.6412.8715.52-3.4413.9810.54 Phe3910.12-3.11-2.990.22-4.23-4.01 Glu411-1.2718.3117.034.56-5.12-0.56 Asp415-0.09-5.78-5.870.01-2.12-2.11 Phe457-0.070.810.74-0.45-4.39-4.84 Lys511-0.09-12.97-13.06-0.29-6.34-6.63 Phe512-0.041.581.54-1.29-8.35-9.64 His513-1.70-12.64-14.34-4.34-12.98-17.32 Val518-0.42-4.31-4.73-1.013.902.89 Tyr520-0.27-2.93-3.200.092.562.65 Arg522-0.12-2.56-2.68-2.57-5.24-7.81 Tyr523-0.89-4.19-5.08-9.243.54-5.70 Phe527-0.050.860.81-0.020.430.41总计-5.77-113.20-118.97-11.31-111.24-132.55
为了验证上述提出的结合模式,分别对不同结合体系的活性位点氨基酸残基进行了结合自由能分解计算 [29]。主要通过DS2.5中的“Calculate Interaction Energy protocol”模块进行计算,在此,调用了经典的CHARMm力场进行计算。结果由表5可知,在ACE的C-domain与VW、IW分别相互作用过程中,Ala354、Ser355、His383、Glu384、Lys511、Phe512和His513的总电势能对体系贡献较大。对VW-C-domain结合体系分析,静电力(-113.20 kJ/mol)比范德华力(-5.77 kJ/mol)对体系稳定起更大作用,特别是His513、Lys511、Ala354、His383和Glu384这些残基与VW之间的静电力起主导作用,分别为-12.64、-12.97、-16.50、-17.94 kJ/mol和-54.99 kJ/mol;His353和Ser355这两个残基对范德华力起主导作用(-3.31 kJ/mol和-3.73 kJ/mol)。
在IW与C-domain的相互作用中,静电力同样较范德华力起主导作用,Ala354、His383、Glu384和His513静电力相对更低,特别是 Glu384与IW的静电力能量负值最大(-48.21 kJ/mol),可能是因为与C-domain存在氢键作用。Tyr523表现出有利的范德华作用贡献(-9.24 kJ/mol)。有研究证明 [24],若抑制剂能与Glu384以氢键结合,可抑制ACE与Zn 2+的结合,并使其失去血压升高的能力,因此抑制剂与Glu384之间形成氢键作用至关重要。通过对C-domain活性位点周围残基的相互作用能计算及上述对接模式、氢键数目和强度等综合分析,可知Ala354、Ala356、His383、Glu384、Lys511、Phe512、His513和Tyr523对复合物的稳定性影响较大,其中Ala354、His383、Glu384和His513作为C-domain活性位点关键残基对复合物的稳定性贡献最大。
表 6 VW、IW与N-domain活性位点氨基酸残基间的相互作用能
Table 6 Electrostatic energy, van der Waals energy and total potential energy between the best poses of bioactive peptides obtained from docking results and the N-domain
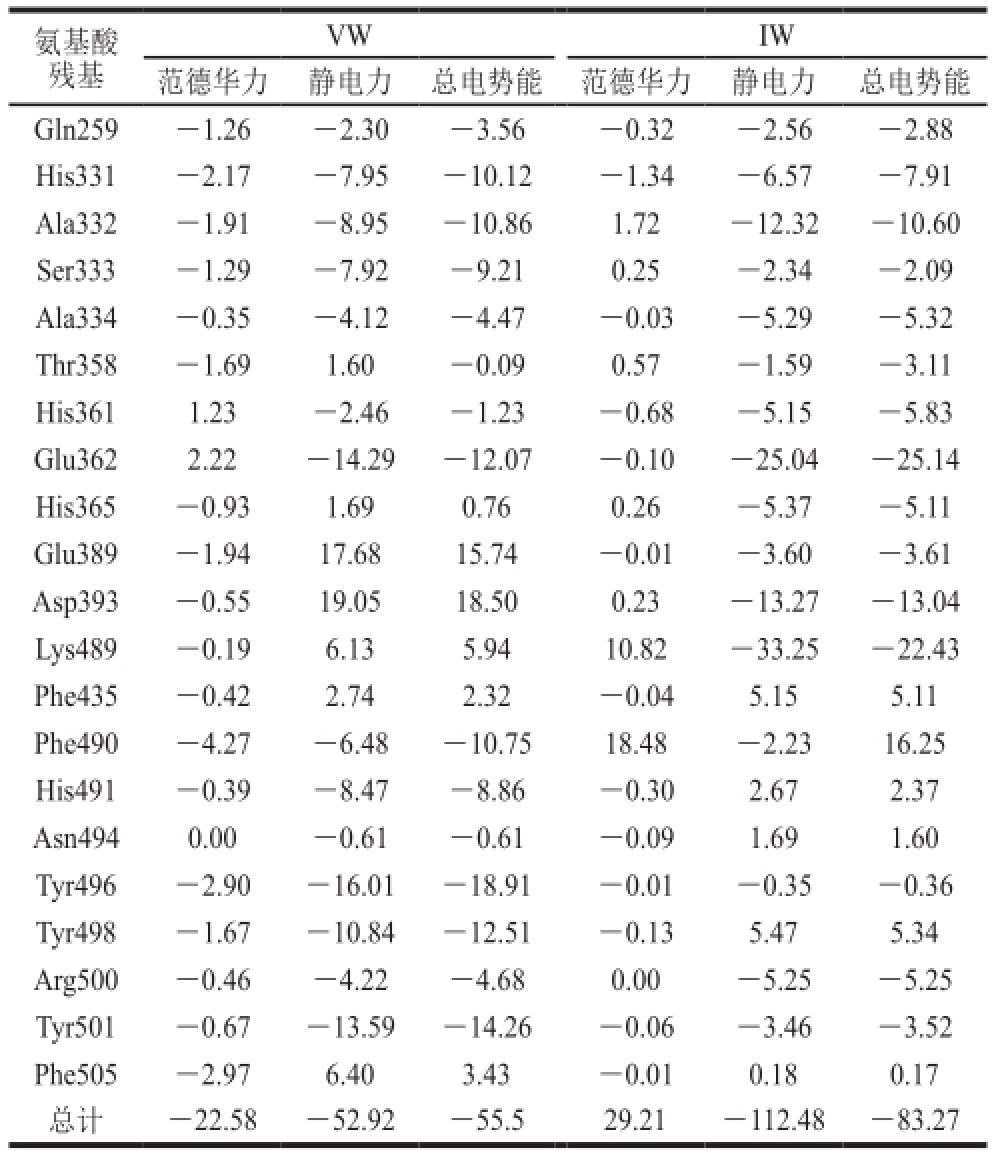
VWIW范德华力静电力总电势能范德华力静电力总电势能Gln259-1.26-2.30-3.56-0.32-2.56-2.88 His331-2.17-7.95-10.12-1.34-6.57-7.91 Ala332-1.91-8.95-10.861.72-12.32-10.60 Ser333-1.29-7.92-9.210.25-2.34-2.09 Ala334-0.35-4.12-4.47-0.03-5.29-5.32 Thr358-1.691.60-0.090.57-1.59-3.11 His3611.23-2.46-1.23-0.68-5.15-5.83 Glu3622.22-14.29-12.07-0.10-25.04-25.14 His365-0.931.690.760.26-5.37-5.11 Glu389-1.9417.6815.74-0.01-3.60-3.61 Asp393-0.5519.0518.500.23-13.27-13.04 Lys489-0.196.135.9410.82-33.25-22.43 Phe435-0.422.742.32-0.045.155.11 Phe490-4.27-6.48-10.7518.48-2.2316.25 His491-0.39-8.47-8.86-0.302.672.37 Asn4940.00-0.61-0.61-0.091.691.60 Tyr496-2.90-16.01-18.91-0.01-0.35-0.36 Tyr498-1.67-10.84-12.51-0.135.475.34 Arg500-0.46-4.22-4.680.00-5.25-5.25 Tyr501-0.67-13.59-14.26-0.06-3.46-3.52 Phe505-2.976.403.43-0.010.180.17总计-22.58-52.92-55.529.21-112.48-83.27氨基酸残基
同理,VW、IW与ACE的N-domain相互作用能情况如表6所示。对于VW-N-domain结合体系,His331、Ala332、Ser333、Glu362、Phe490、His491、Tyr496、 Tyr498和Tyr501总电势能对体系贡献较大。其中Tyr496、Glu362、Tyr501、Tyr498、 Ala332和His491表现出十分有利的静电力贡献(-16.01、-14.29、-13.59、-10.84、-8.95 kJ/mol和-8.47 kJ/mol)。这与2.1.2节中预测的结合模式基本一致,Tyr496和Tyr501都与VW之间存在着氢健相互作用。另外,从表6可以看出Phe490和 Phe505具有较为有利的范德华力贡献。在IW与N-domain的活性位点附近氨基酸残基相互作用中,静电力所起作用比范德华力大,Ala332、Asp393、Glu362和Lys489表现出明显的静电力作用(-12.32、-13.27、-25.04 kJ/mol和-33.25 kJ/mol)。通过对N-domain活性位点周围残基的能量分解值计算及上述对接模式、氢键数目和强度等综合分析,可知His331、Ala332、Ser333、Glu362、Asp393、Lys489、Phe490、 Tyr496、Tyr498和Tyr501对结合体系稳定性有较大影响,特别是Ala332、Glu362、Lys489、Tyr496和Tyr501作为N-domain活性位点关键残基对复合物的稳定性贡献最大。
表 7 IW、VW与两个结构域通过对接形成的最佳构象的结合能
Table 7 Binding energy values of the best conf i gurations in IW and VW obtained by molecular docking at the two ACE domains

注:K i为抑制剂常数,表示为±s。
抑制肽K i/(μmol/L)结合能/(kJ/mol)C-domainN-domainC-domainN-domain IW1.6±0.259.6±10.8-221.44-160.13 VW2.1±0.3151.6±24.5-248.83-135.83
对比肽分别与两个结构域的氨基酸残基间的相互作用能可知,C-domain存在较多静电贡献大的残基,且静电作用强度比N-domain大得多。N-domain残基范德华作用强度相对较大。一般来说,衡量一组配体和受体结合强弱可以通过结合能这一参数,对接预测结合能量越低,则表明活性肽与ACE间的结合越紧密 [30]。利用DS2.5的“calculate binding energy”得到VW-C-domain和VW-N-domain的结合能分别为-248.83 kJ/mol和-135.83 kJ/mol,IW-C-domain和IW-N-domain的结合能分别为-221.44 kJ/mol和-160.13 kJ/mol(表7),由此说明VW、IW对C-domain的结合力更强,因此两种肽均具有较好的C-domain选择性抑制活性。另一方面,从VW与两个结构域的结合能相对比较值来看,也高于IW,说明VW比IW具有更好的结构域选择性抑制,这一分析结果与Lunow等 [12]的实验结果是一致的。
本实验将两个ACE C-domain选择性抑制肽IW、VW分别与sACE的两个结构域对接,通过对对接结果的分析, IW、VW与C-domain、N-domain的结合具有相似的分子作用机制。不同的是,在氢键、疏水相互作用上IW、VW与C-domain结合作用明显强于N-domain,且IW、VW与C-domain的Zn 2+产生静电相互作用,在N-domain上无该作用力。通过结合体系的相互作用方式以及氨基酸残基的能量分解值可知,对C-domain活性起重要作用的残基包括Ala354、His383、Glu384和His513;对N-domain活性起重要作用的残基为Ala332、Glu362、Lys489、Tyr496和Tyr501。另外,通过比较复合体系的结合能,印证了IW、VW具有较好的C-domain选择性抑制作用,且VW的选择性抑制作用强于IW。以上研究可部分揭示ACE C-domain选择性抑制肽的作用机制,给出选择性抑制肽与ACE相互作用的直接证据,对进一步认识C-domain选择性抑制肽与ACE的结合原理有一定的理论指导意义,对于以ACE C-domain为靶点的药物设计提供了依据。
参考文献:
[1] LARAGH J H, BAER L, BRUNNER H R, et al. Renin, angiotensin and aldosterone system in pathogenesis and management of hypertensive vascular disease[J]. The American Journal of Medicine, 1972, 52(5): 633-652. DOI:10.1016/0002-9343(72)90054-X.
[2] ROKS A, BUIKEMA H, PINTO Y M, et al. The renin-angiotensin system and vascular function. the role of angiotensin II, angiotensinconverting enzyme, and alternative conversion of angiotensin I[J]. Heart and Vessels, 1997(Suppl 12): 119-124.
[3] AKIF M, SCHWAGER S L, ANTHONY C S, et al. Novel mechanism of inhibition of human angiotensin-I-converting enzyme (ACE) by a highly specific phosphinic tripeptide[J]. Biochemical Journal, 2011, 436(1): 53-59. DOI:10.1042/BJ20102123.
[4] MASUYER G, YATES C J, STURROCK E D, et al. Angiotensin-I converting enzyme (ACE): structure, biological roles, and molecular basis for chloride ion dependence[J]. Biological Chemistry, 2014, 395(10): 1135-1149. DOI:10.1515/hsz-2014-0157.
[5] ACHARYA K R, STURROCK E D, RIORDAN J F, et al. ACE revisited: a new target for structure-based drug design[J]. Nature Reviews Drug Discovery, 2003, 2(11): 891-902. DOI:10.1038/ nrd1227.
[6] BERNSTEIN K E, SHEN X Z, GONZALEZ-VILLALOBOS R A, et al. Different in vivo functions of the two catalytic domains of angiotensin-converting enzyme (ACE)[J]. Current Opinion in Pharmacology, 2011, 11(2): 105-111. DOI:10.1016/j.coph.2010.11.001.
[7] WEI L, ALHENC-GELAS F, CORVOL P, et al. The two homologous domains of human angiotensin I-converting enzyme are both catalytically active[J]. Journal of Biological Chemistry, 1991, 266(14): 9002-9008.
[8] GEORGIADIS D, BEAU F, CZARNY B, et al. Roles of the two active sites of somatic angiotensin-converting enzyme in the cleavage of angiotensin I and bradykinin insights from selective inhibitors[J]. Circulation Research, 2003, 93(2): 148-154. DOI:10.1161/01. RES.0000081593.33848.FC.
[9] BEZALEL S, MAHLAB-GURI K, ASHER I, et al. Angiotensinconverting enzyme inhibitor-induced angioedema[J]. The American Journal of Medicine, 2015, 128(2): 120-125.
[10] van ESCH J H M, TOM B, DIVE V, et al. Selective angiotensinconverting enzyme C-domain inhibition is sufficient to prevent angiotensin I-induced vasoconstriction[J]. Hypertension, 2005, 45(1): 120-125. DOI:10.1161/01.HYP.0000151323.93372.f5.
[11] 赵钰岚, 许传莲. 血管紧张素转换酶的结构功能及相关抑制剂[J]. 生物工程学报, 2008, 24(2): 171-176. DOI:10.13345/ j.cjb.2008.02.027.
[12] LUNOW D, KAISER S, RUCKRIEMEN J, et al. Tryptophancontaining dipeptides are C-domain selective inhibitors of angiotensin converting enzyme[J]. Food Chemistry, 2015, 166: 596-602. DOI:10.1016/j.foodchem.2014.06.059.
[13] LUNOW D, KAISER S, BRUCKNER S, et al. Selective release of ACE-inhibiting tryptophan-containing dipeptides from food proteins by enzymatic hydrolysis[J]. European Food Research and Technology, 2013, 237(1): 27-37. DOI:10.1007/s00217-013-2014-x.
[14] LI Guanhong, LE Guowei, SHI Yonghui, et al. Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J]. Nutrition Research, 2004, 24(7): 469-486. DOI:10.1016/j.nutres.2003.10.014.
[15] NATESH R, SCHWAGER S L U, STURROCK E D, et al. Crystal structure of the human angiotensin-converting enzyme-lisinopril complex[J]. Nature, 2003, 421: 551-554. DOI:10.1038/nature01370.
[16] PAN Daodong, GUO Huiqing, ZHAO Bo, et al. The molecular mechanisms of interactions between bioactive peptides and angiotensin-converting enzyme[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(13): 3898-3904. DOI:10.1016/j.bmcl.2011.05.033.
[17] PAN Daodong, CAO Jinxuan, GUO Huiqing, et al. Studies on purif i cation and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J]. Food Chemistry, 2012, 130(1): 121-126. DOI:10.1016/j.foodchem.2011.07.011.
[18] 周敏. 小分子肽抑制血管紧张素转化酶的分子动力学模拟研究[D].北京: 北京化工大学, 2011: 17.
[19] 王伟, 沈生荣, 冯凤琴. 基于药效团的血管紧张素转换酶抑制肽的结构优化[J]. 中国科学, 2008, 38(4): 357-364. DOI:10.3321/ j.issn:1006-9240.2008.04.012
[20] 朱志远, 张燕, 李征, 等. 受体蛋白与药物分子对接的研究进展[J].中国临床药理学与治疗学, 2009, 14(11): 1308-1313.
[21] HE R, ALUKO R E, JU X G. Evaluating molecular mechanism of hypotensive peptides interactions with renin and angiotensin converting enzyme[J]. PLoS ONE, 2014, 9(3): e91051. DOI:10.1371/ journal.pone.0091051.
[22] LI Peng, JIA Jia, FANG Ming, et al. In vitro and in vivo ACE inhibitory of pistachio hydrolysates and in silico mechanism of identif i ed peptide binding with ACE[J]. Process Biochemistry, 2014, 49(5): 898-904. DOI:10.1016/j.procbio.2014.02.007.
[23] NCHINDA A T, CHIBALE K, REDELINGHUYS P, et al. Synthesis and molecular modeling of a lisinopril-tryptophan analogue inhibitor of angiotensin I-converting enzyme[J]. Bioorganic & Medicinal Chemistry Letters, 2006, 16(17): 4616-4619. DOI:10.1016/ j.bmcl.2006.06.004.
[24] CORRADI H R, SCHWAGER S L U, NCHINDA A T, et al. Crystal structure of the N domain of human somatic angiotensin I-converting enzyme provides a structural basis for domain-specific inhibitor design[J]. Journal of Molecular Biology, 2006, 357(3): 964-974. DOI:10.1016/j.jmb.2006.01.048.
[25] GUAN Shanshan, HAN Werwei, ZHANG Hao, et al. Insight into the interactive residues between two domains of human somatic angiotensin-converting enzyme and Angiotensin II by MM-PBSA calculation and steered molecular dynamics simulation[J]. Journal of Biomolecular Structure and Dynamics, 2016, 34(1): 15-28. DOI:10.10 80/07391102.2015.1007167.
[26] MONTES M, MITEVA M A, VILLOUTREIX B O. Structurebased virtual ligand screening with LigandFit: pose prediction and enrichment of compound collections[J]. Proteins: Structure, Function, and Bioinformatics, 2007, 68(3): 712-725. DOI:10.1002/prot.21405.
[27] TAHA M O, ALDAMEN M A. Effects of variable docking conditions and scoring functions on corresponding protein-aligned comparative molecular field analysis models constructed from diverse human protein tyrosine phosphatase 1B inhibitors[J]. Journal of Medicinal Chemistry, 2005, 48(25): 8016-8034. DOI:10.1021/jm058047o.
[28] LABERGE M, KOVESI I, YONETANI T, et al. R-state hemoglobin bound to heterotropic effectors: models of the DPG, IHP and RSR13 binding sites[J]. FEBS Letters, 2005, 579(3): 627-632. DOI:10.1016/ j.febslet.2004.12.033.
[29] WU J P, ALUKO R E, NAKAI S. Structural requirements of angiotensin I-converting enzyme inhibitory peptides: quantitative structure-activity relationship study of di-and tripeptides[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 732-738. DOI:10.1021/jf051263l.
[30] 管骁, 刘静, 苏淅娜. ACE 抑制三肽与ACE相互作用的分子机制[J]. 分析测试学报, 2014, 33(10): 1116-1122. DOI:10.3969/ j.issn.1004 -4957.2014.10.004 .
Binding Modes between C-Domain Selective Angiotensin-Converting Enzyme (ACE) Inhibitory Dipeptides and ACE Domains
GUAN Xiao
1, HONG Yanhan
1, LIU Jing
2, LI Jingjun
3, SUN Zhu
4, HAN Fei
5
(1. School of Medical Instruments and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. College of Information Technology, Shanghai Maritime University, Shanghai 201306, China; 3. Jiangsu Longevity Group Co. Ltd., Wuxi 226500, China; 4. Inner Mongolia Yangufang Group Co. Ltd., Hohhot 201106, China; 5. Academy of State Administration of Grain, Beijing 100037, China)
Abstract:The C-domain selective angiotensin-converting enzyme (ACE) inhibitory activities of food-derived dipeptides, including Ile-Trp (IW) and Val-Trp (VW), were recently verif i ed by experiments. However, their interaction modes with the C-domain and N-domain of ACE and the molecular mechanism remain unclear. In the present study, f l exible molecule docking technology was used to elucidate the active sites, interaction energy and intermolecular force types between the peptides and ACE. The results demonstrated that hydrogen bond, hydrophilic, hydrophobic and electrostatic interactions, and coordinate bond existed between the active pockets of the C-domain and IW and VW. The interaction of the N-domain with the peptides was similar to that of the C-domain, which had fewer hydrogen bonds and no electrostatic interactions. By calculating the binding energy difference between the two domains, we could seek the theoretical support for the different inhibitory potency of IW and VW. The above information will be helpful for the development of C-domain selective ACE inhibitory peptides.
Key words: ACE; C-domain selective inhibitory peptides; f l exible docking; interaction mode
DOI:10.7506/spkx1002-6630-201705026
中图分类号:O629.7
文献标志码:A
文章编号:1002-6630(2017)05-0160-07
引文格式:
管骁, 洪延涵, 刘静, 等. ACE C-结构域选择性抑制二肽与ACE结构域的结合模式[J]. 食品科学, 2017, 38(5): 160-166.
DOI:10.7506/spkx1002-6630-201705026. http://www.spkx.net.cn
GUAN Xiao, HONG Yanhan, LIU Jing, et al. Binding modes between C-domain selective angiotensin-converting enzyme (ACE) inhibitory dipeptides and ACE domains[J]. Food Science, 2017, 38(5): 160-166. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201705026. http://www.spkx.net.cn
收稿日期:2016-07-01
基金项目:上海市自然科学基金项目(14ZR1419200)
作者简介:管骁(1979—),男,副教授,博士,研究方向为食品功能与营养。E-mail:gnxo@163.com