于 洋 1,2,于文皓 1,2,晏嘉泽 2,董 浩 2,董家耕 3,靳 艳 2,*,祁艳霞 1,*
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.中国科学院大连化学物理研究所,中国科学院分离分析化学重点实验室,辽宁 大连 116023;3.辽宁辉山生物科技研究有限公司,辽宁 沈阳 110031)
摘 要:利用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)的方法,对4 种酸乳(优味舒风味发酵乳、风味发酵乳、初乳24+K风味发酵乳和十天风味发酵乳)的肽谱进行分析,分别鉴定到152、125、364 条和274 条肽段。利用血管紧张素转换酶(angiotensin converting enzyme,ACE)的抑制活性比较以上4 种酸乳的生物活性,在相同质量浓度2.0 mg/L时,4 种酸乳ACE抑制率分别为46.84%、42.75%、77.41%和63.84%。初乳24+K风味发酵乳含有肽的数量大、ACE抑制活性高可能与其独特的原料成分相关。对4 种酸乳的肽谱及ACE抑制活性的考察,为进一步研究酸乳肽的功能特点和ACE抑制活性提供了理论依据。
关键词:酸乳;肽谱;液相色谱-串联质谱;ACE抑制活性
酸乳是一种公认的健康食品,是牛乳通过乳酸菌发酵制成的具特殊风味的乳制品。在酸乳发酵过程中,有20%左右的蛋白质在乳酸菌的作用下被分解成为小肽和氨基酸等,其中乳酸菌及其分解产物能产生特殊的保健功效,如预防心脑血管疾病、维持改善胃肠道菌群平衡、抗衰老等 [1-2]。酸乳中的益生素、VD和钙对降低2型糖尿病发病风险有积极影响 [3],大量摄入酸乳及其他乳制品可降低2型糖尿病发病几率 [4]。因此酸乳是一种很好的提高机体免疫能力、调节机体生理代谢功能的营养保健食品。
研究表明酸乳中的生物活性肽具有血管紧张素Ⅰ转换酶(angiotensin converting enzyme,ACE)抑制活性、抗氧化和免疫调节等活性 [5]。ACE是一种在血压调节中起关键作用的酶 [6],已从牛乳 [7]、发酵乳 [8-9]和奶酪 [10]中发现具有降血压功能的ACE抑制肽。崔磊等 [11]使用了凝胶层析分离纯化低分子质量肽的方法研究了国内6 种市售酸乳中的ACE抑制活性,6 种酸乳均显示具有ACE抑制活性。牛乳中的蛋白质在乳酸菌的作用下产生长短、活性各异的肽,目前常规的分析方法已无法准确反映酸乳中的肽组成及其活性。液相色谱-串联质谱(liquid chromatograph-tandem mass spectrometry,LC-MS/MS)是一种高通量的分析方法,具有灵敏度高、选择性强、准确性好等特点。随着色谱和质谱技术的发展,LC-MS/MS越来越普遍地应用于药物、食品等多个领域,也被应用于分析鉴定酸乳中的肽 [12]。为了解不同酸乳的肽组成与生物活性之间的差异以及这种差异与酸乳原料和菌种之间的相关性,利用LC-MS/MS研究了4 种市售酸乳的肽谱,研究4 种酸乳的ACE抑制活性,并对其肽谱及活性肽进行了分析和比较,以期为酸乳肽谱及活性的进一步研究提供理论依据。
1.1 材料与试剂
酸乳:辉山乳业出品优味舒风味发酵乳(YWS),风味发酵乳(FW),初乳24+K风味发酵乳(CR24+K)和十天风味发酵乳(ST)购自当地超市; 甲酸(formic acid,FA) 美国Fluka公司;乙腈(acetonitrile,ACN,色谱纯) 德国Merck公司;甲醇(色谱纯) 美国Thermo公司;三氟乙酸(trifluoroacetic acid,TFA)、ACE模拟底物N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰甘氨酰甘氨酸(N-[3-(2-furyl) acryloyl]-L-Phe-Gly-Gly,FAPGG)、兔肺丙酮粉(lung acetone powder from rabbit) 美国Sigma公司;Magic C 18AQ反相色谱填料(5 μm,12 nm) 美国MichromBioRecources公司;石英毛细管 美国Polymicro Technologies公司;其他化学试剂均为分析纯。
1.2 仪器与设备
Finnigan Surveyor液相色谱泵、组合型离子阱轨道阱质谱仪(LTQ Orbitrap XL)配有纳升电喷雾离子源及Xcalibur2.1数据处理系统、SpeedVac真空冷冻干燥机美国Thermo公司;Synergy H1全功能酶标仪 美国BioTek仪器有限公司;Milli-Q超纯水一体机 美国Millipore公司;Allegra 64R台式高速冷冻离心机 美国Beckman公司。
1.3 方法
1.3.1 样品的制备
取酸乳样品100 mL,加入50 mL pH 2.0、35 mmol/L NaCl溶液,218×g均质10 min。然后12 235×g、4 ℃条件下离心20 min,收集上清液。由于多肽的分子质量一般在10 kD以下,上清液用10 kD超滤管超滤,12 235×g、室温条件下离心20 min,收集滤液,用于ACE活性检测。
1.3.2 样品的预处理
中国科学院分离分析化学重点实验室自制的C 18SPE预处理柱经3 倍柱体积的乙腈活化,再用3 倍柱体积的0.1%(V/V)TFA溶液洗去乙腈。样品用50%(V/V)TFA溶液调节pH值至2~3后过柱。经3 倍柱体积的0.1%(V/V)TFA液脱盐后,用1 mL 80%(V/V)乙腈/0.1%(V/V)TFA溶液分3 次洗脱,洗脱液冷冻干燥后于-20 ℃保存,用于质谱分析。
1.3.3 反相液相色谱-串联质谱分析
将冻干样品用0.1%(V/V)的甲酸水溶液配制成0.5 μg/μL的溶液,离心,取上清液进行反相液相色谱(reversed phase liquid chromatography,RPLC)-MS/ MS分析,进样量为20 μL。色谱分析条件:流动相A为0.1%(V/V)的甲酸溶液,流动相B为0.1%(V/V)的甲酸-乙腈溶液,流速为200 nL/min。梯度洗脱过程如下:0~2 min,0%~5% B;2~95 min,5%~35% B;95~108 min,35%~80% B;108~120 min,80%~0% B。自动进样系统包括一根4 cm的自制毛细管富集柱(200 μm,内径)和一根12 cm的自制毛细管分析柱(75 μm,内径)。两根柱子均填充C 18AQ填料。
质谱分析条件:毛细管的温度为200 ℃,电喷雾电压为1.8 kV,归一化碰撞能量为35.0%,一级扫描范围400~2 000 D。均使用数据依赖模式对MS和MS/MS进行图谱采集,扫描模式为全扫描。全扫描中丰度最高的6 个离子峰进行MS/MS扫描,其中动态排除设置为:重复次数为2,重复容忍时间为30 s,动态排除时间为90 s。利用Xcalibur软件进行系统控制和数据收集。每个样品重复两次,对两次结果中重复的肽段视为有效数据进行分析。
1.3.4 数据库检索
Xcalibur采集的 *.RAW文件用Thermo Proteome Discoverer Daemon(v1.4)转换成 *.MGF格式,之后用Mascot 2.3.0软件在牛(bovine,蛋白质数目为17 890)蛋白数据库(http://www.uniprot.org/)中进行检索。搜库参数如下:不设置酶切、最大漏切数和固定修饰,可变修饰设置为甲硫氨酸的氧化(+15.994 9 D)。母离子的质量容忍偏差为20×10 -6,碎片离子为0.8 D。导出肽段时设置Score>20,P<0.01,同时控制假阳性率(false discovery rate,FDR)<1%。
1.3.5 ACE抑制活性的检测
参考Murray等 [13]的方法并按本实验所需条件部分调整方法。用磷酸盐缓冲液(phosphate buffer saline,PBS)(100 mmol/L,pH 8.3,含300 mmol/L NaCl)配制一定浓度的抑制剂溶液(样品)和1.6 mmol/L的FAPGG溶液。20 mg兔肺丙酮粉加入20 倍体积的PBS(100 mmol/L,pH 8.3,含5%丙三醇),4 ℃振摇过夜。30 000×g、4 ℃离心30 min,上清液保存于4 ℃,临用前用PBS(100 mmol/L,pH 8.3,含300 mmol/L NaCl)稀释5 倍,即为实验所用的ACE溶液。
实验设置样品组和对照组。样品组:85 μL抑制剂溶液与15 μL的ACE溶液混合均匀,加入100 μL FAPGG溶液,立即于340 nm波长下测定吸光度,记为A 0。37 ℃温育60 min后再次于340 nm波长下测定吸光度,记为A 1。测定各个样品的吸光度,令ΔA=A 0-A 1。每个样品平行测定3 次。对照组:将抑制剂溶液用缓冲溶液替代,其他步骤同样品组。
计算抑制率的公式如下:
式中:I表示抑制率/%;ΔA control表示对照组0 min与60 min时吸光度的差值;ΔA sample表示样品组0 min与60 min时吸光度的差值。
1.4 统计分析
统计分析用t检验法进行分析,结果以
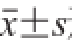 形式表示。
形式表示。
2.1 酸乳ACE抑制活性
表 1 4 种酸乳肽样品ACE抑制率
Table 1 ACE inhibitory activities of four yogurt samples

注:同一列中不同肩标小写字母表示具有显著性差异(P<0.05)。
样品质量浓度/(mg/mL)0.51.02.0 YWS7.32±1.15 a28.96±1.34 a46.84±2.68 aFW6.91±0.87 a20.36±4.92 b42.75±5.71 aCR24+K16.35±2.34 b54.64±2.47 c77.41±4.75 bST13.77±2.40 b31.57±4.87 ad63.84±2.80 c
ACE抑制活性是乳源活性肽中比较明确且研究较多的生物活性 [14-18],本研究利用ACE抑制活性作为酸乳活性的检测指标。表1为4 种酸乳样品的ACE抑制率,样品质量浓度分别为0.5、1.0、2.0 mg/mL。由数据可以看出,4 种酸乳样品的ACE抑制率均具有剂量依赖性,每种酸乳在不同质量浓度之间的ACE抑制率均具有显著性差异(P<0.05);在3 个样品质量浓度下,相同质量浓度条件下CR24+K的ACE的抑制率均为最高,且当样品质量浓度为1.0 mg/mL和2.0 mg/mL时,CR24+K的ACE的抑制率与其他3 种酸乳相比具有显著性差异(P<0.05),因此CR24+K的ACE抑制能力与其他3 种酸乳相比具有明显优势。综上所述,4 种酸乳的ACE抑制能力排序为CR24+K>ST>YWS>FW。
2.2 基于LC-MS/MS的酸乳肽谱
酸乳按照1.3节中方法处理后进行LC-MS/MS分析,基峰色谱图如图1所示,4 种酸乳的基峰谱图差异较大,CR24+K的基峰谱与其他3 种相比,出峰时间较为集中,绝大多数高丰度的峰出现在20~50 min。所检测到的肽的维恩(Venn)图见图2,YWS、FW、CR24+K和ST样品分别鉴定到152、125、364、274 条肽段,其中有23 条肽段在4 种样品中均检测到,有52、19、213、79 条肽段分别仅在对应样品中检测到。
4 种酸乳样品中,CR24+K不仅鉴定到的肽段数量最多,且独有肽的数量同样最多,364 条肽段中有213 条肽段在其他3 种酸乳中均未鉴定到,其数量显著高于其他3 种酸乳的52、19 条和79条。CR24+K中独有的213 条肽段中,源于α s1-酪蛋白、α s2-酪蛋白、β-酪蛋白和κ-酪蛋白的肽段分别有48、25、69、71 条。其中一些肽已有文献报道具有不同生理活性,如源于α s2-酪蛋白的YQKFPQY f(89~95)具有较高的ACE抑制活性 [19];源于β-酪蛋白的PGPIPN f(63~68)具有免疫调节活性 [20];源于κ-酪蛋白的YYQQKPVA f(42~49)和LPYPY f(56~60)则分别具有抗菌活性 [21]和DPP-IV抑制活性 [22]。β-酪啡肽是由β-酪蛋白酶解得到的一类阿片活性肽,其中研究最多的β-酪啡肽7(β-casomorphin-7,β-CM7)是来源于β-酪蛋白60~66 位的一种具有阿片活性的七肽物质(YPFPGPI) [23]。β-CM7在牛乳 [24]、奶酪 [25]等乳制品中均有报道,但在酸乳中没有检测出β-CM7 [25-26],本研究的酸乳样品中也均未检测到β-CM7。
酸乳商品信息中标注CR24+K的发酵菌种为嗜热链球菌、保加利亚乳杆菌、乳双歧杆菌和嗜酸乳杆菌,与YWS、FW所用菌种相同,尽管相同菌株投放比例不同也可能会影响肽的产量,但并非导致肽的数量及活性差异的主要原因。4 种酸乳的蛋白质量浓度不同,但质谱分析时所用样品蛋白质量浓度相同,因此肽的数量及活性差异也不是由蛋白质量浓度所引起。这些表明,酸乳原料组成和配方与肽的数量及抑制活性可能有直接关系,酸乳肽谱及活性的研究可为酸乳产品的开发设计提供技术支持。
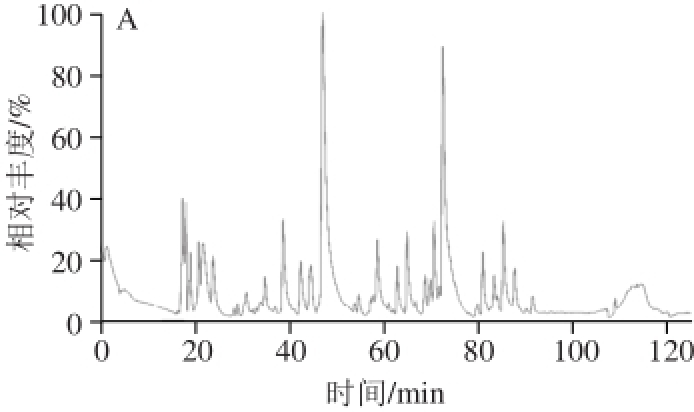
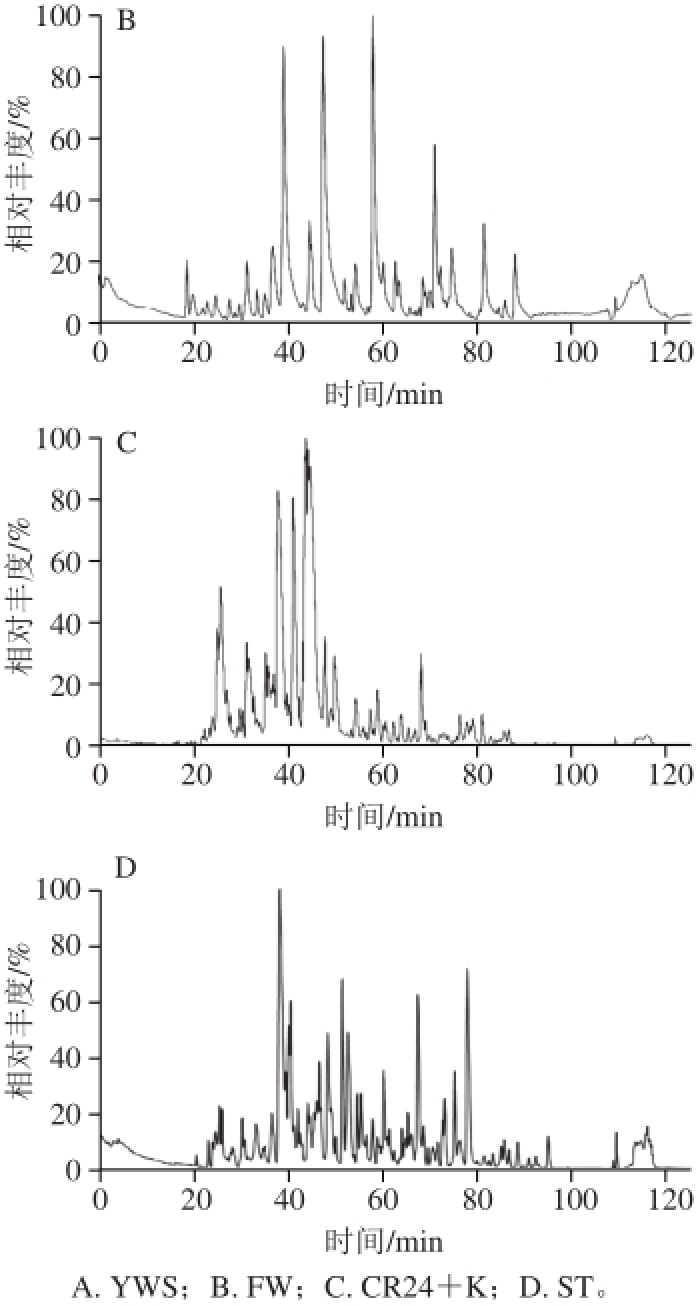
图 1 4 种酸乳基峰色谱图
Fig. 1 Base peak chromatograms of four yogurt samples by LC-MS/MS analysis

图 2 LC-MS/MS鉴定4 种酸乳肽数目
Fig. 2 Venn diagram showing the numbers of peptides identif i ed in four yogurts by LC-MS/MS analysis
2.3 酸乳中ACE抑制肽
4 种酸乳中鉴定到已有文献报道的典型的ACE抑制肽,如从YWS中鉴定到的源于α s2-酪蛋白的AMKPWIQPK f(189~197),从CR24+K和ST中鉴定到的源于β-酪蛋白的LNVPGEIVE f(6~14)、NIPPLTQTPV f(73~82)等肽段均具有较高的ACE抑制活性,半抑制浓度(half-inhibitory concentration,IC 50)分别为600、300、173 μmol/L [27]。由2.1、2.2节可知CR24+K ACE抑制活性最高且鉴定到的肽段数最多。表2列出了CR24+K独有肽段中的ACE抑制肽与潜在的ACE抑制肽。其中4 条肽段与文献中的肽段序列一致,分别为源于α s1-酪蛋白FPEVFGK f(28~35),源于β-酪蛋白的TPVVVPPFLQP f(80~90)、KVLPVPQ f(169~175)以及源于κ-酪蛋白的LPYPY f(56~60),IC 50分别为140、749、1 000、28.9 μmol/L。6 条肽段与文献中的肽段序列相似且C末端三肽的序列完全一致。由于ACE抑制肽的C末端三肽与其抑制能力关系紧密 [28],因此可以认为这6 条肽段具有潜在的ACE抑制活性。在检测到的ACE抑制肽或潜在的ACE抑制肽中,源于α s1-酪蛋白、α s2-酪蛋白和κ-酪蛋白的ACE抑制肽分别有2、1、1 条,源于β-酪蛋白的有6 条,可见由β-酪蛋白释放的ACE抑制肽数量较多。
表 2 CR24+K 213 条独有肽段中的ACE抑制肽或潜在的ACE抑制肽
Table 2 ACE inhibitory peptides and potential ACE inhibitory peptides out of 213 unique peptides of Churu24+K fl avor fermented milk

ACE抑制肽文献中的ACE抑制肽ACE IC 50 /(μmol/L)α s1-酪蛋白f(26~34)APFPEVFGKFFVAPFPEVFGK [29]77 α s1-酪蛋白f(28~35)FPEVFGKFPEVFGK [30]140 α s2-酪蛋白f(188~196)KAMKPWIQPKMKPWIQPK [31]300 β-酪蛋白f(6~14)PGEIVELNVPGEIVE [30]300 β-酪蛋白f(56~68)QSLVYPFPGPIPNYPFPGPIPN [32]15 β-酪蛋白f(80~90)TPVVVPPFLQPTPVVVPPFLQP [33]749 β-酪蛋白f(134~143)HLPLPLLQSWLQSW [31]500 β-酪蛋白f(169~175)KVLPVPQKVLPVPQ [31]1 000 β-酪蛋白f(195~209)EPVLGPVRGPFPIIVVRGPFPIIV [34]630 κ-酪蛋白f(56~60)LPYPYLPYPY [35]28.9蛋白名称及片段ACE抑制肽或潜在的
本研究利用LC-MS/MS对4 种市售酸乳的肽谱进行研究,YWS、FW、CR24+K和ST共分别鉴定到152、125、364、274 条肽段,其中独有的肽段分别有52、19、213、79 条。初乳24+K风味发酵乳拥有最多的总肽段数和独有的肽段数。以ACE抑制活性作为酸乳生物活性检测指标,结果显示初乳24+K风味发酵乳的ACE的抑制活性最高。经过肽谱、ACE抑制活性与原料、菌种的相关性研究,表明酸乳的原料和组成可能影响其产品的肽数量和ACE抑制活性。
通过对酸乳肽谱和ACE抑制活性的考察,可更好地了解酸乳肽谱及活性的性质和特点,为进一步研究酸乳肽的功能和特点以及乳源ACE抑制肽提供了理论依据。
参考文献:
[1] HERNÁNDEZ-LEDESMA B, GARCÍA-NEBOT M J, FERNÁNDEZTOMÉ S, et al. Dairy protein hydrolysates: peptides for health benefits[J]. International Dairy Journal, 2014, 38(2): 82-100. DOI:10.1016/j.idairyj.2013.11.004.
[2] RICCI-CABELLO I, HERRERA M O, ARTACHO R. Possible role of milk-derived bioactive peptides in the treatment and prevention of metabolic syndrome[J]. Nutrition Reviews, 2012, 70(4): 241-255. DOI:10.1111/j.1753-4887.2011.00448.
[3] PASIN G, COMERFORD K B. Dairy foods and dairy proteins in the management of type 2 diabetes: a systematic review of the clinical evidence[J]. Advances in Nutrition, 2015, 6(3): 245-259. DOI:10.3945/ an.114.007690.
[4] CHEN M, SUN Q, GIOVANNUCCI E, et al. Dairy consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated metaanalysis[J]. Bmc Medicine, 2014, 12(4): 1088-1096. DOI:10.1186/ s12916-014-0215-1.
[5] SAAVEDRA L, HEBERT E M, MINAHK C, et al. An overview of“omic” analytical methods applied in bioactive peptide studies[J]. Food Research International, 2013, 54(1): 925-934. DOI:10.1016/ j.foodres.2013.02.034.
[6] FOLTZ M, MEYNEN E E, BIANCO V, et al. Angiotensin converting enzyme inhibitory peptides from a lactotripeptide-enriched milk beverage are absorbed intact into the circulation[J]. The Journal of Nutrition, 2007, 137(4): 953-958.
[7] OTTE J, SHALABY S M, ZAKORA M, et al. Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates: effect of substrate, enzyme and time of hydrolysis[J]. International Dairy Journal, 2007, 17(5): 488-503. DOI:10.1016/j.idairyj.2006.05.011.
[8] HERNÁNDEZ-LEDESMA B, MIRALLES B, AMIGO L, et al. Identif i cation of antioxidant and ACE-inhibitory peptides in fermented milk[J]. Journal of the Science of Food and Agriculture, 2005, 85(6): 1041-1048. DOI:10.1002/jsfa.2063.
[9] PAN D D, GUO Y X. Optimization of sour milk fermentation for the production of ACE-inhibitory peptides and purification of a novel peptide from whey protein hydrolysate[J]. International Dairy Journal, 2010, 20(7): 472-479. DOI:10.1016/j.idairyj.2010.01.007.
[10] STUKNYTĖ M, CATTANEO S, MASOTTI F, et al. Occurrence and fate of ACE-inhibitor peptides in cheeses and in their digestates following in vitro, static gastrointestinal digestion[J]. Food Chemistry, 2015, 168: 27-33. DOI:10.1016/j.foodchem.2014.07.045.
[11] 崔磊, 张少辉. 国内6 种市售酸奶中的ACE抑制肽研究[J]. 中国乳品工业, 2012, 40(6): 30-32. DOI:10.3969/j.issn.1001-2230.2012.06.008.
[12] JIN Y, YU Y, QI Y X, et al. Peptide profiling and the bioactivity character of yogurt in the simulated gastrointestinal digestion[J]. Journal of Proteomics, 2016, 141: 24-46. DOI:10.1016/ j.jprot.2016.04.010.
[13] MURRAY B A, WALSH D J, FITZGERALD R J. Modification of the furanacryloyl-l-phenylalanylglycylglycine assay for determination of angiotensin-I-converting enzyme inhibitory activity[J]. Journal of Biochemical and Biophysical Methods, 2004, 59(2): 127-137. DOI:10.1016/j.jbbm.2003.12.009.
[14] CHAVES-LÓPEZ C, TOFALO R, SERIO A, et al. Yeasts from Colombian Kumis as source of peptides with Angiotensin I converting enzyme (ACE) inhibitory activity in milk[J]. International Journal of Food Microbiology, 2012, 159(1): 39-46. DOI:10.1016/ j.ijfoodmicro.2012.07.028.
[15] GONZALEZ-GONZALEZ C R, TUOHY K M, JAUREGI P. Production of angiotensin-I-converting enzyme (ACE) inhibitory activity in milk fermented with probiotic strains: effects of calcium, pH and peptides on the ACE-inhibitory activity[J]. International Dairy Journal, 2011, 21(9): 615-622. DOI:10.1016/j.idairyj.2011.04.001.
[16] OTTE J, LENHARD T, FLAMBARD B, et al. Influence of fermentation temperature and autolysis on ACE-inhibitory activity and peptide prof i les of milk fermented by selected strains of Lactobacillus helveticus and Lactococcus lactis[J]. International Dairy Journal, 2011, 21(4): 229-238. DOI:10.1016/j.idairyj.2010.12.008.
[17] RASIKA D M D, UEDA T, JAYAKODY L N, et al. ACE-inhibitory activity of milk fermented with Saccharomyces cerevisiae K7 and Lactococcus lactis subsp. lactis NBRC 12007[J]. Journal of the National Science Foundation of Sri Lanka, 2015, 43(2): 141-151. DOI:10.4038/jnsfsr.v43i2.7942.
[18] SHAKERIAN M, RAZAVI S H, ZIAI S A, et al. Proteolytic and ACE-inhibitory activities of probiotic yogurt containing non-viable bacteria as affected by different levels of fat, inulin and starter culture[J]. Journal of Food Science and Technology, 2015, 52(4): 2428-2433. DOI:10.1007/s13197-013-1202-9.
[19] CONTRERAS M D M, CARRÓN R, MONTERO M J, et al. Novel casein-derived peptides with antihypertensive activity[J]. Journal of Dairy Science, 2009, 19(10): 566-573. DOI:10.1016/ j.idairyj.2009.05.004.
[20] MEISEL H. Overview on milk protein-derived peptides[J]. International Dairy Journal, 1998, 8(Suppl 5/6): 363-373. DOI:10.1016/S0958-6946(98)00059-4.
[21] LÓPEZ-EXPÓSITO I, MINERVINI F, AMIGO L, et al. Identif i cation of antibacterial peptides from bovine kappa-casein[J]. Journal of Food Protection, 2006, 69(12): 2992-2997.
[22] NONGONIERMA A B, FITZGERALD R J. Susceptibility of milk protein-derived peptides to dipeptidyl peptidase IV (DPP-IV) hydrolysis[J]. Food Chemistry, 2014, 145(7): 845-852. DOI:10.1016/ j.foodchem.2013.08.097.
[23] NGUYEN D D, JOHNSON S K, BUSETTI F, et al. Formation and degradation of beta-casomorphins in dairy processing[J]. Critical Reviews in Food Science and Nutrition, 2015, 55(14): 1955-1967. DOI: 10.1080/10408398.2012.740102.
[24] de NONI I, CATTANEO S. Occurrence of β-casomorphins 5 and 7 in commercial dairy products and in their digests following in vitro simulated gastro-intestinal digestion[J]. Food Chemistry, 2010, 119(2): 560-566. DOI:10.1016/j.foodchem.2009.06.058.
[25] ANNA C, ELŻBIETA K, HENRYK K, et al. Milk from cows of different β-casein genotypes as a source of β-casomorphin-7[J]. International Journal of Food Sciences and Nutrition, 2012, 63(4): 426-430. DOI:10.3109/09637486.2011.634785.
[26] SCHIEBER A, BRÜCKNER H. Characterization of oligo- and polypeptides isolated from yoghurt[J]. European Food Research and Technology, 2000, 210(5): 310-313. DOI:10.1007/s002170050555.
[27] van de VEN C. Biochemical and functional characterisation of casein and whey protein hydrolysates. A study on the correlations between biochemical and functional properties using multivariate data analysis[D]. Wageninge: Wageningen Universiteit, 2002: 13.
[28] CUSHMAN D W, ONDETTI M A. Design of angiotensin converting enzyme inhibitors[J]. Nature Medicine, 1999, 5(10): 1110-1112. DOI:10.1038/13423.
[29] JÉRÔME T, LAURENT M, JEAN-LUC G. Angiotensin-I-converting enzyme inhibitory peptides from tryptic hydrolysate of bovine α S2-casein[J]. FEBS Letters, 2002, 531(2): 369-374. DOI:10.1016/ S0014-5793(02)03576-7.
[30] van de VEN C, GRUPPEN H, de BONT D B A, et al. Optimisation of the angiotensin converting enzyme inhibition by whey protein hydrolysates using response surface methodology[J]. International Dairy Journal, 2002, 12(10): 813-820. DOI:10.1016/S0958-6946(02)00077-8.
[31] MAENO M, YAMAMOTO N, TAKANO T. Identification of an antihypertensive peptide from casein hydrolysate produced by a proteinase from Lactobacillus helveticus, CP790[J]. Journal of Dairy Science, 1996, 79(8): 1316-1321. DOI:10.3168/jds.S0022-0302(96)76487-1.
[32] RICHARD J F, BRIAN A M, DANIEL J W. The emerging role of dairy proteins and bioactive peptides in nutrition and healthhypotensive peptides from milk proteins[J]. The Journal of Nutrition, 2004, 134: 980-988.
[33] ABUBAKAR A, SAITO T, KITAZAWA H, et al. Structural analysis of new antihypertensive peptides derived from cheese whey protein by proteinase K digestion[J]. Journal of Dairy Science, 1998, 81(12): 3131-3138. DOI:10.3168/jds.S0022-0302(98)75878-3.
[34] MIGUEL M, RECIO I, RAMOS M, et al. Antihypertensive effect of peptides obtained from Enterococcus faecalis-fermented milk in rats[J]. Journal of Dairy Science, 2006, 89(9): 3352-3359.
[35] GÓMEZ-RUIZ J Á, RAMOS M, RECIO I. Identification of novel angiotensin-converting enzyme-inhibitory peptides from ovine milk proteins by CE-MS and chromatographic techniques[J]. Electrophoresis, 2007, 28(22): 4202-4211. DOI:10.1002/ elps.200700324.
Peptide Prof i ling of Yogurts Identif i ed by LC-MS/MS and Their ACE Inhibitory Activities
YU Yang
1,2, YU Wenhao
1,2, YAN Jiaze
2, DONG Hao
2, DONG Jiageng
3, JIN Yan
2,*, QI Yanxia
1,*
(1. College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China; 2. Key Laboratory of Separation Science for Analytical Chemistry, Dalian Institute of Chemical and Physics, Chinese Academy of Sciences, Dalian 116023, China; 3. Liaoning Huishan Biotechnology Research Co. Ltd., Shenyang 110031, China)
Abstract:This study investigated the peptide prof i ling of four yogurt samples (Youweishu fl avored fermented milk, plain fl avored fermented milk, Churu 24+K fl avored fermented milk and Shitian fl avored fermented milk) from local market by liquid chromatography-tandem mass spectrometry (LC-MS/MS). A total of 152, 125, 364 and 274 peptides were identif i ed from the yogurts by LC-MS/MS, respectively. Angiotensin converting enzyme (ACE) inhibitory activity was used to evaluate the biological activities of yogurt peptides. The ACE inhibition rates of peptides from these yogurts were 46.84%, 42.75%, 77.41% and 63.84% at a concentration of 2.0 mg/L, respectively. The large number of identif i ed peptides and high ACE inhibitory activities in Churu 24+K fl avor fermented milk may be related to its special ingredients. This study may provide the theoretical basis for further study on the functions and ACE inhibitory activity of yogurt peptides.
Key words:yogurt; peptide prof i ling; LC-MS/MS; ACE inhibitory activity
DOI:10.7506/spkx1002-6630-201705034
中图分类号:TS252.54
文献标志码:A
文章编号:1002-6630(2017)05-0208-05
引文格式:
于洋, 于文皓, 晏嘉泽, 等. 基于LC-MS/MS的酸乳肽谱及ACE抑制活性[J]. 食品科学, 2017, 38(5): 208-212.
DOI:10.7506/spkx1002-6630-201705034. http://www.spkx.net.cn
YU Yang, YU Wenhao, YAN Jiaze, et al. Peptide prof i ling of yogurts identif i ed by LC-MS/MS and their ACE inhibitory activities[J]. Food Science, 2017, 38(5): 208-212. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705034. http://www.spkx.net.cn
收稿日期:2016-05-18
基金项目:辽宁省博士启动基金项目(20141107)
作者简介:于洋(1991—),女,硕士研究生,研究方向为食品科学。E-mail:yy361878997@163.com
*通信作者:靳艳(1968—),女,研究员,博士,研究方向为生物化工。E-mail:yanjin@dicp.ac.cn
祁艳霞(1982—),女,副教授,博士,研究方向为食品安全与检测。E-mail:qiyanxia@dlou.edu.cn