 表示,应用SPSS 19.0软件进行数据处理,数据的差异统计分析均采用单因素方差分析(one-way analysis of variance,one-way ANOVA)进行处理
[21],P<0.05代表组间差异具有显著性,P<0.01代表组间差异具有极显著性。
表示,应用SPSS 19.0软件进行数据处理,数据的差异统计分析均采用单因素方差分析(one-way analysis of variance,one-way ANOVA)进行处理
[21],P<0.05代表组间差异具有显著性,P<0.01代表组间差异具有极显著性。
钱 叶 1,丁 祥 1,曾益春 2,伏 雷 1,朱洪庆 1,张 楠 1,侯万儒 1,侯怡铃 1,*
(1.西华师范大学生命科学学院,西南野生动植物资源保护省部共建教育部重点实验室,四川 南充 637009;2.四川省农业科学院蚕业研究所,四川 南充 637000)
摘 要:为研究松乳菇多糖(Lactarius deliciosus Gray polysaccharide,LDG-A)对特异性免疫细胞的增殖效应活性及对肿瘤细胞凋亡的影响,在LDG-A作用下检测T淋巴细胞、B淋巴细胞的增殖效应,并观察T淋巴细胞、B淋巴细胞的细胞形态,检测T淋巴细胞、B淋巴细胞在LDG-A的作用下处于细胞周期各个时期的细胞数量及B淋巴细胞分泌抗体的情况,观察LDG-A作用于肺癌细胞A549的凋亡和细胞骨架情况。结果表明:随着LDG-A质量浓度的增加,能够促进T淋巴细胞、B淋巴细胞的增殖,并呈现出一定的剂量依赖关系;同时LDG-A能够减少T淋巴细胞、B淋巴细胞在G 0/G 1期的细胞数量百分比,促进细胞进入G 2/M期,具有促进B淋巴细胞分泌抗体免疫球蛋白M、免疫球蛋白D和免疫球蛋白E的作用。在12.5~50.0 μg/mL范围内,LDG-A能够诱导肺癌细胞A549凋亡,并呈现出一定的剂量依赖关系;在细胞凋亡时F-肌动蛋白丝断裂,蛋白纤维网络结构被破坏。综上所述,在体外实验中,LDG-A对特异性免疫细胞具有促增殖效应活性,能够促进肿瘤细胞的凋亡。
关键词:松乳菇多糖;免疫细胞;增殖效应;肿瘤细胞;凋亡
食药用真菌多糖在国际上被称为“生物反应调节剂”,一般是指从真菌的子实体和菌丝体所提取的代谢产物,是一类重要的生物活性成分 [1]。近些年的研究表明,真菌多糖具有多种药理活性,如抗肿瘤、抗病毒、延缓衰老、促进淋巴细胞增殖和免疫调节等多种生物功效 [2-4]。
松乳菇(Lactarius deliciouss (L. ex Fr.) Gray),红菇科乳菇属,可与高山松马尾等形成外生菌根菌 [5],是珍稀的野生食用菌 [6],被誉为“菌中王子”。任慧波 [7]、Barros [8]等的研究表明,松乳菇胞外多糖具有明显的抑菌作用,通过调动机体的抗应激能力、提高机体免疫功能和抗病防御机能,从而达到治疗疾病的目的。邱美珍等 [9]的研究表明,松乳菇菌丝多糖能提高小鼠的特异性免疫功能。松乳菇菌丝多糖能提高B淋巴细胞产生特异性抗体的潜力,促进T淋巴细胞直接作用于靶细胞,使得小鼠的特异性免疫功能增强。但这些研究只针对松乳菇粗多糖,其精细结构并不清楚,导致相关分子机制的研究成为难点。
真菌多糖的活性与其结构有着密切的关系 [10],一般来说,真菌多糖的分子质量越大、支链的分支越多,其免疫调节能力和抗肿瘤活性就越强 [11]。在本课题组前期的研究中,从200 g的松乳菇子实体中纯化得到了水溶性的松乳菇多糖(Lactarius deliciosus Gray polysaccharide,LDG-A)430 mg,LDG-A的提取率为0.215%,其重均分子质量为11 003 D,并运用光谱学技术解析了其结构。结果显示该多糖是由两个单糖组成的杂多糖,即α-L-甘露糖和α-D-木糖以质量比3∶1的比例组成,具有(1→6)α-L-甘露糖的骨架,甘露糖的2-O上连接一个→3-α-D-木糖的侧链 [12]。陈杨琼等 [13]以不同剂量的LDG-A进行抗肿瘤活性研究,结果表明LDG-A在28 mg/kg时对肿瘤S180的抑瘤率为68.51%,在一定剂量LDG-A的作用下,对人喉癌Hep-2和人肝癌HepG-2都具有一定的抑制作用,并且在质量浓度为150 μg/mL时能显著促进肝细胞增殖,表明LDG-A具有明显的免疫调节活性和抗肿瘤活性。免疫调节活性一般通过对特异性免疫细胞的调控发挥作用,抗肿瘤活性一般通过直接诱导肿瘤细胞凋亡发挥作用,但LDG-A究竟对哪些免疫细胞有影响,以及LDG-A诱导肿瘤细胞凋亡过程中对肿瘤细胞结构的影响仍需进一步深入研究。本实验主要研究LDG-A对特异性免疫细胞的增殖效应活性及在肿瘤细胞凋亡过程中对细胞结构的影响。
1.1 材料与试剂
LDG-A由西华师范大学生命科学学院西南野生动植物资源保护省部共建教育部重点实验室提供,制备方法参考文献[12];T淋巴细胞、B淋巴细胞、肺癌细胞A549 中国科学院上海生命科学研究院生物化学与细胞生物学研究所;细胞计数-8试剂盒(cell counting kit-8,CCK-8)、细胞周期与细胞凋亡检测试剂盒 上海碧云天生物技术研究所;人免疫球蛋白M(immunoglobulin,IgM)、人IgD和人IgE酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒 上海继锦化学科技有限公司;膜联蛋白-V/碘化丙啶细胞凋亡试剂盒 杭州联科生物技术股份有限公司;细胞骨架(肌动蛋白微丝、F-肌动蛋白)绿色荧光染色试剂盒 上海杰美基因医药科技有限公司。
1.2 仪器与设备
Epoch酶标仪 美国基因有限公司;DMI 3000倒置荧光显微镜、SP8激光扫描共聚焦显微镜 徕卡显微系统(上海)贸易有限公司;Accuri C6流式细胞仪 碧迪医疗器械(上海)有限公司;3100系列CO 2恒温培养箱美国Thermo公司。
1.3 方法
1.3.1 LDG-A作用于特异性免疫细胞
1.3.1.1 LDG-A对T淋巴细胞、B淋巴细胞的增殖效应
T淋巴细胞和B淋巴细胞为悬浮生长的细胞,采用CCK-8试剂盒对T淋巴细胞、B淋巴细胞形态和增殖进行检测 [14]。B淋巴细胞复苏并用无酚红培养基进行悬浮培养,待细胞处于对数生长期,更换培养液,并用培养液稀释为2×10 5个/mL。实验设置空白对照组、LDG-A实验组和脂多糖(lipopolysaccharide,LPS)阳性对照组。用LDG-A配制终质量浓度为0.25、0.50、1.00、5.00、10.00、15.00、20.00 μg/mL的溶液(LDG-A实验组),LPS分别配制为:5 μg/mL(B淋巴细胞增殖LPS阳性对照组)、10 μg/mL(T淋巴细胞增殖LPS阳性对照组),每个质量浓度设6 个重复。向空白对照组、LDG-A实验组、LPS阳性对照组中每孔加入100 μL细胞稀释液,在37 ℃、5%的二氧化碳培养箱中培养24 h。在空白对照组中每孔加入100 μL细胞稀释液、LDG-A实验组按梯度每孔添加100 μL LDG-A配制液、LPS组中每孔加入100 μL LPS配制液,混匀。在37 ℃、5%的二氧化碳培养箱中培养24 h后各孔添加CCK-8 10 μL,再培养3 h。用酶标仪在450 nm波长处测定各孔光密度(OD 450 nm)值并记录实验结果。OD值越高,说明细胞数量越多。
1.3.1.2 LDG-A对T、B淋巴细胞形态的影响
操作同1.3.1.1节,最后在倒置荧光显微镜下观察T、B淋巴细胞在LDG-A的作用后细胞形态。
1.3.1.3 LDG-A对T、B淋巴细胞周期的影响
T、B淋巴细胞均为悬浮生长的细胞,采用细胞周期与细胞凋亡检测试剂盒对T、B淋巴细胞周期进行检测 [15]。T细胞周期实验设置空白对照组、LDG-A实验组(LDG-A 6.25、12.50、25.00 μg/mL)和阳性对照组(LPS 12.5 μg/mL);B淋巴细胞周期实验设置空白对照组、实验组(LDG-A 0.5、1.0、10.0 μg/mL)和阳性对照组(LPS 5 μg/mL);按照试剂盒所提供的实验步骤准备细胞样品,加入1 mL冰浴预冷的体积分数为70%的乙醇中,吹打混匀,4 ℃固定2 h。配制碘化丙啶染色液,以1 个样品为例,染色缓冲液0.5 mL,(20×)碘化丙啶染色液25 μL,(50×)核糖核酸酶A 10 µL,终体积 0.535 mL。向每管细胞样品中加入0.5 mL碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37 ℃避光温浴30 min。用流式细胞仪在激发波长为488 nm条件下检测红色荧光,并对处于各个细胞周期(G 0/G 1期、S期、G 2/M期)的细胞数量百分比进行分析 [16-17]。
1.3.1.4 LDG-A刺激B淋巴细胞分泌抗体的检测
采用人IgM、IgD和IgE ELISA检测试剂盒检测LDG-A刺激下B淋巴细胞抗体的分泌。实验设置空白对照组,实验组(LDG-A 0.625、1.250、2.500、5.000 μg/mL)和阳性对照组(LPS 5 μg/mL),收集B淋巴细胞培养上清液,根据试剂盒操作说明进行抗体检测。用酶标仪在450 nm波长处测定各孔光密度(OD 450 nm)值,记录实验结果。
1.3.2 LDG-A诱导肿瘤细胞凋亡
1.3.2.1 LDG-A诱导肺癌细胞A549凋亡
肺癌细胞A549是贴壁生长的细胞,采用膜联蛋白-V/碘化丙啶细胞凋亡试剂盒检测LDG-A诱导肺癌细胞A549凋亡 [18]。实验设置空白对照组、LDG-A实验组(LDG-A 12.5、25、50 μg/mL)和阳性对照组(LPS 10 μg/mL),按照试剂盒所提供的实验步骤进行肺癌细胞A549凋亡检测。肺癌细胞A549经磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤、胰酶消化、室温孵育、离心(1 000×g、5 min)后收集细胞,用PBS重悬细胞并计数。取数量为5~10万个重悬的细胞,1 000×g离心5 min,弃上清液,加入195 μL Annexin V-FITC结合液重悬细胞。依次加入5 μL Annexin V-FITC、10 μL碘化丙啶染色液并混匀,室温避光孵育10~20 min,随后置于冰浴中。1 000×g离心5 min,收集细胞,50~100 μL Annexin V-FITC结合液重悬细胞,涂片后,在激光扫描共聚焦显微镜 [19]下观察肺癌细胞A549凋亡的情况。
1.3.2.2 肺癌细胞A549细胞骨架观察
肺癌细胞A549分别用等量的培养液、LDG-A和LPS进行培养,设置空白对照组、LDG-A实验组(LDG-A 10 μg/mL)和阳性对照组(LPS 10 μg/mL),采用细胞骨架绿色荧光染色试剂盒进行细胞骨架实验 [20]。配制染色工作液,置于暗室中的冰槽备用。接种待测细胞培养,直至每孔铺满率达70%。按照试剂盒所提供的操作步骤,分别添加试剂处理细胞,使细胞充分染色。封片后,即刻在激光扫描共聚焦显微镜下进行观察,在激发波长488 nm、散发波长530 nm条件下,F-肌动蛋白显示绿色荧光。
1.4 数据统计分析
本实验结果以
 表示,应用SPSS 19.0软件进行数据处理,数据的差异统计分析均采用单因素方差分析(one-way analysis of variance,one-way ANOVA)进行处理
[21],P<0.05代表组间差异具有显著性,P<0.01代表组间差异具有极显著性。
表示,应用SPSS 19.0软件进行数据处理,数据的差异统计分析均采用单因素方差分析(one-way analysis of variance,one-way ANOVA)进行处理
[21],P<0.05代表组间差异具有显著性,P<0.01代表组间差异具有极显著性。
2.1 LDG-A作用于特异性免疫细胞
2.1.1 LDG-A对T淋巴细胞增殖的影响
T淋巴细胞由骨髓中的造血干细胞迁移到胸腺内分化成熟,成为具有免疫活性的T淋巴细胞。成熟的T淋巴细胞能与靶细胞特异性结合,直接杀伤靶细胞,或释放淋巴因子,使得免疫效应增强,主要参与机体的细胞免疫。
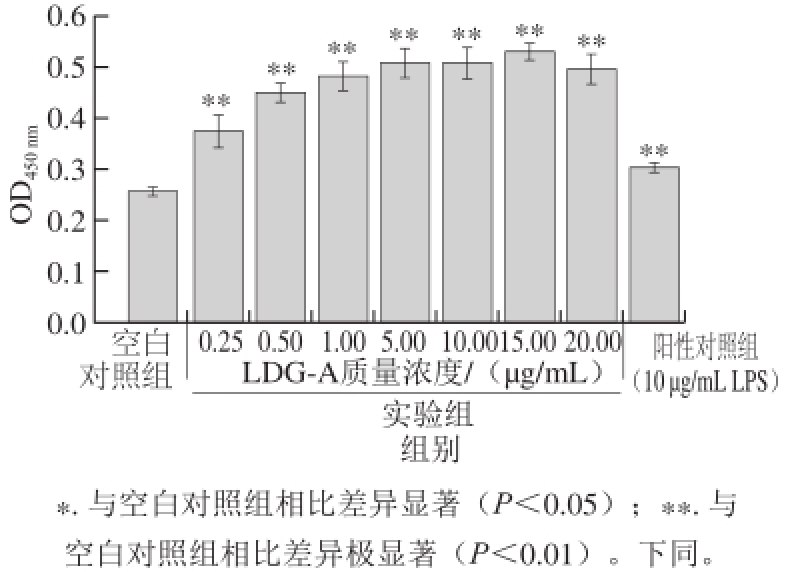
图 1 LDG-A对T淋巴细胞增殖的影响
Fig. 1 Effect of LDG-A on the proliferation of T cells
由图1可知,当LDG-A 的质量浓度为0.25~20 μg/mL时,均能够显著促进T淋巴细胞的增殖,与空白对照组相比具有极显著性差异 (P<0.01)。LDG-A的质量浓度为0.25~15 μg/mL时,其质量浓度与促进T淋巴细胞增殖的效应呈正相关。值得注意的是,当LDG-A质量浓度为20 μg/mL时,虽然增殖效应显著,但增殖效应相对于在15 μg/mL时略有下降。由此可得,当LDG-A的质量浓度在0.25~20 μg/mL范围内,T淋巴细胞的增殖效应的最适质量浓度为15 μg/mL。综上结果显示,LDG-A在细胞免疫方面具有免疫增强作用。
2.1.2 LDG-A对T淋巴细胞形态的影响
由图2可知,正常状态下,T淋巴细胞呈圆球形,极易成团生长。在倒置荧光显微镜下观察T淋巴细胞,细胞状态良好,细胞形态没有明显变化。随着LDG-A质量浓度的增加,单位视野内T淋巴细胞数量逐渐增加并呈分散生长,呈现出一定的剂量依赖关系,当LDG-A质量浓度为15 μg/mL时T淋巴细胞状态和增殖效果最好。

2.1.3 LDG-A对T淋巴细胞周期的影响
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束,有间期和分裂期两个阶段。G 0期是指具有分裂能力的细胞在连续分裂数次之后处于停滞状态的时期。间期又分为G 1期、S期和G 2期。G 1期为DNA合成的准备期;S期主要进行DNA的合成,除此之外还合成DNA复制所需要的酶;G 2期是有丝分裂准备期,主要完成蛋白质的合成。M期即细胞分裂期。细胞周期从G 0/G 1期进入S期是细胞增殖的前提和准备,通过促进细胞从G 0/G 1期进入S期,细胞的增殖作用增强,细胞分裂更加旺盛,即通过改变细胞周期,使细胞分裂更加旺盛,促进细胞增殖 [22]。
LDG-A对T淋巴细胞周期的影响实验,结果如图3所示,与空白对照组相比,当LDG-A的质量浓度为6.25~25 μg/mL时,T淋巴细胞处于G 0/G 1期的细胞数量百分比与LDG-A质量浓度呈负相关,而处于G 2/M期所占细胞数量百分比与LDG-A质量浓度呈正相关,表明T淋巴细胞在一定质量浓度的LDG-A刺激下细胞周期发生改变,在G 0期的停止时间和G 1期的准备时间减少,G 2期和细胞分裂期(M期)的细胞数量百分比增加,即T淋巴细胞分裂能力增强。综上,LDG-A可以作为T淋巴细胞有丝分裂原,促进T细胞从G 0/G 1期进入G 2/M期,使得T淋巴细胞增殖作用增强,具有促增殖作用。2.1.4 LDG-A对B淋巴细胞增殖效应的影响

B淋巴细胞由哺乳动物骨髓或鸟类法氏囊中的造血干细胞分化发育而来。在抗原的刺激下,B淋巴细胞分化成浆细胞,由浆细胞合成和分泌抗体,执行体液免疫功能。
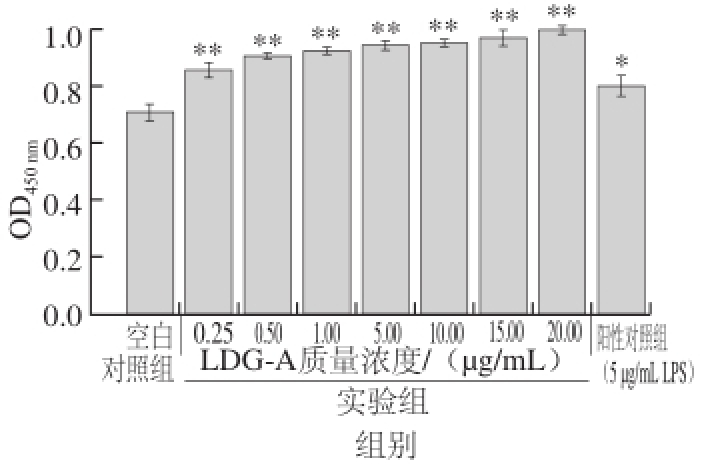
图 4 LDG-A对B淋巴细胞增殖的影响
Fig. 4 Effect of LDG-A on the proliferation of B cells
由图4可知,当LDG-A的质量浓度为0.25~20 μg/mL时,均能够显著促进B淋巴细胞的增殖,与空白对照组相比具有极显著性差异(P<0.01),并且LDG-A的质量浓度与促进B淋巴细胞增殖的效应呈正相关,当LDG-A质量浓度为20 μg/mL时B淋巴细胞增殖效应最好,即LDG-A在体液免疫方面具有免疫增强作用。
2.1.5 LDG-A对B细胞形态的影响
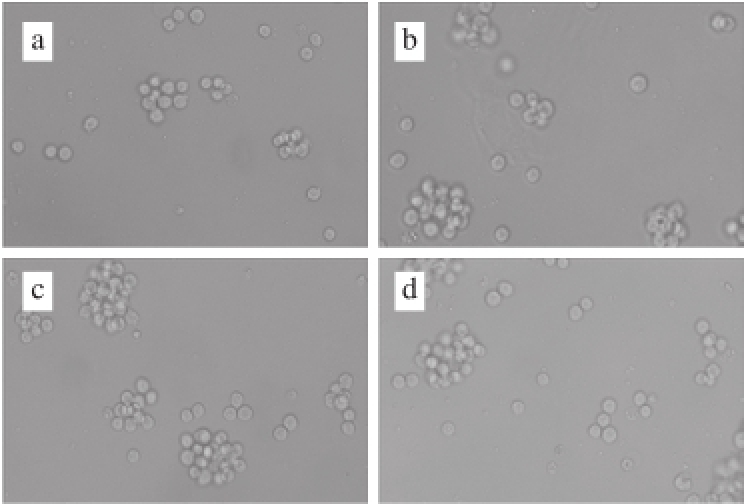

图 5 LDG-A对B淋巴细胞形态的影响
Fig. 5 Effect of LDG-A on B cell morphology
由图5可知,正常状态下,B淋巴细胞呈规则的圆形,明显的集簇生成。在倒置荧光显微镜下观察B淋巴细胞,细胞状态良好,细胞形态无显著变化。随着LDG-A质量浓度的增加,单位视野内B淋巴细胞数量增加并逐渐分散开来,呈现出一定的剂量依赖关系,当LDG-A的质量浓度为20 μg/mL时B淋巴细胞状态和增殖效果最好。
2.1.6 LDG-A对B淋巴细胞周期的影响
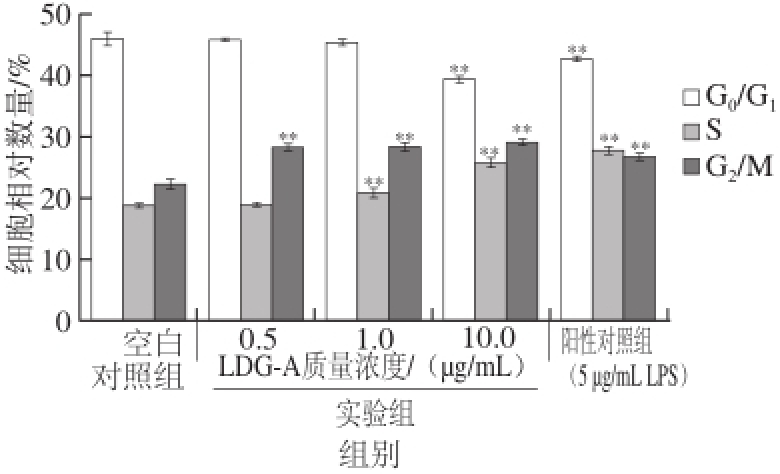
图 6 LDG-A对B淋巴细胞周期影响的统计学分析
Fig. 6 Statistical analysis of the effect of LDG-A on the cell cycle distribution of B cells
LDG-A对B淋巴细胞周期的影响实验,结果如图6所示。与空白对照组相比,当LDG-A的质量浓度为0.5~10 μg/mL时,B淋巴细胞处于G 0/G 1期的细胞数量百分比与LDG-A质量浓度呈负相关,而处于S期和G 2/M期所占细胞数量百分比与LDG-A质量浓度呈正相关,表明B淋巴细胞在一定质量浓度的LDG-A刺激下,B淋巴细胞的细胞周期发生改变,在G 0期的停止时间和G 1期的准备时间减少,相应的细胞数量百分比也就减少,而处于S期、G 2期和细胞分裂期(M期)的细胞数量百分比增加,即B淋巴细胞分裂能力增强,当LDG-A的质量浓度为10 μg/mL时效果最好。即LDG-A能够促进B淋巴细胞从G 0/G 1期进入S期和G 2/M期,从而使得B细胞增殖作用增强,具有促增殖作用。
2.1.7 LDG-A对B淋巴细胞分泌抗体的影响

图 7 LDG-A对B淋巴细胞分泌抗体的影响
Fig. 7 Effect of LDG-A on the secretion of antibody from B cells
当机体受到病原体的侵害时,病原体的抗原刺激T淋巴细胞产生淋巴因子,B淋巴细胞在的抗原的刺激和淋巴因子的作用下,增殖、分化为浆细胞,合成和分泌抗体(免疫球蛋白),执行体液免疫功能。本实验检测了在LDG-A的刺激下B淋巴细胞分泌IgM、IgD和IgE的情况,结果如图7所示,LDG-A在质量浓度为0.625~5 μg/mL时,均能刺激B淋巴细胞分泌IgM、IgD和IgE,并且均与LDG-A的质量浓度呈正相关,值得注意的是,LDG-A在质量浓度为0.625~5 μg/mL范围内,IgM和IgE抗体水平与空白对照组相比均具有极显著差异(P<0.01),其中,LDG-A质量浓度为5 μg/mL时,IgM、IgD和IgE的促分泌效果最好。
2.2 LDG-A诱导肿瘤细胞凋亡
2.2.1 LDG-A诱导肺癌细胞A549凋亡
细胞凋亡是指为维持细胞内环境的稳定,由基因控制,细胞发生自主的、有序性的死亡。细胞凋亡在形态学上共分为3 个阶段,第1阶段是凋亡的起始阶段,在这一阶段细胞体积收缩,细胞连接消失,染色质逐渐浓缩凝聚成新月状附于核膜周围;第2阶段形成凋亡小体;第3阶段凋亡小体被邻近的细胞吞噬及消化 [23]。何雅军等 [18]的研究表明,Annexin V-FITC/PI双标记染色可以准确反映细胞凋亡的过程,可作为检测细胞凋亡早期的方法。本实验所用试剂为膜联蛋白-V/碘化丙啶细胞凋亡试剂盒,与Annexin V-FITC/PI双标记染色作用机理类似,故可以检测肺癌细胞A549凋亡早期的过程。肺癌细胞A549的细胞形态呈上皮细胞样,是贴壁生长的细胞。
在激光扫描共聚焦显微镜下观察LDG-A诱导肺癌细胞A549凋亡,可以观察到肺癌细胞A549体积收缩,染色质逐渐浓缩凝聚成新月状附于核膜周边,呈现出细胞凋亡的一般形态。当LDG-A的质量浓度为12.5~50 μg/mL时,LDG-A能够诱导肺癌细胞A549凋亡,并呈现出一定的剂量依赖关系,肺癌细胞A549凋亡的程度与LDG-A的质量浓度呈正相关。当LDG-A的质量浓度为50 μg/mL时,其促进肺癌细胞A549凋亡的效果最好。结果表明,LDG-A能够诱导肺癌细胞A549凋亡(图8)。
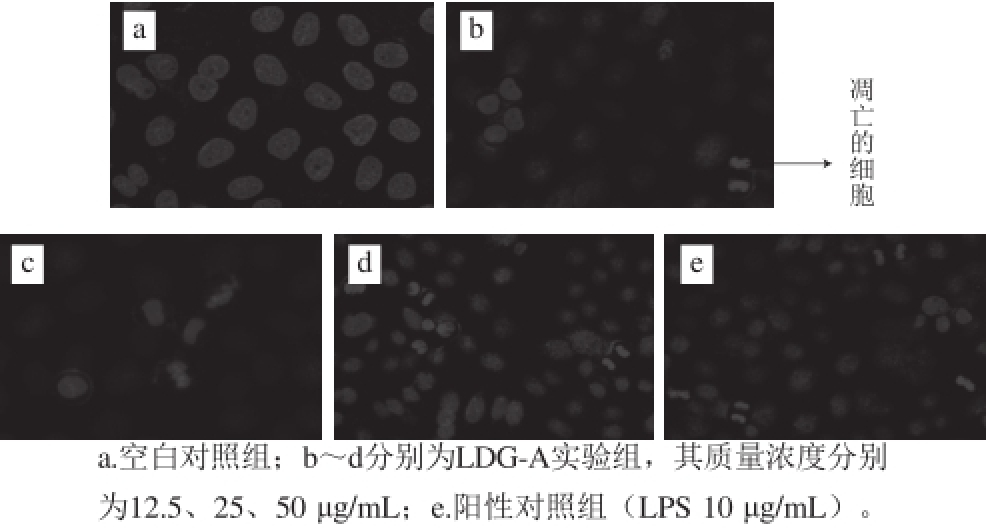
图 8 LDG-A诱导肺癌细胞A549凋亡
Fig. 8 A549 cell apoptosis induced by LDG-A
2.2.2 肺癌细胞A549细胞骨架观察
细胞骨架是真核细胞中的蛋白质纤维网架结构,它不仅能维持细胞形态,保持细胞内部结构的有序性,而且还参与许多重要的生命活动。Chad等 [20]的研究表明,细胞凋亡时细胞骨架形态会发生改变,包括细胞骨架网状结构的凝聚、降解和分布不均等。有研究表明,细胞凋亡时,细胞骨架形态变化的一个典型特征就是F-肌动蛋白细丝断裂,肌动蛋白网状结构破坏。
在激光扫描共聚焦显微镜下观察LDG-A诱导肺癌细胞A549凋亡的细胞骨架,与空白对照组相比,可以观察到在细胞凋亡时F-肌动蛋白丝发生断裂,蛋白纤维网络结构遭到破坏,但作用效果没有阳性对照组明显。表明细胞骨架改变是细胞凋亡形态学改变的基础,即细胞骨架结构改变使得活细胞的结构形态和生理功能发生改变,细胞失去原有的活性,从而导致细胞凋亡(图9)。
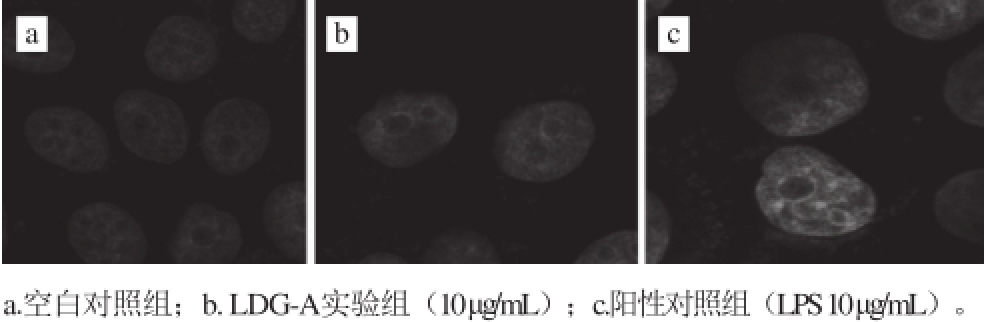
图 9 肺癌细胞A549骨架观察
Fig. 9 Cytoskeleton of A549 cells
多糖制剂作为抗肿瘤药物,不像一般药物直接杀伤肿瘤细胞,而是作为免疫调节剂,通过促进机体的特异性免疫功能,达到抑制和消灭肿瘤细胞的效果 [24]。大量的研究表明,真菌多糖的抗肿瘤免疫机制是通过激活T、B淋巴细胞等免疫细胞,提高机体免疫力来抑制肿瘤细胞的生长,甚至是直接诱导肿瘤细胞凋亡 [25-26]。本实验结果显示,LDG-A虽然能够诱导肺癌细胞A549凋亡,但肺癌细胞A549骨架观察结果显示,在LDG-A作用下,F-肌动蛋白丝发生断裂的情况没有阳性对照组明显,提示LDG-A可能主要通过作用于特异性免疫细胞来抑制肿瘤细胞的生长。
LPS可以诱导B淋巴细胞产生抗体,从而介导机体的体液免疫机制 [27];同时,LPS也能刺激T淋巴细胞增殖 [28]。本实验研究了LDG-A对T、B淋巴细胞的增殖效应及细胞形态的影响,结果表明,T、B淋巴细胞的促增殖效应与LDG-A的质量浓度呈正相关,细胞状态良好。基于两种特异性免疫细胞的差异,不同质量浓度的LDG-A显示出不同的促增殖效应。研究表明,在细胞的增殖过程中,G 0/G 1期的细胞百分比明显降低,而S期或G 2/M期细胞百分比增加 [29]。本实验研究了LDG-A对T、B细胞周期的影响,结果表明,在一定质量浓度范围内,LDG-A能够降低B淋巴细胞在G 0/G 1期的细胞数量百分比,促进B淋巴细胞进入S期和G 2/M期,从而促进B淋巴细胞增殖;同时,LDG-A也能够降低T淋巴细胞在G 0/G 1期的细胞数量百分比,促进T淋巴细胞进入G 2/M期,继而促进T淋巴细胞增殖。
免疫球蛋白作为机体中具有生物活性的物质,在防止细菌入侵、抗病毒、增强机体免疫力、活化补体、杀伤肿瘤细胞等方面起到重要作用 [29],是机体的重要防御机制 [30]。机体接受抗原刺激后首先产生抗体IgM,在一定程度上抵抗外源性刺激对机体的伤害 [31]。本实验中LDG-A可以作为B淋巴细胞有丝分裂原,通过促进B淋巴细胞增殖,诱导B淋巴细胞产生抗体IgM、IgD和IgE,从而介导机体的体液免疫,增强机体的特异性免疫。
综上所述,在体外实验中LDG-A对特异性免疫细胞具有促增殖效应活性,且能够诱导肿瘤细胞的凋亡,但涉及的相关信号转导通路与分子机制还有待进一步验证。
参考文献:
[1] 杜庆. 食(药)用真菌多糖的研究进展[J]. 中国食物与营养, 2011, 17(5): 75-77. DOI:10.3969/j.issn.1006-9577.2011.05.018.
[2] 张莘莘. 黑灵芝多糖的抗肿瘤活性及其分子机制初探[D]. 南昌: 南昌大学, 2014: 4.
[3] 翁梁, 温鲁. 药用真菌多糖研究进展[J]. 食品科学, 2008, 29(1): 748-751. DOI:10.3321/j.issn:1002-6630.2008.12.
[4] 王健, 龚兴国. 多糖的抗肿瘤及免疫调节研究进展[J]. 中国生化药物杂志, 2001, 22(1): 52-54. DOI:10.3969/j.issn.1005-1678.2001.01.026.
[5] 卯晓岚. 中国大型真菌[M]. 郑州: 河南科学技术出版社, 2000: 369.
[6] 杨明毅, 徐虹. 松乳菇的研究与开发[J]. 中国野生植物资源, 2001, 20(2): 29-30. DOI:10.3969/j.issn.1006-9690.2001.02.011.
[7] 任慧波, 杜丽飞, 肖兵南, 等. 松乳菇菌丝体胞内多糖与胞外多糖体外抑菌试验[J]. 饲料工业, 2009, 30(20): 31-32.
[8] BARROS L, CALHELHA R C, VAZ J A, et al. Antimicrobial activity and bioactive compounds of portuguese wild edible mushrooms methanolic extracts[J]. European Food Research and Technology, 2007, 225(2): 151-156. DOI:10.1007/s00217-006-0394-x.
[9] 邱美珍, 傅胜才, 周望平, 等. 松乳菇菌丝多糖对小鼠免疫调节作用研究[J]. 黑龙江畜牧兽医科技版, 2010, 21(3): 137-139.
[10] 杨云华, 江南, 罗霞, 等. 药用真菌多糖抗肿瘤的构效关系[J]. 时珍国医国药, 2010, 21(3): 612-614. DOI:10.3969/j.issn.1008-0805.2010.03.050.
[11] ZHU Z Y, LIU N, SI C L, et al. Structure and anti-tumor activity of a high-molecular-weight polysaccharide from cultured mycelium of Cordyceps gunnii[J]. Carbohydrate Polymers, 2012, 88(3): 1072-1076. DOI:10.1016/j.carbpol.2012.01.068.
[12] DING X, HOU Y L, HOU W R. Structure feature and antitumor activity of a novel polysaccharide isolated from Lactarius deliciosus Gray[J]. Carbohydr Polymers, 2012, 89(2): 397-402. DOI:10.1016/ j.carbpol. 2012.03.020.
[13] 陈杨琼, 丁祥, 伍春莲, 等. 松乳菇多糖抗肿瘤和免疫调节活性研究[J]. 食用菌学报, 2012, 19(3): 73-78. DOI:10.3969/ j.issn.1005-9873.2012.03.014.
[14] 万文婷, 李宁, 刘静, 等. CCK-8法与MTT法检测人前列腺癌PC3细胞活性的比较研究[J]. 时珍国医国药, 2010, 21(12): 3046-3048. DOI:10.3969/j.issn.1008-0805.2010.12.004.
[15] 王萍. 雷公藤多苷对变应性接触性皮炎小鼠T淋巴细胞凋亡及其机理的研究[D]. 天津: 天津医科大学, 2007: 26-39. DOI:10.7666/ d.y1127656.
[16] 耿慧霞, 王来, 王强. 流式细胞仪在生物学中的应用[J]. 生物学杂志, 2005, 22(4): 44-45; 51. DOI:10.3969/j.issn.2095-1736.2005.04.016.
[17] SITTON G, SRIENC F. Single-cell tracking with a reversing flow cytometer[J]. Cytometry, 2011, 79(1): 66-76. DOI:10.1002/cyto. a.20999.
[18] 何雅军, 舒建昌, 吕霞, 等. Annexin V-FITC/PI 流式细胞术检测姜黄素诱导的肝星状细胞凋亡[J]. 实用医学杂志, 2009, 25(1): 28-30. DOI:10.3969/j.issn.1006-5725.2009.01.011.
[19] THOMPSON K J, HARLEY C M, BARTHEL G M, et al. Plasmon resonance and the imaging of metal-impregnated neurons with the laser scanning confocal microscope[J]. Elife, 2015, 4: e09388 DOI:10.7554/ eLife.09388.
[20] CHAD L M, DELFINE C, GERALD J S, et al. Correlated light and electron microscopy observations of the uterine epithelial cell actin cytoskeleton using fl uorescently labelled resin-embedded sections[J]. Micron, 2016, 84: 61-66. DOI:10.1016/j.micron.2016.02.010.
[21] 张苏江, 许宗运. 数据统计分析软件SPSS的应用(一)[J]. 畜牧与兽医, 2003, 35(3): 23-24. DOI:10.3969/j.issn.0529-5130.2003.03.012.
[22] GE Q Q, ZHOU J, TU M, et al. Nuclear vasohibin-2 promotes cell proliferation by inducing G 0/G 1to S phase progression[J]. Oncology Reports, 2015: 34(3): 1327. DOI:10.3892/or.2015.4127.
[23] SONAA E, USHA S, JA IN J. An ex vivo study of selenium, genistein on the morphological and nuclear changes in anticancer drug-induced apoptosis in human peripheral blood lymphocytes[J]. BioFactors, 2013, 39(3): 279-293. DOI:10.1002/biof.1069.
[24] 郭焱, 崔健丽, 朱娜. 猴头菇多糖对TGF-β1抑制的T淋巴细胞增殖的影响[J]. 中国实验诊断学, 2012, 16(1): 48-49. DOI:10.3969/ j.issn.1007-4287.2012.01.016.
[25] RUDD P, ELLIOTT T, CRESSWELL P, et al. Glycosylation and the immune system[J]. Science, 2001, 291: 2370-2376. DOI:10.1126/ science.291.5512.2370.
[26] 欧阳天贽, 李小定, 荣建华. 真菌多糖抗肿瘤及免疫调节作用研究进展[J]. 天然产物研究与开发, 2006, 18(3): 524-528. DOI:10.3969/ j.issn.1001-6880.2006.03.043.
[27] 钱莉, 佟大可, 潘兴元, 等. 脂多糖对B细胞的活化作用及机制的初步研究[J]. 第二军医大学学报, 2011, 32(11): 1231-1234. DOI:10.3724/SP.J.1008.2011.01231.
[28] 阎衡, 叶庆佾, 郝飞, 等. CTLA 4Ig抑制T细胞增殖的体外研究[J]. 免疫学杂志, 2001, 17(3): 210-212. DOI:10.3969/j.issn.1000-8861.2001.03.014.
[29] 张英民, 党红波, 王克强, 等. ET-1促进人血管平滑肌细胞的表型变化和增殖[J]. 解剖学通报, 2003, 26(3): 215-218. DOI:10.3969/ j.issn.1001-1633.2003.03.003.
[30] 裴晓言, 顾名夏, 黄鹤, 等. 牛乳中的免疫球蛋白与健康的研究[J]. 现代生物医学进展, 2007, 7(3): 413-421. DOI:10.3969/ j.issn.1673-6273.2007.03.033.
[31] 李雷, 杨波, 何燕. 新生儿227 例血清免疫球蛋白检测分析[J]. 山东医药, 2007, 47(4): 62-63. DOI:10.3969/j.issn.1002-266X.2007.04.032.
[32] 张红. 免疫球蛋白在肝病患者血清检测中的临床应用价值[J]. 当代医学, 2010, 16(33): 107-108. DOI:10.3969/j.issn.1009-4393.2010.33.074.
Polysaccharide from Lactarius deliciosus Gray Stimulates Immunocyte Proliferation and Induces Tumor Cells Apoptosis
QIAN Ye
1, DING Xiang
1, ZENG Yichun
2, FU Lei
1, ZHU Hongqing
1, ZHANG Nan
1, HOU Wanru
1, HOU Yiling
1,*
(1. Key Laboratory of Southwest China Wildlife Resources Conservation, Ministry of Education, College of Life Science, China West Normal University, Nanchong 637009, China; 2. Sericultural Research Institute, Sichuan Academy of Agricultural Sciences, Nanchong 637000, China)
Abstract:To understand the effect of Lactarius deliciosus Gray polysaccharide (LDG-A) on the proliferation of specif i c immunocytes and tumor cell apoptosis, we tested and observed the proliferation and morphological changes of T lymphocytes and B lymphocytes in the presence of LDG-A, determined the number of T lymphocytes and B lymphocytes in each stage of the cell cycle, and also evaluated antibody secretion by B lymphocytes under the stimulation of LDG-A. In addition, the apoptosis and cytoskeleton of lung cancer cell A549 were evaluated. The results showed that the proliferation of B lymphocytes and T lymphocytes’ proliferation was promoted LDG-A in a dose-response manner. LDG-A could also reduce the number of B lymphocytes at the G 0/G 1phase and promote them to enter the G 2/M phase. Meanwhile, LDG-A also promoted the secretion of IgM, IgD and IgE by B lymphocytes. In addition, LDG-A in the range of 12.5–50.0 μg/mL could induce the apoptosis of lung cancer cell A549 in a dose-dependent manner. Moreover, we observed fractured F-actin fi laments in the cells as well as damaged protein fi ber networks during apoptosis. In conclusion, LDG-A has a promoting effect on the proliferation of specif i c immunocytes, and accelerates the apoptosis of tumor cells in vitro.
Key words:L. deliciosus Gray polysaccharide; immunocyte; proliferation activity; tumor cells; apoptosis
DOI:10.7506/spkx1002-6630-201705036
中图分类号:Q939.91
文献标志码:A
文章编号:1002-6630(2017)05-0220-07
引文格式:
钱叶, 丁祥, 曾益春, 等. 松乳菇多糖刺激免疫细胞增殖及诱导肿瘤细胞凋亡的研究[J]. 食品科学, 2017, 38(5):
220-266. DOI:10.7506/spkx1002-6630-201705036. http://www.spkx.net.cn
QIAN Ye, DING Xiang, ZENG Yichun, et al. Polysaccharide from Lactarius deliciosus Gray stimulates immunocyte proliferation and induces tumor cells apoptosis[J]. Food Science, 2017, 38(5): 220-266. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705036. http://www.spkx.net.cn
收稿日期:2016-03-06
基金项目:国家自然科学基金青年科学基金项目(31400016)
作者简介:钱叶(1993—),女,硕士研究生,主要从事资源微生物研究。E-mail:937614129@qq.com
*通信作者:侯怡铃(1983—),女,教授,博士,主要从事生物化学与分子生物学研究。E-mail:starthlh@126.com