 表示,P<0.05表示具有显著差异。
表示,P<0.05表示具有显著差异。
邓乾春,臧茜茜,陈 鹏,孟露曦,黄庆德,黄凤洪 *
(中国农业科学院油料作物研究所,油料脂质化学与营养湖北省重点实验室,农业部油料作物生物学与遗传育种重点实验室,湖北 武汉 430062)
摘 要:为研究枸杞子、桑椹多糖提取物与叶黄素联合干预对可见光诱导视网膜变性的抗氧化作用,采用可见光光照造成青紫蓝兔视网膜光损伤,共设空白组、模型组、低剂量组(7.47 mg/(kg·d)多糖提取物+3.11 mg/(kg·d)5%叶黄素)、中剂量组(22.40 mg/(kg·d)多糖提取物+9.33 mg/(kg·d)5%叶黄素)、高剂量组(67.20 mg/(kg·d)多糖提取物+28.00 mg/(kg·d)5%叶黄素)5 组实验动物(灌胃量均以体质量计),给药21 d后测定视网膜脂质氧化、蛋白氧化和DNA氧化的生物标志物和抗氧化活性。结果表明,光照导致青紫蓝兔视网膜组织产生氧化应激,视网膜组织的脂质、蛋白质和DNA等分子发生氧化反应,而摄入中、高剂量受试物的给药组与模型组相比,丙二醛含量分别降低了39.02%、54.08%,4-羟基壬烯酸含量降低了32.86%、41.78%,3-硝基酪氨酸含量降低了17.20%、19.69%,8-羟基脱氧鸟苷含量降低了6.12%、28.81%,过氧化氢酶活力增加了1.96、2.40 倍,总抗氧化能力升高了1.98、2.11 倍,高剂量组与模型组均具有显著性差异(P<0.05)。因此,枸杞子、桑椹多糖提取物和叶黄素联合干预能显著改善可见光照射导致的视网膜组织氧化损伤。
关键词:枸杞子多糖提取物;桑椹多糖提取物;叶黄素;可见光诱导视网膜损伤;抗氧化Abstracts: The purpose of this study was to explore the protective effect of wolfberry and mulberry polysaccharides combined with lutein on visible light-induced retinal degeneration through their antioxidant activity. Pigmented rabbits were exposed to visible light to induce retinal light damage and then treated with different doses of polysaccharides extracted from a mixture of both dried fruits (1:1, m/m) and lutein for 21 days. Afterwards, lipid peroxidation, protein oxidation, DNA oxidation biomarkers and antioxidant parameters in the retina were evaluated. The results revealed that light exposure induced signif i cant increases in oxidative damage to lipids, proteins and DNA in the retina of pigmented rabbits. In contrast, co-treatment with medium and high doses of polysaccharide extracts and lutein decreased the contents of malondialdehyde (39.02%; 54.08%, P < 0.05), 4-hydroxy azelaic acid (32.86%; 41.78%, P < 0.05), 3-nitro-tyrosine (17.20%; 19.69%) and 8-hydroxy-deoxyguanosine (6.12%; 28.81%), paralleling with increased activities of catalase (1.96-fold; 2.40-fold, P < 0.05) and total antioxidant capacity (1.98-fold; 2.11-fold, P < 0.05). Accordingly, combined intervention with wolfberry and mulberry polysaccharides and lutein can signif i cantly alleviate visible light-induced retinal oxidative damage in pigmented rabbits.
视觉的形成依赖于将光信号转换为大脑能识别的电子信号信息,从而接收到周围事物的信息。光线包括紫外线光(100~400 nm)、可见光(400~750 nm)和红外线辐射(750~10 000 nm) [1],可见光能透过眼的屈光介质到达视网膜,过多、过强的光线会导致视网膜上的感光细胞凋亡,引起视网膜结构改变和损伤,并使其功能下降,加快年龄相关性黄斑变性(age-related macular degeneration,AMD)和遗传性视网膜变性(retinal degeneration,RD)等相关疾病的进展 [2-3]。其中,视网膜感光细胞的光诱导氧化应激是AMD相关疾病进展加速的重要机制之一 [4],当氧化应激发生时,氧自由基、氧化氮自由基、过氧化亚硝酸阴离子、羟自由基等大量增加。正常生理条件下,非酶抗氧化剂、抗氧化酶类及分子修复系统能够有效地降低氧化应激水平,但长期高水平氧化应激会引起视网膜防御系统受损,最终导致视网膜功能紊乱和细胞凋亡 [5]。因此从天然资源中寻找具有抑制氧化损失的活性成分,对于改善由于长期、低强度、间歇性的阳光辐射以及视频终端光辐射等光线导致的视网膜损伤具有重要意义。
枸杞子是目前获得具有缓解视疲劳保健食品批文产品使用最多的原料之一,中药记载上以滋补肝肾、益精明目著称,现代营养学和医学研究表明,枸杞子多糖是其发挥缓解视疲劳的重要物质基础之一,主要通过抑制视网膜细胞氧化损伤、促进细胞增殖,从而对青光眼、糖尿病视网膜病变等产生积极干预作用 [6];桑椹是一种富含多糖类活性成分的重要中药类原料,其多糖提取物具有清除自由基作用 [7-8]。但以上研究大多以高纯度的多糖提取物为试材进行,不利于指导原料在实际生产和功能食品的开发利用。本研究以枸杞子、桑椹的水提醇沉多糖提取物为原料,通过与具有抗氧化活性的叶黄素联合干预,以视网膜光损伤青紫蓝兔为动物模型,通过检测脂质、蛋白质和DNA等物质的氧化产物,研究其对氧化损伤的干预作用,为功能性食品研发提供理论依据。
1.1 材料、动物与试剂
枸杞子和桑椹购自武汉药材市场。
实验采用普通级青紫蓝兔(北京开源养殖场),雌雄不限,体质量(2.5±0.2) kg。所有实验动物均于实验前行裂隙灯显微镜检查和散瞳后眼底检查,眼前后节均未见异常。青紫蓝兔饲养于解放军总医院第一附属医院动物实验中心,室内通风条件良好,正常昼夜变化(8:00—20:00),饲养环境相对湿度为(55±5)%,室温为(23±2) ℃。
复方托吡卡胺滴眼液、氯霉素滴眼液 沈阳神龙药业有限公司;速眠新II注射液(盐酸赛拉嗪注射液)吉林省敦化市圣达动物药品有限公司;导电膏 北京达孚医用制品有限公司;3-硝基酪氨酸(3-nitro-L-tyrosine,3-NT)酶联免疫分析试剂盒、4-羟基壬烯酸(4-hydroxynonenal,4-HNE)酶联免疫分析试剂盒、8-羟基脱氧鸟嘌呤核苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)酶联免疫分析试剂盒 北京科盈美科技有限公司;丙二醛(malondialdehyde,MDA)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒和总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒南京建成生物公司;蛋白测定试剂盒 碧云天公司;5%叶黄素 荷兰DSM公司。
1.2 仪器与设备
APS-2000AER视觉电生理检查仪 重庆康华瑞明科技股份有限公司;TES-1332A照度计 泰仕电子工业股份有限公司;DY89-Ⅱ型电动玻璃均浆机 宁波新芝生物科技有限公司;光照箱 北京盛世科林净化技术有限公司;白色荧光灯(85 W) 中山市重诚照明电器有限公司;SpectraMax M2e酶标仪 美国Molecular公司。
1.3 方法
1.3.1 实验样品提取
取桑椹、枸杞子干果按1∶1质量混合粉碎后依次用10 倍体积水、8 倍体积水95 ℃各提取1 h,合并提取液,浓缩至相对密度为1.2后,添加乙醇至70%,静置12 h取沉淀即得多糖提取物,得率为8%。桑椹和枸杞子的生药摄入量为每天各3 g,换算成多糖提取物为480 mg,5%叶黄素为每天200 mg。
1.3.2 动物分组和给药
将青紫蓝兔适应性饲养一周,期间自由采水、饮食。1 周后30 只普通级青紫蓝兔按体质量随机分成5 组,分别为空白组、模型组、受试样品低、中、高剂量组。灌胃量的计算根据徐淑云等 [9]的方法进行计算,即按照人和兔子的体表面积折算的等效剂量比值来算,计算得低剂量组为7.47 mg/(kg·d)多糖提取物+3.11 mg/(kg·d)5%叶黄素、中剂量组为22.40 mg/(kg·d)多糖提取物+9.33 mg/(kg·d)5%叶黄素、高剂量组为67.2 mg/(kg·d)多糖提取物+28.00 mg/(kg·d)5%叶黄素,均以兔体质量计。每天灌胃1 次。灌胃方法:样品用生理盐水制成混悬液,半透明硅胶导尿管,开口器进行灌胃,灌胃过程中使用兔夹进行固定。饲喂给药21 d,第14天进行光损伤照射。空白组与模型组灌胃等体积生理盐水。
1.3.3 光损伤照射模型建立 [10]
模型组和低、中、高剂量组青紫蓝兔经暗适应24 h后,复方托吡卡胺滴眼液对双眼进行散瞳,20 min后置于自制光照箱中开始光照,每个光照箱中内放置一只青紫蓝兔,光照度为(18 000±1 000) lux,光照2 h,不限制青紫蓝兔活动,整个光照过程保持通风,光照箱内的温度保持在21~24 ℃。光照结束后实验动物送回动物房中暗适应,各组实验动物分别于光照前、光照后第1天和第7天进行视网膜电流图测定,整个实验过程自由采水、饮食。
1.3.4 视网膜组织匀浆制备
空气栓塞法将青紫蓝兔处死,摘除眼球,沿着视神经垂直子午线,剪切得到视网膜组织,-80 ℃冰箱保存。分析时取出保存的视网膜组织,分析天平准确称量待测标本的质量,按质量体积比1∶9加冰生理盐水,在冰水浴下用研磨棒将EP管中视网膜组织研磨成组织匀浆。-4 ℃、2 500 r/min低温高速离心机离心15 min,取上清液备用。
1.3.5 视网膜组织抗氧化指标检测
T-AOC、CAT活性、MDA含量、3-NT含量、4-HNE含量、8-OHdG含量和蛋白质量浓度测定检测参照试剂盒说明书进行检测。
1.4 统计学分析
数据均用Origin 8.5统计软件进行处理,用单因素方差分析ANOVA,以Tukey检测来进行显著性分析,实验结果以
 表示,P<0.05表示具有显著差异。
表示,P<0.05表示具有显著差异。
2.1 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中MDA含量的影响
视网膜富含多不饱和脂肪酸,在光损伤产生的活性氧自由基作用下,发生脂质过氧化反应,产生大量包括MDA、4-HNE、丙烯酸、丁烯酸等小分子物质,进而严重影响DNA的合成、裂解及转录,破坏细胞膜的完整性,流动性,严重影响细胞功能 [11-12]。其中MDA是脂质过氧化的主要标志物 [13],图1结果表明,与空白组相比,光损伤后模型组视网膜组织中MDA含量升高2.4倍,具有显著性差异(P<0.05),表明可见光照射导致了严重的氧化应激反应;而摄入中、高剂量受试物后的干预组视网膜中MDA水平,相对于模型组分别降低了39.02%和54.08%(P<0.05)。
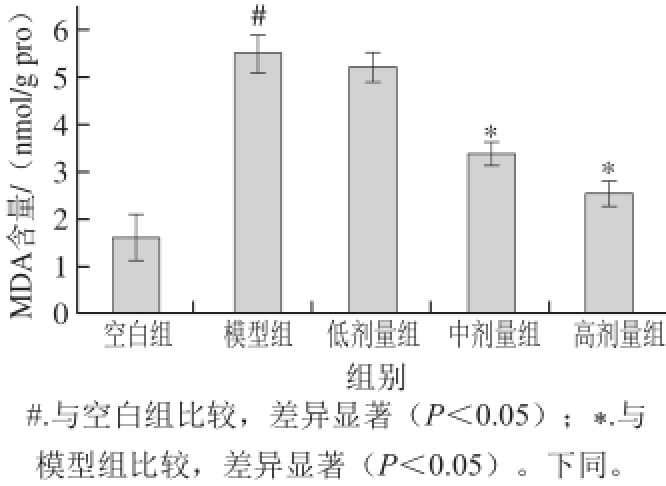
图 1 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中MDA含量的影响
Fig. 1 Effect of polysaccharide extracts and lutein on retinal malondialdehyde content in pigmented rabbit
2.2 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中4-HNE含量的影响
4-HNE是氧化应激和脂质过氧化反应的主要生物标志物之一,在眼底疾病发生发展过程中起着至关重要的作用 [14];图2实验结果表明光照后,光损伤模型组视网膜组织中4-HNE含量升高,与空白组相比具有显著性差异(P<0.05),中、高剂量受试物组视网膜中4-HNE含量相对于模型组分别降低了32.86%和41.78%,均具有显著性差异(P<0.05)。
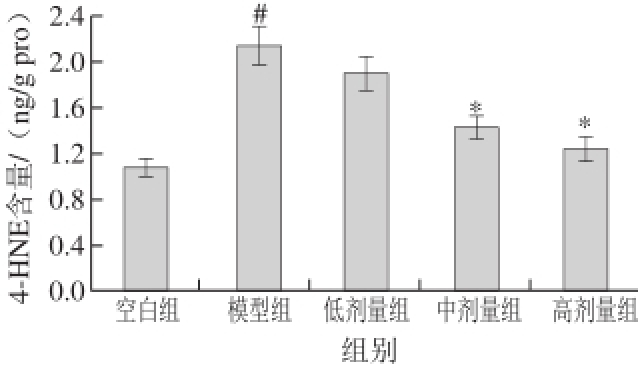
图 2 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中4-HNE含量的影响
Fig. 2 Effect of polysaccharide extracts and lutein on retinal 4-hydroxy azelaic acid content in pigmented rabbit
2.3 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中3-NT含量的影响
过氧化亚硝酸阴离子能与游离的或蛋白质结构中的酪氨酸发生硝基化生成3-NT,可以引起蛋白质结构和功能改变,导致细胞损伤,能进一步降低体内抗氧化能力 [15],与多类神经退行性疾病呈正相关 [16]。图3实验结果表明,与空白组相比,光损伤后模型组视网膜组织中3-NT含量升高46.90%,具有显著性差异(P<0.05),因此光导致的视网膜组织损伤除了与脂质氧化产物密切相关外,与蛋白质的氧化产物也密切相关;低、中、高剂量受试物组视网膜中3-NT水平相对于模型组分别降低了9.70%、17.20%和19.69%,其中高剂量组与模型组相比,具有显著性差异(P<0.05)。

图 3 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中3-NT含量的影响
Fig. 3 Effect of polysaccharide extracts and lutein on retinal 3-nitrotyrosine content in pigmented rabbit
2.4 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中8-OHdG含量的影响
DNA中碱基鸟嘌呤C 8位易受羟自由基攻击,形成碱基修饰产物8-OHdG,因此8-OHdG是氧化应激的生物标志物,能够衡量细胞内氧化应激水平,反映在病理状态下细胞的内环境,是评价氧化应激水平的重要指标 [14,17]。图4实验结果表明光照后,光损伤模型组视网膜组织中8-OHdG水平显著降升,与空白组相比具有显著性差异(P<0.05),表明可见光照射能导致视网膜组织的DNA氧化损伤。而摄入不同剂量的联合干预受试物后,8-OHdG有不同程度的下降,其中高剂量组视网膜中8-OHdG水平相对于模型组降低28.81%,具有显著性差异(P<0.05)。
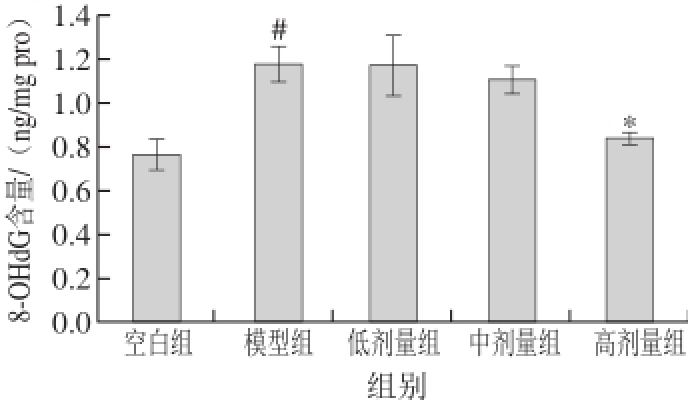
图 4 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中8-OHdG含量的影响
Fig. 4 Effect of polysaccharide extracts and lutein on retinal 8-hydroxy-deoxyguanosine content in pigmented rabbit
2.5 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中CAT活力的影响
正常的生物体内存在着丰富的抗氧化系统,氧化应激产生的活性氧自由基和活性氮自由基即由机体自身的抗氧化系统清除,其中CAT是抗氧化系统中重要的酶类之一 [14],在清除超氧阴离子自由基上发挥了重要作用。图5实验结果表明,与空白组相比,模型组视网膜组织中CAT活力显著降低(P<0.05),中、高剂量受试物组视网膜中CAT水平相对于模型组分别升高1.96、2.40 倍(P<0.05)。
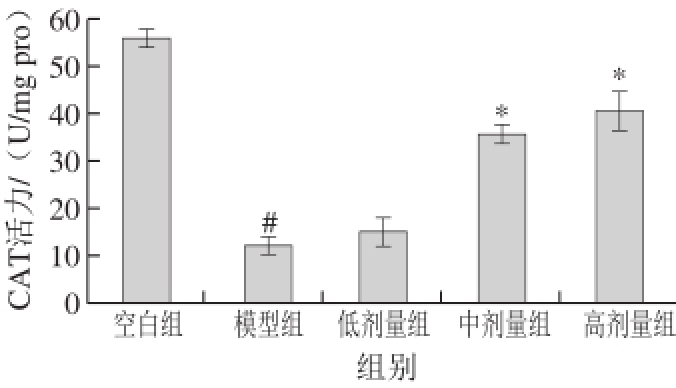
图 5 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中CAT活力的影响
Fig. 5 Effect of polysaccharide extracts and lutein on retinal catalase activity in pigmented rabbit
2.6 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中T-AOC的影响
在机体防御体系中,T-AOC代表体内酶类和非酶类抗氧化物的总体水平,能全面地反映动物机体的抗氧化状态,其作用是维持内环境活性氧(reactive oxygen species,ROS)的动态平衡,清除过高的ROS,使机体处于氧化还原相对稳定的状态 [18]。图6实验结果表明,与空白组相比,模型组视网膜组织中T-AOC显著降低(P<0.05),中、高剂量受试物组视网膜中T-AOC相对于模型组分别升高1.98 倍和2.11 倍(P<0.05)。

图 6 多糖提取物和叶黄素联合干预对青紫蓝兔视网膜组织中T-AOC的影响
Fig. 6 Effect of polysaccharide extracts and lutein on retinal total antioxidant capacity in pigmented rabbit
光诱导的视网膜损伤是自1966年以来研究视网膜病变的重要模型 [19]。光介导的ROS的产生能够诱导视网膜氧化应激和炎症反应,被认为是AMD发病和进展的关键因素 [20]。本研究采用可见光光照诱导青紫蓝兔视网膜组织产生氧化应激,视网膜组织的脂质、蛋白质和DNA等分子发生氧化反应,表现为MDA、4-HNE、3-NT和8-OHdG等化学和生物氧化标志物显著增加,而机体的抗氧化酶CAT活力和T-AOC也显著降低。这与国外其他学者的研究结果相一致 [10]。
枸杞(Lycium barbarum L.)具有“红宝”之称,枸杞多糖是枸杞中功效研究最多也是最重要的活性组分之一,包含6 种单糖(半乳糖、葡萄糖、鼠李糖、阿拉伯糖、甘露糖和木糖) [21]。枸杞多糖对神经系统尤其是视网膜损伤的保护作用已有较多的报道,如保护视网膜神经节细胞凋亡及降低视网膜缺血再灌注损伤等 [22-24]。其作用机制主要包括激活Nrf2/HO-1抗氧化信号通路、促进视网膜前体细胞增殖、抑制JNK通路 [25-27]。桑椹(Morus alba L.)是中医临床中常用的中药材。桑椹果多糖是桑椹果的重要生物活性成分(5.71%),其多糖组成具有品种特异性,主要为半乳糖、阿拉伯糖和鼠李糖,而葡萄糖和果糖含量则较低 [28-29]。研究报道指出对视网膜光感受细胞具有显著的保护作用。因此成为具有明目功能产品的重要组分之一 [30]。其主要作用机制可能归结于桑椹多糖的抗氧化作用 [7,31]。目前关于桑椹果多糖对视网膜的保护作用的报道还较少。黄斑区是视网膜的一个重要区域,叶黄素和玉米黄质在黄斑区的特异性富集被认为是其拮抗视网膜光损伤的重要物质基础。动物实验结果表明,摄食叶黄素能够改善视网膜缺血再灌注诱导的氧化损伤,保护丙烯醛诱导的视网膜色素上皮细胞氧化应激 [32-33]。流行病学研究表明,增加叶黄素和玉米黄质摄入量能够降低年龄相关性黄斑变性发病风险。类胡萝卜素类物质可能主要通过两种途径发挥拮抗光氧化损伤:一是由于其特定的理化特性能够有效的削弱蓝光,降低其对视网膜损伤;二是作为抗氧化剂猝灭单线态氧,捕获活性氧自由基如脂质过氧化物和超氧阴离子自由基等,拮抗视网膜光损伤 [34]。新近的研究表明,叶黄素和玉米黄质能够通过保护视网膜色素上皮细胞蛋白酶体氧化失活,从而调节光氧化诱导的炎性反应 [35]。
基于以上研究,推测枸杞、桑椹多糖提取物和叶黄素联合干预能够通过不同的分子机制协同改善可见光诱导的视网膜氧化损伤的潜力。本研究结果表明,枸杞子、桑椹多糖提取物和叶黄素联合干预能够剂量依赖性地改善可见光诱导的视网膜组织中脂质、蛋白质和DNA氧化,增加视网膜抗氧化活性。提示该组合物在缓解视疲劳、预防眼疾等方面具有显著作用,是研发功能性食品的理想功能素材。
参考文献:
[1] 方圆, 苏途, 谢平, 等. α-倒捻子素对小鼠视网膜光损伤的保护作用[J].国际眼科杂志, 2015, 15(7): 1143-1147.
[2] TANITO M, KAIDZU S, OHIRA A, et al. Topography of retinal damage in light-exposed albino rats[J]. Experimental Eye Research, 2008, 87(3): 292-295. DOI:10.1016/j.exer.2008.06.002.
[3] SUI G Y, LIU G C, LIUG Y, et al. Is sunlight exposure a risk factor for age-related macular degeneration? A systematic review and metaanalysis[J]. British Journal of Ophthalmology, 2013, 97(4): 389-394. DOI:10.1136/bjophthalmol-2012-302281.
[4] MASUTOMI K, CHEN C, NAKATANI K, et al. All-trans retinal mediates light-induced oxidation in single living rod photoreceptors[J]. Photochemistry and Photobiology, 2012, 88: 1356e1361. DOI:10.1111/j.1751-1097.2012.01129.x.
[5] BEATTY S, KOH H H, PHIL M, et al. The role of oxidative stress in the pathogenesis of age-related macular degeneration[J]. Survey of Ophthalmology, 2000, 45(2): 115-134. DOI:10.1016/S0039-6257(00)00140-5.
[6] 金鑫, 臧茜茜, 葛亚中, 等. 缓解视疲劳功能食品及其功效成分研究进展[J]. 食品科学, 2015, 36(3): 258-264. DOI:10.7506/spkx1002-6630-201503049.
[7] 李颖, 李庆典. 桑椹多糖抗氧化作用的研究[J]. 中国酿造, 2010, 29(4): 59-61.
[8] 王锐, 何嵋, 袁晓春, 等. 桑椹多糖体外清除自由基活性研究[J]. 安徽农业科学, 2012, 40(2): 775-776; 779.
[9] 徐淑云. 药理学实验方法学[M]. 北京: 人民卫生出版社, 2002: 179-181.
[10] LIU Yixiang, SONG Xue, ZHANG Di, et al. Blueberry anthocyanins: protection against ageing and light-induced damage in retinal pigment epithelial cells[J]. British Journal of Nutrition, 2012, 108(1): 16-27. DOI:10.1017/S000711451100523X.
[11] ESTERBAUER H, SCHAUR R J, ZOLLNER H. Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes[J]. Free Radical Biology & Medicine, 1991, 11(1): 81-128. DOI:10.1016/0891-5849(91)90192-6.
[12] VOULGARIDOU G P, ANESTOPOULOS I, FRANCO R, et al. DNA damage induced by endogenous aldehydes: current state of knowledge[J]. Mutation Research, 2011, 711(1/2): 13-27. DOI:10.1016/j.mrfmmm.2011.03.006.
[13] SHAMSI F A, CHAUDHRY I A, BOULTON M E, et al. L-carnitine protects human retinal pigment epithelial cells from oxidative damage[J]. Current Eye Research, 2007, 32: 575-584. DOI:10.1080/02713680701363833.
[14] 陈晓云, 罗燕. 氧化损伤在眼底疾病发生发展中的作用[J]. 眼科新进展, 2010, 30(12): 1186-1191.
[15] 余静, 徐圆媛, 陈立立, 等. 3-硝基酪氨酸对HepG2细胞氧化还原状态的影响[J]. 中国细胞生物学学报, 2014, 36(4): 509-515. DOI:10.11844/cjcb.2014.04.0388.
[16] MIHM M J, SCHANBACHER B L, WALLACE B L, et al. Free 3-nitrotyrosine causes striatal neurodegeneration in vivo[J]. Journal of Neuroscience, 2001, 21(11): RC149.
[17] 高玉楠, 杨靖, 宋沁馨, 等. 羟基脱氧鸟苷作为氧化损伤标志物在疾病诊断中的应用[J]. 药学与临床研究, 2012, 20(3): 223-228.
[18] 李焰, 王华, 周孝琼, 等. 银杏叶复方对实验性脾虚证模型小鼠消化酶活性和抗氧化性能的影响[J]. 中国畜牧杂志, 2010, 46(21): 52-55.
[19] NOELL W K, WALKER V S, KANG B S, et al. Retinal damage by light in rats[J]. Investigative Ophthalmology & Visual Science, 1966, 5(5): 450-473.
[20] HOLLYFIELD J G, BONILHA V L, RAYBORN M E, et al. Oxidative damage-induced inf l ammation initiates age-related macular degeneration[J]. Nature Medicine, 2008, 14(2): 194-198. DOI:10.1038/ nm1709.
[21] GAN Lu, ZHANG Shenghua, LIU Qiong, et al. A polysaccharideprotein complex from Lycium barbarum upregulates cytokine expression in human peripheral blood mononuclear cells[J]. European Journal of Pharmacology, 2003, 471(3): 217-222. DOI:10.1016/S0014-2999(03)01827-2.
[22] CHIU K, CHAN H C, YEUNG S C, et al. Modulation of microglia by wolfberry on the survival of retinal ganglion cells in a rat ocular hypertension model[J]. Journal of Ocular Biology, Diseases, and Informatics, 2009, 2(3): 127-136. DOI:10.1007/s12177-009-9023-9.
[23] LI S, YANG D, YEUNG C, et al. Lycium barbarum polysaccharides reduce neuronal damage, blood-retinal barrier disruption and oxidative stress in retinal ischemia/reperfusion injury[J]. PLoS ONE, 2011, 6(1): e16380. DOI:10.1371/journal.pone.0016380.
[24] WANG Ke, XIAO Jia, PENG Bo, et al. Retinal structure and function preservation by polysaccharides of wolfberry in a mouse model of retinal degeneration[J]. Scientific Reports, 2014, 4: 7601. DOI:10.1038/srep07601.
[25] HE Meihua, PAN Hong, CHANG R C, et al. Activation of the Nrf2/ HO-1 antioxidant pathway contributes to the protective effects of Lycium barbarum polysaccharides in the rodent retina after ischemiareperfusion-induced damage[J]. PLoS ONE, 2014, 9(1): e84800. DOI:10.1371/journal.pone.0084800.
[26] WANG H, LAU B W, WANG Ningli, et al. Lycium barbarum polysaccharides promotes in vivo proliferation of adult rat retinal progenitor cells[J]. Neural Regeneration Research, 2015, 10(12): 1976. DOI:10.4103/1673-5374.172315.
[27] LI Hongying, LIANG Yuxiang, CHIU K, et al. Lycium barbarum (wolfberry) reduces secondary degeneration and oxidative stress, and inhibits JNK pathway in retina after partial optic nerve transection[J]. PLoS ONE, 2013, 8(7): e68881. DOI:10.1371/journal.pone.0068881.
[28] 魏兆军, 胡海梅, 柏晓辉, 等. 桑椹多糖提取工艺的优化[J]. 食品科学, 2007, 28(11): 261-264.
[29] LEE J S, SYNYTSYA A, KIM H B, et al. Purif i cation, characterization and immunomodulating activity of a pectic polysaccharide isolated from Korean mulberry fruit Oddi (Morus alba L.)[J]. International Immunopharmacology, 2013, 17(3): 858-866. DOI:10.1016/ j.intimp.2013.09.019.
[30] 王延东, 王炜. 黄斑明目胶囊对MNU诱导大鼠视网膜光感受器细胞损伤的防护作用[J]. 现代食品科技, 2011, 27(1): 22-25.
[31] HAMZAA R G, SHAHAT A N E, MEKAWEY H M S. The antioxidant role of mulberry (Morus alba L.) fruits in ameliorating the oxidative stress induced in γ-irradiated male rats[J]. Biochemistry & Analytical Biochemistry, 2012, 1: 8.
[32] LI S Y, FU Z J, MA H, et al. Effect of lutein on retinal neurons and oxidative stress in a model of acute retinal ischemia/reperfusion[J]. Investigative Ophthalmology & Visual Science, 2009, 50(2): 836-843. DOI:10.1167/iovs.08-2310.
[33] SHEU S J, LIU N C, CHEN J L. Resveratrol protects human retinal pigment epithelial cells from acrolein-induced damage[J]. Journal of Ocular Pharmacology and Therapeutics, 2010, 26(3): 231-236. DOI:10.1089/jop.2009.0137.
[34] STAHL W. Macular carotenoids: lutein and zeaxanthin[M]//Nutrition and the eye. Karger Publishers, 2004: 70-88. DOI:10.1159/000082768.
[35] BIAN Qingning, GAO Shasha, ZHOU Jilin, et al. Lutein and zeaxanthin supplementation reduces photooxidative damage and modulates the expression of inflammation-related genes in retinal pigment epithelial cells[J]. Free Radical Biology and Medicine, 2012, 53(6): 1298-1307. DOI:10.1016/j.freeradbiomed.2012.06.024.
Protective Effect of Plant Polysaccharide Extracts Combined with Lutein on Visible Light-Induced Retinal Damage via an Antioxidant Mechanism
DENG Qianchun, ZANG Xixi, CHEN Peng, MENG Luxi, HUANG Qingde, HUANG Fenghong
*
(Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture, Hubei Key Laboratory of Lipid Chemistry and Nutrition, Oil Crops Research Institute, Chinese Academy of Agricultural Sciences, Wuhan 430062, China)
Key words:wolfberry polysaccharides; mulberry polysaccharides; lutein; visible light-induced retinal degeneration; antioxidant effect
DOI:10.7506/spkx1002-6630-201705038
中图分类号:R151.3
文献标志码:A
文章编号:1002-6630(2017)05-0233-06
引文格式:
引文格式:
邓乾春, 臧茜茜, 陈鹏, 等. 多糖提取物与叶黄素联合干预对可见光诱导视网膜损伤的抗氧化作用[J]. 食品科学, 2017, 38(5): 233-238. DOI:10.7506/spkx1002-6630-201705038. http://www.spkx.net.cn
DENG Qianchun, ZANG Xixi, CHEN Peng, et al. Protective effect of plant polysaccharide extracts combined with lutein on visible light-induced retinal damage via an antioxidant mechanism[J]. Food Science, 2017, 38(5): 233-238. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705038. http://www.spkx.net.cn
收稿日期:2016-03-28
基金项目:公益性行业(农业)科研专项(201303072);中国农业科学院油料作物研究所所长基金项目(1610172014006)
作者简介:邓乾春(1979—),男,副研究员,博士,研究方向为脂质营养。E-mail:chunn2@163.com
*通信作者:黄凤洪(1965—),男,研究员,博士,研究方向为脂质化学与营养。E-mail:huangfh@oilcrops.cn