李鹏程 1,朴春红 1,*,张 岚 2,*,张 羽 1,李 想 1,赵梓瀛 1,王玉华 1,刘俊梅 1,于寒松 1
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林医药学院公共卫生学院,吉林 吉林 132013)
摘 要:目的:研究荞麦壳黄酮提取物(buckwheat hull extracts,BHEs)对2型糖尿病大鼠血糖水平改善作用和机制。方法:体外实验中,测定了BHEs抑制α-葡萄糖苷酶和α-淀粉酶活性,并采用Lineweaver-Burk作图法确定其抑制反应的类型。体内实验中,高脂饮食与注射链脲佐菌素(streptozocin,STZ)复合诱导制备2型糖尿病大鼠模型,分为正常组(未诱导,蒸馏水),模型组(诱导,蒸馏水),阳性对照组(盐酸二甲双胍,100 mg/(kg·d))和BHEs低、中、高剂量组(50、100、200 mg/(kg·d),分别标记为LBHEs、MBHEs、HBHEs)。灌胃给药,每天1 次,连续干预28 d,观察大鼠体质量、空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting serum insulin,FINS)和C肽水平变化,并进行口服糖耐量实验(oral glucose tolerance test,OGTT)。结果:BHEs在α-葡萄糖苷酶-麦芽糖体系中与其抑制活性成剂量依赖关系,当BHEs质量浓度为1 mg/mL时抑制率为41.12%,酶促动力学数据表明其为竞争型抑制。STZ诱导的2型糖尿病大鼠实验结果显示,与正常组相比,模型组大鼠体质量减少了33.1%,FBG升高到(17.85±2.25) mmol/L,而FINS、C肽水平分别降低了24.80%和12.77%(P<0.05);与模型组相比,BHEs实验组改善糖尿病大鼠体质量减少,且干预28 d后MBHEs组和HBHEs组大鼠FBG与干预前比较分别降低了39.4%和48.2%(P<0.05),OGTT曲线下面积降低了47.36%、59.47%(P<0.05),MBHEs组和HBHEs组同时改善大鼠血清FINS和C肽水平,与模型组相比分别提高了32.79%、34.44%和7.40%、13.08%(P<0.05)。结论:BHEs抑制α-葡萄糖苷酶活性和修复胰岛细胞功能的双重机制改善STZ诱导的2型糖尿病大鼠的血糖指标,并呈现一定的剂量-效应关系。
关键词:荞麦壳黄酮提取物;α-葡萄糖苷酶;2型糖尿病;血糖;胰岛素;C肽
糖尿病的人数每年都在呈现递增的趋势,并且该病已经成为了全球性的公共健康问题。在最近国际糖尿病协会统计中,2015年全球糖尿病人数已经超过4.15亿人,预测到2040年糖尿病患病人数将达到6.42亿 人 [1],在中国确诊的糖尿病患者有1亿多人 [2]。糖尿病患者常伴有肾功能衰竭、冠状动脉心脏疾病、失明、缺血性脑病等并发症 [3],对患者的生活以及健康带来极大的危害。目前降糖药物主要分为胰岛素类、磺酰脲类、双胍类、α-糖苷酶抑制剂、GLP-1受体激动剂、DPP-4抑制剂等。由于α-葡萄糖苷酶抑制剂药物具有安全、有效、低血糖风险低等功效,因此被国际糖尿病联合会和美国临床内分泌医学会列为一线治疗药物 [4-5]。
荞麦中富含蛋白质、淀粉、膳食纤维、矿质元素、维生素、黄酮类化合物和其他生物活性物质,具有特殊的营养价值和保健活性 [6],因其营养成分丰富被列为一种药食同源的保健食品 [7]。荞麦具有降血糖的功效已经被许多专家所认同 [8-9],其主要活性物质为黄酮类化合物。俞浩 [10]、李超 [11]、李丹 [12]等研究表明黄酮类物质具有良好的降低血糖以及改善糖尿病并发症的功效。荞麦壳为荞麦粉生产后的主要副产物,含有丰富的黄酮类化合物,但对其开发研究不充分。本研究在优化荞麦壳黄酮提取工艺基础上 [13],进一步进行荞麦壳黄酮提取物对改善糖尿病方面的研究。
1.1 动物、材料与试剂
雄性5 周龄Wistar大鼠(SPF级)90 只,体质量120~150 g,许可证号:SCXK(吉)-2011-0004,序号:20146484;高脂高糖饲料(含10%蔗糖,10%猪油,5%胆固醇) 长春市亿斯实验动物技术有限责任公司。
甜荞麦壳购于内蒙古赤峰市鸿燕荞麦米厂;荞麦壳黄酮提取物(buckwheat hull extracts,BHEs)的制备参照朴春红等 [13]的方法。
芦丁(纯度>98%) 北京寰宇科创生物科技发展有限公司;盐酸二甲基双胍 北京双鹤药业股份有限公司;链脲佐菌素(streptozocin,STZ) 美国Sigma公司;α-葡萄糖苷酶(酶活>10 000 U/g) 北京索莱宝科技有限公司;对硝基苯-α-D-葡萄糖吡喃苷(p-nitrophenyl-α-D-glucopyranoside,PNPG) 美国阿拉丁试剂公司;α-淀粉酶(酶活>4 000 U/g) 上海Kayon公司;大鼠血清胰岛素试剂盒、大鼠血清C肽试剂盒、葡萄糖氧化酶试剂盒 上海恒远试剂公司;其余试剂均为国产分析纯。
1.2 仪器与设备
HY-04A高速粉碎机 北京环亚天元机械技术有限公司;YXQ-LS-75G立式压力蒸汽灭菌锅 上海博讯实业有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE52CS旋转蒸发仪 上海亚荣生化仪器厂;infiniteM200酶标仪 瑞士Tecan公司;Onetouch Ultra血糖测定仪 强生(中国)投资有限公司。
1.3 方法
1.3.1 BHEs中总黄酮含量测定
BHEs中总黄酮含量的测定参考《保健食品检验与评价技术规范》(2003版)NaNO 2-Al(NO 3) 3法略有改进。以芦丁作为标准试剂 [14]。准确移取芦丁标准品溶液(200 mg/mL)0.0、0.1、0.2、0.4、0.6、0.8、1.0、2.0、3.0 mL于试管中,各试管补加甲醇至3.0 mL,加入4% NaNO 2溶液0.5 mL,摇匀后静置6 min。再加入10% Al(NO 3) 3溶液0.5 mL,摇匀后静置6 min。最后加入4% NaOH溶液3 mL,摇匀后静置15 min,在510 nm波长处测定吸光度,绘制芦丁标准曲线得线性回归方程为:y=0.905 0x+0.039 3,R 2=0.999,根据标准曲线测得BHEs总黄酮含量为31.79%。
1.3.2 BHEs抑制α-葡萄糖苷酶和α-淀粉酶活性的测定
1.3.2.1 抑制α-葡萄糖苷酶活性测定
以PNPG为底物的α-葡萄糖苷酶活性测定参照Xiao Jianbo等 [15]的方法加以改良。所有溶液均用0.1 mol/L磷酸盐缓冲溶液(phosphate buffered saline,PBS)配制,样品孔中分别加入60 μL的PNPG(10 mmol/L)、28 μL的α-葡萄糖苷酶(5 mg/mL),再加入2 μL的谷胱甘肽(1 mg/mL),最后加入10 μL BHEs,BHEs质量浓度分别为0.006 25、0.012 50、0.025 00、0.050 00、0.100 00、0.250 00、0.500 00、0.750 00、1.000 00 mg/mL,设空白孔(不加BHEs,用0.1 mol/L PBS代替),颜色对照孔(不加α-葡萄糖苷酶,用0.1 mol/L PBS代替),37 ℃温育反应20 min,然后加入100 μL的0.1 mmol/L Na 2CO 3终止反应,在400 nm波长处测定吸光度。抑制率按公式(1)计算。
式中:A 空白为空白孔的吸光度;A 样品为各质量浓度BHEs样品孔的吸光度;A 颜色对照为颜色对照孔的吸光度。
1.3.2.2 抑制α-葡萄糖苷酶(麦芽糖)活性测定
以麦芽糖为底物的α-葡萄糖苷酶活性测定方法参照范文娅等 [16]方法加以改良。取100 μL 0.1 mol/L PBS于1.5 mL的EP管,加入30 μL α-葡萄糖苷酶(5 mg/mL),然后加入麦芽糖(10 mmol/L)60 μL,最后加入BHEs 10 μL,BHEs质量浓度分别为0.00、0.05、0.10、0.25、0.50、1.00 mg/mL,首先37 ℃温育30 min,然后沸水加热5 min终止反应,然后4 ℃、1 000 r/min离心2 min,取上清液10 μL用葡萄糖氧化酶试剂盒测定葡萄糖含量。抑制率按公式(2)计算。
式中;A 空白为不加BHEs的吸光度;A 样品为各质量浓度BHEs样品孔的吸光度。
1.3.2.3 BHEs对α-葡萄糖苷酶的抑制反应类型的定
以麦芽糖为底物,浓度分别为5、10、20、40 mol/L,加入不同质量浓度BHEs,测定反应体系中酶促反应速率v(Δ A值)随底物浓度变化趋势,以底物浓度的倒数(1/[S])为横坐标,速率倒数(1/v)为纵坐标作图,即Lineweaver-Burk(L-B)双倒数作图法,确定各抑制剂对α-葡萄糖苷酶抑制反应的类型。以直线的斜率和对Y轴的截距以及BHEs质量浓度二次作图可以求出抑制常数K i。计算公式(3)和(4)如下:

式中:v
max表示最大催化反应速率;v为酶促反应速率;K
i、K
m和
 分别表示抑制常数、米氏常数和表观米氏常数;[I]和[S]分别为BHEs质量浓度/(mg/mL)和底物麦芽糖浓度/(mmol/L)。
分别表示抑制常数、米氏常数和表观米氏常数;[I]和[S]分别为BHEs质量浓度/(mg/mL)和底物麦芽糖浓度/(mmol/L)。
1.3.2.4 BHEs抑制α-淀粉酶活性测定
参照Yang Xiaowei等 [17]的方法略有改动。根据配制0.2%可溶性淀粉溶液,在96 孔板中先加入100 μL淀粉溶液,再加入10 μL BHEs,抑制剂质量浓度分别为0.05、0.10、0.25、0.50、1.00 mg/mL,设空白孔,用水代替抑制剂,在37 ℃孵育5 min后,加入20 μL的5 mg/mL α-淀粉酶酶液,37 ℃反应1 h,加入50 μL的1 mol/L盐酸终止反应。再加入20 μL碘-碘化钾溶液显色,在620 nm波长处测定吸光度。抑制率按公式(2)计算。
1.3.3 动物模型的建立和分组
1.3.3.1 糖尿病模型制作
5周龄Wistar大鼠,1 周适应性喂养后,干预组大鼠饲喂高脂高糖饲料4 周。4 周后,禁食12 h,腹腔注射STZ 40 mg/kg,1 周后空腹血糖(fasting blood glucose,FBG)含量<16.7 mmol/L的大鼠再次注射1 次。1 周后FBG含量>16.7 mmol/L的为成模标准 [18-19]。正常组注射1%柠檬酸-柠檬酸纳缓冲液40 mg/kg做安慰剂。
1.3.3.2 动物分组及干预剂量
将造模成功的糖尿病大鼠随机分为5 组,加上正常组共6 组,每组10 只。实验前进行FBG水平测定。各组大鼠分组及灌胃处理情况如下:
正常组:蒸馏水灌胃10 mL/(kg·d);模型组:蒸馏水灌胃10 mL/(kg·d);BHEs低剂量组(LBHEs):BHEs 50 mg/(kg·d);中剂量组(MBHEs):BHEs 100 mg/(kg·d);高剂量组(HBHEs):BHEs 200 mg/(kg·d);阳性对照组:盐酸二甲双胍100 mg/(kg·d),灌胃量为10 mL/kg。
1.3.4 生化检测指标测定
1.3.4.1 大鼠体质量
分别于干预前、干预1、2、3、4 周后进行大鼠体质量的测定。
1.3.4.2 FBG、空腹血清胰岛素、C肽含量测定的口服糖耐量实验
在造模3 d后对大鼠进行干预、测定干预前、干预7、14、21、28 d后进行FBG含量测定,每次测定前大鼠空腹12 h后尾部静脉取血测定FBG含量。干预26 d后进行口服糖耐量实验(oral glucose tolerance test,OGTT) [20],对大鼠禁食不禁水12 h,不同实验组大鼠按要求灌胃BHEs,同时每只大鼠灌胃给予10%淀粉溶液(3 g/kg(以体质量计)),灌胃后0、30、60、120 min分别对尾尖进行取血,分离血清,测定各时间点的血糖含量,计算:OGTT曲线下面积(area under the curve,AUC)。AUC按公式(5)计算:
式中:C 1为给药0 min血糖含量/(mmol/L);C 2为给药30 min血糖含量/(mmol/L);C 3为给药60 min血糖含量/(mmol/L);C 4为给药120 min血糖含量/(mmol/L)。
干预28 d后,空腹12 h后给大鼠注射20%乌拉坦,腹主动脉取血,对各组大鼠所采血样4 ℃静置30 min,3 000 r/min离心20 min,后取上层血清分装于EP管中,取血清根据试剂盒说明书测定血清中空腹血清胰岛素(fasting serum insulin,FINS)含量和C肽含量。
1.4 数据统计分析
数据均以
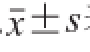 表示,运用SPSS 17.0软件统计分析数据,采用单因素方差分析(one-way ANOVA analysis)进行显著性分析,P<0.05为差异显著性。
表示,运用SPSS 17.0软件统计分析数据,采用单因素方差分析(one-way ANOVA analysis)进行显著性分析,P<0.05为差异显著性。
2.1 BHEs抑制α-葡萄糖苷酶和α-淀粉酶活性的影响
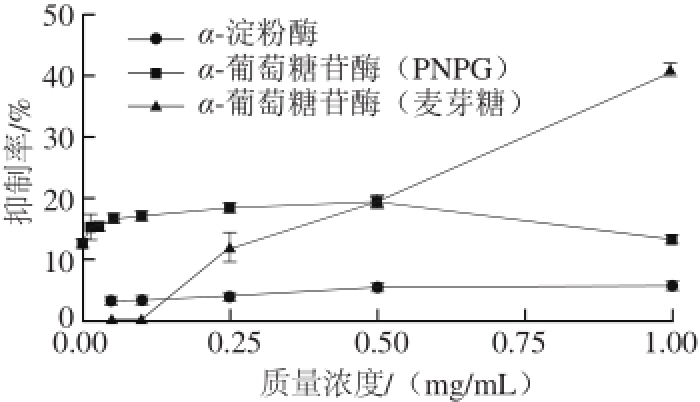
图 1 BHEs抑制α-葡萄糖苷酶和α-淀粉酶活性的影响
Fig. 1 Inhibitory effect of BHE on α-amylase and α-glucosidase activities
从图1可以看出,以PNPG和麦芽糖做底物时,BHEs抑制α-葡萄糖苷酶活性呈现出不同的趋势。PNPG为底物时,BHEs在低质量浓度条件下对α-葡萄糖苷酶具有较好的抑制作用,但是其抑制活性与BHEs质量浓度无剂量依赖关系。而当麦芽糖为α-葡萄糖苷酶底物时,随着BHEs质量浓度的升高,其对α-葡萄糖苷酶抑制率显著增加,最高抑制率达到41.12%。进一步测定BHEs对α-淀粉酶的抑制作用,结果表明BHEs具有抑制α-淀粉酶活性的作用,但其抑制率较低,约为5%。李艳琴等 [21]研究得到甜荞麦麸皮提取物对α-葡萄糖苷酶活性具有抑制活性,其半抑制率浓度(half inhibition concentration,IC 50)为17.56 mg/mL。朱丽艳等 [22]研究表明,荞麦花总黄酮对α-葡萄糖苷酶抑制率为54.74%,此时总黄酮的质量浓度为20 mg/mL。由于BHEs含有较高的色素物质,高质量浓度无法满足实验要求,故本实验没有进行更高质量浓度条件下抑制率的测定。但从本实验获得的结果看,BHEs抑制α-葡萄糖苷酶的活性远高于荞麦麸皮或花中的黄酮。王斯慧等 [23]研究苦荞黄酮抑制α-淀粉酶活性,其IC 50为0.18 mg/mL,高于BHEs抑制α-淀粉酶活性,这可能与荞麦品种不同有关。
2.2 BHEs对α-葡萄糖苷酶的抑制反应类型的确定

图 2 不同质量浓度BHEs对α-葡萄糖苷酶抑制的双倒数动力曲线
Fig. 2 Lineweaver-Burk plot for the inhibition of BHE on α-glucosidase
选择有高抑制率的α-葡萄糖苷酶(麦芽糖)体系,测定α-葡萄糖苷酶抑制反应类型,结果如图2所示。随着BHEs质量浓度的增大(0.00、0.10、0.25、0.50、1.00 mg/mL),1/[S]与1/v线性方程的斜率也随着增加,纵截距为1/v max,基本保持不变,表明BHEs对α-葡萄糖苷酶的抑制剂类型为竞争型抑制型,这与黄云霞等 [24]的研究结果相一致。通过公式(1)和公式(2)计算抑制常数K i,可得K i=(0.62±0.10) mmol/L。
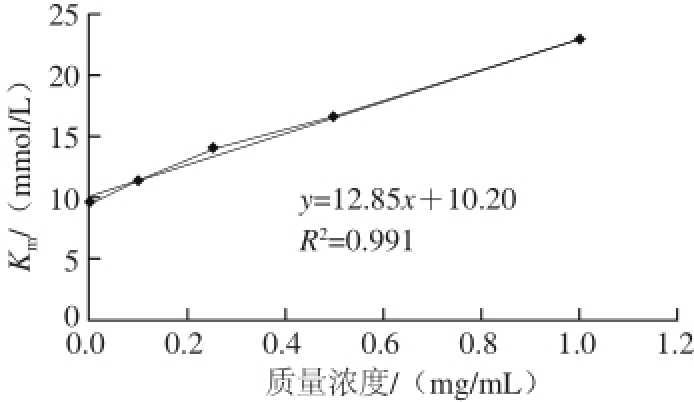
图 3 BHEs质量浓度对K
m值的影响
Fig. 3 Effect of BHE concentration on K
m
如图3所示,米氏常数K m值随抑制剂BHEs质量浓度的增大而增大,并与抑制剂质量浓度呈良好线性关系。说明BHEs在α-葡萄糖苷酶上只有一个或一种单独的抑制位点。
2.3 BHEs对STZ诱导的糖尿病大鼠体质量的影响
表 1 BHEs干预前后STZ诱导的糖尿病大鼠体质量变化
Table 1 Effect of BHE on body weight in STZ-induced diabetic rats
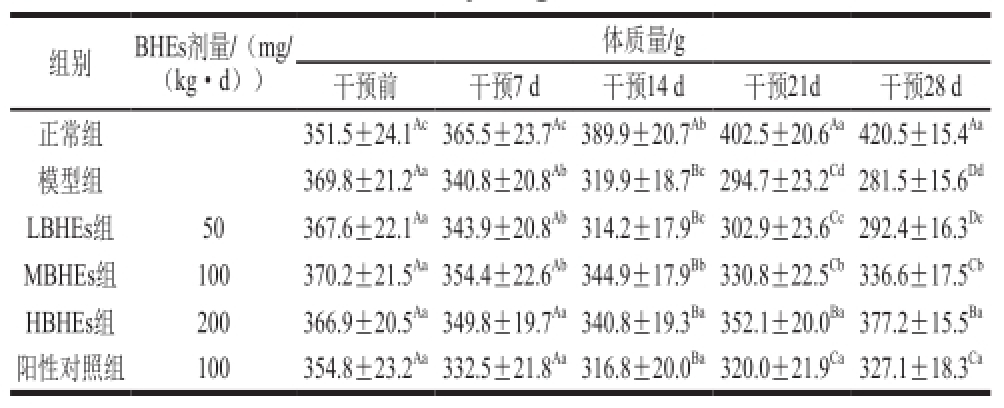
注:肩标大写字母不同代表组间显著性差异(P<0.05);肩标小写字母不同代表组内不同时间显著性差异(P<0.05)。下同。
组别B H E s剂量/(m g /(k g · d))体质量/ g干预前干预7 d 干预1 4 d 干预2 1 d 干预2 8 d正常组3 5 1 . 5 ± 2 4 . 1 Ac3 6 5 . 5 ± 2 3 . 7 Ac3 8 9 . 9 ± 2 0 . 7 Ab4 0 2 . 5 ± 2 0 . 6 Aa4 2 0 . 5 ± 1 5 . 4 Aa模型组3 6 9 . 8 ± 2 1 . 2 Aa3 4 0 . 8 ± 2 0 . 8 Ab3 1 9 . 9 ± 1 8 . 7 Bc2 9 4 . 7 ± 2 3 . 2 Cd2 8 1 . 5 ± 1 5 . 6 DdL B H E s组5 0 3 6 7 . 6 ± 2 2 . 1 Aa3 4 3 . 9 ± 2 0 . 8 Ab3 1 4 . 2 ± 1 7 . 9 Bc3 0 2 . 9 ± 2 3 . 6 Cc2 9 2 . 4 ± 1 6 . 3 DcM B H E s组1 0 0 3 7 0 . 2 ± 2 1 . 5 Aa3 5 4 . 4 ± 2 2 . 6 Ab3 4 4 . 9 ± 1 7 . 9 Bb3 3 0 . 8 ± 2 2 . 5 Cb3 3 6 . 6 ± 1 7 . 5 CbH B H E s组2 0 0 3 6 6 . 9 ± 2 0 . 5 Aa3 4 9 . 8 ± 1 9 . 7 Aa3 4 0 . 8 ± 1 9 . 3 Ba3 5 2 . 1 ± 2 0 . 0 Ba3 7 7 . 2 ± 1 5 . 5 Ba阳性对照组1 0 0 3 5 4 . 8 ± 2 3 . 2 Aa3 3 2 . 5 ± 2 1 . 8 Aa3 1 6 . 8 ± 2 0 . 0 Ba3 2 0 . 0 ± 2 1 . 9 Ca3 2 7 . 1 ± 1 8 . 3 Ca
如表1所示,模型组大鼠体质量从(369.8±21.3) g下降到(281.5±15.6)g,干预28 d后体质量与正常组相比,减少了33.1%。BHEs灌胃后HBHEs组的体质量呈现先下降后上升的趋势,LBHEs组和MBHEs组呈下降趋势,但差异不显著(P>0.05)。当干预28 d后MBHEs组和HBHEs组体质量低于正常组20.0%和10.2%,但显著高于模型组大鼠的体质量。阳性对照组体质量较模型组提高了16.20%,具有显著性差异(P<0.05),但低于HBHEs组。可以得出BHEs对糖尿病大鼠体质量减少症状有改善作用。
2.4 BHEs对STZ诱导的糖尿病大鼠血清FBG浓度的影响
表 2 BHEs干预前后STZ诱导糖尿病大鼠的FBG浓度
Table 2 Effect of BHE on FBG in STZ-induced diabetic rats
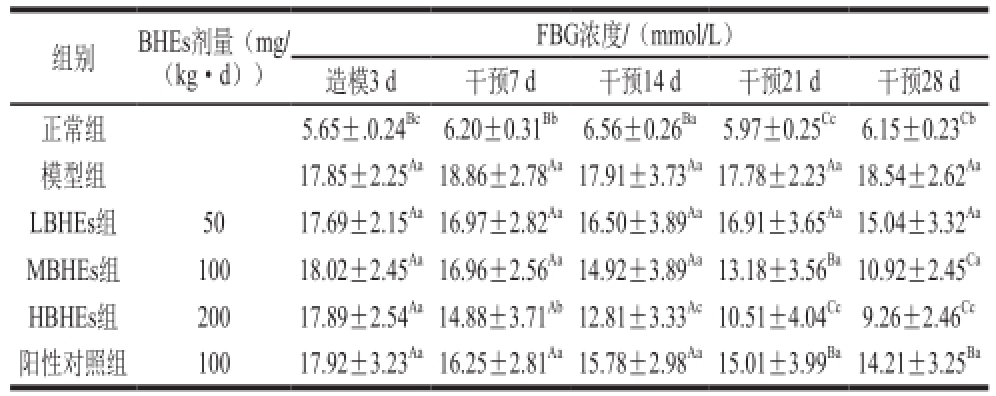
FBG浓度/(mmol/L)造模3 d 干预7 d 干预14 d干预21 d干预28 d正常组5.65±.0.24 Bc6.20±0.31 Bb6.56±0.26 Ba5.97±0.25 Cc6.15±0.23 Cb模型组17.85±2.25 Aa18.86±2.78 Aa17.91±3.73 Aa17.78±2.23 Aa18.54±2.62 AaLBHEs组5017.69±2.15 Aa16.97±2.82 Aa16.50±3.89 Aa16.91±3.65 Aa15.04±3.32 AaMBHEs组10018.02±2.45 Aa16.96±2.56 Aa14.92±3.89 Aa13.18±3.56 Ba10.92±2.45 CaHBHEs组20017.89±2.54 Aa14.88±3.71 Ab12.81±3.33 Ac10.51±4.04 Cc9.26±2.46 Cc阳性对照组10017.92±3.23 Aa16.25±2.81 Aa15.78±2.98 Aa15.01±3.99 Ba14.21±3.25 Ba组别BHEs剂量(mg/(kg·d))
BHEs干预7、14、21、28 d后FBG浓度结果见表2。干预28 d后模型组FBG浓度无明显变化(P>0.05);LBHEs组在BHEs干预28 d后,FBG浓度从造模3 d后的(17.69±2.15) mmol/L下降到(15.04±3.32) mmol/L,但是与模型组干预28 d后的FBG浓度相比无显著差异(P>0.05)。MBHEs组在干预第21天时,FBG浓度比模型组显著降低,当干预到28 d时FBG浓度下降到(10.92±2.45) mmol/L(P<0.05),降低幅度为39.4%。HBHEs组干预效果更加显著,干预21d后FBG显著降低,当干预28 d时FBG浓度下降到(9.26±2.46) mmol/L,降低幅度高达48.2%。阳性对照组的干预效果趋势与LBHEs组相似,干预28 d后FBG浓度下降到(14.21±3.25) mmol/L,降低幅度为20.7%。
2.5 BHEs对STZ诱导的糖尿病大鼠血清FINS和C肽含量的影响

图 4 BHEs干预28 d后STZ诱导大鼠FINS浓度变化
Fig. 4 Effect of BHE on serum FINS in STZ-induced diabetic rats after 28 days of intervention
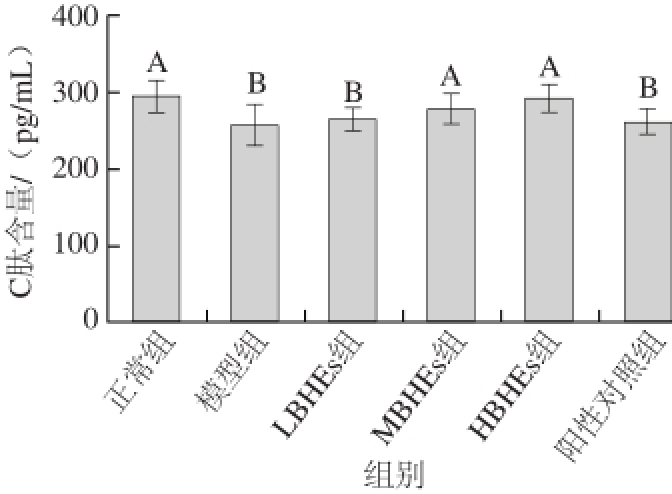
图 5 BHEs干预28 d后STZ诱导大鼠血清C肽含量变化
Fig. 5 Effect of BHE on serum C-Peptide level in STZ-induced diabetic rats after 28 days of intervention
在干预28 d后处死大鼠,离心血浆获得血清,用试剂盒测定血清中F I N S和C肽含量如图4所示模型组大鼠血清中FINS浓度为(14.64±1.44) µmol/L与正常组相比显著降低,但BHEs干预后MBHEs组和HBHEs组FINS浓度分别为(18.71±1.40) µmol/L和(19.44±2.12) µmol/L,与模型组相比分别提高32.79%、34.44%,差异显著(P<0.05),几乎达到了正常组FINS水平。相比之下,阳性对照组FINS浓度与模型组相比无显著性变化(P>0.05)。由图5可知,C肽含量变化与图3中的FINS浓度变化趋势一致,随着BHEs剂量的增加,C肽含量呈上升趋势,MBHEs组和HBHEs组大鼠血清中C肽含量与正常组无显著差异。
2.6 BHEs对STZ诱导的糖尿病大鼠OGTT和AUC结果
在干预26 d后进行OGTT,结果如表3所示,HBHEs组在灌胃淀粉30 min后FBG浓度为(16.45±1.76) mmol/L,接近于正常组的FBG(16.71±0.58) mmol/L。给药120 min后MBHEs组和HBHEs组FBG浓度都可以恢复到给药0 min时的FBG水平。阳性对照组给药120 min后FBG浓度下降到(17.01±2.24) mmol/L,并未达到其FBG水平。模型组AUC值(68.46±1.85)远远高于正常组的(23.39±1.44)。随着BHEs剂量的增加,AUC值逐渐降低,MBHEs组和HBHEs组AUC值分别为36.04±1.39和27.75±0.95,与模型组相比差异显著(P<0.05);HBHEs组与正常组差异不显著(P>0.05)。阳性对照组组AUC值为44.42±1.23,显著高于MBHEs组和HBHEs组(P<0.05)。干预28 d后MBHEs组、HBHEs组、阳性对照组与模型组相比都能显著降低AUC值,下降程度分别为47.36%、59.47%和35.12%。
表 3 BHEs干预26 d后糖尿病大鼠糖耐量的影响
Table 3 Effect of BHE on glucose tolerance in STZ-induced diabetic rats after 26 days of intervention
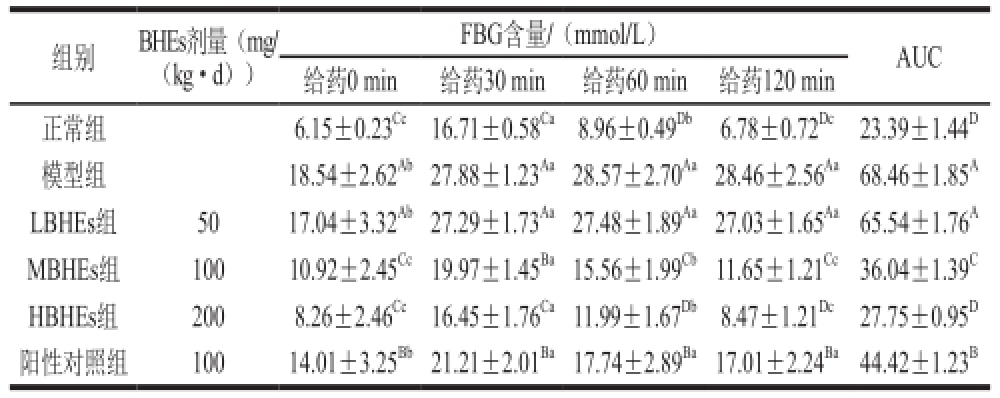
组别BHEs剂量(mg/(kg·d))FBG含量/(mmol/L)AUC给药0 min给药30 min给药60 min给药120 min正常组6.15±0.23 Cc16.71±0.58 Ca8.96±0.49 Db6.78±0.72 Dc23.39±1.44 D模型组18.54±2.62 Ab27.88±1.23 Aa28.57±2.70 Aa28.46±2.56 Aa68.46±1.85 ALBHEs组5017.04±3.32 Ab27.29±1.73 Aa27.48±1.89 Aa27.03±1.65 Aa65.54±1.76 AMBHEs组10010.92±2.45 Cc19.97±1.45 Ba15.56±1.99 Cb11.65±1.21 Cc36.04±1.39 CHBHEs组2008.26±2.46 Cc16.45±1.76 Ca11.99±1.67 Db8.47±1.21 Dc27.75±0.95 D阳性对照组10014.01±3.25 Bb21.21±2.01 Ba17.74±2.89 Ba17.01±2.24 Ba44.42±1.23 B
本研究通过BHEs在抑制α-葡萄糖苷酶和α-淀粉酶活性的体外实验以及STZ诱导的2型糖尿病大鼠模型体内实验,证明了荞麦壳提取物具有改善糖尿病大鼠高血糖的作用。研究表明BHEs可以抑制α-葡萄糖苷酶和α-淀粉酶活性。其中在以麦芽糖为底物的α-葡萄糖苷酶反应中,BHEs表现为竞争型抑制类型,其K i为(0.62±0.10) mmol/L。而对α-淀粉酶,BHEs具有较低的抑制率。
关于BHEs对α-葡萄糖苷酶的抑制作用,本研究使用PNPG和麦芽糖2 种底物进行活性检测,结果显示BHEs对以麦芽糖为底物反应抑制率高于PNPG为底物的抑制率。文丽霞等 [25]研究不同底物时,阿卡波糖抑制α-葡萄糖苷酶的效果,结果也表明麦芽糖为底物时对α-葡萄糖苷酶抑制率高于PNPG为底物。由于PNPG不存在于体内,而正常人进食后食物中的淀粉经过α-淀粉酶作用,分解成为麦芽糖、麦芽三糖等,在经过α-葡萄糖苷酶作用生成葡萄糖、果糖等。因此α-葡萄糖苷酶(麦芽糖)体系为更接近体内的反应类型。
在STZ诱导的2型糖尿病大鼠的体内实验中,BHEs可显著改善糖尿病大鼠体质量的降低,同时具有显著的降血糖效果。尤其在MBHEs组和HBHEs组大鼠FBG浓度从干预前(18.02±2.45)、(17.09±2.54) mmol/L到干预28 d后的(10.92±2.45)、(9.26±2.46) mmol/L,显著性降低(P<0.05),与正常组(6.15±0.23) mmol/L相比无显著性差异(P>0.05)。同时OGTT结果也表明,BHEs可显著降低糖尿病模型大鼠的AUC值。特别是MBHEs组和HBHEs组与模型组相比每个时间点的血糖都有明显的降低(P<0.05)。这个结果可能与BHEs抑制α-葡萄糖苷酶和α-淀粉酶活性有关。韩淑英等 [26]的研究证明荞麦花黄酮可以降低OGTT中糖尿病大鼠的血糖水平,但灌胃120 min后FBG并未达到正常水平。
2型糖尿病是一种慢性代谢性疾病,是由遗传、环境、生活习惯及肥胖等多种病因引起的代谢异常综合症,表现为胰岛素分泌相对缺乏(部分胰岛β细胞分泌功能受损)或产生胰岛素抵抗,而引起的糖脂代谢紊乱等症状 [27]。糖尿病模型动物包括自发型、诱导型和基因敲除型等。STZ诱导的2型糖尿病模型由于价格便宜,经常用于在糖尿病药物初期筛查研究中。本研究通过高脂膳食和STZ复合诱导的方法,成功诱导出2型糖尿病模型。模型组与正常组大鼠相比,胰岛素水平显著下降,说明模型组大鼠部分胰岛细胞受损。经过BHEs干预后,发现MBHEs组和HBHEs组血清中胰岛素含量显著提升(32.79%、34.44%)(P<0.05),并且与正常组相比无显著性差异。同时在血清中C肽含量变化与FINS浓度有相似的趋势。胰岛素虽然是评价胰岛受损程度的主要指标,但是因其半衰期较短,故检测结果可能与实际情况存在一定差异。C肽由胰岛素原裂解产生,一分子胰岛素原是裂解后产生一分子C肽和一分子胰岛素,而C肽半衰期较胰岛素明显长,故C肽较胰岛素更能准确反映胰岛细胞的分泌能力,是评价胰岛素内源性分泌的重要指标,从临床上也得到充分肯定 [28]。本研究结果预示BHEs可能通过修复胰岛细胞功能机制来改善2型糖尿病大鼠高血糖症。众多研究结果表明 [29-31],这种机制将有广阔的发展前景。
综上所述,荞麦壳黄酮提取物抑制α-葡萄糖苷酶活性和修复胰岛细胞功能的双重机制改善STZ诱导的2型糖尿病大鼠的血糖指标,并呈现一定的剂量-效应关系。
参考文献:
[1] CHO N H. Q&A: fi ve questions on the 2015 IDF Diabetes Atlas[J]. Diabetes Research and Clinical Practice, 2016, 115: 157-159. DOI:10.1016/j.diabres.2016.04.048.
[2] BUNKENBORG M. The uneven seepage of science: diabetes and biosociality in China[J]. Health & Place, 2016, 39: 212-218.
[3] Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes[J]. The New England of Journal of Medicine, 2008, 358: 2545-2559. DOI:10.1056/ NEJMoa0802743.
[4] International Diabetes Federation Guideline Development Group. Global guideline for type 2 diabetes[J]. Diabetes Research and Clinical Practice, 2014, 104(1): 1-2. DOI:10.1016/j.diabres.2012.10.001.
[5] FORCE T. AACE comprehensive diabetes management algorithm[J]. Endocrine Practice, 2013, 19(2): 327-328.
[6] 秦培友. 我国主要荞麦品种资源品质评价及加工处理对荞麦成分和活性的影响[D]. 北京: 中国农业科学院, 2012: 1-8.
[7] 阎红. 荞麦的应用研究及展望[J]. 食品工业科技, 2011, 32(1): 363-365.
[8] 余红, 王志路, 韩淑英, 等. 荞麦种子提取物对α-糖苷酶及餐后血糖影响的实验研究[J]. 四川中医, 2010, 28(5): 60-62.
[9] 张敏. 荞麦凉茶工艺研究及其对Ⅱ型糖尿病小鼠降血糖作用[D]. 杨凌: 西北农林科技大学, 2014: 32-43.
[10] 俞浩, 毛斌斌, 周国梁, 等. 白背三七总黄酮对糖尿病大鼠的降血糖作用[J]. 食品科学, 2013, 34(15): 295-298. DOI:10.7506/spkx1002-6630-201315061.
[11] 李超, 崔珏, 周小双, 等. 鼠曲草总黄酮改善糖尿病小鼠抗氧化功能的研究[J]. 食品科学, 2013, 34(21): 311-314.
[12] 李丹, 彭成, 谢晓芳. 黄酮类化合物治疗糖尿病及其并发症的研究进展[J]. 中国实验方剂学杂志, 2014, 20(11): 239-242.
[13] 朴春红, 刘丽苹, 初琦, 等. 热水法提取荞麦壳黄酮工艺优化及抗氧化活性[J]. 吉林农业大学学报, 2014, 36(6): 719-722; 734. DOI:10.13327/j.jjlau.2014.2266.
[14] 陈旭清. 荞麦壳精深加工综合利用研究[D]. 西安: 陕西科技大学, 2014: 10-11.
[15] XIAO J, HUO J, JIANG H, et al. Chemical compositions and bioactivities of crude polysaccharides from tea leaves beyond their useful date[J]. International Journal of Biological Macromolecules, 2011, 49(5): 1143-1151.
[16] 范文娅, 吴正钧, 季红, 等. 不同干酪乳杆菌菌株对α-葡萄糖苷酶抑制作用的比较[J]. 食品与发酵工业, 2012, 38(4): 29-33.
[17] YANG X W, HUANG M Z, JIN Y S, et al. Phenolics from Bidens bipinnata and their amylase inhibitory properties[J]. Fitoterapia, 2012, 83(7): 1169-1175. DOI:10.1016/j.f i tote.2012.07.005.
[18] 林心君, 王麒又, 辛金钟, 等. 高成模率和高稳定性的糖尿病大鼠模型制备—高脂高糖膳食+STZ体重联合体表面积法构建糖尿病大鼠模型[J]. 中国老年学杂志, 2013, 33(9): 2051-2054. DOI:10.3969/ j.issn.1005-9202.2013.09.031.
[19] 邵俊伟, 蔡逊. 高脂饮食联合链脲佐菌素建立2型糖尿病大鼠模型的研究进展[J]. 中国实验动物学报, 2014, 22(4): 90-93. DOI:10.3969/j.issn.1005-4847.2014.04.020.
[20] 李晨岚. 以α-葡萄糖苷酶为靶向降糖物质的研究[D]. 武汉: 华中农业大学, 2008: 31-32.
[21] 李艳琴, 周凤超, 陕方, 等. 荞麦麸皮提取物对α-葡萄糖苷酶活性的影响[J]. 食品科学, 2010, 31(17): 10-13.
[22] 朱丽艳, 郭兰, 王瑞雪, 等. 荞麦花总黄酮和槲皮素对α-葡萄糖苷酶活性的影响[J]. 时珍国医国药, 2010, 21(5): 1135-1136. DOI:10.3969/ j.issn.1008-0805.2010.05.051.
[23] 王斯慧, 白银花, 黄琬凌, 等. 苦荞黄酮对 α-淀粉酶的抑制作用研究[J].食品工业, 2012, 33(3): 109-111.
[24] 黄云霞, 张民, 张倩, 等. α-葡萄糖苷酶抑制剂筛选及其抑制类型研究[J]. 中国食品添加剂, 2014(3): 96-99. DOI:10.3969/ j.issn.1006-2513.2014.03.008.
[25] 文丽霞, 吴正钧, 郭本恒. 两种α-糖苷酶抑制剂体外筛选模型的改良与比较[J]. 天然产物研究与开发, 2015, 27(4): 681-686.
[26] 韩淑英, 张博男, 张静怡, 等. 荞麦花叶黄酮对2型糖尿病大鼠血糖稳态的影响[J]. 第三军医大学学报, 2013, 35(23): 2597-2599.
[27] BANERJEE M, VATS P. Reactive metabolites and antioxidant gene polymorphisms in type 2 diabetes mellitus[J]. Redox Biology, 2014, 2: 170-177.
[28] 周玉荣, 肖健青. 2型糖尿病患者血清胰岛素及C肽水平变化的临床研究[J]. 检验医学与临床, 2013, 10(18): 2413-2415. DOI:10.3969/ j.issn.1672-9455.2013.18.030
[29] IRUDAYARAJ S S, STALIN A, SUNIL C, et al. Antioxidant, antilipidemic and antidiabetic effects of f i cusin with their effects on GLUT4 translocation and PPAR gamma expression in type 2 diabetic rats[J]. Chemico-Biological Interactions, 2016, 256: 85-93.
[30] SALMANOGLU D S, GURPINAR T, VURAL K, et al. Melatonin and L-carnitin improves endothelial disfunction and oxidative stress in type 2 diabetic rats[J]. Redox Biology, 2016, 8: 199-204.
[31] DOGAN A, CELIK I, KAYA M S. Antidiabetic properties of lyophilized extract of acorn (Quercus brantii Lindl.) on experimentally STZ-induced diabetic rats[J]. Journal of Ethnopharmacology, 2015, 176: 243-251.
Antidiabetic Effect and Mechanism of Flavonoids Extracted from Bunckwheat Hulls in Type 2 Diabetic Rats
LI Pengcheng
1, PIAO Chunhong
1,*, ZHANG Lan
2,*, ZHANG Yu
1, LI Xiang
1, ZHAO Ziying
1, WANG Yuhua
1, LIU Junmei
1, YU Hansong
1
(1. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China;2. School of Public Health, Jilin Medical College, Jilin 132013, China)
Abstract:Objective: To evaluate the improvement of blood glucose levels in type 2 diabetic rats using buckwheat hull extracts (BHEs) rich in flavonoids and to explore its possible mechanisms. Methods: The inhibitory effect of BHEs on α-glucosidase and α-amylase activities was evaluated in vitro, and the type of enzyme inhibition was determined by Lineweaver-Burk (L-B) analysis. Type 2 diabetic rat models were established with a high-fat diet and intraperitoneal injection of streptozotocin (STZ), and then the rats were randomly divided into control (without induction of diabetes mellitus, given distilled water), model group (given distilled water), positive control group (gavaged with metformin hydrochloride at 100 mg/(kg·d)), and low-, medium- and high-dose BHEs groups (50, 100 and 200 mg/(kg·d), respectively). The administration by gavage once a day last for 28 days. The body weight, fasting blood glucose (FBG), fasting serum insulin (FINS), fasting C-peptide and oral glucose tolerance test (OGTT) were determined during this period. Results: The inhibitory activity of BHEs on α-glucosidase-maltose system was dose dependent with a percentage inhibition of 41.12% at a concentration of 1 mg/mL. The data of enzyme kinetics showed the inhibition was competitive. In the model group, body weight was reducedby 33.1%, FBG was increased up to (17.85 ± 2.25) mmol/L as well as the levels of FINS and C peptide were reduced to 24.80% and 12.77%, respectively (P < 0.05), when compared with the normal control group. Compared with the model group, the BHEs groups showed a significant improvement in body weight loss after 28 days of invention, FBG levels in the medium- and high-dose groups were decreased by 39.4% and 48.2%, respectively, and the area under the curve (AUC) of OGTT was declined by 47.36% and 59.47%, respectively (P < 0.05). Compared with the model group, the middle- and high-dose groups improved the levels of FINS by 32.79% and 34.44% and C-peptide by 7.40% and 13.08%, respectively (P < 0.05). Conclusion: BHEs can improve blood glucose level in a dose-dependent manner in type 2 diabetes induced by STZ as α-glucosidase inhibitors, and simultaneously can repair islet β-cell function.
Key words:buckwheat hull extracts; α-glucosidase; diabetes mellitus type 2; blood glucose; insulin; C-peptide
DOI:10.7506/spkx1002-6630-201705040
中图分类号:TS210.9;TS218
文献标志码:A
文章编号:1002-6630(2017)05-0244-07
引文格式:
李鹏程, 朴春红, 张岚, 等. 荞麦壳黄酮提取物对2型糖尿病大鼠的血糖改善作用及机制[J]. 食品科学, 2017, 38(5): 244-250. DOI:10.7506/spkx1002-6630-201705040. http://www.spkx.net.cn
LI Pengcheng, PIAO Chunhong, ZHANG Lan, et al. Antidiabetic effect and mechanism of flavonoids extracted from bunckwheat hulls in type 2 diabetic rats[J]. Food Science, 2017, 38(5): 244-250. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705040. http://www.spkx.net.cn
收稿日期:2016-07-01
基金项目:吉林省科技厅重大科技攻关项目(20160519013JH);吉林省科技厅青年科研基金项目(20150520133JH);吉林省教育厅科学技术研究项目 (吉教科合字[2016]第239号)
作者简介:李鹏程(1989—),男,硕士研究生,研究方向为谷物食品科学与副产物高值化利用。E-mail:814036032@qq.com
*通信作者:朴春红(1972—),女,教授,博士,研究方向为生物反应器与功能性食品。E-mail:piaochunhong9111@163.com张岚(1980—),女,副教授,博士,研究方向为功能性食品。E-mail:lan4531@163.com