 表示,组间均值比较采用单因素方差分析,P<0.05表示差异显著,用a表示;P<0.01表示差异极显著,用b表示。
表示,组间均值比较采用单因素方差分析,P<0.05表示差异显著,用a表示;P<0.01表示差异极显著,用b表示。
孙玉军 1,2,江昌俊 3,*,任四海 4
(1.安徽科技学院生命科学学院,安徽 凤阳 233100;2.安徽农业大学生命科学学院,安徽 合肥 230036;3.安徽农业大学茶与食品科技学院,茶树生物学与资源利用国家重点实验室,安徽 合肥 230036;4.安徽省农业科学院烟草研究所,安徽 合肥 230031)
摘 要:研究秀珍菇子实体多糖(polysaccharide from the fruiting body of Pleurotus geesteranus,PFP)对D-半乳糖致衰老小鼠的保护作用。通过腹腔注射60 mg/(kg·d)D-半乳糖建立衰老小鼠模型,同时灌胃50、100、200 mg/(kg·d)不同剂量的PFP,42 d后,采用试剂盒测定小鼠肝、脑组织中过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活力和丙二醛(malondialdehyde,MDA)的含量;同时,对小鼠血清谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatas,ALP)活力以及脾脏指数、胸腺指数进行测定;苏木精-伊红染色观察肝、脑组织。结果表明,PFP能拮抗D-半乳糖引起的小鼠衰老,使小鼠肝、脑组织中的CAT、SOD、GSH-Px活力升高,MDA含量降低。与模型组相比,中、高剂量组PFP显著降低小鼠血清的AST、ALP、ALT活力(P<0.05,P<0.01),极显著提高脾脏指数和胸腺指数(P<0.01);组织切片显示PFP对小鼠肝、脑损伤具有保护作用。因此PFP具有良好的抗衰老作用,其机制可能与其提高机体的抗氧化能力、增强机体的免疫功能有关。
关键词:秀珍菇;多糖;D-半乳糖;抗氧化;抗衰老
食用菌是一类可供食用的大型真菌,味道鲜美,营养价值高,深受消费者的喜爱。食用菌多糖是其一种重要的活性成分。目前研究表明,食用菌多糖具有抗氧化 [1]、抗肿瘤 [2]、抗衰老 [3]、抗突变 [4]、提高机体免疫力 [5]等多种生物功能。
秀珍菇(Pleurotus geesteranus)是人们经常食用的一种菌类,属于真菌门、担子菌纲、伞菌目、侧耳科、侧耳属 [6]。目前秀珍菇的研究主要集中在栽培工艺 [7-9],液体发酵 [10-11]等方面,对于其活性物质多糖的提取 [12]、抑瘤活性 [13]、抗氧化活性 [14]等方面也有文献报道,但对于抗衰老方面的研究尚鲜见文献报道。
目前,多糖有酶法提取 [15]、超声提取 [16]、微波提取 [17]、超高压提取 [18]、超临界提取 [19]等多种方法,不同的方法各有其优缺点。闪式提取是近年来发展起来的一种高效的提取方法,其原理是利用高速机械剪切力和超速动态分子的渗滤作用,在室温条件下将植物、食用菌子实体等材料破碎成细微颗粒,具有提取效率高、能耗低等优点,适合多糖等活性物质的有效提取 [20]。本实验采用闪式提取、乙醇沉淀制备秀珍菇子实体多糖(polysaccharide from the fruiting body of Pleurotus geesteranus,PFP),采用小鼠腹腔注射D-半乳糖建立衰老模型,同时灌胃不同剂量的PFP,通过测定小鼠肝、脑组织中过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活力和丙二醛(malondialdehyde,MDA)的含量以及小鼠血清谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatas,ALP)、谷丙转氨酶 (alanine aminotransferase,ALT)活力指标,计算脾脏指数、胸腺指数,并对其肝、脑组织切片进行观察,来探讨秀珍菇多糖的抗氧化和抗衰老功能,为秀珍菇多糖的开发利用提供参考。
1.1 材料、实验动物与试剂
秀珍菇子实体:由安徽科技学院食用菌研究所栽培获得。
昆明种小鼠,雄性,体质量(20±2) g,SPF级,批准号:SCXK(沪)2012-0006,购于上海杰思婕实验动物有限公司。
CAT测试盒、SOD测试盒、GSH-Px测试盒、MDA测试盒、总蛋白测试盒 南京建成生物工程研究所;D-半乳糖、VC 国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JHBE-50T闪式提取器 河南智晶生物科技股份有限公司;V-5000型可见分光光度计 上海元析仪器有限公司;X-22R型冷冻离心机 美国Beckman公司;H-18R型离心机 北京安必升科技发展有限公司;1510型酶标仪 赛默飞世尔科技(中国)有限公司;BS-200型全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;2235型轮转切片机 德国莱卡测量系统设备有限公司; BA410型显微摄影系统 厦门麦克奥迪实业有限公司。
1.3 方法
1.3.1 秀珍菇多糖的制备
秀珍菇子实体经冷冻干燥,粉碎机粉碎,过100 目筛。取300 g粉末,加入8 000 mL 蒸馏水,电子转速8 000 r/min,闪式提取器提取2 min,5 000 r/min离心10 min,上清液旋转蒸发浓缩至适当体积,加入3 倍体积95%乙醇于4 ℃冰箱中沉淀过夜,5 000 r/min离心10 min,沉淀复溶,冷冻干燥得PFP。
经测定PFP的总糖及蛋白含量分别为60.42%、18.91%,与Molish反应呈阳性;易溶于水,不溶于高体积分数的乙醇、丙酮、乙酸乙酯等有机溶剂;与I-KI反应不显示蓝色,因此PFP是一种非淀粉类多糖复合物。
1.3.2 小鼠分组及处理
将60 只小鼠适应性饲养一周,随机分成6 组,每组10 只,分别为:正常对照组、模型对照组、阳性对照组(VC)、PFP低剂量组(PFP-L)、PFP中剂量组(PFP-M)、PFP高剂量组(PFP-H)。除正常对照组外,其他各组腹腔注射D-半乳糖,剂量为60 mg/(kg·d),以体质量计,下同;正常对照组的小鼠注射相同剂量(60 mg/(kg·d))生理盐水;低、中、高剂量组分别以50、100、200 mg/(kg·d)的PFP灌胃,阳性对照组每天灌胃50 mg/(kg·d)的VC,正常对照组及模型对照组则灌胃等体积的生理盐水,持续处理42 d。
1.3.3 小鼠实验样本的采集
第42天给药12 h后,称质量,采用断颈法处死小鼠,采集血样并解剖,分别提取肝脏、脑,脾、胸腺,滤纸吸干、称质量。肝脏、脑组织分成2 份,一份于10%福尔马林中固定,用于组织切片观察;另一份按照器官1∶9(m/V)的比例加入冷生理盐水,剪碎,用玻璃匀浆器冰浴研磨制备10%的组织匀浆,3 800 r/min、4 ℃离心10 min,取上清液,用于组织生化指标测定。血液于4 ℃、3 000 r/min离心10 min,收集血清,用于血清生化指标测定。
1.3.4 生化指标测定
肝、脑组织匀浆的CAT、SOD、GSH-Px活力和MDA含量测定均按照试剂盒说明书的方法进行;脾脏指数、胸腺指数均按组织的质量(mg)与小鼠的体质量(g)的比值来表示;血清中的AST、ALT、ALP活力利用全自动生化分析仪测定。
1.3.5 组织切片观察
从固定液中取出肝、脑组织,梯度乙醇脱水,二甲苯透明,制作石蜡切片,苏木精-伊红染色,中性树胶封片,显微观察。
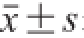
1.4 数据处理
实验数据采用SPSS 18.0软件进行分析,以
 表示,组间均值比较采用单因素方差分析,P<0.05表示差异显著,用a表示;P<0.01表示差异极显著,用b表示。
表示,组间均值比较采用单因素方差分析,P<0.05表示差异显著,用a表示;P<0.01表示差异极显著,用b表示。
2.1 PFP对D-半乳糖致衰老小鼠肝脏CAT、SOD、GSH-Px活力和MDA含量的影响
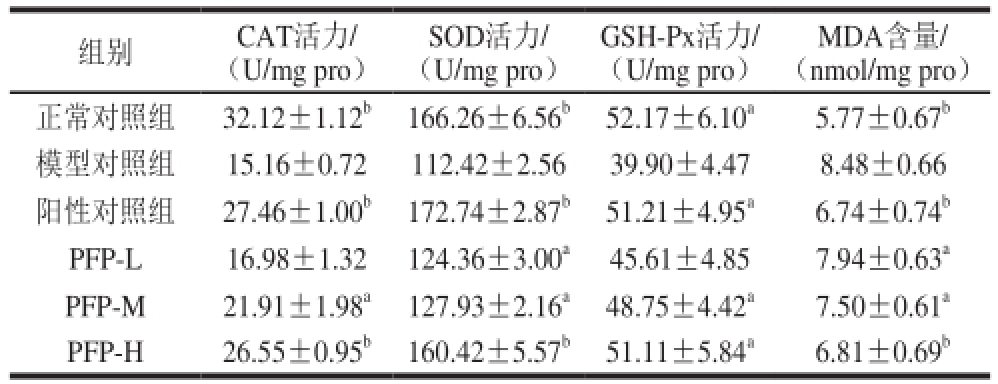
表 1 PFP对D-半乳糖致衰老小鼠肝脏CAT、SOD、GSH-Px活力和MDA含量的影响
Table 1 Effect of PFP on the activities of CAT, SOD and GSH-Px, and the contents of MDA in liver of mice
注:a.与模型对照组比较差异显著( P<0.05);b.与模型对照组比较差异极显著(P<0.01)。下同。
MDA含量/(nmol/mg pro)正常对照组32.12±1.12 b166.26±6.56 b52.17±6.10 a5.77±0.67 b模型对照组15.16±0.72112.42±2.5639.90±4.478.48±0.66阳性对照组27.46±1.00 b172.74±2.87 b51.21±4.95 a6.74±0.74 bPFP-L16.98±1.32124.36±3.00 a45.61±4.857.94±0.63 aPFP-M21.91±1.98 a127.93±2.16 a48.75±4.42 a7.50±0.61 aPFP-H26.55±0.95 b160.42±5.57 b51.11±5.84 a6.81±0.69 b组别CAT活力/(U/mg pro)SOD活力/(U/mg pro)GSH-Px活力/(U/mg pro)
不同处理对小鼠肝脏CAT、SOD、GSH-Px活力和MDA含量的影响见表1。由表1可知,正常对照组小鼠肝脏的CAT、SOD活力极显著高于模型组(P<0.01),GSH-Px活力显著高于模型对照组(P<0.05),而MDA含量极显著低于模型对照组(P<0.01),说明造模成功。多糖低剂量组小鼠肝脏CAT、GSH-Px活力较模型对照组略有升高,但不显著,而SOD活力较模型对照组显著升高、MDA含量较模型对照组显著降低(P<0.05);多糖中剂量组小鼠肝脏CAT、SOD、GSH-Px活力较模型对照组均显著升高(P<0.05),MDA含量显著下降(P<0.05);高剂量组、VC组小鼠肝脏CAT、SOD活力均极显著高于模型对照组(P<0.01),GSH-Px活力显著高于模型对照组(P<0.05),而MDA含量均极显著低于模型对照组(P<0.01)。
2.2 PFP对D-半乳糖致衰老小鼠脑CAT、SOD、GSH-Px活力和MDA含量的影响
表 2 PFP对D-半乳糖致衰老小鼠大脑CAT、SOD、GSH-Px活力和
MDA含量的影响
Table 2 Effect of PFP on the activities of CAT, SOD and GSH-Px and the contents of MDA in brain tissues of mice

MDA含量/(nmol/ mg pro)正常对照组17.38±2.87 b156.48±6.81 b113.41±3.32 b10.88±0.97 b模型对照组11.87±1.32111.51±4.7186.40±2.7019.80±1.69阳性对照组18.54±2.05 b188.86±5.41 b120.62±2.67 b13.33±0.36 bPFP-L13.64±1.97 a130.49±6.36 a88.25±4.0919.07±0.51 PFP-M14.63±1.58 a141.27±6.05 a96.31±3.23 a17.76±0.91 aPFP-H17.60±1.95 b171.80±2.97 b110.73±4.75 b14.01±0.51 b组别CAT活力/(U/mg pro)SOD活力/(U/mg pro)GSH-Px活力/(U/mg pro)
不同处理对小鼠脑CAT、SOD、GSH-Px活力和MDA含量的影响见表2。由表2可知,正常对照组小鼠脑的CAT、SOD、GSH-Px活力极显著高于模型对照组(P<0.01),而MDA含量极显著低于对照模型组(P<0.01),说明造模成功。多糖低剂量组小鼠脑GSH-Px活力较模型对照组略有升高,但不显著,而CAT、SOD活力较模型对照组显著升高(P<0.05),MDA含量较模型对照组略有下降;多糖中剂量组小鼠脑CAT、SOD、GSH-Px活力较模型对照组均显著升高(P<0.05),而MDA含量较对照模型组显著下降(P<0.05);多糖高剂量组、VC组小鼠肝脏CAT、SOD、GSH-Px活力均极显著高于模型对照组(P<0.01),而MDA含量均极显著低于模型对照组(P<0.01)。
2.3 PFP对D-半乳糖致衰老小鼠胸腺指数、脾脏指数的影响
不同处理对小鼠胸腺指数、脾脏指数的影响见表3,正常对照组小鼠胸腺指数、脾脏指数显著高于模型对照组(P<0.05),说明造模成功。多糖低剂量组小鼠胸腺指数、脾脏指数较模型对照组显著升高(P<0.05);多糖中剂量组、高剂量组、VC组小鼠胸腺指数、脾脏指数极显著高于模型对照组(P<0.01)。
表 3 PFP对D-半乳糖致衰老小鼠胸腺指数、脾脏指数的影响
Table 3 Effect of PFP on thymus index and spleen index of mice mg/g
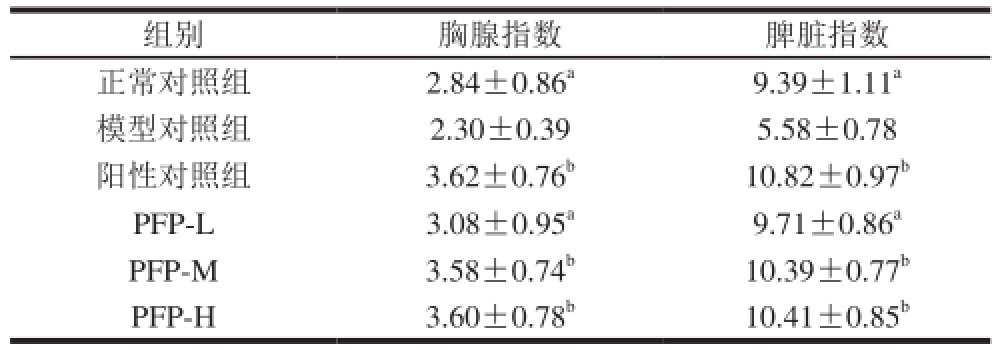
组别胸腺指数脾脏指数正常对照组2.84±0.86 a9.39±1.11 a模型对照组2.30±0.395.58±0.78阳性对照组3.62±0.76 b10.82±0.97 bPFP-L3.08±0.95 a9.71±0.86 aPFP-M3.58±0.74 b10.39±0.77 bPFP-H3.60±0.78 b10.41±0.85 b
2.4 PFP对D-半乳糖致衰老小鼠血清AST、ALP、ALT活力的影响
表 4 PFP对D-半乳糖致衰老小鼠血清AST、ALP、ALT活力的影响
Table 4 Effect of PFP on the activities of AST, ALP and ALT in serum of mice U/L

组别AST活力ALP活力ALT活力正常对照组86.10±8.23 b213.07±12.15 b56.32±3.72 b模型对照组247.10±12.67750.09±28.76157.52±18.05阳性对照组125.44±9.95 a339.13±17.76 b71.28±9.82 bPFP-L185.71±8.59604.23±22.64126.17±13.93 PFP-M143.85±9.36 a446.71±15.67 a89.10±11.21 aPFP-H125.51±8.65 a351.67±25.64 b73.04±7.94 b
不同多糖处理对小鼠血清AST、ALP、ALT活力的影响见表4。正常对照组小鼠血清AST、ALP、ALT活力均极显著低于模型对照组(P<0.01),说明造模成功。多糖低剂量组小鼠血清AST、ALP、ALT活力较模型对照组略有下降,但不显著;多糖中剂量组小鼠血清AST、ALP、ALT活力显著低于模型对照组(P<0.05),多糖高剂量组、VC组小鼠血清AST活力显著低于模型对照组(P<0.05),多糖高剂量组、VC组小鼠血清ALP、ALT活力极显著低于模型对照组(P<0.01)。
2.5 PFP对D-半乳糖致衰老小鼠肝组织的影响
PFP对D-半乳糖致衰老小鼠肝组织的影响如图1所示。正常对照组肝脏组织结构正常,肝细胞相互连接形成肝板,以中央动脉为中心向周围呈辐射状形成肝小叶,肝细胞之间空隙形成肝血窦。衰老模型组肝细胞内炎性细胞较多,偶见炎性细胞聚集,细胞胞核较大,胞浆疏松;VC阳性对照组肝脏组织结构正常,显微镜下肝脏组织结构完整,着色较好,细胞结构较模型对照组清晰。PFP低、中、高剂量组肝脏组织结构正常,着色清晰,肝血窦明显,结构完整,细胞界限明显,胞核胞浆未发现异常,形态结构较好。
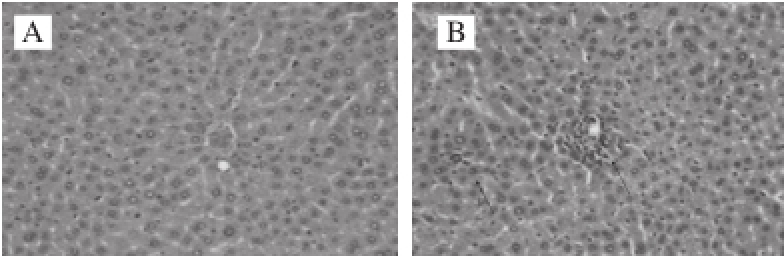
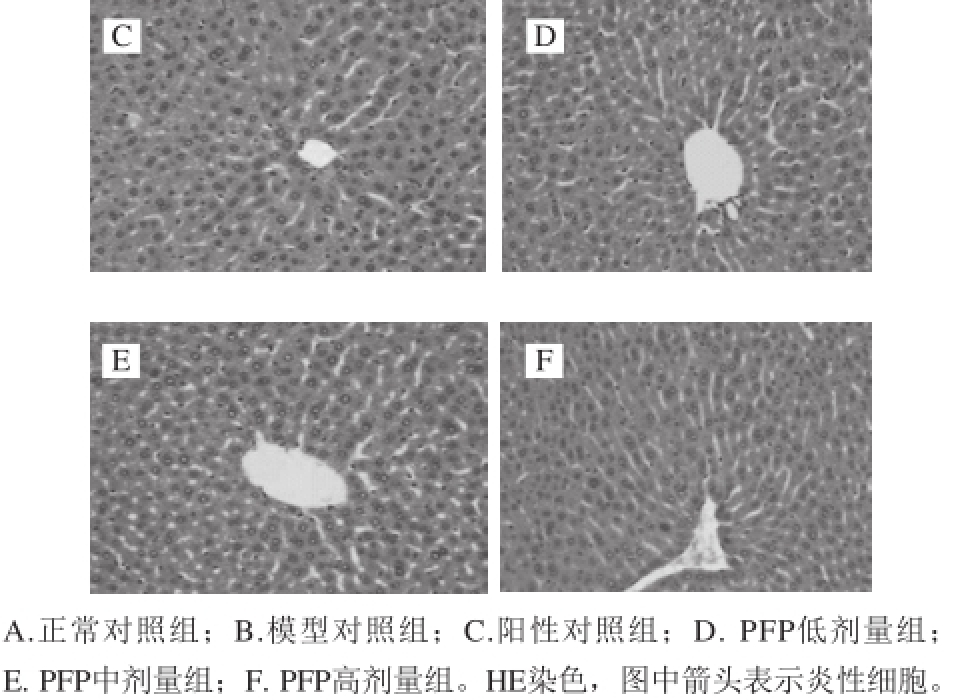
图 1 小鼠肝脏组织切片(×200)
Fig. 1 Observation of liver histological sections (× 200)
2.6 PFP对D-半乳糖致衰老小鼠脑组织的影响
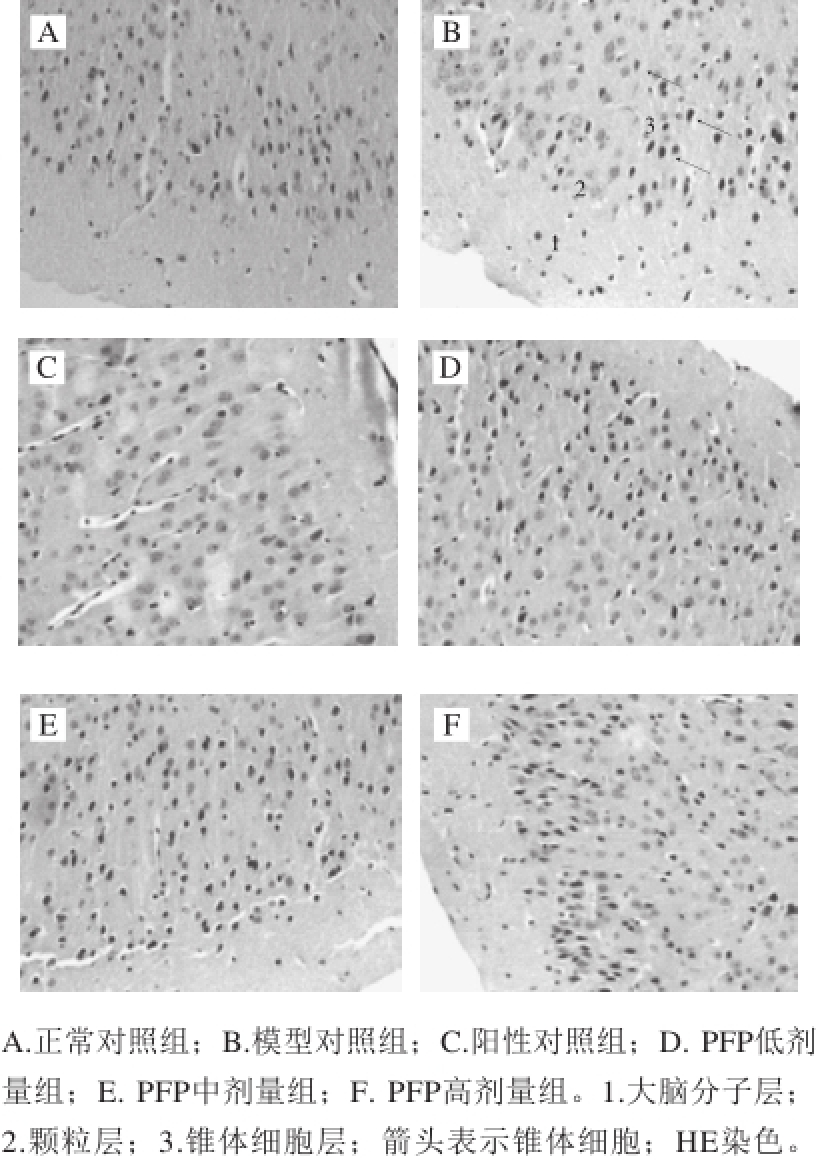
图 2 小鼠脑组织切片(×200)
Fig. 2 Observation of brain histological sections (× 200)
PFP对D-半乳糖致衰老小鼠脑组织的影响如图2所示。正常对照组大脑组织结构正常,大脑皮层分子层、颗粒细胞层、锥体细胞层分层较明显;与正常对照组相比较,衰老模型组分子层较对照组厚,细胞分层不明显,锥体细胞数量较少,散落分布;VC阳性对照组分子层较对照组薄,细胞分层明显,锥体细胞数量较少;PFP低、中、高剂量组大脑分子层明显较薄,细胞分层明显,锥体细胞明显增多,且分子层较VC阳性对照组薄,锥体细胞层内锥体细胞数量明显较多。
长期注射一定剂量的D-半乳糖,在小鼠体内代谢得到大量的半乳糖醇,不能被进一步代谢因而堆积起来,影响细胞正常的渗透压,导致细胞肿胀,代谢紊乱 [21]。同时,D-半乳糖在小鼠体内代谢氧化产生大量的自由基,超过机体正常的清除能力,即氧化与抗氧化的动态平衡被打破,使细胞极易受到自由基的攻击从而引起衰老的发生。D-半乳糖致衰老的过程与机体的自然衰老过程较为相似,因此D-半乳糖诱导氧化应激导致小鼠衰老,已被广泛应用于抗氧剂、抗衰老药物等的筛选 [22-23]。
MDA是机体内的自由基引发脂质过氧化的一种产物,常被作为评价衰老的一种指标 [24]。SOD是体内一种重要的抗氧化酶,能够有效清除超氧阴离子自由基,降低MDA及自由基代谢产物的产生,使细胞免受破坏。本实验中,秀珍菇多糖的低、中、高各剂量组与模型对照组相比,肝脏组织和脑组织中的SOD活力均显著提高(P<0.01,P<0.05),且呈现一定的量效关系,表明秀珍菇多糖清除自由基的能力较强,阻断自由基的链式反应,能够拮抗D-半乳糖致小鼠的衰老。与模型对照组相比,秀珍菇多糖的低剂量组MDA含量稍有下降,中、高剂量组MDA含量下降显著(P<0.01,P<0.05),也呈现一定的量效关系,表明秀珍菇多糖减轻了小鼠机体的脂质过氧化程度,延缓衰老。
·OH是机体内化学性质最活泼的一种活性氧 [25],能够损伤细胞,引起衰老。过氧化氢是产生·OH的前体物质,CAT可以分解H 2O 2,减少·OH的产生,延缓衰老 [26]。GSH-Px也是机体内一种重要的抗氧化酶,它特异性地催化GSH还原过氧化物的反应 [27]。本实验中,与模型对照组相比,秀珍菇多糖中、高剂量组小鼠肝脏和脑组织中的GSH-Px和CAT活力也均显著提高(P<0.01,P<0.05),且活力随着多糖质量浓度的升高而增大。表明秀珍菇多糖能够将活性氧自由基和H 2O 2降解为无毒的H 2O和O 2,同时促使GSH将过氧化物还原,减少过氧化物量的产生,阻断由过氧化物引发的自由基对机体组织造成的伤害,起到一定的抗衰老作用。
血液中ALT和AST活力是肝细胞受损的重要指标之一,肝细胞受损,ALT和AST便释放入血液中,因此可以根据血清中ALT和AST活力的高低来判断肝细胞的损伤程度 [28]。ALT在肝脏中活力最高,AST在心脏中活力最高,其次是肝脏。ALT在肝脏中主要存在于肝细胞质内,AST在肝脏中主要存于肝细胞的线粒体内,当肝细胞受损时,其线粒体膜和细胞膜损伤,血液中ALT和AST活力明显升高。ALP主要来自骨骼的成骨细胞和肝脏,当肝脏受到损伤时,ALP经淋巴道和肝窦进入血液,引起血清ALP的明显升高 [29-30]。本实验中,模型组小鼠血清AST、ALT、ALP活力均比正常对照组明显升高,表明D-半乳糖可致小鼠肝细胞受损,产生明显的肝脏毒性,但灌胃不同剂量的秀珍菇多糖组小鼠血清AST、ALT、ALP活力均有所下降,表明肝脏毒性减轻,且毒性随多糖剂量的升高而逐渐降低。
机体的免疫功能与衰老过程密切相关,细胞免疫功能低下是导致衰老的重要因素之一。胸腺与脾脏是机体两种重要的免疫器官,胸腺指数与脾脏指数数值的高低能够反映机体胸腺和脾脏免疫功能的状况。与正常对照组相比,模型组D-半乳糖可导致小鼠胸腺和脾脏等免疫器官萎缩,胸腺组织和脾脏组织发生病理性改变,胸腺指数和脾脏指数降低。与模型组相比,秀珍菇多糖低、中、高剂量组小鼠的胸腺指数、脾脏指数显著增加(P<0.01,P<0.05),表明PFP能够抑制机体免疫器官的退化、增强机体的免疫能力。
本实验研究结果表明,秀珍菇多糖能够显著提高D-半乳糖致衰老小鼠的肝脏指数和脾脏指数,增强肝、脑组织中的SOD、GSH-Px及CAT活力,降低肝、脑组织中的MDA含量,证明秀珍菇子实体多糖可显著抑制D-半乳糖致衰老小鼠机体组织器官的退化,提高抗氧化酶活性、清除超氧阴离子自由基、清除·OH等活性氧。综上所述,秀珍菇子实体多糖具有延缓衰老作用,其机制可能与其提高机体的抗氧化能力、增强机体的免疫功能有关,研究结果可为进一步开发和利用秀珍菇资源提供参考。
参考文献:
[1] CHATCHAI T, SARANYU K, KHAJEELAK C, et al. Antioxidant properties and cytotoxicity of crude polysaccharides from Lentinus polychrous Lév[J]. Food Chemistry, 2011, 128(3): 634-639. DOI:10.1016/j.foodchem.2011.03.077.
[2] ZHANG Bingzhao, YAN Peisheng, CHEN Hao, et al. Optimization of production conditions for mushroom polysaccharides with high yield andantitumor activity[J]. Carbohydrate Polymers, 2012, 87(4): 2569-2575. DOI:10.1016/j.carbpol.2011.11.042.
[3] 余强, 聂少平, 李文娟, 等. 黑灵芝多糖对D-半乳糖致衰老小鼠的作用研究[J]. 食品科学, 2009, 30(17): 305-307.
[4] 李雪, 金乾坤, 李晓东, 等. 长白山野生食用菌多糖抗突变作用的研究[J]. 食品研究与开发, 2015, 36(14): 139-142. DOI:10.3969/ j.issn.1005-6521.2015.14.034.
[5] HAN Xiaoqiang, CHAI Xingyun, JIA Yamin, et al. Structure elucidation and immunological activity of a novel polysaccharide from the fruit bodies of an edible mushroom, Sarcodon aspratus (Berk.) S. Ito[J]. International Journal of Biological Macromolecules, 2010, 47(3): 420-424. DOI:10.1016/j.ijbiomac.2010.05.021.
[6] 李维焕, 蔡德华, 郑芳, 等. 秀珍菇菌株的亲缘关系分析[J]. 食品科学, 2010, 31(17): 267-271.
[7] 吴登, 郎宁, 陈雪凤, 等. 桑枝屑栽培秀珍菇高产配方试验[J]. 南方农业学报, 2011, 42(3): 308-310. DOI:10.3969/ j.issn.2095-1191.2011.03.019.
[8] 邓玲姣, 彭虹, 梁彩芳, 等. 香蕉茎叶栽培平菇和秀珍菇的比较试验[J]. 中国食用菌, 2011, 30(2): 27-30. DOI:10.13629/ j.cnki.53-1054.2011.02.022.
[9] 马洪艳, 白宝良. 秀珍菇栽培技术[J]. 北方园艺, 2014(13): 140-141.
[10] 张炎灼, 吴俐, 沈恒胜, 等. 富硒秀珍菇液体培养菌丝生长规律的动态分析[J]. 福建农业学报, 2012, 27(4): 400-404. DOI:10.3969/ j.issn.1008-0384.2012.04.016.
[11] 李守勉, 李明, 田景花, 等. 不同碳、氮源营养对秀珍菇菌丝体生长及其胞外酶活性的影响[J]. 北方园艺, 2014(2): 143-145.
[12] 杨润亚, 李维焕, 吕芳芳. 秀珍菇子实体多糖的提取工艺优化及体外抗氧化性[J]. 食品与生物技术学报, 2013, 31(10): 1093-1099. DOI:10.3969/j.issn.1673-1689.2012.10.014.
[13] ZHANG Mei, ZHU Lin, STEVE W C, et al. Fractionation, partial characterization and bioactivity of water-soluble polysaccharides and polysaccharide-protein complexes from Pleurotus geesteranus[J]. International Journal of Biological Macromolecules, 2011, 48(1): 5-12. DOI:10.1016/j.ijbiomac.2010.09.003.
[14] 孙玉军, 江昌俊, 祝嫦巍. 秀珍菇多糖PMP-2a的理化性质及其体外抗氧化活性研究[J]. 现代食品科技, 2014, 30(12): 79-84. DOI:10.13982/j.mfst.1673-9078.2014.12.014.
[15] 付明, 颜素贞, 向萍, 等. 纤维素酶提取藜蒿多糖的工艺优化[J]. 江苏农业科学, 2009(2): 229-231. DOI:10.15889/j .issn.1002-1302.2009.02.011.
[16] 李亚辉, 马艳弘, 黄开红, 等. 芦荟多糖的超声波辅助纤维素酶提取及抗肿瘤活性研究[J]. 中国食品学报, 2015, 15(11): 91-97. DOI:10.16429/j.1009-7848.2015.11.014.
[17] 卫强, 桂芹, 邱镇, 等. 紫荆花中多糖的微波提取工艺优化及其抗氧化活性[J]. 食品科学, 2015, 36(4): 39-44. DOI:10.7506/spkx1002-6630-201504008.
[18] 杜冰, 温升南, 唐健, 等. 超高压提取灵芝孢子粉多糖的工艺研究[J]. 现代食品科技, 2009, 25(4): 420-422. DOI:10.13982/ j.mfst.1673-9078.2009.04.006.
[19] 段丽丽, 句荣辉, 王辉, 等. 响应面法优化超临界提取茯苓多糖工艺研究[J]. 中国农业科技导报, 2016, 18(5): 193-199. DOI:10.13304/ j.nykjdb.2015.714.
[20] 赵宏, 张宇, 柴桂芳, 等. 沙棘多糖的闪式提取工艺条件的优化[J]. 辽宁中医杂志, 2015(2): 364-366. DOI:10.13192/ j.issn.1000-1719.2015.02.057.
[21] WEI Haifeng, LI Lin, SONG Qiujie, et al. Behavioural study of D-galactose induced aging model in C57BL/6J mice[J]. Behavioural Brain Research, 2005, 157(2): 245-251. DOI:10.1016/j.bbr.2004.07.003.
[22] JARVELAINEN H A, FANG C, INGELMAN SUNDBERG-M, et al. Effect of chronic coadministration of endotoxin and ethanolon rat liver pathology and proinf l ammatiry and anti-inf l ammatory cytokines cytokines[J]. Hepatology, 1999, 29: 1503-1510. DOI:10.1002/ hep.510290508.
[23] LIU Jun, LUO Jianguang, YE Hong, et al. In vitro and in vivo antioxidant activity of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Carbohydrate Polymers, 2010, 82(4): 1278-1283. DOI:10.1016/j.carbpol.2010.07.008.
[24] 郭永月, 陶眀煊, 程光宇, 等. 黑牛肝菌多糖对急性酒精肝损伤小鼠的保护作用[J]. 中国食品学报, 2016, 6(1): 35-41.
[25] 吴清华, 翟心慧. 线粒体DNA氧化损伤与肿瘤发生[J]. 中国病理生理杂志, 2007, 23(7): 1446-1450. DOI:10.3321/ j.issn:1000-4718.2007.07.047.
[26] 赵雪, 董诗竹, 孙丽萍, 等. 海带多糖清除氧自由基的活性及机理[J].水产学报, 2011, 35(4): 531-537. DOI:10.3724/SP.J.1231.2011.17159.
[27] 李卫芬, 张小平, 宋文辉, 等. 养殖水体中添加芽孢杆菌对草鱼免疫和抗氧化功能的影响[J]. 中国水产科学, 2012, 19(6): 1027-1033. DOI:10.3724/SP.J.1118.2012.01027.
[28] 刘超群, 陈静, 黄雪松, 等. 大蒜多糖对慢性酒精中毒小鼠肝损伤的保护作用[J]. 吉林大学学报(医学版), 2012, 38(1): 23-27. DOI:10.13481/j.1671-587x.2012.01.010.
[29] 杜永华, 王川, 周黎军, 等. 1,8-桉叶油素亚慢性中毒对小鼠血液生化指标的影响[J]. 西北农林科技大学学报(自然科学版), 2014, 42(2): 29-34. DOI:10.13207/J.CNKI.JNWAFU.2014.02.03.
[30] 王慧文, 孙丰梅, 赵英川, 等. 加丽素红对蛋鸡生产性能、蛋品质及血清生化指标的影响[J]. 中国兽医学报, 2015, 35(12): 2049-2053. DOI:10.16303/j.cnki.1005-4545.2015.12.31.
Protective Effect of Polysaccharides from the Fruiting Body of Pleurotus geesteranus against D-Galactose-Induced Aging Mice
SUN Yujun
1,2, JIANG Changjun
3,*, REN Sihai
4
(1. School of Life Science, Anhui Science and Technology University, Fengyang 233100, China; 2. College of Life Sciences, Anhui Agricultural University, Hefei 230036, China; 3. State Key Laboratory of Tea Plant Biology and Utilization, School of Tea and Food Science and Technology, Anhui Agricultural University, Hefei 230036, China; 4. Tobacco Research Institute, Anhui Academy of Agricultural Sciences, Hefei 230031, China)
Abstract:The anti-aging effect of polysaccharides from the fruiting body of Pleurotus geesteranus (PFP) on a D-galactoseinduced aging mouse model. The aged mouse model was established by the injection of D-galactose. These mice were simultaneously administrated by gavage with PFP at different dosages for 42 days. At 12 h after the last administration, the activities of catalase (CAT), superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px), and the contents of malondialdehyde (MDA) in serum, liver and brain were measured by using commercial reagent kits. The activities of serum aspartate aminotransferase (AST), alkaline phosphatas (ALP) and alanine aminotransferase (ALT), and spleen and thymus indexes were also determined. The liver and brain were taken for histological analysis through HE staining. The results showed that PFP had antagonism effects on D-galactose-induced aging in mice, and could increase the activities of CAT, SOD and GSH-Px and reduce MDA levels in serum, and liver and brain tissues. Compared with the aging model group, the activities of serum AST, ALT, ALP in the medium- and high-dosage PFP group signif i cantly decreased (P < 0.05, P < 0.01) in parallel with a highly signif i cant increase in both spleen index and thymus index (P < 0.01). Histological sections showed that PFP displayed a signif i cant protective effect on liver and brain injury induced by D-galactose. In conclusion, PFP has signif i cant antioxidant and anti-aging effects. The underlying mechanism might be related to improving antioxidant function and enhancing immune function in the body.
DOI:10.7506/spkx1002-6630-201705041
中图分类号:S646.9
文献标志码:A
文章编号:1002-6630(2017)05-0251-06
引文格式:
孙玉军, 江昌俊, 任四海. 秀珍菇多糖对D-半乳糖致衰老小鼠的保护作用[J]. 食品科学, 2017, 38(5): 251-256.
DOI:10.7506/spkx1002-6630-201705041. http://www.spkx.net.cn
SUN Yujun, JIANG Changjun, REN Sihai. Protective effect of polysaccharides from the fruiting body of Pleurotus geesteranus against D-galactose-induced aging mice[J]. Food Science, 2017, 38(5): 251-256. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705041. http://www.spkx.net.cn
收稿日期:2016-06-21
基金项目:安徽省高等学校省级自然科学研究重点项目(KJ2014A052);安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016221);安徽大学现代生物制造协同创新中心2015年开放课题(BM2015004)
作者简介:孙玉军(1975—),男,教授,博士研究生,研究方向为食用菌多糖的功能。E-mail:sunyujun208@163.com
*通信作者:江昌俊(1957—),男,教授,硕士,研究方向为茶与食品生物技术。E-mail:jiangcj@ahau.edu.cn
Key words: Pleurotus geesteranus; polysaccharide; D-galactose; antioxidant; anti-aging