鲫鱼贮藏过程中微生物菌相PCR-DGGE分析及其防腐保鲜
李秀秀,曾维伟,陆兆新,别小妹,赵海珍,张 充,吕凤霞
*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:采用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-amplif i cation and denaturing gradient gel electrophorsis,PCR-DGGE)技术,分析4 ℃冷藏条件下鲫鱼肌肉和鱼鳃的菌相组成及变化,并利用不同浓度(效价分别为67 608、32 359、2 239、1 820、1 157 IU/mL)抗菌脂肽溶液对鲫鱼进行浸泡处理,以未处理作为对照,分别测定其菌落总数、挥发性盐基氮(total volatile basic nitrogen,TVB-N)、pH值和硫代巴比妥酸(thiobarbituric acid,TBA)等指标,评价抗菌脂肽对鲫鱼冷藏保鲜效果。结果表明:鲫鱼贮藏过程中的微生物具有多样性,PCRDGGE技术确定气单胞菌属(Aeromonas sp.)、假单胞菌属(Pseudomonas sp.)、不动杆菌属(Acinetobacter sp.)和热杀索丝菌属(Brochothrix thermosphacta)为鲫鱼鱼肉的主要腐败菌群,荧光假单胞菌是鲫鱼贮藏过程中的优势腐败菌。而棉子糖乳球菌属(Lactococcus raffinolactis)、从毛单胞菌属(Comamonas sp.)和气单胞菌属(Aeromonas sp.)为鲫鱼鱼鳃的主要腐败菌群,表明鱼肉和鱼鳃在贮藏过程中,导致腐败的主要腐败菌群有一定差异性。同时,不同浓度的抗菌脂肽对鲫鱼均有明显的防腐保鲜作用,有效抑制了鲫鱼菌落总数、TVB-N值和TBA值的增加以及pH值的升高。其中,高浓度抗菌脂肽(效价为67 608 IU/mL)在4 ℃贮藏条件下使鲫鱼的货架期延长了6 d,说明抗菌脂肽对鲫鱼具有良好的保鲜作用,能明显延缓鲫鱼的腐败变质。
关键词:鲫鱼;腐败微生物;聚合酶链式反应-变性梯度凝胶电泳技术;抗菌脂肽;保鲜
鲫鱼是我国传统的淡水鱼类,其产量居于各淡水鱼前列。因鲫鱼中营养丰富,含有钙、铁、维生素、核黄素等许多营养成分,而深受大众消费者的喜爱
[1],但鱼肉中蛋白质和水分含量高,且含有多种不饱和脂肪酸及内源酶,使得鲫鱼容易腐败
[2]。水产品的腐败主要受来自自身和环境中的微生物,以及本身的酶和脂肪氧化等因素的影响,其中微生物是造成腐败的主要因素。因此,研究鱼类腐败菌的生长,探究细菌群落动态变化并采取相应的能够有效抑制微生物生长的保鲜方法,对水产品捕捞、加工、贮藏、运输、销售过程中提高水产品品质和延长货架期至关重要
[3]。聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-amplif i cation and denaturing gradient gel electrophorsis,PCR-DGGE)是研究微生物群落组成及亲缘关系的分子指纹技术,可以高效、直接、快速全面地分析微生物组成及群落结构
[4-5]。国内外已有很多研究将该方法有效地用来分析食品中腐败菌
[6-11]。目前DGGE技术在水产品腐败菌群结构分析中的应用研究较多,但在鲫鱼贮藏过程中的腐败菌分析国内鲜见报道。有关鲫鱼贮藏过程中菌群结构的变化情况,各类微生物的生长、腐败特点,如何利用保鲜技术高效、针对性抑制鲫鱼中的微生物生长、延长货架期等,需有待进一步研究。
目前,水产品保鲜技术主要有冷冻保鲜、气调保鲜、化学保鲜及辐照保鲜等,但以上技术存在蛋白质变性、营养成分流失和化学药品残留等问题
[12],因而安全、无毒的生物保鲜技术受到了人们广泛关注。抗菌脂肽(lipopeptide)是指一类由芽孢杆菌(Bacillus sp.)通过非核糖体肽合成酶(non-ribosomal peptide synthetases,NRPSs)合成的具有高效抑菌活性的脂肽类次级代谢产物,其结构中包含一个含有7~10 个氨基酸和1 个短链脂肪酸(C
9~C
13)组成的环型脂肽,具有抗菌性强、抗菌谱广、安全无毒、稳定性好等特性,因而抗菌脂肽作为一种新型、高效、广谱的生物源天然食品防腐剂,在食品加工中具有潜在的应用前景
[13-14]。目前抗菌脂肽已在食品保鲜中广泛应用,如肉制品
[15]、焙烤制品
[16]、果蔬采后保鲜
[17]等。但在淡水鱼产品保鲜方面的应用研究鲜见报道。本实验利用PCR-DGGE技术,研究鲫鱼腐败过程中的菌相变化,确定其在贮藏过程中的主要优势腐败菌,探讨抗菌脂肽对鲫鱼防腐保鲜作用,旨在为抗菌脂肽在水产保鲜中的应用提供依据。
1 材料与方法
1.1 材料与试剂
鲜活鲫鱼(300~400 g)购于南京市玄武区铁匠营苏果超市,产地为江苏省兴化市。
菌种Bacillus amyloliquefaciens ES-2-4,为本实验室保藏。营养肉汤固体培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂18 g、水1 000 mL,pH 7.0;平板菌落计数培养基 北京陆桥生物技术有限公司。
MgO、硼酸、盐酸(均为分析纯)、甲基红、亚甲基蓝 国药集团化学试剂有限公司。
1.2 仪器与设备
5084R高速冷冻离心机 德国Eppendorf公司;高压蒸汽灭菌锅 北京发恩科贸有限公司;PCR扩增仪美国艾尔特公司;隔水式电热恒温培养箱 上海跃进医疗器械厂;Dcode DGGE电泳系统(配有凝胶成像系统)美国伯乐公司;拍击式均质机 法国Interscience公司;3-Star型pH计 美国Orion公司。
1.3 方法
1.3.1 菌落总数的测定
将从超市买的鲜活鲫鱼在最短的时间内运送到实验室,迅速敲头致死,在无菌条件下用无菌剪刀分别取25 g鱼肉样品(含鱼鳞,鱼皮)置于无菌均质袋中,并加入225 mL含0.1%蛋白胨的0.85%的生理盐水中;取10 g鱼鳃置于无菌均质袋中加入90 mL含0.1%蛋白胨的0.85%的生理盐水中,放入均质机中均质2 min。具体操作参照GB 4789.2—2010《食品卫生微生物学检验 菌落总数测定》。
1.3.2 挥发性盐基氮和pH值的测定
挥发性盐基氮(total volatile basic nitrogen,TVB-N)值按照GB/T 5009.44—2003《肉与肉质品卫生标准的分析方法》中半微量定氮法进行测定。
取10 g样品加入100 mL的煮沸冷却后的蒸馏水浸提30 min,过滤后滤液使用经校正剂校正后的3-Star型pH计进行测定。
1.3.3 提取DNA的样品处理
在无菌超净工作台中用无菌剪刀分别剪取鱼肉25 g置于装有50 mL含0.1%蛋白胨的0.85%的生理盐水的无菌均质袋中,鱼鳃10 g置于装有25 mL含0.1%蛋白胨的0.85%的生理盐水的无菌均质袋中,均质2 min。200 目绢布过滤后,加入25 mL生理盐水,滤液1 000 r/min离心10 min,去沉淀,滤液10 000 r/min离心10 min,弃上清液,沉淀加入5 mL无菌双蒸水,10 000 r/min离心10 min,去上清液,沉淀悬浮于1 mL TE buffer 中置于-20 ℃条件下备用。
1.3.4 总DNA的提取
按照Omega公司细菌基因组DNA提取试剂盒的方法操作,提取细菌总DNA,并用2%的琼脂糖凝胶电泳检测提取效果。
1.3.5 PCR扩增
参考陈慧斌等
[18]的方法采用巢式PCR扩增鲫鱼鱼肉和鲫鱼鱼鳃中细菌菌群的16SrDNA V3区。第1轮扩增16 S rDNA,引物为27F和1492R;第2轮扩增V3区,正向引物为5’端带40GC夹子的338F(5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG CAC-3’),反向引物为518R(5’-ATT ACC GCA GCT GCT GG-3’)。本实验所用引物均由生工生物工程(上海)股份有限公司合成。第2轮对细菌的16S rDNA的V3区片段进行PCR扩增。第2轮V3区扩增以第1轮16S rDNA扩增产物稀释100 倍后的产物为模版。两轮均用无菌ddH
2O代替模版作为阴性对照进行扩增。扩增体系为:0.25 μL的Taq DNA聚合酶,10×buffer (Mg
2+Plus) 5 μL,dNTP(各2.5 mmol/L)4 μL,引物各1 μL,模板4 μL,补ddH
2O为34.75 μL。扩增条件扩增条件为94 ℃、5 min;94 ℃、1 min,55 ℃、1 min,72 ℃、2 min,循环30 次;72 ℃ 8 min。PCR产物用1%的琼脂糖凝胶检测。
1.3.6 细菌DGGE分析
鲫鱼鱼肉和鱼鳃中菌群的DGGE分析参照Chen Huibin等
[19]的方法并加以改进。具体方法如下:采用8%的聚丙烯酰胺凝胶,变性梯度为38%~55%(100%的变性剂:尿素42 g+甲酰胺 40 mL/100 mL)。实验在Biorad Dcode DGGE电泳仪上进行,上样量为15 μL,在电泳系统电压65 V,温度60 ℃条件下电泳时间13.5 h。电泳结束后将胶片在SYBR GreenⅠ中染色30 min后取出,在然后在凝胶成像系统上拍照,采用Quantity One软件分析图像。
1.3.7 条带回收及测序
在紫外灯下对各泳道的主要片段进行切割,回收24 条条带,放入1.5 mL离心管中,加入40 μL无菌ddH
2O,捣碎,置于4 ℃条件下过夜溶解。取上述回收DNA溶液2 μL作为模版,以338F(无GC夹子)和518R作为引物,进行PCR扩增。取5 μL PCR产物,琼脂糖电泳检查产量及特异性。剩余PCR产物,采用PCR清洁试剂盒进行纯化。经纯化后的PCR产物连接到PMD19-T载体,转化DH5α感受态细胞,将阳性克隆株由上海生工生物工程(上海)股份有限公司测序。测序后获得的24 个主要细菌16S rDNA基因片段序列,登录NCBI(www. ncbi.nlm.nih.gov/blast/)查询测序结果。
1.3.8 抗菌脂肽在鲫鱼中保鲜应用
1.3.8.1 抗菌脂肽的制备
Bacillus amyloliquefaciens ES-2-4产抗菌脂肽粗提物为芬荠素(fengycins)、表面活性素(surfactins)和伊枯草菌素(iturins)的混合物
[13]。抗菌脂肽制备方法参考文献[20]并作修改:将本实验室保藏的Bacillus amyloliquefaciens ES-2-4接种于试管斜面PAD琼脂培养基上,37 ℃培养箱中培养24 h活化菌种,再将活化后的菌种接种于装有种子培养基BPY培养基的三角瓶中,37 ℃、180 r/min条件下培养24 h制成种子液。种子液以4%浓度接种于Landy发酵培养基中,在33 ℃、180 r/min条件下发酵36 h后取出,9 000 r/min离心15 min除去菌体,用HCl将上清液调节pH值至2,然后轻微搅动或静止于4 ℃条件下12 h,最后9 000 r/min离心10 min收集沉淀,加入60%的乙醇抽提(约每50 mL的发酵液,加入1 mL的60%的乙醇),再用NaOH中和,10 000 r/min离心10 min取上清液,获得抗菌粗提物的浓缩储备液。并以Nisin做标准物,用效价的方法定量其抑菌特性。
1.3.8.2 抗菌脂肽对鲫鱼中腐败菌的最小抑菌浓度抑菌实验
无菌条件下将抗菌脂肽倍比稀释液按稀释度从高到低加入无菌96 孔板的第1~11列,每孔加100 μL,第12孔为阳性对照加入等量的无菌水。随后每孔加入100 μL浓度为10
5~10
6CFU/mL的荧光假单胞菌、气单胞菌、热杀索丝菌和不动杆菌菌液,密封混匀。用酶标仪测试0 h的OD
630
nm值,然后将96 孔板置于37 ℃培养箱中培养24 h后测试24 h的OD
630
nm值。对比0 h的OD
630
nm值和24 h的OD
630
nm值,从而得出该抗菌脂肽的最小抑菌浓度(minimal inhibitory concentration,MIC)。
1.3.8.3 不同浓度抗菌脂肽对鲫鱼的保鲜效果
将一定量的抗菌脂肽ES-2-4溶解在无菌水溶液中,稀释制得效价为67 608、32 359、2 239、1 820、1 157 IU/mL的抗菌脂肽保鲜液。将新鲜鲫鱼敲头致死,去鳞,去头,去内脏,用无菌水冲洗干净后晾干,分为处理组和对照组6 个组。分别在相应效价为67 608、32 359、2 239、1 820、1 157 IU/mL的抗菌脂肽保鲜液浸泡30 min,取出沥干水分,放入到无菌自封袋中置于冰箱中贮藏,控制贮藏温度(4±1) ℃,每隔2 d取样进行菌落总数、TVB-N值、pH值和硫代巴比妥酸(thiobarbituric acid,TBA)指标的测定,TBA测定参考文献[12]方法,结果以丙二醛(malondialdehyde,MDA)计,单位表示为:mg MDA/kg。
2 结果与分析
2.1 鲫鱼贮藏期间的菌落总数及各指标的变化
表 1 鲫鱼在4 ℃贮藏条件下微生物指标及理化指标的变化
Table 1 Changes in microbial and physicochemical properties of crucian carp during storage at 4 ℃

注:同列肩标小写字母不同表示差异显著(P<0.05)。
菌落总数(lg(CFU/g))pHTVB-N值/(mg N/100 g)鱼肉鱼鳃03.81±0.06
a5.85±0.11
a6.23±0.03
a9.42±0.69
a24.25±0.19
b6.86±0.07
b6.08±0.01
b10.56±0.72
a45.25±0.17
c7.91±0.11
c6.33±0.03
c15.35±1.66
b66.38±0.15
d8.14±0.13
d6.40±0.12
d18.87±1.30
c86.72±0.03
f8.49±0.10
e7.27±0.09
f21.37±0.11
f贮藏时间/d
由表1可以看出,鲫鱼贮藏期间鱼鳃中初始菌相菌落总数为(5.85±0.11)(lg(CFU/g)),远远大于鱼肉中的菌落总数(3.81±0.06)(lg(CFU/g))。鱼肉在第6天菌落总数为(6.38±0.15)(lg(CFU/g)),已经超过国家标准中规定的菌落总数6(lg(CFU/g)),而鱼鳃中的菌落总数在第2天就已经达到(6.86±0.07)(lg(CFU/g));鲫鱼的初始pH值为6.23±0.03,由于糖酵解的作用产生乳酸有一个下降的过程,之后由于蛋白质的分解pH值又有一个上升的过程,腐败终点pH值达到6.40±0.12,而腐败后期达到7.27±0.09;TVB-N是多肽和氨基酸在微生物作用下的分解产物,通常可以作为鱼类初期腐败的指标。鲫鱼的TVB-N的初始值为(9.42±0.69) mg N/100 g,随着贮藏时间的延长,TVB-N值不断增加,当腐败终点时TVB-N值达到(18.87±1.30) mg N/100 g,腐败后期达到(21.37±0.11) mg N/100 g。
2.2 鲫鱼贮藏过程中优势菌的分析

图 1 鲫鱼在4 ℃条件下贮藏细菌的DGGE图谱
Fig. 1 DGGE fi ngerprinting of PCR products of DNA extracted from crucian carp stored at 4 ℃
DGGE分析结果如图1所示。DGGE图谱上不同条带代表不同的微生物种类,条带亮度大小代表微生物数量的多少,越亮则代表微生物数量越多
[21]。由图1可以看出,鱼肉和鱼鳃在贮藏过程中条带存在一定的差异。将不同条带割胶回收收后的测序结果见表2。
表 2 DGGE目标条带基因片段序列的比对分析
Table 2 Sequence analysis of selected bands in DGGE

编号菌株登录号相似度/% 1 Lactococcus sp. TSB94 JQ864364.1100 2 Cetobacterium sp.AB353124.199 3Lactococcus raff i nolactis strain PT120KT124565.1100 4 Comamonas sp.NR11359799 5 Vagococcus sp. SVI6JN029833.199 6Brochothrix thermosphacta strain KSN1 KC346293.199 7Acinetobacter sp. GV-GYC-8KR704447.198 8 Aeromonas sp. FPW150KT728000.1100 9Brochothrix thermosphacta strain B13 KT767854.1100 10Aeromonas sp. RW175KT216589.199 11Acinetobacter sp. KUT-26KT025238.199 12Enterobacter sp. AMAAS2JN391530.199 13Aeromonas sp. UIWRF0300KR189998.199 14Pseudomonas sp. WD11LC034144.199 15Pseudomonas sp.LB184FR675976.196 16Psychrobacter pulmonis strain WD817KR856350.199 17Aeromonas veronii strain WX153415KT964297.199 18Pseudomonas f l uorescensAB680296.199 19Psychrobacter pulmonis strain WD817KR856350.199 20Citrobacter freundii strain: JCM 24064AB548829.192 21Shewanella sp.KJ922527.199 22Shewanella sp. XH10KJ922527.199 23Clostridium sartagoforme strain BG-C95 FJ384380.199 24Pseudomonas sp. 2-2KJ936911.199
由图1可知,鲫鱼鱼肉初始菌相条带较多且没有较亮的条带,说明微生物具有较高的多样性。贮藏2 d时,微生物菌群发生变化,条带3、4、5变亮,分别属于棉子糖乳球菌属(Lactococcus raffinolactis)、从毛单胞菌属(Comamonas sp.)和漫球菌属(Vagococcus sp.)。随着时间的延长,贮藏6 d即腐败终点时条带3、4、5消失,可能是其他菌的代谢产物及环境的不适应抑制了这些菌的生长。但腐败后期第8天条带3、4、5又出现较暗的条带,可能是腐败终点未被完全抑制住,腐败后期又重新获得生长,使菌群比例发生改变的结果。条带6、11、13、15、18、22均是在贮藏中期和腐败终点时出现,分别属于热杀索丝菌属(Brochothrix thermosphacta)、不动杆菌属(Acinetobacter sp.)、气单胞菌属(Aeromonas sp.)、假单胞菌属(Pseudomonas sp.)、希瓦氏菌属(Shewanella sp.),且条带18、6、10、11条带明显的亮于其他条带,尤其条带18为最亮条带,表明它的主导优势地位,这与Gram等
[22]关于特定腐败菌(specific spoilage organism,SSO)理论相符:特定腐败菌在产品贮藏初期数量很少,仅占微生物群落的很少部分,但在产品腐败过程中逐渐占据主导地位。而条带10气单胞菌属(Aeromonas sp.)从贮藏初期至腐败后期都存在,说明它也是鲫鱼腐败时的主要腐败菌之一。因此,确定假单胞菌属、热杀索丝菌属、气单胞菌属和不动杆菌属为4 ℃贮藏鲫鱼鱼肉的主要腐败菌群,荧光假单胞菌是鲫鱼贮藏过程中的优势腐败菌。
鱼鳃DGGE图谱与鱼肉DGGE图谱并不完全相同。鱼鳃贮藏初始时就有5、12、16条亮的条带,分别属于漫球菌属 (Vagococcus sp.)、肠杆菌属(Enterobacter sp.)和嗜冷杆菌属(Psychrobacter pulmonis)。贮藏2 d条带6、10、11、14、18变成亮带,条带5、12、16均消失,说明微生物菌群发生变化,漫游球菌属和大肠杆菌属和嗜冷杆菌属细菌生长逐渐受到抑制。随着时间的延长,贮藏中期、腐败终点和腐败后期时即贮藏4、6 d和8 d时,条带3、4、8、10、24处于较亮的状态,分别代表棉子糖乳球菌属(Lactococcus raffinolactis)、从毛单胞菌属(Comamonas sp.)、气单胞菌属、假单胞菌属,其中3、4、10为最亮条带,确定棉子糖乳球菌、从毛单胞菌属、气单胞菌属为4℃贮藏鱼鳃的优势腐败菌。腐败后期条带14、18又出现,可能是腐败后期那些没完全被抑制住的菌种又重新获得生长空间,使菌群的比例发生了改变而导致,说明假单胞菌属亦是鱼鳃腐败菌的一部分,但在数量上不占主导。
表 3 鲫鱼鱼肉和鱼鳃4 ℃贮藏过程中细菌多样性的相似性
Table 3 Similarity of bacterial diversity between fl esh and grill of crucian carp

注:编号与图1编号对应。
编号0A2A4A6A8A0B2B4B6B8B 0A100.047.317.332.035.313.124.531.715.321.5 2A47.3100.030.632.931.213.228.522.429.044.4 4A17.330.6100.061.142.131.076.320.017.031.1 6A32.032.961.1100.042.624.658.326.921.236.9 8A35.331.242.142.6100.033.048.68.912.418.2 0B13.113.231.024.633.0100.027.310.914.912.7 2B24.528.576.358.348.627.3100.020.418.331.3 4B31.722.420.026.98.910.920.4100.054.259.1 6B15.329.017.021.212.414.918.354.2100.077.7 8B21.544.431.136.918.212.731.359.177.7100.0
根据DGGE图谱中每个样品不同条带的强度及迁移率,对每个样品的条带图谱进行细菌群落多样性分析。由表3可知,鲫鱼鱼肉和鱼鳃在不同贮藏时期相似性不大。鲫鱼鱼肉在贮藏中期即第4天和腐败终点即第6天相似性最高,为61.1%;而鲫鱼鱼鳃在腐败终点第6天与腐败后期第8天相似性最高77.7%。鲫鱼鱼肉和鱼鳃在初始和腐败终点时的相似性均不高分别为13.1%和21.2%,这可能是因为鱼鳃与外界环境接触比较多,反映的主要是水环境中的微生物群落。
2.3 抗菌脂肽对鲫鱼腐败菌的抑菌效果
结合DGGE技术的实验结果有选择性地分离出鲫鱼的优势腐败菌荧光假单胞菌、热杀索丝菌、气单胞菌和不动杆菌,并用于抗菌脂肽MIC测定,结果如表4所示。
表 4 抗菌脂肽对鲫鱼腐败菌的MIC
Table 4 MIC of antimicrobial lipopeptide for inhibition of spoilage bacteria in crucian carp
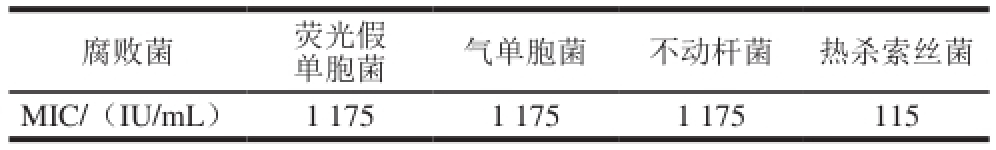
腐败菌荧光假单胞菌气单胞菌不动杆菌热杀索丝菌MIC/(IU/mL)1 1751 1751 175115
由表4可见,抗菌脂肽对鲫鱼中的优势腐败菌均有抑制作用,其中对热杀索丝菌的MIC最小为115 IU/mL,对荧光假单胞菌、不动杆菌和气单胞菌的MIC均为1 175 IU/mL。
2.4 抗菌脂肽的防腐保鲜效果
表 5 4 ℃贮藏条件下不同处理鲫鱼中微生物数量变化
Table 5 Changes in microbial counts of crucian carp during storage at 4 ℃

注:同列肩标小写字母不同表示差异显著(P<0.05);同行肩标大写字母不同表示差异显著(P<0.05)。
微生物数量(lg(CFU/g))0 d2 d4 d6 d8 d对照5.23±0.04
aE6.72±0.11
aD7.62±0.10
aC8.57±0.05
aB8.70±0.08
aA1 1574.76±0.47
bE5.83±0.10
bD6.64±0.12
bC7.95±0.04
bB8.32±0.11
bA1 8204.95±0.13
cE5.69±0.03
cD6.49±0.03
cC7.84±0.09
cB8.07±0.09
cA2 2394.57±0.04
dE5.51±0.02
dD6.10±0.11
dC7.42±0.18
dB7.87±0.12
dA32 3594.01±0.02
dE4.64±0.10
eD5.84±0.03
eC6.67±0.22
eB7.57±0.19
eA67 6083.72±0.19
eD4.33±0.07
fC5.49±0.10
fB5.65±0.58
fB7.39±0.08
fA抗菌脂肽效价/(IU/mL)
从表5可知,效价为67 608、32 359、2 239、1 820、1 157 IU/mL的抗菌脂肽对鲫鱼均有很好的保鲜效果,且随着效价的增大,其抑菌效果是逐渐增加的。未加抗菌脂肽对照组鲫鱼在第2天菌落总数达到6.72 (lg(CFU/g)),已超过国家标准中规定的菌落总数6 (lg(CFU/g)),而添加了抗菌脂肽的处理组在第2天菌落总数均未超过国家标准中规定的菌落总数6 (lg(CFU/g))。在第4天除效价为67 608 IU/mL和32 359 IU/mL的处理组外,其他组均超过国家标准中规定的菌落总数6 (lg(CFU/g))。而效价为67 608 IU/mL的处理组在第8天菌落总数才超过国家标准中规定的菌落总数6 (lg(CFU/g))。
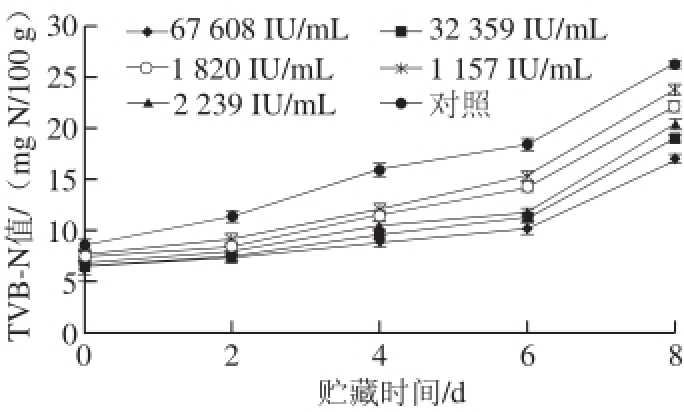
图 2 4 ℃贮藏条件下不同防腐处理鲫鱼TVB-N值的变化
Fig. 2 Changes in TVB-N of crucian carp during storage at 4 ℃
由图2可知,抗菌脂肽对鲫鱼T V B-N值的增长有很好的抑制作用。对照组初始值为(10.04±0.71) mg N/100 g,而其他处理组初始值均在7 mg N/100 g左右。随着时间的延长,对照组的TVB-N的值始终高于处理组。贮藏8 d后,对照组TVB-N值最高达到(26.25±0.82) mg N/100 g,而效价为67 608 IU/mL和32 359 IU/mL的抗菌脂肽处理组的TVB-N值增长的最缓慢,仅为(17.04±0.35)、(18.97±0.52) mg N/100 g。但各处理组TVB-N值在腐败终点时始终未超过25 mg N/100 g。

图 3 4 ℃贮藏条件下不同防腐处理鲫鱼pH值的变化
Fig. 3 Changes in pH of crucian carp during storage at 4 ℃
由图3可知,无论是对照组还是抗菌脂肽处理组鲫鱼pH值均呈现出先下降后上升的趋势,对照组与处理组初始值几乎无差异均在6.3左右;4 ℃条件下贮藏2 d后,各组pH值迅速下降,随着时间的延长pH值开始上升,但最终pH值都未超过7。其中无论是对照组还是处理组均是在第4天迅速上升,之后便缓慢上升。腐败终点时,对照组和处理组的pH值均在在6.3~6.5左右,但各处理组pH值始终低于对照组pH值。

图 4 4 ℃贮藏条件下不同防腐处理鲫鱼TBA值的变化
Fig. 4 Changes in TBA value of crucian carp during storage at 4 ℃
由图4可知,抗菌脂肽各处理组均能有效地降低鲫鱼的TBA值。各组初始TBA值差异不大,均在0.1~0.2 mg MDA/kg左右,但是随着时间的延长,对照组TBA值增长速度显著大于各保鲜组。贮藏8 d后,对照组鲫鱼TBA值为(1.718±0.034) mg MDA/kg。而效价为1 157 IU/mL抗菌脂肽处理组的TBA值为(1.597±0.044) mg MDA/kg,与对照组相差不大,效价为67 608 IU/mL的抗菌脂肽处理组TBA值为(0.839±0.016) mg MDA/kg,显著低于对照组(P<0.05)。
3 讨 论
应用PCR-DGGE分析水产品在贮藏过程中微生物的组成及变化有许多报道。王建辉等
[23]通过PCR-DGGE技术研究冷藏过程中草鱼肌肉的细菌群落结构分析中,发现假单胞菌属和热杀索丝菌属是其冷藏过程中的优势菌属。许振伟等
[24]也发现有氧冷藏鲤鱼腐败终点的腐败菌为假单胞菌属和希瓦氏菌属,蓝蔚青等
[25]也采用PCRDGGE技术发现假单胞菌属和希瓦氏菌属为冷藏带鱼贮藏后期的优势腐败菌。由此可见,大多数水产品中,假单胞菌属、热杀索丝菌属和希瓦氏菌属等腐败菌占绝对优势。
本研究运用PCR-DGGE技术分析冷藏鲫鱼贮藏期间的菌相组成及变化,微生物菌群结构随鲫鱼贮藏时间而变化,贮藏2 d 鲫鱼各部位的细菌种类呈现多样性;贮藏4、6 d后鱼体各部位的细菌的种类明显减少,而优势菌群明显。通过DGGE图谱中对主要条带的测序和GenBank数据库比对结果,确定假单胞菌属、热杀索丝菌属、不动杆菌属、气单胞菌属为鲫鱼鱼肉的主要腐败菌群,荧光假单胞菌是鲫鱼贮藏过程中的优势腐败菌。而棉子糖乳球菌属、从毛单胞菌属、气单胞菌属为鲫鱼鱼鳃的主要腐败菌群,表明鱼肉和鱼鳃在贮藏过程中,导致腐败的主要腐败菌群有一定差异性。高祥英
[26]采用传统方法分离鲫鱼中的腐败菌发现腐败终点的优势腐败菌为希瓦氏菌属和假单胞菌属,本研究在后期也检测到了希瓦氏菌属,但是条带相对于假单胞菌属、热杀索丝菌属、不动杆菌属、气单胞属的条带较暗。这可能是因为不同地区的淡水鱼细菌含量及种类存在差异,其菌相受到影响所致。研究结果说明PCR-DGGE技术能有效地应用于冷藏鲫鱼中微生物的研究,直观地反映冷藏鲫鱼贮藏期间主要微生物群落及其菌相的动态变化过程。
同时,采用传统培养技术与16S rDNA基因鉴定技术相结合的方法,对冷藏鲫鱼在贮藏不同阶段的微生物进行分离、纯化和鉴定,确定冷藏鲫鱼的主要腐败菌群为假单胞菌属、热杀索丝菌属、不动杆菌属、气单胞菌属。因此,可以通过靶向抑制这些特定腐败菌的生长来控制鲫鱼腐败变质。首先,通过抗菌脂肽对鲫鱼防腐保鲜效果研究中,发现抗菌脂肽对鲫鱼中的腐败菌荧光假单胞菌、热杀索丝菌、不动杆菌、气单胞菌的最小抑菌浓度分别为1 175、115、1 175、1 175 IU/mL。其次,不同浓度的抗菌脂肽对鲫鱼均有明显的防腐保鲜作用,有效抑制了鲫鱼菌落总数、TVB-N值的增长、pH值的升高以及TBA值的增长。其中,效价为67 608 IU/mL的抗菌脂肽在4 ℃贮藏条件下,使鲫鱼的货架期延长了6 d,说明抗菌脂肽对鲫鱼具有良好的保鲜作用,明显延缓鲫鱼的腐败变质。而目前乳酸链球菌素Nisin作为一种高效、无毒、安全和营养的生物保鲜剂,已被许多国家和地区广泛应用于水产品保鲜中
[27-28]。Nisin能够有效抑制革兰氏阳性菌,但对革兰氏阴性菌的抑制效果并不好,且在中性和碱性条件下对热不稳定。从已有的报道來看,Nisin主要用来抑制水产品中单增李斯特菌的生长,一般与其他保鲜剂复合使用来增强抑菌作用
[29-30]。与化学防腐剂和生物防腐剂Nisin相比,特别是一些发达国家在某些食品中禁止使用苯甲酸钠等化学防腐剂的现状而言,抗菌脂肽能有效抑制革兰氏阳性菌和革兰氏阴性菌,抗菌谱广、抗菌性强,特别是其本身为氨基酸组成的肽链,安全性高,王东
[31]发现纳豆抗菌脂肽对凡纳滨对虾具有良好的保鲜作用,不仅可以明显抑制细菌的增长还能降低TVB-N值和pH值的增加,与本研究结果类似。因而抗菌脂肽作为新型绿色生物防腐剂在水产品保鲜中具有潜在的应用前景。
参考文献:
[1] 马卫平, 吕秀霞, 刘建元, 等. 鲫鱼的营养保健功能[J]. 肉品卫生, 1999(6): 30.
[2] DUAN J Y, JIANG Y Y, CHERIAN G, et al. Effect of combined chitosan-krill oil coating and modified atmosphere packaging on the storability of cold-stored lingcod (Ophiodon elongates) fillets[J]. Food Chemistry, 2010, 122(4): 1035-1042. DOI:10.1016/ j.foodchem.2010.03.065.
[3] 涂宗财, 马达, 王辉, 等. PCR-DGGE技术分析不同包装条件下鱼肉表面优势菌的菌群变化[J]. 食品科学, 2014, 35(20): 143-147. DOI:10.7506/spkx1002-6630-201420029.
[4] PENNACCHIA C, ERCOLINI D, VILLANI F. Spoilage-related microbiota associated with chilled beef stored in air or vacuum pack[J]. Food Microbiology, 2011, 28(1): 84-93. DOI:10.1016/ j.fm.2010.08.010.
[5] DING Xiaofei, WU Chongde, HUANG Jun, et al. Eubacterial and archaeal community characteristics in the man-made pit mud revealed by combined PCR-DGGE and FISH analyses[J]. Food Research International, 2014, 62: 1047-1053. DOI:10.1016/j.foofres.2014.05.045.
[6] 施荷, 胡铁军, 秦凤贤, 等. 真空包装冷却鹿肉贮藏过程中的菌相变化[J]. 肉类研究, 2015, 29(4): 15-19. DOI:10.7506/rlyj1001-8123-201504004.
[7] 赵飞, 肖莉莉, 张昭寰, 等. 基于PMA-PCR-DGGE对检测生鲜南美白对虾在贮藏过程中微生物多样性方法的优化[C]//中国食品科学技术学会第十二届年会暨第八届中美食品业高层论坛, 大连, 2015: 251-252.
[8] TU R J, WU H Y, LOCK Y S, et al. Evaluation of microbial dynamics during the ripening of a traditional Taiwanese naturally fermented ham[J]. Food Microbiology, 2010, 27(4): 460-467. DOI:10.1016/ j.fm.2009.12.011.
[9] SIDIRA M, GALANIS A, NIKOLAOU A, et al. Evaluation of Lactobacillus casei ATCC 393 protective effect against spoilage of probiotic dry-fermented sausages[J]. Food Control, 2014, 42: 315-320. DOI:10.1016/j.foodcont.2014.02.024.
[10] WANG Jingjing, LIN Ting, LI Jibing, et al. Effect of acidic electrolyzed water ice on quality of shrimp in dark condition[J]. Food Control, 2014, 35(1): 207-212. DOI:10.1016/j.foodcont2013.07.005.
[11] DELGADO S, RACHID C, FERNANDEZ E, et al. Diversity of thermophilic bacteria in raw, pasteurized and selectively-cultured milk, as assessed by culturing, PCR-DGGE and pyrosequencing[J]. Food Microbiology, 2013, 36(1): 103-111. DOI:10.1016/j.fm.2013.04.01.
[12] 张玲, 马月, 罗永康, 等. 鲢鱼皮改性明胶复合多肽锌对草鱼的保鲜作用[J]. 食品科学, 2016, 37(14): 231-236. DOI:10.7506/spkx1002-6630-201614042.
[13] 孙力军. 植物内生菌Bacillus amyloliquefaciens ES-2的分离筛选及其抗菌物质的研究[D]. 南京: 南京农业大学, 2006: 2-17.
[14] 方传记. Bacillus amyloliquefaciens ES-2-4产抗菌脂肽发酵工艺的优化及产物的分离[D]. 南京: 南京农业大学, 2007: 1-11. DOI:10.7666/ d.Y1215635.
[15] 章栋梁. Surfactin工业分离纯化工艺及其对肉品的防腐保鲜效果[D].南京: 南京农业大学, 2013: 75-89. DOI:10.7666/d.Y2527169.
[16] 汪水呈, 曾维伟, 陆兆新. Surfactin抑菌稳定性及其在米饭和面包中的应用[J]. 食品工业科技, 2016, 37(13): 257-261. DOI:10.13386/ j.issn1002-0306.2016.13.044.
[17] 张丽, 郁志芳, 姜丽, 等. 淀粉液化芽孢杆菌ES-2发酵产物对贮藏期间“湖锦蜜露”水蜜桃品质和生理特性的影响[J]. 食品科学, 2009, 30(20): 421-425.
[18] 陈慧斌, 孙钧政, 王梅英, 等. 基于16S rDNA-DGGE技术的真空包装鲢鱼片腐败菌群研究[J]. 西北农林科技大学学报(自然科学版), 2015, 43(4): 157-162.
[19] CHEN Huibin, LIU Zhiyu, WANG Meiying, et al. Characterisation of the spoilage bacterial microbiota in oyster gills during storage at different temperatures[J]. Journal of the Science of Food and Agriculture, 2013, 93(15): 3748-3754. DOI:10.1002/jsfa.6237.
[20] 赵君峰. 淀粉液化芽孢杆菌ES-2-4基因组改组提高脂肽产量及其突变菌株差异蛋白组学分析[D]. 南京: 南京农业大学, 2012: 34-37. DOI:10.7666/d.Y2360432.
[21] 孙彦雨, 周光宏, 徐幸莲. 冰鲜鸡肉贮藏过程中微生物菌相变化分析[J]. 食品科学, 2011, 32(11): 146-151.
[22] GRAM L, DALGAARD P. Fish spoilage bacteria-problems and solutions[J]. Current Opinion in Biotechnology, 2002, 13(3): 262-266. DOI:10.1016/S0958-1669(02)00309-9.
[23] 王建辉, 杨晶, 刘永乐, 等. 基于PCR-DGGE技术对冷藏过程中草鱼肌肉的细菌群落结构分析[J]. 中国食品学报, 2014, 14(10): 216-223. [24] 许振伟, 李学英, 杨宪时, 等. 冷藏鲤鱼和罗非鱼优势腐败菌腐败能力分析[J]. 食品科学, 2012, 33(4): 243-246.
[25] 蓝蔚青, 谢晶. 冷藏带鱼贮藏期间主要微生物动态变化的PCRDGGE分析[J]. 食品工业科技, 2012, 33(17): 118-122.
[26] 高祥英. 淡水鱼中耐冷菌菌群分析与特征腐败菌生物学特性研究[D].扬州: 扬州大学, 2015: 17-42.
[27] MIRHOSSEINI M, AFZALI M. Investigation into the antibacterial behavior of suspensions of magnesium oxide nanoparticles in combination with nisin and heat against Escherichia coli and Staphylococcus aureus in milk[J]. Food Control, 2016, 68: 208-215. DOI:10.1016/j.foodcont.2016.03.048.
[28] HUI Guohua, LIU Wei, FENG Hailin, et al. Effects of chitosan combined with nisin treatment on storage quality of large yellow croaker (Pseudosciaena crocea)[J]. Food Chemistry, 2016, 203: 276-282. DOI:10.1016/j.foodchem.2016.01.122.
[29] 张璟晶, 唐劲松, 王海波, 等. 溶菌酶、Nisin、壳聚糖复合保鲜剂对冰鲜银鲳保鲜效果的研究[J]. 食品工业科技, 2014, 35(4): 323-326.
[30] CHEN Chen, HU Wenzhong, ZHANG Ruidong, et al. Levels of phenolic compounds, antioxidant capacity, and microbial counts of fresh-cut onions after treatment with a combination of nisin and citric acid[J]. Horticulture Environment and Biotechnology, 2016, 57(3): 266-273. DOI:10.1007/s13580-016-0032-x.
[31] 王东. 纳豆菌抗菌脂肽固态发酵工艺优化及其在对虾保鲜上的应用[D]. 湛江: 广东海洋大学, 2012: 29-34.
PCR-DGGE Analysis of Microbial Community Composition and Preservation of Crucian Carp during Storage
LI Xiuxiu, ZENG Weiwei, LU Zhaoxin, BIE Xiaomei, ZHAO Haizhen, ZHANG Chong, LÜ Fengxia
*
(College of Food and Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:The microbial community structure of crucian carp was studied by polymerase chain reaction-amplification and denaturing gradient gel electrophorsis (PCR-DGGE) during storage at 4 ℃. Meanwhile, in order to use it for the preservation of crucian carp, the antimicrobial effect of antimicrobial lipopeptide was evaluated through the determination of total bacterial counts, total volatile basic nitrogen (TVB-N), pH and thiobarbituric acid (TBA). The results showed that the microbial community of crucian carp was diverse during storage. Specif i cally, Aeromonas sp., Pseudomonas sp., Acinetobacter sp. and Brochothrix thermosphacta were the main spoilage microorganisms, and Pseudomonas fluorescens was the dominant spoilage microorganism in the flesh of the fish, while Lactococcus raffinolactis, Comamonas sp. and Aeromonas sp. were the main spoilage microorganisms in the gill. These results also indicated that although the microbial community compositions in the flesh and gill of crucian carp were different, but they showed a similar trend during storage. On the other hand, the antimicrobial lipopeptide at different concentrations signif i cantly inhibited the increase of total bacterial counts, TVB-N, pH and TBA. The lipopeptide at a concentration of 67 608 IU/mL extended the shelf-life of crucian carp by up to 6 days during storage at 4 ℃. All these fi ndings demonstrated that the antimicrobial lipopeptide can signif i cantly inhibit the growth of spoilage microorganisms in crucian carp, thus being a promising preservative.
Key words:crucian carp; spoilage bacteria; polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE); antimicrobial lipopeptide; preservation
DOI:10.7506/spkx1002-6630-201705045
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)05-0274-07
引文格式:
引文格式:
李秀秀, 曾维伟, 陆兆新, 等. 鲫鱼贮藏过程中微生物菌相PCR-DGGE分析及其防腐保鲜[J]. 食品科学, 2017, 38(5): 274-280. DOI:10.7506/spkx1002-6630-201705045. http://www.spkx.net.cn
LI Xiuxiu, ZENG Weiwei, LU Zhaoxin, et al. PCR-DGGE analysis of microbial community composition and preservation of crucian carp during storage[J]. Food Science, 2017, 38(5): 274-280. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201705045. http://www.spkx.net.cn
收稿日期:2016-08-12
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B04)
作者简介:李秀秀(1992—),女,硕士研究生,研究方向为食品微生物。E-mail:2014108044@njau.edu.cn
*通信作者:吕凤霞(1963—),女,教授,博士,研究方向为食品微生物与生物技术。E-mail:lufengxia@njau.edu.cn







