董 佳 1,胡嘉杰 1,王 庆 2,牛继国 2,刘静明 3,田月月 1,王增利 1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.龙腾祥元(北京)科技发展有限公司,北京 100163;3.北京二商集团,北京 100053)
摘 要:研究新兴低温冻结技术液体浸渍冷冻对鲟鱼贮藏期品质的影响,分析比较液体浸渍冷冻和传统空气冷冻处理后的鲟鱼在贮藏期的品质变化,并对多个指标进行了检测分析。结果表明,液体浸渍冷冻处理的鲟鱼冷冻速率是传统空气冷冻的12.47 倍,经过液体浸渍冷冻的鲟鱼其肌纤维受到的破坏较空气冷冻小,贮藏过程中鲟鱼的回复性与L *值均较空气冷冻高(P<0.05),二者挥发性盐基氮值和过氧化值的变化趋势也具有显著性差异(P<0.05)。因此,液体浸渍冷冻能够更好地保持鲟鱼原有的品质,可在鲟鱼贮藏保鲜过程中加以利用。
关键词:鲟鱼;液体浸渍冷冻;贮藏;电子显微镜
鲟鱼(Acipenser sinensis),又名鲟龙,成年鱼可长至2~3 m,最长可达9~10 m,平均体质量200~400 kg,是世界上最大的淡水鱼类 [1]。鲟鱼肉质鲜美细腻,营养丰富,且其通身均为软骨,软骨素含量丰富,具有巨大的加工潜力。现如今我国水产品养殖生产规模已经达到国际领先水平,但是后期运输、加工还无法满足日益增长的市场需求,所以更优的冻藏保鲜技术则显得尤为重要 [2]。空气式鼓风冻结技术是目前应用最为广泛的一种冻结方法,但是却存在易使食品表面大量脱水、增加能耗、易存在温度波动等问题 [3]。
液体浸渍冷冻技术作为一种新兴的冷冻加工技术,可以快速将食品内部热量吸收,起到速冻的效果,能够较好地保持食品原有的品质和外观形态,有着前期投入低、降低能耗等优点 [4-5]。国内许韩山等 [6]研究了超声对浸渍冷冻过程的影响;Sun Dawen等 [7]利用低温扫描电子显微镜观察经液体浸渍冷冻后的马铃薯样品,认为快速冷冻有利于保护细胞结构的完整;韩光赫 [8]对液体冷冻的载冷剂进行了研究,通过不同载冷剂配比、不同流速、不同温度对热物理特性、传质变化的影响,从而确定冷冻液的最优配比及扩散规律。国外关于液体浸渍冷冻主要集中于对载冷剂的热量传递方面,Fikiin [9]通过研究以NaCl作为载冷剂的液体冻结过程,证明了液体冷冻的高效传热能力,并通过对组织的微观结构观察发现,其冷冻过程更好地保持了鱼体肌肉组织结构完整。Verboven等 [10]对草莓进行了液体冷冻的研究,确定出液体冷冻期间传热的变化规律。Ribero等 [11]对奶酪进行了冷冻实验,通过透射电子显微镜的观察,得到NaCl的存在减小了冷冻对奶酪微观结构的影响。Lucas等 [12]还对液体冷冻的传质过程进行了深入的研究,通过对明胶进行冷冻实验,建立模型并分析其冻结过程中的传质以及热传递。
鲟鱼有着很高的营养价值与加工潜力,但是目前的运输保存方式不能满足人们对水产品品质日益增长的要求 [13]。液体浸渍冷冻技术在节约水产品运输成本、提高水产品附加价值、调节水产时空分布不均等问题都有着良好的应用潜力 [14-15]。而对鲟鱼在液体浸渍冷冻及其在长期冷冻效果方面少有研究。本实验通过研究鲟鱼在液体冷冻过程中的品质变化规律,探究其在冷冻过程中的品质状况,以期为淡水鱼的利用和加工提供更多的理论依据 [16-17]。通过比较空气冷冻与液体浸渍冷冻在贮藏过程中的挥发性盐基氮(total volatile basic nitrogen,TVB-N)、过氧化值(peroxide value,POV)、质构、色差、蒸煮损失及电子显微镜观察等结果来对其进行研究,从而对鲟鱼运输贮藏过程中品质的提升提供一定的理论指导。
1.1 材料与试剂
鲟鱼(Acipenser sinensis),购于北京京深海鲜市场,来源于同一养殖厂同一批次的健康鲟鱼,养殖时间约为1 a。其平均体质量为(1 748.56±213.11) g,体长为(43.51±4.11) cm。在市场直接宰杀,去头、去内脏,并使用清水冲洗掉表面的黏液及血渍,放置于冰袋中迅速运至实验室,并用真空机对鲟鱼进行真空包装。鲜冻液由北京四季大通公司自主研发。
胰蛋白胨、葡萄糖、琼脂(均为分析纯) 华中海威(北京)基因科技有限公司;酵母浸膏(分析纯)北京奥特星技术责任有限公司;硼酸、丙酮(分析纯)北京化工厂;氧化镁、亚甲基蓝、甲基红、硫代巴比妥酸、冰醋酸、甲醇、三氯甲烷、碘化钾、淀粉、硫代硫酸钠、磷酸二氢钾、氢氧化钠、硫酸铜、酒石酸钾钠、戊二醛、锇酸、环氧树脂、柠檬酸铅、醋酸双氧铀(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
3K15冷冻离心机 美国Sigma公司;LAD5-2A低速离心机 北京医用离心机厂;UV-5200紫外-可见分光光度计 上海元析有限公司;ADDI色差仪 北京辰泰克仪器技术有限责任公司;KDY-9820凯氏定氮仪 北京通润源机电技术有限责任公司;4500gCT3质构仪美国Brookfield公司;PB-10 pH计 赛多利斯科学仪器有限公司;XSR30无纸记录仪 深圳市金顺隆科技发展有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵 巩义市英峪仪器厂;UC6超薄切片机 德国徕卡有限责任公司;JEM-1230透射电子显微镜 日本电子株式会社广州事务所。
1.3 方法
1.3.1 冷冻速率与解冻速率的测定
1.3.1.1 冷冻速率的测定
将去头去内脏的鱼置于真空袋内,再把连接无纸记录仪的温度探头放到鱼肉前端的中心处,使用真空机抽真空并封口后放入到冷冻液中,每隔20 s对温度进行一次记录,直至中心温度降至-18 ℃时,停止记录。根据公式(1)计算液体浸渍冷冻处理与空气冷冻处理的鲟鱼的冷冻速率:
式中:V f1为冷冻速率/(cm/h);L为食品表面与热中心的最短距离/cm;t为表面从0 ℃开始至中心温度达到-10 ℃所需的时间/h。
1.3.1.2 解冻速率的测定
将冷冻好的鲟鱼水平放置于4 ℃冰箱中进行解冻,每隔20 s对其温度进行一次记录,待温度上升至2 ℃停止记录。根据公式(2)计算液体浸渍冷冻处理与空气冷冻处理的鲟鱼的解冻速率:
式中:V f2为解冻速率/(cm/h);L为食品表面与热中心的最短距离/cm;t为食品表面达0 ℃至热中心达2 ℃所用的时间/h。
1.3.2 贮藏时期品质指标的测定
将鲟鱼样品随机分成两组,其中一组使用液体冷冻方法进行冻结,另一组使用空气冷冻方法进行冻结。当鲟鱼中心温度达到-18 ℃时,将其转移到-18 ℃冰箱中进行贮藏。从第一次冷冻后,每隔15 d对样品进行理化指标的检测,每次实验使用2 条鲟鱼,检测至150 d。实验前将鲟鱼放入4 ℃冰箱中进行解冻处理,每次解冻20 h,待鱼肉中心温度到达2 ℃时,停止解冻开始检测实验。
1.3.2.1 剪切力的测定
从两条鲟鱼前半部分的肌肉上,顺着肌肉方向各用刀切取截面为10 mm×5 mm鱼肉,避开肌肉间隙的结缔组织和鱼骨部分,采用4500gCT3质构分析仪及相应软件,并使用片状探头TA-SBA对鱼肉进行剪切实验,每组实验重复次数不少于6 次,取平均值 [14]。
参数设定:触发点负载:5 g;测试速率:1 mm/s;循环次数:1 次;采样比率:10 点/s;压缩距离:15 mm;探头型号:TA-SBA;夹具型号:TA-RT-KIT。
1.3.2.2 质构的测定
采用两次咀嚼测试质地剖析分析(t e x t u r e profile analysis,TPA),从两条鲟鱼前部背肌各取块肌肉,去除鱼刺、黏膜及表面结缔组织,切成40 mm×50 mm×10 mm的鱼块,采用5 点取样法对每一个鱼块进行实验,重复次数不少于8 次,取平均值。使用4500gCT3质构仪进行测试。
参数设定:触发点负载5 g;测试速率:1 mm/s;探头回复速率:1 mm/s;压缩形变量:30%;可恢复时间:5 s;探头型号:TA5;夹具型号:TA-RT-KIT。
1.3.2.3 蒸煮损失率的测定
将新鲜及经过液体、空气冷冻过的鲟鱼背部肌肉切成约1 cm×1 cm×4 cm的块状,质量为(5±0.01)g。用锡箔纸包裹放入试管中,并用试管塞封口。在沸水中加热15 min,用镊子取出肉块,再用吸水纸吸干表面水分,放到天平称质量,读数精确到0.01 g,每组实验平行3 次,取平均值。
1.3.2.4 色差的测定
待鲟鱼解冻完成后,使用校正过的色差仪进行测定,测量结果用红度值(a *)、黄度值(b *)和亮度值(L *)表示,每组3 个平行。
1.3.2.5 pH值的测定
根据GB/T 5009.45—2003《水产品卫生标准的分析方法》进行样品pH值的测定。
1.3.2.6 挥发性盐基氮值测定
根据GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》,用半微量蒸馏法测定挥发性盐基氮(total volatile basic nitrogen,TVB-N)值。
1.3.2.7 POV的测定
将鱼腹部脂肪组织分离,并去除表皮和鱼刺,绞碎后使用混合提取液(水、甲醇、氯仿体积比3∶5∶10)进行提取,其过氧化值的测定方法参考Jung等 [18]的方法并加以修改。将提取的脂质样品称取1.000 g,放置于250 mL碘量瓶中,并加入2 5mL配制好的乙酸和三氯甲烷的混合溶液中(冰乙酸-三氯甲烷体积比3∶2),待样品完全溶解后,加入1 mL新配制的饱和碘化钾溶液,盖好瓶塞轻摇30 s,立即将溶液放于避光处静止10 min,后加入30 mL蒸馏水,并加入1.00 mL新配淀粉溶液,用0.01 mol/L的硫代硫酸钠进行滴定,滴定至溶液中蓝色褪去。根据公式(3)计算出POV。
式中:S为样品滴定量/mL;B为空白滴定量/mL;F为0.01 mol/L Na 2S 2O 3滴定量/mL;m代表样品质量/g。
1.3.3 冷冻及贮藏后鲟鱼微观组织观察
1.3.3.1 切片的制备
购买来的鱼进行前处理后随机分为3 组,第1组为新鲜对照组,不做处理,顺着肌纤维的方向切成5mm×3mm×3mm的大小,直接放入2.5%戊二醛中进固定2 h以上;第2组使用液体速冻进行冷冻,待中心温度降至-18 ℃后,立即用刀将肌肉切成相同大小,置入戊二醛中进行固定;第3组使用空气冷冻,待冷冻结束后将肌肉切分并置入戊二醛中进行固定,每组固定时间大于4 h。取样前对刀具及案板进行预冷处理,使其温度降低至同样的温度。
之后用刀片将固定好的样品顺肌纤维方向切成3 mm×1 mm×1 mm的小块,用磷酸缓冲液冲洗,重复3次。1%锇酸进行2 次固定,固定时间2 h,待固定完成后使用磷酸缓冲液冲洗3次。随后依次使用体积分数为30%、50%、70%、80%、90%、100%的丙酮对样品进行梯度脱水,其中100%的丙酮反复脱水3~4 次,每次10 min左右。脱水完成后使用环氧树脂SPURR进行包埋处理,待树脂浸透样本将其放入60℃恒温箱中,3 d后取出。待聚合完成后使用UC6超薄切片机切成超薄切片,然后使用2%的醋酸双氧铀和6.18%的柠檬酸铅进行染色处理,待染色完成后使用JEM-1230透射电子显微镜进行观察。
1.3.3.2 肌节长度的测定
通过观察电子显微镜照片,找出每组样品中较为清晰的图片,使用直尺测量出相邻3 个肌节的长度之和,并与照片中的比例尺进行换算,见公式(4):
式中:L为肌节长度/mm;X为电子显微镜照片中连续3 个相邻肌节的长度和/mm;a为图片中比例尺所代表的长度/mm;l为图片中比例尺的长度/mm。
1.4 数据处理
数据结果采用软件SPSS 18和Excel进行处理,结果以±s的形式表示。不同冷冻方法间数据使用显著差异法进行分析,取95%置信度(P<0.05)。
2.1 不同冷冻方法对鲟鱼冷冻速率及解冻速率的影响
2.1.1 不同冷冻方法对鲟鱼冷冻速率的影响
表 1 不同冷冻方式鲟鱼的冷冻速率
Table 1 Freezing rates of sturgeon under different freezing conditions

冷冻速率/(cm/h)冻结方式冷冻时间/h表面至中心距离/cm通过最大冰晶形成区时间/min空气冷冻4.783±0.0131.5±0.10.314±0.009186±1液体浸渍冷冻0.383±0.0211.5±0.13.917±0.00814±1
由表1可以看出,使用液体浸渍冷冻方法冻结速率可以达到3.917 cm/h,而传统空气冷冻技术对于鲟鱼的冻结速率为0.314 cm/h,使用液体浸渍方法的冻结速率是传统方法的12.47 倍。欧阳杰等 [19]利用鲍鱼作为研究对象,使用空气冷冻和液体冷冻技术进行冷冻处理,证明了液体浸渍冷冻的冻结速率比空气冷冻普遍提高了10 倍左右。张志广 [20]在对大黄鱼速冻研究后认为使用液体速冻提高了冷冻样品与载冷剂的热交换速率,从而提高了单位时间内分子热交换量和分子内势能即温度差。从本实验中可以看出使用液体浸渍冷冻的冷冻速率要优于传统空气冷冻。
2.1.2 不同冷冻方法对鲟鱼解冻速率的影响
表 2 不同冷冻方法的解冻速率
Table 2 Thawing rates of sturgeon under different freezing conditions

解冻速率/(cm/h)空气冷冻19.2±0.031.5±0.10.078±0.01液体浸渍冷冻17.5±0.061.5±0.10.086±0.02冻结方式解冻时间/h表面至中心距离/cm
由表2得出,使用液体浸渍冷冻法的解冻速率为0.086 cm/h,传统空气冷冻法的解冻速率为0.078 cm/h,是前者的1.1 倍,解冻时微小的差别可能是和肌肉冰晶体的大小有关,冰晶小而多解冻时间就短,冰晶大,热量不容易传递,所以解冻较慢。
2.2 不同冷冻方法对鲟鱼贮藏过程中剪切力的影响
如图1所示,为不同冷冻方式的鲟鱼在-18 ℃贮藏过程中剪切力的变化。可以看出随着冻结时间的延长,两种冷冻方法鲟鱼的剪切力均呈下降趋势。并且可以发现,液体浸渍冷冻的剪切力数值较空气冷冻的略高,但是差异不显著(P>0.05)。其中,液体浸渍冷冻鲟鱼的剪切力数值由1 584.7 g降低到508.0 g,下降了67.9%,空气冷冻剪切力数值由初始的1014.1 g减少到479.6 g,下降幅度达52.7%。这与肌肉保水性、蛋白变性等因素相关,这也与冻藏期间细胞内冰晶生长相关,冰晶的增大导致其对肌肉细胞产生了机械损伤 [21]。
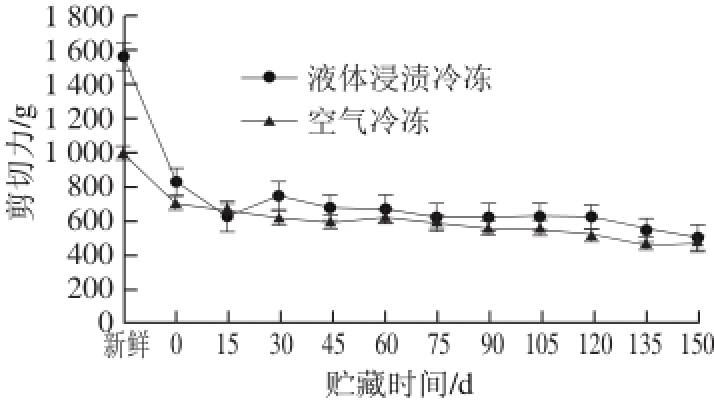
图 1 冻藏过程中鲟鱼剪切力的变化
Fig. 1 Change in shear force of sturgeon during frozen storage
2.3 不同冷冻方法对鲟鱼贮藏过程中TPA的影响

图 2 冻藏过程中鲟鱼硬度的变化
Fig. 2 Changes in hardness of sturgeon during frozen storage
如图2所示,在5 个月的冷冻贮藏过程中,两种方式冻结鲟鱼的硬度均呈下降趋势,从整体来看液体浸渍冷冻硬度数值由283.7 g减低为113.6 g,空气冷冻由初始的193.3 g降低为127.9 g。从前3 个月的结果来看,液体浸渍冷冻鲟鱼硬度比空气冷冻高(P<0.05),经过贮藏时间达到5 个月时,两种处理方法已经没有显著性差异。冷冻初期空气冷冻的鲟鱼硬度下降较快可能是由于冷冻速率较低,导致蛋白质变性程度较高,细胞内冰晶形成较大,对细胞造成了较大的机械损伤。随着冷冻时间的延长,冰晶生长导致两种冷冻方式对细胞的机械损伤差异减小,显著性差异消失 [22-23]。

图 3 冻藏过程中鲟鱼回复性的变化
Fig. 3 Changes in resilience of sturgeon during frozen storage
回复性反映了鱼肉形变过程中回复所需能量的变化值,图3为不同冷冻方式冻结的鲟鱼在-18 ℃贮藏过程中回复性的变化趋势。可以发现,两种冷冻的回复性都呈下降趋势,其中液体浸渍冷冻的回复性从初始的0.24降低到0.17,空气冷冻由初始值0.22降低为0.18。利用软件SPSS对5 个月贮藏过程中的回复性进行比较,得出不同冷冻方式对回复性变化具有明显的影响(P<0.05)。
2.4 不同冷冻方法对鲟鱼贮藏过程中蒸煮损失率的影响

图 4 冻藏过程中鲟鱼蒸煮损失率的变化
Fig. 4 Changes in cooking loss of sturgeon during frozen storage
蒸煮损失是鱼肉持水性的重要指标 [24],如图4所示,两种冻结方式下损失率均成上升的趋势,其中液体浸渍冷冻鲟鱼的蒸煮损失率由初始的39.4%上升至49.7%,提高了10.4%;空气冷冻鲟鱼的蒸煮损失率由初始值42.6%升高至48.2%,升高了5.6%。经过两种冷冻方式冻结的鲟鱼在贮藏过程中蒸煮损失的变化没有显著性差异(P>0.05)。
2.5 不同冷冻方法对鲟鱼贮藏过程中色差的影响
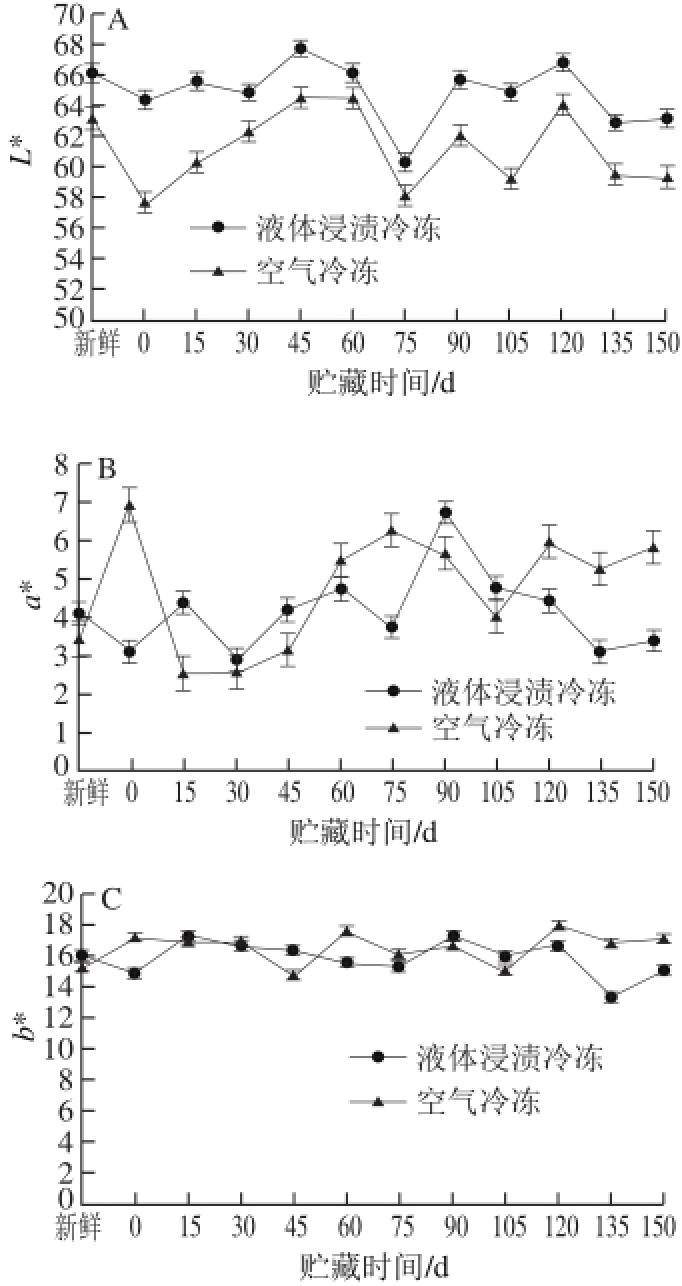
图 5 鲟鱼在冻藏过程中L*值(A)、a*值(B)和b*值(C)的变化
Fig. 5 Changes in L* (A), a* (B) and b* (C) values of sturgeon during frozen storage
色差是反映在鱼肉在冷冻贮藏过程中的重要指标 [25],在冻藏过程中由于发生一系列的生物化学反应使肌肉颜色发生改变。如图5A所示,随着贮藏时间的延长,L*值都有下降的趋势,其中液体浸渍冷冻L*值由初始的66.20减少到63.22,空气冷冻的L*值由63.21降低到59.44。且经过液体冷冻的鲟鱼与空气冷冻的具有显著性差异(P<0.05)。实验数据中液体浸渍冷冻的L *值较大,说明其较为明亮,这与新鲜的鲟鱼也更为接近,即在贮藏过程中变化较小。根据黄鸿兵等 [26]的研究表明,样品在解冻过程中失去水分后,引起表面光鲜反射率的改变,导致亮度值降低。另外,冻藏过程中组织表面的水分由于升华而减少,这也增大了肌肉与空气接触的程度,加速了氧化反应的速率,从而使得肉品表面亮度降低。Farouk等 [27]在羊肉和牛肉的冻藏过程中也观察到了L*值的降低。由图5B可知,两种冷冻方法处理鱼肉的a *值波动较大,且两种冷冻方法没有显著性差异(P>0.05);图5C显示,随着贮藏时间的延长,b *值变化较小,且两种冷冻对其没有显著性差异(P>0.05)。
2.6 不同冷冻方法对鲟鱼贮藏过程中pH值的影响
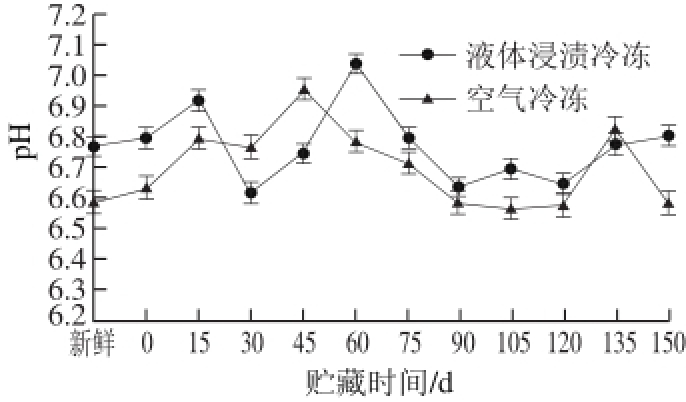
图 6 鲟鱼在冻藏过程中pH值的变化
Fig. 6 Changes in pH of sturgeon during frozen storage
如图6所示,在5个月冷冻贮藏过程中,鲟鱼的pH值总体上有先上升后下降的趋势。其中液体浸渍冷冻的鲟鱼pH值在第60天升到最高值7.04,相比于初始值6.77升高了0.27;而空气冷冻的鲟鱼pH值在第45天升到最高值6.96,相比于初始值6.59升高了0.37。可以看出使用液体浸渍冷冻方法的鲟鱼变化较小,但经数据分析后可知,使用不同冷冻方法的鲟鱼pH值没有明显差异(P>0.05),这也与Sriket等 [28]的研究结论相似。
2.7 不同冷冻方法对鲟鱼贮藏过程中TVB-N值的影响
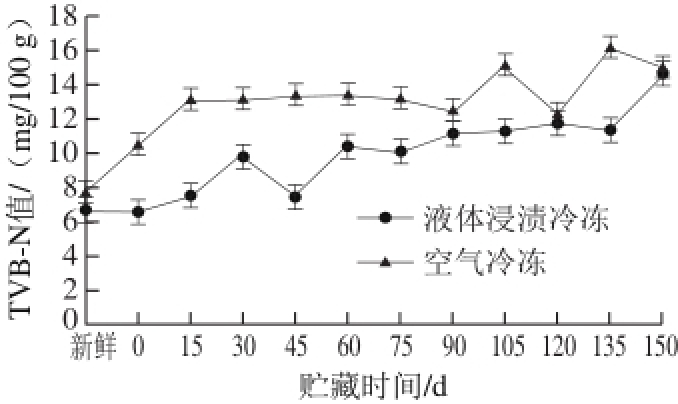
图 7 鲟鱼在冻藏过程中TVB-N值的变化
Fig. 7 Changes in TVB-N value of sturgeon during frozen storage
如图7所示,随着贮藏时间的延长,TVB-N值呈上升的趋势。液体浸渍冷冻的鲟鱼TVB-N值由初始6.54 mg/100 g升至11.75 mg/100 g,空气冷冻由7.72 mg/100 g升高至14.97 mg/100 g,根据水产品新鲜度的行业标准 [29]可知,经过5 个月的贮藏,液体浸渍冷冻的鲟鱼新鲜度保持良好,而空气冷冻的样品属于二级品。经过液体浸渍冷冻的鲟鱼在-18 ℃冰箱中贮藏过程中TVB-N指标变化较小,且两种方式冻结的鲟鱼其TVB-N值具有显著性差异(P<0.05)。
2.8 不同冷冻方法对鲟鱼贮藏过程中POV的影响
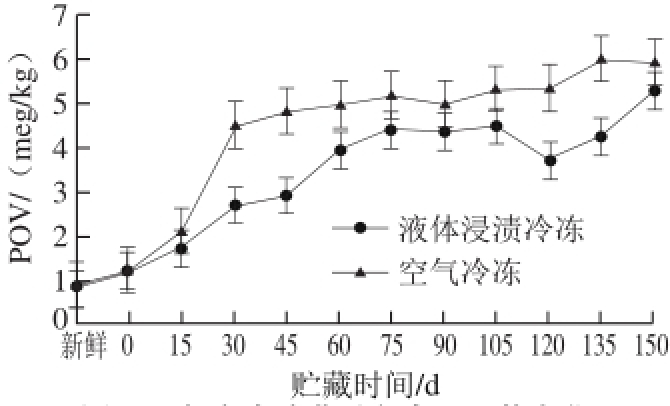
图 8 鲟鱼在冻藏过程中POV的变化
Fig. 8 Changes in POV of sturgeon during frozen storage
如图8所示,随着冷冻时间的延长,两种冻结方式鲟鱼的POV均呈上升的趋势,并且在前3 个月内上升较快,在贮藏的后期上升趋势减缓。其中,使用液体浸渍冷冻技术的鲟鱼POV由0.82 meq/kg升高至5.29 meq/kg,空气冷冻的鲟鱼数值由初始的0.91 meq/kg提高到5.96 meq/kg。由此可知,经过液体浸渍冷冻的鲟鱼其在冻藏5 个月的过程中脂肪氧化程度相对较低,且两种冷冻方式的样品具有显著性差异(P<0.05)。
2.9 冷冻及贮藏后不同冷冻方法对鲟鱼微观组织的影响

图 9 新鲜及冷冻后鲟鱼肌肉组织结构(×12 000)
Fig. 9 Muscular structure of fresh and frozen sturgeon (× 12 000)
如图9所示,从肌纤维的微观结构来看,经过液体浸渍冷冻对鲟鱼破坏较小,与新鲜差距不大;空气冷冻后的鲟鱼肌纤维间距增大,肌节受到机械损伤明显,说明液体浸渍冷冻更好地保护了肌肉细胞的完整性 [24]。当贮藏时间达到5 个月时,不同冷冻方法冻结鲟鱼间的差异已不明显,两者趋于一致。
表 3 鲟鱼肌节长度
Table 3 Lengths of muscle segment in fresh and frozen sturgeon
空气冷冻(5 个月)肌节长度1.73±0.010.83±0.021.08±0.021.75±0.031.56±0.03指标新鲜液体浸渍冷冻空气冷冻液体浸渍冷冻(5 个月)
根据表3不同处理方法处理后鲟鱼肌节长度的值,可以看出新鲜样品肌节长度为1.73 μm,并且从图9可以看出,Z线清晰可见,肌动蛋白纤丝和肌球蛋白纤丝明显。说明此时肌肉处于松弛阶段,还未进入僵直期 [11]。而经过液体浸渍冷冻后肌节长度最短,其长度为0.83 μm;空气冷冻后肌节长度为1.08 μm,二者具有显著性差异(P<0.05)。并且Z线不明显,明带消失,说明此时肌肉处于收缩状态。通过比较贮藏5 个月后的肌节长度可以发现,经过5 个月的贮藏后,液体浸渍冷冻的肌节长度值为1.75 μm,空气冷冻的肌节长度为1.56 μm,并且两者Z线明显,明带暗带清晰可见,并且肌节长度与新鲜时没有显著性差异(P>0.05),说明此时肌肉恢复正常长度 [30],液体浸渍冷冻效果更好。
本实验比较分析了液体浸渍冷冻和传统空气冷冻处理后的鲟鱼在贮藏期的品质变化,并使用透射电子显微镜对冻结后及贮藏5 个月的样品进行了观察。结果表明,液体浸渍冷冻处理的鲟鱼冷冻速率是传统空气冷冻的12.47 倍,在5 个月的贮藏过程中不同冷冻方法处理的鲟鱼在物理指标和化学指标上均有显著差异(P<0.05),液体冷冻后鲟鱼的回复性与L *值均较空气冷冻高,二者TVB-N值和POV具有的变化趋势也具有显著性差异(P<0.05),且液体冷冻各指标变化幅度较小,优势较为明显,更好地保持了鲟鱼原有的品质。电子显微镜观察结果显示经过液体浸渍冷冻的鲟鱼其肌纤维受到的破坏较空气冷冻后的小,但对于长期贮藏而言,液体浸渍冷冻的优势逐渐减弱。由此可见,液体浸渍冷冻处理鲟鱼较传统空气冷冻有着较明显优势,可以在鲟鱼贮藏保鲜过程中加以利用,对其推广应用也将对水产品保鲜的发展有着重要意义。
参考文献:
[1] 马国军. 鲟鱼驯养和营养研究[D]. 哈尔滨: 东北农业大学, 2003: 20-27. DOI:10.7666/d.y571632.
[2] 包玉龙, 汪之颖, 李凯风, 等. 冷藏和冰藏条件下鲫鱼生物胺及相关品质变化的研究[J]. 中国农业大学学报, 2013(3): 157-162.
[3] 李杰, 谢晶. 我国鼓风冻结技术及连续式鼓风冻结装置的发展现状[J]. 渔业现代化, 2007(4): 61-63. DOI:10.3969/ j.issn.1007-9580.2007.04.019.
[4] LIANG Dongwu, LIN Fengying, YANG Gongming, et al. Advantages of immersion freezing for quality preservation of litchi fruit during frozen storage[J]. LWT-Food Science and Technology, 2015, 60(2): 948-956. DOI:10.1016/j.lwt.2014.10.034.
[5] ZORRILLA S E, RUBIOLO A C. Mathematical modeling for immersion chilling and freezing of foods[J]. Journal of Food Engineering, 2005, 66(3): 329-338. DOI:10.1016/j.jfoodeng.2004.03.027.
[6] 许韩山, 张慜, 孙金才. 超声波对毛豆浸渍冷冻过程的影响[J].食品与生物技术学报, 2009, 28(6): 748-752. DOI:10.3321/ j.issn:1673-1689.2009.06.005.
[7] SUN Dawen, BING Li. Microstructural change of potato tissues frozen by ultrasound-assisted immersion freezing[J]. Journal of Food Engineering, 2003, 57(4): 337-345. DOI:10.1016/S0260-8774(02)00354-0.
[8] 韩光赫. 直接浸渍冷冻载冷剂组成、传递特性及应用研究[D]. 广州: 华南理工大学, 2010: 3-19.
[9] FIKIIN A G. New method and fluidized water system for intensive chilling and freezing of fish[J]. Food Control, 1992, 3(3): 153-160. DOI:10.1016/0956-7135(92)90100-O.
[10] VERBOVEN P , SCHEERLINCK N, NICOLAI B M. Surface heat transfer coeff i cients to stationary spherical particles in an experimental unit for hydrof l uidisation freezing of individual foods[J]. International Journal of Refrigeration, 2003, 26(3): 328-336. DOI:10.1016/S0140-7007(02)00110-X.
[11] RIBERO G G, RUBIOLO A C, ZORRILLA S E. Microstructure of Mozzarella cheese as affected by the immersion freezing in NaCl solutions and by the frozen storage[J]. Journal of Food Engineering, 2009, 91(4): 516-520. DOI:10.1016/j.jfoodeng.2008.09.029.
[12] LUCAS T, RAOULT-WACK A L. Immersion chilling and freezing in aqueous refrigerating media: review and future trends: réfrigération et congélation par immersion dans des milieux réfrigérants: revue et tendances futures[J]. International Journal of Refrigeration, 1998, 21(6): 419-429. DOI:10.1016/S0140-7007(98)00014-0.
[13] 邓敏. 浸渍冻结流速及冻藏对草鱼块品质影响的研究[D]. 广州: 华南理工大学, 2013: 4-9.
[14] FERNÁNDEZ A M, VIEIRA C. Effect of chilling applied to suckling lamb carcasses on hygienic, physicochemical and sensory meat quality[J]. Meat Science, 2012, 92(4): 569-574.
[15] LI Ke, ZHANG Yimin, MAO Yanwei, et al. Effect of very fast chilling and aging time on ultra-structure and meat quality characteristics of Chinese Yellow cattle M. Longissimus lumborum[J]. Meat Science, 2012, 92(4): 795-804. DOI:10.1016/j.meatsci.2012.07.003.
[16] CHOE J H, STUART A, KIM Y H. Effect of different aging temperatures prior to freezing on meat quality attributes of frozen/thawed lamb loins[J]. Meat Science, 2016, 116: 158-164. DOI:10.1093/ps/84.4.607.
[17] HERNANDEZ-HERRERO M M, ROIG-SAGUES A X, LOPEZSABATER E I, et al. Total volatile basic nitrogen and other physicochemical and microbiological characteristics as related to ripening of salted anchovies[J]. Journal of Food Science, 1999, 64(2): 344-347. DOI:10.1111/j.1365-2621.1999.tb15897.
[18] JUNG D, LEE S, YOON J, et al. Inhibition of pork and f i sh oxidation by a novel plastic film coated with horseradish extract[J]. LWTFood Science and Technology, 2009, 42(4): 856-861. DOI:10.1016/ j.lwt.2008.11.015.
[19] 欧阳杰, 谈佳玉, 沈建, 等. 浸渍冻结大黄鱼贮藏期间品质变化研究[J].南方水产科学, 2013(6): 72-77.
[20] 张志广. 冷冻对养殖大黄鱼品质影响的研究[D]. 杭州: 浙江工商大学, 2010: 4-9. DOI:10.7666/d.Y1719800.
[21] TOUATI N, TARAZONA-DÍAZ M P, AGUAYO E, et al. Effect of storage time and temperature on the physicochemical and sensory characteristics of commercial apricot jam[J]. Food Chemistry, 2014, 145: 23-27. DOI:10.1016/j.foodchem.2013.08.037.
[22] BRADY P L, HUNECKE M E. Correlations of sensory and instrumental evaluations of roast beef texture[J]. Journal of Food Science, 2006, 50(2): 300-303. DOI:10.1111/j.1365-2621.1985. tb13386.x.
[23] 梁锐, 张宾, 李淑芳, 等. 鲐鱼在不同冻藏温度下品质变化的研究[J].浙江海洋学院学报(自然科学版), 2012(4): 345-349.
[24] YUAN H B K, LIESSE C, KEMP R, et al. Evaluation of combined effects of ageing period and freezing rate on quality attributes of beef loins[J]. Meat Science, 2015, 110: 40-45.
[25] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2): 93-98. DOI:10.1016/j.meatsci.2012.01.013.
[26] 黄鸿兵, 王道营, 张牧晗, 等. 草鱼冷藏过程中肌原纤维超微结构及质构的变化[J]. 天津农业科学, 2015, 21(12): 58-60.
[27] FAROUK M M, PRICE J F. The effect of post-exsanguination infusion on the composition, exudation, color and post-mortem metabolic changes in lamb[J]. Meat Science, 1994, 38(3): 477-496. DOI:10.1016/0309-1740(94)90072-8.
[28] SRIKET P, BENJAKUL S, VISESSANGUAN W, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle[J]. Food Chemistry, 2007, 104(1): 113-121. DOI:10.1016/ j.foodchem.2006.11.004.
[29] 李泽瑶. 水产品安全质量控制与检验检疫手册[J]. 中国农业信息, 2005(12): 27.
[30] 郑海波. 肌原纤维断裂指数及其与肉质嫩度的关系[J]. 肉类研究, 2007, 21(5): 13-16.
Effect of Immersion Chilling and Freezing Technique on Sturgeon Quality during Frozen Storage
DONG Jia
1, HU Jiajie
1, WANG Qing
2, NIU Jiguo
2, LIU Jingming
3, TIAN Yueyue
1, WANG Zengli
1,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. Longtengxiangyuan (Beijing) Technology Development Co. Ltd., Beijing 100163, China; 3. Beijing Er Shang Group, Beijing 100053, China)
Abstract:Immersion chilling and freezing (ICF) is a new low-temperature processing technology with the features of instantaneousness and energy saving. In this study, the quality changes of sturgeon in terms of various parameters were comparatively investigated under the processing conditions of ICF and traditional air freezing (TAF) during 6 months of storage. Results indicated that the freezing rate of ICF was 12.47 times higher than TAF, and ICF could maintain relatively better the texture of sturgeon muscle. In addition, the resilience and L *value of sturgeon during ICF were higher than during TAF (P < 0.05), and a signif i cant difference was also recorded in total volatile basic nitrogen (TVB-N) and peroxide value (POV) (P < 0.05). Thus ICF can better maintain the quality of frozen sturgeon, and it can be used in the freshness maintenance of sturgeon during storage.
Key words:sturgeon; immersion chilling and freezing technique; storage; electron microscope
DOI:10.7506/spkx1002-6630-201705046
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)05-0281-07
引文格式:
董佳, 胡嘉杰, 王庆, 等. 液体浸渍冷冻对鲟鱼贮藏过程中品质的影响[J]. 食品科学, 2017, 38(5): 281-287. DOI:10.7506/ spkx1002-6630-201705046. http://www.spkx.net.cn
DONG Jia, HU Jiajie, WANG Qing, et al. Effect of immersion chilling and freezing technique on sturgeon quality during frozen storage[J]. Food Science, 2017, 38(5): 281-287. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705046. http://www.spkx.net.cn
收稿日期:2016-08-27
基金项目:北京市鲟鱼、鲑鳟鱼创新团队项目(SCGWZJ20161105-2)
作者简介:董佳(1993—),女,硕士研究生,研究方向为营养与食品安全。E-mail:donjia@cau.edu.cn
*通信作者:王增利(1968—),男,副教授,硕士,研究方向为食品加工。E-mail:wangzengli@cau.edu.cn