
图 1 ACE与卡托普利的作用模型
[6]
Fig. 1 Reaction mode between ACE and captopril
[6]
王晓丹 1,薛 璐 1,2,*,胡志和 1,2,张 琦 3,李艳军 1,夏 磊 1
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津市食品生物技术重点实验室,天津 300134;3.博福-益普生(天津)制药有限公司,天津 300384)
摘 要:血管紧张素转化酶(angiotensin-converting enzyme,ACE)抑制肽是一类从食源性蛋白质中分离得到的具有降高血压活性的多肽。由于其降血压效果好,而且没有降压药物的毒副作用从而引起了广泛关注。近年来,ACE抑制肽的构效关系研究成为研究重点。结构生物信息学研究表明,ACE抑制肽的ACE抑制能力不仅与其分子质量有关,而且与其氨基酸序列以及其立体空间构象之间存在高度相关性。ACE抑制肽的抑制类型与ACE抑制活性、构效关系也存在一定相关性。对ACE抑制肽构效关系进行深入研究将有助于指导开发高活性的功能性食品及降血压药物。
关键词:ACE抑制肽;构效关系;氨基酸序列
血管紧张素转化酶(angiotensin-converting enzyme,ACE)是一种含锌二肽羧肽酶,在血压调节中扮演着重要角色,广泛存在于哺乳动物体内,尤其存在于血管内皮细胞、上皮吸收细胞、神经上皮细胞以及雄性生殖细胞中 [1]。ACE分为sACE和tACE两种:sACE即体细胞ACE,存在于内皮和上皮细胞中,是由1 306 个氨基酸组成的多联糖蛋白,包含26 个外显子,由两个同源的结构域组成(N端结构域、C端结构域);tACE存在于雄性哺乳动物睾丸组织和精子细胞中,含701 个氨基酸残基,除了前36 个氨基酸残基不同,它与sACE的C端结构域具有相同的结构 [2]。ACE通过肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikrein-kinin system,KKS)发挥作用导致血压升高 [3]。在RAS中,ACE切掉十肽的血管紧张素Ⅰ的C-末端的组氨酸(His)和亮氨酸(Leu)残基使之成为最有效的血管收缩剂血管紧张素Ⅱ,从而引起血压升高。在KKS中,ACE能使血管舒张剂九肽——舒缓激肽(bradykinin)失活,从而引起血压的升高。Ondetti等 [4]根据ACE与胰羧肽酶A同是含锌酶及它们的一些相似性质,建立了ACE与底物作用的模型,并依此设计出了第一个有效的非肽类抑制剂卡托普利。1982年,Cushman等 [5]对该模型进行了修正,并设计出了其他高效抑制剂。如图1所示,ACE的活性位点为S1、S1’、S2’。根据竞争性抑制剂的抑制机理,竞争性ACE抑制肽在ACE的活性位点上产生竞争性结合,从而抑制ACE催化血管紧张素Ⅰ。

图 1 ACE与卡托普利的作用模型
[6]
Fig. 1 Reaction mode between ACE and captopril
[6]
ACE抑制肽是一类从食物中提取的具有降高血压活性的多肽。由于其对高血压有抑制作用而对正常血压无影响,并且相对于降压药物来讲,对人体无毒无副作用,因此具有代替降血压药物的潜在可能性。自1979年Oshima等 [7]首次报道成功提取食源性ACE抑制肽以来,随后大量来源于植物性和动物性食品的食源性ACE抑制肽,如酪蛋白源 [8]、大豆蛋白源 [9]、蚕蛹蛋白源 [10]、大米蛋白源 [11]、小麦胚芽蛋白源 [12]、远东拟沙丁鱼蛋白源 [13]等也相继被发现,目前对于ACE抑制肽的提取和制备方面的研究已较为成熟。
ACE抑制肽是酶抑制剂,其结构影响着其对ACE的抑制能力。综合文献分析,ACE抑制肽活性的影响因素包括分子质量、氨基酸序列及由此形成的空间构象等因素。
2.1 分子质量对ACE抑制肽抑制能力的影响
目前发现的大部分ACE抑制肽均为分子质量较小的短肽,这可能是因为短肽更容易与ACE活性位点结合。由于ACE活性位点不能容纳大分子肽,因此ACE抑制肽的氨基酸残基数量通常为2~12 个 [14]。王晶晶等 [13]通过采用动物蛋白水解酶和风味蛋白酶联合水解制备远东拟沙丁鱼肌肉蛋白酶解产物,分离得到>10 kD、3~10 kD和<3 kD 3 种不同分子质量的组分,经测定发现分子质量<3 kD的组分抑制率最高,高达71.4%;分子质量>10 kD的组分抑制率与原酶解液相比有所下降;徐克寒等 [15]利用葡聚糖凝胶层析分离三斑海马源ACE抑制肽并对其抑制率进行测定,发现分子质量<1 kD的组分抑制率最高,其半抑制浓度(half maximal inhibitory concentration,IC 50)值为0.91 mg/mL。刘文颖等 [16]以三文鱼皮、乌鸡、玉米黄粉、谷朊粉、大豆分离蛋白为原料制备的食源性低聚肽并对其进行ACE抑制活性的分析,并测得其IC 50值分别为1.25、2.76、0.53、0.62、0.88 mg/mL,并发现5 种食源性ACE抑制肽的分子质量在1 kD以下的分别占90.59%、95.95%、93.09%、93.03%和86.13%,其中以二肽、三肽为主。说明具有高活性的ACE抑制肽主要为分子质量较小的短肽。
已被报道的ACE抑制肽大部分都为分子质量较小的短肽,Kleekayai等 [17]从泰国传统发酵虾膏中发现了二肽SV。Ngo等 [18]分离出了具有高活性的九肽MVGSAPGVL和七肽LGPLGHQ,IC 50值分别为3.09 μmol/L和4.22 μmol/L。Jiang Zhanmei等 [8]从酪蛋白中分离出六肽RYPSYG和四肽DERF,经测定IC 50值分别为(54.0±1.2) μg/mL和(21.0±0.8) μg/mL。然而,ACE抑制肽活性之间的差异并不完全与其分子质量相关,Aluko等 [19]测得0.5 mg/mL质量浓度下的九肽FEGTVFENG比六肽IIPLEN的抑制率要高的多;Girgih等 [20]的研究结果中也显示很多五肽和六肽的ACE抑制率高于三肽和四肽。这说明短链ACE抑制肽中,并非其分子质量越小,其抑制能力越强。
也有研究表明,某些长链肽段的抑制能力也很强。Quirós [21]等测得十九肽LVYPFPGPIPNSLPQNI-PP的IC 50值为5 μmol/L,远低于Fuglsang等 [22]测得二肽LY的IC 50值44 μmol/L,本课题组从酪蛋白水解产物中纯化提取的十肽YQKFPQYLQY和二肽YS的IC 50值分别为11.75 μg/mL和11.89 μg/mL [23],可以看出十肽与二肽的抑制能力基本相同,这说明ACE抑制肽的抑制能力与肽链的长度及分子质量之间并不完全相关,有可能存在对ACE抑制肽抑制能力有更大影响的因素。
2.2 氨基酸序列对ACE抑制肽抑制能力的影响
ACE抑制肽的抑制能力不但与其肽链的长度及分子质量相关,与其自身的氨基酸序列也有紧密联系。最早有关ACE抑制肽氨基酸序列与活性之间的关系是由Ondetti等 [4]于1977年提出的,活性肽C端3 个氨基酸的序列对ACE抑制能力的影响最大,当活性肽C端序列为-Phe-Glu-Pro时,其与ACE活性中心亲和能力最强。
根据近几年文献报道,ACE抑制肽氨基酸序列的特点主要有:一级氨基酸序列中含有大量疏水性氨基酸,C端存在Pro、Leu等带正电荷的氨基酸残基具有较高的ACE抑制能力;N端存在芳香族氨基酸或碱性氨基酸时活性较高。
由于ACE抑制肽来源广泛,其氨基酸序列差别较大,ACE抑制能力也参差不齐,因此研究人员引入了结构生物信息学的方法对其构效关系进行较为全面的分析。其中,定量构效关系(quantitative structure activity relationship,QSAR)是研究ACE抑制肽构效关系的主要方法之一,即运用QSAR模型预测和分析ACE抑制肽的活性。其执行的主要步骤有:1)收集化合物的结构和活性数据;2)得到结构描述符并对化合物结构进行定量描述;3)采用适当算法对结构和活性建立数学模型;4)检验模型(模型拟合能力、稳健性和预测能力);5)解释模型(提取对活性影响大的结构信息) [24]。
QSAR模型可以应用于预测水解不同来源蛋白水解物中可能存在的高活性ACE抑制肽,Majumder等 [25]用QSAR模型预测到鸡蛋蛋白源ACE抑制肽IRY、LKP和IQY,经检测IC 50值分别为0.6、1.6、2.9 μmol/L。Gu Yuchen等 [26]运用液相色谱-串联质谱(liquid chromatograph-tandem mass spectrometer,LC-MS/MS)结合定量构效分析,发现5 种三肽IVF、LLF、LNF、LSW、LEF,经检测均有较高ACE抑制活性。
运用QSAR模型进行分析的主要以二肽和三肽等短肽为主,而对于多肽的模型则较为少见。2006年,Wu Jianping等 [27]运用Z-scale描述子、偏最小二乘法对168 条二肽和140 条三肽构建了定量构效分析模型。研究发现,二肽中具有大侧链基团和疏水氨基酸,则其抑制能力更强;三肽中C端为疏水性氨基酸,N端为芳香族氨基酸,中间为带正电荷的氨基酸的抑制能力最强。Udenigwe等 [28]对二肽进行偏最小二乘法QSAR分析,结果显示小分子氨基酸的疏水侧链在N端,而含大侧链的氨基酸在C-末端则存在较高ACE抑制活性。
借助QSAR对ACE抑制肽的结构与活性关系研究都是基于对氨基酸序列分析得到的,但是还有许多ACE抑制肽构效关系并不符合这些研究结论。贾俊强等 [29]通过统计分析270 种已被报道过的ACE抑制肽的组成后发现,ACE抑制肽的主要特点有:N端氨基酸主要为Arg、Tyr、Glu、Val、Ala、Ile、和Leu,C端氨基酸主要为Tyr、Pro、Trp、Phe和Leu,其中N端疏水氨基酸与非疏水氨基酸的比例基本相等,C端含疏水氨基酸的比例为60%,肽链两端至少含有一个疏水氨基酸的比例为83%。这说明ACE抑制肽的抑制能力与是否存在疏水氨基酸有强关联性,而疏水氨基酸的数量及其在肽链上的位置则直接影响了多肽的空间结构的形成。
综上所述,ACE抑制肽的氨基酸序列对其ACE抑制能力十分重要。目前对于ACE抑制肽的QSAR研究还处于起步阶段,鲜见能够准确描述所有ACE抑制肽的结构与其抑制能力的模型。因此,建立适用性较强的ACE抑制肽构效关系的QSAR模型为将成为ACE构效关系研究的重点之一。
2.3 ACE抑制肽立体构象与其抑制能力的关系
根据前文分析可知,ACE抑制肽的抑制能力显然不能单纯用其一级结构氨基酸残基的种类、数量及序列来解释。ACE抑制肽的一级结构不同,其形成的空间构象也千差万别,影响了其与ACE的结合,进而影响其ACE抑制能力。因此借助QSAR从一级结构出发研究ACE抑制肽的构效关系有一定的局限性。
分子对接作为结构生物信息学的重要方法之一,成为研究ACE抑制肽构象及其与ACE结合作用方式的主要方法。分子对接也是一种理论模拟方法,该方法运用分子模拟软件,研究ACE与ACE抑制肽的分子间相互作用,并预测其结合模式和亲合力。它也可以通过分子动力学对ACE抑制肽进行模拟构象优化,选择最稳定的分子构象与ACE进行模拟对接并分析。
Pan Daodong等 [30]采用模拟分子对接的方法进行研究,结果表明ACE活性位点的6 个氨基酸残基His353、Ala354、Ser355、Glu384、Arg522和Tyr523为与二肽LL的主要结合位点。管骁等 [31-32]同样采用分子对接研究二肽和三肽与ACE的相互作用模式与分子机制,结果表明氢键、亲水、疏水、静电等作用力共同对二肽和三肽与ACE的结合存在贡献,但均以氢键作用为主;ACE分子中Ala354、Glu384、Arg522等氨基酸残基为二肽与其结合的重要活性位点;ACE分子中Lys511、His513、Tyr520、Tyr523等氨基酸残基为其与三肽结合的重要结合位点;ACE抑制二肽中N端氨基对其抑制活性影响显著;ACE抑制三肽中N端氨基和C端羧基对其抑制活性影响显著,其中N端氨基的作用更为重要。Li Peng等 [33]发现ACE分子中的7 个氨基酸残基(His383、His387、Glu384、Arg522、Asp358、Ala356、Asn70)与ACE抑制肽ACKEP的结合影响较大,其中Arg522和Asp358分别与ACE抑制肽ACKEP的O5和H60两个原子之间形成了最为稳定的氢键。
Liu Rui等 [34]的模拟分子对接结果表明,ACE分子中的His383、His387和Glu411氨基酸残基为其与ACE抑制肽的主要结合位点,并且发现六肽VVCVPW的半胱氨酸巯基可能与ACE的活性部位结合发挥关键作用。Rawendra等 [35]对其甲鱼蛋白源ACE抑制肽IVR进行模拟分子对接发现IVR的C末端与tACE分子的Lys511和Tyr520氨基酸残基之间的氢键作用与其抑制程度明显相关。Zhou Min等 [36]通过分子模拟对接发现同为三肽的LKP和IKP的ACE抑制率不同的原因是N端的Leu和Ile氨基酸残基与cACE的结合位点不同,从而影响到肽与ACE的相互作用。
综上所述,ACE抑制肽与ACE的模拟分子对接表明,ACE分子中活性中心的氨基酸残基对ACE抑制肽与其结合起到重要作用,如Glu384、Tyr520、His387等;ACE与ACE抑制肽之间的作用力以氢键为主;不同的ACE抑制肽与ACE的活性结合位点不完全相同。
2.4 非竞争性ACE抑制肽的抑制机理
酶抑制剂的抑制机理分为可逆与不可逆两种。研究表明ACE抑制肽的抑制类型主要为可逆抑制 [37]。可逆抑制又分为4 种类型:1)竞争性抑制,其特点是抑制剂是酶的底物类似物或反应物,抑制剂和酶结合部位与底物和酶的结合部位相同,随着抑制剂浓度的增大,抑制作用增大,但增加底物浓度可使抑制程度变小。2)非竞争性抑制,其特点是抑制剂与底物可同时与酶的不同部位结合,抑制剂的分子结构不一定与底物的分子结构类似。3)反竞争抑制,其特点是抑制剂只与酶-底物复合物结合而不与游离酶结合。4)混合型抑制,作用的机理基本上与非竞争性抑制作用相似,线性混合型抑制中不同的结合次有不同的反应常数 [38]。
ACE抑制肽的抑制类型以竞争性抑制为主 [55],也有很多文献报道非竞争性ACE抑制肽。由于非竞争性ACE抑制肽与ACE结合的位点不同于竞争性ACE抑制肽的结合位点,因此非竞争性、竞争性ACE抑制肽的构效关系是不同的。综合文献报道,将不同来源的ACE抑制肽氨基酸序列与抑制类型整理如表1所示。竞争性ACE抑制肽以短链肽为主,非竞争性ACE抑制肽主要为长链肽;对于非竞争性ACE抑制肽,长链肽与短链肽相比ACE抑制活性更高,抑制率更强,如金枪鱼来源的二十一肽的IC 50值为11.28 μmol/L [47],菜籽源三肽的IC 50值为1 710 μmol/L [50],明显看出二十一肽的活性远高于三肽。这可能是因为大分子的非竞争ACE抑制肽与ACE的其他结合位点结合后,对于血管紧张素Ⅰ与ACE的结合能够起到更好的空间阻碍作用。
利用模拟分子对接研究ACE抑制肽的构效关系主要集中于对竞争性抑制的活性多肽的研究,而对于非竞争性抑制类型的ACE抑制肽的构效关系研究鲜见报道。可以推断,由于ACE抑制肽的结构不同导致了酶抑制类型不同以及抑制机理差异,进而影响到ACE抑制肽的活性。因此,在ACE抑制肽的构效研究中应考虑ACE抑制肽抑制类型的因素。
表 1 不同来源ACE抑制肽的抑制类型及其IC
50值
Table 1 Inhibition types and IC
50values of ACE inhibitory peptides from different sources
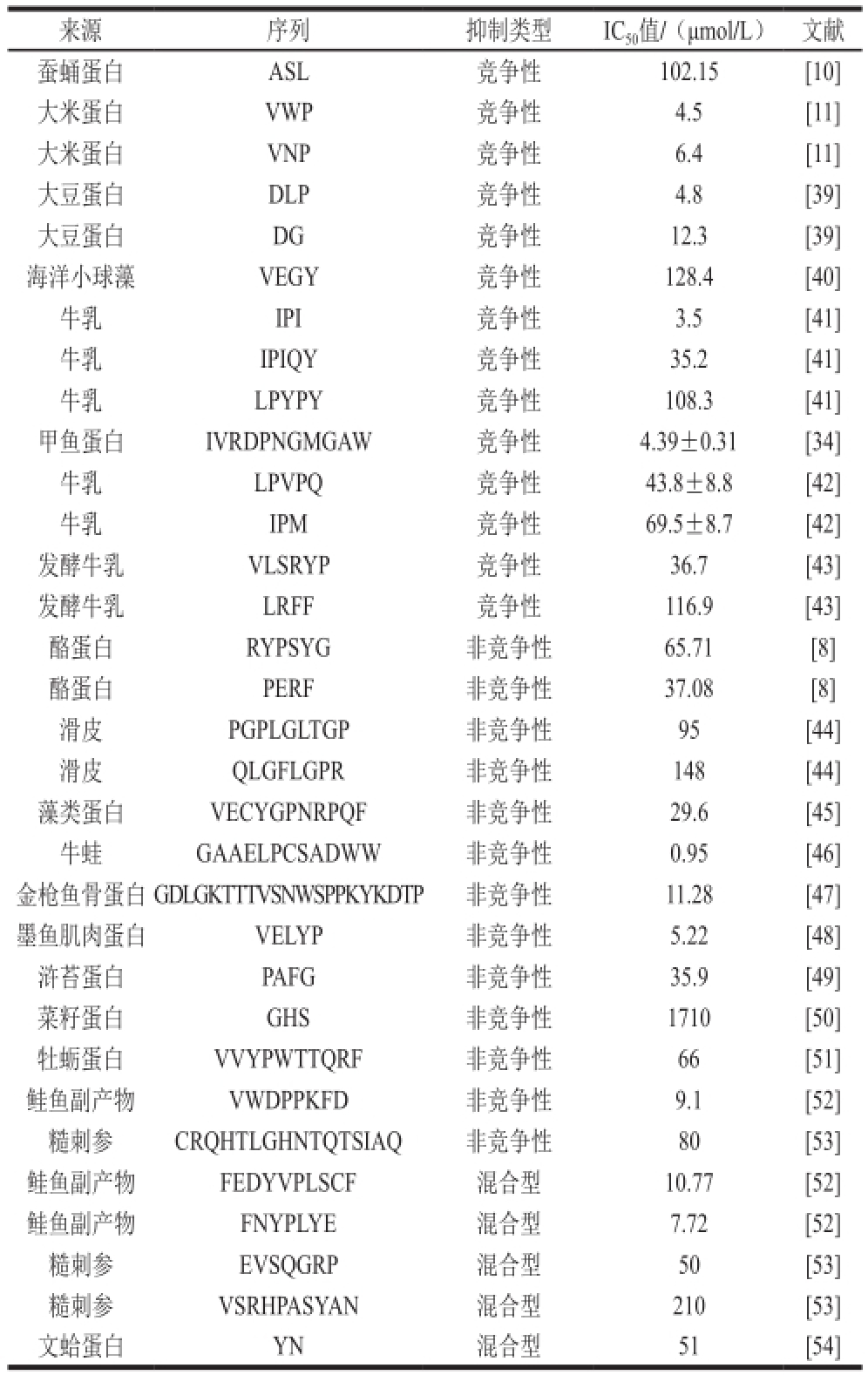
来源序列抑制类型IC 50值/(μmol/L)文献蚕蛹蛋白ASL竞争性102.15[10]大米蛋白VWP竞争性4.5[11]大米蛋白VNP竞争性6.4[11]大豆蛋白DLP竞争性4.8[39]大豆蛋白DG竞争性12.3[39]海洋小球藻VEGY竞争性128.4[40]牛乳IPI竞争性3.5[41]牛乳IPIQY竞争性35.2[41]牛乳LPYPY竞争性108.3[41]甲鱼蛋白IVRDPNGMGAW竞争性4.39±0.31[34]牛乳LPVPQ竞争性43.8±8.8[42]牛乳IPM竞争性69.5±8.7[42]发酵牛乳VLSRYP 竞争性36.7[43]发酵牛乳LRFF竞争性116.9[43]酪蛋白RYPSYG非竞争性65.71 [8]酪蛋白PERF非竞争性37.08[8]滑皮PGPLGLTGP非竞争性95[44]滑皮QLGFLGPR非竞争性148[44]藻类蛋白VECYGPNRPQF非竞争性29.6[45]牛蛙GAAELPCSADWW非竞争性0.95[46]金枪鱼骨蛋白GDLGKTTTVSNWSPPKYKDTP非竞争性11.28[47]墨鱼肌肉蛋白VELYP非竞争性5.22[48]浒苔蛋白PAFG非竞争性35.9[49]菜籽蛋白GHS非竞争性1710[50]牡蛎蛋白VVYPWTTQRF非竞争性66[51]鲑鱼副产物VWDPPKFD非竞争性9.1[52]糙刺参CRQHTLGHNTQTSIAQ非竞争性80[53]鲑鱼副产物FEDYVPLSCF 混合型10.77[52]鲑鱼副产物FNYPLYE混合型7.72[52]糙刺参EVSQGRP混合型50[53]糙刺参VSRHPASYAN混合型210[53]文蛤蛋白YN混合型51[54]
ACE抑制肽的构效关系研究已经引起了广泛关注。综合文献报道,目前已被发现的ACE抑制肽大部分为分子质量较小的短肽,但是并非ACE抑制肽的分子质量越小,ACE抑制能力越强。尽管定量构效分析是研究氨基酸序列对ACE抑制肽抑制能力影响的较为准确的方法,但也存在着一定的局限性:在建立模型时,可能会为保证拟合的准确性而忽略一些不符合大部分氨基酸序列规律但又具有较高ACE抑制能力的多肽,因此不利于进行更加深入的构效分析。
基于模拟分子对接的研究表明,ACE分子活性中心的氨基酸残基对ACE抑制肽与其结合起到重要作用,ACE与ACE抑制肽之间的作用力以氢键为主。由于ACE抑制肽的序列各不相同,因此主要氨基酸结合位点也不同,目前尚缺乏对ACE抑制肽进行归纳总结式模拟分子对接研究。
随着新的ACE抑制肽不断被发现和鉴定,模拟分子对接技术和定量构效关系仍是研究ACE抑制肽构效关系的主要方法。另外,ACE抑制肽的一级结构不同,导致其酶抑制类型也不同。因此可以将酶抑制类型与ACE抑制活性的关联性做为切入点,进行ACE抑制肽的构效关系研究。对ACE抑制肽构效关系的深入研究,能够为开发高效食源性ACE抑制肽提供理论指导。
参考文献:
[1] CHEN J W, WANG Y M, YE R, et al. Comparison of analytical methods to assay inhibitors of angiotensinⅠ-converting enzyme[J]. Food Chemistry, 2013, 141(4): 3329-3334. DOI:10.1016/j.foodchem.2013.06.048.
[2] HUBERT C, HOUOT A M, CORVOL P, et al. Structure of the angiotensin I-converting enzyme gene. Two alternate promoters correspond to evolutionary steps of a duplicated gene[J]. Journal of Biological Chemistry, 1991, 266(23): 15377-15383.
[3] 刘静, 管骁, 彭剑秋. 基于氨基酸描述符SVHEHS的ACE抑制肽QSAR研究[J]. 化学学报, 2012, 70(1): 83-91.
[4] ONDETTI M A, RUBIN B, CUSHMAN D W. Design of specific inhibitors of angiotensin converting enzyme. New class of orally active antihypertensive agents[J]. Science, 1977, 196: 441-444. DOI:10.1126/ science.191908.
[5] CUSHMAN D W, CHEUNG H S, SABO E F, et al. Development and design of specif i c inhibitors of angiotensin-converting enzyme[J]. The American Journal of Cardiology, 1982, 49(6): 1390-1394. DOI:10.1016/0002-9149(82)90348-4.
[6] 倪贺. 酵母来源血管紧张素转移酶抑制多肽的制备及其抑制机理的研究[D]. 广州: 华南理工大学, 2012: 11.
[7] OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensin Ⅰ-converting enzyme in digests of gelatin by bacterial collagenase[J]. Biochimica Et Biophysica Acta, 1979, 566(1): 128-137. DOI:10.1016/0005-2744(79)90255-9.
[8] JIANG Z M, TIAN B, BRODKORB A, et al. Production, analysis and in vivo, evaluation of novel angiotensin-Ⅰ-converting enzyme inhibitory peptides from bovine casein[J]. Food Chemistry, 2010, 123(3): 779-786. DOI:10.1016/j.foodchem.2010.05.026.
[9] 韩飞, 于婷婷, 周孟良. 酶法生产大豆蛋白ACE抑制肽的研究[J]. 食品科学, 2008, 29(11): 369-374. DOI:10.3321/j.issn:1002-6630.2008.11.084.
[10] WU Q Y, JIA J Q, YAN H, et al. A novel angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa (Bombyx mori) protein: biochemical characterization and molecular docking study[J]. Peptides, 2014, 68: 17-24. DOI:10.1016/j.peptides.2014.07.026.
[11] CHEN J W, LIU S S, YE R, et al. Angiotensin-Ⅰ converting enzyme (ACE) inhibitory tripeptides from rice protein hydrolysate: purif i cation and characterization[J]. Journal of Functional Foods, 2013, 5(4): 1684-1692. DOI:10.1016/j.jff.2013.07.013.
[12] QU W J, MA H L, JIA J Q, et al. Enzymolysis kinetics and activities of ACE inhibitory peptides from wheat germ protein prepared with SFP ultrasound-assisted processing[J]. Ultrasonics Sonochemistry, 2012, 19(5): 1021-1026. DOI:10.1016/j.ultsonch.2012.02.006.
[13] 王晶晶, 吉薇, 吉宏武, 等. 远东拟沙丁鱼酶解产物的降血压效果评价及其ACE抑制肽的分离纯化与鉴定[J]. 食品与发酵工业, 2016, 42(4): 63-68. DOI:10.13995/j.cnki.11-1802/ts.201604012.
[14] HERNANDEZ-LEDESMA B, CONTRERAS M M, RECIO I. Antihypertensive peptides: production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35. DOI:10.1016/j.cis.2010.11.001.
[15] 徐克寒, 申铉日, 陈国华. 三斑海马蛋白肽ACE抑制活性的研究[J]. 食品工业科技, 2015, 36(15): 96-99. DOI:10.13386/ j.issn1002-0306.2015.15.012.
[16] 刘文颖, 林峰, 陈亮, 等. 食源性低聚肽的血管紧张素转化酶(ACE)抑制作用[J]. 食品科技, 2016, 41(2): 9-13. DOI:10.13684/j.cnki. spkj.2016.02.002.
[17] KLEEKAYAI T, HARNEDY P A, O’KEEFFE M B, et al. Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J]. Food Chemistry, 2015, 176: 441-447. DOI:10.1016/j.foodchem.2014.12.026.
[18] NGO D H, RYU B M, KIM S K. Active peptides from skate (Okamejei kenojei) skin gelatin diminish-Ⅰ converting enzyme activity and intracellular free radical-mediated oxidation[J]. Food Chemistry, 2014, 143(1): 246-255. DOI:10.1016/j.foodchem.2013.07.067.
[19] ALUKO R E, GIRGIH A T, HE R, et al. Structural and functional characterization of yellow f i eld pea seed (Pisum sativum L.) proteinderived antihypertensive peptides[J]. Food Research International, 2015, 77: 10-16. DOI:10.1016/j.foodres.2015.03.029.
[20] GIRGIH A T, HE R, MALOMO S, et al. Structural and functional characterization of hemp seed (Cannabis sativa L.) protein-derived antioxidant and antihypertensive peptides[J]. Journal of Functional Foods, 2013, 6(1): 384-394. DOI:10.1016/j.jff.2013.11.005.
[21] QUIRÓS A, RAMOS M, MUGUERZA B, et al. Identification of novel antihypertensive peptides in milk fermented with Enterococus faecalis[J]. International Dairy Journal, 2007, 17(1): 33-41. DOI:10.1016/j.idairyj.2005.12.011.
[22] FUGLSANG A, NILSSON D, NYBORG C B. Characterization of new milk-derived inhibitors of angiotensin converting enzyme in vitro and in vivo[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2008, 18(5): 155-158. DOI:10.1080/1475636031000138723.
[23] 胡志和, 夏磊, 孙振刚, 等. 酪蛋白水解物中ACE抑制肽分离及氨基酸序列分析[J]. 食品科学, 2015, 36(24): 156-163. DOI:10.7506/ spkx1002-6630-201524028.
[24] 彭剑秋. ACE抑制肽定量构效关系研究[D]. 上海: 上海理工大学, 2012: 5-6.
[25] MAJUMDER K, WU J A. new approach for identification of novel antihypertensive peptides from egg proteins by QSAR and bioinformatics[J]. Food Research International, 2011, 44(8): 1371-1378. DOI:10.1016/j.foodres.2010.04.027.
[26] GU Y C, WU J P. LC-MS/MS coupled with QSAR modeling in characterising of angiotensin I-converting enzyme inhibitory peptides from soybean proteins[J]. Food Chemistry, 2013, 141(3): 2682-2690. DOI:10.1016/j.foodchem.2013.04.064.
[27] WU J P, ALUKO R, NAKAI S. Structural requirements of angiotensin I-converting enzyme inhibitory peptides: quantitative structureactivity relationship modeling of peptides containing 4-10 amino acid residues[J]. Qsar & Combinatorial Science, 2006, 25(10): 873-880. DOI:10.1002/qsar.200630005.
[28] UDENIGWE C C, LI H, ALUKO R E. Quantitative structure-activity relationship modeling of renin-inhibiting dipeptides[J]. Amino Acids, 2012, 42(4): 1379-1386. DOI:10.1007/s00726-011-0833-2.
[29] 贾俊强, 马海乐, 王振斌, 等. 降血压肽的构效关系研究[J]. 中国粮油学报, 2009, 24(5): 110-114.
[30] PAN D D, CAO J X, GUO H Q, et al. Studies on purification and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J]. Food Chemistry, 2012, 130(1): 121-126. DOI:10.1016/j.foodchem.2011.07.011.
[31] 管骁, 刘静, 苏淅娜, 等. 血管紧张素转化酶抑制二肽抑制ACE作用的柔性分子对接[J]. 食品科学, 2015, 36(5): 1-6. DOI:10.7506/ spkx1002-6630-201505001.
[32] 管骁, 刘静, 苏淅娜. ACE抑制三肽与ACE相互作用的分子机制[J]. 分析测试学报, 2014, 33(10): 1116-1122. DOI:10.3969/ j.issn.1004-4957.2014.10.004.
[33] LI P, JIA J, FANG M, et al. In vitro, and in vivo, ACE inhibitory of pistachio hydrolysates and in silico, mechanism of identif i ed peptide binding with ACE[J]. Process Biochemistry, 2014, 49(5): 898-904. DOI:10.1016/j.procbio.2014.02.007.
[34] LIU R, ZHU Y H, CHEN J, et al. Characterization of ACE inhibitory peptides from Mactra veneriformis hydrolysate by nano-liquid chromatography electrospray ionization mass spectrometry (Nano-LC-ESI-MS) and molecular docking[J]. Marine Drugs, 2014, 12: 3917-3928. DOI:10.3390/md12073917.
[35] RAWENDRA R D S, AISHA A, CHEN S H, et al. Isolation and characterization of a novel ACE-inhibitory tripeptide from enzymatic hydrolysis of soft-shelled turtle (Pelodiscus sinensis) egg white: an invitro, in-vivo and in-silico Study[J]. Journal of Agricultural and Food Chemistry, 2014, 62(50): 12178-12185. DOI:10.1021/jf504734g.
[36] ZHOU M, DU K, JI P J, et al. Molecular mechanism of the interactions between inhibitory tripeptides and angiotensin-converting enzyme[J]. Biophysical Chemistry, 2012, 168/169(5): 60-66. DOI:10.1016/ j.bpc.2012.05.002.
[37] TSAI J S, CHEN J L, PAN B S. ACE-inhibitory peptides identified from the muscle protein hydrolysate of hard clam (Meretrix lusoria)[J]. Process Biochemistry, 2008, 43(7): 743-747. DOI:10.1016/ j.procbio.2008.02.019.
[38] 龚仁敏. 酶可逆抑制作用中线性混合型抑制的动力学[J]. 安徽师范大学学报(自然科学版), 1998(1): 46-49. DOI:10.14182/ j.cnki.1001-2443.1998.01.011.
[39] WU J P, DING X L. Characterization of inhibition and stability of soy-protein-derived angiotensin Ⅰ-converting enzyme inhibitory peptides[J]. Food Research International, 2002, 35(4): 367-375. DOI:10.1016/S0963-9969(01)00131-4.
[40] KO S C, KANG N, KIM E A, et al. A novel angiotensin Ⅰ-converting enzyme (ACE) inhibitory peptide from a marine Chlorella ellipsoidea, and its antihypertensive effect in spontaneously hypertensive rats[J]. Process Biochemistry, 2012, 47(12): 2005-2011. DOI:10.1016/ j.procbio.2012.07.015.
[41] NONGONIERMA A B, FITZGERALD R J. Susceptibility of milk protein-derived peptides to dipeptidyl peptidase Ⅳ (DPP-Ⅳ) hydrolysis[J]. Food Chemistry, 2014, 145(7): 845-852. DOI:10.1016/ j.foodchem.2013.08.097.
[42] NONGONIERMA A B, FITZGERALD R J. Structure activity relationship modelling of milk protein-derived peptides with dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory activity[J]. Peptides, 2016, 79: 1-7. DOI:10.1016/j.peptides.2016.03.005.
[43] LI Y, SADIQ F A, LIU T J, et al. Purification and identification of novel peptides with inhibitory effect against angiotensin Ⅰ-converting enzyme and optimization of process conditions in milk fermented with the yeast Kluyveromyces marxianus[J]. Journal of Functional Foods, 2015, 16: 278-288. DOI:10.1016/j.jff.2015.04.043.
[44] LEE J K, JEON J K, BYUN H G. Effect of angiotensin Ⅰ converting enzyme inhibitory peptide purif i ed from skate skin hydrolysate[J]. Food Chemistry, 2011, 125(2): 495-499. DOI:10.1016/j.foodchem.2010.09.039.
[45] SHEIH I C, FANG T J, WU T K. Isolation and characterisation of a novel angiotensin Ⅰ-converting enzyme (ACE) inhibitory peptide from the algae protein waste[J]. Food Chemistry, 2009, 115(1): 279-284. DOI:10.1016/j.foodchem.2008.12.019.
[46] QIAN Z J, JUNG W K, LEE S H, et al. Antihypertensive effect of an angiotensin Ⅰ-converting enzyme inhibitory peptide from bullfrog (Rana catesbeiana Shaw) muscle protein in spontaneously hypertensive rats[J]. Process Biochemistry, 2007, 42(10): 1443-1448. DOI:10.1016/j.procbio.2007.05.013.
[47] LEE S H, QIAN Z J, KIM S K. A novel angiotensin Ⅰ converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J]. Food Chemistry, 2010, 118(1): 96-102. DOI:10.1016/j.foodchem.2009.04.086.
[48] BALTI R, BOUGATEF A, SILA A, et al. Nine novel angiotensinⅠ-converting enzyme (ACE) inhibitory peptides from cuttlef i sh (Sepia off i cinalis) muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J]. Food Chemistry, 2015, 170: 519-525. DOI:10.1016/j.foodchem.2013.03.091.
[49] PAN S K, WANG S J, JING L L, et al. Purif i cation and characterisation of a novel angiotensin-Ⅰ converting enzyme (ACE)-inhibitory peptide derived from the enzymatic hydrolysate of Enteromorpha clathrata, protein[J]. Food Chemistry, 2016, 211: 423-430. DOI:10.1016/ j.foodchem.2016.05.087.
[50] HE R, MALOMO S A, GIRGIH A T, et al. Glycinyl-histdinylserine (GHS), a novel rapeseed protein-derived peptide has blood pressure-lowering effect in spontaneously hypertensive rats[J]. Journal of Agricultural & Food Chemistry, 2013, 61(35): 8396-8402. DOI:10.1021/jf400865m.
[51] WANG J P, HU J E, CUI J Z, et al. Purif i cation and identif i cation of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J]. Food Chemistry, 2008, 111(2): 302-308. DOI:10.1016/ j.foodchem.2008.03.059.
[52] AHN C B, JEON Y J, KIM Y T, et al. Angiotensin Ⅰ converting enzyme (ACE) inhibitory peptides from salmon byproduct protein hydrolysate by alcalase hydrolysis[J]. Process Biochemistry, 2012, 47(12): 2240-2245. DOI:10.1016/j.procbio.2012.08.019.
[53] FORGHANI B, ZAREI M, EBRAHIMPOUR A, et al. Purif i cation and characterization of angiotensin converting enzyme-inhibitory peptides derived from Stichopus horrens: stability study against the ACE and inhibition kinetics[J]. Journal of Functional Foods, 2016, 20: 276-290. DOI:10.1016/j.jff.2015.10.025.
[54] LI G H, LE G W, SHI Y H, et al. Angiotensin Ⅰ-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J]. Nutrition Research, 2004, 24(7): 469-486. DOI:10.1016/j.nutres.2003.10.014.
[55] POKORA M, ZAMBROWICZ A, DĄBROWSKA A, et al. An attractive way of egg white protein by-product use for producing of novel anti-hypertensive peptides[J]. Food Chemistry, 2014, 151(4): 500-505. DOI:10.1016/j.foodchem.2013.11.111.
Progress in Research on Structure-Activity Relationship of ACE Inhibitory Peptides
WANG Xiaodan
1, XUE Lu
1,2,*, HU Zhihe
1,2, ZHANG Qi
3, LI Yanjun
1, XIA Lei
1
(1. College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China; 2. Tianjin Key Laboratory of Food and Biotechnology, Tianjin 300134, China; 3. Beaufour-Ipsen (Tianjin) Pharmaceutical Co. Ltd., Tianjin 300384, China)
Abstract:Angiotensin converting enzyme (ACE) inhibitory peptides are a category of peptides derived from food proteins which can reduce blood pressure. ACE inhibitory peptides have gained extensive concerns because they can reduce blood pressure without side effects as antihypertensive drugs. In recent years, the structure-activity relationship of ACE inhibitory peptides has become one of the research focuses. Structural bioinformatics showed that the activity of ACE inhibitory peptides is related to not only their molecular masses, but also their amino acid sequences and spatial conformation. It is also found that the type of inhibit of ACE inhibitory peptides is related to their activity and structure-activity relationship. Intensive studies on ACE inhibitory peptide structure-activity relationship will be helpful to guide the development of new functional foods and antihypertensive drugs.
Key words:ACE inhibitory peptide; structure-activity relationship; amino acid sequences
DOI:10.7506/spkx1002-6630-201705049
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)05-0305-06
引文格式:
王晓丹, 薛璐, 胡志和, 等. ACE抑制肽构效关系研究进展[J]. 食品科学, 2017, 38(5): 305-310. DOI:10.7506/spkx1002-6630-201705049. http://www.spkx.net.cn
WANG Xiaodan, XUE Lu, HU Zhihe, et al. Progress in research on structure-activity relationship of ACE inhibitory peptides[J]. Food Science, 2017, 38(5): 305-310. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705049. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:天津市应用基础与前沿技术研究计划重点项目(14JCZDJC34500);天津市科技支撑计划项目(14ZCZDNC00017);天津市高等学校创新团队项目(TD12-5049);天津市大学生创新创业训练计划项目(201510069050)
作者简介:王晓丹(1992—),女,硕士研究生,研究方向为食品生物技术。E-mail:prettyshoot@126.com
*通信作者:薛璐(1976—),女,副教授,博士,研究方向为食品生物技术。E-mail:xuelu@tjcu.edu.cn