雷 欢1,2,谢 婷1,魏宇清1,刘 欢1,钟青萍1,*
(1.华南农业大学食品学院,广东 广州 510642;2.中山大学附属第三医院,广东 广州 510630)
摘 要:在确定4 种防腐剂壳聚糖、山梨酸钾、脱氢乙酸钠和ε-聚赖氨酸对副溶血弧菌(Vibro parahaemolyticus)的最小抑菌浓度(minimum inhibitory concentration,MIC)的基础上,研究其对副溶血弧菌生物膜的抑制作用。采用结晶紫染色法测生物膜形成量,XTT法测生物膜代谢活性,硫酸-苯酚法测定生物膜中胞外多糖的分泌量。结果表明,壳聚糖的MIC最小,为1.25 mg/mL。4 种防腐剂在MIC以及亚抑菌浓度条件下对副溶血弧菌生物膜均有明显的抑制作用,不仅抑制生物膜的形成,而且能显著降低细菌的代谢活性,减少胞外多糖的分泌,其中壳聚糖对副溶血弧菌生物膜的抑制作用最强。
关键词:副溶血弧菌;生物膜;防腐剂;抑制
副溶血弧菌(Vibro parahaemolyticus)是嗜盐性革兰氏阴性杆菌,广泛存在于近海岸海水、海底沉积和鱼贝类海洋生物中,是沿海地区引起食物中毒的重要致病菌[1-3]。近年来副溶血弧菌已成为食源性致病菌之首,在我国一些省市引起的食物中毒占细菌性食物中毒的60%以上[4-5]。副溶血弧菌污染的主要食物是海产品或盐腌渍品,常见的有蟹类、贝类、海蜇、鱼虾、田螺等,其次是肉蛋类和蔬菜[6-7]。在自然环境中副溶血性弧菌主要以生物膜的形式存在[8]。生物膜是微生物细胞及其产生的细胞外大分子多聚物所形成的一种特殊细菌群落,它也是细菌抵抗不利环境、产生耐药性并导致持续感染的重要方式[9-10]。研究表明成熟的生物膜内细菌的耐药性是游离菌的500~5 000 倍[11]。因此,生物膜一旦形成,使用一般的抗生素、消毒剂很难去除,在医疗和食品安全等领域带来很大的风险[12-13]。
目前对副溶血弧菌生物膜的研究主要是对生物膜形成条件的探究[14-16],关于不同的防腐剂对其抑制作用的研究较少。本实验研究了4 种食品防腐剂壳聚糖、山梨酸钾、脱氢乙酸钠、ε-聚赖氨酸对副溶血弧菌生物膜形成的抑制作用,分析其对生物膜形成量、生物膜代谢活性以及胞外多糖分泌量的影响,以期为防治副溶血弧菌污染提供理论参考。
1.1 材料与试剂
副溶血弧菌标准菌株ATCC17802购于广东省微生物研究所微生物菌种保藏中心,副溶血弧菌标准菌株J5421由中国军事医学科学院微生物流行病研究所赠送。菌种均保藏在-80 ℃条件下20%的甘油管中。
壳聚糖 青岛潜光生物工程有限公司;山梨酸钾武汉万荣科技发展有限公司;脱氢乙酸钠 广东辰源精细化工有限公司;ε-聚赖氨酸 河南润诚化工产品有限公司;链霉蛋白酶E(pronase E)、甲萘醌(纯度>98%) 美国Sigma公司;XTT(纯度为98%) 南京凯基生物科技有限公司。
含3% NaCl的胰蛋白胨大豆肉汤培养基(TSB):胰蛋白胨15 g、大豆蛋白胨5 g、NaCl 130 g、去离子水1 L。用1 mol/L NaOH溶液调节pH值为7.0~7.4;121 ℃,0.15 MPa条件下高压灭菌20 min。含3% NaCl的胰蛋白胨大豆肉汤琼脂培养基(TSA):在上述TSB配方的基础上加入2%的琼脂,加热融化后灭菌。水解酪蛋白胨肉汤(MH肉汤):称取MH肉汤培养基21 g,加入去离子水1 L,搅拌加热煮沸至完全溶解,分装三角瓶,121 ℃、0.15 MPa条件下高压灭菌20 min。
1.2 仪器与设备
Multiskan FC酶标仪、Forma Class Ⅱ A2生物安全柜美国Thermo公司;150A恒温培养箱 江苏省金坛市荣华仪器制造有限公司;5417R高速冷冻离心机 德国Eppendorf公司;KQ-500E型超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 菌悬液的制备
将菌种活化后,从TSA斜面培养基上挑取适量菌体,转接入含3% NaCl的TSB培养基中,37 ℃恒温150 r/min振荡培养12~16 h,然后于4 ℃条件下,4 000 r/min离心10 min收集菌体,用无菌生理盐水将菌浓度调整到108CFU/mL左右待用。
1.3.2 二倍稀释法测定防腐剂对副溶血弧菌的最小抑菌浓度
采用96 孔板微量稀释法测定不同防腐剂的最小抑菌浓度(minimum inhibitory concentration,MIC)。参考4 种防腐剂在食品保鲜过程中所使用的质量浓度,将其用MH肉汤培养基二倍稀释成6 个梯度,孔中再加入终浓度为105CFU/mL的菌液,同时设置未加防腐剂的对照组,在30 ℃条件下培养24 h后首先肉眼观察浑浊度,防腐剂质量浓度最小但孔内却澄清的质量浓度可推测为最小抑菌浓度,然后在595 nm波长处测定吸光度,只有相邻两孔的吸光度差异较大且极显著时(P<0.01),确定为该防腐剂的MIC。
1.3.3 防腐剂对生物膜形成量的抑制
将制备好的浓度为108CFU/mL的菌悬液与TSB培养基按1∶3的比例加入96 孔板中,加入终质量浓度分别为MIC、1/2 MIC、1/8 MIC的防腐剂溶液,同时设不加防腐剂的对照组。将96 孔板放置于30 ℃的培养箱中培养48 h,取出孔板,弃去游离菌,用250 μL无菌生理盐水清洗2 次,然后60 ℃干燥固定15 min,再每孔加入0.1%的结晶紫溶液200 μL,染色5 min,用250 μL无菌生理盐水清洗3 次,干燥后加入33%的冰乙酸200 μL,放置10 min,在595 nm波长处测OD值[17]。抑制率计算参考下式:
1.3.4 生物膜代谢活性测定
将XTT用磷酸盐缓冲液配制成1 g/mL的溶液,贮存在-80 ℃冰箱中。甲萘醌在用之前溶解在丙酮中,使其终浓度为1 mmol/L,每次实验所用XTT与甲萘醌比例为12.5∶1。不同防腐剂处理条件下副溶血弧菌培养48 h后形成生物膜,移除浮游菌,用100 μL无菌磷酸盐缓冲液冲洗3 次,加入13.5 μL的混合液,轻轻振动孔板,然后放置在黑暗处37 ℃温育2~3 h,另设对照组,测定OD450nm值[18]。
1.3.5 胞外多糖含量测定
将制备好的浓度为108CFU/mL的菌悬液按1%的接种量加入到含有载玻片的液体培养基试管中,加入终质量浓度分别为MIC、1/2 MIC、1/8 MIC的防腐剂溶液,同时设不加防腐剂的对照组。副溶血弧菌在30 ℃条件下培养48 h后形成生物膜,取出玻片,放入10 mL的生理盐水中,超声振荡后取出玻片,将菌悬液煮沸10 min,室温冷却20 min。再加入50 μL的pronase E,37 ℃孵育2 h,加入200 μL的质量分数为10%的TCA溶液,冰水放置30 min,10 000 r/min离心30 min。收集上清液,加入等体积的乙醇溶液,-20 ℃放置1 h,15 000 r/min离心20 min,除去上清液,沉淀物用95%的苯酚和5 mL浓硫酸复溶,沸水浴10 min,反应液呈红色,设置对照组,测定OD450nm值[19]。
1.4 数据统计与分析
应用SPSS 22.0软件进行平均值和标准偏差的计算,并对其进行显著性分析(P<0.01为差异极显著,0.01≤P<0.05为差异显著)。
2.1 不同防腐剂对副溶血弧菌的MIC
表1 不同防腐剂对副溶血弧菌的MIC
Table 1 MICs of different food preservatives for V. parahaemolyticus

从表1可以看出,壳聚糖的MIC为1.25 mg/mL;山梨酸钾的MIC为10 mg/mL,防腐剂不同,对副溶血弧菌的抑制作用所需的质量浓度也有差异。4 种防腐剂都可以有效地抑制副溶血弧菌的生长。每种防腐剂对2 株菌的MIC是一致的。
2.2 不同质量浓度防腐剂抑制副溶血弧菌生物膜形成
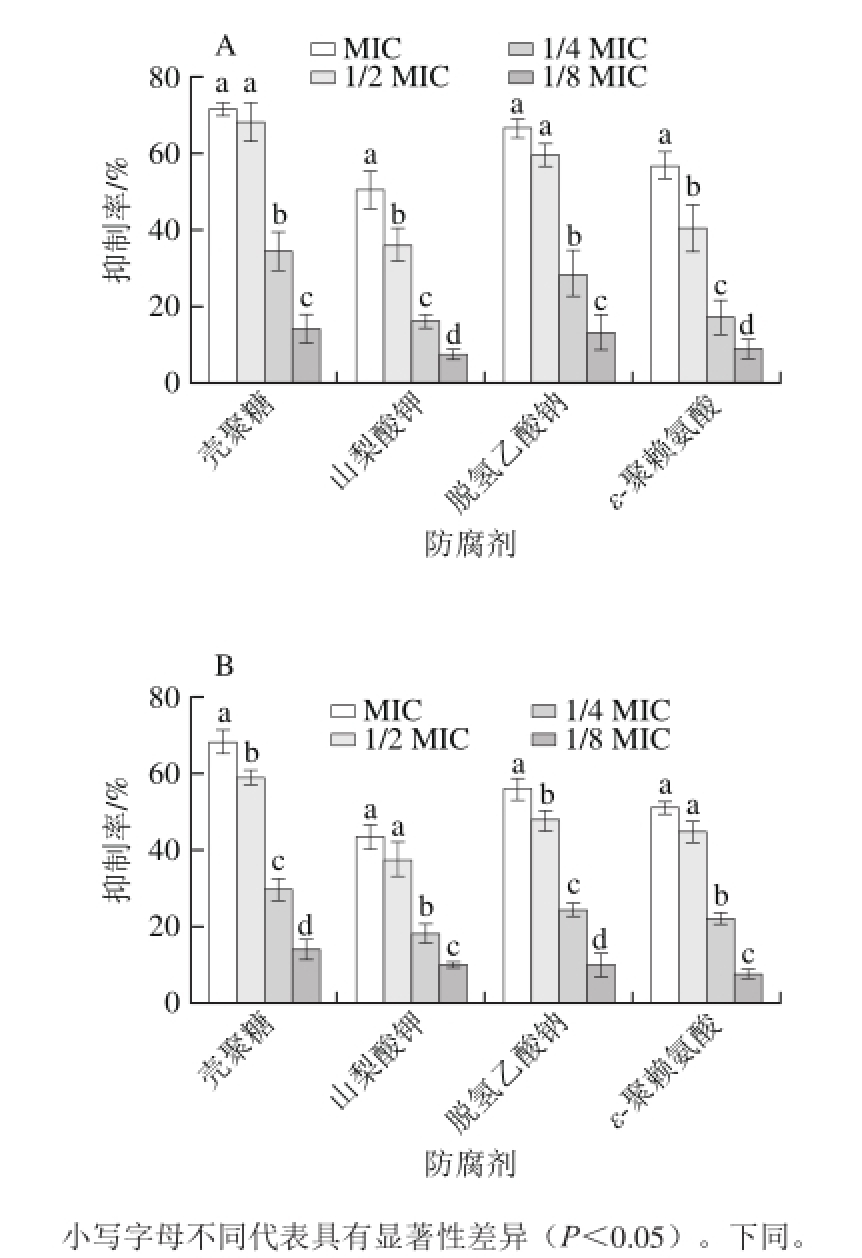
图1 不同防腐剂对ATCC17802菌株(A)和J5421菌株(B)生物膜形成的抑制率
Fig. 1 Inhibitory effects of different food preservatives on V. parahaemolyticus ATCC17802 (A) and V. parahaemolyticus J5421 (B)
设定4 个防腐剂的质量浓度均为MIC、1/2 MIC、1/4 MIC、1/8 MIC,测定它们对两株副溶血弧菌的生物膜形成的影响。从图1可以看出,不同质量浓度的4 种防腐剂对副溶血弧菌生物膜的形成有显著的抑制作用,随着质量浓度的升高,抑制率明显增大。壳聚糖质量浓度为MIC和1/8 MIC时对两株菌生物膜的抑制率分别为70.98%、14.38%和67.90%、13.94%;山梨酸钾质量浓度为MIC和1/8 MIC时对两株菌生物膜的抑制率分别为50.16%、7.06%和43.07%、9.93%;脱氢乙酸钠质量浓度为MIC和1/8 MIC时对ATCC17802菌株、J5421菌株生物膜的抑制率分别为66.35%、11.50%和55.74%、10.23%;ε-聚赖氨酸质量浓度为MIC和1/8 MIC时对两株菌生物膜的抑制率分别为56.50%、9.67%和50.97%、7.22%。其中壳聚糖的抑制效果最显著。两株菌之间无显著差异。
2.3 不同质量浓度防腐剂对副溶血弧菌生物膜代谢活性的影响

图2 不同防腐剂对ATCC17802菌株(A)和J5421菌株(B)生物膜代谢活性影响
Fig. 2 Effects of different food preservatives on the metabolic activity of V. parahaemolyticus ATCC17802 (A) and V. parahaemolyticus J5421 (B)
将培养后的菌株ATCC17802和J5421,通过XTT法检测4 种防腐剂在不同质量浓度条件下对两株菌代谢活性的影响,结果如图2所示。可以看出随着防腐剂质量浓度的增加,生物膜代谢活性抑制率逐渐增大。壳聚糖质量浓度为MIC和1/8 MIC时对两株菌生物膜代谢活性的抑制率分别为46.83%、17.17%和52.40%、12.37%;山梨酸钾质量浓度为MIC和1/8 MIC时对两株菌生物膜代谢活性的抑制率分别为24.81%、8.66%和23.59%、8.77%;脱氢乙酸钠质量浓度为MIC和1/8MIC时对两株菌生物膜代谢活性的抑制率分别为40.63%、10.57%和37.06%、13.85%;ε-聚赖氨酸质量浓度为MIC和1/8MIC时对两株菌生物膜代谢活性的抑制率分别为33.58%、7.79%和32.98%、9.60%。其中,壳聚糖的抑制作用最强,即使亚抑菌质量浓度,1/2 MIC处理时,仍有明显的抑制作用。
2.4 不同质量浓度防腐剂对副溶血弧菌胞外多糖产生的影响
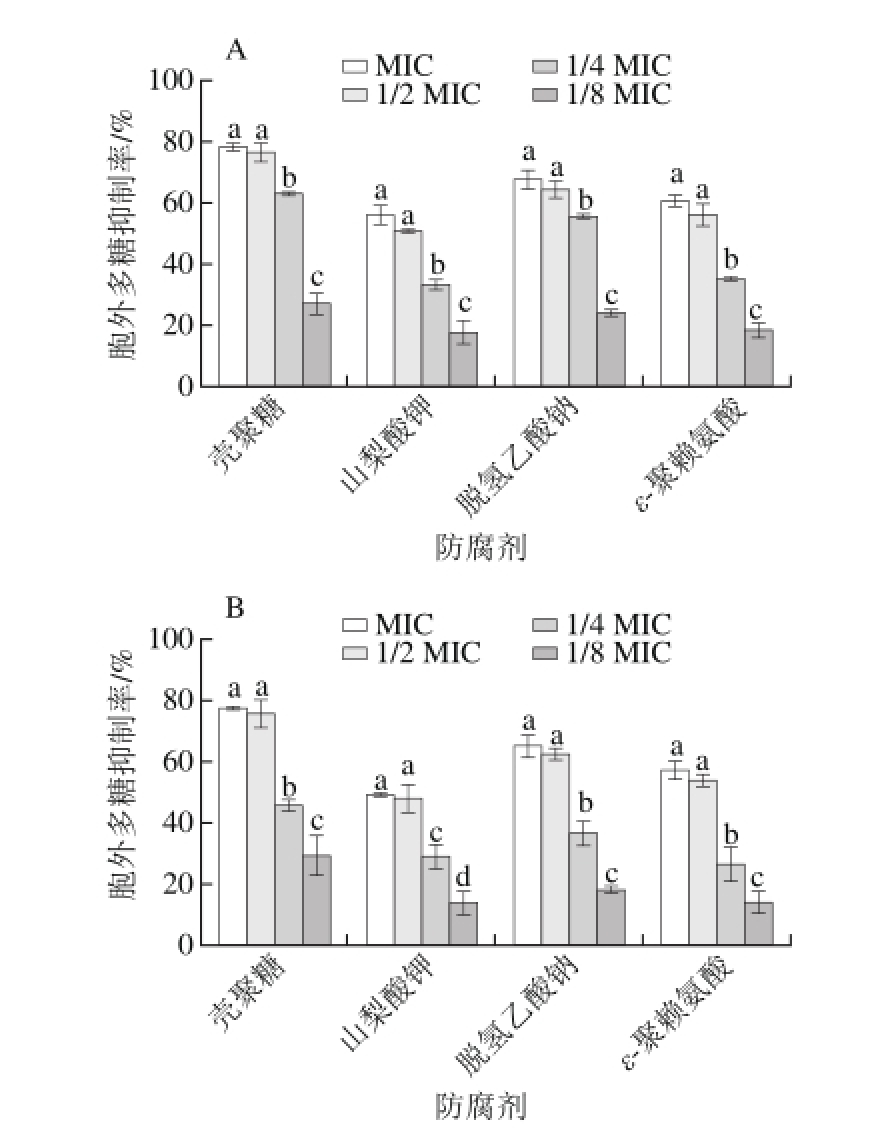
图3 防腐剂对ATCC17802菌株(A)和J5421菌株(B)生物膜胞外多糖产生的影响
Fig. 3 Effects of different food preservatives on EPS secretion of V. parahaemolyticus ATCC17802 (A) and V. parahaemolyticus J5421 (B)
胞外多糖是细菌生物膜的主要成分,既是生物膜结构的基础,又是功能的主要承担者[20]。因此,抑制或减少细菌分泌胞外多糖,是抑制生物膜形成的一种重要方法。将培养后的菌株ATCC17802和J5421,通过苯酚-硫酸法检测4 种防腐剂在不同质量浓度条件下对两株菌胞外多糖的影响,结果如图3所示。随着防腐剂质量浓度的增加,生物膜胞外多糖抑制率逐渐增大。壳聚糖质量浓度为MIC和1/8 MIC时对两株菌生物膜胞外多糖的抑制率分别为78.04%、27.01%和76.87%、29.38%;山梨酸钾质量浓度为MIC和1/8 MIC时对两株菌生物膜胞外多糖的抑制率分别为55.53%、17.25%和48.56%、14.30%;脱氢乙酸钠质量浓度为MIC和1/8 MIC时对两株菌生物膜胞外多糖的抑制率分别为67.53%、24.08%和64.65%、18.04%;ε-聚赖氨酸质量浓度为MIC和1/8 MIC时对两株菌生物膜胞外多糖的抑制率分别为60.33%、18.14%和56.76%、 14.18%。而且,亚抑菌质量浓度1/2 MIC条件下的4 种防腐剂的抑制作用强度与MIC的抑制作用无显著差异,与1/4 MIC和1/8 MIC的抑制作用有显著性差异(P<0.05)。其中,壳聚糖对两株菌生物膜胞外多糖的产生影响最大。
4 种防腐剂在MIC以及亚抑菌质量浓度条件下对副溶血弧菌生物膜均有明显的抑制作用,不仅抑制了生物膜的形成,而且生物膜内细菌的代谢活性明显下降,胞外多糖的分泌也减少了。其中壳聚糖对副溶血弧菌生物膜的抑制作用最强,其对两株菌的生物膜抑制率分别为70.98%和67.90%,代谢活性抑制率分别为46.83%和52.40%,胞外多糖的抑制率分别为78.04%和76.87%。
近年来寻求天然、高效、安全的防腐剂以控制生物膜的研究逐渐兴起,如有研究报道了天然产物(生姜提取物、大蒜提取物、茶多酚、留兰香精油)可有效地抑制副溶血弧菌生物膜的形成[20-21]。壳聚糖、山梨酸钾、脱氢乙酸钠、ε-聚赖氨酸是应用较广的食品防腐剂,它们的抑菌谱不同,抑菌效果也大不相同。本实验考察了这两种天然防腐剂和两种化学防腐剂对副溶血弧菌生物膜的抑制作用,研究发现这4 种防腐剂对副溶血弧菌生物膜均有显著的抑制作用,在MIC以及亚抑菌质量浓度条件下,对生物膜的形成量、代谢活性、胞外多糖的产生皆表现出抑制效果,其中壳聚糖的抑制作用最强。壳聚糖对于细菌成熟生物膜的作用,可能是壳聚糖通过自身所带的正电荷与微生物细胞膜所携带的负电荷相互作用,破坏细菌细胞壁原有结构,造成细胞成分的泄漏而起到抗菌作用[22]。一些小分子的壳聚糖可以渗透进入细胞内与带阴离子的生物大分子发生作用,破坏细胞的正常代谢活动,从而抑制细菌的生长[23]。胡春红等[24]研究发现,经过壳聚糖涂膜后的介质表面对细菌和真菌生物膜的形成具有抑制作用;Zheng Zhonghui等[25]研究发现壳聚糖结合抗生素对李斯特菌被膜的抑制和清除作用显著。Costa等[26]研究表明低浓度的山梨酸钾对金黄色葡萄球菌的生长和生物膜形成具有明显的抑制作用,高盐浓度下山梨酸钾会导致细胞内外渗透压改变,使得细胞膨胀细胞内物质外溢,生物膜结构受到破坏,从而导致细菌生存能力下降[27]。此外,脱氢乙酸钠的抗菌作用主要在于氨基酸脱氢酶的活性[28]。也有研究报道ε-聚赖氨酸在酸性条件下与乳酸链球菌素复配使用,能够更好地抑制微生物的生长[29],其作用机制主要是因为静电相互作用的影响以及进入生物膜的能力的差异性,对生物膜的抑制作用受到周围液体中二价阳离子的影响,减小pH值和增加ε-聚赖氨酸的正电荷可以有效抑制生物膜形成[30]。因此,防腐剂在控制细菌生物膜方面具有较好的应用前景,可进一步开发复合抗生物膜制剂,减少使用量,提高效果。
参考文献:
[1] 滕勇勇, 王琪, 吴雷, 等. 致病性弧菌的生物学特性和致病因子研究进展[J]. 热带医学杂志, 2014, 14(10): 1396-1398.
[2] SU Yicheng, LIU Chengchu. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiology, 2007, 24(6): 549-558. DOI:10.1016/j.fm.2007.01.005.
[3] DRAKE S L, DEPAOLA A, JAYKUS L A. An overview of Vibrio vulnif i cus and Vibrio parahaemolyticus[J]. Comprehensive Reviews in Food Science and Food Safety, 2007, 6: 120-144. DOI:10.1111/j.1541-4337.2007.00022.x.
[4] 李明强, 汪皓秋, 郑伟, 等. 余杭区8 起副溶血弧菌食物中毒的同源性研究[J]. 中国卫生检验杂志, 2011, 21(2): 502-504.
[5] 刘秀梅, 陈艳, 郭云昌, 等. 2005年中国食源性疾病暴发事件监测资料分析[J]. 中国食品卫生杂志, 2008, 20(6): 506-509. DOI:10.3969/ j.issn.1004-8456.2008.06.012.
[6] 龙诚, 罗书全, 何源. 一起副溶血性弧菌食物中毒的调查与分析[J].食品与发酵科技, 2010, 46(1): 97-99. DOI:10.3969/j.issn.1674-506X.2010.01-025.
[7] 严纪文, 朱海明, 王海燕, 等. 2000—2005年广东省食品中食源性致病菌的监测与分析[J]. 中国食品卫生杂志, 2006, 15(6): 528-531. DOI:10.3969/j.issn.1004-8456.2006.06.009.
[8] ELEXSON N, AFSAH-HEJRI L, RUKAYADI Y, et al. Effect of detergents as antibacterial agents on biofilm of antibiotics-resistent Vibrio parahaemolyticus isolates[J]. Food Control, 2014, 35(1): 378-385. DOI:10.1016/j.foodcont.2013.07.020.
[9] WHITEHEAD K A, VERRAN J. Formation, architecture and functionality of microbial biofilms in the food industry[J]. Current Opinion in Food Science, 2015, 2: 84-91. DOI:10.1016/ j.cofs.2015.02.003.
[10] SMIRNOVA T A, DIDENKO L V, AZIZBEKYAN R R, et al. Structural and functional characteristics of bacterial biofilms[J]. Microbiology, 2010, 79(4): 413-423. DOI:10.1134/ S0026261710040016.
[11] 何年安, 王文平. 超声在细菌生物膜相关感染治疗中的应用[J].中华超声影像学杂志, 2012, 21(9): 815-817. DOI:10.3760/cma. j.issn.1004-4477.2012.09.025.
[12] GUPTA P, SARKAR S, DAS B, et al. Biofilm, pathogenesis and prevention-a journey to break the wall: a review[J]. Archives of Microbiology, 2016, 198: 1-15. DOI:10.1007/s00203-015-1148-6
[13] TAYLOR P K, YEUNG A T Y, HANCOCK R E W. Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies[J]. Journal of Biotechnology, 2014, 191: 121-130. DOI:10.1016/ j.jbiotec.2014.09.003.
[14] HAN N, MIZAN M F R, JAHID I K, et al. Biof i lm formation by Vibrio parahaemolyticus on food and food contact surfaces increases with rise in temperature[J]. Food Control, 2016, 70: 161-166. DOI:10.1016/ j.foodcont.2016.05.054.
[15] 陈珍, 覃映雪, 邹文政, 等. 致病性副溶血弧菌生物膜形成特性研究[J].海洋学报, 2010, 32(5): 110-116.
[16] 渠宏雁, 孟良玉, 刘锦峰, 等. 副溶血性弧菌生物被膜的形成与优化[J].中国食品学报, 2013, 13(9): 56-61.
[17] 渠宏雁, 李学鹏, 仪淑敏, 等. 亚硝酸钠对金黄色葡萄球菌和副溶血性弧菌生物被膜形成的抑制作用[J]. 食品工业科技, 2015, 36(21): 178-182.
[18] MEJDI S, DEHMANI A, NOUMI E, et al. Chemical composition and antibiof i lm activity of Petroselinum crispum and Ocimum basilicum essential oils against Vibrio spp. strains[J]. Microbial Pathogenesis, 2016, 90: 13-21. DOI:10.1016/j.micpath.2015.11.004.
[19] 王桂洋. 壳聚糖对希瓦氏菌生物被膜抑制和清除作用的研究[D]. 杭州: 浙江工商大学, 2015: 30.
[20] 郭钦, 徐海棠, 杨龙平, 等. 不同条件下副溶血弧菌生物膜形成规律及其天然抑制物质的研究[J]. 食品工业科技, 2014, 35(10): 110-115.
[21] SNOUSSI M, NOUMI E, TRABELSI N, et al. Mentha spicata essential oil: chemical composition, antioxidant and antibacterial activities against planktonic and biofilm cultures of Vibrio spp. strains[J]. Molecules, 2015, 20: 14402-14424. DOI:10.3390/ molecules200814402.
[22] CARLSON R P, TAFFS R, DAVISON W M, et al. Antibiofilm properties of chitosan-coated surfaces[J]. Journal of Biomaterials Science Polymer Edition, 2008, 19(8): 1035-1046. DOI:10.1163/156856208784909372.
[23] MU Haibo, ZHANG Amin, ZHANG Lin, et al. Inhibitory effects of chitosan in combination with antibiotics on Listeria monocytogenes biofilm[J]. Food Control, 2014, 38: 215-220. DOI:10.1016/ j.foodcont.2013.10.032.
[24] 胡春红, 葛红莲, 李季平, 等. 苯甲酸钠对大肠杆菌和金黄色葡萄球菌生长的影响[J]. 食品工业科技, 2011, 32(4): 180-181.
[25] ZHENG Zhonghui, ZENG Wei, HUANG Yaojian, et al. Detection of antitumor and antimicrobial activities in marine organism associated actinomycetes isolated from the Taiwan Strait, China[J]. FEMS Microbiology Letters, 2000, 188(1): 87-91. DOI:10.1111/j.1574-6968.2000.tb09173.x.
[26] COSTA E M, SILVA S, MADUREIRA A R, et al. A comprehensive study into the impact of a chitosan mouthwash upon oral microorganism’s biof i lm formation in vitro[J]. Carbohydrate Polymers, 2014, 101: 1081-1086. DOI:10.1016/j.carbpol.2013.09.041.
[27] NOSANCHUK J D, CASADEVALL A. Cellular charge of Cryptococcus neoformans: contributions from the capsular polysaccharide, melanin, and monoclonal antibody binding[J]. Infection and Immunity, 1997, 65(5): 1836-1841.
[28] MORTEN H, TINA M, BRIAN S V, et al. The antimicrobial mechanism of action of epsilon-poly-l-lysine[J]. Applied Environmental Microbiology, 2014, 80(24): 7758-7770. DOI:10.1128/ AEM.02204-14.
[29] van der WAAL S V, JIANG L M, de SOET J J, et al. Sodium chloride and potassium sorbate: a synergistic combination against Enterococcus faecalis biof i lms: an in vitro study[J]. European Journal of Oral Sciences, 2012, 120(5): 452-457. DOI:10.1111/j.1600-0722.2012.00982.x.
[30] ZHANG Hui, WEI Hewen, CUI Yinan, et al. Antibacterial interactions of monolaurin with commonly used antimicrobials and food components[J]. Journal of Food Science, 2009, 74(7): M418-M421. DOI:10.1111/j.1750-3841.2009.01300.x.
Inhibitory Effects of Four Kinds of Food Preservatives on Biof i lm Formation by Vibrio parahaemolyticus
LEI Huan1,2, XIE Ting1, WEI Yuqing1, LIU Huan1, ZHONG Qingping1,*
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China; 2. The Third Aff i liated Hospital, Sun Yat-sen University, Guangzhou 510630, China)
Abstract:In this study, we analyzed the minimum inhibitory concentrations (MICs) of four kinds of food preservatives (chitosan, potassium sorbate, sodium dehydroacetate and ε-polylysine) for Vibro parahaemolyticus, and we then investigated their inhibitory effects on biof i lm formation by V. parahaemolyticus. The crystal violet straining method was conducted to determine the amount of biof i lm, and XTT reduction assay and phenol-sufuric acid method were used to detect the changes of metabolic activities and extracellular polysaccharide of biofilm, respectively. The results showed that the MIC of chitosan was the lowest, which was 1.25 mg/mL. At both MIC and sub-MIC, these four food preservatives could not only demonstrate a remarkable inhibitory effect on biof i lm formation by V. parahaemolyticus, but also reduce the metabolic activity and the secretion of extracellular polysaccharides of cells in biof i lms. Among these preservatives, the inhibitory effect of chitosan was the strongest.
Key words:Vibrio parahaemolyticus; biof i lm; food preservatives; inhibition
DOI:10.7506/spkx1002-6630-201707002
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)07-0006-05
引文格式:
雷欢, 谢婷, 魏宇清, 等. 4 种防腐剂对副溶血弧菌生物膜形成的抑制作用[J]. 食品科学, 2017, 38(7): 6-10. DOI:10.7506/ spkx1002-6630-201707002. http://www.spkx.net.cn
LEI Huan, XIE Ting, WEI Yuqing, et al. Inhibitory effects of four kinds of food preservatives on biofilm formation by Vibrio parahaemolyticus[J]. Food Science, 2017, 38(7): 6-10. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707002. http://www.spkx.net.cn
收稿日期:2016-06-29
基金项目:国家自然科学基金面上项目(31271956)
作者简介:雷欢(1990—),女,硕士,研究方向为食品质量与安全。E-mail:15017568226@163.com
*通信作者:钟青萍(1967—),女,副教授,博士,研究方向为食品安全、食品微生物。E-mail:zhongqp@scau.edu.cn